Способ получения фактора некроза опухоли, человеческий фактор некроза опухоли
Номер патента: 1400
Опубликовано: 16.09.1996
Авторы: Гленн Эван Недвин, Бхарат Бхушан Эггэрвал, Сэнг Хе Ли, Дэвид Ванноман Гоэддел
Текст
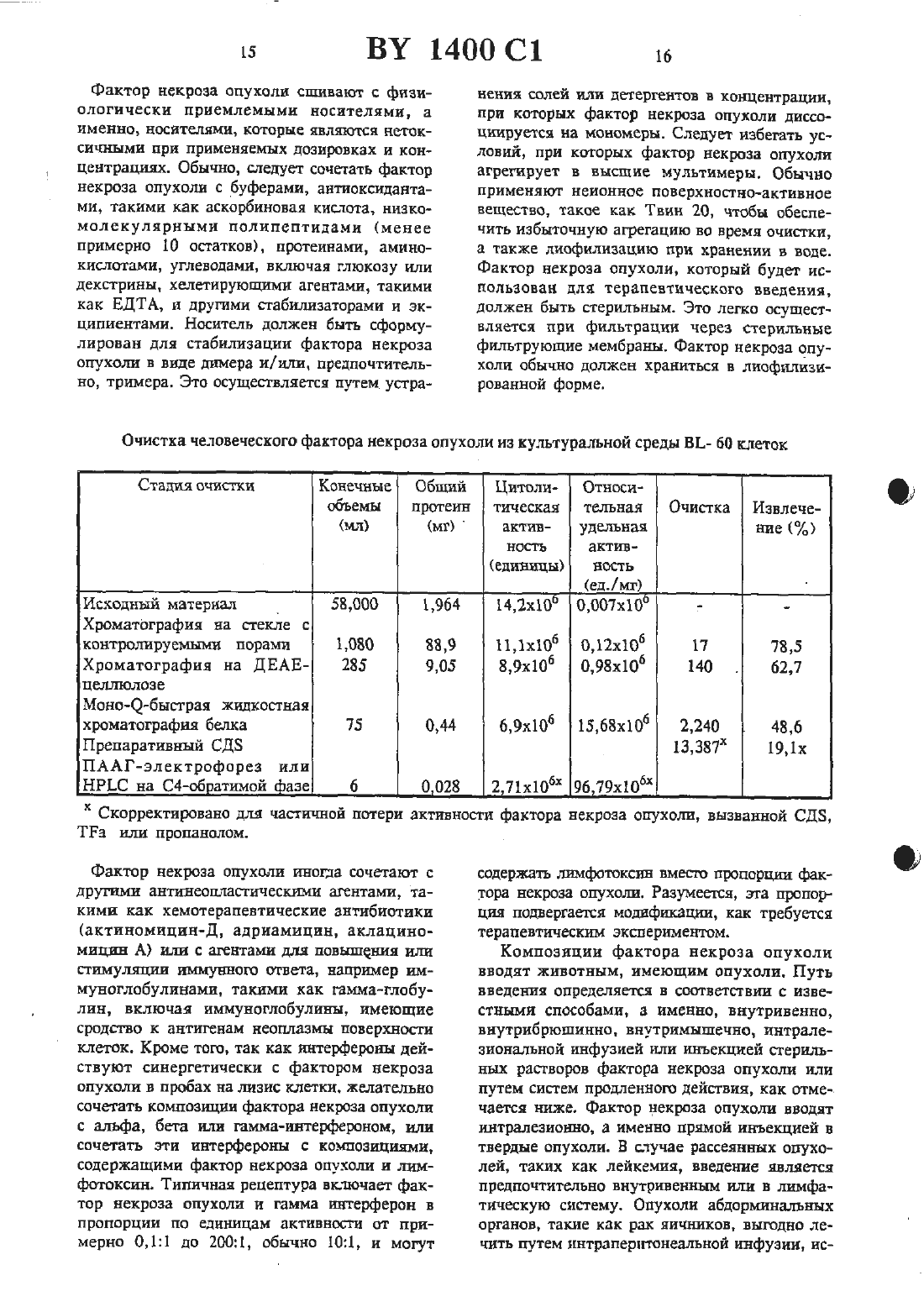
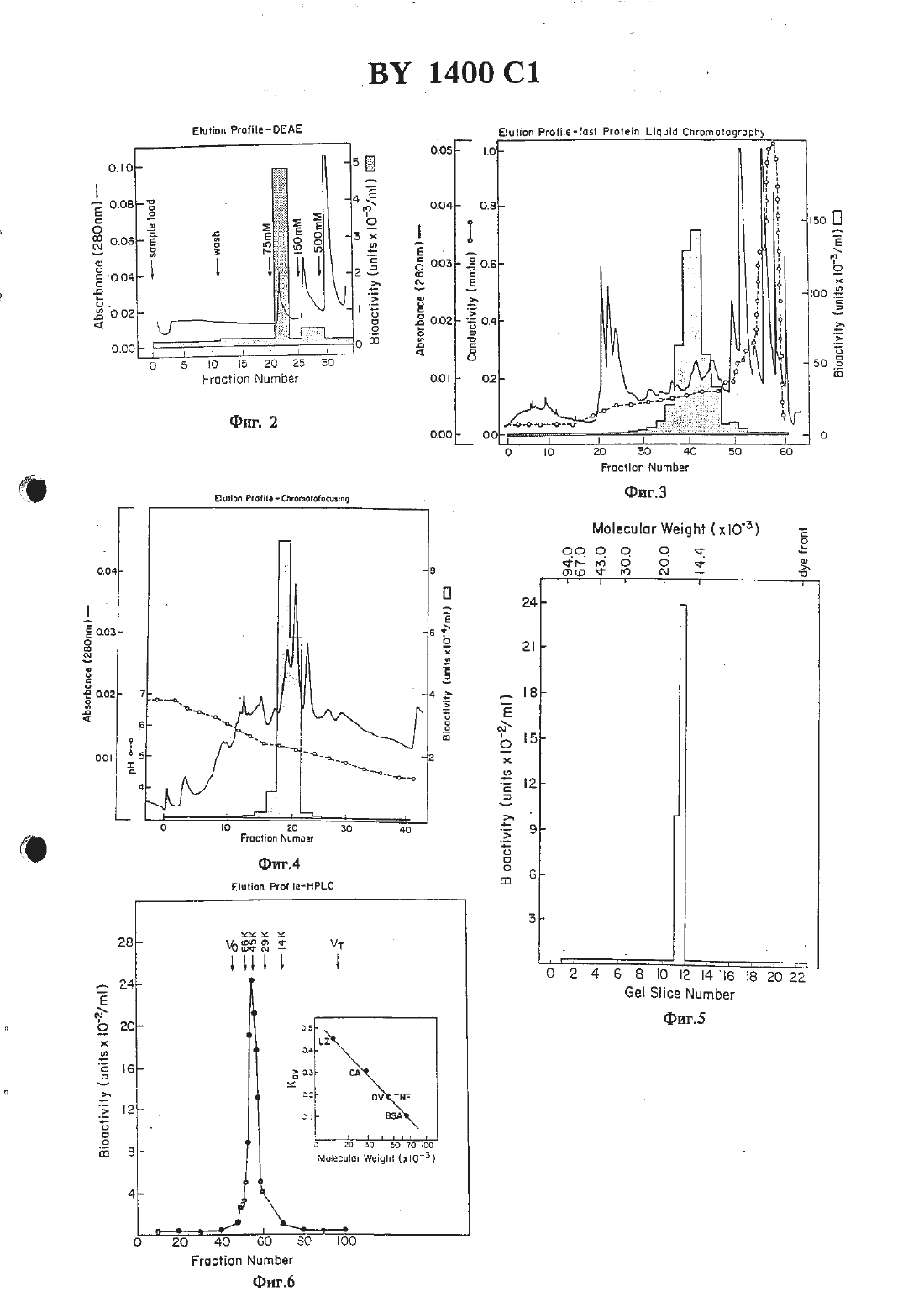
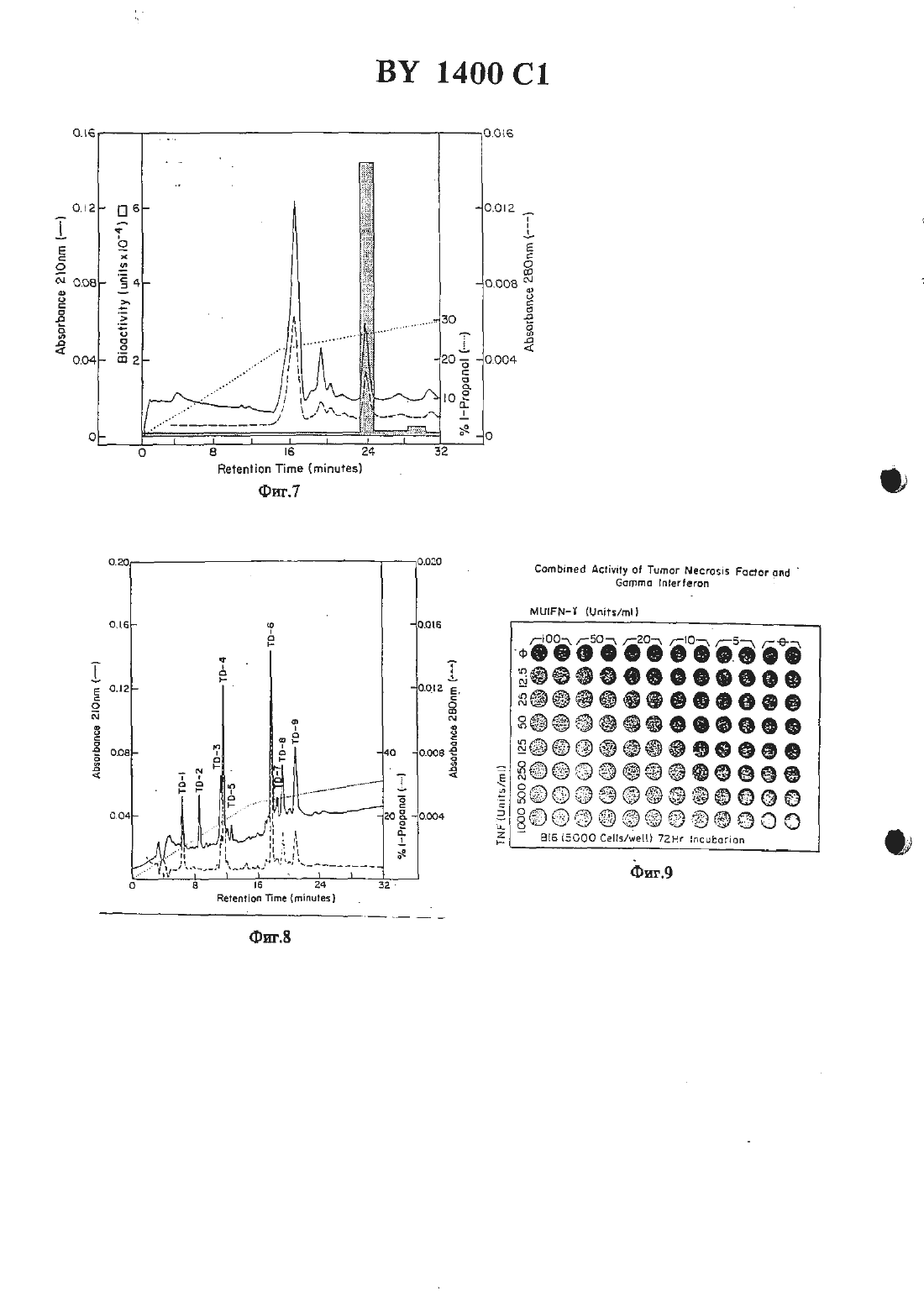
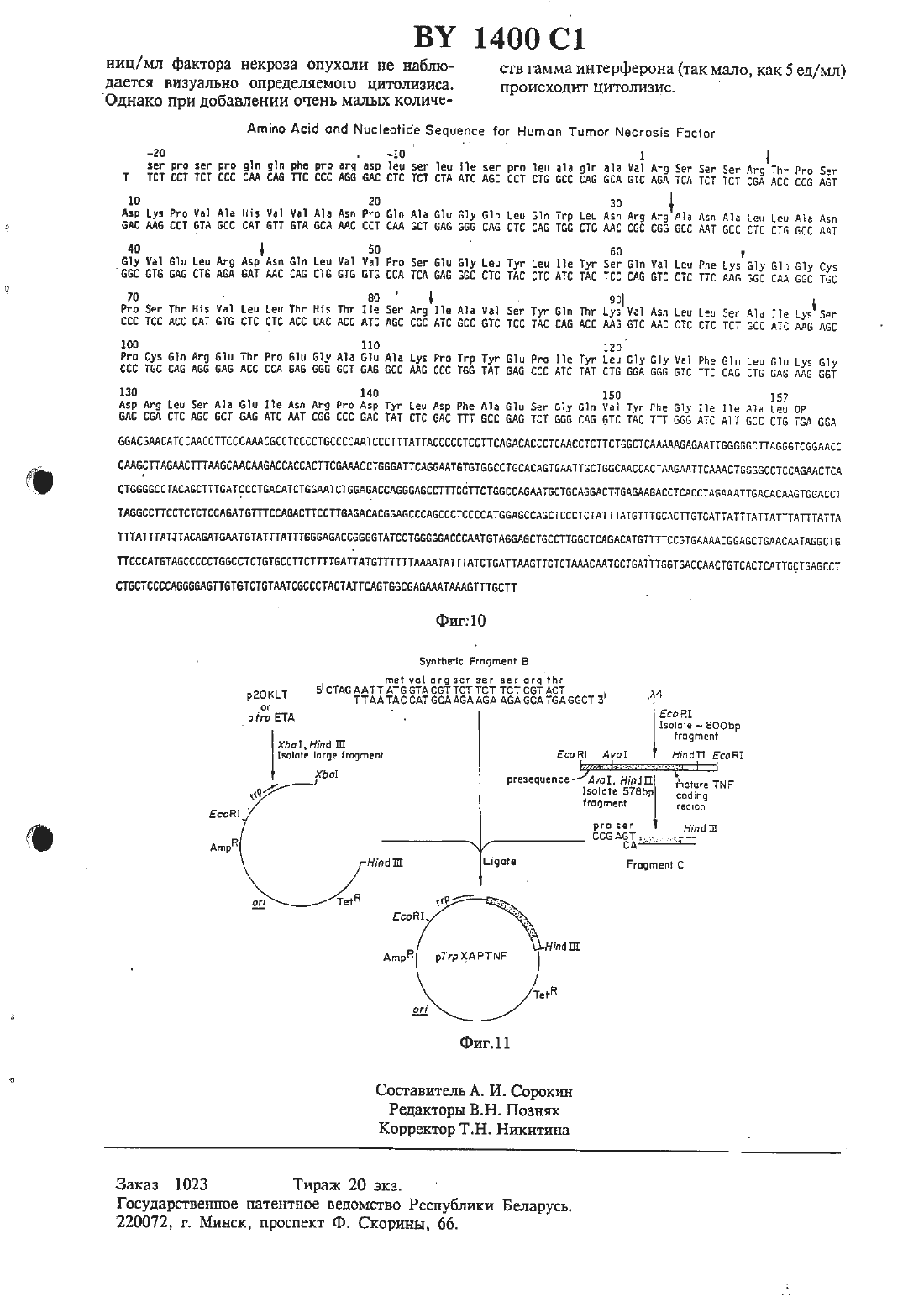
жидкостной хроматографией при высоком давлении на С 4-обратной фазе.2 Способ по 11.1, отличающийся тем, что при хроматографии на стеклянных шариках элюцшо фактора некроза опухоли проводят этиленгликолем. , 3. Человеческий фактор некроза опухоли, способный к разрушению или ингибированию опухолевых клеток, полученный из НЬ-60 или РЕД-человеческой клеточной линии со следующей аминокислотной последовательностью и имеющий следующие свойства16. Тдшеоа ет.а 1., 1983, Се 11 ц 1 аг апа Мо 1 есп 1 аг Вйонву, 296) 349-352.Изобретение относится к цитотоксическнм факторам, которые секретнруются лимфатическими клетками, и к способам их получения В-клетки, Т-клетки и макрофаги вырабатывают вещества, которые проявляют цитотоксическую активность по отношению к опухолевым клеткам, но которые являются безвредными для нормальных клеток. Эти вещества имеют различные названия, например, лимфотоксин, фактор некроза опухоли,цитогтоксический фактор НК клетки, фактор гемморташтческото некроза, макрофаговый цитотоксин или цитотоксическнй макрофатовый фактор. В настоящее время Идентичность протеинов, связанных с этими названиями, неясна. Принципиальные трудности заключаются в том, что биологические анализы, применяемые для обнаружения протеинов, не дают различия между ними, протеины находятся в природе в виде агрегатов или гидролитических продуктов, и, следовательно. полученные ко 10личества являются настолько матами, что не была достигнута необходимая высокая степень очистки, чтобы полностью охарактеризовать протеины.Обычно такие цитотоксические вещества находятся в сыворотке иитактных животных или В Надосадотшых слоях культуры лимфатических клеток или клеточных линий, после того как животные или клетки были обработаны веществом, известным для стимуляции пролиферации иммунных клеток (индуктором). После этого сыворотку шш надосадочпъпч слой навлекают и проверяют на шпотоксическую активность по отношению клеточной линии опухоли-мишени. Стандартной мишенью является 1.929, клеточная линия мышиной опухоли. Эта клеточная линия и другие, исподпэзуеьше в бнопробах этого типа, являются иеспецифнчестоили по их литическому ответу, потому что множество раздельных продуктов лимфатических клеток, по-вицъшому, способны вызыватьлизис. Подобные неспецифические ответы наблюдаются при анализе ш что некроза опухоли. Итак, цитолитические пробы, которые наблюдаются при лизисе клеточных линий йп что или некроза опухоли йп тою, являются неадекватными для различения среди различных цитотоксических лимфатических продуктов.Цитотоксические факторы классифицируют с учетом того, какими клетками они индуцируются. Например, название лимфотоксин обычно применяется к цитотоксическим секреторным продуктам В и Т лимфоцитов или клеточных линий, которые происходят из этих лимфоцитов. Фактором некроза опухоли называют цитотоксические продукты макрофагов или гслеточных линий, полученных из макрофагов.Были сделаны попытки очистить и охарактеризовать цитотоксические факторы, секретнруемые каждым типом клеток. Имеющиеся различные сообщения о свойствепитотоксиче ского фактора являются полностью противоре-чивыми в отношении данного свойства, можно сделать вывод, что или эта характеристика является ошибочной, или что каждой клеткой этого типа секрстируется множество раздельных цитотоксических факторов. Например,цптотоксическне продукты, происходящие ИЗ макрофагов, МОЕОЦПТОВ ИЛИ МОНОЦИТЫческих клеточных линий, которые иногда упоМИНЗЮТСЯ как ФЗКТОР НВКРОЗЗ ОПУХОЛИ, ПО сообщениям обладают свойствами, которые кажутся противоречащими теории единого цитотоксггческого продукта 1-3. Предполагают, что лимфотоксин морской свинки и цитотоксический фактор макрофашв морской свинки являются иммунохимически подобными, если не идентичными 4-5. Попытки охарактеризовать иммунные цитотоксические факторы также были сфокусированы на использовании в качестве исходного материала сыворотки или внутрибрюшинной жидкости животных, которые быт обработаны иммуногенвщти антгпенами 6-10. Известен цитотоксическнй пощшептид, который был очищен от примесей из культуры человеческих шшфобласгондных клеток. Этот полипептид был назван лимфотоксином, хотя его отношение к другим описанным цитотокСПЧССЕСИЬЛ ПОЛИПЕПТНДЗМ ПОД НЗЗБЗНИСМ ЛИМфотокси-н является предположительным. Неизвестно, является ли он единственным цитотоксическим полипептндом, вырабатываеМНМ ИММУННЫМИ КЛСТКВМИ, ИЛИ же ОН является одним из потенциального семейства цитотоксических факторов 17. Этот полипептид имеет две концевые аминогруппы, оканчивается Лей Про Гли Вал Лей Тр Про Ала Ала Гли Тр Ада Арт Гли Гнс ПроЛиз Мег Гнс Лей Ада Гнс Сар Тр и меньший вариант с усеченной концевой аминогруппой Гнс Сер Тр Лей Лиз Про Ала АлаВ соответствии с известными литературными данными интерфероны, которые обладают некоторой активностью ингибирования опухолей,и недостаточно охарактеризованный протеин,имеющий на конце Ала Ада, являются кандидатами для нелимфотоксических цитотоксических факторов. Как будет показано, фактор некроза опухоли настоящею изобретения не является интерфероном, не является лимфотоксином и не имеет Ала Ала окончания.Ближайшим аналогом заявляемого способа является способ получения фактора некроза опухоли из крови кроликов, которым предварительно вводят 50 мг умерщвленных сухих клеток Рго рйопй-Ьастегйпщ аспез, путем фильтрации плазмы и нанесения фильтрата на колонку ДЕАЕ - Зерпогозе СЪ-бВ с последующей повторной хроматографией на ДЕАЕ - Бьагозе СЬ-БВ и дальнейшей очисткой ультрафильтрацией, хроматографией на Зерпосгуе В-20 ультрафильтрацпей, хроматографией на 2 п 2 хелатной сефарозе и на То 3 орег 1 55 (18).Цитотоксический фактор был очищен до юмогенносги охарактеризован. Этот фактор для удобства обозначен как фактор некроза опухоли (ФНО) (Т ЫР) и определен ниже. Его ПОЛУЧЗЮТ В ГОМОГЕННОМ БИДЕ ИЗКЛЕток при удельной активности больше 10 мил.Фактор некроза опухоли может быть получен путем культивирования клеточных линий животных, а именно индуцированных моноцихтическнх клеточных линий, при выращивании в присутствии дгбега-форбол-Ш-шшнстат-13-ацетате (РМА) или клеточных линий,таких как гибридомы или ЕВЧ трансформированные клетки. При этом фактор некроза опухоли получают в результате очистки, извлекая надосадочную культуральную жидкость или лизнрованную клеточную культуру, удаляя твердые вещества, адсорбируя фактор некроза опухоли из надосадочной смеси (содержащей фактор некроза опухоли и другие протеины) на гидрбфобное вещество, элюируя фактор некроза опухоли с вещества, адсорбируя фактор некроза опухоли на анионообменную смолу с третичными аминогруппами, элюируя фактор некроза опухоли со смолы, адсорбируя фактор некроза опухоли на анноонообметшую смолу(предпочтительно замещеиную четъертичными аминогруппами), имеющую практически однородный размер частиц, и элюируя фактор некроза опухоли со смолы. В некоторых случаях композиции фактора некроза опухоли концентрируют и очищают хроматофокусированием в любой точке процедуры очистки, например, изоэлектрическим фокусированием, или пропусканием черезмолекулярносгтговой гель, такой как Сефадекс С-25.Очищенный фактор некроза опухоли индуцированной клеточной культуры объединят для терапевтического применения с физиологически безвредными стабилизаторами и эхЦИПИЦСНТЕМИ И ПОЛУЧЗЮТ В ВИДЕ ДОЗИрОВЗННЫК форм путем лиофнлизации в дозироночиых сосудах, или хранят в виде стабилизированных водных препаратов. Альтернативно, фактор некроза опухоли включают в полимерную матрицу для имплантации в опухоли или в хирургические участки, из которых опухоли были вырезаны, в результате чего проводится пролонгированное выделение фактора некроза опухоли с локализованной высокой концентрацией.Полученные здесь композиции свободны от загрязняющих цитотоксических факторов, такнх как лимфотоксин, интерфсроны или другие цитотоксические протеины, упоминаемые в литературе. Однако при терапевтическом применении фактор некроза опухоли выгодно сочетать с заранее определенными количествами лимфотоксина и/ или интерферона. Композиции, содержащие фактор некроза опухоли и интерферон, такой как гамма интерферон,являются особенно полезными, так как было обнаружено, что они проявляют синергетическую цитотоксическую активность.Композиции, содержащие фактор некроза опухоли в терапевтически эффективных дозах вводят животным, в частности, имеющим злокачественные опухоли. Подходящие дозы могут быть определены врачом в терапевтическом контексте, как описано здесь далее.На рис.1 показан профиль эшоирования фактора некроза опухоли со стекла с контролируемыми порами.На рис.2 показан профиль элюировании фактора некроза опухоли с диэтилашшоэтилцеллголозы.На рис.З показан профиль элюировании фактора некроза опухоли при скоростной жидкостной хроматографии протеинов.На рисА показан профиль элюировании фактора некроза опухоли при хроматофокусированны.На рис.З приведена молекулярная масса фактора некроза опухоли при электрофорезе на СДС НААГ геле.На рис.6 показана молекулярная масса фактора некроза опухоли при элюировании с помощью высокоэффективной жидкостной хроматографии.На рис.7 показан профиль элюировании фактора некроза опухоли с колонки при высокоэффективной жидкостной хроматографии.На рис.З показано разделение фрагментов трипсиновото перевара фактора некроза опухоли высокоэффективной жидкостной хроматографией.На рис.9 показано цитоггоксическое действие смесей гамма интерферона и фактора некроза опухолеи.На рис.10 представлена иуклеотидная и дм. нохислотная последовательности для префактора человеческого некроза опухоли, включая полный секреториый лидер фактора некроза опухоли.Фактор некроза опухоли определен как полипептид, другой чем лимфотоксин, обладающий предпочтительной цитотоксической активностью и имеющий область, обладающую функциональной аминокислотной гомологией с аминокислотной последовательностью зрелого фактора некроза опухоли, представленной на рис.10, его фрагмент или производное такого полипептида или фрагмента.Предпочтительны цитотоксическая активносгь определяется как предпочтительиая деструкция или ингибирование роста опухолевых клеток по сравнению с обычными клетками в тех же самых условиях. Предпочтительны цитотоксическая активность определяется по действию полгшептида на опухолевые клетки ш то или 111 что по сравнению с нормальными клетками или тканью. Этот лизис обычно является диагностическим индикатором ш что,тогда как некроз опухоли определяется в эксперименте ш то. Однако цитотоксическая активность может быть доказана как цитосгазиз или антипролиферирующая активность. Хорошо известны подходящие аналитические системы.Удельная активность фН 0 подсчитывается в переводе на целевой лизис клеток, а не на цитостазис. Одна единица фактора некроза опухоли определяется как количество, требующееся для 50 -ного лизиса целевых клеток,помещенных в каждое углубление в соответствии с примером 1. Однако это не означает исключение других анализов для измерения удельной активности, а именно, методов, основанных на скорости роста целевых клеток.ПрефНО является видом фактора некроза опухоли, включенным в вышеупомянутое определение фактора некроза опухоли. Оннаивного шш лидерного полипептида, который служит для пост-трансляционном переноса протеина на участок внутри или вне клетки. Обычно сьтншгьътьсгт пошшептнд (который не обладает некротирующей опухоль активностью) протеолптически отщепляется от остаточного протеина, имеющего активность фактора некроза опухоли как часть секреторноюпроцесса, в котором тхротеин транспортируется в периплазму клеткиили культурную среду. Сигнальный пептид может быть микробным или млекопитающим (включающим нативную прспоследовательность 76 остатков), но предпочтительно является сигналом, который является гомологичным к клетке хозяина. Нативный фактор некроза опухоли из нормальных биологических источников имеет расчетную молекулярную массу около 17000 при электрофорезе на додецилсульфанатриевом полиакриламидном геле (СДС-ПААГ), как описано ниже, изоэлектрическую точку около 5,3 и восприимчивость к гидролизу трипсином на множестве участков. Натниный фактор некроза опухоли, который был очищен высокоэффективной жидкостной хроматографией с обратной фазой, гидролизуется трипсином по крайней мере на девять фрагментов в условиях, описанных ниже. Точное количество фрагментов, на которое гидролизуется трипсином фактор некроза опухоли, будет зависеть оттаких факторов, как активность трипсина, концентрация фактора некроза опухоли и параметры инкубированття, включая ионную силу, рН, теьшературу и время инкубирования.Фактор некроза опухоли вероятно не является гликопротеином, так как он не удерживается на пектиновых аффинных колонках и не содержит подобных участков гликозилированпя.Степень шмологтгчностп аминокислотной последовательности, кодирующей фНО будет варьировать в зависимости от тот, будет ли гомология между протеином-кандидатом и фактором некроза опухших попадать внутрь области фактора некроза опухоли, ответственной за цитотоксическую активность области,которые являются критическими для цитотоксической активности, должны обладать высокой степенью гомологии. Последовательности,обеспечивающие конформацию фактора некроза опухоли или эффективный связывающий рецептор, могут показывать сравнительно низкую томологичносгь. Кроме того, практические области могут проявлять цптотоксическую активносгь и еще оставаться гомологичными, как определено здесь, если остатки, содержащие функционально подобные аминокислотные боковые цешт, являются замещениыми. Функционштьное подобие относится к доминантным характеристикам боковых цепей, таких как основная, вейтральная или кислая, или наличие или отсутствие стерического блока. Однако фактор некроза опухоли. как определено здесь, специфически исключает лимфотоксин.Обычно полнпептид, определенный как фактор некроза опухоли, должен содержать области, по существу гомологичные с протеином рис.10 или его фрагментом в непрерывном бло 5хе примерно от 20 до 100 аминокислотныхНаиболее существенным фактором при доказательстве идентичности полипептида,как фактора некроза опухоли, является способность антисыворотки, которая может посуществу нейтрализовать цитотоксическую еактивность зрелого фактора некроза опухоли,также нейтрализовать цитолитическую активность рассматриваемого полипептида. Однако,следует указать, что иммунологическая иденТИЧНОСТЬ И ЦИТОТОКСиЧЕСкая идентичность не являются необходимо сосуществующими. Нейтрализующее антитело для фактора некроза опухоли может не связывать протеин-кандидат, потому что нейтрализующее антитело не связывается со специфическим участком на факторе некроза опухоли, который является критическим для его цитотоксической активности. Действительно, антитело может связывать безвредную область и проявлять свое нейтрализующее действие путем стерическою препятствия. Следовательно, протеин-кандидат, мутированный в этой безвредной области,может больше не связывать нейтрализующее антитело, но тем не менее он не будет фак тором некроза опухоли с учетом юмологичности и биологической активности.Важно отметить, что такие характеристики, как молекулярная масса, изоэлектрическая точка и т.п. для нативвото или зрелого фактора некроза опухоли, полученного из периферических лимфоцитов или при культивировании определенных клеточных шший,являются наглядными только для нативных видов фактора некроза опухолей. Фактор некроза опухоли, как рассматривалось в приведенном выще определении, будет включать другие виды, которые не будут обладать всеми характеристиками нативпою фактора некроза опухоли. Хотя фактор некроза опухоли, как определено здесь, включает нативныгс фактор некроза опухоли, другие относительно цитотоксические полипептиды будут попадать под это определение. Например, производные фНО типа мутантов со вставкой, мутантов с делецией или сшитые протеины, описанные выше, не будут обладать молекулярной массой, установленной для нативното фактора некроза опухоли (сшитые протеины со зрелым фактором некроза опухоли или сам префНО,а также мутанты со вставками будут иметь большую молекулярную массу, чем нативный зрелый фактор некроза опухоли, тогда как делециониые мутанты нативного зрелого фактора некроза опухшш будут иметь меньшую молекулярную массу). Подобным образом фактор некроза опухоли может быть сконструирован ДЛЯ ТОГО, ЧТОБЫ СНИЗИТЬ или устранить
МПК / Метки
МПК: C12N 15/28, C07K 15/04
Метки: фактор, некроза, опухоли, получения, способ, фактора, человеческий
Код ссылки
<a href="https://by.patents.su/15-1400-sposob-polucheniya-faktora-nekroza-opuholi-chelovecheskijj-faktor-nekroza-opuholi.html" rel="bookmark" title="База патентов Беларуси">Способ получения фактора некроза опухоли, человеческий фактор некроза опухоли</a>
Предыдущий патент: Производные 1-фенил-2-(1,2,4-триазол-1-ил) пропена Е-изомера и фунгицидная композиция
Следующий патент: Способ удаления эндотоксина из культуральной жидкости штамма фазы I Bordetella pertussis
Случайный патент: Гидромашина