Соединение, фармацевтическая композиция, промежуточное соединение
Номер патента: 3544
Опубликовано: 30.09.2000
Авторы: Поль А. ДАСИЛВА ЖАРДИНЕ, Роберт Л. РОЗАТИ, Кимберли О. КАМЕРОН
Текст
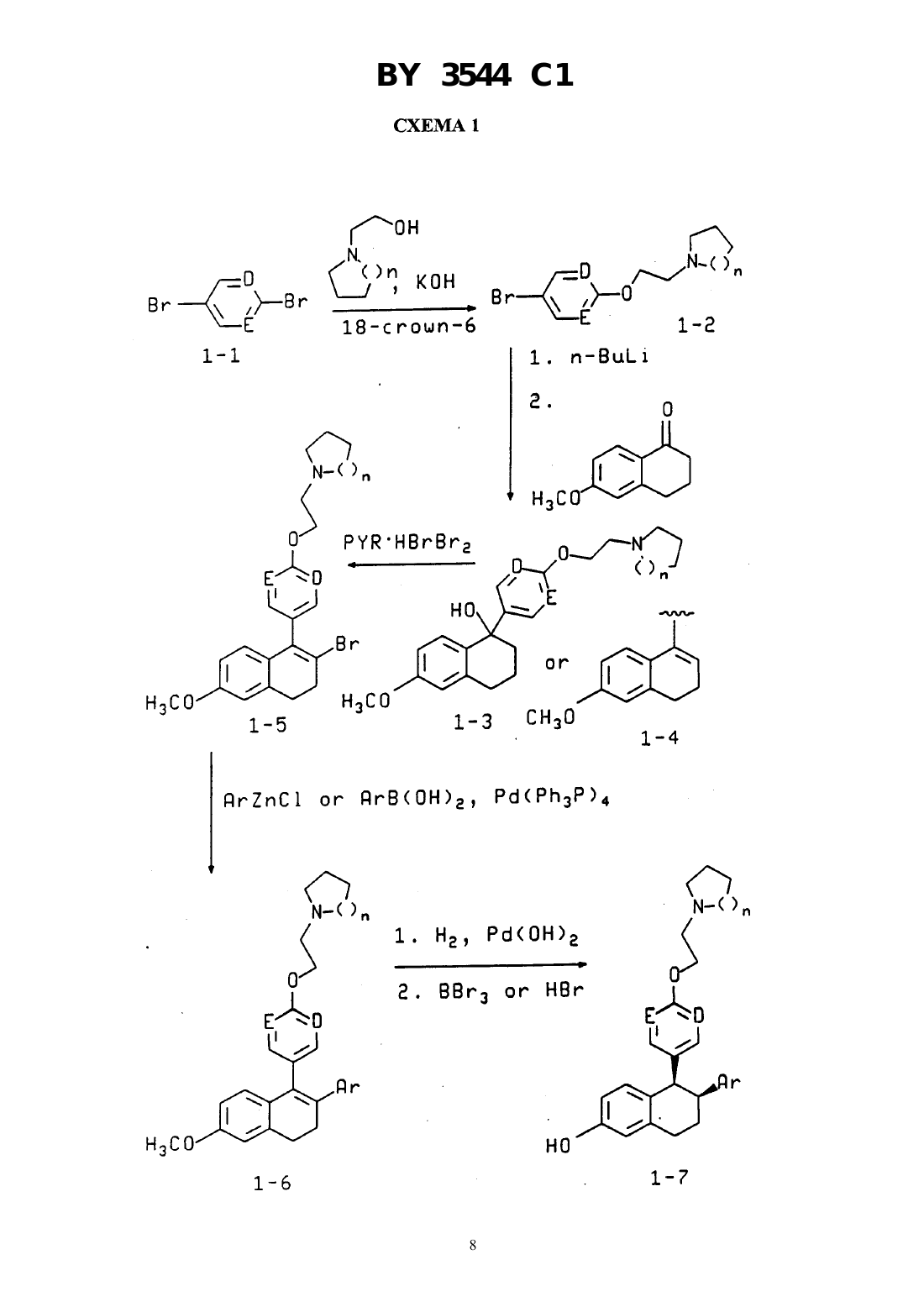
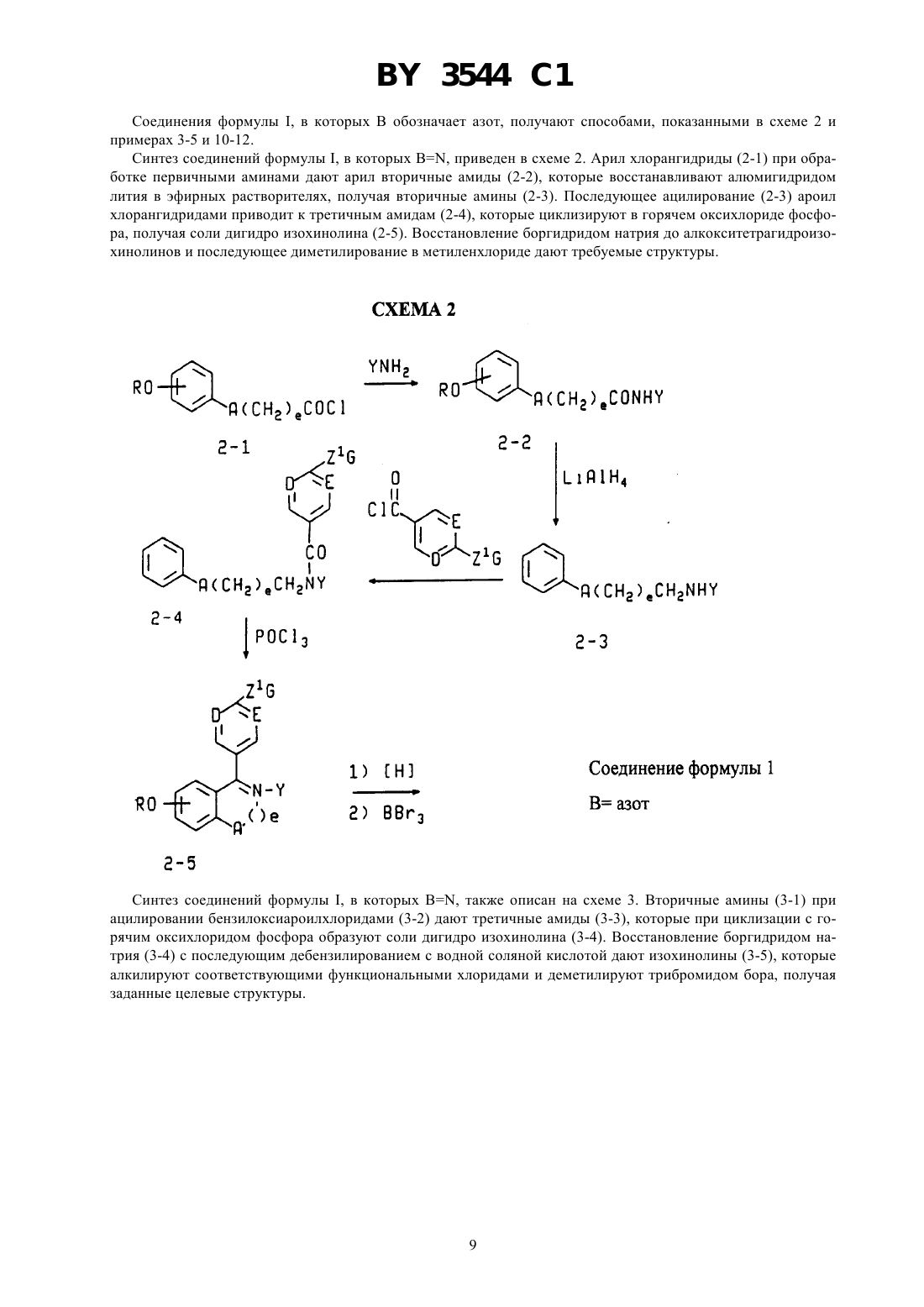
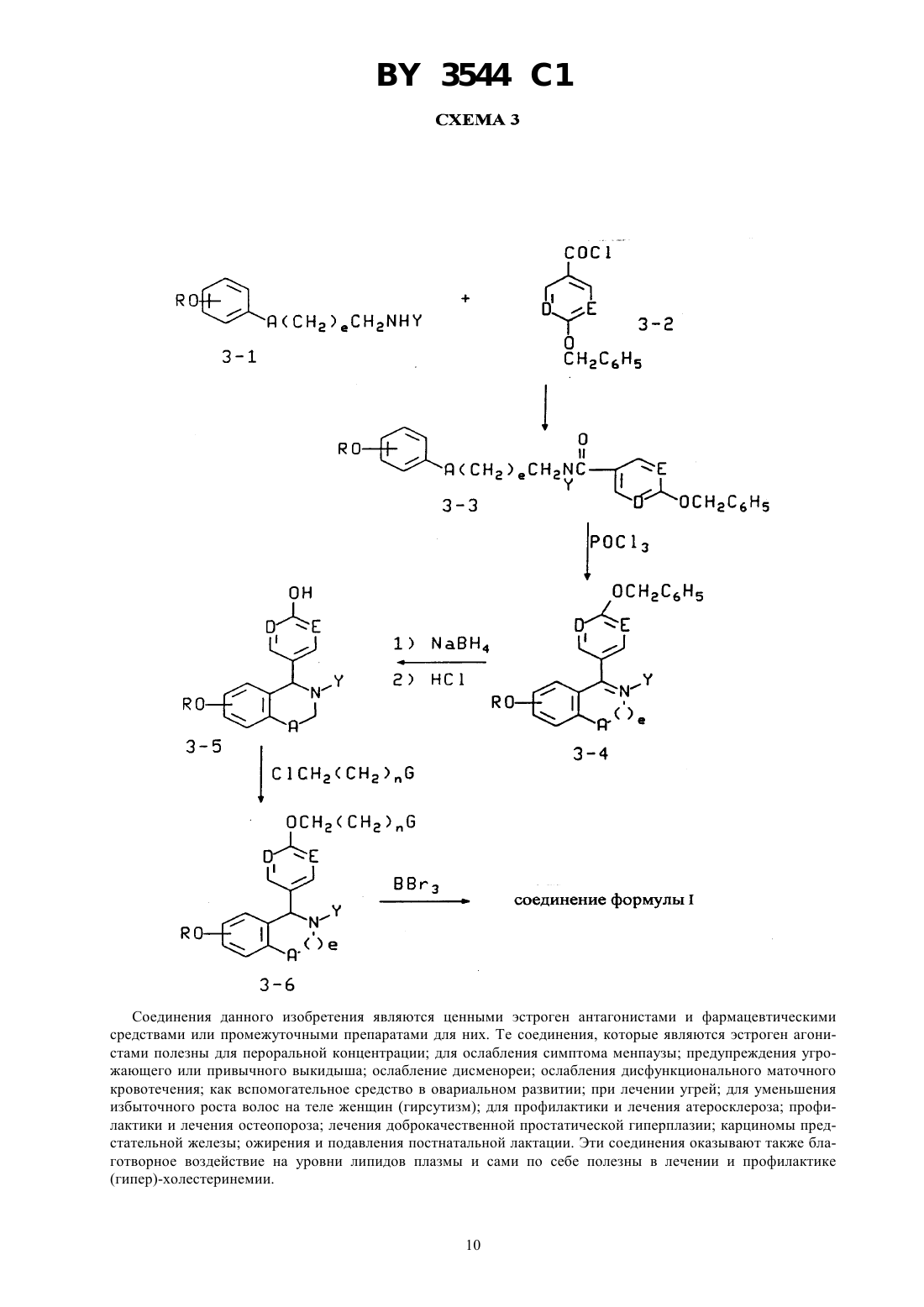
ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ(57) 1. Соединение общей формулы гдеи- независимо выбраны изили ,4 - водород, галоген, гидрокси, представляет собой их оптические и геометрические изомеры и нетоксичные фармацевтически приемлемые кислотноаддитивные соли. 2. Соединение по п. 1, в котором 4 - водород, гидрокси, фтор или хлор. 3. Соединение по п. 1, в которомиобозначают . 4. Соединение по п. 1, в которомобозначает , иобозначает . 5. Соединение по п. 1, в которомобозначает , иобозначает . 6. Соединение по п. 1, представляющее собой цис-6-(4-фторфенил)-5-4-(2-пиперидин-1 илэтокси)фенил-5,6,7,8-тетрагидронафталин-2-ол. 7. Соединение по п. 1, представляющее собой (-)-цис-6-фенил-5-4-(2-пирролидин-1-илэтокси)фенил 5,6,7,8-тетрагидронафталин-2-ол. 8. Соединение по п. 1, представляющее собой цис-6-фенил-5-4-(2-пирролидин-1-илэтокси)фенил 5,6,7,8-тетрагидронафталин-2-ол. 9. Соединение по п. 1, представляющее собой цис-1-(6-пирролидиноэтокси-3-пиридил)-2-фенил-6 гидрокси-1,2,3,4-тетрагидронафталин. 10. Соединение по п. 1, представляющее собой 1-(4-пирролидиноэтоксифенил)-2-(4-фторфенил)-6 гидрокси-,2,3,4-тетрагидроизохинолин. 3544 1 11. Соединение по п. 1, представляющее собой цис-6-(4-гидроксифенил)-5-4-(2-пиперидин-1 илэтокси)фенил-5,6,7,8-тетрагидронафталин-2-ол. 12. Соединение по п. 1, представляющее собой 1-(4-пирролидиноэтоксифенил)-2-фенил-6-гидрокси 1,2,3,4-тетрагидроизохинолин. 13. Фармацевтическая композиция, обладающая эстроген антагонистической/агонистической активностью, содержащая активный агент и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного агента она содержит соединение по п. 1 в эффективном количестве. 14. Фармацевтическая композиция по п. 13 для лечения или профилактики остеопороза. 15. Фармацевтическая композиция по п. 13 для лечения или предупреждения сердечно-сосудистого заболевания или (гипер) холестеринемии. 16. Фармацевтическая композиция по п. 13 для лечения или предупреждения заболевания простаты. 17. Фармацевтическая композиция по п. 13 для снижения уровня холестерина сыворотки. 18. Фармацевтическая композиция по п. 13 для лечения или предупреждения ожирения. 19. Фармацевтическая композиция по п. 13 для лечения или предупреждения эндометриоза. 20. Промежуточное соединение для получения соединения формулы , представляющее собой 1-2-4-(6-метокси-3,4-дигидронафталин-1-ил)феноксиэтилпирролидин или 1-2-4-(2-бром-6-метокси-3,4-дигидронафталин-1-ил)феноксиэтилпирролидин. Изобретение относится к эстроген агонистам и антагонистам и их фармацевтическому применению. Ценность эстрогенов природного происхождения и синтетических композиций демонстрирующих эстрогенную активность состоит в их медицинском и терапевтическом применении. Традиционный перечень терапевтических применений эстрагенов, как таковых, или в комбинации с другими активными агентами включает пероральную контрацепцию ослабление симптомов менопаузы профилактику угрожающего или привычного выкидыша ослабление дисменореи ослабление дисфункционального маточного кровотечения вспомогательное средство в овариальном развитии лечении угрей уменьшении избыточного роста волос на теле женщин (гирсутизм) профилактику сердечно-сосудистых заболеваний лечение остеопороза лечение рака предстательной железы и подавление постнатальной лактации,( ), 1985, стр. 1421-1423. Таким образом, существует повышенный интерес к открытию вновь синтезированных композиций и к новым применениям ранее известных соединений, которые являются очевидно эстрогенными, т. е., способными имитировать действие эстрогена в эстроген чувствительной ткани. Остеопороз, заболевание в котором кость становится значительно более ломкой, существенно снижается при применении полностью активных эстрогенов, однако, ввиду признанного возрастающего риска карциномы матки у пациенток, постоянно подвергающихся обработке активными эстрогенами, клинически не целесообразно лечить остеопороз интактной женщины полностью активными эстрогенами по причине увеличения длительности менструации. Таким образом, эстроген агонисты представляют основной интерес и центральный аспект проблемы. Остеопороз является системным заболеванием скелета, характеризующимся низкой костной массой и разрушением костной ткани, с последующим увеличением ломкости костей и подверженностью переломам. Эстроген выбирается в качестве лекарственного средства для предотвращения остеопороза или постклимактерического разрежения кости у женщин, это единственный курс лечения, который определенно снижает переломы. Однако эстроген стимулирует матку и связан с возрастанием риска внутриматочной карциномы. Хотяпредполагается, что риск образования внутриматочной карциномы снижается одновременным применением прогестогена, все же, при применении эстрогена существует опасность возможного увеличения случаев рака молочной железы. В ЕР 0605193 А 1 описано, что эстроген, в частности при пероральном введении снижает уровни плазмыи повышает уровни благотворных альфа-липопротеинов высокой плотности . Однако продолжительная терапия с использованием эстрогена влечет за собой разнообразные нарушения, включая увеличение риска возникновения маточной карциномы и, возможно, рака молочной железы, заставляющие многих женщин избегать этого лечения. Недавно предложены терапевтические схемы, которые стараются уменьшить риск появления карцином, такие как введение комбинации прогестогена и эстрогена, приводящие к тому,что пациентки испытывают нежелательное кровотечение. Кроме того, комбинация прогестерона с эстрогеном, по-видимому, притупляет воздействие эстрогена, понижающее холестерин сыворотки. Значительные 2 3544 1 нежелательные воздействия, связанные с терапией с использованием эстрогена подтверждают необходимость развития альтернативной терапии для (гипер) холестеринемии, оказывающей заданное воздействие насыворотки, но не вызывающей нежелательные эффекты. Существует потребность в улучшенных эстроген агонистах, оказывающих избирательные воздействия на различные ткани организма. Тамоксифен, 1-(4-диметиламиноэтоксифенил)-1,2-дифенил-бут-1-ен, является антиэстрогеном, оказывающим временное облегчающее воздействие на рак молочной железы, но, по сообщениям, проявляет эстрогенную активность в матке.- и др., .(1993) 99, 395, раскрывают, что тамоксифен при 200 и 400 мг/кг/день понижает массу яичек и вторичных половых органов у самцов крыс. Недавно поступило сообщение (( 1812/13 Апрель 16/20, 1993, стр. 29),что ралоксифен, 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидинэтокси)бензоил бензотиофен, имитирует благоприятное воздействие эстрогена на кости и липиды, но в отличие от эстрогена обладает минимальным стимулирующим воздействием на матку (.10(1). 198731-36, , . С. и др.).и др., Т 23245 (1993), сообщают, что обработка ралоксифеном самцов крыс приводит к регрессии вентральной простаты. Ралоксифен и родственные соединения описываются как антиэстрогенные и антиандрогенные вещества,которые эффективны в лечении рака молочной железы и предстательной железы, патент США 4,418,068. В патенте США 4,133,814 описываются производные 2-фенил-3-ароил-бензотиофена и 2-фенил-3 ароилбензотиофен-1-окислов, которые полезны в качестве подавляющего рост опухолей молочной железы.и др., . . . 12, 881 (1969) описали эстроген антагонисты структуры, в которой 2 представляет фенил или циклофенил и 3 обозначает , или -Н 2 СНОНСН 2 ОН.и др. . . . 10, 138 (1967) получили серии тетрагидронафталинов, предназначенных для достижения разделения эстрогенной, противозачаточной и гипохолестеринемической активностей. Эти структуры имеют общую формулу 2 3, в которойобозначает 1,2-фенилен радикал,представляет моноциклическую карбоциклическую арил группу, замещенную третичным низшим-амино алкил-окси, в которой третичная амино группа отделена от окси, как минимум, двумя атомами углерода,обозначает водород, алифатический радикал, карбоксициклический арил радикал, карбоксициклический арил-алифатический радикал, гетероциклический арил 3 3544 1 радикал или гетероциклический арил алифатический радикал, группа формулы -(СН 2-2) - обозначает неразветвленный алкилен радикал, имеющий от трех до пяти углеродных атомов и несущей группыи , их солям, -окислам, солям -окислов или четвертичным аммониевым соединениям, а также к способу получения таких соединений. Патент 3 относится к неполным сложным эфирам многоатомных спиртов с эстрогенным, гипохолестеринемическим и противозачаточным действиями, имеющим формулу,в которойобозначает 1,2-фенилен радикал,представляет моноциклический арил радикал замещенный, по крайней мере, одной низшей-амино алкил-окси группой, в которой атом азота отделен от атома кислорода, по крайней мере, двумя атомами углерода,обозначает арил радикал, радикал -(СН 2-2) - обозначает низший алкилен, образующий сшести- или семи-членный цикл, два углеродных атома, входящие в состав кольца, несут группыи , их солям, -окислам, солям -окислов и четвертичным аммониевым соединениям. В 4 приводятся соединения формулы в которой 1 и 2 выбраны из класса, состоящего из низшего алкила и низшего алкила, связанных вместе таким образом, что образуется 5-7 членный насыщенный гетероциклический радикал. Изобретение предлагает соединения формулы, гдеи- независимо выбраны изили ,4 - водород, галоген, гидрокси, представляет собой их оптические и геометрические изомеры и нетоксичные фармацевтически приемлемые кислотноаддитивные соли. Предпочтительным является, когда 4 представляет водород, гидрокси, фтор или хлор. В иобозначают . Целесообразно, когдаобозначаетиобозначаетили когдаобозначаетиобозначает . Наиболее предпочтительными соединениями являются цис-6-(4-фторфенил)-5-4-(2-пиперидин-1 илэтокси)фенил-5,6,7,8-тетрагидронафталин-2-ол 3544 1 Дальнейший аспект изобретения составляет фармацевтическая композиция, обладающая эстроген антагонистической/агонистической активностью, содержащая активный агент и фармацевтически приемлемый носитель, согласно изобретению, в качестве активного агента она содержит соединение формулыв эффективном количестве. Фармацевтическая композиция может быть использована для лечения или профилактики остеопороза,для лечения или предупреждения сердечно-сосудистого заболевания или (гипер) холестеринемии, заболевания простаты, для снижения уровня холестерина сыворотки, эндометриоза. Изобретением является также и промежуточное соединение для получения соединения формулы , представляющее собой 1-2-4-(6-метокси-3,4-дигидронафталин-1-ил)феноксиэтил пирролидин или 1-2-4-(2-бром-6-метокси 3,4-дигидронафталин-1-ил)феноксиэтил пирролидин. 1-С 3 хлоралкил и 1-С 3 фторалкил включают метил, этил, пропил и изопропил, замещенный до некоторой заданной степени атомами хлора или фтора, от одного атома до полного замещения. 5-7 циклоалкил включает циклопентил, циклогексил и циклогептил. Галоид означает хлор, бром, йод и фтор. Арилвключает фенил и нафтил, необязательно замещенные одним-тремя заместителями, выбранными из 4, как определено выше.означает дитиотреитол,диметилсульфоксид,- этилендиаментетрауксусная кислота. Эстроген агонисты определяются здесь как химические соединения, способные связываться по эстроген рецепторным участкам в ткани млекопитающих, и имитирующие действия эстрогена в одной или более тканях. Эстроген агонисты определяются здесь как химические соединения, способные связываться по эстроген рецепторным участкам в ткани млекопитающих, и блокирующие действия эстрогена в одной или более тканях. Некоторые перечисленные в данном изобретении соединения будут химически несовместимы одно с другим или с гетероатомами в соединениях, и следует избегать этих несовместимостей при выборе соединений данного изобретения. Аналогично, некоторые функциональные группы (в ходе синтезов) могут нуждаться в защитных группах. Некоторые соединения данного изобретения содержат атомы, которые могут давать отдельные оптические и геометрические конфигурации. Все такие изомеры включены в данное изобретение, предпочтительны левовращающие изомеры в цис конфигурации. Очевидно, что из некоторых соединений данного изобретения могут быть получены разнообразные фармакологически приемлемые сложные эфиры и соли. Все такие эфиры и соли включены в данное изобретение. Используемое в данном описании понятие заболевания простаты означает доброкачественную гиперплазию простаты или рак предстательной железы. Лекарственные средства для лечения заболеваний простаты, рака молочной железы, ожирения, сердечнососудистого заболевания, (гипер) холестеринемии и остеопороза в данном изобретении включают в качестве активного ингредиента соединение формулыили его соль, или сложный эфир. Фармацевтически приемлемыми солями соединений формулыявляются обычно используемые нетоксичные соли, такие как соли с органическими кислотами (например, муравьиная, уксусная, трифторуксусная, лимонная, малеиновая, щавелевая кислоты, метансульфокислота, бензолсульфокислота и толуолсульфокислота), неорганическими кислотами (например, соляная, бромистоводородная, серная или фосфорная кислоты) и аминокислотами (например, аспарагиновая или глутаминовая кислоты). Такие соли могут быть получены известными каждому специалисту-химику способами. Лекарственные средства для лечения заболеваний простаты, рака молочной железы, ожирения, сердечнососудистого заболевания, (гипер) холестеринемии и остеопороза, согласно данному изобретению, могут вводится животным, а также человеку, перорально или парентерально в обычно используемых для препаратов формах, таких как капсулы, микрокапсулы, таблетки, гранулы, порошки, лепешки, пилюли, суппозитории,инъекции, суспензии и сиропы. Лекарственные средства данного изобретения для лечения заболеваний простаты, рака молочной железы,ожирения, сердечно-сосудистого заболевания, (гипер) холестеринемии и остеопороза могут быть получены обычными способами с применением обычных органических добавок, таких как наполнитель (например, сахароза, крахмал, маннитол, сорбитол, лактоза, глюкоза, целлюлоза, тальк, фосфат кальция или карбонат кальция), связывающие вещества (например, целлюлоза, метилцеллюлоза, гидроксиметилцеллюлоза, полипропилпирролидин, поливинилпирролидин, желатин, гуммиарабик, полиэтиленгликоль, сахароза или крахмал), разрыхлитель (например, крахмал, карбоксиметилцеллюлоза, гидроксипропилкрахмал, мало замещенная гидроксипропилцеллюлоза, бикарбонат натрия, фосфат кальция или нитрат кальция), смазывающее вещество (например, стеарат магния, маловязкая безводная кремниевая кислота, тальк или лаурилсульфат натрия), корригент (например, лимонная кислота, метанол, гликокол или апельсиновый порошок),5(например, лимонная кислота, цитрат натрия или уксусная кислота), суспендирующее вещество (например,метилцеллюлоза, поливинилпирролидон или стеарат алюминия), диспергирующее вещество (например, гидроксипропилметилцеллюлоза), растворитель (например, вода), и восковая основа (например, масло какао,белый вазелин или полиэтиленгликоль). Количество активного ингредиента в медицинской композиции должно быть на таком уровне, чтобы оказывать желаемый терапевтический эффект например, приблизительно от 0,1 мг до 50 мг в стандартной дозе как для перорального, так и для парентерального введения. Активный ингредиент обычно вводится пациенту от одного до четырех раз в день со стандартной дозой от 0,1 мг до 50 мг, но данная доза может быть соответственно изменена в зависимости от возраста, веса тела и медицинского состояния пациента и типа введения. Предпочтительная доза для человека составляет от 0,25 мг до 25 мг. Предпочтительно введение одной дозы в день. Соединения изобретения легко можно получить по приведенным ниже реакционным схемам. Определенные соединения формулыможно получить из ненасыщенного промежуточного соединения путем гидрирования с благородным металлом в качестве катализатора в реакционно инертном растворителе. Давление и температура не являются решающими и гидрирование обычно завершается за несколько часов при комнатной температуре и при давлении водорода 20-80 фунт/кв. дюйм (1,4-26,7 кг/см 2). Продукт гидрирования выделяют, очищают при желании, и простую эфирную группу расщепляют с кислотным катализатором в реакционно инертном растворителе при температуре между 0 и 100 в зависимости от используемого кислотного катализатора. Найдено, что в этой реакции эффективны бромистый водород при повышенных температурах, трибромид бора и хлористый алюминий при температурах от 0 до температуры окружающей среды. Продукт формулывыделяют и очищают стандартными способами. Промежуточные продукты формулы , в которыхпредставляет 2, и ,иобозначают , описаны в патенте США 3,274,213 . . . 10, 78 (1967) . . . 10, 138 (1967) и . . . 12,881 (1969), каждый из которых представлен здесь в качестве ссылки. Они могут также быть получены по описанным ниже методикам. Получение соединений формулы , в которых , 2, 22, циклоалкиламин, В, показано в схеме 1. Соединения 1-2, в которыхипредставляют , получают алкилированием 4 бромфенола с соответствующим -хлорэтиламином, используя карбонат кальция в качестве основания в полярном апротонном растворителе, таком как диметилформамид, при повышенных температурах. Предпочтительна температура в 100 С. Соединения 1-2, в которыхили , или оба, обозначают , синтезируют,используя реакцию нуклеофильного замещения, выполненного на дибромидах (-) с использованием гидроксиэтилциклоалкиламинов в условиях фазового переноса, что дает бромамины (1-2). , 77, 573(1980). Последующий металлогалоидный обмен с использованием н-бутиллития или металлического магния и бромаминов (1-2) дает соответствующие литиевые или магниевые реагенты, позволяющие проводить реакцию при низких температурах, предпочтительно в присутствии цезий хлорида (в отсутствии цезий хлорида реакция также протекает) с 6-метокси-1-тетралоном с получением карбинолов (1-3) или стиролов (1-4) после обработки кислотой. Обработка карбинолов (1-3) или стиролов (1-4) бромирующим агентом, таким как пиридиний бромид, дает бромстиролы (1-5). Арил или гетероарил хлориды цинка или арил или гетероарил борные кислоты реагируют с бромидами (1-5) в присутствии металлического палладия в качестве катализатора, такого как тетракис трифенил фосин палладий (0), с образованием диарил стиролов (1-6).. 63, 419, (1991) и . С, . . 61, 3008-3010 (1988). Для получения предпочтительных соединений в этой реакции используют замещенные фенил хлориды цинка или замещенные фенилборных кислот. Арил хлориды цинка получают гашением соответствующего литиевого реагента безводным хлористым цинком. Арил борные кислоты, которые не выпускаются промышленностью, получают гашением соответствующего арил литиевого реагента триалкил боратом, предпочтительно триметил или триизопропил боратом, с последующей обработкой водной кислотой (. 47, 221-230, 1993). Литиевые реагенты, не выпускаемые промышленностью, получают путем металло-галоидного обмена соответствующего бромида или галогена с н-бутил или т-бутиллитием. Или же иначе, литиевый реагент получают путем облегченной гетероатомной литизации, как описано в,27,1. Каталитическое 6 3544 1 гидрирование (1-6) в присутствии гидроокси палладия на активированном угле, например, дает соответствующие дигидрометокси промежуточные продукты, которые впоследствии диметиллируют, используя трибромид бора при 0 в метилен хлориде или 48 бромистый водород в уксусной кислоте при 80-100 , что дает целевые структуры (1-7). Эти соединения рацемические и могут быть разделены на энантиомеры жидкостной хроматографией высокого давления с применением колонки с хиральной неподвижной фазой, такой как колонки. Иначе, оптическое разделение может быть выполнено перекристаллизацией диастереомерных солей, образованных с оптически чистыми кислотами, такими как 1,1-динафтил-2,2-диил кислый фосфат (пример 8). Цис соединения (1-7) могут быть изомеризированы в транс соединения обработкой основаниями (пример 2). Когдаи/илиявляется азотом, промежуточные соединения (формула ) и соединения формулымогут быть получены из соответствующих дигалоидпиридинов или пиримидинов, как показано в схеме 1 и, как подробно описано для 6-фенил-5-6-(2-пирролидин-1-ил-этокси)пиридин-3-ил-5,6,7,8-тетрагидронафталин 2-ола в примере 6. Простой метиловый эфир соединения формулы , в котором 1, А 2, 22, пирролидин, В, , удобно получать на первой стадии гидрирования нафоксидина (., 700, ,49001) в реакционно инертном растворителе в присутствии благородного металла в качестве катализатора. Давление и температура не имеют решающего значения реакция обычно проходит в этаноле при комнатной температуре приблизительно за 20 часов при 10,5 кг/см 2. Второй стадией является расщепление метокси группы, которое выполняется обычно при комнатной температуре с кислотным катализатором, таким как трибромид бора в реакционно инертном растворителе или при 80-100 с бромистым водородом в уксусной кислоте. Продукт затем выделяют обычными способами и превращают при желании в кислую соль. 3544 1 Соединения формулы , в которыхобозначает азот, получают способами, показанными в схеме 2 и примерах 3-5 и 10-12. Синтез соединений формулы , в которых , приведен в схеме 2. Арил хлорангидриды (2-1) при обработке первичными аминами дают арил вторичные амиды (2-2), которые восстанавливают алюмигидридом лития в эфирных растворителях, получая вторичные амины (2-3). Последующее ацилирование (2-3) ароил хлорангидридами приводит к третичным амидам (2-4), которые циклизируют в горячем оксихлориде фосфора, получая соли дигидро изохинолина (2-5). Восстановление боргидридом натрия до алкокситетрагидроизохинолинов и последующее диметилирование в метиленхлориде дают требуемые структуры. Синтез соединений формулы , в которых , также описан на схеме 3. Вторичные амины (3-1) при ацилировании бензилоксиароилхлоридами (3-2) дают третичные амиды (3-3), которые при циклизации с горячим оксихлоридом фосфора образуют соли дигидро изохинолина (3-4). Восстановление боргидридом натрия (3-4) с последующим дебензилированием с водной соляной кислотой дают изохинолины (3-5), которые алкилируют соответствующими функциональными хлоридами и деметилируют трибромидом бора, получая заданные целевые структуры. Соединения данного изобретения являются ценными эстроген антагонистами и фармацевтическими средствами или промежуточными препаратами для них. Те соединения, которые являются эстроген агонистами полезны для пероральной концентрации для ослабления симптома менпаузы предупреждения угрожающего или привычного выкидыша ослабление дисменореи ослабления дисфункционального маточного кровотечения как вспомогательное средство в овариальном развитии при лечении угрей для уменьшения избыточного роста волос на теле женщин (гирсутизм) для профилактики и лечения атеросклероза профилактики и лечения остеопороза лечения доброкачественной простатической гиперплазии карциномы предстательной железы ожирения и подавления постнатальной лактации. Эти соединения оказывают также благотворное воздействие на уровни липидов плазмы и сами по себе полезны в лечении и профилактике 3544 1 Хотя соединения данного изобретения являются эстроген агонистами в кости, они служат также антиэстрогенами в ткани молочной железы и, как таковые, полезны в лечении и профилактике рака молочной железы. Предупреждение и борьба с эндометриозом. Протокол хирургически индуцируемого эндометриоза идентичен протоколу, описанному ,106 282-8. Используют взрослые особи-самок крыс(200-240 г.). Косой вентральный надрез делают через кожу и мускулатуру стенки тела. Вырезают сегмент правой трубы матки, мышечную оболочку матки отделяют от эндометрия и сегмент режут продольно. Разрез эндометрия 5 х 5 мм с эпителиальной выстилкой, соединенной со стенкой тела, сшивают по четырем углам с мышцей, используя полиэфирную нить (, 7-0). Критерием жизнеспособного трансплантанта является аккумуляция жидкости, аналогичная аккумуляции, которая происходит в результате стимуляции эстрогеном. Спустя три недели после трансплантации эндометриальной ткани (3 недели) животным производят лапаротомию, объем эксплантанта (длинаширинавысота) в мм измеряют циркулем и начинают обработку лекарственными препаратами. Животным впрыскивают подкожно в течение 3 недель от 10 до 1000 мг/кг/день соединения формулы . В качестве контрольных используют животных с эндометриальным трансплантантом, вводя подкожно в течение 3 недель кукурузное масло по 0,1 мл/день. По окончании 3-х недельного периода обработки (6 недель), животным производят лапоротомию и определяют объем эксплантанта. Спустя 8 недель после прекращения обработки лекарственными средствами (14 недель) животных забивают эксплантант измеряют вновь. Статистический анализ объема эксплантанта производят путем анализа отклонений. Воздействие на массу простаты. Самцам крыс - в возрасте трех месяцев ежедневно в течение 14 дней (6/группа) подкожно инъектируют растворитель (10 этанол в воде) или эстрадиол (30 мг/кг), или тестостерон (1 мг/кг), или соединение формулы . Спустя 14 дней животных забивают, простату удаляют и определяют массу влажной простаты. Определяют среднюю массу и статистическую значимость (0,05) по сравнению с группой обработанной растворителем, используя -тест . Соединения формулысущественно (р 0,05) снижают массу простаты по сравнению с растворителем. Тестостерон не оказывает никакого действия, хотя экстрадион при концентрации 30 мкг/кг также значительно уменьшает массу простаты. Минеральная плотность костей. Прочность кости более чем на 80 зависит от ее минеральной плотности и степени минерального содержания. Снижение минеральной плотности кости с возрастом и/или в связи с заболеванием делает ее более склонной к переломам. Степень минерального содержания кости точно измеряют у людей и животных путем абсорбциометрии с помощью двойного рентгеновского луча , так, что могут быть определены незначительные изменения, вплоть до 1 . Абсорбциометрияиспользовалась для оценки изменений в минеральной плотности костей, обусловленной дефицитом эстрогена, вызванным овариэктомией (хирургическое удаление яичников) и обработкой растворителем, эстрадиолом (2), кеоксифеном (ралоксифеном),или другими агонистами эстрогена. Целью этих изучений является оценка способности соединений данного изобретения предупреждать вызываемое дефицитом эстрогена разрежение кости, измеренное посредством. Самок крыс (-) в возрасте 4-6 месяцев подвергают овариэктомии или симулированному хирургическому вмешательству и дают оправиться от наркоза. Крыс обрабатывают путем подкожной инъекции или перорально через зонд различными дозами (например, 10-1000 мг/кг/день) соединения формулыежедневно в течение 28 дней. Все соединения взвешивают и растворяют в 10 этаноле в стерильном физиологическом растворе. Спустя 28 дней крыс забивают и бедренные кости удаляют и очищают от мяса. Бедренную кость помещают в аппарат 1000 (, . , ), и определяют минеральную плотность кости в периферической части, в месте, расположенном на 1-2 см от конца бедренной кости, используя программное обеспечение с высоким разрешением, поставляемую фирмой . Минеральную плотность кости определяют путем давления костного минерального содержания на площадь дистальной бедренной кости. Каждая группа состоит, по крайней мере, из 6 животных. Получают среднюю минеральную плотность кости для каждого животного и определяют -тестом статистические разности(0,05) для группы, обработанной растворителем, овариэктомией и симулированным хирургическим вмешательством. Испытание эстроген-рецепторного связывания. Для определения способности соединений настоящего изобретения к эстроген-рецепторному связыванию используют испытание эстроген-рецепторного связывания, которое определяет способность соединений настоящего изобретения к замещению 3-эстрадиола из человеческого эстроген-рецептора, полученного рекомбинантными способами в дрожжах. В данном изобретении использованы следующие вещества (1) буферный раствор для испытания,-0,3 (содержащий 10 нМ Трис, рН 7,6 0,3 М хлористого калия и 5 мМ 3544 1 ве холодного лиганда использован эстрадиол, полученный от(4) рекомбинантный человеческий эстроген рецептор, . Раствор подлежащего испытанию соединения получают в- 0,3 с 4 ДМСО и 16 этанола. Насыщенный тритием эстрадиол растворяют в- 0,3 так, чтобы конечная концентрация в опыте составляла 5 нМ.также растворяют в- 0,3, так, чтобы 4-10 мг общего белка было в каждой ячейке для испытания. На используемых пластинах для микротитрования, в каждый инкубат добавляют 50 (мкл) холодного эстрадиола (неспецифическое связывание) или раствор соединения, 20 (мкл) насыщенного тритием эстрадиола и 30 (мкл) растворов . Каждая пластина содержит тройное повторение общего связывания и различных концентраций соединения. Пластины инкубируют в течение ночи при 4 . Затем реакцию связывания прерывают добавлением и перемешиванием со 100 мл 3 гидроксилапатита в 10 мМ трис, рН 7,6 и инкубируют 15 минут при 4 С. Смеси центрифугируют и осадок промывают четыре раза 1100 в 10 мМ Трис, рН 7,6. Осадки гидроксилапатита суспензируют ви определяют радиоактивность, используя бетасцинциграфию. Определяют среднее значение из трех полученных точек (подсчет в минуту). Специфическое связывание рассчитывают путем вычитания неспецифического подсчета (определенного как подсчет остатка после разделения реакционной смеси, содержащей рекомбинантный рецептор радиолиганд и избыток немеченого лиганда) из подсчета общего связывания (определенного как подсчет остатка после разделения реакционной смеси, содержащей только рекомбинантный рецептор, радиолиганд). Активность соединения оценивают, определяя значение С 50 (концентрация соединения, необходимая для ингибирования 50 от общего специфического связывания, насыщенного тритием эстрадиола). Определяют специфическое связывание в присутствии различных концентраций соединения и рассчитывают как процент специфического связывания от общего специфического связывания радиолиганда. Данные представляют графически как процент ингибирования соединением (линейная шкала) в зависимости от концентрации соединения ( шкала). Влияние на общие уровни холестерина. Влияние соединений настоящего изобретения на плазменные уровни общего холестерина определяют следующим образом. Образцы крови отбирают путем сердечной пункции у анестезированных самок крыс 4-6 месячного возраста, которым билатерально произведена овариэктомия, и обработанных соединением(например, 10-1000 мг/кг/день), подкожно или перорально в течение 28 дней или растворителем в течение того же времени), или которым произведена симулированная операция. Кровь помещают в пробирки, содержащие 30 мкл ЭДТА (10 мкл ЭДТА/1 мл крови). После центрифугирования при 2500 об/мин в течение 10 минут при 20 плазму собирают и сохраняют стандартный образец при 20 . Общий холестерин анализируют, используя стандартный набор ферментативного определения из(методика 352). Воздействие на ожирение.- самкам крыс в возрасте 10 месяцев, весящим приблизительно 450 г, производят симулированную операцию (симуляцию) или овариэктомиюи обрабатывают перорально растворителем, 17 этинилэстрадиолом при 30 мг/кг/день или соединением формулыпри 10-1000 мг/кг/день в течение 8 дней. В каждой подгруппе используют 6-7 крыс. В последний день изучения определяют состав тела всех крыс, используя рентгеновский абсорбциометр двойной мощности (- 1000/) с программным обеспечением сканирования для всего тела, который показывает соотношение жировой массы тела и обезжиренной массы тела. Снижение жировой массы тела показывает, что эстроген агонисты формулыполезны для предупреждения и лечения ожирения. Специалисту в области фармакологии ясно, что физиологически активные соединения, обладающие доступными гидроксильными группами, вводятся в форме фармацевтически приемлемых сложных эфиров. Литература, описывающая подобные соединения, такие как эстрадиол, дает большое число примеров таких эфиров. Соединения данного изобретения не являются исключением в этом отношении, и могут быть эффективно введены в виде сложных эфиров, образованных по гидрокси группам, именно так, как может предполагать каждый специалист в фармацевтической химии. Хотя механизм пока еще не исследован, предполагается, что эфиры метаболически расщепляются в теле, и что фактическим лекарственным средством,вводимым в такой форме, является само гидрокси соединение. Как известно в фармацевтической химии,возможно регулирование скорости выделения или длительности воздействия соединения путем соответствующего выбора эфирных групп. Определенные сложноэфирные группы являются предпочтительными в качестве составных частей соединений данного изобретения. Соединения формулымогут содержать сложноэфирные группы в различных частях, как определено выше, и эти группы обозначены как -9. 9 представляет 1-14 алкил,1-С 3 хлоралкил, 1-С 3 фторалкил, 5-7 циклоалкил, 1-4 алкокси, фенил, или фенил моно-, или дизамещенный 1-4 алкилом, 1-4 алкокси, гидрокси, нитро, хлором, фтором или три (хлор или фтор) метилом. Фармацевтически приемлемые соли кислотного присоединения соединений данного изобретения могут быть образованы как самими соединениями, так и любыми их сложными эфирами, и включают фармацевти 12 3544 1 чески приемлемые соли, которые часто используются в фармацевтической химии. Например, соли могут быть образованы с неорганическими или органическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, сульфокислотами, включающими такие соединения как нафталинсульфо-, метансульфо- и толуолсульфокислоты, серной кислотой, азотной кислотой,фосфорной кислотой, винной кислотой, пиросерной кислотой, метафосфорной кислотой, янтарной кислотой,муравьиной кислотой, талевой кислотой, молочной кислотой и тому подобными, наиболее предпочтительно с хлористоводородной кислотой, лимонной кислотой, бензойной кислотой, малеиновой кислотой, уксусной кислотой и пропионовой кислотой. Обычно желательно вводить соединение данного изобретения в форме соли кислотного присоединения, как это принято для введения фармацевтических препаратов, имеющих основную группу, такую как пирролидиновое кольцо. Соединения данного изобретения, как обсуждалось выше, очень часто вводятся в форме солей кислотного присоединения. Эти соли удобно получать, как известно из органической химии, реакцией соединения данного изобретения с подходящей кислотой, такой как описано выше. Соли быстро образуются с высоким выходом при умеренных температурах, и часто их получают простым отделением соединения от соответствующей кислоты промывкой в качестве конечной стадии синтеза. Солеобразующую кислоту растворяют в подходящем органическом растворителе, или водном органическом растворителе, таком как алканол, кетон или сложный эфир. С другой стороны, если соединение данного изобретения желательно получить в форме свободного основания, его отделяют от основания конечной стадией промывки, в соответствии с общепринятой практикой. Предпочтительный способ получения хлористоводородных солей состоит в растворении свободного основания в подходящем растворителе и тщательном высушивании раствора, например, над молекулярными ситами перед барботированием через него газообразного хлористого водорода. Доза соединения данного изобретения, требующаяся для введения человеку, изменяется в довольно широких пределах и определяется лечащим врачом. Следует отметить, что может быть необходимо подбирать дозу соединения, при введении его в форме соли, такой как лаурат, в которой солеобразующая составляющая имеет значительный молекулярный вес. Обычный интервал эффективных доз введения соединений составляет примерно от 0,5 мг/день до 50 мг/день. Предпочтительный интервал доз составляет приблизительно от 0,25 мг/день до 25 мг/день. Конечно, часто практикуется введение суточной нормы соединения порциями в различное время дня. Однако в любом приведенном случае количество вводимого соединения будет зависеть от таких факторов, как растворимость активного компонента, используемый состав и способ введения. Способ введения соединений данного изобретения не имеет решающего значения. Известно, что соединения абсорбируются из пищеварительного тракта, и поэтому обычно желательно вводить соединение перорально из соображений удобства. Однако соединения могут быть в равной степени эффективно введены подкожно, или в виде суппозиториев путем абсорбции через прямую кишку, если это желательно в данной ситуации. Соединения настоящего изобретения обычно вводятся в виде фармацевтических композиций, что является еще одним воплощением изобретения. Могут быть использованы все обычные типы композиций, включая таблетки, жевательные таблетки, капсулы, растворы, парентеральные растворы, лепешки, суппозитории и суспензии. Составы готовят так, чтобы они содержали суточную дозу, или нужную часть суточной дозы, в стандартной дозе, которая может представлять отдельную таблетку или капсулу, или подходящий объем жидкости. Любые соединения могут быть легко составлены в виде таблеток, капсул и тому подобного желательно готовить растворы водорастворимых солей, таких как хлористоводородная соль. Обычно все составы готовят по общепринятым в фармацевтической химии методам. Капсулы получают смешением соединения с подходящим растворителем и заполнением капсул соответствующим количеством смеси. Обычные разбавители включают инертные порошкообразные вещества, такие как крахмал различных видов, порошкообразную целлюлозу, особенно кристаллическую или микрокристаллическую целлюлозу, сахара, такие как фруктоза, маннитол и сахароза, муку различных видов и тому подобные пригодные в пищу порошки. Таблетки получают путем непосредственного прессования, путем влажного или сухого гранулирования. Их составы обычно включают растворители, связывающие, смазывающие вещества и разрыхлители наряду с самими соединениями. Типичные разбавители включают, например, различные типы крахмала, лактозу,маннитол, каолин, фосфат или сульфат кальция, неорганические соли, такие как хлористый натрий и порошкообразный сахар. Полезны также порошкообразные производные целлюлозы. Типичные связывающие вещества, входящие в таблетку, включают, например, такие как крахмал, желатин и сахара, такие как лактоза,фруктоза, глюкоза и тому подобные. Используются также подходящие натуральные и синтетические смолы,включающие сок акации, альтинаты, метилцеллюлозу, поливинилпирролидин и тому подобные. Полиэтиленгликоль, этилцеллюлоза и парафины могут также служить связывающими веществами. 3544 1 Смазывающие вещества необходимы в составе таблеток для препятствия слипания таблеток. Смазывающее средство выбирают из таких скользких твердых веществ, как тальк, стеарат магния или кальция, стеариновая кислота и гидрированные растительные масла. Разрыхлителями для таблеток служат вещества, которые разбухают при смачивании, разрушая таблетку и высвобождая соединение. Они включают крахмалы, глины, целлюлозу, альгины и смолы. Более предпочтительно, кукурузный и картофельный крахмалы, метилцеллюлоза, агар, бентонит, древесная целлюлоза, порошкообразная природная губка, катион-обменные смолы, альгиновая кислота, кизельгуровая смола, цитрусовая мякоть и карбоксиметилцеллюлоза, например, могут быть использованы наравне с лаурил сульфатом натрия. Таблетки часто покрывают сахаром в качестве вкусовой добавки и изолирующего слоя, или пленкообразующими защитными веществами для модификации способности таблетки к растворению. Соединения могут также быть составлены в виде жевательных таблеток, путем использования в их составе разнообразных приятных на вкус веществ, таких как манитол, что в настоящее время хорошо технически отработано. Когда желательно вводить соединение в виде суппозитория, могут быть использованы стандартные основы. Масло какао является традиционной основой суппозитория, которая может быть модифицирована добавкой парафинов, чтобы слегка повысить температуру плавления. Широко используются смешиваемые с водой основы суппозиториев, в частности, включающие полиэтиленгликоли различных молекулярных весов. Действие соединений может быть замедлено или отсрочено применением соответствующего состава. Например, может быть получен и включен в таблетки или в капсулы слабо растворимый шарик соединения. Методика может быть улучшена изготовлением гранул с несколькими различными скоростями растворения и заполнением капсул смесью шариков. Таблетки или капсулы могут быть покрыты пленкой, которая может препятствовать растворению в течение заданного времени. Даже парентеральные препараты могут быть изготовлены длительно действующими путем растворения или суспензирования соединения в масле или эмульгидирующих растворителях, которые позволяют ему диспергировать, только медленно, в сыворотку. Следующие примеры служат для иллюстрации, но не ограничения, изобретения, которое определено формулой изобретения. Пример 1. Цис-6-фенил-5-4-(2-пирролидин-1-илэтокси)фенил-5,6,7,8-тетрагидронафталин-2-ол. Стадия А. Цис-1-2-4-(6-метокси-2-фенил-1,2,3,4-тетрагидронафталин-1-ил)феноксиэтилпирролидин. Раствор 1-2-4-(6-метокси-2-фенил-3,4-дигидронафталин-1-ил)феноксиэтилпирролидин гидрохлорида (нафоксиден гидрохлорид) (1,0 г, 2, 16 ммоль) в 20 мл абсолютного этанола, содержащего 1,0 г гидроокси палладия на углероде, гидрируют при 50 фунт/кв. дюйм (10,5 кг/см 2) при 20 в течение 19 ч. Фильтрация и упаривание дают 863 мг(93 ) цис-1-2-4-(6-метокси-2-фенил-1,2,3,4-тетрагидронафталин-1 ил)феноксиэтил-пирролидина 1 Н-ЯМР(СС 3)3,50-3,80 (, 3), 3,85 (, 3), 4,20-4,40 (, 3), 6,80-7,00 (, 3)428 (1). Стадия . К раствору 400 мг (0.94 ммоль) продукта стадиив 25 мл метиленхлорида при 0 добавляют, по каплям при перемешивании, 4,7 мл (4,7 ммоль) 1,0 М раствора трибромида бора в метиленхлориде. После 3 ч при комнатной температуре реакционную смесь выливают в 100 мл быстро перемешиваемого насыщенного водного раствора бикарбоната натрия. Органический слой отделяют, сушат над сульфонатом натрия, фильтруют и концентрируют, получая 287 мг (74 ) указанного в заглавии вещества в виде свободного основания. ПМР (СС 3) 3,35 (, 1 Н), 4,00 (, 2 Н), 4,21 (, 1 Н), 6,35 (, 4). Соответствующую хлористоводородную соль получают обработкой раствора основания избытком 4 вв диоксане, с последующим упариванием досуха и растиранием с диэтиловым эфиром (4151). Ниже описан альтернативный способ, используемый для получения соединения примера 1. Стадия А. 1-2-4-(6-метокси-3,4-дигидронафталин-1-ил)феноксиэтилпирролидин. Смесь безводного 3 (138 г, 560 ммоль) и ТГФ (500 мл) энергично перемешивают в течение 2 ч в сосуде для разделения жидкостей, раствор 1-2-(4-бромфенокси)этилпирролидина (100 г, 370 ммоль) в ТГФ(1000 мл) охлаждают до -78 и медленно добавляют в течение 20 мин и-бутиллитий (-) (2,6 М в гексане, 169 мл, 440 ммоль). Через 15 мин раствор добавляют к суспензии СеС 3, охлажденной до -78 через стеклянную трубку и реакционную смесь перемешивают 2 ч при -78 С. Через трубку к арилцериевому реагенту при -78 добавляют раствор 6-метокси-1-тетралона (65,2 г, 370 ммоль) в ТГФ (1000 мл). Реакционной смеси дают медленно нагреться до комнатной температуры и перемешивают в общей сложности 16 ч. Смесь концентрируют в вакууме и добавляют 3 НС (500 мл) и 2 (500 мл). После перемешивания в течение 15 мин слои разделяют. Водный слой дополнительно промывают 2 (2 раза). Объединенные органические слои сушат (4), фильтруют и концентрируют, получая 6-метокси-1-тетралон (22 г). Водный слой подщелачивают до 12 с помощью 5 и 15 водный (4)23 (1000 мл). Водную смесь экс 14 3544 1 трагируют 22 (2 раза). Органический раствор сушат (4), фильтруют и концентрируют, получая коричневое масло. Примеси отгоняют (110-1400,2 ), получая продукт (74 г, 57 ),ПМР (250 , 3) 7,27 (, 8,7 , 2), 6,92-6,99 (, 3), 6,78 (, 2,6 , 1), 6,65 (, 8,6,2,6 , 1), 5,92 (, 4,7 , 1), 4,15 (, 6,0 , 2), 3,80 (, 3), 2,94 (, 6,0 , 2), 2,81 (, 7,6 ,2), 2,66 (, 2), 2,37 (, 2), 1,84 (, 4). Стадия . 1-2-4-(2-бром-6-метокси-,3,4-дигидронафталин-1-ил)феноксиэтилпирролидин. Пербромид пиридиний бромид (21,22 г, 60,55 ммоль) добавляют порциями к раствору 1-2-4-(6 метокси-3,4-дигидронафталин-1-ил)феноксиэтилпирролидина (23 г, 72 ммоль) в ТГФ (700 мл). Реакционную смесь перемешивают 60 ч. Осадок фильтруют через слой целита с добавлением ТГФ. Не совсем белый твердый продукт растворяют в 22 и Ме удаляют фильтрованием с целита. Органический раствор сушат (4), фильтруют и концентрируют, получая коричневый твердый продукт (21,5 г, 83 ). ПМР (250 , 3) 7,14 (, 8,7 , 2), 6,97 (, 8.8 , 2), 6.71 (, 2.2 , 1), 6.55 (, 2),4.17 (, 6.0 , 2), 3.77 (, 3), 2.96 (, 4), 2.66 (, 4), 1,85 (, 4). Стадия С. 1-2-4-(6-метокси-2-фенил-3,4-дигидронафталин-1-ил)феноксиэтилпирролидин гидрохлорид (нафоксиден гидрохлорид). К смеси 1-2-4-(2-бром-6-метокси-3,4-дигидронафталин-1-ил)феноксиэтилпирролидина (19 г,44 ммоль), фенилборной кислоты (7,0 г, 57 ммоль), и тетракис (трифенилфосфоний) палладия (1,75 г,1,51 ммоль) в ТГФ (300 мл) добавляют а 2 О 3 (13 г, 123 ммоль) в Н 2 (100 мл). Реакционную смесь нагревают при температуре кипения с обратным холодильником 18 ч. Слои разделяют и органический слой промывают Н 2 и впоследствии раствором соли. Органический раствор сушат (4), фильтруют и концентрируют, получая 17,96 г коричневого твердого продукта. Остаток растворяют в смеси 11 22 и(250 мл) и добавляют 1 в 2 (100 мл). После перемешивания в течение 2 ч, продукт оставляют кристаллизоваться из раствора и путем фильтрации собирают 11 г вещества. Концентрирование маточного раствора до половины его объема дает дополнительно 7,3 г продукта. Стадия . Цис-1-2-4-(6-метокси-2-фенил-1,2,3,4-тетрагидронафталин-1-ил)феноксиэтилпирролидин. 1-2-4-(6-метокси-2-фенил-3,4-тетрагидронафталин-1-ил)фенокси-этил пирролидин гидрохлорид (нафоксиден гидрохлорид) (75 г, 162 ммоль), растворяют в 1000 мли 300 мл МеОН. Добавляют сухой(ОН) на углероде и смесь гидрируют на вибраторе Парра при 50 и 50 фунт/кв. дюйм (10,5 кг/см 2) в течение 68 ч. Катализатор отфильтровывают с помощью целита и растворители удаляют в вакууме. Образовавшийся твердый белый продукт растворяют в СН 2 С 2 и раствор промывают насыщенным 3 (водн.). Органический раствор сушат (4), фильтруют и концентрируют, получая не совсем белый твердый продукт (62,6 г, 90 ). Стадия . Цис-6-фенил-5-4-(2-пирролидин-1-илэтокси)фенил-5,6,7,8-тетрагидронафталин-2-ол. Смесь цис-1-2-4-(6-метокси-2-фенил-1,2,3,4-тетрагидронафталин-1-ил)феноксиэтил пирролидина(12 г, 28 ммоль), уксусной кислоты (75 мл), и 4875 мл) нагревают при 10015 часов раствор охлаждают и образовавшийся белый осадок собирают фильтрацией. Гидробромидную соль (9,6 г, 69 ) растворяют в 3/ и перемешивают с насыщен. 3 (водн.). Слои разделяют и водный слой экстрагируют в дальнейшем СНС 3/МеОН. Объединенные органические слои сушат (4), фильтруют и концентрируют, получая продукт в виде не совсем белой пены. ПМР (250 , СС 3) 7,04 (, 3), 6,74 (, 2), 6,63 (, 8,3 , 2), 6,50 (, 3), 6,28 (, 8,6 ,2), 4,14 (, 4,9 , 1), 3,94 (, 5,3 , 2), 3,24 (, 12,5, 4,1 , 1), 2,95 (, 4), 2,78 (, 4), 1,88(500 мг, 1,17 ммоль) в 10 мл диметилсульфоксида при 10 медленно добавляют 4,7 мл (11,7 ммоль) 2,5 М н-бутиллития в гексане. Реакционной смеси дают нагреться до 20 и перемешивают 19 ч. После добавления воды и экстракции диэтиловым эфиром, органические слои объединяют, сушат над сульфатом магния,фильтруют и концентрируют досуха, получая 363 мг (73 ) транс-6-метоксидигидронафталина. ПМР (3)3,45 (, 2), 3,82 (, 3 Н), 4,06 (, 1), 4,45 (, 2), 6,80 (, 2). Стадия . Используя бор трибромидный способ снятия защиты, описанный в примере 1 стадии , 363 мг(0,85 ммоль) продукта стадиипревращают в 240 мг (68 ) указанного в заглавии соединения. ПМР (3)4,02 (, 1), 4,45 (, 2), 7,00 (, 2). Соответствующую хлористоводородную соль получают как описано в стадиипримера 1 ( 414 1). 15 3544 1 Пример 3. 1-(4-пирролидиноэтоксифенил)-2-(4-гидроксифенил)-6-гидрокси-1,2,3,4-тетрагидроизохинолин гидрохлорид. Стадия . 3-метоксифенилацет-4-метоксианилид. Раствор 20,0 г (0,120 ммоль) 3-метоксифенилуксусной кислоты и 40 мл (65,3 г, 0,549 моль) тионилхлорида в 100 мл бензола нагревают при температуре кипения с обратным холодильником в течение 2 ч и упаривают досуха, что дает соответствующий хлорангидрид (предположительно 0,120 моль). Хлорангидрид перемешивают в 50 мл диэтилового эфира и добавляют к смеси 4-метоксианилина в 100 мл диэтилового эфира при 0 С. После перемешивания при 20 в течение ночи, суспензию фильтруют, получая твердый продукт,который промывают водой, 5,5 водн. НС, водой и диэтиловым эфиром. Последующее высушивание над 25 в вакууме в течение 4 ч дает 19,7 г (60 ) указанного в заглавии вещества в виде белого твердого продукта. ПМР (3)3,70 (, 2 Н), 3,77 (, 3), 3,81 (, 3 Н). Стадия .-(4-метоксифенил)-2-(3-метокси фенетиламин)гидрохлорид. Суспензию 19,6 г (0,072 моль) продукта стадиии 6,04 г (0,159 моль) алюмогидрида лития в 130 мл диэтилового эфира и 75 мл диоксана нагревают при 35 в течение 48 ч. Добавляют избыток декагидрата сульфита натрия и смесь фильтруют и промывают 5 водн. НС. Органический слой сушат над безводным сульфатом магния и концентрируют, получая 10,84 г указанного вещества в виде НС - соли (51 ). ПМР (3)3,15 (, 2 Н), 3,42 (, 2 Н), 3,71 (, 3 Н), 3,74 (, 3 Н). Стадия .-2-(3-метоксифенил)-4-бензилоксибен-4 метоксианилид К суспензии 4,83 г (0,164 моль) продукта стадиии 2,12 г (0,0164 моль) диизопропилэтиламина в 50 мл диэтилового эфира добавляли 0,013 моль 4-бензилоксибензоил хлорида (полученного из 3,00 г (0,013 моль) соответствующей бензойной кислоты и 7,13 г (0,059 моль) тионилхлорида в 35 мл бензола) в 50 мл диэтилового эфира при 20 и реакционную смесь перемешивают в течение ночи. После декантации с осадка,эфирный раствор промывают 5 водн. , водой, раствором соли, сушат над сульфатом магния, фильтруют и упаривают досуха, получая 5,58 г указанного в заглавии вещества (73 ). ПМР (3)3,00 (, 2), 3,75 (, 9 Н), 4,05 (, 2). Стадия . 1-(4-бензилоксифенил)-2-(4-метоксифенил)-6-метокси-3,4-дигидроизохинолиний хлорид. Раствор 1,04 г (2,22 моль) продукта стадиив 5 мл оксихлорида фосфора нагревают при 100 в течение 2,5 ч. Реакционную смесь упаривают досуха и распределяют в смеси этилацетат/вода. Этилацетатный слой сушат над безводным сульфатом магния и концентрируют, получая 1,03 г указанного в заглавии соединения в виде масла (96 ). ПМР (С 3)3,46 (, 2), 3,80 (, 3), 4,00 (, 3), 4,55 (, 2). Стадия . 1-(4-бензилоксифенил)-2-(4-метоксифенил)-6-метокси-1,2,3,4-дигидроизохинолин. К продукту стадии (1,00 г, 2,07 ммоль) в 10 мл метанола добавляют 200 мг (5,28 ммоль) боргидрида натрия. После перемешивания в течение 19 ч при 25 осадок собирают и сушат в вакууме, получая 611 мг(66 ) указанного в заглавии соединения в виде пены. ПМР (3)2,95 (, 2), 3,50 (, 2), 3,71 (, 3), 3,78 (, 3), 5,09 (, 1). Стадия . 1-(4-гидроксифенил)-2-(4-метоксифенил)-6-метокси-1,2,3,4-тетрагидроизохинолин гидрохлорид. Раствор 611 мг (1,35 ммоль) продукта стадиив 6 мл конц. водн.и 6 мг диоксана нагревают при 90 С в течение 5 ч. Диоксан удаляют в вакууме и водный слой разбавляют водой. Указанное в заглавии соединение выделяют (155 мг, 29 ) в виде выпавшей в осадок хлористоводородной соли. ПМР (3)3,72 (, 3), 3,76 (, 3), 5,94 (, 1). Стадия . 1-(4-пирролидиноэтоксифенил)-2-(4-метоксифенил)-6-метокси-1,2,3,4-тетрагидроизохинолин. К суспензии 152 мг (0,382 ммоль) продукта стадиив 5 мл диоксана и 1 мл ДМФ добавляют 152,8 мг(3,82 ммоль) 60 дисперсии гидрида натрия в растительном масле. После перемешивания при 45 в течение 0,5 ч, 65 мг (0,382 ммоль) 2-хлорэтилпирролидин гидрохлорида медленно добавляют порциями и перемешивают 3 ч при 45 С. После добавления воды, реакционную смесь экстрагируют этилацетатом. Этилацетатный слой сушат над безводным сульфатом магния и концентрируют, получая 203 мг сырого продукта,который хроматографируют на силикагеле смесью хлороформ/метанол (991), получая 78 мг (45 ) указанного в заглавии вещества. ПМР (3)2,85 (, 2), 3,72 (, 3), 3,79 (, 3), 4,00 (, 2 Н), 5,50 (, 1). Стадия . 16 3544 1 1-(4-пирролидиноэтоксифенил)-2-(4-гидроксифенил)-6-гидрокси-1,2,3,4-тетрагидроизохинолин гидрохлорид. К раствору 75 мг (0,164 ммоль) продукта стадиив 5 мл метиленхлорида при 0 добавляют по каплям 0,82 мл (0,82 ммоль) 1,0 М трибромида бора в метиленхлориде. После перемешивания при 0 в течение 0,5 ч, реакцию проводят при 20 в течение 2 ч. Реакционную смесь выливают в охлажденный льдом насыщенный раствор бикарбоната натрия. Супернатант отфильтровывают от смолы, которую растворяют в метаноле, сушат над сульфатом магния, фильтруют и упаривают досуха, получая 53 мг (75 ) указанного в заглавии соединения в виде пены. ПМР (3)4,02 (, 2 Н), 5,50 (, 1), 6,50-7,00 (, 11 Н). Хлористоводородную соль получают аналогичным способом в виде белого твердого продукта 431(1). Пример 4. 1-(6-пирролидиноэтокси-3-пиридил)-2-(4-гидроксифенил)-6-гидрокси-1,2,3,4-тетрагидроизохинолин гидрохлорид. Стадия . 1-(6-хлор-3-пиридил)-2-(4-метоксифенил)-6-метокси-1,2,3,4-тетрагидроизохинолин. Используя методику, описанную для примера 3 стадии , заменяя 4-бензилоксибензоил хлорид на 6 хлорникотиноил, получено соединение, указанное в заглавии. Стадия В. 1-(6-пирролидинэтокси-3-пиридил)-2-(4-метоксифенил)-6-метокси-1,2,3,4-тетрагидроизохинолин. Продукт стадии А (500 мг, 1,31 ммоль) суспензируют в 10 мл толуола и обрабатывают 364 мг(5,52 ммоль) гидрокси калия, 346 мг (1,31 ммоль) 18-краун-6, и 318 мг (2,76 ммоль) 1-(2 гидроксиэтил)пирролидина. После нагревания при 80 в течение 18 ч, реакционную смесь охлаждают, разбавляют водой и экстрагируют этилацетатом. Объединенные органические экстракты промывают раствором соли, сушат над сульфатом магния, фильтруют и концентрируют досуха, получая 575 мг пены. Хроматография на силикагеле с использованием 97,5 смеси хлороформ/метанол (91) и 2,5 конц. 4 дает 127 мг (21 ) указанного в заглавии соединения. ПМР (СС 3)2,50 (, 4 Н), 2,90 (, 4), 3,42 (, 2 Н), 3,72 (, 3), 3,79 (, 3 Н), 4,39 (, 2 Н), 5,05 (,1). Стадия С. С продукта стадииснимают защиту по методике, описанной в примере 1 и, превращают в хлористоводородную соль обычным способом, получая указанное в заглавии соединение. ПМР (СС 3)2,55 (, 2 Н), 5,45 (, 1),(1) 432. Пример 5. 1-(4-азабициклогептаноэтоксифенил)-2-(4-гидроксифенил)-6-гидрокси-1,2,3,4-тетрагидроизохинолин гидрохлорид. Используя методику примера 3, заменяя на стадии 4-бензилокси бензойную кислоту на 4-(2 азабицикло 2.2.1.-гептаэтокси) бензойную кислоту, и последующим применением стадий ,и , получают указанное в заглавии соединение в виде белого твердого продукта. ПМР (3)2,95 (, 3 Н), 3,90 (, 1), 4,15 (, 3 Н), 5,42 (, 1)457(1). Пример 6.(100 мл) нагревают при 70 в течение 1 ч. Раствор охлаждают до комнатной температуры и добавляют воду и . Органический слой промывают водой и раствором соли. Раствор сушат (4), фильтруют и концентрируют в вакууме. Молекулярная перегонка (1530,1 мм ) дает указанное в заглавии соединение в виде бесцветного масла, кристаллизирующегося при охлаждении (14,9 г, 87 ). ПМР (250 , 3)8,15 (, 2,4 , 1), 7,65 (, 2,4, 8,4 , 1), 6,67 (, 8,4 , 1), 4,38(, 5,8 , 2), 2,84 (, 5,8 , 2), 2,62 (, 4), 1,82 (, 4). Стадия . 6-метокси-1-6-(2-пирролидин-1-илэтокси)пиридин-3-ил-1,2,3,4-тетрагидронафталин-1-ол. К раствору 5-бром-2-(2-пирролидин-1-илэтокси)пиридин (7,0 г, 26 ммоль) в сухом ТГФ (50 мл) при 78 добавляют по каплям - (2,5 в гексане, 12,4 мл, 31,0 ммоль). Через 30 мин добавляют 6 метокси-1-тетралон (4,55 г, 25,8 ммоль) в сухом ТГФ. После перемешивания в течение 15 мин при -78 ,реакционной смеси дают нагреться до комнатной температуры. Через 30 мин реакционную смесь выливают в водн. 3 (насыщ.). Водный слой экстрагируют (2). Объединенные органические растворы 17 3544 1 сушат (04), фильтруют и концентрируют. Флэш хроматография (3 Ме, 955) дает целевое соединение (4,23 г, 44 ) в виде белого твердого вещества. ПМР (250 , СС 3)8,07 (, 2,5 , 1), 7,49 (, 2,5, 8,7 , 1), 7,00 (, 8,5 , 1), 6,73(, 3), 1,82 (, 5). Стадия . 5-(2-бром-6-метокси-3,4-дигидронафталин-1-ил)-2-(2-пирролидин-1-илэтокси)пиридин. Пиридиний бромид пербромид (3,5 г 12,2 ммоль) добавляют к раствору 6-метокси-1-6-(2-пирролидин-1 илэтокси)пиридин-3-ил-1,2,3,4-тетрагидронафталин-1-ола (3,3 г, 8,9 ммоль) в 22 (50 мл). Реакционную смесь перемешивают 18 ч и добавляют водный 3 (насыщ.). Водный слой экстрагируют 22 и объединенный органический раствор промывают водой и раствором соли. Органический раствор сушат(4), фильтруют и концентрируют. Флэш хроматография (3 Ме, 955) дает заданный винил бромид (2,65 г, 70 ). ПМР (250 , 3)8,0 (, 2,4 , 1), 7,41 (, 2,4, 8,4 , 1), 6,83 (, 8,4 , 1), 6,69 (,1), 6,55 (, 2), 4,92 (, 5,8 , 2), 3,76 (, 3), 2,94 (, 6), 2,64 (, 4), 1,82 (, 4). Стадия . 5-(6-метокси-2-фенил-3,4-дигидронафталин-1-ил)-2-(2-пирролидин-1-илэтокси)пиридин. Фениллитий (1,8 М в смеси циклогексан/диэтиловый эфир, 3,8 мл. 7,0 ммоль) медленно добавляют к хлористому цинку (0,5 М в ТГФ, 14 мл, 7,0 ммоль) при 0 . После перемешивания в течение 15 мин добавляют 5-(2-бром-6-метокси-3,4-дигидронафталин-1-ил)-2-(2-пирролидин-1-илэтокси) пиридин (1,0 г, 2,3 ммоль) в сухом ТГФ (20 мл) и впоследствии (3)4 (200 мг, 0,173 ммоль). Реакционную смесь нагревают до комнатной температуры и затем кипятят с обратным холодильником 4 ч. Реакционную смесь выливают в водный раствор 4 (насыщ.). Водный слой промывают СНС 3 (2 х) и объединенные органические растворы промывают водой и затем раствором соли. Органический раствор сушат (4), фильтруют и концентрируют в вакууме. Флэш хроматография (СНС 3 Ме, 955) дает указанное в заглавии соединение. ПМР (250 , 3)7,78 (, 2,1 , 1), 7,27 (, 1), 7,07 (, 5), 6,68 (, 4), 4,40 (, 5,8 ,2), 3,80 (, 3), 2,88 (, 6), 2,71 (, 4), 1,81 (, 4). Стадия . Цис-5-(6-метокси-2-фенил-1,2,3,4-тетрагидронафталин-1-ил)-(2-пирролидин-1-илэтокси)пиридин.(50 мл). Смесь гидрируют в вибраторе Парра при 50 фунт/кв. дюйм (10,5 кг/см 2) и при 50 в течение 16 ч. Катализатор отфильтровывают с помощью целита и уксусную кислоту удаляют в вакууме. ПМР показал, что реакция не завершена и остаток вновь выдерживали в реакционных условиях (50 фунт/кв. дюйм(10,5 кг/см 2) и при 60 ) дополнительно 6 ч. Катализатор удаляют фильтрацией через целит и растворитель отгоняют в вакууме. Заданный продукт (207 мг, 72 ) получают радиальной хроматографией (градиент растворителя от 22 до 10 Ме в 22). ПМР (250 , СС 3)7,19 (, 4 Н), 6,84 (, 3), 6,75 (, 2,4 , 1), 6,68 (, 2,4, 8,4 , 1),6,59 (, 2,4, 8,4 , 1), 6,40 (, 8,4 , 1), 4,35 (, 5,7 , 2), 4,21 (, 4,8 , 1), 3,82 (, 3),3,38 (, 1), 3,06 (, 2), 2,90 (, 5,7 , 2), 2,69 (, 4 Н), 2,11 (, 2), 1,84 (, 4 Н). Стадия . Цис-6-фенил-5-6-(2-пирролидин-1-илэтокси)пиридин-3-ил-5,6,7,8-тетрагидронафталин-2-ол. К раствору цис-5-(6-метокси-2-фенил-1,2,3,4-тетрагидронафталин-1-ил)-2-(2-пирролидин-1 илэтокси)пиридина (69,6 мг, 0,162 ммоль) в сухом СН 2 С 2 (3 мл) при 0 добавляют АС 3 (110 мг,0,825 ммоль) и впоследствии избыток(400 мкл). Через 0,5 ч реакционную смесь нагревают до комнатной температуры и добавляют дополнительно АС 3 (130 мг). Спустя 0,5 ч, осторожно добавляют водный 3 (насыщ.) и водный слой экстрагируют 22/Ме (3 х). Объединенные органические слои сушат(4), фильтруют и концентрируют. Радиальная хроматография (градиент растворителя, от 22 до 15 Ме в СН 2 С 2) дает соединение со снятой защитой (64,6 мг, 96 ) в виде не совсем белого твердого вещества. ПМР (250 , 3)7,18 (, 3), 6,95 (, 2,4 , 1), 6,82 (, 2), 6,70 (, 2,4 , 1), 6,67 (,8,4 , 1), 6,62 (, 2,4, 8,5 , 1), 6,52 (, 2,4, 8,4 , 1), 5,80 (, 8,5 , 1), 4,45 (, 2),4,18 (, 4,8 , 1), 3,40 (, 1), 3,04 (, 3), 2,75 (, 6), 2,11 (, 1), 1,88 (, 4 Н). Два энантиомера разделяют хроматографически на 5 см внутр. х 5 смколонке, используя 5 этанол/95 гептан с 0,05 диэтиламина. Энантиомер 1 17,96 мин, 242(с 1, Ме) Энантиомер 2 25,21 мин, 295 (с 1, Ме) Пример 7. Цис-6-(4-фтор-фенил)-5-4-(2-пиперидин-1-илэтокси)-фенил-5,6,7,8-тетрагидронафталин-2-ол. 18 3544 1 Стадия . К 1 г 1-4-пиперидино этокси фенил-2-4 фтор фенил-6-метокси-3,4-дигидронафталина (который может быть получен как в примере 1, но замененный фенилборной кислотой в стадии С на 4-фторфенилборную кислоту) в 35 мл уксусной кислоты добавляют гидроокись палладия на углероде (20 , 1) (высушен пламенем в вакууме). Смесь гидрируют на вибраторе Парра при 50 и 50 фунт/кв. дюйм (10,5 кг/см 2) в течение 4 ч. Фильтрация через целит и концентрация дает 1,2 г сырого реакционного продукта, который используют в следующей стадии без дополнительной очистки. ПМР (250 , 3)1,91 , 3,1 , 3,25 , 3,8 (, 3), 4,2 (, 1), 4,25 , 6,35 (, 2), 6,5 (,2 Н), 6,65 , 6,75 , 6,8-6,88 ./ 460 (1). Стадия В. Раствор цис-1-4-пиперидиноэтокси фенил-2-4-фторфенил-6-метокси-1,2,3,4-тетрагидронафталин-1 илфенокси-этил)-пиперидина (540 мг, 1,17 ммоль) в безводном 22 охлаждают до 0 и впоследствии добавляют 3 5,8 мл (1 М раствор 22 ), 5,88 ммоль по каплям. Реакционной смеси дают нагреться до комнатной температуры и перемешивают еще один час. После завершения реакции, реакционную смесь вновь охлаждают до 0 и осторожно добавляют водный 3. Водный слой экстрагируют 22 (3 х). Органический слой сушат над 4, фильтруют и концентрируют. Сырой продукт подвергают круговой хроматографии (растворитель 41 диэтиловый эфир/гексан, 1 триэтиламин), получая незащищенный продукт. -соль продукта получают с Н /диэтиловый раствор с последующим растиранием со смесью(-)Цис-6-фенил-5-4-(2-пирролидин-1-ил-этокси)фенил-5,6,7,8-тетрагидронафталин-2-ол. Рацемическое соединение примера 1 (3 г) подвергают энантиомерному разделению на 5 см х 5 смколонке, используя 99,95(5/95 гептан)/0,05 диэтиламин в качестве элемента,что дает 1 г быстро вымываемогоэнантиомера и 1 г медленно вымываемого (-) энантиомера, которые проявляются на ПМР,и , как рацемат. Или же иначе, для разделения может быть применена методика кристаллизации с использованием - фосфорной кислоты. В 20 мл метанола и 20 мл метиленхлорида добавляют 7,6 г (0,0184 моль) продукта примера 1 и 6,4 г (0,0184 моль) -(-)-, 1-бинафтил-2,2-диил кислого фосфата. После завершения растворения, упаривание растворителя с последующим растиранием с диэтиловым эфиром дает 14,2 г рацемической соли. Этот твердый продукт суспензируют в 500 мл диоксана и 25 мл метанола, и полученную смесь нагревают до растворения исходного твердого продукта. При выдерживании в течение 1 часа образуется белый осадок (6,8 г), который собирают и ВДЖХ которого (использование приведенных выше условий) показывает приблизительно 73 чистоту энантиомера. Этот продукт суспензируют в 250 мл абсолютного этанола и нагревают до получения раствора, после этого раствор оставляют стоять при комнатной температуре в течение ночи. Собранные кристаллы промывают охлажденным этанолом и затем диэтиловым эфиром, получая 3,1 г 98 энантиомерно чистой соли вторичной обработкой получают также 588 мг. Распределение между 12 метанол/метилен хлорид и 1 водной гидроокисью натрия дает соответствующее основание, которое превращают в хлористоводородную соль ( в диоксане). Перекристаллизация из смеси ацетонитрил/метиленхлорид дает левовращающий предпочтительный энантиомерный гидрохлорид соответствующий примеру 1.- 330.6 (с 0,05, 22 Т.пл. 260-263 . Пример 9. Цис-6-(4-гидроксифенил)-5-4-(2-пиперидин-1-илэтокси)фенил-5,6,7,8-тетрагидронафталин-2-ол. Указанное в заглавии соединение получают, следуя методике, описанной в способе примера 1. ПМР (3)3,12 (, 1), 3,90 (, 2), 4,15 (, 1), 6,15-6,72 (, 11 Н)430. Пример 10. 1-(4-пиперидиноэтоксифенил)-2-(4-гидроксифенил)-6-гидрокси-1,2,3,4-тетрагидроизохинолин гидрохлорид. Используя методику примера 3, описанную в стадии , заменяя -2-хлорэтилпирролидин гидрохлорид на 3544 1 Указанное в заглавии соединение получают, используя методику примера 3, описанную в стадии , заменяя 4-метоксианилин на 4-фторанилин. ПМР (3)2,12 (, 2 Н) 3,65 (, 2 Н) 4,45 (, 2 Н) 6,10 (, 1) 7,5 (, 2 Н)433. Пример 12. 1-(4-пирролидиноэтоксоксифенил)-2-фенил-6-гидрокси-1,2,3,4-тетрагидроизохинолин гидрохлорид. Указанное в заглавии соединение получают, используя методику примера 3, описанную в стадии , заменяя 4-метоксианилин анилином. ПМР (3)1,70 (, 4 Н) 2,70 (, 2 Н) 4,00 (, 2 Н) 5,70 (, 1) 6,60-7,25 (, 12)415. Пример 13. Данные проведенногоанализа связывания эстроген-рецептор (по методике, описанной на с. 28). Соединение 150 (нм)примера 1 11,3 2 9,75 3 37,5 4 16,0 5 37,2 6 7,0 8 11,1 12 14,8. Пример 14. Испытание эффективности соединения, полученного по примеру 1, в отношении потери костной ткани,уровня холестерина и увеличения массы тела. Используют 60 самок крыс (-) в возрасте 5 месяцев, массой приблизительно 280 г (, , ). Крысы акклиматизировались в условиях вивария (24 , 12 ч - свет 12 ч - темнота) в течение 2 недель. Все крысы имели свободный доступ к воде и пище, содержащей 0,97 кальция, 0,85 фосфора и 1,05 /2 витамина Д 3. Десять крыс оперировали и им перорально вводили растворитель (10 этанола 90 физиологического раствора, 1 мл/день) оставшихся крыс овариектомизировали и вводили перорально растворитель 17 эстрадиол (Е 2, 30 мг/кг, ежедневно подкожной инъекцией), или соединение примера 1 (5, 10 или 20 мг/кг,ежедневно перорально) в течение 4 недель. Всем крысам подкожно вводили 10 мг/кг кальцеина (флюорисцентная метка для кости) за 12 и 2 дня до умерщвления для того, чтобы исследовать динамические изменения костной ткани. После 4-х недельной обработки крыс умерщвляли и определяли динамические изменения костной ткани,увеличение массы тела и содержание холестерина в крови. Исследования показали, что введение соединения примера 1 овариэктомизированным крысам в количестве приблизительно 10 мг/кг в день перорально предотвращает потерю костной массы, значительно снижает уровень холестерина в крови и значительно снижает массу тела по сравнению с контрольными овариектомизированными животными. Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66.
МПК / Метки
МПК: C07C 35/36, C07D 401/12, C07D 217/04, A61K 31/47, C07D 401/10
Метки: фармацевтическая, промежуточное, соединение, композиция
Код ссылки
<a href="https://by.patents.su/20-3544-soedinenie-farmacevticheskaya-kompoziciya-promezhutochnoe-soedinenie.html" rel="bookmark" title="База патентов Беларуси">Соединение, фармацевтическая композиция, промежуточное соединение</a>