Способ определения эффекторных свойств физиологически активных соединений
Номер патента: 5752
Опубликовано: 30.12.2003
Авторы: Литвинко Наталья Михайловна, Кучуро Светлана Викторовна, Филич Елена Рэмовна, Желдакова Татьяна Анатольевна
Текст
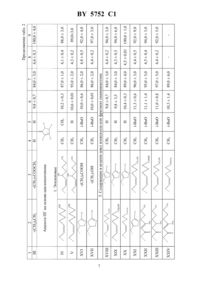
12 1/34 НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СПОСОБ ОПРЕДЕЛЕНИЯ ЭФФЕКТОРНЫХ СВОЙСТВ ФИЗИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ(71) Заявитель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(72) Авторы Литвинко Наталья Михайловна Кучуро Светлана Викторовна Желдакова Татьяна Анатольевна Филич Елена Рэмовна(73) Патентообладатель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(57) 1. Способ определения эффекторных свойств физиологически активных соединений по отношению к ферментативному гидролизу фосфолипидов путем выявления изменения активности фосфолипазы А 2, отличающийся тем, что проводят преинкубацию исследуемого соединения с ферментом с последующим взаимодействием полученной смеси с субстратосодержащим агарозным гелем при температуре не выше 50 С, вычисляют площади лизисных зон в присутствии исследуемого соединенияи без него (0) и рассчитывают степень эффекторного воздействия по формуле 100. 0 2. Способ по п. 1, отличающийся тем, что преинкубацию проводят в течение 0,5-5,0 ч.., , 1972. - . 50. - . 163-165.930489676 , 1996.94022481 1, 1996.94045174 1, 1996.92011348 , 1995.94/25623 1. Изобретение относится к фармацевтической промышленности и медицине и может быть использовано в качестве контрольного теста при получении, очистке и применении лекарственных средств. Фосфолипаза А 2 (КФ 3.1.1.4), катализирующая гидролиз сложноэфирной связи во втором положении 1,2-диацил 3-фосфоглицеридов, является важнейшим ферментом обмена липидов в организме (Брокерхоф . Дженсен Р. Липолитические ферменты. - М. Мир, 1978. - . 356). 5752 1 Известно, что фосфолипаза А 2 принимает участие в патогенезе острого панкреатита. Нежелательное увеличение активности фосфолипазы А 2 происходит в течение многих болезней человека, таких как ишемия миокарда и гипоксия, воспалительные процессы, аллергия, тромбообразование, отеки при радиационном поражении и др. Действие многих лекарственных средств прямо или опосредованно связано с ингибированием активности фосфолипазы А 2. В частности, ницерголин, циннаризин, алигерон,пирацетам, которые используются в химиотерапии гипоксии, ингибируют фосфолипазу А 2. Местные анестетики хлорпромазин, лидокаин, тетракаин и др., а также антиаритмическое средство амиодарон являются сильными ингибиторами фосфолипазы А 2 С. . Нарушение функциональной активности клеточных фосфолипаз может привести к серьезным патологическим изменениям в жизнедеятельности организма. В частности, реакции гидролиза фосфолипидов, осуществляемой фосфолипазой А 2 и приводящей к образованию свободной арахидоновой кислоты, принадлежит ключевая роль в биосинтезе биологически активных эйкозаноидов простагландинов, тромбоксанов и лейкотриенов(Литвинко Н.М., Кисель М.А. Эндогенные фосфолипазы А 2. Структура и функция. Минск Наука и техника, 1991. - . 270). Методы определения активности фосфолипазы А 2 трудоемки, требуют затраты больших количеств фермента, реактивов и времени, что создает определенные трудности при выявлении ингибиторной активности исследуемых эффекторов ( , , // . 1975. - . 114. -1. - . 129-141). Для успешного изучения ингибирования фосфолипазной реакции необходимы предварительные экспрессные тесты на потенциальные ингибиторные свойства изучаемых соединений. Наиболее близким к заявляемому является способ определения активности фосфолипазы А 2 по степени гидролиза фосфолипидов, заключающийся в диффузии нативного фермента в лецитин-агарозный гель с последующим измерением диаметра просветленной зоны ( Е., . ., 1972. - . 50. - . 163-173). Однако данный способ позволяет только фиксировать наличие активности фермента. Задачей настоящего изобретения является разработка способа скрининга эффекторной активности любого ряда химических соединений, который может быть использован в качестве контрольного теста при получении, очистке и применении лекарственных средств. Поставленная задача решается заявляемым способом определения эффекторных (ингибиторных и активаторных) свойств физиологически активных соединений по отношению к ферментативному гидролизу фосфолипидов с помощью выявления изменения активности фосфолипазы А 2. Основной особенностью фосфолипазы А 2, как и всех липолитических ферментов, является осуществление каталитической функции не в свободном объеме, как у большинства ферментов, а на поверхности раздела липид-вода. Для успешного осуществления каталитического акта необходимо соблюдение определенных условий. В частности, со стороны субстрата важны наличие поверхности раздела липид-вода, физическое состояние субстрата, его упаковка в составе поверхности и поверхностный электростатический заряд, а также надмолекулярная организация субстрата. Сложное строение активного центра фосфолипазы А 2, включающее совокупность раздельно существующих в молекуле фермента центра распознавания поверхности, двух Са-связывающих сайтов и непосредственно каталитического центра, предполагает существование большого числа эффекторов,которые могут оказывать действие на проявление ее каталитической активности. Поскольку отщепление фосфолипазой А 2 арахидоновой кислоты приводит к целому каскаду реакций с образованием в результате биологически активных соединений, среди которых особое место занимают простагландины, указанные медиаторы или их метаболиты могут оказывать воздействие на активность фосфолипазы А 2 по принципу обратной связи. В литературе имеются отдельные противоречивые факты относительно действия простагландинов на активность фосфолипазы А 2. В частности, простагландины Е 2 и 2 не ингибируют 2 5752 1 фосфолипазу А 2 из лейкоцитов, тогда как олигомер простагландина 1 ингибирует фермент из сердца крысы и нейтрофилов человека. В соответствии с изобретением описывается способ определения эффекторных (ингибиторных и активаторных) свойств физиологически активных соединений по отношению к ферментативному гидролизу фосфолипидов путем выявления изменения активности фосфолипазы А 2, заключающийся в том, что проводят преинкубацию исследуемого соединения с ферментом (в течении 0,5-5,0 ч), в частности с фосфолипазой А 2, с последующим взаимодействием полученной смеси с субстратсодержащим агарозным гелем при температуре не выше 50 С, вычисляют площади лизисных зон в присутствии исследуемого соединенияи без него (0) и рассчитывают степень эффекторного воздействия по формуле 100. 0 Вследствие липолитического действия фосфолипазы А 2 на мутную эмульсию яичного желтка (субстрат), включенного в агарозный гель, вокруг лунки, содержащей фермент,образуется прозрачная зона просветления, площадью 002 - 2, где 0 - радиус зоны просветления, а- радиус лунки. Поскольку имеется однозначная прямопропорциональная зависимость между диаметром зоны просветления и концентрацией фосфолипазы А 2,уменьшение площади зоны просветления должно указывать на уменьшение содержания свободного фермента и, если присутствие дополнительных веществ в лунке вызывает образование зоны просветления меньшей площади (2 - 2, где- радиус лунки,и- площадь и радиус зоны просветления в присутствии ингибитора, причем 0), то можно говорить об ингибирующем действии на фосфолипазу А 2 этих веществ. Тогда относительное уменьшение площади зоны просветления /0(2 - 2) / (02 - 2) может служить мерой остаточной активности фермента в присутствии ингибитора. Способ обнаруживает ряд преимуществ отличается хорошей воспроизводимостью(точность воспроизведения колеблется от 1,2 до 3 ), малым расходом фермента и других компонентов системы, позволяет одновременно проводить испытания нескольких десятков веществ (одна чашка Петри диаметром 88 мм позволяет произвести одновременно скрининг 12-18 веществ). Для поставленных целей особенно важно, что при проведении фосфолипазной реакции данным методом изменение концентрации субстрата не влияет на его состояние (организацию) в геле. В липидно-водных системах организация субстрата меняется с изменением его концентрации, а следовательно, по ходу реакции, что негативно сказывается на процессе гидролиза и создает определенные сложности при интерпретации результатов. Для лучшего понимания сущности заявляемого изобретения приводятся примеры конкретного выполнения, не ограничивающие объема изобретения. Пример 1. Для определения эффекторных свойств физиологически активных гидрофильных соединений, в частности, 9,10,11-метальных аналогов простагландинов, по отношению к активности фосфолипазы А 2 используют диффузию фермента в лецитин-агарозном геле. Мерой ингибирования служит относительное уменьшение площади зоны просветления(/0), образующейся вследствие липолитического действия фермента на эмульсию яичного желтка, включенного в агарозный гель, которое рассчитывают по формуле/0(2 - 2) / (02 - 2),где , 0 - радиусы зон просветления в присутствии потенциального ингибитора и без него,- радиус лунки. Эмульсию яичного желтка (субстрат фосфолипазы 2) готовят по методу Хабермана и Хардта. Для приготовления геля используют 0,05 М веронал-ацетатный буфер, рН 7,5. 3 5752 1 Гель содержит 0,8 агарозы, 1,6 мМ СаС 2 и 27 эмульсии яичного желтка. Высота слоя геля в чашках Петри составляет 4 мм. Фосфолипазу 2 (9 мкг в 20 мкл Н 2 О) преинкубируют в течение 3 ч с равным по объему спиртовым раствором простагландина (1 мг/мл). 10 мкл этого раствора смешивают с равным объемом воды и вносят в вырезанную в геле круглую лунку (диаметр 4 мм, объем 25 мкл). Реакцию проводят в течение 20 ч при 50 С. Измерение диаметра зоны просветления производят с помощью измерительной лупы с ценой деления 0,1 мм, причем величинаменяется в пределах от 10 до 22 мм. Пример 2. Для определения эффекторных свойств физиологически активных гидрофобных соединений, в частности, производных глицерина, по отношению к активности фосфолипазы А 2 используют диффузию фермента в лецитин-агарозном геле. Мерой ингибирования служит относительное уменьшение площади зоны просветления (/0), образующейся вследствие липолитического действия фермента на эмульсию яичного желтка, включенного в агарозный гель, которое рассчитывают по формуле/0(2 - 2) / (02 - 2),где , 0 - радиусы зон просветления в присутствии потенциального ингибитора и без него,- радиус лунки. Эмульсию яичного желтка (субстрат фосфолипазы А 2) готовят по методу Хабермана и Хардта. Для приготовления геля используют 0,05 М веронал-ацетатный буфер, рН 7,5. Гель содержит 0,068 агарозы, 1,6 мМ СаС 2 и 13 эмульсии яичного желтка. Высота слоя геля в чашках Петри составляет 4 мм. 0,012 -ный предварительно прогретый (100 С, 60 с) раствор фосфолипазы А 2 инкубируют 45 мин с равным по объему 16,6 мМ раствором ингибитора, содержащим 0,65 и 0,1 сывороточного альбумина. 10 мкл этого раствора смешивают с равным объемом воды и вносят в вырезанную в геле круглую лунку (диаметр 4 мм, объем 25 мкл). Реакцию проводят в течение 20 ч при 50 С. Измерение диаметра зоны просветления производят с помощью измерительной лупы с ценой деления 0,1 мм, причем величинаменяется в пределах от 10 до 22 мм. Пример 3. Для определения эффекторных (активаторных) свойств физиологически активных соединений, в частности, бетаина (глицинбетаина), мочевины и аминоэфира бензойной кислоты, по отношению к активности фосфолипаз А 2 различного происхождения (змеиного яда, пчелы и панкреаса свиньи) используют диффузию фермента в лецитин-агарозном геле. Мерой активирования служит относительное увеличение площади зоны просветления(/0), образующейся вследствие липолитического действия фермента на эмульсию яичного желтка, включенного в агарозный гель, которое рассчитывают по формуле/0(2 - 2) / (02 - 2),где , 0 - радиусы зон просветления в присутствии потенциального эффектора и без него, - радиус лунки. Эмульсию яичного желтка (субстрат фосфолипазы А 2) готовят по методу Хабермана и Хардта. Для приготовления геля используют 0,05 М веронал-ацетатный буфер, рН 7,5. Гель содержит 0,068 агарозы, 1,6 мМ СаС 2 и 13 эмульсии яичного желтка. Высота слоя геля в чашках Петри составляет 4 мм. 0,012 -ный предварительно прогретый (100 С, 60 с) раствор фосфолипазы А 2 инкубируют 45 мин с равным по объему 16,6 мМ раствором ингибитора, содержащим 0,654 5752 1 и 0,1 сывороточного альбумина. 10 мкл этого раствора смешивают с равным объемом воды и вносят в вырезанную в геле круглую лунку (диаметр 4 мм, объем 25 мкл). Реакцию проводят в течение 20 ч при 50 С. Измерение диаметра зоны просветления производят с помощью измерительной лупы с ценой деления 0,1 мм, причем величинаменяется в пределах от 10 до 22 мм. В табл 1. представлены результаты определения активности фосфолипазы А 2 после преинкубации с различными представителями 9,10,11-метальных производных и аналогов простагландинов. По приведенной в таблице величине остаточной активности фермента видно, что все испытываемые вещества снижали активность фосфолипазы А 2. В табл. 2, 3 приведены средние значения из 3-4 опытов, указана среднеквадратичная ошибка. В качестве контроля служили площади зоны просветления (0) вокруг лунок с внесенным в них в тех же условиях раствором фермента, в случае гидрофобных соединений преинкубированного в течение 3 ч с соответствующим по объему количеством спирта без простагландина. В табл. 4 представлены результаты определения активности фосфолипазы А 2 после преинкубации с бетаином (глицинбетаином), мочевиной (карбамидом) и аминоэфиром бензойной кислоты. По приведенной в таблице величине /0, значение которой выше единицы, видно, что все испытываемые вещества увеличивали активность фосфолипазы А 2. Представленные результаты по испытанию ингибиторного (производные простагландинов, как гидрофобных соединений, и производные глицерина, как гидрофильных соединений), а также активаторного (бетаин, мочевина и аминоэфир бензойной кислоты) действия физиологически активных соединений на фосфолипазную реакцию позволяют применять описанный в данной работе полуколичественный, удобный в выполнении метод гель-диффузии фосфолипазы А 2 для быстрого и одновременного тестирования эффекторной активности любого ряда химических соединений по отношению к ферментативному гидролизу фосфолипидов. Таблица 1 Характеристика гидролиза фосфатидилхолина фосфолипазой А 2 после преинкубации фермента с некоторыми аналогами простаноидов Шифр соединения Аналоги ПГ на основе циклопентанона( ) Общий Остаточная Общий Остаточная гидролиз активность, гидролиз активность Относительное уменьшение площади зоны просветления при гель-диффузии ФЛА 2 в присутствии природных простагландинов (ПГ) и их аналогов 5. Содержащие в -цепи цикл изоксазола или фрагмент енаминокетона Аналоги ПГ на основе циклопентенона 5752 1 Таблица 3 Относительное уменьшение площади зоны просветления при гель-диффузии фосфолипаз А 2 в присутствии производных глицерина (21(2)23) Таблица 4 Относительное увеличение зоны просветления при гель-диффузии фосфолипазы А 2 из разных источников в присутствии следующих веществ Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: G01N 33/15, C12Q 1/34
Метки: свойств, физиологически, определения, способ, соединений, активных, эффекторных
Код ссылки
<a href="https://by.patents.su/8-5752-sposob-opredeleniya-effektornyh-svojjstv-fiziologicheski-aktivnyh-soedinenijj.html" rel="bookmark" title="База патентов Беларуси">Способ определения эффекторных свойств физиологически активных соединений</a>