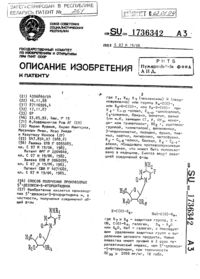
Способ получения 9-(2-дезокси-2-фтор-?-D-арабинофуранозил)аденина
Номер патента: 18120
Опубликовано: 30.04.2014
Авторы: Калиниченко Елена Николаевна, Сивец Григорий Гаврилович
Текст
(71) Заявитель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(72) Авторы Сивец Григорий Гаврилович Калиниченко Елена Николаевна(73) Патентообладатель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(57) Способ получения 9-(2-дезокси-2-фторарабинофуранозил)аденина, при котором проводят реакцию конденсации 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида с калиевой солью производного аденина общей формулы 2 гдепредставляет собой пивалоил или бензоил,с образованием ацилированного 9-2-фторарабинонуклеозида аденина общей формулы 3 гдепредставляет собой пивалоил или бензоил,который после хроматографической очистки деацилируют аммиаком в метаноле. 18120 1 2014.04.30 Изобретение относится к области биоорганической химии, в частности к способу получения 9-(2-дезокси-2-фторарабинофуранозил)аденина (2), обладающего ингибирующей активностью в отношении протозойного паразита 1. 2 Фторнуклеозид проявляет более высокую антипротозойную активность, чем метронидазол - лекарственный препарат, разрешенный для лечения трихомониаза 1. Кроме того, 2 является одним из ключевых исходных в ряду 2-фтор-2-дезоксиарабинофуранозил нуклеозидов, используемых для получения структурных блоков и синтеза антисмысловых олигонуклеотидов (2-дезокси-2-фторарабино нуклеиновых кислот, являющихся ингибиторами транскрипции и экспрессии генов), разработки на основе последних лекарственных средств 2-4. Описан способ получения 2 через 2,6-дихлор-9-(5-О-бензил-3-О-бензоил-2 дезокси-2-фторарабинофуранозил)пурин путем конденсации производного 2 дезокси-2-фторарабинофуранозы с 2,6-дихлорпурином в присутствии катализатора п-толуолсульфокислоты. Описанный процесс позволяет получать промежуточное соединение с выходом 30 после хроматографии на силикагеле, обработка которого аммиаком в метаноле и гидрогенолиз на палладиевом катализаторе дают целевой адениновый нуклеозид с низким суммарным выходом 5. Описан также способ получения 2 путем конденсации 1,3,5-трибензоил 2-дезокси-2-фторарабинофуранозы при кипячении в ацетонитриле с бис-триметилсилильным производным -6-бензоиладенина в присутствии катализатора - триметилсилилтрифлата - с последующим удалением бензоильных защитных групп смеси трех изомерных продуктов реакции и их хроматографическим разделением на силикагеле. Описанный процесс позволяет получать -9-р-арабинозид аденина с выходом 146. Недостатками этих способов являются низкий выход промежуточных 9-нуклеозидов 2,6-дихлорпурина или -6-бензоиладенина и образование смеси четырехтрехизомерных нуклеозидов (-7/-9- и -/-аномеров) в реакции гликозилирования гетерооснований 1-О-ацетильным или бензоильным производными 2-дезокси-2-фторарабинофуранозы соответственно, а для разделения нуклеозидов необходима сложная хроматография на силикагеле. Схема 1 Недавно описан химико-энзиматический способ получения 9-(2-дезокси-2-фторарабинофуранозил)аденина, включающий синтез в три стадии -1-фосфата 2-дезокси-2 фторарабинофуранозы (4) из 2-дезокси-2-фтор-3,5-ди-О-бензоиларабинофуранозил бромида (2), получаемого из 2-дезокси-2-фторарабинофуранозы 1, и реакцию стереоселективного энзиматического гликозилирования аденина -1-фосфатом (4) в фосфатном буфере при 50 С в присутствии катализатора - пуриннуклеозидфосфорилазы 18120 1 2014.04.30 Недостатками описанного четырехстадийного метода являются образование смеси,-1-фосфатов 4 в процессе получения из бромида 2, длительное протекание (6 суток) реакции энзиматического гликозилирования при нагревании, умеренный суммарный выход 2 и использование хроматографии в обратной фазе для его выделения 7. Схема 2 Описан способ получения аденинового нуклеозида 5 из 3 ацетил-5 бензоил-2 дезокси-2-фторарабинофуранозил бромида (2) (схема 2). В результате конденсации последнего с -6-бензоиладенином при кипячении в хлористом метилене в присутствии молекулярных сит и хроматографии на силикагеле получено промежуточное соединение 7 с выходом 34 , деацилирование которого метилатом натрия в метаноле при кипячении приводило к целевому нуклеозиду 5 с суммарным выходом 298. Наиболее близким к изобретению является способ получения 2 А, который является прототипом и включает реакцию конденсации при кипячении в смеси толуола и тетрагидрофурана 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида(2), полученного бромированием 1,3,5-трибензоил-2-дезокси-2-фторарабинофуранозы 30 в уксусной кислоте 2, 9, с калиевой солью -6-гептаноилпурина 8, которую получают с использованием гексаметилдисилазида калия в толуоле при - 35 С (схема 2) 10. Выход промежуточного нуклеозида 9 после хроматографии на силикагеле составляет 51 . В результате обработки промежуточного соединения 9 метилатом натрия в метаноле при 45 С и комнатной температуре, последующей кристаллизации получен 9-(2 дезокси-2-фторарабинофуранозил)аденин (5) с выходом 81 . Недостатки прототипа - проведение реакций конденсации 1 бромсахара 2 с -6 ацильным производным аденина и деацилирования промежуточного нуклеозида 9 при кипячении 10. Кроме того, синтез -6-гептаноилпурина осуществляют из аденина и ангидрида каприловой кислоты при 130 С, а калиевую соль -6-гептаноилпурина получают при - 35 С. Суммарный выход 9-(2-дезокси-2-фторарабинофуранозил)аденина (5) при его получении из производного 2-дезокси-2-фторарабинофуранозы 2 и аденина или -6-ацилпурина составляет 29-4110. Задачей настоящего изобретения является усовершенствование способа получения 9-(2-дезокси-2-фторарабинофуранозил)аденина. Технический результат, достигаемый при осуществлении изобретения, состоит в упрощении процесса (проведение ключевых стадий при комнатной температуре), высокой стереоселективности реакции конденсации бромсахара с гетероциклическим основанием при использовании калиевых солей легкодоступных -6-ацил производных аденина с преимущественным образованием 9 нуклеозида, что позволяет осуществить эффективное хроматографическое разделение смеси промежуточных - и -аномерых нуклеозидов и в целом повысить выход целевого нуклеозида (схема 3). Поставленная задача решается заявляемым способом получения 2 (5), заключающимся в конденсации 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида (1) с калиевыми солями -6-пивалоил или -бензоиладенина (2), полученными путем обработки производных аденина трет-бутилатом калия в 1,2-диметоксиэтане, с образованием 9-(3,5-дибензоил-2-дезокси-2-фторарабино-фуранозил)-6 пивалоиладенина (3 а) или -бензоиладенина (3) соответственно, которые выделяют хроматографией на силикагеле и обрабатывают аммиаком в метаноле. Целевой продукт выделяют кристаллизацией без хроматографической очистки. Калиевую соль -6-пивалоил или -бензоиладенина (2) получают обработкой ацильных производных аденина эквимолярным количеством трет-бутилата калия в 1,2-диметоксиэтане при 0 С с последующим удалением в вакууме растворителя. Реакция анионного гликозилирования калиевой соли -6-пивалоиладенина бромидом 1 2, 9 в ацетонитриле при комнатной температуре в присутствии гидрида кальция дает 9-(3,5-ди-бензоил-2-дезокси-2-фторарабинофуранозил)-6 пивалоиладенин (3 а) с выходом 51 после хроматографии на силикагеле (соотношение -/-аномеров 61 согласно 4 Н ЯМР спектральным данным). Проведение реакции конденсации в смеси ацетонитрил/дихлорэтан в присутствии гидрида кальция позволило повысить выход промежуточного нуклеозида 3 а до 61 и ее стереоселективность (соотношение -/-аномеров 12141). Найденные условия реакции обеспечивают более высокий выход промежуточного-нуклеозида 3 а (61 ) в сравнении с прототипом, в котором используется калиевая соль-6-гептаноилпурина (выход ацильного производного нуклеозида 51 ), и высокую стереоизбирательность образования гликозидной связи из 1-бромпроизводного сахара 1, а также упрощают хроматографическое разделение на силикагеле смеси образующихся аномерных нуклеозидов. Реакция гликозилирования калиевой соли легкодоступного -6-бензоиладенина бромидом 1 в условиях, аналогичных для калиевой соли -6-пивалоиладенина, приводила также к преимущественному образованию 9 нуклеозида 3 (выход 50 после хроматографического выделения) с хорошей селективностью (соотношение -/аномеров 101). Синтез 2 (5) осуществляют при комнатной температуре из индивидуальных промежуточных -нуклеозидов 3 и 3 в метаноле, насыщенном при 0 С аммиаком, с последующей кристаллизацией целевого нуклеозида с выходами 80 . Отличительными особенностями способа являются использование легкодоступных 6-пивалоил и -бензоиладенина, получение их калиевых солей в результате обработки -6 пивалоил и -бензоиладенина трет-бутилатом калия в 1,2-диметоксиэтане при 0 С в сравнении с прототипом, проведение реакций анионного гликозилирования гетерооснований с 1-бромпроизводным сахара 1 в смеси ацетонитрила/хлорированного углеводорода в присутствии гидрида кальция и реакций деацилирования промежуточных нуклеозидов 3 и 3 аммиаком в метаноле при комнатной температуре. Заявляемый способ позволяет получать 9-(2-дезокси-2-фторарабинофуранозил)аденин из легкодоступных -6-пивалоил и -бензоиладенина и 1-бромпроизводного сахара с высоким суммарным выходом 40-50 , проводить все стадии в более мягких условиях в сравнении с прототипом. Способ получения 9-(2-дезокси-2-фторарабинофуранозил)аденина (5) иллюстрируется в примерах. Примеры. 1. Получение 9-(2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил)-6 пивалоиладенина (3) из 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида (1). Получение -6-пивалоиладенина. К суспензии 0,495 г (14,43 ммоль) аденина в 9 мл безводного пиридина добавляют по каплям 0,9 мл (14,43 ммоль) пивалоила хлористого. Реакционную смесь нагревают при 100 С в течение 1,5 ч и далее перемешивают 18 ч при комнатной температуре, затем добавляют 15 мл безводного метанола, упаривают и соупаривают с толуолом (225 мл). Остаток кристаллизуют из изопропилового спирта. Получают 0,684 г (78 ) -6 пивалоиладенина. Т.пл. 212-216 С. 1 Н ЯМР (-6) 12.2 уш.с (1, ), 10.5 уш.с(1, ), 8.61 с (1, -2), 8.39 с (1, -8), 1.27 с 9, (3)3. 13 ЯМР (-6) 175.56 с (3)3, 151.54, 146.23, 145.44, 115.32, 40.1, 27.3. /-, / 220,(1). УФмакс 279 нм( 13100). А). К суспензии 0,312 г (1,42 ммоль) -6-пивалоиладенина в 42 мл 1,2-диметоксиэтана при 0 С добавляют 0,138 г (1,224 ммоль) трет-бутилата калия и перемешивают при охлаждении в атмосфере азота 20 мин, а затем упаривают досуха. К полученной калиевой соли-6-пивалоиладенина (2) добавляют 13 мл безводного ацетонитрила и 0,054 г (1,28 ммоль) гидрида кальция, перемешивают 10 мин при комнатной температуре, а затем добавляют по каплям раствор 0,48 г (1,134 ммоль) бромсахара 1 в 18 мл дихлорэтана. Реакционную смесь перемешивают 19 ч в атмосфере азота при комнатной температуре. Осадок отфильтровывают и промывают безводным хлористым метиленом (60 мл), фильтрат упаривают 5 18120 1 2014.04.30 досуха. Маслообразный остаток после упаривания фильтрата хроматографируют на силикагеле 60 Н (70-230 меш, Мерк, Германия), используя для элюции смесь петролейный эфир-этилацетат и этилацетат-метанол (101). Получают 0,03 г (5 ) -нуклеозида 4 а в виде масла. 1 Н ЯМР (3) 8.73 с (1, -2), 8.47 уш.с (1, ), 8.21 с (1, -8), 7.398.11 м (10, 2), 6.53 д (1, 1,14.16 гц, -1), 6.26 д (1, 2,49.0 гц, -2), 5.83 дм( 21900), макс 271 нм( 14120). Б). К суспензии 0,235 г (1,07 ммоль) -6-пивалоиладенина в 30 мл 1,2-диметоксиэтана при 0 С добавляют 0,105 г (0,935 ммоль) трет-бутилата калия и перемешивают при охлаждении в атмосфере азота 20 мин, а затем упаривают досуха. К полученной калиевой соли-6-пивалоиладенина (2) добавляют 15 мл безводного ацетонитрила и 0,04 г (0,95 ммоль) гидрида кальция, перемешивают 10 мин при комнатной температуре, а затем добавляют по каплям раствор 0,36 г (0,85 ммоль) бромсахара 1 в 11 мл ацетонитрила. Реакционную смесь перемешивают 19 ч в атмосфере азота при комнатной температуре. Осадок отфильтровывают и промывают безводным хлористым метиленом (50 мл), фильтрат упаривают досуха. Маслообразный остаток после упаривания фильтрата хроматографируют на силикагеле 60 Н (70-230 меш, Мерк, Германия), используя для элюции смесь петролейный эфир-этилацетат и этилацетат-метанол (101). Получают 0,04 г (8 ) -нуклеозида 4 а и 0,245 г (51 ) -нуклеозида 3 а. Получение 9-(2-дезокси-2-фторарабинофуранозил)аденина (5) из 9-(2-дезокси-2 фтор-3,5-дибензоиларабинофуранозил)-6 пивалоиладенина (3 а). Раствор 0,2 г (0,343 ммоль) нуклеозида 3 а в 8,5 мл метанола, насыщенного сухим аммиаком при 0 С, перемешивают 48 ч при комнатной температуре. Реакционную смесь упаривают, остаток промывают безводным эфиром и кристаллизуют из смеси этанол/эфир. Получают 0,076 г (82 ) нуклеозида 5 с общим выходом 50 из бромида 1. Т.пл. 233-234 С (этанол/эфир). 1 НЯМР (3) 8.31 д (1, -8,2.0 гц, -8), 8.19 с/-, / 270, (1). УФ (2) макс 210 нм ( 17500), макс 259 нм ( 14700). 2. Получение 9-(2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил)-6 бензоиладенина (3) из 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида (1). К 0,216 г (0,904 ммоль) -6-бензоиладенина добавляют 28 мл 1,2-диметоксиэтана и нагревают суспензию в течение 2-3 мин, а затем при 0 С добавляют 0,1 г (0,892 ммоль) трет-бутилата калия и перемешивают при охлаждении в атмосфере азота 12 мин, упаривают досуха. К полученной калиевой соли -6-бензоиладенина (2) добавляют 8,8 мл безводного ацетонитрила и 0,04 г (0,948 ммоль) гидрида кальция, а затем прибавляют по каплям раствор 0,308 г (0,728 ммоль) бромсахара 1 в 12 мл безводного дихлорэтана. Реакционную смесь перемешивают 24 ч в атмосфере азота при комнатной температуре. Оса 6 18120 1 2014.04.30 док отфильтровывают и промывают безводным хлористым метиленом (40 мл), фильтрат упаривают досуха. Маслообразный остаток растворяют в этилацетате (40 мл) и промывают водой (220 мл). Органический слой сушат над безводным сульфатом натрия и упаривают досуха. Продукты реакции хроматографируют на силикагеле 60 (70-230 меш,Мерк, Германия), используя для элюции смесь петролейный эфир-этилацетат и этилацетат-метанол (101). Получают 0,02 г (5 ) -нуклеозида 4 в виде масла. 1 Н ЯМР (3) 9.12 уш.с (1, ), 8.8 с (1, -2), 8.32 с (1, -8), 7.43-8.11 м (15, 3), 6.56 д (1,1,14.1 гц, -1), 6.26 д (1, 2,49.1 гц, -2), 5.83 дм (1, 3,16.0 гц, -3), 5.0 м(1, -4), 4.73 дд (1, 5,44.4 Гц, 5,511.2 Гц, -5), 4.72 дд (1, 5,44.6 Гц, -5). 19 ЯМР (3) -188.0 (дм, -2). УФмакс 231 нм ( 22190), макс 274 нм ( 22290). 0,212 г (50 ) -нуклеозида 3. Т.пл. 74-77 С (/петрол.эфир). 1 ЯМР (3) 9.15 уш.с (1, ), 8.82 с (1, -2), 8.31 д (1, -8,2.95 гц, -8), 7.43-8.12 м (15,3), 6.72 дд (1, 1,22.64 гц, 1,21.4 гц, Н-1), 5.78 дд (1, 3,42.8 Гц, 3,16.5 гц, -3), 5.40 дд (1, 2,49.8 гц, -2), 4.83 д (2, -5 и -5), 4.62 м (1, -4). 13 ЯМР (3) 166.32 и 165.28 2 с (65), 164.77 с (65), 153.0, 151.6, 149.82,142.36 (д, -8,6.7 гц, -8), 134.38, 133.57, 133.0, 129.89, 129.48, 128.9, 128.68, 128.26,92.72 д (-2, 2,2192.81), 83.7 д (-1, 1,217.0), 81.5 с (-4), 76.81 д (-3,3,230.6), 63.36 с (-5). 19 ЯМР (3) -198.27 (дт, -2). /-, / 582,(1). УФмакс 231 нм ( 22170), макс 274 нм ( 21000). Получение 9-(2-дезокси-2-фторарабинофуранозил)аденина (5) из 9-(2-дезокси-2 фтор-3,5-дибензоиларабинофуранозил)-6 бензоил-аденина (3). Раствор 0,134 г (0,238 ммоль) нуклеозида 3 в 5 мл метанола, насыщенного сухим аммиаком при 0 С, перемешивают 48 ч при комнатной температуре. Реакционную смесь упаривают, остаток промывают безводным эфиром и кристаллизуют из смеси этанол/эфир. Получают 0,05 г (80 ) нуклеозида 5, идентичного образцу, полученному из нуклеозида 3, с общим выходом 40 из бромида 1. Источники информации 1..,.,,.,.,.,, - . Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 7
МПК / Метки
МПК: C07H 19/19
Метки: получения, 9-(2-дезокси-2-фтор-?-d-арабинофуранозил)аденина, способ
Код ссылки
<a href="https://by.patents.su/7-18120-sposob-polucheniya-9-2-dezoksi-2-ftor-d-arabinofuranoziladenina.html" rel="bookmark" title="База патентов Беларуси">Способ получения 9-(2-дезокси-2-фтор-?-D-арабинофуранозил)аденина</a>
Предыдущий патент: Канюля для перфузии органа при эксплантации
Следующий патент: Способ получения 9-(2-дезокси-2-фтор-?-D-арабинофуранозил) гуанина (варианты)
Случайный патент: Арилсульфонилмочевины, способы их получения и их применение в качестве гербицидов