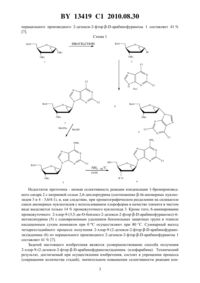
Способ получения 2-хлор-9-(2-дезокси-2-фтор-?-D-арабинофуранозил)аденина
Номер патента: 13419
Опубликовано: 30.08.2010
Авторы: Сивец Григорий Гаврилович, Калиниченко Елена Николаевна
Текст
(51) МПК (2009) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ(71) Заявитель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(72) Авторы Калиниченко Елена Николаевна Сивец Григорий Гаврилович(73) Патентообладатель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси где- бензоил или ацетил,бромируют триметилсилилбромидом в присутствии цинка бромистого, затем осуществляют реакцию конденсации образовавшегося 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида с калиевой солью 2,6-дихлорпурина, полученной путем обработки 2,6-дихлорпурина трет-бутилатом калия в 1,2-диметоксиэтане, с образованием 9(3,5-дибензоил-2-дезокси-2-фторарабинофуранозил)-2,6-дихлорпурина, который обрабатывают аммиаком в смеси метанола и 2,3-бутандиола при объемном соотношении 41, и выделяют целевой продукт. 2. Способ по п. 1, отличающийся тем, что реакцию конденсации осуществляют в смеси ацетонитрил/хлорированный углеводород. 13419 1 2010.08.30 Изобретение относится к области биоорганической химии, в частности к способу получения 2-хлор-9-(2-дезокси-2-фторарабинофуранозил)аденина (клофарабина), обладающего противоопухолевой активностью в отношении ряда клеточных линий и используемого в медицинской практике при лечении детской лейкемии 1-2. Известен способ получения 2-хлор-9-(2-дезокси-2-фторарабинофуранозил)аденина через промежуточный 2,6-дихлор-9-(3 ацетил-5 бензоил-2-дезокси-2-фторарабинофуранозил)пурин, полученный конденсацией 2,6-дихлорпурина при 100 С в дихлорэтане с 2-дезокси-2-фтор-3 ацетил-5 бензоиларабинофуранозил бромидом,который получали обработкой перацильного производного 2-дезокси-2-фторарабинофуранозы бромистым водородом в хлористом метилене 2, 3. Выход промежуточного соединения 2,6-дихлор-9-(3 ацетил-5 бензоил-2-дезокси-2-фторарабинофуранозил)пурина после хроматографии на силикагеле составлял 32 , который в результате аминирования аммиаком в этаноле и удаления защитной группы гидроокисью лития в смеси ацетонитрил/вода превращен в 2-хлор-9-(2-дезокси-2-фторарабинофуранозил)аденин с выходом 42 . Недостатки данного способа - низкий суммарный выход целевого нуклеозида (13 ) и низкая селективность реакции гликозилирования 2,6-дихлорпурина 1-бромпроизводным сахара с образованием смеси - и -аномерных нуклеозидов в соотношении 11 3. Описан способ получения 2-хлор-9-(2-дезокси-2-фторарабинофуранозил)аденина(клофарабина) через 2,6-дихлор-9-(3,5-дибензоил-2-дезокси-2-фтор-(арабинофуранозил)пурин конденсацией 1,3,5-трибензоил-2-дезокси-2-фторарабинофуранозы при кипячении в ацетонитриле с бистриметилсилильным производным 2,6-дихлорпурина в присутствии катализатора - триметилсилилтрифлата. Описанный процесс позволяет получать промежуточное соединение с выходом 35 после хроматографии на силикагеле 4. 2-Хлор-9-(2-дезокси-2-фторарабинофуранозил)аденин был получен в результате обработки 2,6-дихлор-9-(3,5-дибензоил-2-дезокси-2-фторарабинофуранозил)пурина аммиаком в 1,2-диметоксиэтане и метаноле. Суммарный выход 2-хлор-9-(2-дезокси-2 фторарабинофуранозил)аденина, полученного таким способом, составил 254. Недостатками способа являются низкий выход промежуточного соединения 9-(3,5-ди-бензоил-2-дезокси-2-фторарабинофуранозил)-2,6-дихлорпурина и низкая селективность (соотношение -/-аномеров, 1.11) реакции гликозилирования производного 2,6-дихлорпурина перацильным производным 2-дезокси-2-фторарабинофуранозы. Получение бистриметилсилильного производного гетероциклического основания в результате кипячения 2,6-дихлорпурина в смеси гексаметилдисилазана и триметилхлорсилана осуществляется отдельной стадией, что усложняет процесс. Наиболее близким к изобретению является способ получения 2-хлор-9-(2-дезокси-2 фторарабинофуранозил)аденина (клофарабина), который включает бромирование 1,3,5-трибензоил-2-дезокси-2-фторарабинофуранозы (1) 30 в уксусной кислоте 5-6, реакцию конденсации 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида (2) в ацетонитриле с натриевой солью 2,6-дихлорпурина, получаемой с использованием гидрида натрия (хема 1) 7. Выход промежуточного нуклеозида 3 после хроматографии на силикагеле составляет 68 . Суммарный выход 9-(3,5-ди-бензоил-2-дезокси-2-фторарабинофуранозил)-2,6-дихлорпурина (3) из сахара 1 составляет 66 . В результате обработки промежуточного соединения 3 метилатом натрия при комнатной температуре и аммиаком в этаноле при 80 С получен 2-хлор-9-(2-дезокси 2-фторарабинофуранозил)аденин (6). Суммарный выход целевого нуклеозида (6) из Недостаток прототипа - низкая селективность реакции конденсации 1-бромпроизводного сахара 2 с натриевой солью 2,6-дихлорпурина (соотношение -/-аномерных нуклеозидов 3 и 4 - 3,6/41), и, как следствие, при хроматографическом разделении на силикагеле смеси аномерных нуклеозидов с использованием хлороформа в качестве элюента в чистом виде выделяется только 14 промежуточного нуклеозида 3. Кроме того, 6-аминирование промежуточного 2-хлор-9-(3,5-дибензоил-2-дезокси-2-фторарабинофуранозил)-6 метоксипурина (5) с одновременным удалением бензоильных защитных групп в этаноле насыщенным сухим аммиаком при 0 С осуществляют при 80 С. Суммарный выход четырехстадийного процесса получения 2-хлор-9-(2-дезокси-2-фторарабинофуранозил)аденина (6) из перацильного производного 2-дезокси-2-фторарабинофуранозы 1 составляет 417. Задачей настоящего изобретения является усовершенствование способа получения 2-хлор-9-(2-дезокси-2-фторарабинофуранозил)аденина (клофарабина). Технический результат, достигаемый при осуществлении изобретения, состоит в упрощении процесса(сокращении количества стадий), значительном повышении селективности реакции кон 3 13419 1 2010.08.30 денсации бромсахара с гетероциклическим основанием при использовании калиевой соли 2,6-дихлорпурина, повышении выхода целевого нуклеозида. Поставленная задача решается заявляемым способом (схема 2) получения 2-хлор-9-(2 дезокси-2-фторарабинофуранозил)аденина (5), заключающимся в бромировании 1-ацил-2-дезокси-2-фтор-3,5-дибензоиларабинофураноз 1 триметилсилилбромидом в присутствии цинка бромистого, последующей конденсации образовавшегося 2-дезокси 2-фтор-3,5-дибензоиларабинофуранозил бромида (2) с калиевой солью 2,6-дихлорпурина, полученной путем обработки 2,6-дихлорпурина трет-бутилатом калия в 1,2-диметоксиэтане, с образованием 9-(3,5-дибензоил-2-дезокси-2-фторарабинофуранозил)2,6-дихлорпурина (3), который обрабатывают аммиком в смеси метанола и 2,3-бутандиола при объемном соотношении 41, и выделяют целевой продукт. Схема 2 1,3,5-Трибензоил-2-дезокси-2-фторарабинофуранозу (1) получают из рибозы по известной методике 5, 8. 1 Ацетил-2-дезокси-2-фтор-3,5-дибензоил-,-арабинофуранозу (1) получают из -ксилозы через промежуточный метил-5 бензил 2-дезокси-2-фторарабинофуранозид 9 с использованием процесса гидрогенолиза бензильной группы на палладиевом катализаторе, бензоилирования гидроксильных групп бензоилом хлорисистым в пиридине и ацетолиза промежуточного метил гликозида в смеси уксусная кислота/уксусный ангидрид/серная кислота 10. Использование триметисилилбромида в присутствии безводного 2 в хлористом метилене позволяет получить 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил 4 13419 1 2010.08.30 бромид (2) из 1 ацил-2-дезокси-2-фтор-3,5-дибензоиларабинофураноз 1 а или 1 с выходами 96 и 99 , соответственно, без хроматографического выделения. Калиевую соль 2,6-дихлорпурина получают обработкой 2,6-дихлорпурина эквимолярным количеством трет-бутилата калия в 1,2-диметоксиэтане с последующим удалением в вакууме растворителя. Реакция конденсации калиевой соли 2,6-дихлорпурина с 2-дезокси 2-фтор-3,5-дибензоиларабинофуранозил бромидом (2) в ацетонитриле при комнатной температуре дает 9-(3,5-дибензоил-2-дезокси-2-фторарабинофуранозил)2,6-дихлорпурин (3) с выходом 73 после хроматографии на силикагеле. Данные условия реакции обеспечивают более высокий выход промежуточного -нуклеозида 3 и высокую селективность образования гликозидной связи из 1-бромпроизводного сахара 2 с 2,6-дихлорпурином (соотношение -/-аномеров 91 согласно 1 ЯМР спектральным данным), а также более полное хроматографическое разделение на силикагеле смеси аномерных нуклеозидов в сравнении с натриевой солью 2,6-дихлорпурина, используемой в прототипе. Реакция конденсации бромида 2 с калиевой солью 2,6-дихлорпурина в смеси ацетонитрила и дихлорэтана при комнатной температуре приводит к улучшению селективности образования промежуточных аномерных нуклеозидов (соотношение -/-аномеров, 211,согласно 1 ЯМР спектральным данным) с увеличением выхода -нуклеозида 3. Синтез 2-хлор-9-(2-дезокси-2-фторарабинофуранозил)аденина (5) осуществляют в результате обработки 9-(3,5-дибензоил-2-дезокси-2-фторарабинофуранозил)2,6-дихлорпурина (3) в смеси метанола, насыщенного при 0 С аммиаком, и 2,3-бутандиола при объемном соотношении 41 при комнатной температуре с последующей хроматографией на силикагеле с выходом 78 . Отличительными особенностями способа являются использование триметилсилилбромида в присутствии катализатора 2 при мягком бромировании перацильных производных 2-дезокси-2-фторарабинофуранозы 1, калиевой соли 2,6-дихлорпурина,получаемой путем обработки 2,6-дихлорпурина трет-бутилатом калия в 1,2-диметоксиэтане, в реакции конденсации с 1-бромпроизводным сахара 2 в апротонном растворителе или в смеси апротонного растворителя/хлорированного углеводорода, превращение в одну стадию промежуточного -нуклеозида 3 в целевой нуклеозид 5 при обработке аммиаком в смеси растворителей, что позволяет осуществить в одну стадию 6-аминирование и удаление бензоильных защитных групп 9-(3,5-дибензоил-2-дезокси-2-фторарабинофуранозил)-2,6-дихлорпурина (3) при комнатной температуре в отличие от прототипа, где используется двухстадийный процесс через получение 6- производного нуклеозида и последующее превращение его в жестких условиях в конечный нуклеозид. Заявляемый способ позволяет получать 2-хлор-9-(2-дезокси-2-фторарабинофуранозил)аденин (клофарабин) с высоким суммарным выходом 55-63 , проводить все стадии при комнатной температуре и сократить их количество. Способ получения 2-хлор-9-(2-дезокси-2-фторарабинофуранозил)аденина (5) приведен в примере. Пример. 1. Получение 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида (2). А) Из 1,3,5-трибензоил-2-дезокси-2-фторарабинофуранозы (1 а). К раствору 0,39 г (0,84 ммоль) трибензоата 1 а в 10 мл безводного хлористого метилена добавляют 0,057 г (0,25 ммоль) безводного 2. К суспензии сахара и катализатора добавляют при охлаждении 0 С 0,2 мл (1,55 ммоль) триметисилилбромида. Реакционную смесь перемешивают 1 час при 0 С и 18 часов при комнатной температуре, разбавляют хлористым метиленом (10 мл) и добавляют при перемешивании охлажденный водный раствор 3. Органический слой отделяют, водную фазу экстрагируют хлористым 5 13419 1 2010.08.30 метиленом (40 мл). Объединенный органический слой промывают водой (210 мл) и сушат над безводным 4, и упаривают досуха. Получают 0,34 г (96 ) бромида 2 в виде желтоватого масла. 1 ЯМР (3) 7,43-8,13 м (10, 2 ), 6,62 д (1, 1,12,07 гц, -1),5,61 дд (1, 2,31,0 Гц, 2,50 гц, Н-2), 5,55 ддд (1, 3,43,94 Гц, 3,22,0 гц, -3),4,84 дд (1, 5,43,0 Гц, 5,511,8 Гц, -5), 4,81 м (1, -4), 4,73 дд (1, 5,44,0 Гц, -5). Б) Из 1 ацетил-2-дезокси-2-фтор-3,5-дибензоил-,арабинофуранозы (1). К раствору 0,408 г (1,01 ммоль) ацетата 1 1 ЯМР (3) 7,42-8,09 м (10, 2 ),6,49 д (1, -аномер, 1,10,1 гц, -1), 6,47 д (1, -аномер, 1,26,6 гц, -1), 5,85 дт(-5), 21,12 с (3) в 8 мл безводного хлористого метилена добавляют 0,071 г (0,31 ммоль) безводного 2. К суспензии сахара и катализатора добавляют при охлаждении 0 С 0,39 мл (3,04 ммоль) триметилсилилбромида. Реакционную смесь перемешивают 1 час при 0 С и 5 часов при комнатной температуре, разбавляют хлористым метиленом (10 мл) и добавляют при перемешивании охлажденный водный раствор 3. Органический слой отделяют, водную фазу экстрагируют хлористым метиленом (40 мл). Объединенный органический слой промывают водой (210 мл) и сушат над безводным 4, и упаривают досуха. Получают 0,425 г (99 ) бромида 2 в виде желтоватого масла. 2. Получение 9-(2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил)-2,6-дихлорпурина (3) из 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида (2). А). К раствору 0,222 г (1,17 ммоль) 2,6-дихлорпурина в 17 мл 1,2-диметоксиэтана при охлаждении добавляют 0,135 г (1,20 ммоль) трет-бутилата калия. Полученный раствор перемешивают в атмосфере азота 12 минут при комнатной температуре и упаривают досуха. К калиевой соли 2,6-дихлорпурина добавляют 30 мл безводного ацетонитрила и перемешивают 10 минут при комнатной температуре, а затем добавляют по каплям раствор 0,408 г(0,96 ммоль) бромсахара 2. Реакционную смесь перемешивают 18 часов в атмосфере азота при комнатной температуре. Осадок отфильтровывают и промывают безводным ацетонитрилом (10 мл), фильтрат упаривают досуха. Остаток растворяют в безводном хлористом метилене, фильтруют. Маслообразный остаток после упаривания фильтрата хроматографируют на силикагеле 60 (70-230 меш, Мерк, Германия), используя для элюции смесь гексанэтилацетатхлороформ (103,31). Получают 0,374 г (73 ) -нуклеозида 3. Т.пл. 159-160 С . 1 ЯМР (3) 8,39 д (1, -8,2,97 гц, -8), 7,44-8,10 м (10, 2(95) макс 231 нм ( 15500), макс 274 нм ( 5600). Б). К калиевой соли 2,6-дихлорпурина, полученной из 0,222 г (1,17 ммоль) гетероциклического основания, как описано выше, добавляют 20 мл безводного ацетонитрила и перемешивают 10 минут при комнатной темрпературе, а затем добавляют по каплям раствор 6 13419 1 2010.08.30 0,408 г (0,96 ммоль) бромсахара 2 в 20 мл безводного дихлорэтана. Реакционную смесь перемешивают 20 часов в атмосфере азота при комнатной температуре. Осадок отфильтровывают и промывают безводным ацетонитрилом (10 мл), фильтрат упаривают досуха. Остаток растворяют в безводном хлористом метилене, фильтруют. Маслообразный остаток после упаривания фильтрата хроматографировали на силикагеле 60 Н (70-230 меш,Мерк, Германия), используя для элюции смесь гексанэтилацетатхлороформ (103,31). Получают в порядке выхода с колонки 0,099 г (24 ) исходного бромсахара 2, 0,318 г(82 ) -нуклеозида 3 и 0,014 г (3,7 ) -нуклеозида 4 в виде пены. 3. Получение 2-хлор-9-(2-дезокси-2-фторарабинофуранозил)аденина (5) из 9-(2 дезокси-2-фтор-3,5-дибензоиларабинофуранозил)-2,6-дихлорпурина (3). 0,21 г (0,038 ммоль) нуклеозида 3 растворяют в смеси 9 мл 2,3-бутандиола и 38 мл метанола, насыщенного сухим аммиаком при 0 С, и перемешивают 24 часа при комнатной температуре. Реакционную смесь упаривают. Маслообразный остаток хроматографируют на силикагеле 60 (70-230 меш, Мерк, Германия), используя для элюции хлороформ,смесь хлороформметанол 151 и 51. Получают 0,093 г (78 ) нуклеозида 5. Т.пл. 224226 С (этанол/эфир). 1 ЯМР (-6) 8,22 д (1, -8,2,00 гц, -8), 6,28 д (1,1,24,48 гц 1,14,1 гц, -1), 5,92 д (1, 3,3-5,2 гц, 3-), 5,23 дт (1, 3,24,2 Гц 2,52,6 гц, Н-2), 5,04 т (1, 5,5-5,7 гц, 5-), 4,40 дк (1, 3,20,8 Гц,3,44,4 Гц, 3,18,8 гц, -3), 3,80 м (1, -4). 3,62 м (1, 5,44,7 Гц, 5,511,8 Гц,-5), 3,57 дд (1, 5,45,5 Гц, -5). 19 ЯМР (-6) -198,38 (, -2). 13 ЯМР 13419 1 2010.08.30 Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: C07H 19/00, C07H 1/00
Метки: получения, способ, 2-хлор-9-(2-дезокси-2-фтор-?-d-арабинофуранозил)аденина
Код ссылки
<a href="https://by.patents.su/8-13419-sposob-polucheniya-2-hlor-9-2-dezoksi-2-ftor-d-arabinofuranoziladenina.html" rel="bookmark" title="База патентов Беларуси">Способ получения 2-хлор-9-(2-дезокси-2-фтор-?-D-арабинофуранозил)аденина</a>
Предыдущий патент: Способ производства консервированного пюре из сахарной свеклы
Следующий патент: Замещенные производные тиазолидиндиона
Случайный патент: Способ получения углеродных наноразмерных материалов