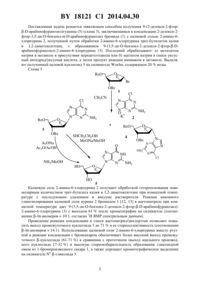
Способ получения 9-(2-дезокси-2-фтор-?-D-арабинофуранозил) гуанина (варианты)
Текст
(71) Заявитель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(72) Автор Сивец Григорий Гаврилович(73) Патентообладатель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(57) 1. Способ получения 9-(2-дезокси-2-фторарабинофуранозил)гуанина, при котором проводят реакцию конденсации 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида с калиевой солью 2-амино-6-галогенпурина формулы 2 гдепредставляет собой галоген с образованием нуклеозида формулы 3,гдепредставляет собой галоген,который обрабатывают в метаноле 4,0 эквивалентами метилата натрия и 4,1 эквивалентами меркаптоэтанола на 1 эквивалент нуклеозида формулы 3, и выделяют гуаниновый нуклеозид на силикагеле , содержащем 20 воды. 18121 1 2014.04.30 2. Способ по п. 1, отличающийся тем, что используют 2-амино-6-галогенпурин формулы 2, гдепредставляет собой хлор. 3. Способ получения 9-(2-дезокси-2-фторарабинофуранозил)гуанина, при котором проводят реакцию конденсации 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида с калиевой солью 2-амино-6-галогенпурина формулы 2 гдепредставляет собой галоген с образованием нуклеозида формулы 3,гдепредставляет собой галоген,который обрабатывают ацетатом натрия в смеси уксусный ангидрид/уксусная кислота,а затем полученный продукт - аммиаком в метаноле, и выделяют гуаниновый нуклеозид на силикагеле , содержащем 20 воды. 4. Способ по п. 3, отличающийся тем, что используют 2-амино-6-галогенпурин формулы 2, гдепредставляет собой хлор. Изобретение относится к области биоорганической химии, в частности к способу получения 9-(2-дезокси-2-фторарабинофуранозил)гуанина (2 Ара-Г), обладающего противоопухолевой активностью в отношении ряда клеточных линий лейкемии человека 1-3 и являющегося труднодоступным исходным нуклеозидом среди пуриновых нуклеозидов этого класса, используемым для получения антисмысловых олигонуклеотидов (2 дезокси-2-фторарабино нуклеиновых кислот) с улучшенными фармокинетическими свойствами (способность образовывать стабильные дуплексы с РНК, активность ) для биомедицинского применения 4-8. Впервые описан способ получения 9-(2-дезокси-2-фторарабинофуранозил)гуанина из 1,3-диацетил-5 бензоил-2-дезокси-2-фторарабинофуранозы через промежуточный 2,6-дихлор-9-(3 ацетил-5 бензоил-2-дезокси-2-фторарабинофуранозил)пурин, который получен реакцией конденсации 2,6-дихлорпурина с 1-бромпроизводным 2-дезокси-2-фторарабинофуранозы при кипячении в дихлорэтане в присутствии молекулярных сит 3. Выход промежуточного соединения после хроматографии на силикагеле составлял 32 , который в четыре стадии превращен в 2 Ара-Г с использованием реакции энзиматического дезаминирования на последней стадии. Недостатки данного способа - шестистадийный процесс с низким суммарным выходом целевого нуклеозида (10 ), и низкая селективность реакции гликозилирования 2,6-дихлорпурина 1-бромпроизводным сахара, и трудное хроматографическое разделение смеси промежуточных - и -аномерных нуклеозидов 3. Описан похожий способ получения 9-(2-дезокси-2-фторарабинофуранозил)гуанина из 1,3,5-трибензоил-2-дезокси-2-фторарабинофуранозы путем конденсации последней с триметилсилильным производным 2,6-дихлорпурина в присутствии триметилсилилтрифлата при кипячении в ацетонитриле с образованием промежуточного 2,62 18121 1 2014.04.30 дихлор-9-(3,5-дибензоил-2-дезокси-2-фторарабинофуранозил)пурина с выходом 35 после хроматографии на силикагеле. 2 Ара-Г был получен из промежуточного соединения в четыре стадии с суммарным выходом 669. Недостатками этого способа являются использование триметилсилильного производного 2,6-дихлорпурина, которое приводит к увеличению числа стадий и усложнению процесса, низкий выход промежуточного 9 нуклеозида 2,6-дихлорпурина, низкая селективность реакции конденсации 2,6-дихлорпурина с производным 2-дезокси-2-фторарабинофуранозы и невысокий суммарный выход (23 ) целевого нуклеозида из перацильного производного 2-дезокси-2-фторарабинофуранозы 9. Близким к изобретению является способ получения 2 Ара-Г, который включает реакцию конденсации 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида(1) с синильным производным 2-хлоргипоксантина при кипячении в четыреххлористом углероде в течение 3 дней (схема 1) 5. Выход промежуточного 9 нуклеозида 2 после хроматографии на силикагеле составляет 52 . В результате реакции аминирования и удаления защитных групп промежуточного соединения 2 аммиаком в метаноле при температуре 150 С в течение 6 ч получен 2 Ара-Г (3) с выходом 67 . Суммарный выход целевого нуклеозида из бромида 1 составляет 355. Недостатками данного способа являются длительное протекание (3 суток) реакции гликозилирования силильного производного 2-хлор-6-гидроксипунина при нагревании и проведение последней стадии в жестких условиях. Описан химико-энзиматический способ получения 9-(2-дезокси-2-фторарабинофуранозил)гуанина, включающий синтез в три стадии -1-фосфата 2-дезокси-2 фторарабинофуранозы (5) из 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида (1), реакцию стереоселективного энзиматического гликозилирования 2,6-диаминопурина -1-фосфатом (5) в фосфатном буфере при 50 С в присутствии катализатора - пуриннуклеозидфосфорилазы (схема 1) 10. Схема 1 3 Целевой гуаниновый нуклеозид 3 получен с выходом 87 в результате энзиматического дезаминирования 2-фтор-арабинонуклеозида 2,6-диаминопурина 6 с использованием аденозиндезаминазы. Суммарный выход 2 Ара-Г составляет 34 из бромида 1. Недостатки описанного метода, включающего пять стадий умеренный суммарный выход 2 Ара-Г, образование смеси - и -1-фосфатов 5 в процессе получения из бромида 1, длительное протекание (6 суток) реакции энзиматического гликозилирования при нагревании и использование хроматографии в обратной фазе для выделения 10. 3 18121 1 2014.04.30 Наиболее близким к изобретению является способ получения 2 Ара-Г, который является прототипом и включает реакцию конденсации 2-дезокси-2-фтор-3 ацетил-5-бензоиларабинофуранозил бромида (7) с ртутной солью 2-ацетамидо-6-хлорпурина или силильным производным последнего в присутствии цианида ртутипри кипячении в ксилоле или бензоле соответственно (схема 2) 2. Выход промежуточного нуклеозида 8 после хроматографии на силикагеле составляет 17-32 . Схема 2 9 Синтез промежуточного 9 нуклеозида 2-амино-6-хлорпурина 9 был осуществлен с низким выходом 28 после хроматографии на силикагеле в результате реакции гликозилирования силильного производного гетеооснования 1 бромидом (1) в присутствии цианида ртутипри кипячении в смеси ацетонитрила и бензола (схема 2) 11. Недостатки прототипа 2 проведение реакций конденсации 1 бромсахара 7 с ртутным производным 2-ацетамидо-6-хлорпурина или с его синильным производным в присутствии катализатора - цианида ртути , при кипячении в ксилоле или бензоле в течение 15 и 4 ч соответственно. В результате обработки промежуточного ацилированного нуклеозида 8 при кипячении 4,9 или 3,0 экв. метилата натрия в метаноле в присутствии 7,0 или 4,3 экв. меркаптоэтанола соответственно и последующих кристаллизаций был получен 2 Ара-Г (3) с выходами 21 и 67(схема 2) 1, 2. Низкий суммарный выход (11-21 ) целевого нуклеозида 3 в трехстадийном процессе получения из производного 2-дезокси-2-фторарабинофуранозы 7 и использование токсичных солей ртути являются существенными недостатками прототипа 2. Задачей настоящего изобретения является усовершенствование способа получения 9-(2-дезокси-2-фторарабинофуранозил)гуанина. Технический результат, достигаемый при осуществлении изобретения, состоит в упрощении процесса получения и выделения 2 Ара-Г, значительном повышении селективности реакции конденсации бромсахара с гетероциклическим основанием при использовании легкодоступной калиевой соли 2-амино-6-хлорпурина и повышении выхода целевого нуклеозида. 4 18121 1 2014.04.30 Поставленная задача решается заявляемым способом получения 9-(2-дезокси-2-фторарабинофуранозил)гуанина (5) (схема 3), заключающимся в конденсации 2-дезокси-2 фтор-3,5-дибензоиларабинофуранозил бромида (1) с калиевой солью 2-амино-6 хлорпурина 2, полученной путем обработки 2-амино-6-хлорпурина трет-бутилатом калия в 1,2-диметоксиэтане, с образованием 9-(3,5-дибензоил-2-дезокси-2-фторарабинофуранозил)-2-амино-6-хлорпурина (3). Последний обрабатывают а) метилатом натрия в метаноле в присутствии меркаптоэтанола или б) ацетатом натрия в смеси уксусный ангидрид/уксусная кислота, а затем продукт реакции аммиаком в метаноле. Выделяют полученный целевой нуклеозид 5 на силикагеле , содержащем 20 воды. Схема 3 5 Калиевую соль 2-амино-6-хлорпурина 2 получают обработкой гетерооснования эквимолярным количеством трет-бутилата калия в 1,2-диметоксиэтане при комнатной температуре с последующим удалением в вакууме растворителя. Реакция анионного гликозилирования калиевой соли пурина 2 бромидом 1 12, 13 в ацетонитриле при комнатной температуре дает 9-(3,5-дибензоил-2-дезокси-2-фторарабинофуранозил)2-амино-6-хлорпурина (3) с выходом 61 после хроматографии на силикагеле (соотношение -/-аномеров 101, согласно 1 ЯМР спектральным данным). Проведение реакции конденсации в смеси ацетонитрил/дихлорэтан позволяет повысить выход промежуточного нуклеозида 3 до 71 и ее стереоселективность (соотношение-/-аномеров 141). Использование калиевой соли 2-амино-6-хлорпурина вместо ртутной в реакции конденсации с бромсахаром обеспечивает более высокий выход промежуточного -нуклеозида (61-71 ) в сравнении с прототипом (выход ацильного производного нуклеозида 17-32 ) и высокую стереоизбирательность образования гликозидной связи из 1-бромпроизводного сахара 1, а также упрощает хроматографическое выделение на силикагеле 9 гликозида 3. 18121 1 2014.04.30 Синтез 2 Ара-Г (5) осуществляют обработкой метилатом натрия в метаноле промежуточного -нуклеозида 3 в присутствии меркаптоэтанола с последующей очисткой на силикагеле и кристаллизацией целевого нуклеозида с выходом 72 . Двухстадийный процесс получения нуклеозида 5 включает также превращение -нуклеозида 3 в промежуточный блокированный гуаниновый нуклеозид с применением комбинации реагентов ацетата натрия в смеси уксусный ангидрид/уксусная кислота, описанной ранее для получения производного 2-фторгуанозина 14, и деацилирование последнего аммиаком в метаноле при комнатной температуре с суммарным выходом 70 после хроматографии на силикагеле , содержащем 20 воды. Отличительными особенностями способа являются использование легкодоступных 2-амино-6-хлорпурина и его калиевой соли в сравнении с прототипом - ртутная соль 2-ацетамидо-6-хлорпурина или его бистриметилсилильное производное, проведение реакций анионного гликозилирования соли гетерооснования 2 1-бромпроизводным сахара 1 при комнатной температуре в отличие от прототипа (кипячение в ксилоле или бензоле) с высоким выходом и высокой стереоизбирательностью. На конечной стадии - превращение промежуточного -нуклеозида 3 ( 1 экв.) в 2 Ара-Г (5) проводят с 4 экв. метилата натрия в метаноле в присутствии 4,1 экв. меркаптоэтанола в сравнении с прототипом 2. Использование легкодоступных реагентов (ацетат натрия, уксусный ангидрид и уксусная кислота) в альтернативном методе получения из соединения 3 промежуточного гуанинового нуклеозида и аммиака в метаноле при комнатной температуре для его децилирования обеспечивает также высокий суммарный выход трехстадийного заявляемого способа получения целевого фторнуклеозида. Заявляемый способ позволяет получать 9-(2-дезокси-2-фторарабинофуранозил)гуанин из 1-бромпроизводного сахара и 2-амино-6-хлорпурина в две или три стадии с высоким суммарным выходом 44-51 в сравнении с прототипом, использование хроматографии на силикагеле , содержащем 20 воды, упрощает выделение чистого конечного продукта. Способ получения 9-(2-дезокси-2-фторарабинофуранозил)гуананина (5) приведен в примерах. Примеры. 1. Получение 9-(2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил)-2-амино-6-хлорпурина(3) из 2-дезокси-2-фтор-3,5-дибензоиларабинофуранозил бромида (1). А) К 0,21 г (1,24 ммоль) 2-амино-6-хлорпурина в 40 мл 1,2-диметоксиэтана добавляют 0,14 г (1,24 ммоль) трет-бутилата калия. Полученный раствор перемешивают в атмосфере азота 40 мин при комнатной температуре и упаривают досуха. К калиевой соли 2-амино-6 хлорпурина (2) добавляют 40 мл безводного ацетонитрила и перемешивают 20 мин при комнатной температуре, а затем добавляют по каплям раствор 0,35 г (0,82 ммоль) бромсахара 1 в 20 мл ацетонитрила и реакционную смесь перемешивают 5 ч в атмосфере азота при комнатной температуре. Осадок отфильтровывают и промывают 30 мл безводного ацетонитрила, фильтрат упаривают досуха. Остаток растворяют в безводном хлористом метилене, фильтруют. Маслообразный остаток после упаривания фильтрата хроматографируют на силикагеле 60 (70-230 меш, Мерк, Германия), используя для элюции смесь петролейный эфир-этилацетат 21 и 11. Получают 0,025 г (6 ) -нуклеозида 4 в виде пены. 1 ЯМР (3) 8.02 с (1, -8), 7.39-8.11 м (10, 2 ), 6.40 д (1, 1,21.0 гц,1,14.2 гц, -1), 6.10 д (1, 2,48.5 гц, -2), 5.76 дд (1, 3,21.62 Гц, 3,16.6 гц, -3), 5.08 уш.с (2, 2), 4.92 м (1, -4), 4.71 д (2, -5 и -5). 19 ЯМР (3) 188.0 (дт, -2). /-, / 562, (1). УФмакс 223 нм ( 15500),макс 308 нм ( 5600). 0,25 г (61 ) -нуклеозида 3. Т.пл. 89-93 С . 1 ЯМР (3) 8.03 д (1, 8,2.7 гц, -8), 7.43-8.09 м (10, 2 ), 6.45 дд (1, 1,22.38 гц 1,22.3 гц, -1),6 18121 1 2014.04.30 5.76 дд (1, 3,22.23 Гц, 3,16.7 гц, -3), 5.33 ддд (1, 2,49.9 гц, -2), 5.19 уш.с (2, 2), 4.81 дд (1, 5,47.9 Гц, 5,512.1 Гц, -5), 4.78 дд (1, 5,45.13 Гц,-5), 4.57 м (1, -4). 13 ЯМР (3) 166.30 и 165.23 2 с (65), 159.25, 153.38,151.79, 141.42 (д, -8,6.86 гц, С-8), 134.33, 134.56, 129.6, 129.2, 128.8, 128.7, 128.6, 92.68 д (-2, 2,2192.85 гц), 83.50 д (-1, 1,217.0 гц), 81.14 с (-4), 76.89 д (-3,3,230.0 гц), 63.34 с (-5). 19 ЯМР (3) -198.15 (дт, -2). /-, / 512, (1). УФмакс 223 нм ( 15600), макс 308 нм ( 5750). Б) К 0,21 г (1,24 ммоль) 2-амино-6-хлорпурина в 40 мл 1,2-диметоксиэтана добавляют 0,14 г (1,24 ммоль) трет-бутилата калия. Полученный раствор перемешивают в атмосфере азота 40 минут при комнатной температуре и упаривают досуха. К калиевой соли 2-амино-6-хлорпурина (2) добавляют 25 мл безводного ацетонитрила, а затем добавляют по каплям раствор 0,35 г (0,82 ммоль) бромсахара 1 в 20 мл безводного дихлорэтана и реакционную смесь перемешивают 18 ч в атмосфере азота при комнатной температуре. Осадок отфильтровывают и промывают 30 мл безводного ацетонитрила, фильтрат упаривают досуха. Остаток растворяют в 80 мл хлористого метилена, промывают 25 мл воды, органический слой сушат над безводным сульфатом натрия. Маслообразный остаток после упаривания хроматографируют на силикагеле 60 (70-230 меш, Мерк, Германия), используя для элюции смесь петролейный эфир-этилацетат 21 и 11. Получают 0,29 г (71 )-нуклеозида 3 и 0,02 г (5 ) -нуклеозида 4 в виде пены. 2. Получение 9-(2-дезокси-2-фторарабинофуранозил)гуанина (5) из 9-(2-дезокси 2-фтор-3,5-дибензоиларабинофуранозил)-2-амино-6-хлорпурина (3). А) К раствору 0,16 г (0,325 ммоль) нуклеозида 3 в 17 мл безводного метанола добавляют 0,095 мл (1,35 ммоль) меркаптоэтанола и 4,65 мл 0,28 м раствора метилата натрия в метаноле. Реакционную смесь кипятят при перемешивании 5 ч и после охлаждения нейтрализуют 1 м водным раствором . Продукт выделяют на силикагеле , содержащем 20 воды, используя для элюции метанол. Белый аморфный осадок (0,125 г) промывают смесью эфир-гексан (11) и ацетоном, кристаллизуют из воды и получают 0,07 г(2, -5 и -5). 19 ЯМР (-6) -198.45 (дт, -2). /-, / 285,(М 1). УФ (2) макс 253 нм ( 12200). Б) Раствор 0,16 г (0,325 ммоль) нуклеозида 3 и 0,133 г (1,62 ммоль) ацетата натрия в 2,7 мл уксусного ангидрида и 2,7 мл уксусной кислоты перемешивают при 120 С в течение 5 ч. К реакционной смеси после охлаждения добавляют 10 мл безводного метанола и упаривают. Остаток растворяют в смеси 100 мл хлороформа и 30 мл воды, органический слой отделяют, промывают насыщенным раствором бикарбоната и сушат над безводным сульфатом натрия. После упаривания маслообразный продукт растворяют в 10 мл метанола, насыщенного сухим аммиаком при 0 С, и перемешивают 48 ч при комнатной температуре. Реакционную смесь упаривают и хроматографируют на силикагеле ,содержащем 20 воды, используя для элюции смесь хлороформ-метанол (111) и метанол. Белый аморфный продукт промывают смесью эфир-гексан (15 мл, 11) и получают 0,065 г (70 ) нуклеозида 5. Источники информации 1. Патент США 4,918,179, МПК 07 19/173. 2., - .,.-.,.-.,,, // . . . - 1989. - . 37. - . 336-339. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: C07H 19/19
Метки: способ, 9-(2-дезокси-2-фтор-?-d-арабинофуранозил, получения, варианты, гуанина
Код ссылки
<a href="https://by.patents.su/8-18121-sposob-polucheniya-9-2-dezoksi-2-ftor-d-arabinofuranozil-guanina-varianty.html" rel="bookmark" title="База патентов Беларуси">Способ получения 9-(2-дезокси-2-фтор-?-D-арабинофуранозил) гуанина (варианты)</a>
Предыдущий патент: Способ получения 9-(2-дезокси-2-фтор-?-D-арабинофуранозил)аденина
Следующий патент: Система доставки стент-графта
Случайный патент: Способ разжижения нефти и удаления асфальто-смоло-парафиновых отложений в нефтедобывающих скважинах