Брассиностероидные эфиры индолил-3-уксусной кислоты, проявляющие фиторостостимулирующую активность, и способ их получения
Номер патента: 14986
Опубликовано: 30.10.2011
Авторы: Минин Павел Сергеевич, Аникеев Владимир Иванович, Литвиновская Раиса Павловна, Хрипач Владимир Александрович, Райман Михаил Эдуардович
Текст
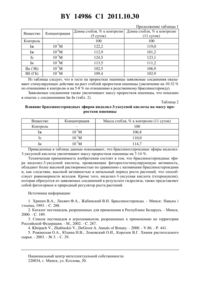
(51) МПК НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ(71) Заявитель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(72) Авторы Хрипач Владимир Александрович Литвиновская Раиса Павловна Райман Михаил Эдуардович Минин Павел Сергеевич Аникеев Владимир Иванович(73) Патентообладатель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(57) 1. Брассиностероидные эфиры индолил-3-уксусной кислоты общей формулы гдеозначает 24-, 1 - 2, 2 - , 3 - ,- 2, илиозначает 24-, 1 - 2, 2 - , 3 - 2,- 2, илиозначает 24-, 1 - 2, 2 - , 3 - ,- 2, илиозначает 24-, 1 - 2, 2 - , 3 - 2,- 2, илиозначает 24-, 1 - 2, 2 - , 3 - ,- 2, илиозначает 24-, 1 - 2, 2 - , 3 - 2,- О 2, илиозначает 24-, 1 -2, 2 - , 3 - ,- 2, илиозначает 24-, 1 - 2, 2 - , 3 - 2,- 2, илиозначает 24-, 1 и 2 означают , 3 - 2,- 2, 2,проявляющие фиторостостимулирующую активность. 2. Способ получения брассиностероидных эфиров индолил-3-уксусной кислоты по п. 1, при котором брассиностероиды общей формулы гдеозначает 24-, 1 - ,- 2, илиозначает 24-, 1 - ,- 2, илиозначает 24-, 1 - ,- 2, илиозначает 24-, 1 - ,- 2, илиозначает 24-, 1 - ,- 2, 2,подвергают взаимодействию с ангидридом индолил-3-уксусной кислоты в диоксане, с последующим выделением целевого продукта. Изобретение относится к области биоорганической химии и сельского хозяйства, в частности, к новым химическим соединениям, а именно брассиностероидным эфирам индолил-3-уксусной кислоты (2) общей формулы 3 где 24-, 12, 2, 3,2 (а)24-, 12, 2, 32,2 (б)24-, 12, 2, 3,2 (в)24-, 12, 2, 32,2 (г)24-, 12, 2, 3,2 (д)24-, 12, 2, 32,2 (е)24-, 12, 2, 3,2 (ж)24-, 12, 2, 32,2 (з)24-, 12, 32,2, 2 (и),проявляющим фиторостостимулирующую активность. Известны природные фиторостостимуляторы - брассиностероиды 1, среди которых наиболее применяемыми в сельском хозяйстве являются 24-эпибрассинолид (ЭБ) (а) и 28-гомобрассинолид (ГБ) (б), представляющие собой, в частности, действующее начало препаратов Эпин и Эпин-плюс 2-4. Задача изобретения - новые фиторостостимуляторы, обладающие более высокой активностью по сравнению с нативными брассиностероидами, и способ их получения. Поставленная цель достигается брассиностероидными эфирами индолил-3-уксусной кислоты общей формулыи способом их получения. Заявляемые соединенияполучают из известных природных брассиностероидовобработкой ангидридом индолилуксусной кислоты в диоксане с последующим выделением целевого продукта. 24-, 1,2 (а)24-, 1,2 (б)24-, 1,2 (в)24-, 1,2 (г)24-, 1,2, 2 (д). Исследование заявляемых соединений в тесте на проростках пшеницы по методике 5 показало, что они оказывают стимулирующее действие как на длину стебля (превосходит на 10-15 стимулирующее действие, вызываемое соответствующим брассиностероидом),так и на массу растения (превосходит на 12-17 ). Заявляемые брассиностероидные эфиры индолил-3-уксусной кислоты неизвестны и в реакциях с брассиностероидами индолил-3-уксусная кислота и ее производные не использовались и не изучались. Сущность изобретения подтверждается примерами конкретного выполнения. Пример 1. Синтез (22,23,24)-3,22,23-Тригидрокси-2-(3-индолилацетокси)-24-метил-5 холестан-6-она . К 25 мг (0,15 ммоль) индолилуксусной кислоты в 2 мл безводного диоксана добавляют 125 мг дициклогексилкарбодиимида и перемешивают в течение 30 мин при комнатной температуре. Выпавший осадок дициклогексилкарбомочевины отфильтровывают, фильтрат добавляют к раствору 50 мг (0,11 ммоль) 24-эпикастастерона (в) и 5 мг диметиламинопиридина в 2 мл безводного диоксана. Реакционную смесь оставляют перемешиваться на 5 ч при 40 С, затем диоксан упаривают и остаток делят на колонке с силикагелем (элюент-петролейный эфир-этилацетат, 11). Получают 50 мг (79 ) 3-индолилацетоксипроизводного (а). Т. пл. 110-115 С, 604-2, 429-, 4112. Пример 2. Синтез (22,23,24)-3,23-Дигидрокси-2,22-ди-(3-индолилацетокси)-24-метил-5 холестан-6-она (б). К 40 мг (0,25 ммоль) индолилуксусной кислоты в 2 мл сухого диоксана добавляют 30 мг дициклогексилкарбодиимида и перемешивают в течение 1 ч при комнатной температуре. Выпавший осадок дициклогексилкарбомочевины отфильтровывают, фильтрат добавляют к раствору 26 мг (0,06 ммоль) 24-эпикастастерона (в) и 2,55 мг диметиламинопиридина в 1 мл безводного диоксана. Реакционную смесь оставляют перемешиваться на сутки при 40 С, затем диоксан упаривают и остаток делят на колонке с силикагелем (элюентпетролейный эфир-этилацетат, 11). Получают 30 мг (70 ) 2,22-диэфира (б). Т.пл. 1183(22,23,24)-3,22,23-Дигидрокси-2-(3-индолилацетокси)-24-метил-гомо-7-окса-5-холестан-6-она (в). По методике, описанной для соединения а, из 50 мг (0,11 ммоль) 24-эпибрассинолида(3, 19-), 0.86-0.92 м(6, 21-, 26-), 0.97 д(3, 27-.7 Гц), 1.01 д(3, 29-,7 Гц),3.44 м(1, (22, 3.69 м(1, (с 23, 3.83 м(2, -2-), 3.98 (1, 3), 4.85 м(1, 2), 7.137.21 м(3), 7.38 д(1,8 Гц). 7.62 д(2,8 Гц), 8.51 (1, ). Пример 4. Синтез (22,23,24)-3,23-Дигидрокси-2,22-ди-(3-индолилацетокси)-24-метил-гомо-7-окса-5-холестан-6-она (г). По методике, описанной для соединения б, из 50 мг (0,11 ммоль) 24-эпибрассинолида(2, ). Масс спектр, /829, 795, 777-2, 620-, 445-2. Пример 5. Синтез (22,23,24)-3,22,23-Тригидрокси-2-(3-индолилацетокси)-24-этил-5-холестан-6-она (д). По методике, описанной для соединения а, из 100 мг (0.21 моль) 28-гомокастастерона(г) получают 78 мг (58 ) стероида (д). Т.пл. 110-113 С . УФ спектр нм 220(27160), 280(5693). ИК спектр (пленка, см-1)3400, 1720, 1710, 1260, 745. Спектр ЯМР 1, , м.д.(3) 0.66 (3, 18-), 0.78 (3, 19-), 0.91 д(3, 21-,7 Гц),0.95-0.98 м(9, 26-, 27-, 29-), 3.58 м(1, 22), 3.71 м(1, 23), 3.79 дд(2, -2-1 11 Гц, 2 11,7 Гц), 3.99 (1, 3), 4.92 м(1, 2), 7.16 м(2), 7.19 м(1), 7.38 д(1,7.8 Гц),7.62 д(1,7.7 Гц), 8.25 (1). Пример 6. Синтез (22,23,24)-3,23-Дигидрокси-2,22-ди-(3-индолилацетокси)-24-этил-5 холестан-6-она (е). По методике, описанной для соединения б, из 100 мг (0.21 моль) 28-гомокастастерона(3, 19-), 0.91 д(3, 21-,7 Гц), 0.95-0.98 м(9, 26-, 27-, 29-), 3.71 м(1, 23),3.80 м(4, -2-), 3.99 (1, 3), 4.92 м(1, 2), 5.13 д(1, 22,8 Гц), 7.16-7.23 м(6),7.38 м (2), 7.62 м(2), 8.25 м(2). Пример 7. Синтез (22,23,24)-3,22,23-Тригидрокси-2-(3-индолилацетокси)гомо-7-окса 24-этил-5-холест-6-она (ж). По методике, описанной для соединения а, из 100 мг (0,2 ммоль) 28 гомобрассинолида б получают 26 мг (20 ) моноэфира ж. Т.пл. 80-82 С . УФ спектр, , нм 220(24368), 280(4526). ИК спектр (пленка), см-13400, 1715, 1635, 760. Спектр ЯМР 1, , м.д.(3) 0.68 (3, 18-), 0.89 д(3, 21-,6.3 Гц), 0,92 (3,19-), 0.94-0.98 м(9, 26-, 27-, 29-), 3.58 м(1, 22), 3.72 м(1, 23), 3.80 д(2 Н, 2-,7 Гц), 3.98 м(1, 3), 4.02 м(2, 7), 4.84 м(1, 2), 7.16-7.19 м(3), 7.37 4(22,23,24)-3,23-Дигидрокси-2,22-ди(3-индолилацетокси)гомо-7 окса-24-этил-5-холест-6-она (з). По методике, описанной для соединения 1, из 100 мг (0.2 ммоль) 28 гомобрассинолида б получают 70 мг (44 ) эфира з. Т.пл. 122-125 С . УФ спектр, , нм 220(25555), 280(10476). Спектр ЯМР 1, , м.д.(3)0.60 (3, 18), 0.72 (3, 19-), 0.85 д(3, 21-,6.3 Гц), 0.93-0.97 м(9, 26-, 27-, 29-), 3.66 м(1, 23), 3.72 м(4, -2-), 3.81 м(2, 7), 3.92 м(1, 3), 4.76 м (1, 2), 5.23 м(1, 22), 7.16 м(2), 7.19 м(4), 7.37 м(2), 7.60 м(2), 8.58 (2, 2). Масс спектр,/808.08 , 790.94 -2, 772.97 -22, 692.91 -, 616.00 -2, 598.03 22, 460 -2, 441.11 -2-2. Пример 9. Синтез (22,23,24)-23-Гидрокси-22-(3-индолилацетокси)-24-этил-5-холест-2-ен 6-она (и). По методике, описанной для соединения а, из 200 мг (0.45 ммоль) секастерона д получают 90 мг (33 ) эфира и. Маслообразное вещество. ИК спектр (пленка), см-13400,1710, 1260, 755. Спектр ЯМР 1, , м.д.(3)0.53 (3, 18-), 0.67 (3, 19-), 0.83 д(3, 21-,6.6 Гц), 0.91-0.97 м (9, 26-, 27-, 29-), 3.83 д(2, -2-,7 Гц), 3.86 м(1, 23), 4.98 д(1, 22,9 Гц), 5.60 м(1, 2), 5.71 м(1, 3), 7.17 м(1), 7.19 м(2), 7.33 д(1,8.3 Гц), 7.67 д(1,7.7 Гц), 8.44 (1, ). Спектр ЯМР 13 ,м.д.(3)11.5, 12.1, 12.7, 13.6, 18.8, 19.4, 21.1, 21.3, 21.8, 23.6, 27.8, 28.9, 32.3, 36.9, 37.6,38.9, 39.5, 40.0, 42.1, 42.7, 46.6, 46.8, 51.9, 53.1, 53.9, 55.7, 56.7, 72.0, 78.7,111.4, 119.1,119.8, 122.3, 123.5, 124.6, 125.1, 127.3, 173.4, 212.3. Результаты исследований биологической активности заявляемых соединений приведены в примере 10. Пример 10. Исследование биологической активности заявляемых соединений проводили в лабораторных условиях на растениях пшеницы сорта Каравай по методике 5. Зерна пшеницы замачивают в растворах производных брассиностероидов с концентрацией 110-7 моль/л в течение суток, затем располагают в ряд на фильтровальной бумаге и свертывают в рулоны. Рулоны помещают в чистую воду и проращивают первые три дня в темноте, затем на свету. Далее осуществляют замеры длины стебля проростков пшеницы и массу проростков на пятые и одиннадцатые сутки. Полученные данные приведены в табл. 1. Таблица 1 Влияние брассиностероидных эфиров индолил-3-уксусной кислоты на длину стеблей проростков пшеницы Длина стебля,к контролю Длина стебля,к контролю Вещество Концентрация-7 б (ГБ) 10109,4 102,9 Из таблицы следует, что в тесте на проростках пшеницы заявляемые соединения оказывают стимулирующее действие на рост стеблей проростков пшеницы (увеличение на 10-32 по отношению к контролю и на 5-8 по отношению к родственному брассиностероиду). Заявляемые соединения также увеличивают массу проростков пшеницы, что показано в опытах с соединениями ж-и (табл. 2). Таблица 2 Влияние брассиностероидных эфиров индолил-3-уксусной кислоты на массу проростков пшеницы Вещество Концентрация Масса стебля,к контролю (11 суток) Контроль 100-7 и 10114,7 Приведенные в таблице данные показывают, что брассиностероидные эфиры индолил 3-уксусной кислоты увеличивают массу проростков пшеницы на 7-14 . Техническая применимость изобретения состоит в том, что брассиностероидные эфира индолил-3-уксусной кислоты, проявляющие фиторостостимулирующую активность,обладают более высокой растворимостью по сравнению с нативными брассиностероидами и, как следствие, высокой активностью в начальный период роста растений, что способствует равномерности всходов. Кроме того, индолил-3-уксусная кислота (гетероауксин),которая образуется из заявляемых соединений в результате гидролиза, также представляет собой фитогормон и природный регулятор роста растений. Источники информации 1. Хрипач В.А., Лахвич Ф.А., Жабинский В.Н. Брассиностероиды. - Минск Навукатэхнка, 1993. - . 288. 2. Каталог пестицидов, разрешенных для применения в Республике Беларусь. - Минск,2000. - . 189. 3. Список пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. - М., 2002. - . 287. 4..,.,.. - 2000. - .86. - . 441. 5. Рожанская О.А., Юдина Н.В., Ломовский О.И., Королев В.Г. Химия растительного сырья. - 2003. -3. - С. 29. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 6
МПК / Метки
МПК: C07J 43/00, C07J 73/00, A01P 21/00
Метки: способ, брассиностероидные, фиторостостимулирующую, кислоты, индолил-3-уксусной, проявляющие, получения, активность, эфиры
Код ссылки
<a href="https://by.patents.su/6-14986-brassinosteroidnye-efiry-indolil-3-uksusnojj-kisloty-proyavlyayushhie-fitorostostimuliruyushhuyu-aktivnost-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Беларуси">Брассиностероидные эфиры индолил-3-уксусной кислоты, проявляющие фиторостостимулирующую активность, и способ их получения</a>
Предыдущий патент: Способ хирургического лечения дистрофического заболевания сетчатки глаза и зрительного нерва
Следующий патент: Способ производства сырокопченой колбасы
Случайный патент: Трансформатор высокого напряжения