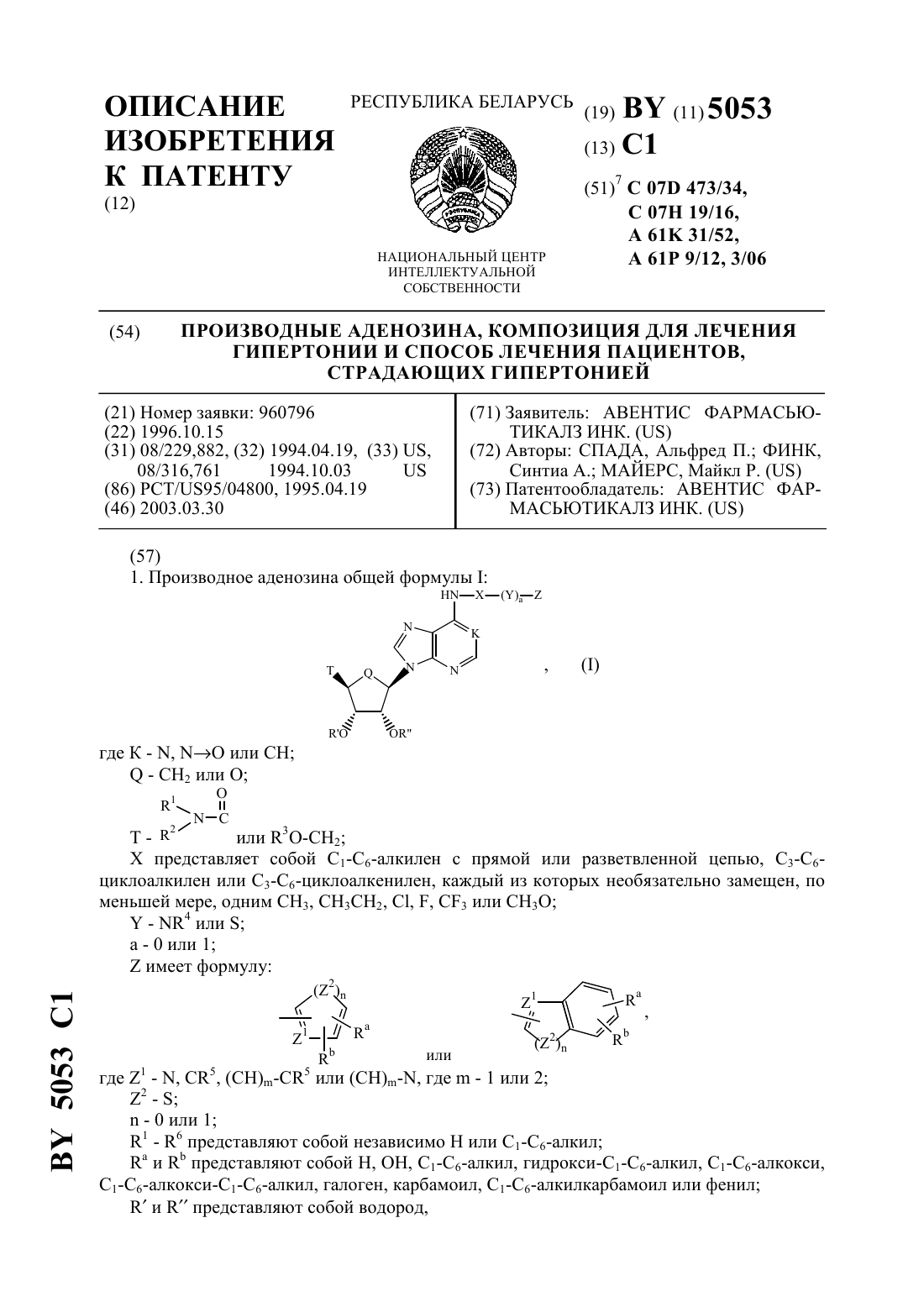
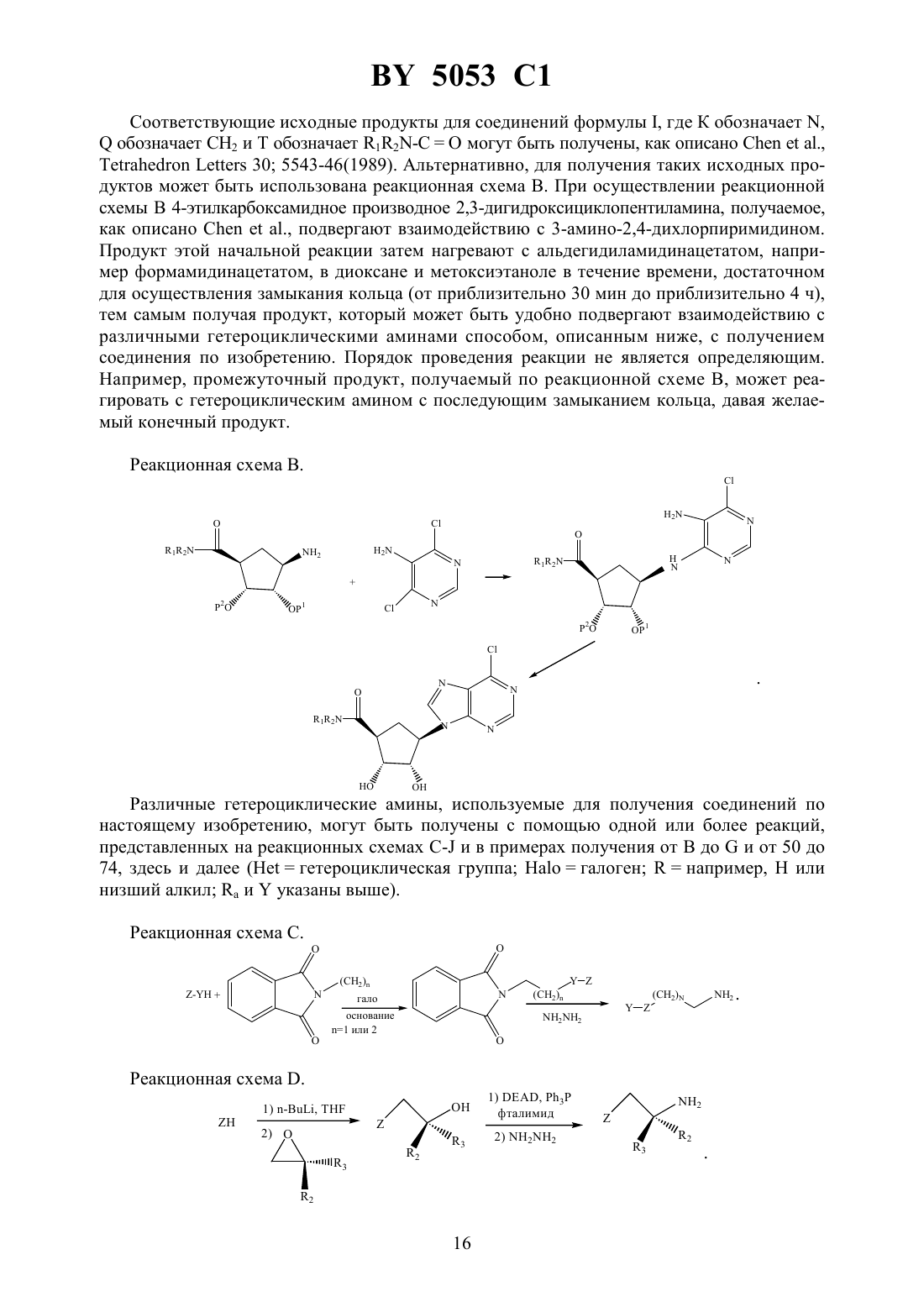
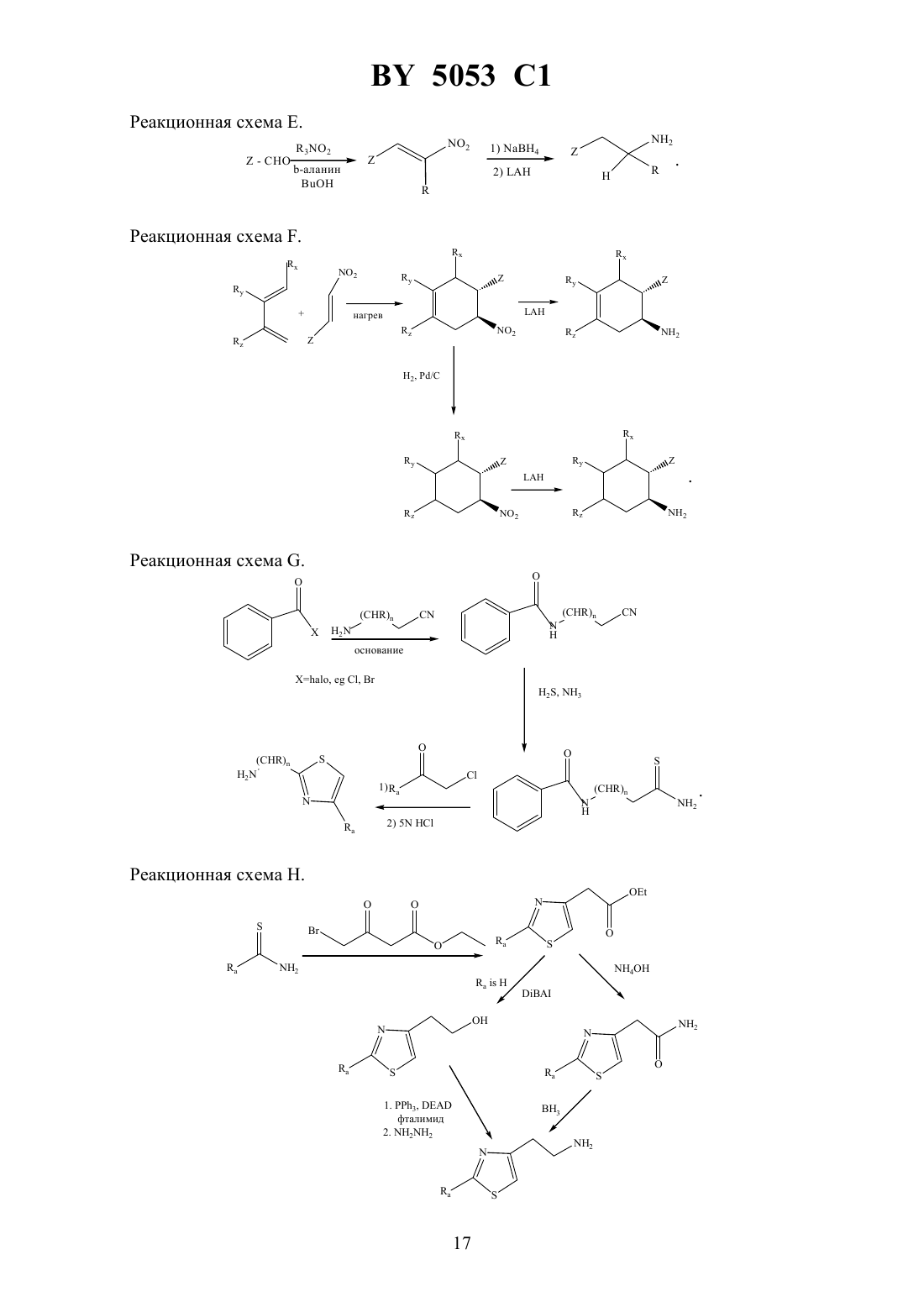
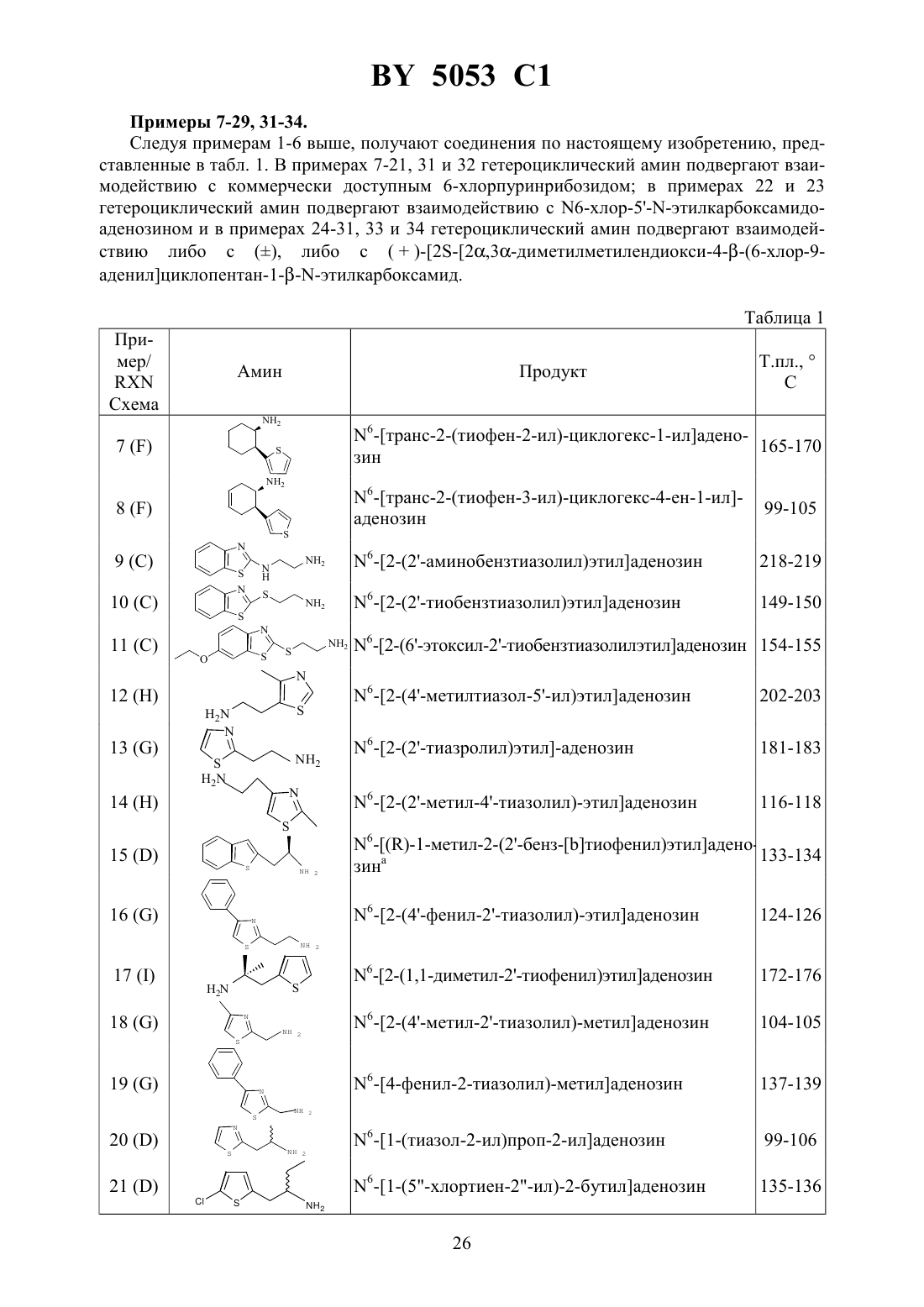
Производные аденозина, композиция для лечения гипертонии и способ лечения пациентов, страдающих гипертонией
Номер патента: 5053
Опубликовано: 30.03.2003
Авторы: СПАДА, Альфред П., МАЙЕРС, Майкл Р., ФИНК, Синтиа А.
Текст
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ПРОИЗВОДНЫЕ АДЕНОЗИНА, КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ГИПЕРТОНИИ И СПОСОБ ЛЕЧЕНИЯ ПАЦИЕНТОВ,СТРАДАЮЩИХ ГИПЕРТОНИЕЙ(71) Заявитель АВЕНТИС ФАРМАСЬЮТИКАЛЗ ИНК.(73) Патентообладатель АВЕНТИС ФАРМАСЬЮТИКАЛЗ ИНК.(57) 1. Производное аденозина общей формулы или 3-2 Т-Х представляет собой С 1-С 6-алкилен с прямой или разветвленной цепью, С 3-С 6 циклоалкилен или С 3-С 6-циклоалкенилен, каждый из которых необязательно замещен, по меньшей мере, одним СН 3, СН 3 СН 2, , , 3 или СН 3- 4 илиа - 0 или 1 имеет формулу где 1 - , 5, -5 или -, где- 1 или 2 2 -- 0 или 1 1 - 6 представляют собой независимо Н или С 1-С 6-алкилипредставляют собой Н, ОН, С 1-С 6-алкил, гидрокси-С 1-С 6-алкил, С 1-С 6-алкокси,С 1-С 6-алкокси-С 1-С 6-алкил, галоген, карбамоил, С 1-С 6-алкилкарбамоил или фенилипредставляют собой водород,5053 1 при условии, что, когда Х обозначает С 1-С 6-алкилен с прямой цепью и- , тогдапредставляет гетероциклил, содержащий, по крайней мере, два гетероатома,или его фармацевтически приемлемая соль. 2. Соединение по п. 1, где Х обозначает С 1-С 6-алкилен, необязательно замещенный, по меньшей мере, одним СН 3, СН 3 СН 2, С, , 3 или СН 3. 3. Соединение по п. 1, гдеобозначает, где,иимеют значения, указанные выше. 4. Соединение по п. 3, где Х обозначает -С 9-С 2-алкилен, где 9 - водород, С 1-С 6 алкил, галоген, галоген-С 1-С 6-алкил или С 1-С 6-алкокси. 5. Соединение по п. 1, гдеобозначает замещенный или незамещенный тиазолил или бензтиазолил. 6. Соединение по п. 5, где атом углерода алкиленовой группы, к которому присоединен 9, является хиральным центром. 7. Соединение по п. 6, где 9 - метил или этил. 8. Соединение по п. 6, где указанный хиральный центр имеет, по существу, исключительно -конфигурацию. 9. Соединение по п. 1, где К - ,- СН 2 и Т - 12-. 10. Соединение по п. 1, где К - СН,- СН 2 и Т - 12-. 11. Соединение по п. 1, представляющее собой 6-транс-2-(тиофен-2-ил)циклогекс-4-ен-1-иладенозин,6-транс-2-(тиофен-3-ил)циклогекс-4-ен-1-иладенозин,6-2-(2-аминобензтиазолил)этиладенозин,6-2-(2-тиобензтиазолил)этиладенозин,6-2-(6-этокси-2-тиобензтиазолил)этиладенозин,6-2-(4-метилтиазол-5-ил)этиладенозин,6-2-(2-тиазолил)этиладенозин,6-2-(4-фенил-2-тиазолил)этиладенозин,6-2-(4-фенил-2-тиазолил)метиладенозин,6-2-(2-метил-4-тиазолил)этиладенозин,61-метил-2-(2-бензтиофенил)этиладенозин или(-)-2-2,3-дигидрокси-4-6-2-(3-хлор-2-тиенил)-(1)-этилэтиламино-9-аденилциклопентан-1-этилкарбоксамид,или его фармацевтически приемлемая соль. 12. Соединение по п. 1, представляющее собой 6-транс-2-(тиофен-2-ил)циклогекс-4-ен-1-иладенозин-5 этилкарбоксамид или 6-2-(2-аминобензтиазолил)этиладенозин-5 этилкарбоксамид,или его фармацевтически приемлемая соль. 13. Соединение по п. 1, представляющее собой 6-2-(4-метил-5-тиазолил)этилкарбоциклический аденозин-5 этилкарбоксамид,6-2-(2-аминобензтиазолил)этилкарбоциклический аденозин-5 этилкарбоксамид,6-2-(2-тиазолил)этилкарбоциклический аденозин-5 этилкарбоксамид,(-)-2-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-1-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамид,6-1-тиофен-2-ил)этан-2-илкарбоциклический аденозин-5 этилкарбоксамид,6-1-(тиофен-3-ил)этан-2-илкарбоциклический аденозин-5 этилкарбоксамид или 61-тиофен-2-ил)проп-2-ил)карбоциклический аденозин-5 этилкарбоксамид,или его фармацевтически приемлемая соль. 2 5053 1 14. Соединение по п. 1, представляющее собой (-)-2-2,3-дигидрокси-4-6-2(5-хлор-2-тиенил)-1-1-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамид,или его фармацевтически приемлемая соль. 15. Соединение по п. 1, представляющее собой-6-1-(тиофен-2-ил)этан-2-илдеазааристеромицин-5 этилкарбоксамид,1-1,2,3,4-4-7-2-(5-хлор-2-тиенил)-1-метил-этиламино-3 Н-имидазо 4,5 пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид,1-1,2,3,4-4-7-2-(3-хлор-2-тиенил)-1-этилэтиламино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид,1-1,2,3,4-4-7-2-(2-тиенил)-1-изопропилэтиламино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид,1-1,2,3,4-4-7-2-(3-хлор-2-тиенил)-1-этилэтиламино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид,1-1,2,3,4-4-7-2-(2-тиенил)-1-метилэтиламино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид или 1-1,2,3,4-4-7-2-(5-хлор-2-тиенил)-1-этилэтиламино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид,или его фармацевтически приемлемая соль. 16. Соединение по п. 15, представляющее собой 1-1,2,3,4-4-7-2-(3 хлор-2-тиенил)-1-этилэтиламино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид, или его фармацевтически приемлемая соль. 17. Соединение по п. 1, представляющее собой (2)-2,3-дигидрокси-4-6-2-(5 хлор-2-тиенил)-(1)-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамид-1 оксид, или его фармацевтически приемлемая соль. 18. Соединение по п. 1, представляющее собой 6-2-(3-хлор-2-тиенил)-(1)-1-метилэтил-2-О-метиладенозин,6-2-(5-хлор-2-тиенил)-(1)-1-метилэтил-2 метиладенозин или 6-транс-5-(2-тиенил)циклогекс-1-ен-4-ил-2 метиладенозин,или его фармацевтически приемлемая соль. 19. Соединение по п. 1, представляющее собой(2)-2,3-дигидки-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамид-2,3-тиокарбонат,или его фармацевтически приемлемая соль. 20. Композиция для лечения гипертонии и для уменьшения уровня липидов, триглицеридов или холестерина у млекопитающих, содержащая соединение по п. 1 в эффективном количестве и фармацевтически приемлемый носитель. 21. Композиция по п. 20, отличающаяся тем, что она предназначена для лечения гипертонии и содержит противогипертонически эффективное количество соединения по п. 1. 22. Композиция по п. 21, отличающаяся тем, что она содержит (-)-(2)-2,3-дигидки-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан-1-этилкарбоксамид или его фармацевтически приемлемую соль. 3 5053 1 23. Композиция по п. 21, отличающаяся тем, что она содержит 1-1,2,3,44-7-2-(3-хлор-2-тиенил)-1-этилэтиламино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3 дигидроксициклопентанкарбоксамид или его фармацевтически приемлемую соль. 24. Композиция по п. 20, отличающаяся тем, что она предназначена для уменьшения уровня липидов, триглицеридов или холестерина у млекопитающих и содержит противолиполитическое количество соединения по п. 1. 25. Способ лечения пациента, страдающего гипертонией, отличающийся тем, что указанному пациенту вводят эффективное для понижения кровяного давления количество соединения по п. 1. 26. Способ по п. 25, отличающийся тем, что вводимое соединение представляет собой (-)-(2)-2,3-дигидки-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамид или его фармацевтически приемлемую соль. 27. Способ по п. 25, отличающийся тем, что вводимое соединение представляет собой 1-1,2,3,4-4-7-2-(3-хлор-2-тиенил)-1-этилэтиламино-3 Н-имидазо 4,5 пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид или его фармацевтически приемлемую соль.(56)4 600 707 , 1986.5 130 731 , 1994. Эта заявка является продолжением заявки, находящейся на рассмотрении на патент США серийный номер 08/316761, поданной 3 октября 1996, которая является частичным продолжением заявки на патент США серийный номер 08/229882, поданной 19 апреля 1994, в настоящее время отозванной, которая является частичным продолжением заявки на патент США. серийный номер 07/955783, поданной 2 октября 1992, в настоящее время патент США 5364562, выданный 15 ноября 1994, которая является частичным продолжением заявки на патент США серийный номер 07/587884, поданной 25 сентября 1990, в настоящее время отозванной. Настоящее изобретение относится к соединениям - производным аденозина и его аналогам, к фармацевтическим композициям, содержащим такие соединения, к их использованию при лечении гипертонии и ишемии миокарда, к их использованию в качестве кардиозащитных средств, которые уменьшают ишемическое поражение или размер инфаркта миокарда, вызванного ишемией миокарда, и к их использованию в качестве противолиполитических средств, которые понижают уровни липидов в плазме крови, уровни сывороточных триглицеридов и уровни холестерина в плазме крови, и к способам и промежуточным соединениям, используемым при получении таких соединений. Гипертония. Гипертонией, состоянием повышенного кровяного давления, страдает большое количество людей. Последствия хронической гипертонии включают поражение сосудов в зрительной, почечной, сердечной, церебральной системах, и риск этих осложнений возрастает вместе с ростом кровяного давления. Основными факторами, контролирующими кровяное давление, являются работа сердечной мышцы и сопротивление периферических сосудов, при этом последнее является доминирующим обычным механизмом, который контролируется с помощью различных факторов. Симпатическая нервная система регулирует сопротивление периферических сосудов посредством прямого влияния альфа- и бета-адренергических рецепторов, а также с помощью опосредованного влияния на выделение ренина. Лекарственная терапия влияет на различные компоненты этих систем регулирования кровяного давления при различных механизмах действия, определяющих 4 5053 1 различные классы лекарств, включая диуретики, антагонисты бета-адренергических рецепторов (бета-блокаторы), ингибиторы ангеотензин-преобразующего фермента (АКФ) и антагонисты кальциевых каналов. Диуретики типа тиазида используются при гипертонии для снижения сопротивления периферических сосудов посредством их влияния на экстракцию натрия и воды. Этот класс лекарств включает гидрохлортиазид, хлортиазид, метилциклотиазид и циклотиазид, а также родственные средства индапамид, метолазон и хлорталидон. Хотя механизм действия бета-блокаторов, как предположено, является блокадой подтипа бета 1-адренергического рецептора в сердце для уменьшения скорости сердцебиения и работы сердечной мышцы,недавно установлено, что бета-блокаторы с присущей симпатомиметической активностью- , включая пиндолол, ацебутолол, пенбутолол и картеолол, являются такими же эффективными, как и не- бета-блокаторы, вызывающие меньшее снижение частоты сердцебиения и работы сердечной мышцы. Другие установленные механизмы для этих лекарств включают ингибирование выделение ренина,центральное влияние и влияние на пре-синаптические бета-адренергические рецепторы,проявляющиеся в ингибировании выделения норэпинефрина. Кардиоселективные бетаблокаторы метопролол ( - ), ацебутолол ( - ) и атенолол ( - ) в малых дозах оказывают более сильное действие на бета 1-адренергические рецепторы, чем на подтипы бета 2-адренергических рецепторов, расположенных в бронхах и в кровеносных сосудах. Неселективные бета-блокаторы действуют на оба подтипа бетаадренергических рецепторов и включают пропранолол ( - ), тимолол ( - ), надолол ( - ), пиндолол (-), пенбутолол ( -- ) и картеолол ( -). Отрицательные эффекты бетаблокаторов включают асимптоматическую брадикардию, обострение хронической сердечной недостаточности, желудочно-кишечные расстройства, повышенную резистантность дыхательных путей, скрытые симптомы гипогликемии и депрессию. Они могут вызвать повышение уровня триглицеридов и могут понизить уровень холестерина с липопротеинами высокой плотности. Ингибиторы АКФ предотвращают образование ангиотензинаи ингибируют распад брадикинина. Ангиотензинявляется сильнодействующим сосудосуживающим средством,а также стимулирует секрецию альдестерона. Блокируя ренинангиотензин-альдостероновую систему, эти вещества понижают сопротивление периферических сосудов, а также удержание натрия и воды. Кроме того, ингибиторы АКФ повышают уровни брадикинина и простагландинов, эндогенных сосудорасширяющих агентов. Катоприл ( - ) и Эналаприл ( - ) являются ведущими ингибиторами АКФ. Отрицательные эффекты ингибиторов АКФ включают сыпь, расстройство вкуса, протеинурию и нейтропению. Антагонисты кальциевых каналов уменьшают приток кальция в клетки сосудов гладких мышц и вызывают системное расширение сосудов, проявляющееся в их противогипертоническом действии. Другие эффекты антагонистов кальциевых каналов включают вмешательство в действие ангиотензинаи блокаду альфа 2-адренергических рецепторов,что может быть дополнением к их противогипертоническому действию. Антагонисты кальциевых каналов не имеют отрицательных метаболических и фармакологических эффектов тиазидов или бета-блокаторов и могут, следовательно, быть использованы у пациентов с диабетом, заболеванием периферических сосудов или с хроническим обструктивным легочным заболеванием. Два антагониста рецепторов кальциевых каналов,Верапамил и дильтиазен, имеют серьезные отрицательные сердечно-сосудистые эффекты в отношении атриовентрикулярной сердечной проводимости у пациентов с ранее существовавшими аномалиями проводимости и они могут ухудшить брадиокардию, блокаду сердца и хроническую сердечную недостаточность. Другие слабые отрицательные эффекты антагонистов рецепторов кальциевых каналов включают отек конечностей, головокру 5 5053 1 жение, ощущение пустоты в голове, головную боль, тошноту и прилив крови к лицу, особенно при приеме нифедипина и никардипина. Много средств могут быть приемлемыми для лечения идеопатической гипертонии. Эти средства включают празосин и теразосин, антагонисты альфа 1-адренергических рецепторов, противогипертоническое действие которых является результатом расширения артериальных сосудов клонидин, альфа 2-адренергический агонист, который действует как центрально, так и периферически на ингибиторные альфа 2-адренергические рецепторы, уменьшая симпатический ответ. Другие центрально действующие средства включают метилдопу, гуанабенз и гуанфацин резерпин, который действует путем уменьшения запасов катехоламинов гуанадрел, периферический адренергический антагонист, подобный гуанатидину с более короткой продолжительностью действия и сосудорасширяющие агенты прямого действия, такие как гидралазин и миноксидил. Эти средства, хотя и эффективные, производят заметные симптоматические побочные эффекты, включая рефлекторную симпатическую стимуляцию и удержание жидкости, ортостатическую гипотензию и импотенцию. Многие противогипертонические средства активируют компенсаторные вазопрессорные механизмы, такие как увеличенный выход ренина, повышенная секреция альдостерона и повышенный симпатический вазоконстрикторный тонус, которые создаются, чтобы вернуть артериальное давление к уровню перед лечением, и которые могут вести к удержанию соли и воды, тошноте и, в конечном счете, к толерантности к противогипертонического действия агента. Более того, из-за широкого спектра побочных эффектов, обнаруженных у современного набора противогипертонических лекарств, и проблем, обнаруженных при этом у отдельных типов пациентов с гипертонией, включая пожилых людей, чернокожих и пациентов с хронической легочной недостаточностью, диабетом или болезнями периферических сосудов, существует потребность в дополнительных классах лекарств для лечения гипертонии. Ишемия. Ишемия миокарда является результатом дисбаланса поступления кислорода в миокард и его расхода и включает дисфункцию от физических нагрузок и вазоспазматическую дисфункцию миокарда. Ишемия, связанная с физическими нагрузками, обычно приписывается наличию критического атеросклеротического стеноза, включая большие коронарные артерии, приводящему к уменьшению субэндокадиального потока. Ангиоспастическая ишемия связана со спазмом очагового типа, возникновение которого не связано с напряжением или стрессом. Этот спазм лучше определяется как внезапное усиление тонуса сосуда. Механизмы ангиоспастической ишемии включают (1) повышенный тонус сосуда в месте стеноза, вызванный увеличенным выходом катехоламина (2) скоротечную внутреннюю закупорку и (3) выход вазоактивных средств, образованных тромбоцитами на месте поражений эндотелия. Коронарная циркуляция является уникальной, поскольку она снабжает кровью орган,который создает перфузионное давление для всей циркуляционной системы. Таким образом, вмешательства, которые изменяют состояние периферической циркуляции и сужение, должны иметь значительное влияние на коронарную циркуляцию. Регуляторным компонентом мускулатуры коронарных сосудов являются мелкие коронарные артериолы,которые могут сильно изменять свой внутренний диаметр. Изменение внутреннего радиуса является результатом либо собственного сокращения гладкой мышцы сосуда (авторегуляция), либо внешнего сжатия из-за вентрикулярного сокращения. Суммарный эффект терапевтического лечения ишемической проблемы включает комплексное взаимодействие противоположных факторов, которые определяют приток и расход кислорода. Кардиопротекция и предотвращение ишемического поражения. Разработка новых терапевтических средств, способных ограничивать размер поражения миокарда, то есть размер инфаркта миокарда, следующего за острой ишемией миокарда, является главной проблемой современной кардиологии. 6 5053 1 Развитие тромболитической (растворяющей тромб) терапии в течение последних десяти лет демонстрирует, что раннее вмешательство во время сердечного приступа может давать в результате значительное уменьшение поражения ткани миокарда. Множество клинических опытов с тех пор показали документально, что тромболитическая терапия уменьшает риск развития расстройства сердечных сокращений, а также поддерживает способность сердца функционировать в качестве насоса. Это сохранение нормальной функции сердца, как показано, уменьшает последующую смертность после инфаркта. Существует также интерес к разработке методов лечения, способных обеспечить дополнительную защиту миокарда, которые могли бы проводиться вместе с тромболитической терапией или сами по себе, поскольку ретроспективные эпидемиологические исследования показали, что смертность во время первых нескольких лет после инфаркта повидимому связана с начальным размером инфаркта. В предклинических исследованиях инфаркта, проведенных на различных животныхмоделях, многие виды фармакологических средств, таких как блокаторы кальциевых каналов, аналоги простациклина и средства, способные ингибировать некоторые пути метаболизма, как было показано, способны снизить ишемическое поражение у некоторых видов животных. Недавние исследования показали, что, подвергая миокард на короткие периоды времени ишемии (прерывание потока крови к сердцу) с последующей реперфузией (восстановление притока крови), можно защитить сердце от последующего ишемического поражения,которое могло бы быть результатом более длительного периода ишемии. Это явление было названо предварительным кондиционированием миокарда и, как предполагается, частично объяснимо высвобождением аденозина во время периода предварительного кондиционирования. Другие исследования показали, что аденозин и агонисты аденозина уменьшают степень поражения ткани, наблюдаемое после прерывания притока крови к сердцу на различных моделях ишемического поражения у некоторых образцов (смотри, например С..,.,86, 986-994 (1992)(1992. Соединения по настоящему изобретению имитируют предварительное кондиционирование миокарда, тем самым уменьшая ишемическое поражение или производя уменьшение размера инфаркта миокарда, следующего за ишемией миокарда, и поэтому являются полезными в качестве кардиопротекторных средств. Антилиполиз. Гиперлипидемия и гиперхолестериномия, как известно, являются двумя главными факторами риска для атеросклероза и коронарной болезни сердца, главной причины смерти и инвалидности в западных странах. Хотя этиология атеросклероза является многофакторной, развитие атеросклероза и состояний, включая болезнь коронарных сосудов,заболевание периферических сосудов и церебрососудистое заболевание, являющихся результатом ограничения притока крови, связаны с аномалиями уровней холестерина и липидов в плазме. Этиология гиперхолестериномии и гиперлипидимии является прежде всего генетической, хотя могут вносить свой вклад такие факторы, как диетический прием насыщенных жиров и холестерина. Антилиполитическая активность аденозина и аналогов аденозина возрастает при активации 1 рецепторного подтипа (, ,, , С. и , ,, , 1988, 107-121). Стимуляция этого подтипа рецептора понижает внутриклеточную концентрацию цикли 7 5053 1 ческого АМФ в адипоцитах. Циклический АМФ является необходимым кофактором для фермента липопротеинлипазы, который гидролитически расщепляет триглицериды до свободных жирных кислот и глицерина в адипоцитах (, ,., . . . . 1992 (89), 8357-8541). Соответственно, уменьшение внутриклеточной концентрации циклического АМФ в адипоцитах уменьшает активность липопротеинлипазы и, следовательно, гидролиз триглицеридов. Повышенные давление крови и содержание липидов в плазме, включая триглицериды,являются двумя общепризнанными факторами риска, связанными со смертностью от сердечно-сосудистых заболеваний. Для пациентов-диабетиков, у которых вероятность смертности от сердечно-сосудистых заболеваний является существенно более высокой, риск, связанный с этими факторами,еще более возрастает (, ,и 1992 (12), 647-656). Кроме того, данные свидетельствуют, что избыточный липолиз является характерным для не-инсулинзависимого диабета и, возможно, вносит вклад в инсулиновую невосприимчивость и гипергликемию (, , . . . 1993 (25), 90-95). Соединения по данному изобретению используются в качестве противогипертонических и противолиполитических средств при лечении и для уменьшения как сосудистых,так и метаболических факторов риска и имеют особое значение и полезность. Настоящее изобретение относится к классу агонистов аденозина и к их применению при лечении гипертонии, ишемии миокарда, в качестве кардиопротекторных средств, которые уменьшают ишемическое поражение или размер инфаркта миокарда вследствие ишемии миокарда, и в качестве противолиполитических средств, которые уменьшают уровни липидов в плазме, уровни триглицеридов в плазме и уровни холестерина в плазме,и к способам и промежуточным соединениям, используемым при получении таких соединений. Опубликованные разработки. Аденозин имеет широкий спектр физиологического и фармакологического действия,включая заметное изменение сердечно-сосудистой и почечной функции. У животных и у человека внутривенная инъекция аденозинового нуклеотида вызывает гипотонию. Физиологическое и фармакологическое действия аденозина опосредуются через специфические рецепторы, расположенные на клеточных поверхностях. Идентифицированы два подтипа рецепторов аденозина, обозначаемые как 1 и 2 рецепторы. 1 рецептор ингибирует образование сАМР путем подавления активности аденилатциклазы, в то время как стимуляция А 2 рецепторов увеличивает активность аденилатциклазы и внутриклеточной сАМР. Каждый рецептор по-видимому опосредует специфическое действие аденозина в различных тканях например, сосудистое действие аденозина по-видимому опосредуется через стимуляцию А 2 рецепторов, которое поддерживается с помощью положительной корреляции между производством сАМР и вазорелаксацией в изолированной гладкой мышце сосудов, обработанных аденозином, тогда как стимуляция сердечных 1 рецепторов уменьшает генерацию сАМР в сердце, что вносит вклад в отрицательные дромотропные, инотропные и хронотропные сердечные эффекты. Далее, в отличие от большинства сосудорасширяющих средств, введение аденозина не вызывает рефлекса тахикардии. Аденозин также оказывает заметное влияние на функцию почек. Интраренальная инфузия аденозина вызывает долговременное падение потока крови через почки и увеличивает невосприимчивость ренальных сосудов. При продолжении инфузии аденозина поток почечной крови возвращается к контрольным уровням, и невосприимчивость сосудов почек уменьшается. Начальные ренальные сосудосуживающие реакции на аденозин не являются вызванными прямым сосудосуживающим действием нуклеотида, но включают взаимодействие между аденозином и ренин-ангиотензинной системой. Аденозин широко рассматривается в качестве первичного физиологического медиатора реактивной гиперемии и авторегуляции коронарного русла в ответ на ишемию миокарда. 8 5053 1 Сообщалось, что коронарный эндотелий обладает А 2 рецепторами аденозина, связанными с аденилатциклазой, которая активируется параллельно с увеличением коронарного потока, и что рецепторы кардиомиоцитов являются преимущественно рецепторами аденозин 1 подтипа и связаны с брадикардией. Соответственно, аденозин дает уникальный механизм терапевтического лечения ишемии. Сердечно-сосудистый ответ на аденозин является короткодействующим из-за быстрого извлечения и метаболизма эндогенного нуклеотида. В противоположность этому, аналоги аденозина являются более устойчивыми к метаболической деградации и, как сообщалось, вызывают длительные изменения артериального давления и частоты сердечных сокращений. Были синтезированы несколько эффективных метаболически стабильных аналогов аденозина, которые демонстрируют различные степени селективности к двум подтипам рецепторов. Агонисты аденозина, как правило, проявляют более высокую селективность по отношению к 1 рецепторам по сравнению с А 2 рецепторами. Циклопентиладенозин(СРА) и -фенилизопропиладенозин (-) являются стандартными агонистами аденозина,которые проявляют заметную селективность по отношению А 1 рецептору (отношение 2/1780 и 106, соответственно). В противоположность этому, -5-этилкарбоксамидоаденозинявляется сильным агонистом А 2 рецептора (-12 нМ), но имеет равное сродство к А 1 рецептору (-6,3 нМ соотношение 2/А 11,87). До недавнего времени-1808 был наиболее селективным доступным агонистом А 2 (2/А 10,19), даже несмотря на то, что соединение является в десять раз менее эффективным, чемв его сродство к А 2 рецептору. В недавних разработках не было описано никаких соединений,которые являются очень эффективными и селективными агонистами А 2 (3-8 нМ для А 1 соотношение А 2/А 10,027-0,042). Различные 6-арил- и 6-гетероарилалкилзамещенные аденозины и замещенные-(2 амино и 2-гидрокси)аденозины, как сообщалось в литературе, обладают различной фармакологической активностью, включая сердечную и циркуляторную активность. Смотри,например, патент Великобритании 1123245, патент Германии 2136624, патент Германии 2059922, патент Германии 2514284, Южно-Африканский патент 67/7630, патент США 4501735, Европейский патент 0139358 (описывающий 6-геминал диарилзамещенные алкиладенозины), Европейская патентная заявка 881068183 (описывающая, что 6-гетероциклзамещенные производные аденозина проявляют сердечную вазодилаторную активность),патент Германии 2131938 (описывающий арильные и гетероарилалкилгидразинильные производные аденозина), патент Германии 2151013 (описывающий 6-арил- и гетероарилзамещенные аденозины), патент Германии 2205002 (описывающий аденозины с 6 заместителями, содержащие мостиковые кольцевые структуры, связывающие 6-зот с заместителями, включающими тиенил) и Южно-Африканский патент 68/5477 (описывающий 6-индолилзамещенные-2-гидроксиаденозины). Патент США 4954504 и Европейский патент 0267878 описывают по существу, что карбоциклические рибозные аналоги аденозина и их фармацевтически приемлемые сложные эфиры, замещенные по 2- и/или 6-положениях арилнизкоалкильными группами,включая тиенил, тетрагидрофуранил, тетрагидротиопиранил и бициклические бензоконденсированные 5- или 6-членные насыщенные гетероциклические низшийалкилпроизводные, проявляют свойства агониста аденозиновых рецепторов. Аденозиновые аналоги,имеющие заместители тиенильного типа, описаны в Европейском патенте 0277917 (описывающем 6-замещенные-2-гетероарилалкиламинозамещенные аденозины, включая 2(2-тиен-2-илэтил)аминозамещенный аденозин), патенте Германии 2139107 (описывающем 6-бензотиенилметил-аденозин), РСТ 85/04882 (описывающем 6-гетероциклалкилзамещенные производные аденозина, включая 6-2-(2-тиенил)этиламино-9(-рибофуранозил)-9 Н-пурин, проявляют сердечно-сосудистую сосудорасширяющую активность, и что 6-хиральные заместители проявляют повышенную активность), опуб 9 5053 1 ликованной ЕР заявке 0232813 (описывающей, что 6-(1-замещенныетиенил)циклопропилметилзамещенные аденозины проявляют сердечно-сосудистую активность), патенте США 4683223 (описывающем, что 6-бензотиопиранилзамещенные аденозины проявляют противогипертонические свойства), РСТ 88/03147 и 88/03148 (описывающих,что 6-2-арил-2-(тиен-2-ил)этилзамещенные аденозины проявляют противогипертонические свойства), патентах США 4636493 и 4600707 (описывающих, что 6-бензтиенилэтилзамещенные аденозины проявляют противогипертонические свойства). Амиды аденозин-5-карбоновых кислот описаны как имеющие применение в качестве противогипертонических и противостенокардических средств в патенте США 3914415, в то время как патент США 4738954 описывает, что 6-замещенные арил и арилалкиладенозин 5-этилкарбоксамиды проявляют различные сердечные и противогипертонические свойства. 6-алкил-2-О-алкил аденозины описаны в публикации ЕР патенте 0378518 и в патентной заявке Великобритании 2226027 как имеющие противогипертоническую активность. 6-алкил-23-диалкиладенозины также описаны как имеющие применение в качестве противогипертонических средств, патент США 4843066. Аденозин-5-(-замещенные)карбоксамиды и их карбоксилатные эфиры и 1-оксиды описаны как коронарные сосудорасширяющие агенты, ,., . . . 1980, 23,313-319 и . . . 19(10), 1180(1976). Аденозин-5-карбоксамиды и их 1-оксиды также описаны в качестве слабых животных ядов в патенте США 4167565. Противолиполитическая активность аденозина описана , , . . .236(12),3125-3130(1961). Ингибирование липолиза с помощью -6 фенилизопропиладенозина описано , ., . .,,, , В. И Нерр, . .,, , 47-54 (1970). 6-моно- и дизамещенные аналоги аденозина описаны как имеющие противолиполитическую, противогиперхолестериномическую и противогипергликемическую активность в патентах США 3787391,3817981, 3838147, 3840521, 3835035, 3851056, 3880829, 3929763, 3929764, 3988317 и 5032583. Как полагают, обнаруженная токсичность,свойства и увеличение частоты сердечных сокращений, связанные с аналогами аденозина, создают трудности, мешающие разработке коммерческих аналогов аденозина как противогипертонических/противоишемических средств. Настоящее изобретение относится к классу метаболически стабильных агонистов аденозина и их производных, обладающих неожиданно желаемыми фармакологическими свойствами, то есть являющихся противогипертоническими, кардиопротективными, противоишемическими и противолиполитическими средствами, имеющими уникальный терапевтический профиль. Соединения по настоящему изобретению описываются формулой Тили 3-2 обозначает алкилен с прямой или разветвленной цепью, циклоалкиленовую или циклоалкениленовую группу, каждый из которых необязательно замещен, по меньшей мере, одним СН 3, СН 3 СН 2, , , 3 или СН 3 2 1 обозначает , 5, -5 или -,равно 1 или 2 2 обозначает , 6, О или ,равно 0 или 1 1, 2, 3, 4, 5 и 6 обозначают, независимо, Н, алкил, арил или гетероциклилиобозначают, независимо, Н, ОН, алкил, гидроксиалкил, алкилмеркаптил, тиоалкил, алкокси, алкоксиалкил, амино, алкиламино, карбоксил, ацил, галоген, карбамоил,алкилкарбамоил, арил или гетероциклил ииобозначают, независимо, водород, алкил, аралкил, карбамоил, алкилкарбамоил, диалкилкарбамоил, ацил, алкоксикарбонил, аралкоксикарбонил, арилоксикарбонил,илиивместе могут образовывать, гдеиобозначают, независимо,гдеобозначает водород или алкил,водород, алкил, или вместе с атомом углерода, которому они присоединены, могут образовывать 1,1-циклоалкильную группу,при условии, что, когдаобозначает алкилен с прямой цепью иобозначает кислород,тогдапредставляет гетероциклил, включающий, по крайней мере, два гетероатома или их фармацевтически приемлемыми солями. Настоящее изобретение относится также к способам лечения сердечно-сосудистой болезни, отмеченной гипертонией или ишемией миокарда, используя фармацевтические композиции, содержащие противогипертонически эффективное количество или противоишемически эффективное количество соединения формулы , указанной выше, к способу уменьшения ишемического поражения или инфаркта миокарда, используя фармацевтические композиции, содержащие кардиопротекторное количество соединения формулы ,указанной выше, к способу лечения гиперлипидемии или гиперхолестеринемии, используя фармацевтические композиции, содержащие противолиполитическое количество соединения формулы , и к способам и промежуточным соединениям, используемым при получении таких соединений. Как используются выше и во всем описании изобретения следующие термины, если не указано другого, должны пониматься как имеющие следующие значения Ацил обозначает алкилСгруппу с прямой или разветвленной цепью. Предпочтительные ацильные группы являются низшими алканоилами, имеющими от 1 до 6 атомов углерода в алкильной группе. Алкил обозначает насыщенную алифатическую углеводородную группу, которая может быть прямой или разветвленной и иметь от приблизительно 1 до приблизительно 20 атомов углерода в цепи. Разветвленный означает, что низшая алкильная группа, такая как метил, этил или пропил, присоединена к линейной алкильной цепи. Низший алкил обозначает алкильную группу, имеющую от 1 до приблизительно 6 атомов углерода. Алкилен обозначает прямую или разветвленную двухвалентную углеводородную цепь, имеющую от 1 до приблизительно 20 атомов углерода. Предпочтительные алкиле 11 5053 1 новые группы являются низшими алкиленовыми группами, имеющими от 1 до приблизительно 6 атомов углерода. Наиболее предпочтительными алкиленовыми группами являются метилен, этилен, этилэтилен, метилэтилен и диметилэтилен. Циклоалкилен обозначает 1,2- или 1,3- двухвалентную карбоциклическую группу,имеющую от приблизительно 4 до приблизительно 8 атомов углерода. Предпочтительные циклоалкиленовые группы включают 4,5-цис- или транс-циклогексенилен, 1,2-циклогексанилен и 1,2-циклопентилен. Необязательно замещенный обозначает, что данный заместитель или заместители могут быть как представлены, так и не представлены. Алкиламино обозначает аминогруппу, замещенную одной или двумя алкильными группами, предпочтительные группы являются низшими алкиламиногруппами. Алкилкарбамоил обозначает карбамоильную группу, замещенную одной или двумя алкильными группами. Предпочтительными являются низшие алкилкарбамоильные группы. Алкилмеркаптил обозначает алкильную группу, замещенную меркаптильной группой. Меркаптильно - низкоалкильные группы являются предпочтительными. Алкокси обозначает алкилоксигруппу, в которой алкил является тем, что описано выше. Низшие алкильные группы являются предпочтительными. Примерные группы включают метокси, этокси, н-пропокси, изопропокси и н-бутокси. Алкоксиалкил обозначает алкильную группу, как описано выше, замещенную алкоксигруппой, как описано выше. Аралкил обозначает алкильную группу, замещенную арильным радикалом, где арил обозначает фенил или фенил, замещенный одним или более заместителями, которые могут быть алкилом, алкокси, амино, нитро, карбокси, карбоалкокси, циано, алкиламино, гало, гидрокси, гидроксиалкилом, меркаптилом, алкилмеркаптилом, карбалкилом или карбамоилом. Карбалкокси обозначает карбоксильный заместитель, этерифицированный спиртом формулы 21, гдеравен от 1 до приблизительно 6. Галоген (или гало) обозначает хлор (хлоро), фтор (фторо), бром (бромо) или иод(иодо). Гетороциклил обозначает кольцевую структуру, от приблизительно 4- до приблизительно 10-членной, в которой один или более атомов в кольце является элементом, отличающимся от углерода, например , О или . Представительные гетероциклические радикалы, содержащие 6-заместитель, соединений формулывключают следующие Предпочтительные гетероциклические группы включают незамещенные и замещенные тиенильную, тиазолильную и бензтиазолильную группы, где заместители могут быть одним или несколькими членами группы из алкокси, алкиламино, арила, карбалкокси,карбамоила, циано, гало, гидрокси, меркаптила, алкилмеркаптила или нитро. Гидроксиалкил обозначает алкильную группу, замещенную гидроксигруппой. Группы гидроксинизшийалкил являются предпочтительными. Примерные предпочтительные группы включают гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил и 3-гидроксипропил. Лекарство-предшественник обозначает соединение, которое может быть или не быть биологически активным само по себе, но которое может с помощью метаболических,сольволитических или других физиологических средств быть превращенным в биологически активное химическое вещество. Кардиопротекция относится к действию, от которого миокард делается менее чувствительным к ишемическому поражению и к инфаркту миокарда, следующему за ишемией миокарда. 12 5053 1 Уменьшение ишемического поражения означает предотвращение или уменьшение ишемического поражения миокарда, следующего за ишемией миокарда. Уменьшение размера инфаркта миокарда означает уменьшение инфаркта миокарда или предотвращение инфаркта миокарда, следующего за ишемией миокарда. Соединения формулывключают, предпочтительно, хиральный (асимметричный) центр. Например, предпочтительные соединения, имеющие такой асимметричный центр,включают соединения, гдеобозначает изопропилен и имеет либо , либоконфигурацию, иконфигурация является наиболее предпочтительной. Изобретение включает индивидуальные стереоизомеры и их смеси. Индивидуальные изомеры получают и выделяют с помощью методов, хорошо известных в данной области, или с помощью способов,описанных здесь. Соединения по изобретению могут быть использованы в виде свободного основания, в виде солей кислот или в виде гидрата. Все эти формы находятся в рамках изобретения. Соли кислот являются просто более удобной формой для использования. На практике использование солевой формы изначально равнозначно использованию основной формы. Кислоты, которые могут быть использованы для получения солей кислот, включают предпочтительно те, которые образуют при соединении со свободным основанием фармацевтически приемлемые соли, то есть соли, анионы которых не являются токсичными для пациента при фармацевтических дозах солей, так что полезное противогипертоническое,кардиопротекторное, противоишемическое и противолиполитическое действие, производимое свободным основанием, не сопровождается побочными эффектами, приписываемыми анионам. Хотя фармацевтически приемлемые соли соединений по настоящему изобретению являются предпочтительными, все соли кислот используются в качестве источника формы свободного основания, даже если отдельная соль сама по себе является желательной только как промежуточный продукт, как, например, когда соль образуется только для целей очистки и идентификации или когда она используется как промежуточный продукт при получении фармацевтически приемлемой соли путем ионного обмена. Фармацевтически приемлемыми солями в рамках изобретения являются такие, которые получают из следующих кислот минеральные кислоты, такие как хлористоводородная кислота, серная кислота, фосфорная кислота, сульфаминовая кислота и органические кислоты, такие как уксусная кислота, лимонная кислота, молочная кислота, винная кислота,малоновая кислота, метансульфоновая кислота, фумаровая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, циклогексилсульфаминовая кислота, хинная кислота и тому подобное. Соответствующие соли кислот включают следующие гидрохлорид, сульфат, фосфат, сульфамат, ацетат, цитрат, лактат, тартрат,метансульфонат, фумарат, этансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфонат и хиноат, соответственно. Соли кислот соединений изобретения удобно получаются либо с помощью растворения свободного основания в водном или водно-спиртовом растворе, или в других подходящих растворителях, содержащих соответствующую кислоту, и выделения соли путем выпаривания раствора, или путем взаимодействия свободного основания и кислоты в органическом растворителе, в этом случае соль отделяется непосредственно или может быть получена с помощью концентрирования раствора. Включенными в рамки формулыявляются классы соединений, которые могут быть охарактеризованы в общем как 6-гетероциклически замещенные аденозины 6 гетероциклически замещенные карбоциклические аденозины (или, альтернативно, дигидрокси 6-гетероциклическизамещенные-9-аденилциклопентаны) и их -оксиды и 6 гетероциклическизамещенные 1-деазааристеромицины (или, альтернативно, дигидрокси 7-гетероциклическизамещенные 4,5-имидазопиридилциклопентаны). Также в рамках формулынаходятся 5-алкилкарбоксамидные производные аденозинов, карбоциклических аденозинов и 1-деазоаристеромицинов, производные соединений упомянутых выше классов, в которых одна или обе 2- или 3-гидроксильных групп циклопентанового кольца,13 5053 1 или в случаях классов соединений, содержащих рибозный остаток, 2- или 3-гидроксильные группы рибозного кольца, являются замещенными. Такие производные могут включать биологически активные химические вещества, используемые при лечении гипертонии и ишемии миокарда сами по себе, и в качестве кардиопротекторных и противолиполитических средств, или могут действовать в качестве лекарств-предшественников таких биологически активных соединений, которые образуются из них в физиологических условиях. Представительные соединения изобретения включают 6-транс-2-(тиофен-2-ил)циклогекс-4-ен-1-иладенозин 6-транс-2-(тиофен-3-ил)циклогекс-4-ен-1-иладенозин 6-транс-2-(тиофен-2-ил)циклогекс-4-ен-1-иладенозин-5 этилкарбоксамид 6-2-(2 аминобензтиазолил)этиладенозин 6-2-(2-тиобензтиазолил)этиладенозин 6-2-(6 этоки-2-тиобензтиазолил)этиладенозин 6-2-(2-аминобензтиазолил)-этиладенозин-5-этилкарбоксамид 6-2-(2-аминотиазолил)этилкарбоциклический аденозин-5 этилкарбоксамид 6-2-(4-метилтиазол-5-ил)этиладенозин 6-2-(2-тиазолил)-этиладенозин 61-(5-хлортиен-2-ил)-2-пропиладенозин-5 этилкарбоксамид 6-2-(2-метил 4-тиазолил)этил-аденозин 61-метил-2-(2-бензтиофенил)этиладенозин 6-2(4-метил-5-тиазолил)этилкарбоциклический аденозин-5 этилкарбоксамид 6-2-(2 тиазолил)этилкарбоциклический аденозин-5 этилкарбоксамид 6-2-(4-фенил-2-тиазолил)этиладенозин 61-(5-хлор-2-тиенил)проп-2-илкарбоциклический аденозин 5 этилкарбоксамид (-)-6-тиофен-2-ил)этан-2-ил)карбоциклический аденозин-5-этилкарбоксамид 6-1-(тиофен-3-ил)этан-2-ил)карбоциклический аденозин-5 этилкарбоксамид 6 тиофен-2-ил)проп-2-ил)карбоциклический аденозин-5 этилкарбоксамид 6(тиофен-2-ил)этан-2-ил 1-деазааристеромицин-5 этилкарбоксамид 61-тиазо-2-ил)проп-2-ил)аденозин-5 этилкарбоксамид 6-1-(тиофен-2 ил)-2-метилпропиладенозин-5 этилкарбоксамид 61-(5-хлортиен-2-ил)-2-бутилкарбоциклический аденозин-5 этилкарбоксамид 6-2-(4-метил-2-тиазолил)этиладенозин 6-4-фенил-2-тиазолил)-метиладенозин (-)-2-2,3-диметилметилендиокси 46-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентанэтилкарбоксамид (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино 9-аденилциклопентан-1 этилкарбоксамид (2)-2,3-дигидрокси-4-6-2-(5-хлор 2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан-1-этилкарбоксамид-1-оксид 1-1,2,3,4-4-7-2-(5-хлор-2-тиенил)-1-метилэтиламино-3-имидазо 4,5-пиридин-3-ил-этил-2,3-дигидроксициклопентанкарбоксамид 1-1,2,3,4-4-7-2-(3 хлор-2-тиенил)-1-этилэтиламино-3-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид 1-1,2,3,4-4-7-2-(2-тиенил)-1-изопропилэтил-амино 3-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид 1-1,2,3,4-4-7-2-(3-хлор-2-тиенил)-1-этилэтиламино-3-имидазо 4,5-пиридин-3 илэтил-2,3-дигидроксициклопентанкарбоксамид 1-1,2,3,4-4-7-2-(2 тиенил)-1-метилэтил-амино-3-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид 1-,2,3,4-4-7-2-(5-хлор-2-тиенил)-1-этилэтиламино 3-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид (2)-2,3-бис-метоксикарбонилокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9 аденилциклопентан-1 этилкарбоксамид (2)-2,3-дигидрокси-4-6-2-(5-хлор-2 тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамидэтоксиметиленацеталь (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамид-2,3-карбонат (2)-2,3-бис-метилкарбамоилокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан 1 этилкарбоксамид (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамид-2,3-тиокарбонат 6-2-(3-хлор 2-тиенил)-(1)-1-метилэтил-2 метиладенозин 6-2-(5-хлор-2-тиенил)-(1)-1-метилэтил 2 метиладенозин и 6-транс-5-(2-тиенил)циклогекс-1-ен-4-ил-2 метиладенозин. 14 5053 1 Предпочтительный класс соединений изобретения описан формулой , гдеиобозначают Н. Другим предпочтительным классом соединений изобретения являются 5-алкилкарбоксамидные производные 6-гетероциклически замещенных карбоциклических аденозинов, другими словами, соединений формулы , где К обозначает ,обозначает СН 2 и Т обозначает 12-или их фармацевтически приемлемые соли. Еще другим предпочтительным классом соединений изобретения являются 5-алкилкарбоксамидные производные 6-гетероциклически замещенных -1-деазааристеромицинов, то есть 4-7-гетероциклиламино-3-имидазол 4,5-пиридин-3-илалкил-2,3 дигидроксициклопенткарбоксамиды, другими словами, соединения формулы , где К обозначает СН,обозначает СН 2 и Т обозначает 12-или их фармацевтически приемлемые соли. Наиболее предпочтительный класс соединений по настоящему изобретению включает соединения формулы , характеризуемые присутствием хирального центрана атоме 6 пурина или 1-деазапуринового кольца, в то время как специальное осуществление этого класса включает соединения, характеризуемые хиральной этильной группой, присоединенной к атому углерода альфа на 6-азоте. Особенно предпочтительный класс соединений характеризуется 6-1-низший алкил-2-(3-галотиен-2-ил)этилзамещающей группой. Наиболее предпочтительные осуществления изобретения включают соединения (-)2-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан-1-этилкарбоксамид (-)-2-2,3-дигидрокси-4-6-1 этил-2-(3-хлор 2-тиенил)этиламино-9-аденилциклопентан-1-этилкарбоксамид 1-1,2,3,44-7-2-(5-хлор-2-тиенил)-1-метилэтиламино-3-имидазол 4,5-пиридин-3-илэтил 2,3-дигидроксициклопентанкарбоксамид 1-1,2,3,4-4-7-2-(3-хлор-2-тиенил)-1 этилэтиламино-3-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид и их фармацевтически приемлемые соли. Соединения по настоящему изобретению могут быть получены с помощью известных способов или в соответствии с последовательностями реакций, описанными ниже. Исходные материалы, используемые при получении соединений изобретения, являются известными или коммерчески доступными, или могут быть получены с помощью известных способов или конкретных схем реакций, описанными здесь. Соединения формулы , где К обозначает ,обозначает О и Т обозначает 3-2,могут быть получены путем взаимодействия коммерчески доступного 6-хлорпуринрибозида с различными гетероциклическими аминами, как представлено ниже. Соединения формулы , где К обозначает ,обозначает О и Т обозначает 12, получают подобным образом, начиная с продукта реакционной схемы А. В этой реакции 6-хлорпуринрибозид, у которого 2- и 3-гидроксильные группы рибозного кольца являются защищенными, обрабатывают оксидантом, например реагентом Джонса, и получаемую в результате кислоту обрабатывают либо дициклогексилкарбодиимидом (ДЦК) либо БОФ- в присутствии выбранного амина с получением 5-алкил-карбоксамидного производного. Реакционная схема А. 5053 1 Соответствующие исходные продукты для соединений формулы , где К обозначает , обозначает СН 2 и Т обозначает 12-Смогут быть получены, как описано.,30 5543-46(1989). Альтернативно, для получения таких исходных продуктов может быть использована реакционная схема В. При осуществлении реакционной схемы В 4-этилкарбоксамидное производное 2,3-дигидроксициклопентиламина, получаемое,как описано., подвергают взаимодействию с 3-амино-2,4-дихлорпиримидином. Продукт этой начальной реакции затем нагревают с альдегидиламидинацетатом, например формамидинацетатом, в диоксане и метоксиэтаноле в течение времени, достаточном для осуществления замыкания кольца (от приблизительно 30 мин до приблизительно 4 ч),тем самым получая продукт, который может быть удобно подвергают взаимодействию с различными гетероциклическими аминами способом, описанным ниже, с получением соединения по изобретению. Порядок проведения реакции не является определяющим. Например, промежуточный продукт, получаемый по реакционной схеме В, может реагировать с гетероциклическим амином с последующим замыканием кольца, давая желаемый конечный продукт. Реакционная схема В. Различные гетероциклические амины, используемые для получения соединений по настоящему изобретению, могут быть получены с помощью одной или более реакций,представленных на реакционных схемах - и в примерах получения от В дои от 50 до 74, здесь и далее (гетероциклическая группагалогеннапример, Н или низший алкилиуказаны выше). Реакционная схема С. Последовательность реакций схемывыше описана в патенте США 4321398 с соответствующей информацией, включенной здесь в качестве ссылки. Пример В. Получение 1-(тиофен-3-ил)этиламина. 3-Тиофенкарбоксальдегид (1 ммоль), нитрометан (1,5 ммоль) и бета-аланин (0,1 ммоль) подвергают взаимодействию в бутаноле в течение 6 ч, с получением 3-нитровинилентиофена, который восстанавливают литийалюминийгидридом (2,5 ммоль), с получением желаемого продукта, амина. 3-Замещенные тиенилалкиламины получают путем замены на 3-замещенные тиофены,таких как 3-хлортиофен, тиофеновых исходных продуктов в примере В, выше. Пример С. Получение транс-2-(тиофен-2-ил)циклогекс-4-ениламина. Смесь 1,3-бутадиена (5 мл) и 2-нитровинилентиофена (7 г) в толуоле нагревают при 140 С в течение ночи в герметически закрытой пробирке. Полученный в результате нитроциклогексен гидрогенируют (35 ф/дюйм 2 Н 2) (5/ ) и обрабатывают литий алюминий гидридом (2,5 г). Рацемический транс-2-(тиофен-2-ил)циклогексиламин получают обычной обработкой. Пример . Общее получение 2-замещенных тиазоламинов. Бензоилхлорид и аминоэтилцианид взаимодействуют, давая -бензоиламиноэтилцианин, который взаимодействует с гидросульфидом в аммиаке, давая тиоамид, который взаимодействует с соответствующим -галокетоном, давая желаемый тиазол. Обработка 5 н соляной кислотой удаляет защитную бензоильную группу, давая желаемый аминовый продукт. Пример Е. Общее получение 4-замещенных тиазолиламинов. Предпочтительный синтез 2-(2-метил-4-тиазолил)-этиламина осуществляют путем реакции тиоацетамида с этилмонобромацетоацетатом с получением тиазоловый эфир, который восстанавливают, предпочтительно, боргидридом натрия, получая спирт, который преобразуют в амин. Предпочтительные приемы для получения амина включают обработку (1) диэтилазодикарбоксилатом, трифенилфосфином и фталимидом и (2) гидразингидратом. Получение 4-замещенных тиазоламинов может быть также проведено путем предшествующей реакционной схемы взаимодействием замещенного тиоамида и этилмонобромацетоацетата. Преобразование полученного в результате тиазолилового эфира в амид осуществляют водным раствором аммиака и амин получают с помощью восстановления бораном. Пример получения 2-(1,1-диметил-1-тиофенил)этиламина описан в патенте США 4321398. Диастереомерные смеси соединений или промежуточных продуктов, полученных по реакционным схемам -, представленным выше, могут быть разделены на отдельные рацемические или оптически активные энантиомеры способами, известными в данной области, например с помощью хроматографии, фракционной дистилляции или фракционной кристаллизации - или 1-(тартратных, дибензоил-тартратных, манделатных или камфарсульфонатных солей. Пример . Получениеи (-) транс-2-(тиофен-2-ил)циклогекс-4-ениламина. Миндальную кислоту (0,55 экв) добавляют к изопропаноловому раствору рацемического амина (3,4 г), полученного по примеру С. Осадок повторно кристаллизуют из 18 5053 1 изопропанола, получая 1,78 г соли (4,13 (с 1,3, МЕОН. Амины выделяют путем экстракции нейтрализованных солей (насыщ. 3) с помощью СН 2 С 2, высушивания (24) и концентрирования, получая частично разделенные свободные амины. Примерно 1 г левовращающего амина (-25,8 (с 1,54, МеОН обрабатывают 2 г 1-(-)-дибензоилвинной кислоты в метаноле и полученную соль обрабатывают, получая 0,64 г левовращающего амина (-28,8 (с 1,65, МеОН. Анализ с помощью ЯМР высокого разрешения МРТА амида левовращающего амина показывает энантиомерный избыток 96 . Примерно 1,6 г обогащенной правовращающим амином смеси обрабатывают 3,2 г-дибензоилвинной кислоты в метаноле. После обработки получают 0,87 г правовращающего амина (25,8 (с 1,67, МеОН. 6-Гетероциклическизамещенные аденозины и карбоциклические аденозины по изобретению могут быть получены путем взаимодействия 6-хлорпуринрибозида или продуктов реакционной схемы А или В с различными гетероциклическими аминами, в соответствии с последовательностью синтеза, представленного ниже на реакционной схеме , где К, Р,и Т указаны выше. Реакционная схема . 6-Гетероциклическизамещенные-алкил-деазааристеромицины по изобретению могут быть получены, как показано на реакционной схеме К. Реакционная схема К. Соединения по настоящему изобретению, которые могут действовать в качестве лекарств-предшественников, включают такие соединения, в которых гидроксильные группы рибозы или циклопентанового кольца замещены группамии , как описано выше в 19 5053 1 формуле . Они могут быть получены известными способами и представлены с помощью примеров получения, показанных на реакционной схемениже. Реакционная схема . Обработка дигидроксисоединений хлорформиатным эфиром в присутствии органического основания, например триэтиламина, должна давать соответствующий бис-карбонат. Алкоксиметиленацеталь может быть получен путем обработки соответствующим ортоэфиром в присутствии каталитического количества п-толуолсульфоновой кислоты. Карбонат становится доступным при обработке 1,1-карбонилдиимидазола, а тиокарбонат при обработке тиокарбонилдиимидизола. Алкил и диалкилкарбамоил производные могут быть получены обработкой соответствующим алкилизоцианатом или диалкилкарбамоилхлоридом, соответственно, в присутствии органического основания. Соединения по настоящему изобретению, где К обозначает , т.е. -оксиды, могут быть получены путем окисления соответствующего аденозина или карбоциклического аденозина известными способами, например обработкой перекисью водорода в уксусной кислоте. 2 алкильные производные могут быть получены с помощью известных способов,например взаимодействием соответствующего гетероциклиламина с 6-хлор-9-(2-О-метилрибофуранозил)-9 Н-пурином. Функциональные группы исходных соединений и промежуточных продуктов, которые используются для получения соединений изобретения, могут быть защищены с помощью обычных защитных групп, известных в данной области. Удобные защитные группы для амина и гидроксильных функциональных групп описаны, например, в книге, , ,(1984). Гидроксильные группы могут быть защищены в виде сложных эфиров, таких как ацильные производные, или в виде простых эфиров. Гидроксильные группы на соседних атомах углерода могут преимущественно быть защищены в форме кеталей или ацеталей. 20 5053 1 На практике соседние 2 и 3 гидроксильные группы исходных соединений в реакционных схемах А и В удобно защищаются с помощью, например, 2,3-изопропилиденовых производных. Свободные гидроксилы могут быть получены повторно с помощью, например,кислотного гидролиза или других реакций сольволиза или гидролиза, традиционно используемых в органической химии. После синтеза соединения по изобретению обычно очищают с помощью жидкостной хроматографии среднего давленияна хроматотроне, радиально ускоренной тонкослойной хроматографии, флэш-хроматографии или колоночной хроматографии на силикагеле или Флорисиле с последующей кристаллизацией. Для соединений формулы , где К обозначает ,обозначает О и Т обозначает 32, типичные системы растворителей включают хлороформметанол, этилацетатгексан и метиленхлоридметанол. Элюаты могут быть кристаллизованы из метанола, этанола,этилацетата, гексана или хлороформа. Для соединений формулы , где К обозначает ,обозначает О и Т обозначает 12-, типичные системы растворителей включают хлороформметанол. Элюаты могут быть кристаллизованы из 50-100 этанола (водный раствор). Для соединений формулы , гдеобозначает СН 2, К обозначаетили СН и Т обозначает 12-, типичные системы растворителей включают метиленхлоридметанол. Элюаты могут быть кристаллизованы из этилацетата с и/или без метанола, этанола или гексана. Соединения, требующие нейтрализации, могут быть нейтрализованы слабым основанием, таким как бикарбонат натрия, с последующей промывкой метиленхлоридом и насыщенным солевым раствором. Продукты, которые очищают в виде масел, иногда растирают с гексаном/этанолом перед конечной кристаллизацией. Следующий аспект настоящего изобретения относится к усовершенствованному способу получения по существу оптически чистого 2-замещенного-2-амино-1-(гетероар-2 или 3-ил)этанового производного. 2-(гетероарил)этиламины и их алкильные и фенильные производные получают различными путями, включая восстановление 2 нитровинилгетероарильных соединений, полученных из гетероарилформальдегидов (смотри, например,.и , . . . 68(5), 591(1979), . ,., . . . 21(9), 978(1978), .и М. , . . . 7,1257 (1970 восстановление цианометилгетероарильных соединений (смотри, например, В.и . , . . . 15,81(1950), .и Н. , . . . 12, 1079(1969 реакцию разложения Хофмана 2-(2-тиенил)пропиламида (смотри, например, .и . , . .. 1938, 2100) и аминирование 2-(2-тиенил)этилпаратолуолсульфонатов, патент США 4128561. Настоящий способ включает взаимодействие хирального 2-замещенного этиленоксидного производного с 2- или 3-ильного анионом гетероарильного соединения и преобразование с помощью стереоспецифических средств гидроксильной группы, образующейся в указанной реакции, в аминогруппу. Способ по настоящему изобретению представлен в реакционной схеме М ниже. Реакционная схема М. 5053 1 Гдеобозначает замещающую группу указанного хирального этилен оксида иобозначает гетероциклическую группу. Преимущество способа по настоящему изобретению по сравнению со способами получения 2-замещенных-2-амино-1-(гетероар-2- или 3-ил)этановых производных, известными в данной области, состоит в том, что получение оптически чистых производных производится непосредственно, в отличие от рацемической смеси, которая должна затем быть разделена с помощью других способов, для получения оптически чистых изомеров. Предпочтительная группа способов по настоящему изобретению является такой, в которой гетроар-2- или 3-ильная группа является замещенной или незамещенной тиен-2 или 3-илом или замещенной или незамещенной бензтиофен-2- или 3-ильной группой. Более предпочтительной группой способов по настоящему изобретению является такой, в которой указанный анион образуется путем реакции замещенного или незамещенного тиофена или бензтиофена, имеющего водородный заместитель в 2- или 3-положении,с металлорганическим основанием в апротонном органическом растворителе. Другой более предпочтительной группой способов по настоящему изобретению является такая, в которой указанный хиральный 2-замещенный этиленоксид является замещенным во 2-положении группой, выбираемой из группы, содержащей алкил, арил,тригалогенметил и бензилокси. Наиболее предпочтительной группой способов по настоящему изобретению является такая, в которой указанное металлорганическое основание является алкиллитием или литийдиизопропиламидом, указанный протонный органический растворитель является тетрагидрофураном, эфиром, гексаном или смесью этих растворителей и указанный хиральный 2-замещенный этиленоксид является 2-алкилэтиленоксидным производным. Средства для стереоспецифического преобразования гидроксигруппы в аминогруппу являются хорошо известными в данной области (смотри, например, ,1981 (1), 1). Следует учесть, что - или -2-замещенное-2-гидрокси-1-гетероарилэтановое производное может быть получено непосредственно, как описано выше, с помощью использования соответствующего - или -2-замещенного этиленоксидного производного в качестве исходного продукта или, если желательно или необходимо, полученный в результатеили -2-замещенный-2-гидрокси-1-гетероарилэтан может быть преобразован в соответствующееили -2-замещенное-2-гидроксид-1-гетероарилэтановое производное, соответственно, с помощью средств, хорошо известных в данной области,для инверсии конфигурации по гидроксигруппе (смотри, например, ,1981 (1), 1). Конкретное осуществление способа по настоящему изобретению является таким, в котором (а) замещенный или незамещенный тиофен или бензтиофен, имеющий водородный заместитель во 2- или 3-положении, обрабатывают бутиллитием в смеси тетрагидрофурана и гексана при пониженной температуре, например при приблизительно -30 С, в течение времени, достаточного для образования аниона указанного тиофена или бензотиофена (б) после этого добавляютили -2-алкилэтиленоксид, и смесь выдерживают при более высокой температуре, например при около 0 С, в течение времени, достаточного для образования соответствующегоили -2-алкил-2-гидрокси-1-тиенильного или бензтиофенилэтанового производного, и (в) после этого преобразуют с помощью стереоспецифических средств гидроксигруппу указанного этанового производного в аминогруппу. Способ по настоящему изобретению далее иллюстрируется и объясняется с помощью примеров от 50-74. Примеры 1-3 описывают получение предшествующих соединений, используемых при получении соединений по настоящему изобретению, которые описаны ниже. Пример 1. Получение 6-хлор-2,3-диметилметилендиоксид 5-этил-карбоксамидоаденозина. Стадия 1 2,3-диметилметиленовое производное 6-хлорпуринрибозида. 22 5053 1 6-Хлорпуринрибозид (31,5 г), триэтилортоформиат (73 мл) и(19,8 г) перемешивают в 600 мл ацетона в течение 2 ч при комнатной температуре. Раствор, реакционную смесь, концентрируют в вакууме, объединяют с этилацетатом и промывают насыщенным раствором 3 и насыщенным солевым раствором, сушат (24) и концентрируют,получая 2,3-диметилметиленовое производное 6-хлорпуринрибозида в виде белого твердого продукта. Стадия 2 6-хлор-2,3-диметилметилендиоксиаденозин карбоновая кислота. Продукт со стадии 1 (10 г) подвергают окислению по Джонсу, кислоту экстрагируют из этилацетата 2,5 раствором , и водную часть промывают этилацетатом и подкисляют концентрированной НС, и экстрагируют этилацетатом. Органический слой промывают Н 2 и насыщенным солевым раствором, сушат (24), фильтруют и концентрируют в вакууме досуха, получая желаемую 5-карбоновую кислоту. Стадия 3 6-хлор-2,3-диметилметилендиокси 5-этилкарбоксамидоаденозин Продукт со стадии 2 (5,7 г) перемешивают с БОФ-С 1 (бис-(2-оксо-3-оксазолидинил)фосфонийхлорид) (4,26 г) и триэтиламином (2,33 мл) в 100 мл метиленхлорида в течение 20 мин при комнатной температуре. Этиламин (3,46 г) перемешивают в до раствора, который перемешивают в течение 2 часов при комнатной температуре. Органическую часть промывают разбавленным раствором НС, разбавленным , 2 и насыщенным солевым раствором и сушат (24), получая конечный продукт в виде пены. Пример 2. Получение -2-2,3-диметилметилендиокси-4-6-хлор-9-аденилциклопентан 1 этилкарбоксамида. Стадия 1 5,6-Диметилендиокси-2-азабицикло 2.2.1 гептан-3-он. 5,6-Дигидрокси-2-азабицикло 2.2.1 гептан-3-он (23,5 г)или полученный по способуи ,,и, и ,,26 (.1986) растворяют в ацетоне (150 мл),содержащем 2,2-диметоксипропан (185 мл) и п-толуолсульфоновую кислоту (5,25 г), и смесь нагревают с обратным холодильником в течение 10 мин, охлаждают, обрабатывают 3 (9,3 г) и концентрируют в вакууме. Остаток растворяют в СН 2 С 2, промывают насыщенным солевым раствором, сушат над 4 и растворитель выпаривают, получая масло. Масло хроматографируют на 2 (41, этилацетатгексан), получая 17,0 г (63 ) рыжевато-коричневого прозрачного твердого продукта (т. пл. 153-154 С). Стадия 2 -4-амино-2,3-диметилендиоксициклопентан-1 этилкарбоксамид. 5,6-Диметилендиокси-2-азабицикло 2.2.1 гептан-3-он (5 г), полученный на стадии 1,обрабатывают этиламином (15 мл) при 140 С около 7 ч. Полученный в результате продукт очищают путем флэш-хроматографии (22/3/,-диметилэтиламин, (90/7/3,получая -4-амино-2,3-диметилендиоксициклопентан-1 этилкарбоксамид (5,8 г). Обработка рацемического амина (13,1 г), полученного, как описано в части А, дибензоилвинной кислотой (21,6 г) дает 15,1 г энантиомерно чистой соли 70,1(С. 1,77, СН 3 ОН). Соль растворяют в 10 водноми водную фазу экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным солевым раствором, сушат над 4 и растворитель удаляют, получая оптически чистое соединение 31,4 С. 1,40, МеОН. Стадия 3 4(3-амино-4-хлор-2-пиримидиниламино)-2,3-диметилендиоксициклопентан-1 этилкарбоксамид. Конденсация 4-амино-2,3-диметилендиоксициклопентан-1 этилкарбоксамида(2,10 г), полученного на стадии 2, часть В, с 3-амино-2,4-дихлорпиридином (1,5 г) в нбутаноле (70 мл), содержащем триэтиламин (3 мл), в течение около 14 ч при нагревании с обратным холодильником с последующим удалением растворителя в вакууме дает масло,которое растворяют в этилацетате и промывают водным 3. Органический экстракт сушат над 24 и концентрируют в вакууме, получая оптически чистое соединение.15,8 С. 41,48, СН 3 ОН. 23 5053 1 Стадия 4 -4-(3-амино-4-хлор-2-пиримидиниламино)-2,3-диметилендиоксициклопентан (2,10 г), формамидинацетат (1,85 г) в метоксиэтаноле (2 мл) и диоксане (80 мл) перемешивают при 70 С в течение около 3 ч. Смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток растворяют в этилацетате, который промывают водным 3 и насыщенным солевым раствором, органический экстракт сушат над 24, концентрируют в вакууме и очищают путем колоночной флэш-хроматографии (метиленхлорид/метанол 955), получая чистый -2,3-диметилметилендиокси-4-6-хлор-9-аденилциклопентан-1 этилкарбоксамид (1,45 г). Альтернативно, оптически чистые 2,3-дизащищенные диокси-4-6-замещенные-9 аденил-циклопентан-1 этилкарбоксамидные производные могут быть получены по схеме реакции, приведенной в примере 3. Пример 3. Получение 2-2 а,3-циклогесилидендиокси-4-6-(2-тиенэтан-2-ил)-9-аденилциклопентан-1 этилкарбоксамида. Стадия 1 4-этилен-2,3-циклогесилидендиоксициклопентанон.(-)-2,3-Циклогесилидендиокси-4-циклопентанон (2,95 г), полученный по способу., . . . 1987, 52, 5457, добавляют в виде раствора в ТГФ (5 мл) к смеси винилмагнийбромида (15,2 ммоль) и(15,2 ммоль) в ТГФ (100 мл). Эту смесь выдерживают при -78 С в инертной атмосфере в течение около 2 ч, нагревают до 0 С и гасят насыщенным водным раствором 41. Органическую фазу промывают насыщенным солевым раствором, сушат над 4 и концентрируют в вакууме, получая желтое масло, которое очищают путем флэш-хроматографии (метиленхлорид, 100 ), получая 2,9 г желаемого соединения в виде масла. Стадия 2 4-этилен-1 гидрокси-2,3-циклогесилидендиоксициклопентан 3,95 мл 1 М раствора диизобутилалюминийгидрида в тетрагидрофуране добавляют к раствору ТГФ (75 мл) и кетона, полученного на стадии 1 (0,73 г), который охлаждают до-78 С. Смесь нагревают до -40 С в течение около 2,5 ч, обрабатывают 2 н(5 мл),нагревают до комнатной температуры и перемешивают в течение около 1,5 часов. Водную фазу экстрагируют диэтиловым эфиром и объединенные органические фазы промывают насыщенным солевым раствором, сушат над 4 и концентрируют в вакууме до получения желтого масла, которое очищают путем колоночной флэш-хроматографии (метилен-хлорид/метанол, 955), получая 0,65 г чистого продукта в виде вязкого масла. Стадия 3 4-этилен-1-трифторметансульфонил-2,3-циклогексилидендиоксициклопентан. Раствор 4-этилен-1-гидрокси-2,3-циклогексилидендиоксициклопентана (0,65 г) в метиленхлориде (5 мл) и пиридине (0,24 мл) добавляют к перемешиваемому раствору трифторметилсульфонил ангидрида (0,49 мл) в метиленхлориде (25 мл) при 0 С в атмосфере аргона. Через приблизительно 20 мин насыщенный солевой раствор добавляют к реакционной смеси, органическую фазу сушат над 24 и растворитель удаляют в вакууме, получая желаемый продукт в виде органического масла, который используют без дополнительной очистки. Стадия 4 1 этилен-2,3-циклогексилидендиокси-46-(2-тиенилэтан-2-ил)-9 аденилциклопентан. Раствор 6-тиофенилэтилпурина (2,13 г),(50 масляная дисперсия, 0,35 г) и 18 краун-6 (0,15 г) в ДМФ (60 мл) добавляют к раствору 4-этилен-1-трифторметилсульфонил-2,3-циклогексилидендиоксициклопентана, полученному на стадии 4, в ДМФ(2 мл) при 0 С. Смесь перемешивают при 0 С в течение около 8 ч, гасят насыщенным 4, растворитель удаляют в вакууме и остаток объединяют с этилацетатом (100 мл) и насыщенным солевым раствором. Органический слой сушат над 4 и концентрируют в вакууме, и сырой продукт очищают путем флэш-хроматографии (метиленхлорид/метанол (991, получая 0,85 г чистого продукта. 24 5053 1 Стадия 5 2 2,3-циклогексилидендиокси-46-(2-тиенилэтан-2-ил)-9-аденилциклопентан-1 этилкарбоксамид. Раствор -этилен-2 а,3-циклогексилидендиокси-46-(2-тиенилэтан-2-ил)-9-аденилциклопентана (0,32 г) в 2 мл бензола добавляют к бензоловому раствору перманганата калия (0,29 г) и 18-краун-6 (0,016 г) при 0 С. Реакционную смесь выдерживают при комнатной температуре в течение около 6 ч, добавляют 5 водный(15 мл), и водную фазу фильтруют через Целит и подкисляют до рН 5 1 н НС, и экстрагируют этилацетатом. Органические экстракты сушат над 4 и концентрируют в вакууме, получая 0,1 г 2,3-циклогексилидендиокси-46-(2-тиенилэтан-2-ил)-9-аденил-циклопентан 1 карбоксилата в виде желтого масла, которое растворяют в метиленхлориде (4 мл),содержащем дициклогексилкарбодимид (ДЦК) (0,044 г). Этиламин (0,4 мл) добавляют к смеси, которую перемешивают при комнатной температуре в течение около 18 ч, растворитель удаляют в вакууме и сырой продукт очищают путем флэш-хроматографии (метиленхлорид/метанол (982, получая 0,077 г чистого продукта. Пример 4. Получение 6-транс-2-(тиофен-2-ил)циклогекс-4-ен-ил)-аденозина. Транс-2-(2-тиофенил)циклогекс-4-ениламин (0,3 г), полученный по способу, описанному в примере С, выше, 6-хлорпуринрибозид (0,28 г) и триэтиламин (0,27 мл) в 20 мл этанола нагревают с обратным холодильником в течение ночи в атмосфере аргона. Реакционную смесь охлаждают до комнатной температуры, растворитель выпаривают и остаток очищают с помощью(хлороформметанол 955), последующая сушка в вакууме при приблизительно 80 С дает целевой продукт в виде твердого продукта, т. пл. 105-110 С элементный анализ, 202354. Пример 5. Получение 6-транс-2-(тиофен-2-ил)циклогекс-4-ен-1-иладенозин-5 этилкарбоксамида. Стадия 1 Транс-2-(тиофен-2-ил)циклогекс-4-ениламин и 2,3-диметилметилендиоксипроизводное 6 подвергают взаимодействию в условиях, описанных в примере 4, давая 2,3-диметилметилендиоксипроизводное целевого продукта. Стадия 2 2,3-диметилметилендиоксипроизводное желаемого продукта смешивают с трифторуксусной кислотой/водой (90/10) в течение 30 мин при комнатной температуре,нейтрализуют, медленно выливая смесь в насыщенный раствор бикарбоната натрия, и экстрагируют метиленхлоридом. Водный слой экстрагируют метиленхлоридом и органические слои объединяют, промывают насыщенным солевым раствором, сушат над сульфатом магния и фильтруют, отфильтрованный чистый раствор выпаривают. Остаток очищают с помощью флэш-хроматографии (метиленхлоридметанол 91), сушат в вакууме, получая целевой продукт в виде белой прозрачной пены, т.пл. 112-117 С 222664. Пример 6. Получение (-)-2-2,3-дигидрокси-46-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамида. Стадия 1 оптически чистый -2-2, 3-диметилметилендиокси-4(6-хлор-9 аденилциклопентан-1 этилкарбоксамид, полученный, как описано в примере 2, и 2(5-хлортиен-2-ил)-2-пропиламин,-15,6 С. 3,7, СН 3 ОН, полученный, как описано в примере 4, объединяют, как описано в примере 4, получая 2,3-диметилметилендиоксипроизводное целевого продукта. Стадия 2 диметилметилендиоксипроизводное со стадии (1) нагревают с обратным холодильником в 5 мл 50 водной муравьиной кислоты в течение около 3 ч. Охлажденную реакционную смесь выпаривают, к твердому осадку добавляют толуол и растворитель выпаривают. Остаток растворяют в этилацетате, промывают раствором бикарбоната натрия и насыщенным солевым раствором, сушат, фильтруют и выпаривают, получая после сушки в печи в течение ночи белый твердый продукт (0,240 г), т. пл. 188 -4 С 202563,-86,49 С. 5,5, МеОН. 25 5053 1 Примеры 7-29, 31-34. Следуя примерам 1-6 выше, получают соединения по настоящему изобретению, представленные в табл. 1. В примерах 7-21, 31 и 32 гетероциклический амин подвергают взаимодействию с коммерчески доступным 6-хлорпуринрибозидом в примерах 22 и 23 гетероциклический амин подвергают взаимодействию с 6-хлор-5 этилкарбоксамидоаденозином и в примерах 24-31, 33 и 34 гетероциклический амин подвергают взаимодействию либо с , либо с -2-2,3-диметилметилендиокси-4(6-хлор-9 аденилциклопентан-1 этилкарбоксамид. Таблица 1 Пример/ оптическое вращение спиртового предшественника амина 14,9 (с. 1,27, СН 3 ОН) оптическое вращение амина 25,8 (. 1,67, СН 3 ОН) с оптическое вращение-15,6 (с. 3,04, СН 3 ОН) амин, прореагировавший с 2,3-изопропилиденовым производным 6-хлор-5-этилкарбоксамид аденозина снятие защиты по примеру 11. Пример 30. Получение -6(тиофенил-2-ил)этан-2-ил 1-деазааристе-ромицин-5 этилкарбоксамида. Стадия 1 2-хлор-3-нитро-4-2-(2-тиофенил)этиламинопиридин. Смесь 2,4-дихлор-3-нитропиридина (1,5 г) 2-аминоэтилтиофена (1 г) и триэтиламина(5 мл) нагревают с обратным холодильником в(60 мл). Реакционную смесь охлаждают, растворитель выпаривают и остаток хроматографируют на силикагеле (10 гексан/СН 2 С 12), получая желаемый продукт присоединения. Стадия 2 -1 этилкарбоксамид-2,3-изопропилидендиокси-4-2-(3-нитро-42-(2-тиофенил)этиламинопиридил)-аминоциклопентан. Смесь тиофениламинопиридина со стадии (1) (1,8 ммоль), -1 этилкарбоксамид 4-амино-2,3-изопропилидендиокси-циклопентана (0,3 г) и триэтиламина (0,3 мл) нагревают с обратным холодильником в нитрометане (15 мл) в течение около 5 ч. Раствори 27(2 метанол/хлороформ), получая твердый продукт, который используют как таковой на следующей стадии. Стадия 3 -1 этилкарбоксамид-2,3-изопропилидендиокси-4-2-(3-амино-4-2(2-тиофенил)этиламинопиридил)-аминоциклопентан. Смесь нитросоединения со стадии (2) (0,39 г), / (0,01 г) в этаноле (7 мл) перемешивают в атмосфере водорода в течение около 5 ч. Катализатор отфильтровывают и после выпаривания фильтрата получают масло, которое очищают на флорисиле (10 метанол/метиленхлорид), получая желаемый продукт в виде твердого продукта. Стадия 4 -6-1-(тиофенил-2-ил)этан)-2-ил 1-деазааристеромицин-5 этилкарбоксамид. Смесь аминосоединения со стадии (3) (0,31 г) и формамидинацетата (0,72 г) в метоксиэтаноле (30 мл) нагревают с обратным холодильником в течение около 3 ч. Реакционную смесь охлаждают, растворитель выпаривают и к остатку добавляют воду (5 мл) и муравьиную кислоту (5 мл). Подкисленную смесь нагревают до 50 С в течение около 5 ч,после чего растворитель удаляют и остаток хроматографируют на силикагеле (10 метанол/метиленхлорид), получая масло, которое перекристаллизуют из этилацетата, получая желаемый продукт в виде кристаллического твердого вещества, т. пл. 155-156 С. Оптически чистое соединение получают, используяили - энантиомер циклопентанамина со стадии (2). Пример 35. Получение (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-1-1-метилэтиламино 9-аденилциклопентан-1 этилкарбоксамид-1-оксида. Раствор (2)-2,3-дигидрокси-43-6-2-(5-хлор-2-тие-нил)-1-1-метилэтиламино 9-аденилциклопентан-1 этилкарбоксамида (0,25 г) и ледяной уксусной кислоты (20 мл) в 30 перекиси водорода (1 л) перемешивают в течение 4 дней при комнатной температуре и смесь концентрируют в вакууме. Остаток очищают путем флэш-хроматографии,элюируют 20 метанолом в этилацетате, затем перемешивают с горячим метанолом и фильтруют, получая желаемый продукт, т. пл.240 С. Пример 36. Получение 1-,2,3,4-4-7-2-(5-хлор-2-тиенил)-1-метилэтиламино-3 Нимидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамида Стадия 1 получение 2-хлор-4-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-3-нитропиридина. Используя, по существу, процедуру примера 30, стадия 1, и очищая сырой продукт флэш-хроматографией, элюируя градиентом от 10 до 30 этилацетата в гептане, получают желаемый продукт из 2-(5-хлор-2-тиенил)-(1)-1-метилэтил-амина. Стадия 2 получение (-)-1 этил-2,3-изопропилиден-диокси-4-4-2-(5-хлор-2 тиенил)-(1)-1-метилэтиламино-3-нитро-2-пиридиламиноциклопентанкарбоксамида. 2-хлор-4-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-3-нитропирдин (0,68 г), (-)-1-этил-2,3-изопропилидендиокси-4-аминоциклопентанкарбоксамид (0,381 г) и триэтиламин (0,85 мл) объединяют в метаноле (50 мл) и смесь нагревают с обратным холодильником в течение около 18 ч. Смесь концентрируют в вакууме и сырой продукт очищают путем флэш-хроматографии, элюируя 0,5 метанолом в метиленхлориде, получая желаемый продукт. Стадия 3 получение (-)-1 этил-2,3-изопропилидендиокси-4-3-амино-4-2-(5 хлор-2-тиенил)-(1)-1-метилэтиламино-2-пиридиламиноциклопентанкарбоксамида.(-)-1 этил-2,3-изопропилидендиокси-4-4-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-3-нитро-2-пиридил-аминоциклопентанкарбоксамид (0,90 г) и хлорид дигидрат олова(2,1 г) смешивают в этаноле (20 мл) и смесь нагревают при 70 С в течение око 28 5053 1 ло 30 мин. Смесь выливают на лед, слегка подщелачивают водным раствором бикарбоната натрия и водный раствор экстрагируют этилацетатом. Этилацетатный раствор сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получая желаемый продукт,который используют без дополнительной обработки на следующей стадии. Стадия 4 получение 1-,2,3,4-4-7-2-(5-хлор-2-тиенил)-1-метилэтиламино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамида. Используя, по существу, процедуру примера 30, стадия 4, желаемый продукт, т. пл. 164-165 С, получают из (-)-1 этил-2,3-изопропилидендиокси-4-3-амино-4-2-(5 хлор-2-тиенил)-(1)-1-метилэтиламино-2-пиридиламиноциклопентанкарбоксамида. Используя, по существу, процедуру примера 30, получают соединения примеров из соответствующих исходных продуктов. Пример 37. 1-,2,3,4-4-7-2-(3-хлор-2-тиенил)-1-этилэтил-амино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид, т. пл. 79-82 С. Пример 38. 1-,2,3,4-4-7-2-(2-тиенил)-1-изопропилэтил-амино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид, т. пл. 75-85 С. Пример 39. 1-,2,3,4-4-7-2-(3-хлор-2-тиенил)-1-этилэтиламино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамид, т. пл. 75-78 С. Пример 40. 1-,2,3,4-4-7-2-(2-тиенил)-1-метилэтил-амино-3 Н-имидазо 4,5-пиридин-3-ил-этил-2,3-дигидроксициклопентанкарбоксамид, т. пл. 155-60 С. Пример 41. Получение 1-,2,3,4-4-7-2-(5-хлор-2-тиенил)-1-этилэтиламино-3 Н-имидазо 4,5-пиридин-3-илэтил-2,3-дигидроксициклопентанкарбоксамида. Используя, по существу, процедуру примера 36, желаемый продукт, т. пл. 77-85 С,получают из 2-(5-хлор-2-тиенил)-(1)-1-этилэтиламина. Пример 42. Получение (2)-2,3-бис-метоксикарбонилокси-4-6-2-(5-хлор-2-тиенил)-(1)-1 метилэтиламино-9-аденилциклопентан-1 этилкарбоксамида. К раствору (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино 9-аденилциклопентан-1 этилкарбоксамида (0,56 г), триэтиламина (0,5 мл) и 4-диметиламинопиридина (1 мг) в тетрагидрофуране (25 мл) добавляют метилхлорформиат (0,21 мл) и раствор перемешивают при комнатной температуре в течение 1 ч. Смесь разбавляют этилацетатом, промывают насыщенным солевым раствором и органический раствор сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Сырой продукт перекристаллизуют из гексана/этилацетата, получая желаемый продукт, т. пл. 74-76 С. Пример 43. Получение (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино 9-аденилциклопентанэтилкарбоксамида этоксиметиленацеталя. Раствор (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино 9-аденилциклопентан-1 этилкарбоксамида (0,14 г), триэтилортоформиата (3 мл) и птолуолсульфоновую кислоту (1 мг) нагревают с обратным холодильником в течение около 1 ч и растворитель затем отделяют в вакууме. Остаток растворяют в этилацетате и раствор промывают насыщенным солевым раствором, сушат над сульфатом натрия, фильтруют,концентрируют в вакууме. Сырой продукт очищают путем флэш-хроматографии, элюируют 5 метанолом в метиленхлориде с последующей перекристаллизацией из гексана/этилацетата, получая желаемый продукт, т. пл. 67-70 С. 29 5053 1 Пример 44. Получение (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино 9-аденилциклопентанэтилкарбоксамид-2,3-карбоната. Раствор (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино 9-аденилциклопентан-1 этилкарбоксамида (0,17 г) и 1,1-карбонилдиимидазола (0,071 г) в бензоле (5 мл) нагревают с обратным холодильником в течение 5 ч, затем перемешивают при 60 С в течение примерно 18 ч. Раствор промывают насыщенным соляным раствором, сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Остаток очищают путем флэш-хроматографии, элюируют 5 метанолом в метиленхлориде с последующей кристаллизацией из гексана/этилацетата, получая желаемый продукт, т. пл. 87-89 С. Пример 45. Получение (2)-2,3-бис-метилкарбамоилокси-4-6-2-(5-хлор-2-тиенил)-(1)1-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамида. К раствору (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино-9-аденилциклопентан-1 этилкарбоксамида (0,16 г) в тетрагидрофуране (5 мл) добавляют метилизоцианат (0,05 мл) и 1,8-диазабицикло 5.4.0 ундек-7-ен (1 каплю). Раствор перемешивают при 50 С в течение около 2,5 ч, охлаждают до комнатной температуры,разбавляют этилацетатом и промывают насыщенным солевым раствором. Органический раствор промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают путем флэш-хроматографии, элюируют 5 метанолом в метиленхлориде с последующей кристаллизацией из гексана/этилацетата,получая желаемый продукт, т. пл. 97-99 С. Пример 46. Получение (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино 9-аденилциклопентанэтилкарбоксамид-2,3-тиокарбоната. Раствор (2)-2,3-дигидрокси-4-6-2-(5-хлор-2-тиенил)-(1)-1-метилэтиламино 9-аденилциклопентан-1 этилкарбоксамида (0,35 г) и тиокарбонилдиимидазола (0,134 г) в бензоле (10 мл) нагревают при 45 С в течение около 2 ч. Раствор промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают путем флэш-хроматографии, элюируют 5 метанолом в гексане с последующей кристаллизацией из гексана, получая желаемый продукт, т. пл. 115-117 С. Пример 47. Получение 6-2-(3-хлор-2-тиенил)-(1)-1-метилэтил-2 метиладенозина. Раствор 6-хлор-9-(2-О-метилрибофуранозил)-9 Н-пурина (полученного согласно Европейской патентной публикации 0378518) (0,28 г), 2-(3-хлор-2-тиенил)-(1)-1 метилэтиламина (0,163 г) и триэтиламин (0,5 мл) в этаноле (30 мл) нагревают с обратным холодильником в течение около 18 ч, охлаждают и концентрируют в вакууме. Остаток очищают путем флэш-хроматографии, элюируют 10 метанолом в метиленхлориде с последующей кристаллизацией из гексана/этилацетата, получая желаемый продукт, т. пл. 75-76 С. Пример 48. Получение 6-2-(5-хлор-2-тиенил)-(1)-1-метилэтил-2 метиладенозина. Используя, по существу, процедуру примера 47, желаемый продукт, т. пл. 84-85 С,получают из 2-(5-хлор-2-тиенил)-(1)-1-метилэтиламина. Пример 49. Получение 6-транс-5-(2-тиенил)циклогекс-1-ен-4-ил-2 метиладенозина. Используя, по существу, процедуру примера 47, желаемый продукт, т.пл. 86-89 С,получают из транс-2-(2-тиенил)циклогекс-4-ениламина. 30
МПК / Метки
МПК: A61K 31/52, C07H 19/16, C07D 473/34, A61P 3/06, A61P 9/12
Метки: пациентов, производные, композиция, лечения, гипертонии, гипертонией, аденозина, страдающих, способ
Код ссылки
<a href="https://by.patents.su/30-5053-proizvodnye-adenozina-kompoziciya-dlya-lecheniya-gipertonii-i-sposob-lecheniya-pacientov-stradayushhih-gipertoniejj.html" rel="bookmark" title="База патентов Беларуси">Производные аденозина, композиция для лечения гипертонии и способ лечения пациентов, страдающих гипертонией</a>
Предыдущий патент: Способ получения смесей битума и термопластического полимера, смеси битума и полимера
Следующий патент: Способ получения циклических лактамов, преимущественно капролактама
Случайный патент: Устройство измерения углов и перемещений