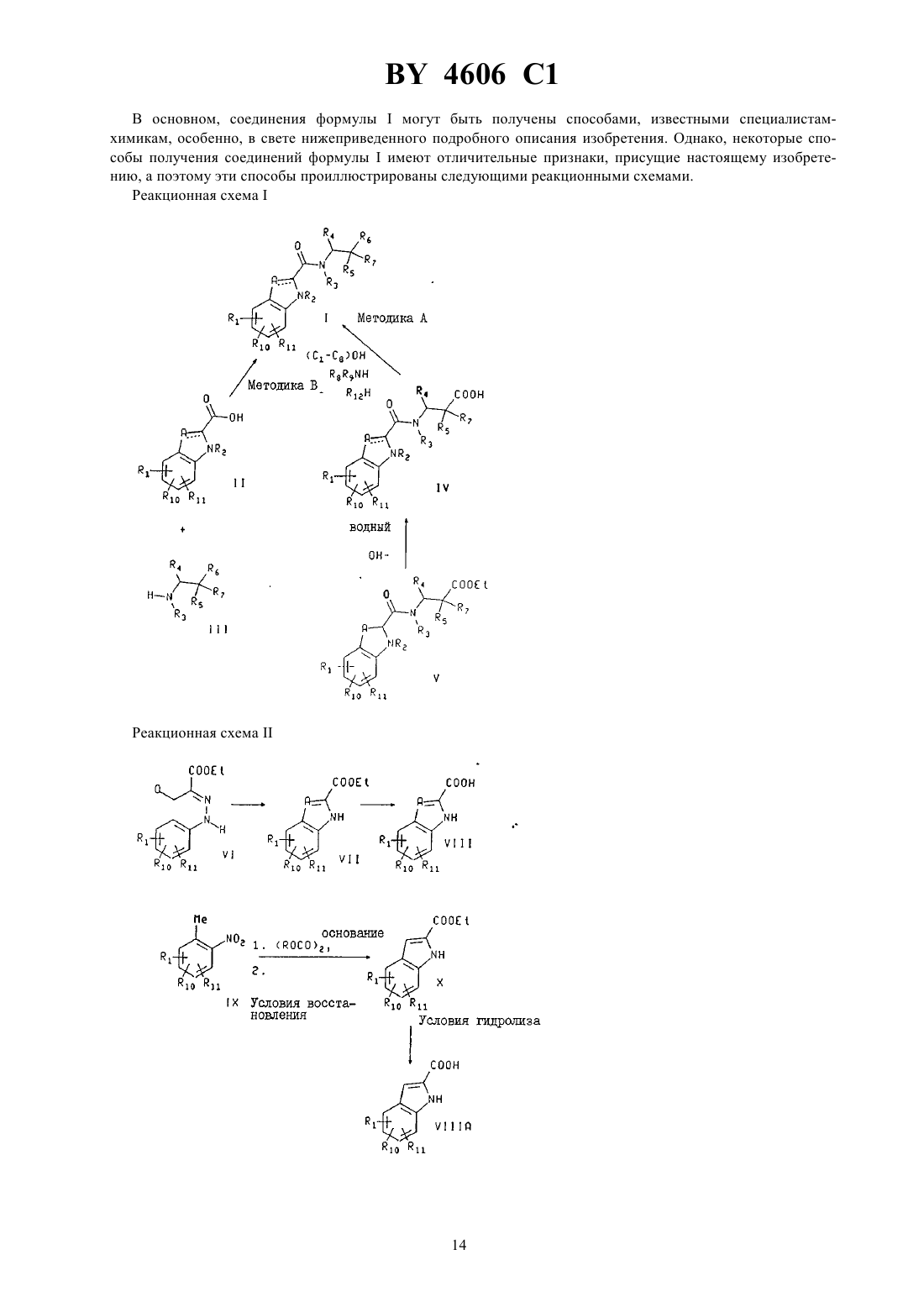
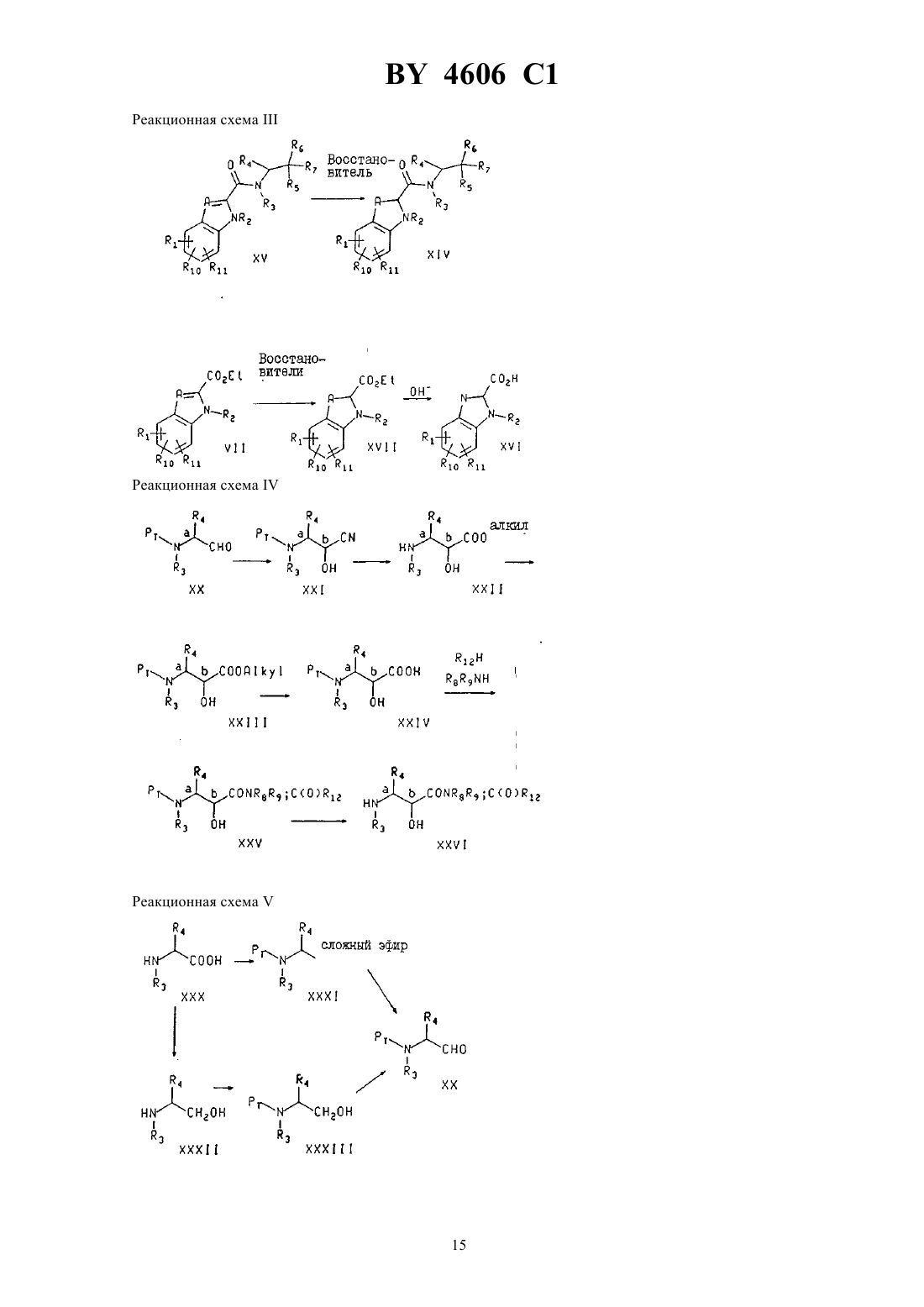
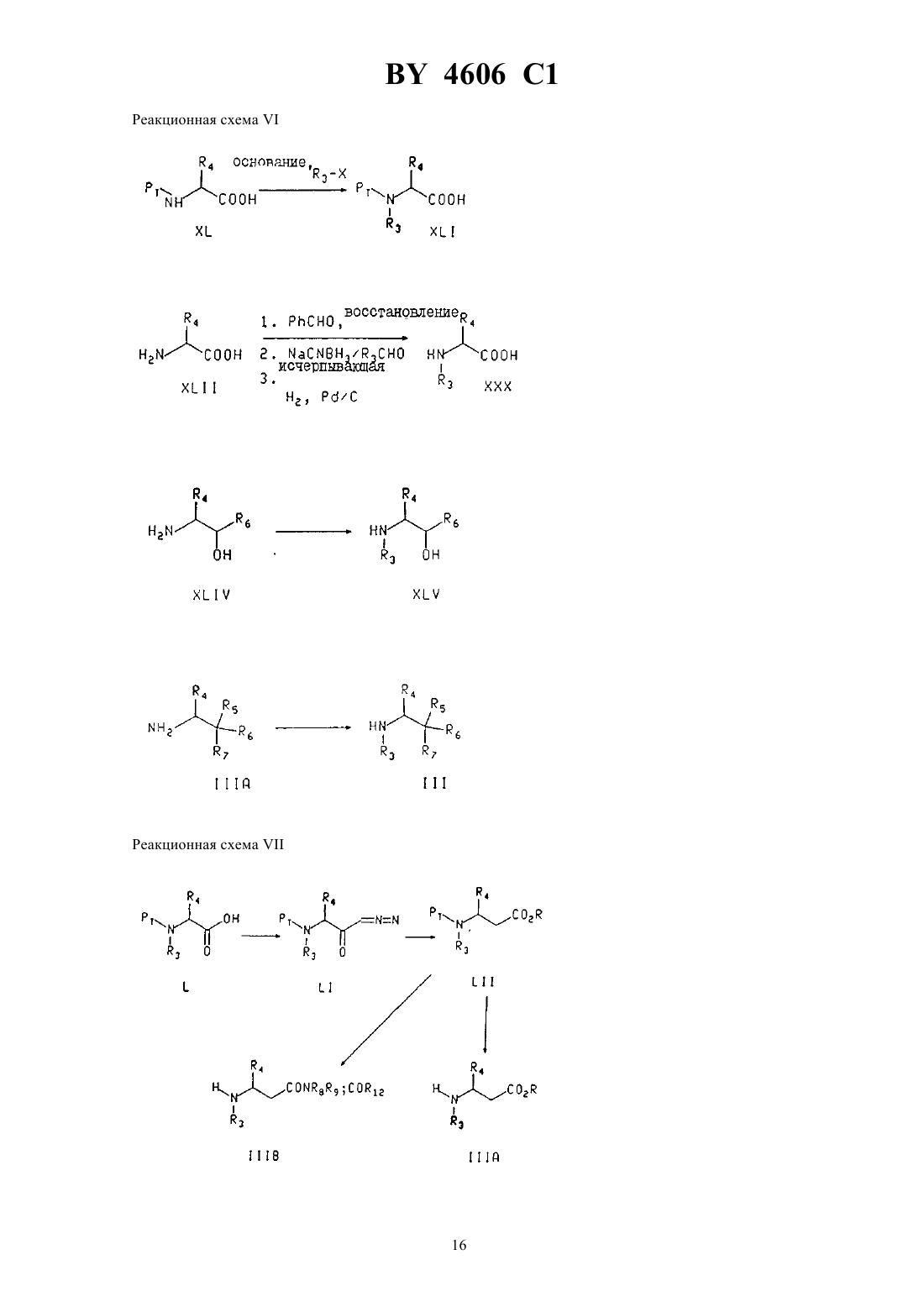
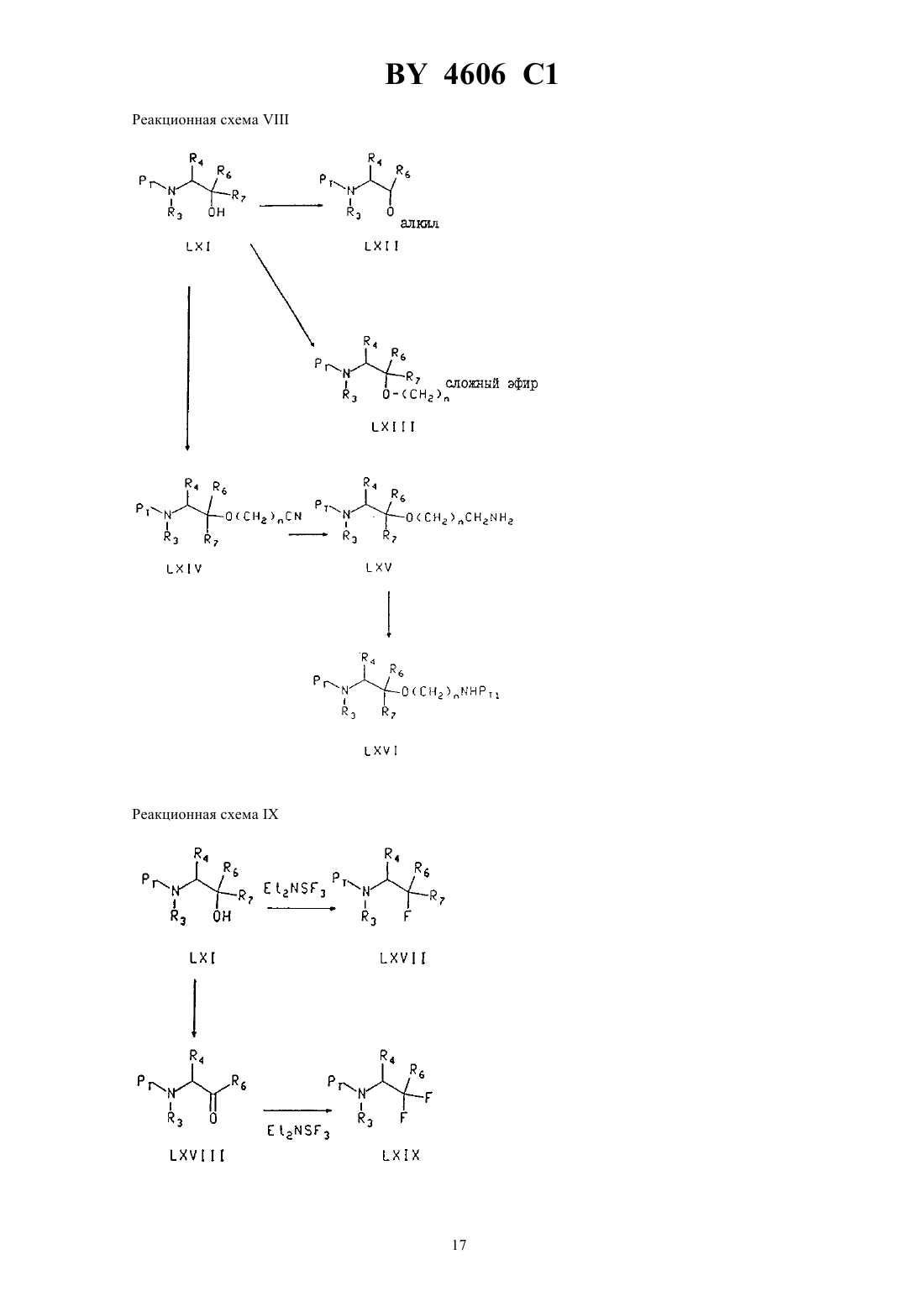
Производные замещенных N-(индол-2-карбонил)-(-аланинамидов, способ лечения гликогенфосфорилазозависимых заболеваний, фармацевтическая композиция
Номер патента: 4607
Опубликовано: 30.09.2002
Авторы: ТРЕДВЕЙ, Юдит Ли, ХУВЕР, Деннис Джей, МАРТИН, Вилльям Холт, ХЬЮЛИН, Бернард
Текст
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ПРОИЗВОДНЫЕ ЗАМЕЩЕННЫХ -(ИНДОЛ-2-КАРБОНИЛ)-АЛАНИНАМИДОВ, СПОСОБ ЛЕЧЕНИЯ ГЛИКОГЕНФОСФОРИЛАЗОЗАВИСИМЫХ ЗАБОЛЕВАНИЙ,ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ или их фармацевтически приемлемые соли или сложные эфиры,где пунктирная линияобозначает связь А представляет собой -С(Н), -(1-С 4-алкил)или -С(галоген)1, 10, 11 независимо представляют водород, галоген, циано, С 1-4-алкил или С 1-4-алкокси 2 - водород 3 - водород 4 - водород, метил, этил, н-пропил, гидрокси-С 1-С 3-алкил, С 1-С 3-алкокси-С 1-С 3-алкил, фенил-С 1-4 алкил, тиен-2- или -3-ил-С 1-С 4-алкил, где указанные кольца 4 независимо моно- или дизамещены у атома углерода галогеном 5 - водород, гидрокси, С 1-С 5-алкил, С 1-С 5-алкокси, бензилоксикарбонил-С 1-С 4-алкокси, карбокси-С 1-4 алкокси или 5-хлор-1 Н-индол-2-карбонилокси 7 - водород или С 1-5-алкил или 5 и 7 вместе представляют оксогруппу 6 - карбокси, 1-8-алкоксикарбонил, 89 или 12,где 8 - водород, 1-С 3-алкил, гидрокси или 1-С 3-алкокси 4606 1 9 - водород, 1-8-алкил, гидрокси, гидрокси-1-5-алкил, 1-8-алкокси, метилен-перфторированный 1-8-алкил, пиридил или пиперидинил, где указанные кольца 9 присоединены через связь углерод-азот, и где неароматические азотсодержащие кольца 9 необязательно замещены у атома азота С 1-4-алкилом, бензилом или 1-С 6-алкоксикарбонилом 12 - пиперазин-1-ил, 4-(1-4-алкил)пиперазин-1-ил, 4-формилпиперазин-1-ил, морфолино, тиоморфолино, 1-оксотиоморфолино, 1,1-диоксотиоморфолино, тиазолидин-3-ил или 1-оксотиазолидин-3-ил или 12 - 2-, 4- и/или 5-моно- или дизамещенный тиазолидин-3-ил, 3- и/или 4-моно- или дизамещенный пирролидин-1-ил, 3-, 4- и/или 5- моно-, ди- или тризамещенный пиперидин-1-ил, 3-, 4- и/или 5-моно-, ди- или тризамещенный пиперазин-1-ил, 3-замещенный азетидин-1-ил, 4- и/или 5-моно- или дизамещенный 1,2 оксазинан-2-ил, 4- и/или 5-моно- или дизамещенный изоксазолидин-2-ил, где указанные заместители независимо представляют водород, гидрокси, формил, оксо, карбокси, 1-6-алкоксикарбонил или гидрокси-1-С 5 алкил при условии, что если 4 является водородом, метилом, этилом или н-пропилом, то 5 является ОН при условии, что если 5 и 7 являются водородом, то 4 не является водородом, метилом, этилом, нпропилом, гидрокси-1-С 3-алкилом,6 является 89, 12 или 1-4-алкоксикарбонилом. 2. Соединение по п. 1,где 1 - 5-Н, 5-галоген, 5-метил или 5-циано 10 и 11 независимо - Н или галоген А - -С(Н)2 и 3 - Н 4 - фенил-1-2-алкил, где указанная фенильная группа независимо моно- или дизамещена галогеном или 4 - тиен-2- или -3-ил-1-2-алкил 5 - гидрокси 6 - 89 или 12 и 7 - Н. 3. Соединение по п. 2,где атом углерода а имеет -конфигурацию атом углеродаимеет -конфигурацию 4 представляет собой фенил-1-2-алкил, тиен-2-ил-1-С 2-алкил или тиен-3-ил-С 1-С 2-алкил, где указанные кольца независимо моно- или дизамещены фтором 6 - 89 8 - С 1-С 3-алкил, гидрокси или С 1-С 3-алкокси,9 - Н, С 1-8-алкил, гидрокси-1-6-алкил, С 1-С 8-алкокси, пиридил или пиперидинил. 4. Соединение по п. 3, выбранное из группы, включающей 5-хлор-1 Н-индол-2-карбоновой кислоты гидроксидиметилкарбамоилметил-2-фенилэтиламид 5,6-дихлор-1 Н-индол-2-карбоновой кислоты гидрокси(метоксиметилкарбамоил)метил-2-фенилэтиламид 5-хлор-1 Н-индол-2-карбоновой кислоты (1)гидрокси(метоксиметилкарбамоил)метил-2-фенилэтиламид 5-хлор-1 Н-индол-2-карбоновой кислоты 1)гидрокси-(2-гидроксиэтилметилкарбамоил)метил-2 фенилэтил)амид 5-хлор-1 Н-индол-2-карбоновой кислоты (1)гидрокси(метилпиридин-2-илкарбамоил)метил-2 фенилэтиламид и 5-хлор-1 Н-индол-2-карбоновой кислоты (1)гидроксиметил-(2-пиридин-2-ил-этил)карбамоилметил-2 фенилэтиламид. 5. Соединение по п. 3, где 1 представляет собой 5-хлор 10 и 11 - Н 4 - бензил 8 - метил и 9 - метил. 6. Соединение по п. 3, где 1 представляет собой 5-хлор 11 - Н 10 - 6-хлор 4 - бензил 8 - метил и 9 4606 1 11. Соединение по п. 2, где атом углерода а имеет -конфигурацию атом углеродаимеет конфигурацию 4 представляет собой фенил-1-2-алкил, тиен-2-ил-С 1-С 2-алкил или тиен-3-ил-С 1-С 2-алкил, где указанные кольца независимо моно- или дизамещены фтором 6 - 12 и 12 - морфолино, 4-(1-4-алкил)пиперазин-1-ил, 3-замещенный азетидин-1-ил, 3- и/или 4-, моно- или дизамещенный пирролидин-1-ил, 4- и/или 5-моно- или дизамещенный изоксазолидин-2-ил, 4- и/или 5-моноили дизамещенный 1,2-оксазинан-2-ил, где указанные заместители независимо представляют собой водород,гидрокси или оксо. 12. Соединение по п. 1, выбранное из группы, включающей 5-хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-(2)-гидрокси-3-(4-метилпиперазин-1-ил)-3-оксопропиламида гидрохлорид 5-хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-(2)-гидрокси-3-(3-гидроксиазетидин-1-ил)-3-оксопропиламид 5-хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-(2)-гидрокси-3-изоксазолидин-2-ил-3-оксопропиламид 5-хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-(2)-гидрокси-3-1,2 оксазинан-2-ил-3-оксопропил)амид 5-хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-(2)-гидрокси-3-3)-гидроксипирролидин-1-ил)-3 оксопропиламид 5-хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-3-3),4)-дигидроксипирролидин-1-ил)-(2)-гидрокси-3-оксопропиламид 5-хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-3-3),4)-дигидроксипирролидин-1-ил)-(2)-гидрокси-3-оксопропиламид и 5-хлор-1 Н-индол-2-карбоновой кислоты(1)-бензил-(2)-гидрокси-3-морфолин-4-ил-3-оксопропиламид. 13. Соединение по п. 11, где 1 представляет собой 5-хлор 10 и 11 - Н 4 - бензил и 12 - 4-метилпиперазин-1-ил. 14. Соединение по п. 11, где 1 представляет собой 5-хлор 10 и 11 - Н 4 - бензил и 12 - 3-гидроксиазетидин-1-ил. 15. Соединение по п. 11, где 1 представляет собой 5-хлор 10 и 11 - Н 4 - бензил и 12 - изоксазолидин-2 ил. 16. Соединение по п. 11, где 1 представляет собой 5-хлор 10 и 11 - Н 4 - бензил и 12 - (1,2)-оксазинан 2-ил. 17. Соединение по п. 11, где 1 представляет собой 5-хлор 10 и 11 - Н 4 - бензил и 12 - 3-гидроксипирролидин-1-ил. 18. Соединение по п. 11, где 1 представляет собой 5-хлор 10 и 11 - Н 4 - бензил и 12 - (3,4)-дигидроксипирролидин-1-ил. 19. Соединение по п. 11, где 1 представляет собой 5-хлор 10 и 11 - Н 4 - бензил и 12 -(3,4)-дигидроксипирролидин-1-ил. 20. Соединение по п. 11, где 1 представляет собой 5-хлор 10 и 11 - Н 4 - бензил и 12 - морфолино. 21. Соединение по п. 1, где 1 представляет собой водород, галоген, метил или циано 10 и 11 - Н или галоген А - -С(Н)2 и 3 - Н 4 - фенил-1-2-алкил, где указанная фенильная группа независимо моно- или дизамещена галогеном или 4 - тиен-2- или -3-ил-С 1-С 2-алкил,5 - гидрокси 6 - карбокси или 1-8-алкоксикарбонил и 7 - водород или 1-6-алкил. 22. Соединение по п. 21,где атом углерода а имеет -конфигурацию атом углеродаимеет -конфигурацию 4 представляет собой фенил-С 1-С 2-алкил, тиен-2-ил-С 1-С 2-алкил или тиен-3-ил-С 1-С 2-алкил, где указанные кольца независимо моно- или дизамещены фтором 10 и 11 - Н 6 представляет собой карбокси и 7 - Н. 3 4606 1 23. Соединение по п. 22, где 1 представляет собой 5-хлор 10 и 11 - Н 4 - бензил. 24. Соединение по п. 1, где 1 представляет собой Н, галоген, метил или циано 10 и 11 - Н или галоген А - -С(Н)2 и 3 - Н 4 - фенил-1-2-алкил, где указанная фенильная группа независимо моно- или дизамещена галогеном или 4 - тиен-2- или -3-ил-С 1-С 2-алкил,5 - С 1-С 4-алкил, С 1-С 5-алкокси, карбокси-С 1-4-лкокси или бензилоксикарбонил-С 1-С 4-алкокси 6 - карбокси или 1-8-алкоксикарбонил и 7 - водород, 1-6-алкил. 25. Соединение по п. 1, где 1 представляет собой Н, галоген, метил или циано 10 и 11 - Н или галоген А - -С(Н)2 и 3 - Н 4 - фенил-1-2-алкил, где указанная фенильная группа независимо моно- или дизамещена галогеном или 4 - тиен-2- или -3-ил-С 1-С 2-алкил,5 - С 1-С 4-алкил, С 1-С 5-алкокси, карбокси-С 1-4-лкокси или бензилоксикарбонил-С 1-С 4-алкокси 6 - 89 или 12 и 7 - водород или 1-6-алкил. 26. Способ лечения гликогенфосфорилазозависимого заболевания или состояния у млекопитающего,предусматривающий введение млекопитающему, страдающему гликогенфосфорилазозависимым заболеванием или состоянием, терапевтически эффективного для лечения указанного заболевания или состояния количества соединения по п. 1. 27. Способ по п. 26, отличающийся тем, что предназначен для лечения гипергликемии у млекопитающего и предусматривает введение млекопитающему, страдающему гипергликемией, эффективного для лечения гипергликемии количества соединения по п. 1. 28. Способ по п. 26, отличающийся тем, что предназначен для лечения диабета у млекопитающего, предусматривающий введение млекопитающему, страдающему диабетом, эффективного для лечения диабета количества соединения по п. 1. 29. Способ по п. 26, отличающийся тем, что предназначен для лечения гиперхолестеринемии у млекопитающего и предусматривает введение млекопитающему, страдающему гиперхолестеринемией, эффективного для лечения гиперхолестеринемии количества соединения по п. 1. 30. Способ по п. 26, отличающийся тем, что предназначен для лечения атеросклероза у млекопитающего и предусматривает введение млекопитающему, страдающему атеросклерозом, эффективного для лечения атеросклероза количества соединения по п. 1. 31. Способ по п. 26, отличающийся тем, что предназначен для лечения гиперинсулинемии у млекопитающего и предусматривает введение млекопитающему, страдающему гиперинсулинемией, эффективного для лечения гиперинсулинемии количества соединения по п. 1. 32. Способ по п. 26, отличающийся тем, что предназначен для лечения гипертензии у млекопитающего и предусматривает введение млекопитающему, страдающему гипертензией, эффективного для лечения гипертензии количества соединения по п. 1. 33. Способ по п. 26, отличающийся тем, что предназначен для лечения гиперлипидемии у млекопитающего и предусматривает введение млекопитающему, страдающему гиперлипидемией, эффективного для лечения гиперлипидемии количества соединения по п. 1. 34. Способ по п. 26, отличающийся тем, что предназначен для пдпждния ишемического повреждения миокарда у млекопитающего и предусматривает введение млекопитающему, подверженному риску ишемического повреждения миокарда в ходе операции, эффективного для предупреждения указанного повреждения количества соединения по п. 1. 35. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении гликогенфосфорилазы, содержащая терапевтически эффективное количество соединения по п. 1 и фармацевтически приемлемый носитель. 36. Фармацевтическая композиция по п. 35, отличающаяся тем, что предназначена для лечения гликогенфосфорилазозависимых заболеваний или состояний у млекопитающих и включает в себя терапевтически эффективное для лечения указанного заболевания или состояния количество соединения по п. 1 и фармацевтически приемлемый носитель. Настоящее изобретение относится к ингибиторам гликогенфосфорилазы к фармацевтическим композициям, содержащим такие ингибиторы, и к использованию указанных ингибиторов для лечения диабета, гипергликемии, гиперхолестеринемии, гипертензии, гиперинсулинемии, гиперлипемии, атеросклероза и ишемии миокарда у млекопитающих. Несмотря на сделанное уже давно открытие инсулина и его последующее широкое применение для лечения диабета, а также более позднее открытие возможности использования сульфонилмочевин (например,ХлорпропамидаТМ , ТолбутамидаТМ , АцетогексамидаТМ ( ), ТолазамидаТМ (,и бигуанидов (например, ФенформинаТМ ( ), МетформинаТМ (в качестве пероральных гипогликемических средств, лечение диабета этими средствами пока не дает удовлетворительных результатов. Использование инсулина, необходимое почти 10 больных диабетом, для которых синтетические гипогликемические средства являются неэффективными (диабет типа 1, инсулин-зависимый диабет), требует ежедневного введения многократных доз, обычно, путем инъекций, проводимых самим пациентом. Определение точной дозы инсулина требует частого проведения анализов мочи или крови на сахар. Введение избыточной дозы инсулина может вызвать гипогликемию с различной степенью тяжести, варьирующейся от легких изменений уровня глюкозы в крови до коматозного состояния или даже смерти. Лечение инсулиннезависимого диабета (диабетатипа, ИНСД) обычно предусматривает применение комплексных мер, а именно диеты упражнений приема пероральных препаратов, например сульфонилмочевины, и, в более тяжелых случаях, введения инсулина. Однако имеющиеся клинические препараты гипогликемизирующего действия могут обладать другими побочными эффектами, ограничивающими их использование. В любом случае там, где один из указанных препаратов не дает желаемого результата, может быть с успехом использован другой препарат. Поэтому постоянная потребность в получении новых гипогликемических средств,которые обладали бы меньшим побочным действием и были бы более эффективными по сравнению с другими имеющимися средствами, является совершенно очевидным фактом. Как было уже признано специалистами, атеросклероз (системное поражение артерий) является одной из главных причин смертности в Соединенных штатах Америки и в Западной Европе. Цепь патологий, приводящая к атеросклерозу и окклюзивных заболеваний сердца, хорошо известна. На ранней стадии этой патологической цепи происходит образование жировых пластов в сонной, венечной и мозговой артериях и в аорте. Эти поражения имеют желтый цвет благодаря присутствию липидных отложений, обнаруживаемых,главным образом, в клетках гладких мышц и в макрофагах внутренней оболочки (интимы) артерий и аорты. Кроме того, было высказано мнение, что большая часть холестерина, находящегося в указанных жировых пластах, в свою очередь, вызывает развитие атеросклеротических бляшек, которые состоят из аккумулированных клеток интимальных гладких мышц, нагруженных липидом и окруженных внеклеточным липидом, коллагеном, эластином и протеогликанами. Эти клетки вместе с матриксом образуют соединительнотканный слой, который покрывает более глубокие отложения клеточного дебриса и находящегося над ними клеточного липида. Этот липид представляет собой, в основном, свободный и этерифицированный холестерин. Такие бляшки из соединительной ткани образуются довольно медленно и со временем подвергаются кальцификации и некрозу, что приводит к развитию осложнений, являющихся причиной артериальной окклюзии и способствующих возникновению пристеночного тромбоза и спазма артериальной мышцы, т.е. признаков, характерных для прогрессирующего атеросклероза. Эпидемиологические данные ясно свидетельствуют о том, что гиперлипидемия является главным фактором риска в развитии сердечно-сосудистых заболеваний , обусловленных атеросклерозом. В последнее время ведущие специалисты в области медицины придают особое значение снижению уровня холестерина в крови, а особенно холестерина низкой плотности, как главной мере для предупреждения . При этом верхние пределы нормального уровня холестерина должны быть, как считают специалисты, значительно ниже тех уровней, которые были признаны до настоящего времени. Исходя из этих соображений, совершенно очевидно, что большая часть населения Западной Европы и Америки составляет группу повышенного риска. Такими независимыми факторами риска являются непереносимость глюкозы, гипертрофия левого желудочка, гипертензия и мужской пол. Сердечно-сосудистые заболевания чаще всего встречаются у больных диабетом, что, по крайней мере, отчасти, можно объяснить наличием у этих индивидуумов множества независимых факторов риска. Поэтому успешное лечение гиперлипидемиии у основной части населения, а в частности у больных диабетом, имеет исключительно важное значение. 4606 1 Гипертензия (или повышенное кровяное давление) представляет собой состояние человека, которое имеет вторичный характер, и является лишь симптомом, связанным с различными другими нарушениями органов или систем, такими как стеноз почечной артерии, феохромоцитома или эндокринные расстройства. Однако гипертензия также наблюдается у многих пациентов, у которых отсутствуют какие-либо характерные для гипертензии этиологические факторы или расстройства. Хотя такая первичная гипертензия часто ассоциируется с различными расстройствами, такими как ожирение, диабет и гипертриглицеридемия, однако прямой связи гипертензии с указанными расстройствами не было установлено. Кроме того, симптомы высокого кровяного давления наблюдаются у пациентов, у которых полностью отсутствуют признаки каких-либо других заболеваний или расстройств. Известно, что гипертензия может непосрественно приводить к сердечной недостаточности, почечной недостаточности и к инсульту (кровоизлиянию в мозг). Эти состояния могут привести к скоропостижной смерти пациента. Гипертензия может также способствовать развитию атеросклероза и ишемической болезни сердца. Эти заболевания постепенно ослабляют организм пациента и могут, в конце концов, медленно привести к летальному исходу. Точная причина первичной гипертензии пока неизвестна, хотя имеются некоторые предположения о ряде факторов, способствующих возникновению этого заболевания. Такими факторами являются, например,стрессы неконтролируемые эмоции нерегулируемое высвобождение гормонов (ренина, ангиотензина, системы альдостерона) избыточное количество соли и воды в организме, обусловленное недостаточной функцией почек утолщение стенок и гипертрофия сосудистой сети, приводящие к сужению кровеносных сосудов, и генетические факторы. Учитывая вышеуказанные факторы, были предприняты попытки лечения первичной гипертензии. В связи с этим был разработан широкий ряд бета-блокаторов, сосудосуживающих средств, ингибиторов ангиотензин-конвертазы (т.е. фермента, конвертирующего ангиотензин) и т.п., которые были квалифицированы как гипотензивные средства. Лечение гипертензии с использованием указанных соединений было признано успешным для предупреждения скоропостижной смерти, например, от сердечной недостаточности, почечной недостаточности и кровоизлияния в мозг. Однако применение указанных средств не решает проблем,связанных с развитием атеросклероза или заболеваний сердца, обусловленным гипертензией, протекающей в течение длительного периода времени. Это означает, что хотя с помощью таких средств может быть снижено кровяное давление, однако эти средства не могут устранить причину, лежащую в основе возникновения первичной гипертензии. Гипертензия также ассоциируется с повышенными уровнями инсулина в крови, т.е. состояния, известного как гиперинсулинемия. Инсулин, который представляет собой пептидный гормон, стимулирует утилизацию глюкозы, пептидный синтез и образование и сохранение нейтральных липидов, а также, помимо всего прочего, он стимулирует рост сосудистых клеток и способствует удержанию натрия в почках. Эти две последние функции инсулина могут осуществляться независимо от уровней глюкозы в крови и являются известными причинами возникновения гипертензии. Так, например, рост периферической сосудистой сети может вызывать сужение периферических капилляров, а повышение концентрации натрия способствует увеличению объема крови. Поэтому снижение уровня инсулина при гиперинсулинемии может способствовать предупреждению аномального роста сосудистой ткани и повышению содержания натрия в почках, обусловленных высокими уровнями инсулина в крови, и, следовательно, такое снижение уровня инсулина повлечет за собой ослабление симптомов гипертензии. Гипертрофия сердца является серьезным фактором риска, провоцирующим внезапную смерть, инфаркт миокарда и застойную сердечную недостаточность. Указанные явления, по крайней мере частично, обусловлены повышенной восприимчивостью пациента к повреждению миокарда после ишемии и реперфузии, которое может происходить у амбулаторных больных, а также в процессе операции. При этом не существует какоголибо подходящего лекарственного средства, которое позволило бы предотвратить или минимизировать неблагоприятный исход операции на сердце, а особенно операции по поводу инфаркта миокарда. Любая хирургическая операция, даже если она проводится не на сердце, связана со значительным риском возникновения инфаркта миокарда, а иногда может приводить к летальному исходу. Примерно из 7 миллионов человек,подвергающихся операциям, не связанным с хирургией сердца, 20-25 пациентов либо умирают уже во время операции, либо получают серьезные осложнения на сердце. Кроме того, из 400 000 пациентов, ежегодно подвергающихся операции на сердце с использованием аппаратов искусственного кровообращения, 1-2 пациентов умирают во время операции, а у 5 в ходе операции возникает инфаркт миокарда. В настоящее время не существует какой-либо лекарственной терапии, которая способствовала бы снижению уровня повреждения сердечных тканей во время операций по поводу ишемии миокарда или усилению резистентности сердечной ткани к приступам ишемии. Такая терапия, как ожидается, могла бы сохранить жизнь пациентам, снизить число госпитализаций, повысить качество жизни и уменьшить затраты на медицинскую помощью пациентам группы высокого риска. 4606 1 Продуцирование глюкозы в печени является важным фактором при лечении инсулин-независимого сахарного диабета (ИНСД). Печень является главным регулятором уровней глюкозы в крови в постабсорбтивном (голодном) состоянии при этом у пациентов с ИНСД, степень продуцирования глюкозы значительно выше, чем у нормальных индивидуумов. Аналогичным образом, после приема пищи, когда печень играет относительно меньшую роль в общей доставке глюкозы в плазму крови, продуцирование глюкозы в печени у пациентов с ИНСД является аномально высоким. Одним из основных способов предупреждения образования глюкозы в печени является прекращение процесса гликогенолиза. Печень продуцирует глюкозу благодаря процессам гликогенолиза (расщепление глюкозных остатков гликогенового полимера) и глюконеогенеза (синтез глюкозы из 2- и 3-углеродных предшественников). Имеется ряд данных, свидетельствующих о том, что гликогенолиз может вносить важный вклад в продуцирование глюкозы в печени у больных диабетом. Во-первых, по оценкам специалистов,до 75 продуцирования глюкозы в печени у нормальных индивидуумов в постабсорбтивном состоянии обусловлено гликогенолизом. И, во-вторых, у пациентов, страдающих заболеванием, связанным с аномальным накоплением гликогена в печени, включая заболевание Герса (недостаточность гликогенфосфорилазы в печени), наблюдается эпизодическая гипогликемия. Эти наблюдения дают основание предположить, что гликогенолиз может играть важную роль в продуцировании глюкозы в печени. Гликогенолиз в печени, мышцах и головном мозге катализируется тканеспецифическими изоформами фермента гликогенфосфорилазы. Этот фермент расщепляет макромолекулу гликогена с образованием глюкозо-1-фосфата и новой укороченной макромолекулы гликогена. В настоящее время известны два типа ингибиторов гликогенфосфорилазы глюкоза и аналоги глюкозы ( . , 1991, 30,10101), и кофеин и другие аналоги пурина ( . . , 1978, 253, 3343-3351 и 91029106). Было высказано предположение, что эти соединения, и ингибиторы гликогенфосфорилазы, в целом,могут быть использованы для лечения инсулин-независимого сахарного диабета путем снижения продуцирования глюкозы в печени и уменьшения уровня глюкозы в крови ( .В.., , 1992, 35,. 2, 569-576 и. , 1991, 30, 10101). Механизм (или механизмы) восприимчивости организма к повреждению миокарда, наблюдаемому после ишемии и реперфузии, пока полностью не изучен. В связи с этим сообщалось (. . .., 267, 66-Н 74, 1994), что у крыс с гипертрофией сердца, предишемическое восстановление гликогенаассоциируется с улучшением постишемического восстановления функции левого желудочка. Таким образом, хотя существует ряд способов лечения гипергликемии, гиперхолестеринемии, гипертензии, гиперлипедемии, атеросклероза и ишемии миокарда, однако потребность в новых лекарственных средствах остается актуальной, а поэтому необходимо продолжать поиск альтернативных способов лечения. Настоящее изобретение относится к соединениям формулы , ингибирующим гликогенфосфорилазу и предназначенным для использования в лечении диабета, гипергликемии, гиперхолестеринемии, гипертензии,гиперинсулинамии, гиперлипидемии, атеросклероза и ишемии миокарда. Соединениями настоящего изобретения являются соединения формулы и его фармацевтические приемлемые соли и пролекарственные предшественники, такие как сложные эфиры,где пунктирная линияозначает связь А представляет собой - , -С (1-4) алкил)или -С(галоген)1, 10, 11 независимо представляют собой , галоген, циано, (1-4) алкил или (1-4) алкокси 2 представляет собой 3 представляют собой 4 представляет собой водород, метил, этил, н-пропил, гидрокси (1-3) алкил, (1-3) алкокси (13) алкил, фенил (1-4) алкил, тиен-2- или -3-ил (1-4) алкил, где указанные кольца 4 независимо являются моно- или дизамещенными у атома углерода галогеном 5 представляет собой водород, гидрокси, (1-5) алкил, (1-5) алкокси, бензилоксикарбонил (1-4) алкокси, карбокси (1-4) алкокси или 5-хлор-1 Н-индол-2-карбонилокси 7 представляет собой водород или (1-5) алкил или 5 и 7, взятые вместе, представляют собой оксо-группу 7 4606 1 6 представляет собой карбокси, (1-8) алкоксикарбонил, 89 или 12, где 8 представляет собой водород, (1-3) алкил, гидрокси или (1-3) алкокси и 9 представляет собой водород, (1-8) алкил, гидрокси, гидрокси (1-5) алкил, (1-8) алкокси, метилен-перфторированный (1-8) алкил, пиридил или пиперидинил, где указанные выше кольца 9 присоединены через связь углерод-азот и где неароматические азотсодержащие кольца 9 являются необязательно замещенными у атома азота (1-4) алкилом, бензилом или (1-6) алкоксикарбонилом и 12 представляет собой пиперазин-1-ил, 4-(1-4) алкилпиперазин-1-ил, 4-формилпиперазин-1-ил, морфолино, тиоморфолино, 1-оксотиоморфолино, 1,1-диоксотиоморфолино, тиазолидин-3-ил или 1 оксотиазолидин-3-ил или 12 представляет собой 2-, 4-, и/или 5-моно- или дизамещенный тиазолидин-3-ил, 3- и/или 4-моно- или дизамещенный пирролидин-1-ил, 3-, 4- и/или 5-моно-, ди- или тризамещенный пиперидин-1-ил, 3-, 4-, и/или 5-моно-, ди- или тризамещенный пиперазин-1-ил, 3-замещенный азетидин-1-ил, 4- и/или 5-моно- или дизамещенный 1,2-оксазинан-2-ил, 4- и/или 5-моно- или дизамещенный изоксазолидин-2-ил, где указанные заместители независимо представляют собой водород, гидрокси, формил, оксо, карбокси, (1-6) алкоксикарбонил или гидрокси (1-5) алкил при условии, что если 4 является водородом, метилом, этилом или н-пропилом, то 5 является ОН при условии, что если 5 и 7 являются водородом, то 4 не является водородом, метилом, этилом, нпропилом, гидрокси (1-3) алкилом,6 является 89, 12 или (1-4) алкоксикарбонилом. Первая группа предпочтительных соединений формулывключает соединения, в которых 1 предстявляет собой 5-Н, 5-галоген, 5-метил или 5-циано 10 и 11 независимо представляет собойили галоген А представляет собой -2 и 3 представляют собой водород 4 представляет собой фенил (1-2) алкил, где указанная фенильная группа независимо является моноили дизамещенной галогеном или 4 представляет собой тиен-2- или -3-ил (1-2) алкил 5 представляет собой гидрокси 6 представляет собой 89 или 12 и 7 представляет собой водород. Из вышеуказанной первой группы предпочтительных соединений формулыпервая группа особенно предпочтительных соединений включает соединения, в которых атом углерода а имеетконфигурацию атом углеродаимеет -конфигурацию 4 представляет собой фенил (1-2) алкил, тиен-2-ил (1-2) алкил или тиен-3-ил (1-2) алкил, где указанные кольца являются независимо моно- или дизамещенными фтором 6 представляет собой 89 8 представляет собой (1-3) алкил, гидрокси или (1-3) алкокси, и 9 представляет собой , (1-8) алкил, гидрокси (1-6) алкил, (1-8) алкокси, пиридил или пиперидинил. Из вышеуказанной первой группы особенно предпочтительных соединений наиболее предпочтительными соединениями являются 5-Хлор-1 Н-индол-2-карбоновой кислоты(1)-)-гидроксидиметилкарбамоилметил)-2-фенилэтиламид 5,6-Дихлор-1 Н-индол-2-карбоновой кислоты (1)гидрокси-(метоксиметилкарбамоил)метил-2-фенилэтиламид 5-Хлор-1 Н-индол-2-карбоновой кислоты (1)гидрокси-(метоксиметилкарбамоил)метил-2-фенилэтиламид 5-Хлор-1 Н-индол-2-карбоновой кислоты 1)гидрокси-(2-гидрокси-этилметил-карбамоилметил 2-фенилэтил)амид 5-Хлор-1 Н-индол-2-карбоновой кислоты (1)гидрокси-(метилпиридин-2-ил-карбамоил)метил-2 фенилэтиламид или 5-Хлор-1 Н-индол-2-карбоновой кислоты 1)гидрокси-метил-(2-пиридин-2-ил-этил)карбамоилметил-2-фенил-этил)-амид. В вышеуказанную первую группу особенно предпочтительных соединений входят соединения, в которых. 1 представляет собой 5-хлор 10 и 11 представляют собой 4 представляет собой бензил 8 представляет собой метил и 9 представляет собой метил 8. 1 представляет собой 5-хлор 11 представляет собой 10 представляет собой 6-хлор 4 представляет собой бензил 8 представляет собой метил и 9 представляет собой метокси с. 1 представляет собой 5-хлор 10 и 11 представляют собой 4 представляет собой бензил 8 представляет собой метил и 9 представляет собой метокси. 1 представляет собой 5-хлор 10 и 11 представляют собой 4 представляет собой бензил 8 представляет собой метил и 9 представляет собой 2-гидроксиэтил е. 1 представляет собой 5-хлор 10 и 11 представляют собой водород 4 представляет собой бензил 8 представляет собой метил и 9 представляет собой пиридин-2-ил и. 1 представляет собой 5-хлор 10 и 11 представляют собой водород 4 представляет собой бензил 8 представляет собой метил и 9 представляет собой 2-(пиридин-2-ил)этил. Из вышеуказанной первой группы предпочтительных соединений формулывторая группа особенно предпочтительных соединений включает соединения, в которых атом углерода а имеет -конфигурацию атом углеродаимеет -конфигурацию 4 представляет собой фенил (1-2) алкил, тиен-2-ил (1-С 2) алкил или тиен-3-ил (1-2) алкил, где указанные кольца являются независимо моно- или дизамещенными фтором 6 представляет собой 12 и 12 представляет собой морфолино, 4-(1-4) алкилпиперазин-1-ил, 3-замещенный азетидин-1-ил, 3-и/или 4-моно- или дизамещенный пирролидин-1-ил, 4- и/или 5-моно- или дизамещенный изоксазолидин-2-ил, 4 и/или 5- моно- или дизамещенный 1,2-оксазинан-2-ил, где указанные заместители независимо представляют собой , гидрокси или оксо. Из вышеуказанной второй группы особенно предпочтительных соединений наиболее предпочтительными являются следующие соединения 5-Хлор-1-Н-индол-2-карбоновой кислоты (1)-бензил-(2)-гидрокси-3-(4-метилпиперазин-1-ил)-3-оксопропиламида гидрохлорид 5-Хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-(2)-гидрокси-3-(3-гидроксиазетидин-1-ил)-3-оксопропиламид 5-Хлор-1 Н-индол-2-карбоновой кислоты 1)-бензил-(2)-гидрокси-3-изоксазолидин-2-ил-3-оксопропил)амид 5-Хлор-1 Н-индол-2-карбоновой кислоты 1)-бензил-(2)-гидрокси-3-1,2-оксазинан-2-ил-3-оксопропил)амид 5-Хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-(2)-гидрокси-3-3)-гидроксипирролидин-1-ил)3-оксопропиламид 5-Хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-3-3,4)-дигидроксипирролидин-1-ил)-(2)-гидрокси-3-оксопропил-амид 5-Хлор-1 Н-индол-2-карбоновой кислоты (1)-бензил-3-3,4)-дигидроксипирролидин-1-ил)-(2)-гидрокси-3-оксопропил-амид или 5-Хлор-1 Н-индол-2-карбоновой кислоты 1)-бензил-(2)-гидрокси-3-морфолин-4-ил-3-оксопропил)амид. В вышеуказанную вторую группу особенно предпочтительных соединений входят соединения, в которых. 1 представляет собой 5-хлор 10 и 11 представляют собой 4 представляет собой бензил и 9. 1 представляет собой 5-хлор 10 и 11 представляют собой 4 представляет собой бензил и 12 представляет собой 3-гидроксиазетидин-1-ил с. 1 представляет собой 5-хлор 10 и 11 представляют собой 4 представляет собой бензил и 12 представляет собой изоксазолидин-2-ил. 1 представляет собой 5-хлор 10 и 11 представляют собой 4 представляет собой бензил и 12 представляет собой 1,2-оксазинан-2-ил е. 1 представляет собой 5-хлор 10 и 11 представляют собой водород 4 представляет собой бензил и 12 представляет собой 3-гидроксипирролидин-1-ил. 1 представляет собой 5-хлор 10 и 11 представляют собой водород 4 представляет собой бензил и 12 представляет собой (3,4)-дигидроксипирролидин-1-ил. 1 представляет собой 5-хлор 10 и 11 представляют собой водород 4 представляет собой бензил и 12 представляет собой (3,4)-дигидроксипирролидин-1-ил. 1 представляет собой 5-хлор 10 и 11 представляют собой водород 4 представляет собой бензил и 12 представляет собой морфолино. Вторая группа предпочтительных соединений формулывключает соединения, в которых 1 предстявляет собой , галоген, метил или циано 10 и 11 независимо представляют собойили галоген А представляет собой -2 и 3 представляют собой водород 4 представляет собой фенил (1-2) алкил, где указанная фенильная группа независимо является моноили дизамещенной галогеном или 4 представляет собой тиен-2- или -3-ил (1-2) алкил 5 представляет собой гидрокси 6 представляет собой карбокси или (1-8) алкоксикарбонил и 7 представляет собой водород или (1-6) алкил. Из второй группы предпочтительных соединений формулыгруппу особенно предпочтительных соединений составляют соединения, в которых атом углерода а имеетконфигурацию атом углеродаимеет -конфигурацию 4 представляет собой фенил (1-2) алкил, тиен-2-ил (1-2) алкил или тиен-3-ил (1-2) алкил, где указанные кольца являются независимо моно- или дизамещенными водородом или фтором 10 и 11 представляют собой водород 6 представляет собой карбокси и 7 представляет собой . Из непосредственно предшествующей группы соединений предпочтительными являются соединения, в которых 1 представляет собой 5-хлор 10 и 11 представляют собой водород 4 представляет собой бензил. Третья группа предпочтительных соединений формулывключает соединения, в которых 1 представляет собой водород, галоген, метил или циано 10 и 11 независимо представляют собой водород или галоген А представляет собой -2 и 3 представляет собой водород 10 4606 1 4 представляет собой фенил (1-2) алкил, где указанная фенильная группа является независимо моноили дизамещенной галогеном или 4 представляет собой тиен-2- или 3-ил (1-2) алкил 5 представляет собой (1-4) алкил, (1-5) алкокси, карбокси (1-4) алкокси или бензилоксикарбонил(1-4) алкокси 6 представляет собой карбокси или (1-8) алкоксикарбонил и 7 представляет собой водород или (1-6) алкил. Четвертая группа предпочтительных соединений формулывключает соединения, в которых 1 представляет собой , галоген, метил или циано 10 и 11 независимо представляют собойили галоген А представляет собой -2 и 3 представляют собой 4 представляет собой фенил (1-2) алкил, где указанная фенильная группа является независимо моноили дизамещенными галогеном или 4 представляет собой тиен-2- или -3-ил (1-2) алкил 5 представляет собой (1-4) алкил, (1-5) алкокси, карбокси (1-4) алкокси или бензилоксикарбонил(1-4) алкокси 6 представляет собой 89 или 12 и 7 представляет собой , фтор или (1-6) алкил. В другом аспекте, настоящее изобретение относится к способу лечения гликогенфосфорилазозависимых заболеваний или состояний у млекопитающего путем введения млекопитающему, страдающему указанным заболеванием или состоянием, эффективного для такого лечения количества соединения формулы . В другом своем аспекте, настоящее изобретение относится к способу лечения гипергликемии у млекопитающего путем введения млекопитающему, страдающему гипергликемией, эффективного для такого лечения количества соединения формулы . В другом своем аспекте, настоящее изобретение относится к способу лечения диабета у млекопитающего путем введения млекопитающему, страдающему диабетом, эффективного против диабета количества соединения формулы . В другом своем аспекте, настоящее изобретение относится к способу лечения гиперхолестеринемии у млекопитающего путем введения млекопитающему, страдающему гиперхолестеринемией, эффективного для лечения гиперхолестеринемии количества соединения формулы . Лечение диабета также предусматривает предупреждение или ослабление хронических осложнений, таких как невропатия, нефропатия, ретинопатия или катаракта. В другом своем аспекте, настоящее изобретение относится к способу лечения атеросклероза у млекопитающего путем введения млекопитающему, страдающему атеросклерозом, эффективного для лечения атеросклероза количества соединения формулы . В другом своем аспекте, настоящее изобретение относится к способу лечения гиперинсулинемии у млекопитающего путем введения млекопитающему, страдающему гиперинсулинемией, эффективного для лечения гиперинсулинемии количества соединения формулы . В другом своем аспекте, настоящее изобретение относится к способу лечения гипертензии у млекопитающего путем введения млекопитающему, страдающему гипертензией, эффективного для лечения гипертензии количества соединения формулы . В другом своем аспекте, настоящее изобретение относится к способу лечения гиперлипидемии у млекопитающего путем введения млекопитающему, страдающему гиперлипидемией, эффективного для лечения гиперлипидемии количества соединения формулы . В другом своем аспекте, настоящее изобретение относится к способу предупреждения ишемических повреждений миокарда у млекопитающего путем введения млекопитающему, подвергающемуся риску ишемического повреждения миокарда при операции, эффективного для предупреждения указанного ишемического повреждения количества соединения формулы . В другом своем аспекте, настоящее изобретение относится к способу предупреждения ишемических повреждении миокарда у млекопитающего путем введения млекопитающему, подвергающемуся риску ишемического повреждения миокарда при операции, эффективного для предупреждения указанного ишемического повреждения количества ингибитора гликогенфосфорилазы. Настоящее изобретение также относится к фармацевтическим композициям, содержащим терапевтически эффективное количество соединения формулыи фармацевтически приемлемый носитель. Предпочтительными являются фармацевтические композиции для лечения гликогенфосфорилазозависимых заболеваний или состояний у млекопитающих, содержащие эффективное для лечения гликоген 11 4606 1 фосфорилазо-зависимых заболеваний или состояний количество соединения формулыи фармацевтически приемлемый носитель. В другом своем аспекте, настоящее изобретение относится к фармацевтическим композициям для лечения диабета, содержащим терапевтически эффективное количество ингибитора гликогенфосфорилазы одно или несколько противодиабетических средств, таких как инсулин или его аналогов (например,-инсулин) -1 (7-37) (инсулинотропин) и -1 (7-36) - 2 сульфомочевины и их аналоги хлоропропамид, глибенкламид, толбутамид, толазамид, ацетогексамид, глипизид, глимепирид, репаглинид, меглитинид бигуаниды метформин, фенформин, буформин 2-антагонисты и имидазолины мидаглизол, изаглидол, дериглидол, идазоксан, эфароксан, флупароксан другие средства, усиливающие секрецию инсулина линоглирид, А-4166 глитазоны циглитазон, пиоглитазон, энглитазон, троглитазон, даглитазон,49653 ингибиторы окисления жирных кислот кломоксир, этомоксир ингибиторы -глюкозидазы миглитол, акарбоза, эмиглитат, воглибоза, -25637, камиглибоза, -73945 -агонисты 35135,37344,16-8714, 11 7114,316243 ингибиторы фосфодиэстеразы -386398 средства, понижающие содержание липидов бенфлуорекс средства против ожирения фенфлурамин ванадатные и ванадиевыекомплексы(например, нагливан) и пероксованадиевые комплексы антагонисты амилина антагонисты глюкагона ингибиторы глюконеогенеза аналоги соматостатина антилиполитические средства никотиновая кислота, аципимокс,994 и необязательно фармацевтически приемлемый носитель. Из описанной выше группы композиций предпочтительными являются такие фармацевтические композиции, в которых ингибитором гликогенфосфорилазы является соединение формулы . В другом своем аспекте, настоящее изобретение относится к способу лечения диабета у млекопитающих с использованием вышеописанных комплексных композиций. К гликогенфосфорилазо-зависимым заболеваниям или состояниям относятся такие состояния, которые частично или полностью опосредуются, инициируются или поддерживаются расщеплением макромолекулы гликогена гликогенфосфорилазами, в результате чего высвобождается глюкозо-1-фосфат и образуется новая более короткая молекула гликогена. Эти состояния характеризуются повышенной гликогенфосфорилазной активностью, и уменьшение интенсивности симптомов указанных состояний может быть достигнуто путем снижения такой активности. Примерами таких заболеваний или состояний являются диабет, гипергликемия,гиперхолестеринемия, гипертензия, гиперинсулинемия, гиперлипидемия, атеросклероз и ишемия миокарда. Термин ингибитор гликогенфосфорилазы относится к любому соединению или средству, или комбинации соединений и/или средств, которые способствуют уменьшению, замедлению или прекращению ферментативного действия гликогенфосфорилазы. Известное в настоящее время действие гликогенфосфорилазы заключается в расщеплении гликогена путем катализа обратимой реакции макромолекулы гликогена и неорганического фосфата с образованием глюкозо-1-фосфата и макромолекулы гликогена, которая становится на один глюкозильный остаток короче, чем исходная молекула гликогена (в направлении гликогенолиза). Под термином лечение, используемым в настоящем описании, подразумевается предупреждающее (например, профилактическое) и паллиативное лечение. Термин галоген означает хлор, бром, йод или фтор. Термин алкил означает насыщенный углеводород с прямой или разветвленной цепью. Примерами таких алкильных групп (длина которых определяется конкретным примером) являются метил, этил, пропил,изопропил, бутил, втор-бутил, трет-бутил, пентил, изопентил, гексил и изогексил. Термин алкокси означает насыщенный прямой или разветвленный алкил, связанный через окси-группу. Примерами таких алкокси-групп (длина которых определяется конкретным примером) являются метокси,этокси, пропокси, изопропокси, бутокси, изо-бутокси, трет-бутокси, пентокси, изопентокси, гексокси, и изогексокси. Выражение фармацевтически приемлемая анионная соль относится к нетоксичным анионным солям,содержащим анионы (но не ограничивается ими), таким как хлорид, бромид, иодид, сульфат, бисульфат,фосфат, ацетат, малеат, фумарат, оксалат, лактат, тартрат, цитрат, глюконат, метансульфонат и 4 толуолсульфонат. Выражение фармацевтически приемлемая катионная соль относится к нетоксичным катионным солям(но не ограничивается ими), таким как соли натрия, калия, кальция, магния, аммония или протонированный бензатин (,-дибензилэтилендиамин), холин, этаноламин, диэтаноламин, этилендиамин, мегламин (метил-глюкамин), бенетамин (-бензилфенэтиламин), пиперазин, или трометамин (2-амино-2 гидроксиметил-1,3-пропандиол). Выражение пролекарство относится к соединениям, которые являются предшественниками лекарственного средства и которые, после их введения, способствуют высвобождениюлекарственного средства посредством определенных химических или физиологических процессов (например, пролекарство, после его введения в среду с физиологическим рН, превращается в нужную лекарственную форму). Типичные 12 4606 1 пролекарства, после их расщепления, высвобождают соответствующую свободную кислоту, и такими гидролизуемыми эфирообразующими остатками соединений настоящего изобретения являются, но не ограничиваются ими, карбоново-кислотные заместители (например, 6 является карбокси, либо 8, 9 или 12 содержат карбокси), где свободный водород замещен (1-С 4) алкилом, (2-С 12) алканоилоксиметилом, 1(алканоилокси) этилом, имеющим 4-9 атомов углерода, 1-метил-1-(алканоилокси)-этилом, имеющим 5-10 атомов углерода, алкоксикарбонилоксиметилом, имеющим 3-6 атомов углерода, 1-(алкоксикарбонилокси) этилом, имеющим 4-7 атомов углерода, 1-метил-1-(алкоксикарбонилокси) этилом, имеющим 5-8 атомов углерода, -(алкоксикарбонил) аминометилом, имеющим 3-9 атомов углерода, 1-(-(алкоксикарбонил) амино) этилом, имеющим 4-10 атомов углерода, 3-фталидилом, 4-кротонолактонилом, гаммабутиролактон-4-илом, ди-,-(1-С 2) алкиламино (2-С 3) алкилом (таким, как -диметиламиноэтил), карбамоил-(С 1-С 2) алкилом, ,-ди (С 1-С 2)-алкилкарбамоил-(С 1-С 2) алкилом и пиперидино-, пирролидино- или морфолино (С 2-С 3) алкилом. Другие типичные пролекарства высвобождают спирт формулы , где свободный водород гидроксизаместителя (например, 5 является гидрокси-группой) замещен (С 1-С 6) алканоилоксиметилом, 1-16) алканоилокси) этилом, 1-метил-1-С 1-С 6) алканоилокси)-этилом, (С 1-С 6) алкоксикарбонилоксиметилом, (1-6) алкоксикарбониламинометилом, сукциноилом, (С 1-С 6) алканоилом, -амино-(1-4) алканоилом,арилактилом и -аминоацилом либо -аминоациламиноацилом (где указанные -аминоацильные радикалы независимо представляют собой любую из натуральных -аминокислот, присутствующих в белках),(ОН)2, -(О)(С 1-С 6)-алкил)2, ом или гликозилом (радикал, образующийся в результате отщепления гидроксила полуацеталя углевода). Другими характерными пролекарствами являются, но не ограничиваются ими, производные формулы ,где 2 является свободным водородом, который замещен -карбонилом, -карбонилом, -карбонилом,гдеинезависимо представляют собой 1-10) алкил, (С 3-С 7) циклоалкил, бензил или -карбонил представляет собой натуральный -аминоацил-натуральный -амино-ацил, -, гдепредставляет собой , (1-6) алкил или бензил, -(0)1, где 0 представляет собой (С 1-С 4) алкил,1 представляет собой (1-6) алкил, карбокси (С 1-С 6) алкил, амино (С 1-С 4) алкил, или моно или ди-,-(С 1-С 6) алкиламиноалкил, -С(2)3, где 2 представляет собойили метил, а 3 представляет собой моно или ди,-(С 1-С 6) алкиламино, морфолино, пиперидин-1-ил, или пирролидин-1-ил. Другими примерами пролекарств являются циклические структуры, такие, как соединения формулы , где 2 и 3 имеют общий углерод, образуя тем самым 5-членное кольцо. Этот связывающий углерод может быть независимо моно- или дизамещен , (С 1-С 6) алкилом, (С 3-С 6) циклоалкилом или фенилом. Альтернативно,3 и 5, взятые вместе, могут образовывать оксазолидиновое кольцо, а два углерода оксазолидинового кольца могут быть независимо моно- или дизамещенными , (С 1-С 6) алкилом, (3-6) циклоалкилом или фенилом. Альтернативно, пролекарственными формами соединения формулыявляются соединения, в которых,5, взятый вместе с 8 или 9, может образовывать оксазолин-4-он овое кольцо, а 2 атома углерода этого кольца могут быть независимо моно- или дизамещенными , (1-6) алкилом, (3-6) циклоалкилом, фенилом или оксо-группой. Используемые в настоящем описании выражения реакционно-инертный растворитель и инертный растворитель относятся к растворителю, который не вступает в нежелательные реакции с исходными соединениями, реагентами, промежуточными соединениями или продуктами реакции и не оказывает неблагоприятного влияния на выход целевого продукта. Каждому среднему специалисту ясно, что определенные соединения настоящего изобретения содержат один или несколько атомов, которые могут находиться в конкретной стереохимической или геометрической конфигурации, образуя стереоизомеры и конфигурационные изомеры. Все такие изомеры и их смеси входят в объем настоящего изобретения. Кроме того, в объем настоящего изобретения входят также гидраты соединений настоящего изобретения. Каждому среднему специалисту ясно, что определенные комбинации заместителей, содержащих гетероатом и входящих в объем настоящего изобретения, определяют соединения, которые являются менее стабильными в физиологических условиях (например, соединения, содержащие ацетальные или аминальные связи). Поэтому такие соединения являются менее предпочтительными. Термин кольцо , где х является целым числом, например, кольцо 9, кольцо 12 или кольцо 4,используемый в настоящем описании при указании на замещение на кольце, относится к тем частям молекулы, где кольцом является , а также к тем частям молекулы, где кольцо содержится в . Используемый в настоящем описании термин моно или ди-,-(1-) алкилотносится к (1-) алкильному радикалу, взятому отдельно, в тех случаях, когда он является ди-,-(1-) алкилом(где х целое число). Другие отличительные признаки и преимущества настоящего изобретения очевидны из нижеследующего подробного описания и формулы настоящего изобретения. 13 4606 1 В основном, соединения формулымогут быть получены способами, известными специалистамхимикам, особенно, в свете нижеприведенного подробного описания изобретения. Однако, некоторые способы получения соединений формулыимеют отличительные признаки, присущие настоящему изобретению, а поэтому эти способы проиллюстрированы следующими реакционными схемами. Реакционная схема В соответствии с реакционной схемойсоединения формулы , где 1, 10, 11, 1, 2, 3, 4, 5, 6 и 7 определены выше, могут быть получены любым из двух основных способов. В первом способе желаемое соединение формулыможет быть получено реакцией взаимодействия соответствующей индол-2-карбоновой кислоты или индолин-2-карбоновой кислоты формулыс соответствующим амином формулы(т.е. реакции ацилирования амина). Во втором способе желаемое соединение формулыможет быть получено реакцией взаимодействия соответствующего соединения формулы(т.е. соединения формулы , в котором 6 представляет собой карбокси-группу) с соответствующим спиртом, или амином формулы 89 или 12,или спиртом, где 8, 9 и 12 определены выше (т.е. реакции ацилирования амина или спирта). Обычно соединение формулыобъединяют с соединением формулы(или соединение формулыобъединяют с соответствующим амином (например, 12 или 89 или спиртом в присутствии соответствующего связующего агента. Подходящим связующим агентом является вещество, которое превращает карбоновую кислоту в соответствующее реакционноспособное соединение, которое образует амидную или сложноэфирную связь при взаимодействии с амином или спиртом. Таким конденсирующим агентом может быть реагент, который после смешивания с карбоновой кислотой и амином или спиртом в одном реакционном сосуде осуществляет реакцию конденсации. Если проводят реакцию конденсации кислоты со спиртом, то спирт в качестве реакционного растворителя предпочтительно использовать в большом избытке без добавления или с добавлением 1,0-1,5 эквивалента диметиламинопиридина. Примерами конденсирующих реагентов являются 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид/гидроксибензотриазол(/НВТ),карбонилдиимидазол,дициклогексилкарбодиимид/гидроксибензотриазол , 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин , карбонилдиимидазол/НВТ и диэтилфосфорилцианнид. Указанная реакция взаимодействия протекает в инертном растворителе, предпочтительно в апротонном растворителе при температуре от около -20 С до около 50 С в течение периода времени от около 1 часа до около 48 часов. Примерами растворителей являются ацетонитрил, дихлорметан, диметилформамид и хлороформ. Примером подходящих методов проведения реакции конденсации является методика А, описанная ниже (непосредственно перед примерами). Конденсирующим агентом может быть также агент, превращающий карбоновую кислоту в активированное промежуточное соединение, которое выделяют и/или которое, после его образования в первой стадии,оставляют для реакции с амином или спиртом во второй стадии. Примерами таких конденсирующих агентов и активированных промежуточных соединений являются тионилхлорид или оксалилхлорид, который образует хлорангидрид фторангидрид циануровой кислоты, который образует фторангидрид или алкилхлороформиат, такой как изобутил- или изопропенилхлороформиат (с основанием, таким как третичный амин), который образует смешанный ангидрид карбоновой кислоты. Если конденсирующим агентом является оксалилхлорид, то для катализа образования хлорангидрида предпочтительно использовать небольшое количество диметилформамида в качестве сорастворителя с другим растворителем (таким, как дихлорометан). Выбор конденсирующих агентов, соответствующих растворителей и температур может быть легко сделан самим специалистом либо определен исходя из специальной литературы. Эти и другие условия реакции конденсации карбоновых кислот описаны в -,,, . , ., .,1974, ,,, -1984,.,(. .. )1-5 (1979-1983). Соединения формулы , где 1, 10, 11, , 2, 3, 4, 5 и 7 определены выше, могут быть получены из соответствующего сложного эфира формулы(т.е. соединений формулы , где 6 представляет собой (1-5) 18 4606 1 алкоксикарбонил или бензилоксикарбонил) реакцией гидролиза с водным раствором щелочи при температуре от около -20 С до около 100 С, как правило, при температуре около 20 С, в течение периода времени от около 30 мин до около 24 ч. Альтернативно, соединения формулымогут быть получены активацией индолкарбоновой кислоты формулыс использованием конденсирующего агента описанного выше, в результате чего получают активированное промежуточное соединение (такое, как хлорангидрид, фторангидрид или смешанный ангидрид),которое затем подвергают реакции с соединением формулы(где 3, 4, 5 и 7 определены выше,6 представляет собой карбокси-группу) в подходящем растворителе и в присутствии подходящего основания. Подходящими растворителями являются вода или метанол, или их смесь, взятые вместе с сорастворителями,такими как дихлорометан, тетрагидрофуран или диоксан. Подходящими основаниями являются гидроксиды натрия, калия, или лития, бикарбонат натрия или калия, карбонат натрия или калия или карбонат калия вместе с бромидом тетрабутиламмония (1 эквивалент), взятом в количестве, достаточном для потребления кислоты, высвобождающейся при реакции (обычно это количество достаточно для поддержания рН реакции до значения более чем 8). Для получения нужного значения рН реакции основание можно добавлять постепенно вместе с активированным промежуточным соединением. Обычно реакцию проводят при температуре от 20 до 50 С. Методика выделения для удаления примесей может быть разработана самим специалистом, но обычно такая методика предусматривает удаление смешиваемых с водой сорастворителей путем выпаривания, экстракцию примесей при высоком рН с использованием органических растворителей, подкисление для понижения рН (1-2) и фильтрацию или экстракцию нужного продукта с использованием подходящего растворителя, такого как этилацетат или дихлорометан. Соединение формулыможет быть получено реакцией взаимодействия соединения формулы , где 6 является алкоксикарбонилом, с соответствующим соединением формулыв соответствии с методикой, аналогичной описанной выше (например, методикой А). Альтернативно, соединения формулы , которые содержат атомы серы в состоянии сульфоксидного или сульфонового окисления, могут быть получены из соответствующих соединений формулы , имеющих атом серы в неокисленном состоянии, обработкой соответствующим окислителем, таким как мхлоропероксибензойная кислота в дихлорометане, при температуре от около 0 С до около 25 С в течение периода времени от около 1 до около 48 часов, с использованием от около 1 до около 1,3 эквивалентов для превращения в состояние сульфоксидного окисления и с использованием примерно более 2 эквивалентов для превращения в состояние сульфонового окисления. Альтернативно, соединения формулы , которые являются моно- или диалкилированными у аминоалкокси-группы 5, могут быть получены из соответствующего соединения формулы , где 5 является аминоалкокси-группой, моноалкилированием или диалкилированием по амину 5 с получением нужного соединения формулы . Такое моно- или диалкилирование может быть осуществлено обработкой соединения, в котором 5 является аминоалкокси, 1 эквивалентом соответствующего карбонильного соединения (для моноалкилирования) или более чем 2 эквивалентами соответствующего карбонильного соединения (для диалкилирования) и соответствующим восстановителем в подходящем растворителе. Подходящими условиями для проведения реакции восстановления являются использование цианоборогидрида натрия или борогидрида натрия в метаноле или этаноле или катализатора гидрирования при гетерогенном катализе (такого, как палладий-наугле) в полярном растворителе, таком как вода, метанол, или этанол при температуре примерно 0-60 С в течение 1-48 ч. Альтернативно, соединения формулы , в которых 5 является алканоилокси (-), могут быть получены О-ацилированием соответствующего соединения формулыс соответствующим хлорангидридом или с другим активированным кислотным производным в присутствии, если это необходимо, соответствующего основания (например, третичного основания, такого как триалкиламин или пиридин), предпочтительно в апротонном растворителе, таком как тетрагидрофуран или дихлорометан, при температуре от около 0 С до около 50 С, в течение примерно 0,5-48 ч. Альтернативно, соединения формулы , где 5 и 7, взятые вместе, представляют собой оксо-группу, могут быть получены путем окисления соответствующего соединения формулы , например соединения, в котором 5 является гидрокси-группой,7 является водородом, с использованием подходящего окислителя. Примерами таких окислителей являются реагент Десс-Мартина в хлорометане, карбодиимиде и диметилсульфоксиде и кислотный катализатор (окисление по Пфицнеру-Моффету или его модификация, например, с использованием водорастворимого карбодиимида или реакции типа Сверна, например, с использованием оксалилхлорида /ДМСО/триэтиламина). Соединения формулы , имеющие другие чувствительные к окислению функциональные группы, могут быть получены в результате соответствующей защиты и деблокирования таких групп. Некоторые способы получения соединений, описанные в настоящей заявке, могут потребовать защиты уходящих функциональных групп (например, первичный амин, вторичный амин, карбоксил в предшественниках соединений формулы ). Необходимость в такой защите может варьироваться в зависимости от приро 19 4606 1 ды уходящей функциональной группы и условий конкретных методов получения. Необходимость такой защиты может быть легко установлена самим специалистом. Использование указанных методов защиты/снятия защиты также хорошо известно специалистам. Общее описание защитных групп и их использование описано, например, ,,,,1991. Например, в реакционной схеме , некоторые соединения формулысодержат первичную аминогруппу,вторичную аминогруппу или карбоновокислотную функциональную группу в части молекулы, определенной 5 или 6, которая может препятствовать нужной реакции взаимодействия, проводимой в соответствии с реакционной схемой , в том случае, если промежуточное соединение формулыили амин 12 или 89 остается незащищенным. Поэтому первичная или вторичная функциональная аминогруппа, если она присутствует в радикалах 5 или 6 промежуточного соединения формулыили амина 89 или 12, может быть защищена с помощью соответствующей защитной группы в процессе реакции взаимодействия реакционной схемы . Продуктом такой реакции взаимодействия является соединение формулы , содержащей защитную группу. В последующей стадии эту защитную группу удаляют с получением соединения формулы. Подходящими защитными группами для защиты аминогруппы и карбоновокислотной группы являются защитные группы, которые обычно используются в пептидном синтезе (например, такие, как -третбутоксикарбонил, -карбобензилокси и 9-флуоренилметиленоксикарбонил для аминов, и низшие алкиловые или бензиловые сложные эфиры для карбоновокислотных групп), которые не вступают в химические реакции в условиях конденсации, описанных выше (а также в методике А, описанной непосредственно перед примерами), и которые могут быть удалены без какого-либо химического воздействия на другие функциональные группы соединения формулы . Исходные индол-2-карбоновые кислоты и индолин-2-карбоновые кислоты, используемые в реакционной схеме , если они не являются коммерчески доступными или известными соединениями (такими, которые очень широко описаны в литературе), могут быть получены методами стандартного синтеза. Например, согласно реакционной схеме , сложный эфир индола формулыможет быть получен из соединения формулы(гдевыбирают так, чтобы получить нужное А, определенное выше) посредством синтеза индолов Фишера (, . (,, 1982 и последующего омыления полученного сложного эфира индола формулыс получением соответствующей кислоты формулы . Исходный арилгидразон может быть получен конденсацией легкодоступного гидразина с соответствующим карбониловым производным или с помощью реакции Яппа-Клингемана ( , , ,1959, 10, 143). Альтернативно, индол-2-карбоновая кислота формулыможет быть получена конденсацией ортометилнитро-соединения формулыс оксалатом (сложным эфиром) с последующим восстановлением нитро-группы и последующим гидролизом. Такой трехстадийный способ синтеза индолов известен как реакция Райссерта (,1897, 30, 1030). Условия для осуществления указанного способа и ссылки, относящиеся к этому синтезу,описаны в литературе (,., . . . 1921 119, 1602., . . . 1981, 24, 238,.,3 (,, , 1962, , ) 18). Примеры конкретного осуществления этого способа приведены в настоящем описании (примеры 10 А-10 С). 3-Галогено-5-хлоро-1 Н-индол-2-карбоновые кислоты могут быть также получены галогенированием 5 хлоро-1 Н-индол-2-карбоновых кислот. Альтернативно (реакционной схеме ), замещенные индолы формулымогут быть получены восстановлением соответствующих индолов формулыс использованием восстановителя, такого как магний в метаноле, при температуре от около 25 С до около 65 в течение времени от около 1 ч до около 48 ч (реакционная схема ). Индолинкарбоновые кислоты формулыполучают омылением соответствующего сложного эфира формулы(реакционная формула ). Соединение формулыполучают восстановлением соответствующего сложного эфира индола формулыс использованием восстановителя, такого как магний в метаноле, как описано выше для превращения соединения формулыв соединение формулы . Ниже описано получение различных аминов, используемых в вышеуказанных реакционных схемах. В соответствии с реакционной схемойсоединения формул(амины формулыв реакционной схеме, где 5 является ОН 7 является 6 является сложным эфиром) или соединения формулы(где 6 является 89 или 12) получают исходя из -защищенного (обозначенного РТ) альдегида формулы . Альдегид формулыили натрийбисульфитный аддукт альдегида формулыобрабатывают цианидом калия или натрия в водном растворе с сорастворителем, таким как диоксан или этилацетат, при температуре от около 0 С до около 50 С, в результате чего получают цианогидрин формулы . Цианогидрин формулыобрабатывают спиртом (например, (С 1-С 6) алканолом, таким как метанол) в присутствии катализатора на основе сильной кислоты, такого как хлороводород, при температуре от около 0 С до 20 4606 1 около 50 С с последующим добавлением воды, если это необходимо. Затем защитную группу (РТ) удаляют,если она присутствует, методом соответствующего деблокирования, в результате чего получают соединение формулы . Например, если -защитной группой РТ (формула ) представляет собой третбутоксикарбонил (-Вос), то соединение формулыможет быть получено непосредственно из соединения формулыи добавление воды не требуется. Соединение формулыможет быть защищено у атома азота соответствующей защитной группой с образованием соединения формулыи последующим гидролизом сложного эфира водной щелочью при температуре от около 0 С до около 50 С в инертном растворителе, в результате чего образуется гидрокси-кислоты формулы . Соединение формулыподвергают взаимодействию (аналогичная реакция описана в реакционной схеме ) с соответствующим амином 89 или 12 и получают соединение формулы , которое затем подвергают деблокированию, в результате чего получают соединение формулы(т.е. соединение формулы , в котором 5 является ОН, 7 является ,6 является 12 или 89). Пример реакции превращения цианогидрина формулыв соответствующий метиловый сложный эфир формулыс удалением защитной группы Вос описан в РСТ-публикации /9325574, в примере 1. Другие примеры превращения цианогидрина в низшие алкиловые сложные эфиры формулыможно найти в патенте США 4814 342 и ЕРОпубликации 0438233. Некоторые соединения формулыявляются стереоизомерами благодаря стереохимической конфигурации у атомов углерода, обозначенных а и .соответствии с реакционной схемойлюбой специалист может получить промежуточные соединения формулис нужной стереохимией. Например, альдегид формулыв любой энантиомерной форме (стереохимия у а) может быть легко получен исходя из стандартной методики, описанной ниже (реакционная схема ). Цианогидрин формулыможет быть получен из соединения формулыобработкой цианидом натрия или калия, как описано выше, сохраняя при этом стереохимию у атома углерода а, в результате чего образуется смесь стереоизомеров у углерода . Для разделения изомеров или для выделения одного изомера на этой стадии можно использовать метод кристаллизации. Например, получение соединения формулы , где РТ является Вос, 3 является , 4 является бензилом, а атомы углерода а иимеют конфигурациюи , соответственно, с проведением очистки перекристаллизацией описано в 1992, 31, 8125-8141. Альтернативно, разделение изомеров может быть осуществлено с использованием методики хроматографии или перекристаллизации после превращения соединения формулы(смесь изомеров) в соединение формул , , , , , ,илив соответствии с методами и/или реакционными схемами, описанными в настоящей заявке. Промежуточные соединения формулы , имеющие конкретную стереохимию у атомов углерода а и , превращают в промежуточные соединения формулыс сохранением этой стереохимии путем обработки спиртом в присутствии сильной кислоты в качестве катализатора, с последующим добавлением воды, если это необходимо, как описано выше. Альтернативно, нужный изомер соединения формулможет быть также получен путем дериватизации промежуточного соединения формулыи хроматографического разделения диастереомерных производных (например, с использованием триметилсилилхлоридаили т-бутилдиметилсилилхлорида с получением О или производных). Например, в примере 24 (приведенном в настоящей заявке) описано разделение диастереомерных производных формулы . Силиловое производное промежуточного соединения формулы , имеющего единственную стереоизомерную форму у атомов углерода а и , превращают, с сохранением стереохимии, в промежуточное соединение формулы(если в этой стадии силильную группу не удаляют, то ее удаляют в последующей стадии с использованием соответствующей методики, например обработкой фторидом тетрабутиламмония в тетрагидрофуране) в соответствии с методикой, описанной выше для превращения соединения формулыв соединение формулы(пример 24 С, приведенный ниже, где описано превращение силильного производного формулыв один изомер формулыс потерей силильной группы). В соответствии с реакционной схемой , альдегиды формулы (исходные соединения для Реакционной схемы ) получают из соответствующих аминокислот формулы . Аминокислоты формулыявляются -защищенными защитной группой (РТ), такой как Вос. Защищенное соединение подвергают этерификации спиртом и превращают в сложный эфир, предпочтительно в метиловый или этиловый сложный эфир соединения формулы . Эта реакция может быть осуществлена путем обработки соединения формулыметил- или этилиодидом в присутствии подходящего основания (например, 23) в полярном растворителе, таком как диметилформамид. Соединение формулыподвергают реакции восстановления, например, с гидридом диизобутиламмония в гексане или толуоле или в их смеси при температуре от около 78 С до около -50 С с последующим гашением реакции метанолом при -78 С, как описано в работе . .., 1985, 28, 779-1790, в результате чего получают альдегид формулы . Альтернативно (на реакционной схемене показано), аналогичные -метоксиметиламиды, соответствующие соединению формулы, в котором спиртовой заместитель сложного эфира заменен на , получают из соединения 21 4606 1 формулы , ,-диметилгидроксиламина и соответствующего конденсирующего агента (например, гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (, как описано в методике А. Полученное соединение восстанавливают с использованием алюмогидрида лития в инертном растворителе, таком как простой эфир или тетрагидрофуран, при температуре от около 0 С до около 25 С, в результате чего получают альдегид формулы . Этот двухстадийный метод является общим методом превращения защищенных -аминокислот в альдегиды формулы(, ,1983, 676-678). Альтернативно, альдегиды формулымогут быть получены окислением защищенных аминоспиртов формулы , например, с использованием пиридин-3 при температуре от около -10 С до около 40 С в инертном растворителе, предпочтительно в диметилсульфоксиде. Защищенные аминоспирты формулы, если они не являются коммерческими продуктами, могут быть получены посредством защиты аминоспиртов формулы . Аминоспирты формулыполучают путем восстановления аминокислот формулы . Эту реакцию восстановления осуществляют обработкой соединений формулыалюмогидридом лития в соответствии с методикой, описанной.,,1990 , . ,530, либо сернокислым борогидридом натрия в соответствии с методикой, описанной,. 1992, 333, 5517-5518, либо иодоборогидридом натрия в соответствии с методикой, описанной, . . . 1993, 58, 3568-3571, где дается также обзор других методов превращения аминокислот формулыв аминоспирты формулы . В соответствии с реакционной схемойформулы , соединения, используемые в реакционной схеме , могут быть получены, как описано ниже. Аминокислоты формулымогут быть получены путем алкилирования защищенных (РТ) аминокислот формулыпутем обработки соответствующим основанием и алкилирующим агентом. Конкретная методика проведения такого алкилирования описана , . .., 1977, 55, 906-910, и , . . ., 1985, 50, 945-950. Например, если 3 является метилом, то используют гидрид натрия и метилиодид в тетрагидрофуране. После деблокирования соединения формулыполучают нужное соединение формулы . Альтернативно, аминокислота формулыможет быть -алкилирована с использованием трехстадийного метода, предусматривающего восстановительное бензилирование (например, с использованием бензальдегида в присутствии катализатора гидрирования /С) с получением монобензилового производного и восстановительное аминирование с использованием соответствующего ацильного соединения(например, формальдегида и цианоборогидрида натрия для введения 3 в качестве метильной группы) с получением -бензил-, -3-замещенной аминокислоты. -бензильную защитную группу затем удаляют(например, путем гидрирования с использованием соответствующего катализатора) и получают соединение формулы . Конкретные условия этого трехстадийного метода алкилирования описаны., .. ., 1968, 11, 258-260. Описанный выше метод может быть также использован для введения радикала 3 в промежуточное соединение формулыс образованием промежуточного соединения формулы(которое представляет промежуточное соединение формулы , где 7 является ОН). Этот метод может быть также использован для введения радикала 3 в промежуточное соединение формулы(которое представляет собой промежуточное соединение формулы , где 3 является ). Аминокислоты, используемые в описываемых реакционных схемах (например, в схемах , ), если они не являются коммерчески доступными, могут быть получены различными методами, хорошо известными специалистам. Например, для этой цели может быть использован синтез Штреккера или его варианты. В соответствии с этим методом, альдегид (4), цианид натрия или калия и хлорид аммония подвергают реакции с получением соответствующего аминонитрила. Этот аминонитрил затем гидролизуют с использованием минеральной кислоты и получают нужную аминокислоту 4(2) формулы . Альтернативно, может быть использован метод Бухерера-Берга, где гидантоин может быть образован путем нагревания альдегида (4) с карбонатом аммония и цианидом калия и последующего кислотного или основного гидролиза (например, с использованием гидроксида бария в кипящем диоксане) с получением нужной аминокислоты формулы(4(2. В литературе также описаны и другие методы синтеза -аминокислот, которые позволят специалисту получить нужное промежуточное соединение 4(2) формулы , необходимое для синтеза соединений формулы . Подходящие методы синтеза или выделения соединений формулы можно найти в обзорных работах( 1994, 50, 1539-1650) или( ,., , 1989). В частности, синтез промежуточного соединения формулыв любой энантиомерной форме из соответствующего промежуточного соединения 4 (,или ) может быть осуществлен по методу Пиррунга и Кришнамурту (. .1993, 58, 957-958) или по методу ,. (. . . . 1989,111, 2353-2355). Необходимые промежуточные соединения 4 могут быть легко получены многими методами, известными специалистам. Например, соединения, где 4 является 2 могут быть получены ра 22 4606 1 дикальным галогенированием соединения 3 или формилированием арена - и превращения спирта в бромид. Другой конкретный метод синтеза промежуточных соединений формулыв любой энантиомерной форме описани(. . . .1992,114,1906-1908). Так, например, промежуточное соединение формулы 43 энантиоспецифически восстанавливают до промежуточного соединения 4(ОН)3, которое восстанавливают каталитическим гидрированием, с получением нужного соединения формулы . Необходимый трихлорометилкетон 43 получают с помощью реакции альдегида 4 с трихлорметил-анионом с последующим окислением (,1989, 466-468). Промежуточные амины формулы(используемые в реакционной схеме ), где 5 и 7 являются , могут быть получены в соответствии с реакционной схемой . Аминокислоту формулы(соответствующим образом замещенную (РТ активируют превращением в хлорангидрид, фторангидрид или смешанный ангидрид (например, с использованием изобутилхлороформата и триэтиламина в инертном растворителе, таком как тетрагидрофуран или диоксан при температуре от около -0 С до около -40 С) и после обработки активированного промежуточного соединения диазометаном получают диазокетон формулы . Диазокетон формулыобрабатывают спиртом(например, (1-6) алканолом, таким как метанол) при нагревании или с использованием подходящего катализатора, такого как оксид серебра или бензоат серебра, в результате чего получают сложный эфир формулы . Сложный эфир формулыподвергают деблокированию с образованием соединения формулы(перегруппировка Вольфа). Альтернативно, сложный эфир формулыгидролизуют, например, щелочью, а затем подвергают реакции с соответствующим амином 12 Н или 89, в результате чего получают соединение формулы , как описано ранее. В соответствии с реакционной схемойпромежуточные амины формулы , где 5 представляет собой связанный с кислородом заместитель (например, алкокси) (использованный в реакционной схеме ), могут быть получены следующим образом. Соединение формулыподвергают О-алкилированию обработкой соответствующим алкилирующим агентом (например, алкилиодидом, алкилбромидом, алкилхлоридом или алкилтозилатом) и достаточным основанием с образованием алкоксида (гидрида натрия или калия) в подходящем полярном апротонном растворителе (например, диметилформамиде или тетрагидрофуране) при температуре от около 0 С до около 150 С, в результате чего получают соединение формулы . Соединение формулыдеблокируют и получают нужное аминовое промежуточное соединение. Промежуточные амины формулы , где 5 представляет собой (С 1-С 6) алкоксикарбонилокси-группу (используемую в реакционной схеме ), могут быть получены следующим образом. Соединение формулыалкилируют с использованием галогено-алканоата (сложного эфира) и получают соединение формулы ,которое затем деблокируют с получением нужного амина. Соответствующая кислота может быть получена гидролизом сложного эфира с использованием водной щелочи в соответствующем растворителе. Амины формулы , где 6 содержат сложноэфирную группу,5 содержит карбокси-группу, могут быть получены из амина формулы(полученного, как описано выше), где 5 содержит карбоновокислотную функциональную группу, такую как т-бутиловый сложный эфир, путем обработки безводной кислотой с получением соответствующей кислоты без гидролиза сложного эфира в положении 6. Соединения формулы(промежуточные амины формулы , в которых 5 является защищенной аминоалкокси-группой) могут быть получены из соединения формулы . Соединение формулыалкилируют с использованием галогено-алкан-нитрила и получают соединение формулы . Соединение формулыподвергают восстановлению до первичного амина путем обработки водородом и соответствующим катализатором (например, родий-на-угле) в присутствии аммиака предпочтительно в полярном протонном растворителе, таком как вода, метанол или этанол, в результате чего получают первичный амин формулы . Соединение формулызащищают у атома азота с использованием защитной группы РТ,которая является ортогональной по отношению к другой защитной группе (РТ), с последующим деблокированием защитной группы РТ, в результате чего получают нужное соединение формулы . Защищенное соединение формулыподвергают взаимодействию с соответствующим соединением формулы , в результате чего получают защищенное соединение формулы , которое является незащищенным. Соединения формули , где 2, получают предпочтительно обработкой соединения формулыизбыточным количеством сложного эфира акриловой кислоты или акрилонитрилом, соответственно,в присутствии подходящего основания, такого как гидроксид калия или натрия, в подходящем растворителе,предпочтительно в полярном протонном растворителе. В соответствии с реакционной схемойсоединения формулыи формулы(соединения формулы , где 5 являетсялибо 5 и 7 оба являются ) могут быть получены из соединения формулы . Соединение формулыобрабатывают подходящим фторирующим агентом, таким как трифторид диэтиламиносеры в инертном растворителе, таком как апротонный растворитель, предпочтительно дихлорометан, в результате чего получают соединение формулы . Соединение формулыобычно подвергают деблокированию. 23 4606 1 Соединение формулыокисляют до соединения формулыв условиях, описанных выше для получения соединений формулы , где 5 и 7, взятые вместе, образуют оксо-группу. Соединение формулыподвергают дефторированию в подходящих условиях (например, с использованием трифторида диэтиламиносеры в дихлорометане). В соответствии с реакционной схемойсоединение формулыили соединение формулы ,где 7 является алкилом (т.е. соединение формулы , где 7 является алкилом), получают из соединения формулы(см. также реакционную схемудля получения аналогичных аминов). Соединение формулыобрабатывают металлоорганическим реагентом 7 и полученный вторичный спирт окисляют, как описано непосредственно выше, с образованием соединения формулы 1. Соединение формулыпревращают посредством цианогидрина формулыв соединение формулыс использованием таких же самых условий, которые были использованы для превращения соединения формулыв соединение формулыв реакционной схеме . Альтернативно, соединение формулыпревращают в соединение формулы , как описано выше для превращения промежуточного циано-соединения в амид в реакционной схеме . Соединение формулы 82 или 92 подвергают моноалкилированию с использованием карбонильного соединения, соответствующего 8 или 9, соответственно, в подходящих условиях восстановительного аминирования, в результате чего получают амин формулы 89. Во избежание диалкилирования, предпочтительно защитить амины 82 или 92 подходящей защитной группой РТ с получением 8 или 9(РТ), например, реакцией с бензальдегидом и восстановителем. Защищенные амины подвергают моноалкилированию с использованием карбонильного соединения в соответствии с 9 или 8 в подходящих условиях восстановительного аминирования, в результате чего получают 89(РТ). После удаления защитной группы(РТ) (например, путем исчерпывающего каталитического гидрирования, если РТ является бензилом) получают соединение формулы 89. Подходящие условия восстановительного аминирования любой специалист может найти в соответствующей литературе. Такие условия описаны. (. . . . 1971, 2897-2904), в обзорных статьях( ,, 1948 (14), 174). (. . .1979 (11). ( 1975, 135). Условия восстановительного аминирования, благоприятствующие -моноалкилированию, описаны. (1984, 1213-1220). ( 1992, 121-125). Амины 82 или 92 могут быть также подвергнуты моноалкилированию с использованием 9 или 8, соответственно, гдеявляется хлоридом, бромидом, тозилатом или мезилатом. Альтернативно, промежуточное соединение формулы 8 или 9 может быть подвергнуто алкилированию с использованием 9 или 8 с последующим удалением защитной группы и образованием соединения формулы 89. Для получения аминов формулы 89, где 8 или 9 имеют кислород-азотную связь, могут быть использованы другие методы. Например, легкодоступное соединение формулы (1-4)алкоксикарбонил- или 2 подвергают диалкилированию по атому азота и по атому кислорода обработкой основанием и избыточным количеством подходящего алкилирующего агента , в результате чего получают соответствующий (1-4)-алкоксикарбонил-, который затем гидролизуют, и получают нужное соединение, имеющее формулу 89 (где 89). Подходящие условия для этой реакции, основания и алкилирующие агенты описаны(. . . . 1987, 19, 75-78)(. . . . 1928, 50, 1479). Альтернативно, амин формулы 2 может быть последовательно алкилирован, сначала по кислороду с получением соединения 2 , а затем по азоту с получением соединения 2 путем последовательной обработки алкилирующими агентамии , соответственно,в присутствии подходящего основания. Подходящие основания и алкилирующие агенты описаны(// 100, 3463-3465 (1967). (. . . . 1973, 95, 57165724). После гидролиза этих алкилированных производных гидроксимочевины получают амины 2 и, которые соответствуют некоторым аминам формулы 89. Любой специалист-химик может модифицировать описанный выше метод для других алкилирующих агентов ,и - в целях получения других аминов формулы 89, где 8 или 9 имеют кислород-азотную связь.. ( 1991,559-560) описывают 3-катализируемую реакцию присоединения металлоорганического реагента - с 0 алкилоксимом формулы-, в результате которой получают соединения формулы . Этот способ может быть также использован для получения соединений формулы 89, где один из 8- или 9- имеет кислород-азотную связь. Пролекарственные формы соединений настоящего изобретения, где карбоксильная группа в карбоновой кислоте формулызаменена на сложный эфир, могут быть получены путем реакции карбоновой кислоты с соответствующим алкилгалогенидом в присутствии основания, такого как карбонат калия в инертном растворителе, таком как диметилформамид, при температуре от около 0 до 100 С в течение периода времени от около 1 до около 24 ч. Альтернативно, указанную кислоту подвергают реакции с соответствующим спиртом,используемым в качестве растворителя в присутствии каталитического количества кислоты, такой как кон 24 4606 1 центрированная серная кислота, при температуре от около 20 до 120 С, предпочтительно при температуре кипения растворителя, в течение периода времени от около 1 ч до около 24 ч. Другой метод предусматривает проведение реакции указанной кислоты со стехиометрическим количеством спирта в присутствии каталитического количества кислоты в инертном растворителе, таком как тетрагидрофуран, и с параллельным удалением выделяемой воды физическими (например, с помощью ловушки Дина-Старка) или химическими (например, с использованием молекулярных сит) средствами. Пролекарственные формы соединений настоящего изобретения, в которых спиртовая функциональная группа была преобразована в эфирную группу, могут быть получены реакцией спирта с соответствующим алкилбромидом или алкилиодидом в присутствии основания, такого как карбонат калия в инертном растворителе, таком как диметилформамид, при температуре от около 0 до 100 С в течение периода времени от около 1 ч до около 24 ч. Алканоиламинометиловые простые эфиры могут быть получены реакцией спирта с бис-(алканоиламино) метаном в присутствии каталитического количества кислоты в инертном растворителе, таком как тетрагидрофуран, в соответствии с методом, описанным в патенте США 4 997 984. Альтернативно, эти соединения могут быть получены методами, описанными. . . . 1994, 59,3530. Сложные эфиры диалкилфосфорной кислоты (диалкилфосфаты) могут быть получены реакцией спирта с диалкилхлорофосфатом в присутствии основания в инертном растворителе, таком как тетрагидрофуран. Бифосфаты могут быть получены реакцией спирта с диарил- или дибензилхлорофосфатом, как описано выше, с последующим гидролизом или гидрированием в присутствии катализатора на основе благородного металла,соответственно. Гликозиды получают реакцией спирта с углеводом в инертном растворителе, таком как толуол, и в присутствии кислоты. Воду, обычно образующуюся в процессе реакции, удаляют, как описано выше. Альтернативный метод предусматривает проведение реакции с соответствующим образом защищенным гликозилгологенидом в присутствии основания с последующим деблокированием.-(1-гидроксиалкил) амиды, -(1-гидрокси-1-(алкоксикарбонил) метил) амиды или соединения, в которых 2 был заменен на , могут быть получены реакцией исходного амида или индола с соответствующим альдегидом в нейтральных или основных условиях (например, с использованием этоксида натрия в этаноле) при температуре 25-70 С. -алкоксиметилиндолы или -1-(алкокси) алкилиндолы могут быть получены реакцией -незамещенного индола с нужным алкилгалогенидом в присутствии основания и в инертном растворителе. 1-(,-диалкиламинометил)индол, 1-(1-(,-диалкиламино) этил) индол и ,-диалкиламинометиламиды (например, 3 СН 2(СН 3)2) могут быть получены реакцией исходного соединенияс соответствующим альдегидом и амином в спиртовом растворителе при 25-70 С. Вышеуказанные пролекарственные формы (например, пролекарства настоящего изобретения, в которых 2 и 3 являются общим углеродом) могут быть получены реакцией исходного соединения (лекарственного средства) с альдегидом или кетоном или с его диметилацеталем в инертном растворителе в присутствии каталитического количества кислоты и с сопутствующим удалением воды или метанола. Альтернативно, эти соединения могут быть получены реакцией аминоспирта или гидроксиамида с гем-дибромоалканом в присутствии основания (например, карбоната калия) в инертном растворителе (например, диметилформамиде). Хотя получение большинства исходных соединений и реагентов, используемых в вышеописанных реакционных схемах, (например, амины, замещенные индолкарбоновые кислоты, замещенные индолинкарбоновые кислоты, аминокислоты) описано в настоящей заявке, однако все эти соединения могут быть легко получены самим специалистом в соответствии со стандартными методами органического синтеза. Например,многие промежуточные соединения, используемые для получения соединений формулы , являются родственными природными аминокислотам или происходят от этих аминокислот и представляют большой научный и коммерческий интерес, а поэтому большинство таких промежуточных соединений производятся промышленностью или широко описаны в литературе, либо они могут быть легко получены из известных соединений методами, описанными в литературе. Такими промежуточными соединениями являются, например, соединения формулы , формулы , формулыи формулы . Соединения формулыимеют асимметрические атомы углерода, а поэтому могут образовывать энантиомеры или диастереомеры. Диастереомерные смеси могут быть разделены с получением отдельных диастереомеров методами, известнымии основанными на физических и химических различиях этих диастереомеров, например, с помощью хроматографии и/или фракционированной кристаллизации. Энантиомеры(например, соединения формулы ,или ) могут быть разделены путем превращения энантиомерной смеси в диастереомерную смесь реакцией с соответствующим оптически активным соединением (например,спиртом), с последующим разделением этих диастереомеров и превращением (например, путем гидролиза) отдельных диастереомеров в соответствующие чистые энантиомеры. Все указанные изомеры, включая диастереомеры, энантиомеры и их смеси входят в объем настоящего изобретения. Хотя многие соединения настоящего изобретения не ионизируются в физиологических условиях, однако некоторые соединения настоящего изобретения являются ионизируемыми в физиологических условиях. 25 4606 1 Примерами таких ионизируемых соединений являются кислотные формы соединений настоящего изобретения, которые образуют соли с фармацевтически приемлемым катионом. Все указанные соли входят в объем настоящего изобретения и могут быть получены стандартными методами. Например, они могут быть получены взаимодействием кислотных и основных молекул, взятых, обычно, в стехиометрическом соотношении,в водной, безводной или частично водной среде. Эти соли могут быть выделены фильтрацией, осаждением безводным растворителем с последующей фильтрацией, выпариванием растворителя или, в случае использования водных растворов, лиофилизацией, если это целесообразно. Кроме того, некоторые из соединений настоящего изобретения являются основными и могут образовывать соли с фармацевтически приемлемым анионом. Все такие соли входят в объем настоящего изобретения и могут быть легко получены стандартными методами. Например, указанные соли могут быть получены посредством взаимодействия кислотных и основных молекул, взятых, обычно, в стехиометрическом соотношении, в водной, безводной или частично водной среде. Эти соли могут быть выделены фильтрацией, осаждением безводным растворителем с последующей фильтрацией, выпариванием растворителя или, в случае использования водных растворов, лиофилизацией, если это целесообразно. Кроме того, если соединения настоящего изобретения образуют гидраты или сольваты, то все они также входят в объем настоящего изобретения. Полезность соединений настоящего изобретения в качестве терапевтических средств для лечения заболеваний, связанных с нарушением метаболизма (подробно описанных в настоящей заявке), у млекопитающих(например, у человека) была подтверждена активностью этих соединений в стандартных анализах, а также вианализах, описанных ниже. Благодаря этим анализам можно также сравнить активности соединений настоящего изобретения с активностью других известных соединений. Результаты этих сравнений были использованы для определения дозы, необходимой для лечения млекопитающих, включая человека, от указанных заболеваний. Очищенная гликогенфосфорилаза печени человекабыла получена методом, описанным ниже. Экспрессия и ферментация.-кДНК была экспрессирована из плазмиды рКК 233-2 ( . ., ,) в штамме -1. (, , ). Этот штамм инокулировали в среду (состоящую из 10 г триптона, 5 г дрожжевого экстракта, 5 ги 1 мл 1 н.на литр), в которую были добавлены 100 мг/л ампициллина, 100 мг/л пиридоксина и 600 мг/л 2, и культивировали при 37 С до тех пор, пока ОП 550 (оптическая плотность при 550 нм) не стала равной 1,0. На этой стадии клетки индуцировали 1 мМ изопропил-1-тиогалактозидом . Через три часа после индуцирования клетки собирали путем центрифугирования, и клеточный осадок замораживали при -70 С, и хранили до тех пор, пока они не понадобятся для очистки. Очистка гликогенфосфорилазы. Клеточный осадок, полученный как описано выше, ресуспендировали в 25 мМ -глицерофосфата (рН 7,0), содержащего 0,2 мМ ДТТ, 1 мМ 2 и следующие ингибиторы протеазы 0,7 мкг/мл пепстатина А,0,5 мкг/мл лейпептина,0,2 мМ фенилметилсульфонилфторидаи 0,5 мМ ЕДТА,и лизировали путем предварительной обработки 200 мкг/мл лизоцима и 3 мкг/мл ДНКазы с последующей обработкой ультразвуком в 250-миллиметровых партиях в течение 51,5 мин на льду с использованием ультразвукового дезинтегратора клеток (.). Клеточные лизаты очищали путем центрифугирования при 35 000 в течение 1 ч, а затем путем фильтрации через фильтр 0,45 мк.в растворимой фракции лизатов (составляющей, как было оценено, менее 1 от всего белка) очищали путем перманентного контроля за ферментной активностью (как описано ниже, в главе Анализ на активность) во фракциях, полученных по ходу хроматографирования (более поробно см. ниже). Хроматография, основанная на сродстве иммобилизованного металла . Эта стадия основана на методе.(1992) 584, 77-84. 500 мл отфильтрованной растворимой фракции клеточных лизатов (полученных приблизительно из 160 г исходного клеточного осадка) загружали в 130-миллилитровую колонкус хелатообразующей Сефарозой (, ,), в которую загружают 50 мМ 2 и 25 мМ/6-глицерофосфата, 250 мМи 1 мМ имидазола с использованием уравновешивающего буфера при рН 7. Колонку промывали уравновешивающим буфером до тех пор, пока 280 не возвращалось к своему исходному значению (т.е. фоновому значению). Затем образец элюировали с колонки тем же самым буфером, содержащим 100 мМ имидазола для удаления связаннойи других связанных белков. Фракции, содержащее -активность,собирали и объединяли (примерно 600 мл), после чего добавляли этилендиаминтетрауксусную кислоту 26, -дитиотреитол , фенилметил-сульфонилфторид , лейпептин и пестатин А до получения концентраций указанных соединений 0,3 мМ, 0,2 мМ, 0,2 мМ, 0,5 мкг/мл и 0,7 мкг/мл соответственно. Полученную объединеннуюобессоливали на колонке с Сефадексом -25 (., ., ), уравновешивали буфером А (25 мМ Трис-, рН 7,3, 3 мМ ) для удаления имидазола и хранили на льду до проведения второй хроматографической стадии. Хроматография на 5-АМР-Сефарозе. Образец обессоленной объединенной(приблизительно 600 мл) смешивали с 70 мл 5-АРМСефарозы (,, ,), а затем уравновешивали буфером А (см. выше). Полученную смесь слегка помешивали в течение 1 ч при 22 С, а затем загружали в колонку и промывали буфером А до тех пор, пока А 280 не возвращалось к своему исходному значению.и другие белки элюировали с колонки Буфером В (25 мМ Трис-, 0,2 мМи 10 мМ аденозин-5-монофосфата, рН 7,3). -содержащие фракции идентифицировали на гликогенфосфатазную активность (как описано ниже) и визуально наблюдали полосу -белка с -97 кДа путем электрофореза в полиакриламидном геле с додецил-сульфатом натрия (ДСН-ПААГ) с последующим окрашиванием серебром (2,., , , ), а затем объединяли. Объединенныедиализовали в Буфер С (25 мМ -глицерофосфата, 0,2 мМ , 0,3 мМ , 200 мМ , рН 7,0) и хранили на льду до использования. Определение -ферментативной активности. А). АктивацияПревращениев . Перед определением -ферментативной активности, неактивную форму фермента , экспрессированную в штамме -1. обозначенную ) (, 1 , ) превращают в активную форму (обозначенную ) путем фосфорилированияс использованием киназы фосфорилазы методом, описанным ниже. Реакцияс иммобилизованной киназой фосфорилазы. Киназу фосфорилазы (,, ) иммобилизировали на гранулах - 10( ., , ) в соответствии с инструкциями производителя. Для этого фермент киназу фосфорилазы (10 мг) инкубировали с промытыми гранулами - (1 мл) в 2,5 мл 100 мМи 80 мМ 2 при рН 7,4 в течение 4 ч при 4 С. Затем гранулы промывали один раз тем же самым буфером, после чего подвергали блокированию с использованием 50 мМи 1 сложного эфира глицина при рН 8,0 в течение 1 ч при комнатной температуре. После этого блокирующий буфер удаляли и заменяли 50 мМ(рН 7,4), 1 мМ -меркаптоэтанола и 0,23 для хранения. Перед проведением реакции превращениявгранулы - с иммобилизованной киназой фосфорилазы уравновешивали путем промывания в буфере, используемом для осуществления киназной реакции и содержащем 25 мМ глицерофосфата, 0,3 мМи 0,3 мМпри рН 7,8 (буфер для киназного анализа). Частично очищенную неактивную , полученную в результате хроматографии на 5-АМРСефарозе, как описано выше, разводили в соотношении 110 буфером для киназного анализа, а затем смешивали с вышеупомянутой киназой фосфорилазы, иммобилизованной на гранулах -. Затем добавлялидо 5 мМ и 2 до 6 мМ. Полученную смесь слегка помешивали в течение 30-60 мин при 25 С. Из этих гранул брали образец и процент активациипосредством ее превращения воценивали путем определения -ферментативной активности в отсутствии или в присутствии 3,3 мМ . Процент полной -ферментативной активности, обусловленной ферментной активностью(АМРнезависимой) вычисляли следующим образом- активность - АМРполнойкак.- активностьАМР В. Анализ на -активность. Гипогликемическая активность (а также активность, способствующая лечению/предупреждению других заболеваний/состояний) соединений настоящего изобретения может быть непосредственно определена путем оценки воздействия соединений настоящего изобретения на активность активированной формы гликогенфосфорилазыиспользованием одного из двух методов а именно, в одном методе, гликогенфосфорилазную активность измеряют в прямом направлении путем перманентного контроля за продуцированием глюкозо-1-фосфата из гликогена а в другом методе, гликогенфосфорилазную активность измеряют в обратном направлении путем оценки синтеза гликогена из глюкозо-1-фосфата с высвобождением неорганического фосфата. Все реакции проводили в тройном повторе в 96-луночных планшетах, а изменение оптической плотности, обусловленное образованием продукта реакции, измеряли на длине волны,конкретно указанной ниже, в -ридере МСС/340 11 ( , ), соединенном с приемником(, , ). Для измерения ферментативной активностив прямом направлении продуцирование глюкозо-1 фосфата из гликогена оценивали в соответствии с общим методом мультиферментного связывания, описанного. (, , , , .С. (1997)23,27 4606 1 1711-1717) и модифицированного следующим образом 1-100 мкг фосфорилазы а. 10 ед. фосфоглюкомутазы и 15 ед. глюкозо-6-фосфат-дегидрогеназы (, , ) разводили до 1 мл в Буфере А (описанном выше). Буфер А (рН 7,2) содержит 50 мМ , 100 мМ , 2,5 мМ этиленгликольтетрауксусной кислоты , 2,5 мМ 2/ 3,5 мМ 24 и 0,5 мМ дитиотреитола. 20 мкл этого маточного раствора добавляли к 80 мкл Буфера А, содержащего 0,47 мг/мл гликогена, 9,4 мМ глюкозы,0,63 мМ окисленной формы никотинамид-адениндинуклеотидфосфат ( ). Перед добавлением ферментов добавляли испытуемые соединения в виде 5 мкл раствора в 14 диметилсульфоксида (ДМСО). Начальный уровень ферментативной активностипри отсутствии ингибиторов определяли путем добавления 5 мкл 14 ДМСО, а полностью ингибированный уровень ферментативной активностиполучали путем добавления 20 мкл 50 мМ кофеина (позитивный контроль). За ходом реакции, протекающей при комнатной температуре, следили путем оценки конверсии окисленногов восстановленныйпри 340 нм. Для измерения ферментативной активностив обратном направлении превращение глюкозо-1 фосфата в гликоген с высвобождением неорганического фосфата оценивали в соответствии с общей методикой, описанной. (, , , ., .В. (1970) . . . 48, 746-754) и модифицированной следующим образом 1-100 мкгразводили до 1 мл в Буфере В (описанном выше). Буфер В (рН 7,2) содержит 50 мМ , 100 мМ , 2,5 мМ , 2,5 мМ 2 и 0,5 мМ дитиотреитола. 20 мкл исходного раствора добавляли к 80 мкл Буфера В, содержащего 1,25 мг/мл гликогена, 9,4 мМ глюкозы и 0,63 мМ глюкозо-1-фосфата. Перед добавлением фермента добавляли испытуемые соединения в виде 5 мкл-раствора в 14 ДМСО. Начальный уровень ферментативной активностипри отсутствии ингибиторов определяли путем добавления 5 мкл 14 ДМСО, а полностью ингибированный уровень ферментативной активностиполучали путем добавления 20 мкл 50 мМ кофеина. Эту смесь инкубировали в течение 1 ч при комнатной температуре, и неорганический фосфат, высвобождаемый из глюкозо 1-фосфата, измеряли в соответствии с общей методикой, описанной. (, ,, , ,, О.А. (1979) . . 100, 95-97) и модифицированной следующим образом 150 мкг 10 мг/мл молибдата аммония, 0,38 мг/мл малахитового зеленого в 1 н.добавляли к 100 мкл ферментной смеси. После 20-минутного инкубирования при комнатной температуре измеряли оптическую плотность при 620 нм. Соединения настоящего изобретения могут быть легко адаптированы для клинического использования в качестве гипогликемических агентов. Гипогликемическая активность соединений настоящего изобретения может быть определена путем оценки количества испытуемого соединения, способствующего снижению уровней глюкозы по сравнению с уровнями глюкозы, полученными с использованием лишь наполнителя(без испытуемого соединения), вводимого / мышам-самцам. Этот тест позволяет также определить приблизительную величину минимальной эффективной дозыдляснижения концентрации глюкозы в плазме крови указанных мышей с использованием испытуемых соединений. Поскольку концентрация глюкозы в крови тесно связана с развитием диабета, эти соединения, благодаря их гипогликемической активности, обладают способностью предупреждать, приостанавливать и/или способствовать обратному развитию диабета. Мышей-самцов 57/6-/ в возрасте от 5 до 8 недель (полученных от,, ) помещали в клетки (по пять животных на клетку) в стандартные условия, обычно применяемые при содержании животных. После недельного периода акклиматизации животных взвешивали, и перед каждой обработкой у мышей брали кровь (25 мкл) из ретроорбитальной полости. Пробу крови сразу разводили 15 физиологическим раствором, содержащим 0,025 натрий-гепарина, и выдерживали на льду для анализа метаболитов. Животных распределяли на группы обработки так, чтобы каждая группа имела одинаковую среднюю концентрацию глюкозы в плазме крови. После распределения на группы животным каждый день в течение 4-х дней перорально вводили дозу наполнителя, содержащего либо 1) 0,25 мас. , метилцеллюлозы в воде без коррекции рН либо 2) 0,1 поверхностно-активное вещество, блок-сополимер Плуроник Р 105 ( , , ) в 0,1 физиологическом растворе без коррекции рН. На 5-й день животных снова взвешивали, после чего вводили перорально дозу испытуемого соединения или наполнителя. Все лекарственные средства вводили в наполнителе, состоящем либо из 1) 0,25 масс/об. метилцеллюлозы в воде без коррекции рН либо из 2) 10 ДМСО/0,1 Плуроника Р 105 ( , , ) в 0,1 физиологическом растворе без коррекции рН. Затем через три часа у животных брали кровь из ретроорбитальной пазухи для определения уровней метаболитов в крови. Свежесобранные образцы центрифугировали в течение двух минут при 10000 хпри комнатной температуре. Супернатант анализировали на глюкозу с помощью, например,( , , ) и автоматического анализатора( ), используя тест-систему реагентов - - ( , , ) (модификация метода,, 101, 860 (1971 (гексокиназный метод) и используя 100 мг/дл-стандарт. Уровень глюкозы в плазме вычисляли по следующему уравнению 4606 1 Глюкоза в плазме (мг/дл)Измеренная величина для данной пробы 51,7848,92 измеренная величина. У животных, которым вводили дозы лишь одного наполнителя, наблюдались, в основном, неизмененные гипергликемические уровни глюкозы в крови (например, равные или превышающие 250 мг/дл), а у животных, которым вводили испытуемые соединения в соответствующих дозах, наблюдалось значительное снижение уровней глюкозы в крови. Гипогликемическую активность испытуемых соединений определяли путем статистического анализа (непарного -критерия Стьюдента) средней концентрации глюкозы в плазме путем сравнения группы, обработанной испытуемым соединением, и группы, которой был введен наполнитель на 5 день. Описанный выше анализ проводили с использованием ряда доз испытуемых соединений, что позволило определить приблизительное значение минимальной эффективной дозы (Э) дляснижения концентрации глюкозы в плазме. Соединения настоящего изобретения могут быть легко адаптированы для клинического использования в качестве средств, способствующих снижению уровня инсулина в крови до нормы в качестве средств, снижающих концентрацию триглицеридов в крови, и в качестве гипохолестеринемических средств. Такая активность может быть определена путем оценки количества испытуемого соединения, способствующего снижению уровней инсулина, триглицеридов или холестерина в крови, по сравнению с контролем (т.е. контрольным / мышам-самцам вводили наполнитель без испытуемого соединения). Поскольку концентрация холестерина в крови тесно связана с развитием сердечно-сосудистых заболеваний, а также нарушений кровообращения головного мозга и периферической системы кровообращения, соединения настоящего изобретения, благодаря их гипохолестеринемической активности, способны предупреждать, приостанавливать и/или вызывать обратное развитие атеросклероза. Поскольку концентрация инсулина в крови тесно связана со стимуляцией роста сосудистых клеток и с увеличением накопления натрия в почках (помимо всех прочих функций, например стимулирования утилизации глюкозы), а эти функции, как известно, приводят к развитию гипертензии, соединения настоящего изобретения, благодаря их гипоинсулинемическому действию, способны предупреждать, приостанавливать и/или вызывать обратное развитие гипертензии. Поскольку концентрация триглицеридов в крови вносит свой вклад в общий уровень липидов в крови,соединения настоящего изобретения, благодаря их действию, приводящему к снижению уровней триглицеридов, способны предупреждать, приостанавливать и/или вызывать обратное развитие гиперлипидемии. Мышей-самцов 57/6-/ в возрасте от 5 до 8 недель (полученных от,, ) помещали в клетки (по пять животных на клетку) в стандартные условия, при которых обычно содержатся животные, и кормили без ограничения стандартным рационом для грызунов. После недельного периода акклиматизации животных взвешивали, и перед каждой обработкой из ретроорбитальной пазухи брали 25 микролитров крови. Пробы крови сразу разводили 15 физиологическим раствором, содержащим 0,025 натрий-гепарин, и выдерживали на льду для анализа на содержание глюкозы в плазме. Животных распределяли на группы обработки так, чтобы каждая группа имела одинаковую среднюю концентрацию глюкозы в плазме крови. Испытуемые соединения вводили с помощью желудочного зонда в виде примерно 0,02-2,0 -ного раствора (масса/объем (мас./об. либо в 1) 10 ДМСО/0,1 Плуроник Р 105 (ПАВ, блоксополимер) ( , , ) в 0,1 -ном физиологическом растворе, без коррекции рН либо в 2) 0,25(мас./об.) метилцеллюлоза в воде, без коррекции рН. Эти соединения вводили ежедневно в течение 1-15 дней в виде разовой дозы либо в виде разделенной дозы два раза в день . Контрольные мыши получали 10 ДМСО/0,1 Плуроник Р 105 в 0,1 -ном физиологическом растворе без коррекции рН либо 0,25(мас./об.) метилцеллюлозу в воде без коррекции рН. Через три часа после введения последней дозы мышей умерщвляли путем декапитации (обезглавливания), и кровь собирали в 0,5-миллилитровые пробирки сепаратора для отделения сыворотоки, содержащие 3,6 мг смеси фторида натрия и оксалата калия (11 мас./мас.). Свежесобранные образцы центрифугировали в течение двух минут при 10000 при комнатной температуре, и сывороточный супернатант собирали и разводили (11 об./об.) 1 /мл ( - международная туберкулиновая единица) раствора апротинина в 0,1 -ном физиологическом растворе, без коррекции рН. Разведенные образцы плазмы хранили при -80 С до использования в анализах. После оттаивания разведенные образцы сыворотки анализировали на уровни инсулина, триглицеридов и холестерина. Концентрацию инсулина в сыворотке определяли с использованием наборов(в соответствии с методом двойного антитела, как описано производителем), которые были закуплены у фирмы ,, . Коэффициент вариации для серии анализов составлял 10 . Уровень триглицеридов в сыворотке определяли с использованием автоматического анализатораи( , , ) тест-системы реагентов -(,, , ) (иммуноферментный метод с использованием липазы модификация метода Сэмпсона (.,21, 1983 (1975. Уровень общего холестерина в сыворотке определяли с помощью автоматического анализатора( , , ) и тест-системы реагентов -29(иммуноферментный метод с использованием холестеринэстеразы модификация метода Аллена (.,20, 470 (1974, с использованием 100- и 300 мг/дл-стандартов. Уровни инсулина, триглицеридов, а также общего холестерина в сыворотке вычисляли по следующему уравнению Уровень инсулина в сыворотке (мкЕд/мл)измеренная величина для данной пробы 2,Уровень триглицеридов в сыворотке (мг/дл)измеренная величина для данной пробы 2,Уровень общего холестерина в сывороткеизмеренная величина для данной пробы 2,где 2 - кратность разведения. У животных, которым вводили дозы одного наполнителя, наблюдались, в основном, неизменные повышенные уровни инсулина (например, 225 мкЕд), уровни триглицеридов (например, 225 мг/дл) и уровни общего холестерина (например, 160 мг/дл) в сыворотке, тогда как у животных, обработанных соединениями настоящего изобретения, наблюдалось снижение сывороточных уровней инсулина, триглицеридов и общего холестерина. Активность соединений настоящего изобретения, направленную на снижение сывороточных уровней инсулина, триглицеридов и общего холестерина, определяли с помощью статистического анализа(непарного -критерия Стьюдента) средних концентраций инсулина, триглицеридов или общего холестерина в сыворотке путем сравнения результатов, полученных для группы, обработанной испытуемыми соединениями, и для контрольной группы, обработанной лишь одним наполнителем. Активность соединений настоящего изобретения, направленная на защиту сердечной ткани от повреждения, может быть продемонстрированас помощью методики, предложенной в., . .., 264, Н 1884-Н 1889, 1993., . . ., 1994, 267, 66-74). Эксперименты проводились с использованием изохорных препаратов сердца крыс, полученных, как описано в вышеуказанной статье. Нормальных самцов крыс -, самцов крыс - с сердечной гипертрофией,индуцированной путем операции с перевязыванием аорты, самцов крыс / с быстро прогрессирующим диабетом или контрольных крыс соответствующего возраста (/), не имеющих диабета, предварительно обрабатывали гепарином (1000 ед., в/бр.), а затем пентобарбиталом (65 мг/кг, в/бр.). После достижения крысами состояния глубокой анестезии, сердце быстро иссекали и помещали в охлажденный льдом физиологический раствор. В течение 2 мин, сердце подвергали ретроградной перфузии через аорту. Частоту сердечных сокращений и внутрижелудочковое давление определяли с использованием в левом желудочке латексного баллона с высоконапорным шлангом, соединенным с датчиком давления. Перфузию сердца проводили перфузирующим раствором, содержащим 118 мМ , 4,7 мМ , 1,2 мМ 2, 1/2 мМ 2/ 25 мМ 3/11 мМ глюкозы. Перфузионный аппарат был снабжен нагреваемой баней для непосредственного регулирования температуры перфузата и воды, циркулирующей вокруг перфузионного шланга для поддержания температуры сердца 37 С. Насыщение кислородом перфузата осуществляли с помощью педиатрического волоконного оксигенатора (,., , ) в непосредственной близости к сердцу. Сначала осуществляли перфузию крысиных сердец перфузатомиспытуемым соединением в течение 10 мин или более, затем в течение 20 мин сердца подвергали глобальной ишемии, а после этого в течение 60 мин осуществляли реперфузию в отсутствие испытуемого соединения. Частоту сердечных сокращений для контроля и для сердец, обработанных испытуемым соединением, сравнивали за период времени, после ишемии. Кроме того, за период времени после ишемии сравнивали давление внутри левого желудочка для контрольных сердец и для сердец, обработанных испытуемым соединением. В конце эксперимента сердца также подвергали перфузии и окрашиванию для определения уровня инфарктных зон по отношению к зонам риска( 1 А/ААР), как описано ниже. Терапевтическое действие соединений настоящего изобретения, способствующее предупреждению повреждения сердечной ткани, являющегося результатом ишемического нарушения кровоснабжения, может быть также продемонстрированов соответствии с методикой, предложенной., ,. 84, 1 ( 1991) и описанной ниже. В этоманализе проводили испытания соединений настоящего изобретения на их способность к защите тканей сердца по сравнению с контрольной группой, которой вводили наполнитель (физиологический раствор). В качестве основной информации следует отметить, что короткие периоды ишемии миокарда с последующей коронарной артериальной реперфузией способствуют защите сердца от последующей тяжелой ишемии миокарда (.,74, 1124-1136, 1986). Защита сердечной ткани, определяемая как уменьшение участков ткани миокарда, подверженных некрозу (инфаркту), может быть индуцирована фармакологически путем внутривенного введения агонистов рецептора аденозина интактным анестезированным кроликам, исследованным какмодель для предварительной подготовки к экспериментам по изучению ишемии миокарда (.,84350-356, 1991). В этомэксперименте проводили исследования на способность соединений обеспечивать фармакологическую защиту сердечной ткани, т.е. на способность этих соединений уменьшать участки инфаркта миокарда при парентеральном введении интактным анестеризованным кроликам. Действие этих соединений можно затемопределяемой по рефлексу конечности.
МПК / Метки
МПК: A61P 3/06, C07D 401/12, A61P 9/10, A61P 3/10, A61P 9/12, A61K 31/40, C07D 405/12, A61K 31/345, C07D 403/12, C07D 209/42
Метки: замещенных, композиция, производные, фармацевтическая, гликогенфосфорилазозависимых, заболеваний, n-(индол-2-карбонил)-(-аланинамидов, лечения, способ
Код ссылки
<a href="https://by.patents.su/30-4607-proizvodnye-zameshhennyh-n-indol-2-karbonil-alaninamidov-sposob-lecheniya-glikogenfosforilazozavisimyh-zabolevanijj-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Беларуси">Производные замещенных N-(индол-2-карбонил)-(-аланинамидов, способ лечения гликогенфосфорилазозависимых заболеваний, фармацевтическая композиция</a>
Предыдущий патент: Фармакологически активные энантиомеры
Следующий патент: Стиральная или посудомоечная машина
Случайный патент: Самоходная молотилка