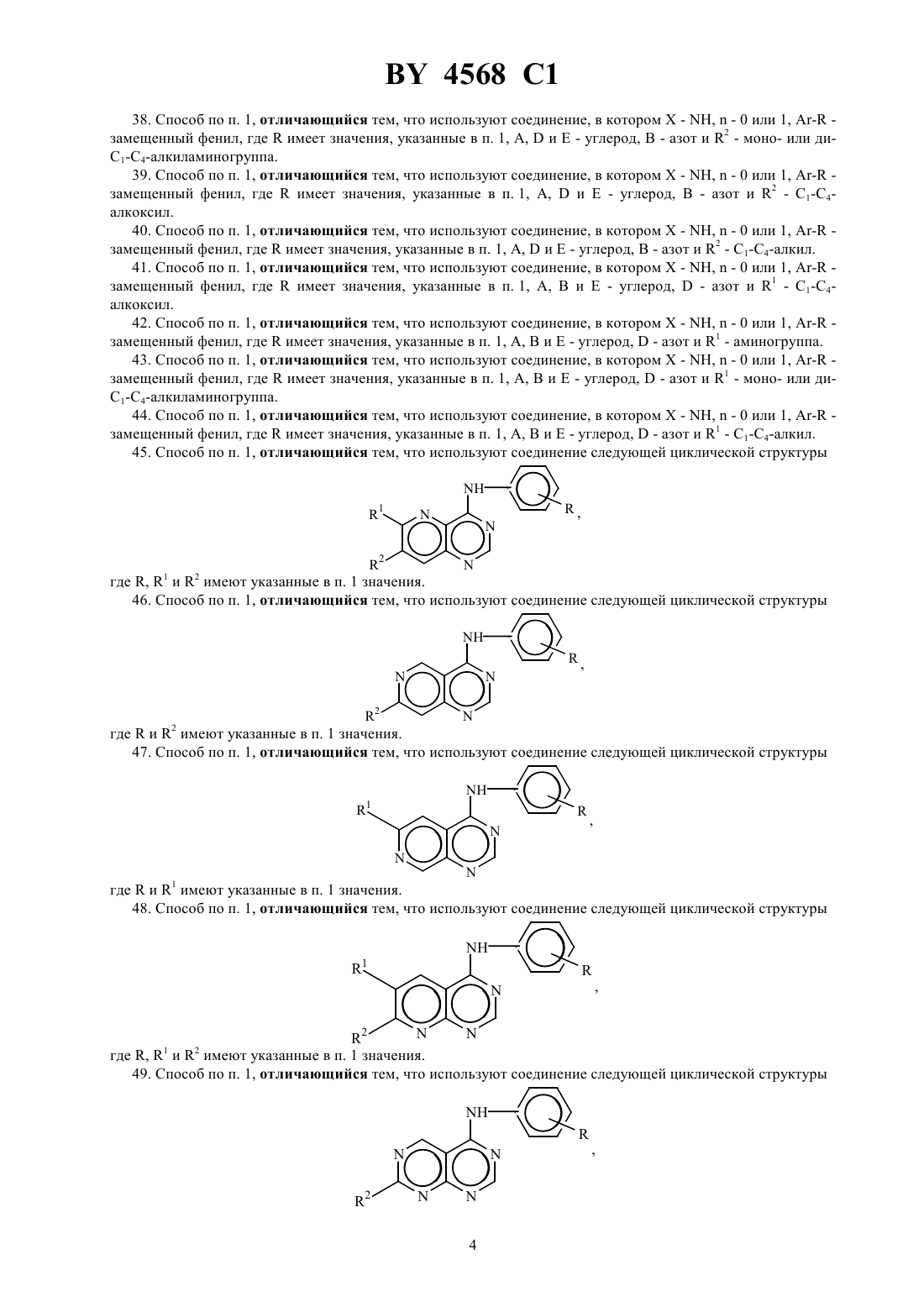
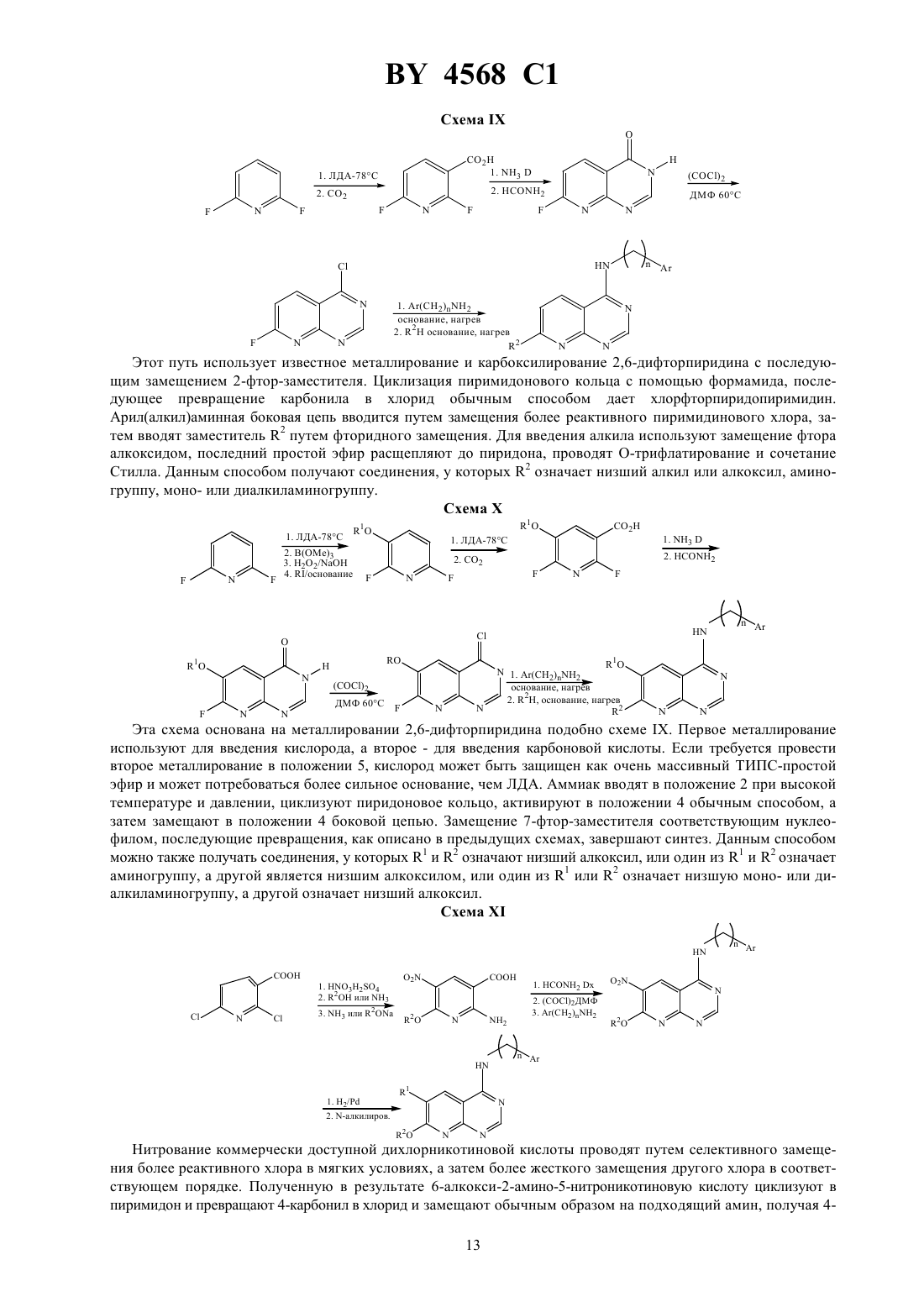
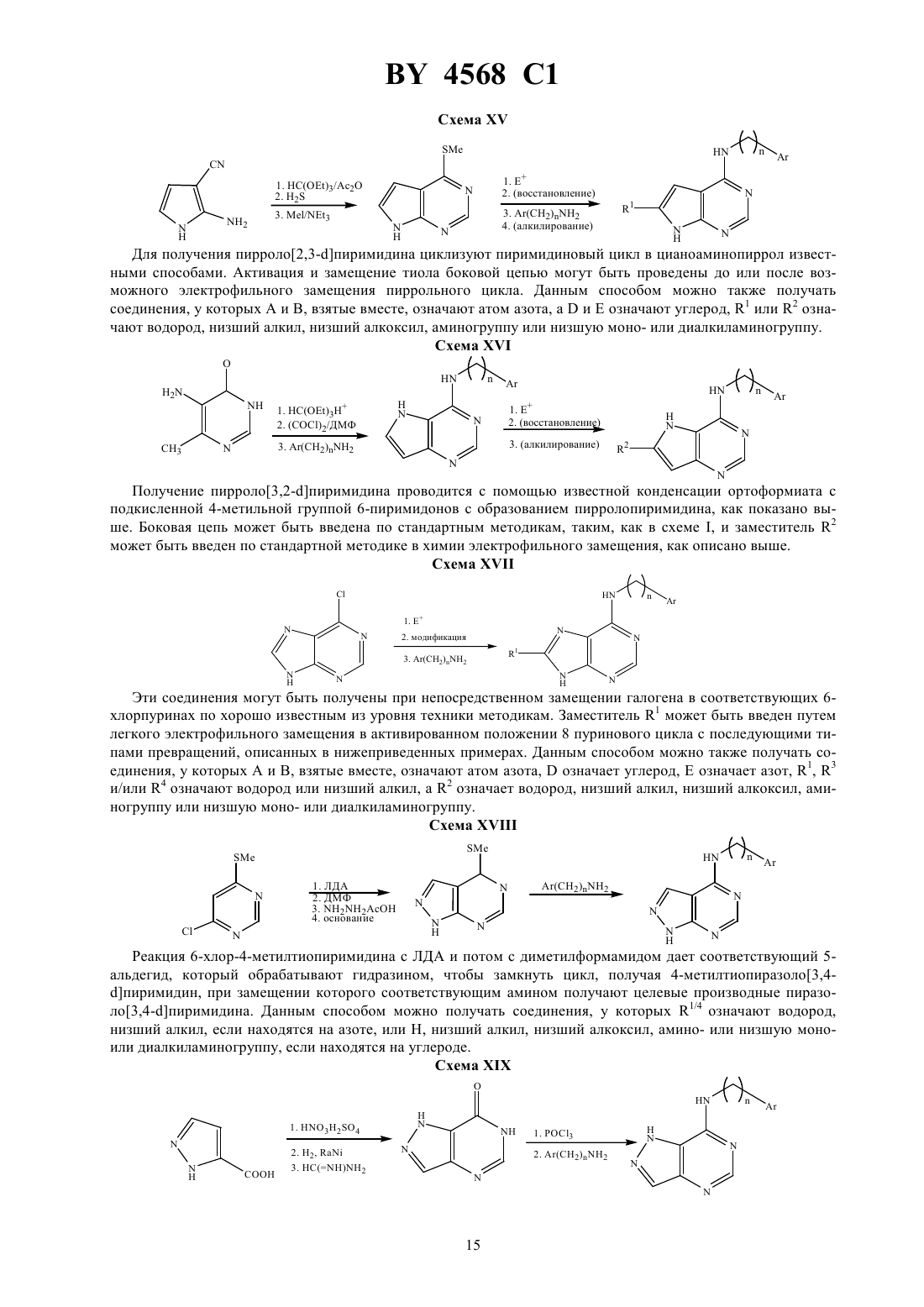
Способы ингибирования тирозинкиназы рецептора эпидермального фактора роста, бициклические производные пиримидина, фармацевтическая композиция, обладающая ингибирующей тирозинкиназу рецептора эпидермального фактора роста активностью, и композиция, обладаю
Текст
(12) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СПОСОБЫ ИНГИБИРОВАНИЯ ТИРОЗИНКИНАЗЫ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА,БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРИМИДИНА,ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ИНГИБИРУЮЩЕЙ ТИРОЗИНКИНАЗУ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА АКТИВНОСТЬЮ,И КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ КОНТРАЦЕПТИВНЫМ ДЕЙСТВИЕМ(/) Дэвид ФРАЙ Алан КРЕЙКЕР Роберт МАЙЕР (/) Гордон, Уиллиам РУКАСЛ Андру, Марк ТОМПСОН (/)(57) 1. Способ ингибирования тирозинкиназы рецептора эпидермального фактора роста при лечении млекопитающего путем введения млекопитающему бициклического производного, отличающийся тем, что в качестве бициклического производного используют бициклическое производное пиримидина общей формулы 4 где 1-2 из радикалов А-Е означают азот, а остальные радикалы - углерод, или два смежных радикала А-Е вместе представляют гетероатом, выбранный из азота и серы, при этом А-Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное или имидазольное кольцо,Х -или 5, где 5 - С 1-С 4-алкил- 0, 1 или 2 отсутствует или означает водород, С 1-С 4-алкил, С 1-С 4-алкоксил, нитрогруппу, галоген, С 1-С 4 перфторалкил, гидроксил, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу 4568 1- фенил или тиенил 1, 2, 3 и 4 независимо друг от друга отсутствуют или означают водород, С 1-С 4-алкил, С 1-С 4-алкоксил,С 1-С 4-ацилокси, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу или С 1-С 4-ациламиногруппу,при этом а) по крайней мере один из радикалов 1-4 имеет значение, отличное от водорода, С 1-С 4 алкила или С 1-С 4-алкоксила б) если Е и В означают азот,и А - углерод, 1 и 4 отсутствуют, 3 - водород, - ,- 0, 1 или 2,- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2 и- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2,- тиенил, то 2 имеет значение, отличное от водорода, аминогруппы или моно- или ди-С 1-С 4-алкиламиногруппы,или его фармацевтически приемлемую соль в эффективном количестве. 2. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод, радикал- азот, один из радикалов 1 и 2 означает водород, а другой - С 1-С 4-алкоксил. 3. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод, радикал- азот, один из радикалов 1 и 2 означает водород, а другой - аминогруппу. 4. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод, радикал- азот, один из радикалов 1 и 2 означает водород, а другой - моно- или ди-С 1-С 4-алкиламиногруппу. 5. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод, радикал- азот, один из радикалов 1 и 2 означает водород, а другой - С 1-С 4-алкил. 6. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод, радикал- азот, радикалы 1 и 2 означают С 1-С 4-алкоксил. 7. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод, радикал- азот, радикалы 1 и 2 означают С 1-С 4-алкил. 8. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод, радикал- азот, один из радикалов 1 и 2 означает аминогруппу, а другой - С 1-С 4-алкоксил. 9. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод, радикал- азот, один из радикалов 1 и 2 означает моно- или ди-С 1-С 4-алкиламиногруппу, а другой - С 1-С 4-алкоксил. 10. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А,и- углерод, радикал В - азот, а 2 - С 1-С 4 алкоксил. 11. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А,и- углерод, радикал В - азот, а 2 - аминогруппа. 12. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А,и- углерод, радикал В - азот, а 2 - моноили ди-С 1-С 4-алкиламиногруппа. 13. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А,и- углерод, радикал В - азот, а 2 - С 1-С 4 алкил. 14. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, а 1 - С 1-С 4 алкоксил. 15. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, а 1 - аминогруппа. 16. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, а 1 - моноили ди-С 1-С 4-алкиламиногруппа. 17. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, а 1 - С 1-С 4 алкил. 4568 1 18. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, один из радикалов 1 и 2 означает водород, а другой - С 1-С 4-алкоксил. 19. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, один из радикалов 1 и 2 означает водород, а другой - аминогруппу. 20. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, один из радикалов 1 и 2 означает водород, а другой - моно- или ди-С 1-С 4-алкиламиногруппу. 21. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, один из радикалов 1 и 2 означает водород, а другой - С 1-С 4-алкил. 22. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, радикалы 1 и 2 означают С 1-С 4-алкоксил. 23. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, радикалы 1 и 2 означают С 1-С 4-алкил. 24. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, один из радикалов 1 и 2 означает аминогруппу, а другой - С 1-С 4-алкоксил. 25. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, А, В и- углерод, радикал- азот, один из радикалов 1 и 2 означает моно- или ди-С 1-С 4-алкиламиногруппу, а другой - С 1-С 4-алкоксил. 26. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0, - - замещенный фенил, гдеимеет значения, указанные в п. 1,и- углерод,и- азот, а 2 - С 1-С 4-алкоксил. 27. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0, - - замещенный фенил, гдеимеет значения, указанные в п. 1,и- углерод,и- азот, а 2 - моно- или ди-С 1 С 4-алкиламиногруппа. 28. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0, - - замещенный фенил, гдеимеет значения, указанные в п. 1,и- углерод,и- азот, а 2 - аминогруппа. 29. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0, - - замещенный фенил, гдеимеет значения, указанные в п. 1, В и- углерод, А и- азот, а 1 и 2 - С 1-С 4 алкоксил. 30. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0, - - замещенный фенил, гдеимеет значения, указанные в п. 1, В и- углерод, А и- азот, а 1 и 2 - моно- или ди-С 1-С 4-алкиламиногруппа. 31. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0, - - замещенный фенил, гдеимеет значения, указанные в п. 1,и- углерод,и- азот, один из радикалов 1 и 2 означает С 1-С 4-алкоксил, а другой - моно- или ди-С 1-С 4-алкиламиногруппу. 32. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1,ивместе означают атом азота,и- углерод, илии- углерод, аивместе означают атом азота, 1 и 2 - водород, С 1-С 4-алкил, С 1-С 4-алкоксил,аминогруппу или моно- или ди-С 1-С 4-алкиламиногруппу. 33. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1,ивместе означают атом серы,- азот и- углерод, илиивместе означают атом углерода,- азот и- серу, 1-4 - водород, С 1-С 4-алкил, С 1-С 4 алкоксил или моно- или ди-С 1-С 4-алкиламиногруппу. 34. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1,ивместе означают атом азота,- азот иуглерод, 1-4 - водород, С 1-С 4-алкил, С 1-С 4-алкоксил или моно- или ди-С 1-С 4-алкиламиногруппу, если они связаны с углеродом. 35. Способ по п. 1, отличающийся тем, что используют соединение формулыв виде отдельных стереоизомеров или рацемических и/или диастереомерных смесей. 36. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод,- азот и 2 - С 1-С 4 алкоксил. 37. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод,- азот и 2 - аминогруппа. 3 4568 1 38. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод,- азот и 2 - моно- или диС 1-С 4-алкиламиногруппа. 39. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод,- азот и 2 - С 1-С 4 алкоксил. 40. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод,- азот и 2 - С 1-С 4-алкил. 41. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод,- азот и 1 - С 1-С 4 алкоксил. 42. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод,- азот и 1 - аминогруппа. 43. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод,- азот и 1 - моно- или диС 1-С 4-алкиламиногруппа. 44. Способ по п. 1, отличающийся тем, что используют соединение, в котором Х - ,- 0 или 1, - замещенный фенил, гдеимеет значения, указанные в п. 1, ,и- углерод,- азот и 1 - С 1-С 4-алкил. 45. Способ по п. 1, отличающийся тем, что используют соединение следующей циклической структуры где ,иимеют указанные в п. 1 значения. 46. Способ по п. 1, отличающийся тем, что используют соединение следующей циклической структуры 1 гдеи 2 имеют указанные в п. 1 значения. 47. Способ по п. 1, отличающийся тем, что используют соединение следующей циклической структуры гдеиимеют указанные в п. 1 значения. 48. Способ по п. 1, отличающийся тем, что используют соединение следующей циклической структуры 2 где ,иимеют указанные в п. 1 значения. 49. Способ по п. 1, отличающийся тем, что используют соединение следующей циклической структуры 1,4568 1 гдеи 2 имеют указанные в п. 1 значения. 50. Способ по п. 1, отличающийся тем, что используют соединение, выбранное из группы, включающей 6-амино-4-(3-броманилино)пиридо 3,2-пиримидин 4-(3-броманилино)-6-метиламинопиридо 3,2-пиримидин 4-(3-броманилино)-6-диметиламинопиридо 3,2-пиримидин 7-амино-4-(3-нитроанилино)пиридо 4,3-пиримидин 7-амино-4-(3-броманилино)пиридо 4,3-пиримидин 7-амино-4-(4-броманилино)пиридо 4,3-пиримидин 7-амино-4-(3-трифторметиланилино)пиридо 4,3-пиримидин 7-ацетиламино-4-(3-броманилино)пиридо 4,3-пиримидин 4-бензиламинопиридо 4,3-пиримидин 7-ацетамидо-4-бензиламинопиридо 4,3-пиримидин 4-(3-броманилино)-6-хлорпиридо 3,4-пиримидин 4-(3-броманилино)-6-метоксипиридо 3,4-пиримидин 4-(3-броманилино)-6-метиламинопиридо 3,4-пиримидин 4-(3-броманилино)-6-диметиламинопиридо 3,4-пиримидин 4-(3-броманилино)тиено 3,4-пиримидин 4-бензиламинотиено 3,4-пиримидин 4-(3-броманилино)тиено 3,2-пиримидин 4-бензиламинотиено 3,2-пиримидин 4-(3-броманилино)тиено 2,3-пиримидин 6-(3-бромфенил)аденин. 51. Бициклические производные пиримидина общей формулы 4 где 1-2 из радикалов А - Е означают азот, а остальные радикалы - углерод, или два смежных радикала А - Е вместе представляют гетероатом, выбранный из азота и серы, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное или имидазольное кольцо,Х -или 5, где 5 - С 1-С 4-алкил- 0, 1 или 2 отсутствует или означает водород, С 1-С 4-алкил, С 1-С 4-алкоксил, нитрогруппу, галоген, С 1-С 4 перфторалкил, гидроксил, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу- фенил или тиенил 1, 2, 3 и 4 независимо друг от друга отсутствуют или означают водород, С 1-С 4-алкил, С 1-С 4-алкоксил,С 1-С 4-ацилокси, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу или С 1-С 4-ациламиногруппу,при этом а) по крайней мере один из радикалов 1-4 имеет значение, отличное от водорода, С 1-С 4-алкила или С 1-С 4-алкоксила б) если Е и В означают азот,и А - углерод, 1 и 4 отсутствуют, 3 - водород,,- 0, 1 или 2,- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2 и- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2,- тиенил, то 2 имеет значение, отличное от водорода, аминогруппы или моно- или ди-С 1-С 4-алкиламиногруппы,или их отдельные стереоизомеры, рацемат или смесь диастереомеров или их фармацевтически приемлемые соли или гидраты. 52. Бициклические производные пиримидина общей формулыпо п. 51, выбранные из группы, включающей 6-амино-4-(3-броманилино)пиридо 3,2-пиримидин 4-(3-броманилино)-6-метиламинопиридо 3,2-пиримидин 4-(3-броманилино)-6-диметиламинопиридо 3,2-пиримидин 7-амино-4-(3-нитроанилино)пиридо 4,3-пиримидин 7-амино-4-(3-броманилино)пиридо 4,3-пиримидин 7-амино-4-(4-броманилино)пиридо 4,3-пиримидин 7-амино-4-(3-трифторметиланилино)пиридо 4,3-пиримидин 7-ацетиламино-4-(3-броманилино)пиридо 4,3-пиримидин 4568 1 7-ацетамидо-4-бензиламинопиридо 4,3-пиримидин 4-(3-броманилино)-6-диметиламинопиридо 3,4-пиримидин. 53. Фармацевтическая композиция, обладающая ингибирующей тирозинкиназу рецептора эпидермального фактора роста активностью, включающая бициклическое соединение в смеси с фармацевтически приемлемым эксципиентом, разбавителем или носителем, отличающаяся тем, что в качестве бициклического соединения она содержит бициклическое производное пиримидина общей формулы где 1-2 из радикалов А - Е означают азот, а остальные радикалы - углерод, или два смежных радикала А - Е вместе представляют гетероатом, выбранный из азота и серы, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное или имидазольное кольцо,Х -или 5, где 5 - С 1-С 4-алкил- 0, 1 или 2 отсутствует или означает водород, С 1-С 4-алкил, С 1-С 4-алкоксил, нитрогруппу, галоген, С 1-С 4 перфторалкил, гидроксил, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу- фенил или тиенил 1, 2, 3 и 4 независимо друг от друга отсутствуют или означают водород, С 1-С 4-алкил, С 1-С 4-алкоксил,С 1-С 4-ацилокси, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу или С 1-С 4-ациламиногруппу,при этом а) по крайней мере один из радикалов 1-4 имеет значение, отличное от водорода, С 1-С 4-алкила или С 1-С 4-алкоксила б) если Е и В означают азот,и А - углерод, 1 и 4 отсутствуют, 3 - водород,,- 0, 1 или 2,- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2 и- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2,- тиенил, то 2 имеет значение, отличное от водорода, аминогруппы или моно- или ди-С 1-С 4-алкиламиногруппы,или его фармацевтически приемлемую соль в эффективном количестве. 54. Способ ингибирования тирозинкиназы рецептора эпидермального фактора роста при лечении раковых заболеваний путем введения млекопитающему бициклического производного, отличающийся тем, что в качестве бициклического производного используют бициклическое производное пиримидина общей формулы где 1-2 из радикалов А - Е означают азот, а остальные радикалы - углерод, или два смежных радикала А - Е вместе представляют гетероатом, выбранный из азота и серы, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное или имидазольное кольцо,Х -или 5, где 5 - С 1-С 4-алкил- 0, 1 или 2 отсутствует или означает водород, С 1-С 4-алкил, С 1-С 4-алкоксил, нитрогруппу, галоген, С 1-С 4 перфторалкил, гидроксил, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу- фенил или тиенил 1, 2, 3 и 4 независимо друг от друга отсутствуют или означают водород, С 1-С 4-алкил, С 1-С 4-алкоксил,С 1-С 4-ацилокси, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу или С 1-С 4-ациламиногруппу,при этом а) по крайней мере один из радикалов 1-4 имеет значение, отличное от водорода, С 1-С 4 алкила или С 1-С 4-алкоксила б) если Е и В означают азот,и А - углерод, 1 и 4 отсутствуют, 3 - водород, - ,- 0, 1 или 2,- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 4568 1 2 и- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2,- тиенил, то 2 имеет значение, отличное от водорода, аминогруппы или моно- или ди-С 1-С 4-алкиламиногруппы,или его фармацевтически приемлемую соль в эффективном количестве. 55. Способ ингибирования тирозинкиназы рецептора эпидермального фактора роста для предотвращения имплантации бластоцита путем введения млекопитающему бициклического соединения, отличающийся тем, что в качестве бициклического соединения используют бициклическое производное пиримидина общей формулы где 1-2 из радикалов А - Е означают азот, а остальные радикалы - углерод, или два смежных радикала А - Е вместе представляют гетероатом, выбранный из азота и серы, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное или имидазольное кольцо,Х -или 5, где 5 - С 1-С 4-алкил- 0, 1 или 2 отсутствует или означает водород, С 1-С 4-алкил, С 1-С 4-алкоксил, нитрогруппу, галоген, С 1-С 4 перфторалкил, гидроксил, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу- фенил или тиенил 1, 2, 3 и 4 независимо друг от друга отсутствуют или означают водород, С 1-С 4-алкил, С 1-С 4-алкоксил,С 1-С 4-ацилокси, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу или С 1-С 4-ациламиногруппу,при этом а) по крайней мере один из радикалов 1-4 имеет значение, отличное от водорода, С 1-С 4 алкила или С 1-С 4-алкоксила б) если Е и В означают азот,и А - углерод, 1 и 4 отсутствуют, 3 - водород, - ,- 0, 1 или 2,- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2 и- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2,- тиенил, то 2 имеет значение, отличное от водорода, аминогруппы или моно- или ди-С 1-С 4-алкиламиногруппы,или его фармацевтически приемлемую соль в эффективном количестве. 56. Композиция, обладающая контрацептивным действием, включающая бициклическое соединение в смеси с контрацептивно приемлемым эксципиентом, разбавителем или носителем, отличающаяся тем, что в качестве бициклического соединения она содержит бициклическое производное пиримидина общей формулы где 1-2 из радикалов А - Е означают азот, а остальные радикалы - углерод, или два смежных радикала А - Е вместе представляют гетероатом, выбранный из азота и серы, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное или имидазольное кольцо,Х -или 5, где 5 - С 1-С 4-алкил- 0, 1 или 2 отсутствует или означает водород, С 1-С 4-алкил, С 1-С 4-алкоксил, нитрогруппу, галоген, С 1-С 4 перфторалкил, гидроксил, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу- фенил или тиенил 1, 2, 3 и 4 независимо друг от друга отсутствуют или означают водород, С 1-С 4-алкил, С 1-С 4-алкоксил,С 1-С 4-ацилокси, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу или С 1-С 4-ациламиногруппу,при этом а) по крайней мере один из радикалов 1-4 имеет значение, отличное от водорода, С 1-С 4-алкила или С 1-С 4-алкоксила б) если Е и В означают азот,и А - углерод, 1 и 4 отсутствуют, 3 - водород,,- 0, 1 или 2,- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2 и 7 4568 1- фенил, замещенный галогеном, аминогруппой или гидроксилом, или если- 1 или 2,- тиенил, то 2 имеет значение, отличное от водорода, аминогруппы или моно- или ди-С 1-С 4-алкиламиногруппы,или его фармацевтически приемлемую соль в эффективном количестве. Настоящее изобретение относится к области ингибирования протеинкиназы, более конкретно к способам ингибирования тирозинкиназы рецептора эпидермального фактора роста, новым бициклическим производным пиримидина, фармацевтической композиции, обладающей ингибирующей тирозинкиназу рецептора эпидермального фактора роста активностью, и композиции, обладающей контрацептивным действием. Поверхностные клеточные рецепторы семейства тирозинкиназных рецепторов эпидермального фактора ростаиграют роль в ряде заболеваний, например раковых заболеваний. Это семейство состоит изрецептора (также называемого -1), -2 рецептора и его существенно активного онкопротеинового мутанта , -В 3 рецептора и -4 рецептора.имеет в качестве наиболее важных лигандов эпидермальный фактор ростаи трансформирующий фактор роста альфа ( альфа). По-видимому,рецепторы проявляют только минимальные функции у взрослых людей, но возможно вовлекаются в процесс заболевания в значительной части всех видов рака, особенно рака ободочной кишки и груди. Близко родственные рецепторы -2, -В 3 и -4 имеют в качестве основных лигандов семейство герегулинов, а рецептор сверхэкспрессии и мутации был четко определен как основной фактор риска при неблагоприятном прогнозе рака груди. Кроме того, также было показано, что все четыре члена этого семейства рецепторов могут образовывать гетеродимерные сигнальные комплексы с другими членами семейства и что это может привести к синергической трансформирующей способности, если более одного члена семейства проявляет сверхэкспрессию при злокачественной опухоли. Сверхэкспрессия более чем одного члена семейства, как было показано, является относительно обычной для злокачественных опухолей у людей. Пролиферативное заболевание кожи - псориаз в настоящее время не может успешно лечиться. Его часто лечат противораковыми средствами, такими как метотрексат, который имеет очень серьезные побочные эффекты и который является не очень эффективным при ограниченных токсичностью дозах, которые могут быть использованы. Полагают, чтоальфа является основным фактором роста, сверхпродуцирующим при псориазе, поскольку у 50 трансгенных мышей, которые сверхэкспрессируютальфа, развивается псориаз. Это наводит на мысль, что хороший ингибиторсигнализации может быть использован в качестве противопсориазного средства, предпочтительно, но не обязательно, при местном дозировании.является мощным митогеном для клеток почечных канальцев. Четырехкратное увеличение каксекреции мочи, так ии мРНК было отмечено у мышей на ранней стадии диабета, вызванного стрептозойцином. Кроме того, повышенная экспрессиябыла отмечена у пациентов с пролиферативным гломерулонефритом ( и др., , 1993, 25, 327). Сообщалось, что хронический панкреатит коррелирует с большим увеличением экспрессии как ,так иальфа ( и др., 1994, 35, 1468). У пациентов с более серьезной формой заболевания, обычно при увеличении верхней части поджелудочной железы, также была показана сверхэкспрессия -2 рецептора ( и др., . . 1994, 220, 183). В процессах созревания бластоцита, имплантации бластоцита в маточный эндометриум и в других случаях переимплантации ткани матки продуцируютиальфа (,1992, 44, 939) имеют повышенные уровни( и др., , 1989, 124, 2882) и легко могут быть индуцированы на продуцирование гепарин-связующихза счет близости развившегося, но не прекратившего развития бластоцита ( и др., , 1994, 120, 1071). В свою очередь, бластоцит имеет достаточно высокий уровеньальфа иэкспрессии (, . . ., 1990, 27, 16). Хирургическое удаление подчелюстных желез, основного участка секрециив организме, и лечение анти- моноклональными антителами, обе меры значительно снижают фертильность мышей ( и др., . ,1993, 138, 437) за счет успешного снижения имплантации бластоцита. Известны бисмоно- и бициклические ариловые и гетероариловые соединения, которые можно применять для ингибирования тирозинкиназы рецептора эпидермального фактора роста и/или рецептора фактора роста тромбоцитов (см. заявку 92/20642, С 07 С 43/21, А 61 К 31/44, 31/50, 31/495, 26.11.1992 г.). Задачей изобретения является расширение арсенала возможностей ингибирования тирозинкиназы рецептора эпидермального фактора роста, например -2, -3 или -4. Поставленная задача решается нижеописанными объектами. Первым объектом изобретения является способ ингибирования тирозинкиназы рецептора эпидермального фактора роста при лечении млекопитающего путем введения млекопитающему бициклического производного,который заключается в том, что в качестве бициклического производного используют бициклическое производное пиримидина общей формулы где 1-2 из радикалов - означает азот, а остальные радикалы углерод, или два смежных радикала - вместе представляют гетероатом из группы азот, сера, при этом - вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное, имидазольное кольцо, - группы , 5, где 5 означает С 1-С 4-алкил, - 0, 1 или 2, - отсутствует или означает водород, С 1-С 4-алкил, С 1-С 4-алкоксил, нитрогруппу, галоген, С 1-С 4 перфторалкил, гидроксил, аминогруппа, моно- или ди-С 1-С 4-алкиламиногруппа, - фенил, тиенил,1, 2, 3 и 4 независимо друг от друга отсутствуют или означают водород, С 1-С 4-алкил, С 1-С 4-алкоксил,С 1-С 4-ацилокси, аминогруппу, моно- или ди-С 1-С 4-алкиламиногруппу, С 1-С 4-ациламиногруппу,при этом а) по крайней мере один из радикалов 1-4 имеет значение, отличное от водорода, С 1-С 4-алкила или С 1-С 4-алкоксила б) еслии В означают азот,и- углерод, 1 и 4 отсутствуют, 3 - водород,- ,0, 1 или 2,- фенил, замещенный галогеном, амино или гидроксилом, или еслиозначает 1 или 2 ифенил, замещенный галогеном, амино или гидроксилом, или еслиозначает 1 или 2 и- тиенил, то 2 имеет значение, отличное от водорода, амино или моно- или ди-С 1-С 4-алкиламиногруппы, или его фармацевтически приемлемую соль в эффективном количестве. Предпочтительные признаки предлагаемого способа включены в подпункты 2-50 формулы изобретения. Вторым объектом изобретения являются бициклические производные пиримидина вышеприведенной формулы ,где -4, , , А, В, ,иимеют вышеуказанные значения, при этом а) по крайней мере один из радикалов 1-4 имеет значение, отличное от водорода, С 1-С 4-алкила или С 1-С 4-алкоксила, б) еслии В означают азот,и- углерод, 1 и 4 отсутствуют, 3 - водород,- ,- 0, 1 или 2,- фенил, замещенный галогеном, амино или гидроксилом, или еслиозначает 1 или 2 и- фенил, замещенный галогеном, амино или гидроксилом, или еслиозначает 1 или 2 и- тиенил, то 2 имеет значение, отличное от водорода,амино или моно- или ди-С 1-С 4-алкиламиногруппы,их отдельные стереоизомеры, рацемат или смесь диастереомеров или их фармацевтические соли или гидраты. Предпочтительными бициклическими производными пиримидина формулыявляются соединения, выбранные из группы, включающей 6-амино-4-(3-бром-анилино)пиридо 3,2-пиримидин 4-(3-броманилино)6-метиламинопиридо 3,2-пиримидин 4-(3-броманилино)-6-диметиламинопиридо 3,2-пиримидин 7 амино-4-(3-нитроанилино)пиридо 4,3-пиримидин 7-амино-4-(3-броманилино)пиридо 4,3-пиримидин 7 амино-4-(4-броманилино)пиридо 4,3-пиримидин 7-амино-4-(3-трифторометиланилино)пиридо 4,3-пиримидин 7-ацетиламино-4(3-броманилино)пиридо 4,3-пиримидин 7-ацетамидо-4-бензиламинопиридо 4,3 пиримидин 4-(3-броманилино)-6-диметиламинопиридо 3,4-пиримидин. Третьим объектом изобретения является фармацевтическая композиция, обладающая ингибирующей тирозинкиназу рецептора эпидермального фактора роста активностью, которая в смеси с фармацевтически приемлемым эксипиентом, разбавителем или носителем включает бициклическое производное пиримидина вышеприведенной общей формулыили его фармацевтическую соль в эффективном количестве. Четвертым объектом изобретения является способ ингибирования тирозинкиназы рецептора эпидермального фактора роста при лечении раковых заболеваний, псориаза, панкреатита или почечных заболеваний путем введения млекопитающему бициклического производного пиримидина вышеприведенной общей формулыили его фармацевтически приемлемой соли в эффективном количестве. Данный способ может также применяться при лечении псориаза, панкреатита или почечных заболеваний. Пятым объектом изобретения является способ ингибирования тирозинкиназы рецептора эпидермального фактора роста для предотвращения имплантации бластоцита путем введения млекопитающему бициклического производного пиримидина вышеприведенной общей формулыили его фармацевтически приемлемой соли в эффективном количестве. Шестым объектом изобретения является композиция, обладающая контрацептивным действием, которая включает в смеси с контрацептивно приемлемым эксипиентом, разбавителем или носителем бициклическое производное пиримидина вышеприведенной общей формулыили его фармацевтическую соль в эффективном количестве. 9 4568 1 Бициклические производные пиримидина вышеприведенной общей формулыможно получать известными способами, например представленными на следующих схемах -, в которыхозначает замещенный фенил или тиенил. Схема 2 Замещение 2-хлора в 2,6-дихлор-3-нитропиперидине проводят с помощью цианида одновалентной меди в-метил-2-пирролидоне (П). Замещение второго хлора в этом нитриле на фторид на этой стадии может быть предпочтительным. Затем проводят мягкое восстановление нитрогруппы в условиях, когда галоген не гидролизуется. Гидролиз нитрила с последующей кристаллизацией орто-формита и хлорирование по типу Вильсмейера приводят к дигалогенпиридопиримидину. Замещение более реактивного 4-хлора на соответствующий амин проводят после замещения 6-галогена на соответствующий нуклеофил для образования конечных продуктов. Данным способом можно получать также соединения, у которых один из 1 или 2 означает водород, а другой является низшим алкоксилом или один из 1 или 2 является водородом, а другой - аминогруппой или один из 1 или 2 означает водород, а другой является низшей моно- или диалкиламиногруппой или один из 1 или 2 означает водород, а другой - низший алкил. Схема 2 Замещение хлора в 2-хлор-3,5-динитропиридине проводят с помощью цианида меди в П. Восстановление нитрогрупп в аминогруппы проводят после гидролиза нитрила в амид. Его циклизуют в пиримидон с помощью ортоформиата, который превращают в хлорид с помощью хлорангидрида ортофосфорной кислоты, или при желании превращают в тиометильное производное путем обработки пентасульфидом фосфора,потом метилйодидом и мягким основанием. Замещение соответствующим амином дает целевое 7 аминосоединение. Аминная функция может быть восстановительно алкилирована или активирована диазотированием аминогруппы в кислых или щелочных условиях, затем восстановлена в гидразид или превращена в низший алкил, простой эфир или в галоген при действии купрата или сочетанием Стилла по методикам, известным специалистам в данной области. Альтернативно амин может быть восстановительно аминирован с образованием алкиламинной боковой цепи. Данным способом можно также получать соединения, упомянутые выше в связи с описанием схемы . Схема 2 4568 1 Обработка ЛДА (диизопропиламид лития) с последующей обработкой боратом/пероксидом водорода позволяет ввести 3-гидрокси-заместитель. Если пиридин подвергают 2-му металлированию в положении 4, спирт может быть защищен как ТИПС (триизопропилсилиловый) простой эфир, который будет вызывать второе металлирование в положении 5. Могут быть использованы альтернативные нитрования, такие как превращение литиевого промежуточного производного в станнан и обработка тетранитрометаном, или использование 24 (нитронийтетрафторборат). 1 - замещение может быть проведено с использованием цианида одновалентной меди или других источников ионов цианида. После гидролиза нитрила и восстановления нитрогруппы может быть использован ортоформиат вместо формамида для циклизации, и, возможно, что некоторые циклизации будут требовать замещениянаперед реакцией. Положение 4 активируют хлорированием,а затем вводят амин с боковой цепью. Окончательное замещение может быть выполнено с помощью алкоксидных или аминных нуклеофилов. Данным способом можно также получать соединения, у которых 1 и 2 являются низшими алкоксилами один из 1 или 2 означает аминогруппу, а другой является низшим алкоксилом или один из 1 или 2 означает моно- или диалкиламиногруппу, а другой - низший алкоксил. Схема 1 Применение 6-алкилхинальдиновой кислоты после ионного бромирования в жестких условиях дает ангидрид, который раскрывают аммиаком, рециклизуют в имид и затем проводят разложение по Гофману с потерей активного карбонила. Циклизацию и присоединение циклической боковой цепи обычным образом проводят путем сочетания по Стиллу для введения алкильной группы, радикала 1 и/или 2. Схема 1. 3 24 Динитрование 2,6-диоксипиридина проводят для превращения в очень реактивное дихлорсоединение. Динитродихлорпиридин просто замещают цианидом одновалентной меди в П, а затем соединение восстанавливают в мягких условиях в диамин. Нитрил гидролизуют до амида, который затем циклизуют в пиридопиримидон, который хлорируют обычным путем. Замещение более реактивного хлора в 4-боковой цепи проводят после замещения 6-хлора алкоксидом. Для получения соединений, у которых 1 или 2 означает моно- или диалкил-амино, а другой - низший алкоксил, амин должен быть соответственно алкилирован по методикам, известным специалистам в данной области. Схема 2 2,4-диамино-5-цианопиридин может быть циклизован непосредственно во многие производные 4 бензиламинопиридопиримидина при обработке бензиламином и муравьиной кислотой при высокой температуре. Для менее нуклеофильных аминов 2,4-диамино-5-цианопиридин превращают путем обработки этилор 11 4568 1 тоформиатом/уксусным ангидридом, последующей циклизацией с помощью гидросульфид-иона в безводных условиях с получением 7-амино-4-тионо-3 Н-пиридо 4,3-пиримидина. -алкилирование и замещение соответствующим амином дают целевой продукт. Если 2 не является аминогруппой, амин может быть ацилирован или восстановительно алкилирован. Альтернативно 2,4-диамино-5-цианопиридин может быть гидролизован в соответствующий амид и эта группа может быть циклизована в 7-амино-4-оксо-3 Нпиридо 4,3-пиримидин с помощью ортоформиата. Диазотирование 7-аминогруппы и замещение фтором позволяют ввести другие аминные и алкоксидные нуклеофилы в конце синтеза, после того, как С 4 заместитель был введен обычным образом. Диазотирование и замена аминогруппы бромом позволяют провести сочетания Стилла в положении 7. Данным способом можно получать соединения, у которых 2 означает низший алкил, низший алкоксил,аминогруппу или низшую моно- или диалкиламиногруппу. Схема 2 1. 2-хлор-5-нитропиридин превращают в соответствующее 2-фторсоединение с помощью фторида калия в диметилсульфоксиде. Восстановление нитрогруппы с последующей обработкой Вос-ангидридом (Вотрет.бутоксикарбонил) дает Вос-аминопроизводное, которое металлируют и карбоксилируют в 4-положении. Удаление Вос-группы с помощью трифторуксусной кислоты и циклизация пиримидонового цикла формамидом дают 6-фтор-4-оксо-3 Н-пиридо 3,4-пиримидин. Его хлорируют в положении 4 обычным образом и вводят 4 боковую цепь через замещение соответствующим амином. Замещение 6-фтора соответствующими нуклеофилами приводит к различным конечным продуктам. Если фтор замещают на тиометоксид, то он, в свою очередь, может быть замещен алкильными группами в катализируемых никелем замещениях Гриньяра. Данным способом можно получать соединения, у которых 1 означает низший алкил или алкоксил, аминогруппу или низшую моно- или диалкиламиногруппу. Схема Нитрование 2-метоксиникотиновой кислоты с последующим замещением активированной метоксигруппы и циклизацией пиримидонового цикла можно проводить в одну стадию с помощью формамидина, или альтернативно в две стадии с помощью аммиака с последующей циклизацией с помощью эквивалента формамида. Карбонил превращают в хлорид и замещают боковой цепью обычным способом, а затем селективно восстанавливают нитрогруппу в аминогруппу. Она может быть алкилирована, ацилирована или диазотирована. Диазосоединение может быть превращено в гидроксильное или, в бромидное или иодидное соединения, и эти последние могут быть введены в реакцию сочетания Стилла для введения низшего алкила, алкоксила, аминогруппы, моно- или диалкиламиногруппы радикала 1. Этот путь использует известное металлирование и карбоксилирование 2,6-дифторпиридина с последующим замещением 2-фтор-заместителя. Циклизация пиримидонового кольца с помощью формамида, последующее превращение карбонила в хлорид обычным способом дает хлорфторпиридопиримидин. Арил(алкил)аминная боковая цепь вводится путем замещения более реактивного пиримидинового хлора, затем вводят заместитель 2 путем фторидного замещения. Для введения алкила используют замещение фтора алкоксидом, последний простой эфир расщепляют до пиридона, проводят О-трифлатирование и сочетание Стилла. Данным способом получают соединения, у которых 2 означает низший алкил или алкоксил, аминогруппу, моно- или диалкиламиногруппу. Схема 1. ЛДА-78 С Эта схема основана на металлировании 2,6-дифторпиридина подобно схеме . Первое металлирование используют для введения кислорода, а второе - для введения карбоновой кислоты. Если требуется провести второе металлирование в положении 5, кислород может быть защищен как очень массивный ТИПС-простой эфир и может потребоваться более сильное основание, чем ЛДА. Аммиак вводят в положение 2 при высокой температуре и давлении, циклизуют пиридоновое кольцо, активируют в положении 4 обычным способом, а затем замещают в положении 4 боковой цепью. Замещение 7-фтор-заместителя соответствующим нуклеофилом, последующие превращения, как описано в предыдущих схемах, завершают синтез. Данным способом можно также получать соединения, у которых 1 и 2 означают низший алкоксил, или один из 1 и 2 означает аминогруппу, а другой является низшим алкоксилом, или один из 1 или 2 означает низшую моно- или диалкиламиногруппу, а другой означает низший алкоксил. Схема Нитрование коммерчески доступной дихлорникотиновой кислоты проводят путем селективного замещения более реактивного хлора в мягких условиях, а затем более жесткого замещения другого хлора в соответствующем порядке. Полученную в результате 6-алкокси-2-амино-5-нитроникотиновую кислоту циклизуют в пиримидон и превращают 4-карбонил в хлорид и замещают обычным образом на подходящий амин, получая 413 4568 1 амино-7-алкокси-6-нитропиридо 2,3-пиримидин. Восстановление нитрогруппы с последующим любым желаемым алкилированием дает целевые продукты. Схема Реакция подходящей -алкилизотиурониевой соли с метоксиметилидинмалононитрилом приводит к полностью функционализированному пиримидиновому предшественнику. Первоначально образовавшийся пиримидин может быть замещен по -этильной группе на 2 до или после гидролиза нитрила, если замещение или окисление позже оказывается проблематичным. Замещение -этильной группы также может быть достигнуто без окисления для активации серы. Циклизацию второго пиримидинового цикла проводят после активации 4-карбонила осернением и алкилированием. Даже если 7-тиогруппа не была замещена в этот момент, предпочтительно происходит введение 4-амино-боковой цепи. Данным способом можно получать соединения, у которых 2 означает низший алкоксил, низшую моно- или диалкиламиногруппу или аминогруппу. Схема 3 Н-тиено 3,2-пиримид-4-он может быть получен по стандартным методикам из коммерчески доступного этил-3-аминотиофенкарбоксилата и формамида. Превращение карбонила в хлорид по стандартным методикам с последующим замещением подходящим амином дает целевые тиено 3,2-пиримидины. Если 2 не является водородом, подходящий электрофил, например нитрогруппа, для заместителей, основанных на аминогруппе или диазотированных производных, или бром для конечных продуктов, получаемых сочетанием Стилла, может быть введен на показанной или более ранней стадии, а затем превращен в 2 путем восстановления или аминирования, например, или с помощью сочетания Стилла, или другими известными специалистам в данной области способами. Данным способом можно также получать соединения, у которых А и В означают углерод,и , взятые вместе, означают атом серы, 1 или 2 означают водород, низший алкил, низший алкоксил, амино или низшую моно- или диалкиламиногруппу. Схема Тиено 2,3-пиримид-4-он получают путем синтеза Гриньяра из 2,5-дитиана и этилцианоацетата с последующей циклизацией с формамидом. Превращение карбонила в хлорид по стандартным методикам с последующим замещением подходящим амином дает целевые тиено 2,3-пиримидины. Для получения пирроло 2,3-пиримидина циклизуют пиримидиновый цикл в цианоаминопиррол известными способами. Активация и замещение тиола боковой цепью могут быть проведены до или после возможного электрофильного замещения пиррольного цикла. Данным способом можно также получать соединения, у которых А и В, взятые вместе, означают атом азота,иозначают углерод, 1 или 2 означают водород, низший алкил, низший алкоксил, аминогруппу или низшую моно- или диалкиламиногруппу. Схема Получение пирроло 3,2-пиримидина проводится с помощью известной конденсации ортоформиата с подкисленной 4-метильной группой 6-пиримидонов с образованием пирролопиримидина, как показано выше. Боковая цепь может быть введена по стандартным методикам, таким, как в схеме , и заместитель 2 может быть введен по стандартной методике в химии электрофильного замещения, как описано выше. Схема Эти соединения могут быть получены при непосредственном замещении галогена в соответствующих 6 хлорпуринах по хорошо известным из уровня техники методикам. Заместитель 1 может быть введен путем легкого электрофильного замещения в активированном положении 8 пуринового цикла с последующими типами превращений, описанных в нижеприведенных примерах. Данным способом можно также получать соединения, у которых А и В, взятые вместе, означают атом азота,означает углерод,означает азот, 1, 3 и/или 4 означают водород или низший алкил,2 означает водород, низший алкил, низший алкоксил, аминогруппу или низшую моно- или диалкиламиногруппу. Схема Реакция 6-хлор-4-метилтиопиримидина с ЛДА и потом с диметилформамидом дает соответствующий 5 альдегид, который обрабатывают гидразином, чтобы замкнуть цикл, получая 4-метилтиопиразоло 3,4 пиримидин, при замещении которого соответствующим амином получают целевые производные пиразоло 3,4-пиримидина. Данным способом можно получать соединения, у которых 1/4 означают водород,низший алкил, если находятся на азоте, или , низший алкил, низший алкоксил, амино- или низшую моноили диалкиламиногруппу, если находятся на углероде. Схема 4568 1 Нитрование пиразол-3-карбоновой кислоты с последующим восстановлением приводит к 4 аминопиразол-3-карбоновой кислоте. Ее циклизуют в пиразоло 3,4-пиримид-4-он с помощью соляно-кислого формамидина и проводят замещение карбонила на галоид по стандартным методикам, затем замещают хлор на соответствующий амин, получая целевой пиразоло 4,3-пиримидин. Получение бициклических производных пиримидина вышеприведенной общей формулыпоясняется следующими примерами. Пример 1 4-Анилинопиридо 3,2-пиримидин-мезилат 3 Н-Пиридо 3,2-пиримидин-4-он Раствор 2,00 г (9,91 ммоля) 6-хлор-3-нитропиколинамида в 100 мл смеси этилацетата с метанолом (11) гидрируют на 0,40 г 5 -го палладия-на-угле при 60 фунт/дюйм 2 ( 4,219 кг/см 2) в течение 6 дней с добавлением свежего катализатора через 2 и 4 дня. После удаления катализатора фильтрованием раствор концентрируют досуха, получают 3-аминопиколинамид в виде оранжевого масла, которое используют непосредственно на следующей стадии. Сырой продукт перемешивают при кипячении с обратным холодильником в 50 мл триэтилортоформиата в течение 42 часов в течение этого времени образуется каштановый осадок. После охлаждения твердый продукт отфильтровывают, тщательно промывают петролейным эфиром и сушат в вакууме, получают 1,27 г (87 ) 3 Н-пиридо 3,2-пиримидин-4-она т.пл. 343-345 . 4-Хлорпиридо 3,2-пиримидин Суспензию 1,00 г (6,80 ммоля) указанного выше пиримидона в 30 мл хлорокиси фосфора кипятят с обратным холодильником в течение 4 часов, затем концентрируют досуха при пониженном давлении. Остаток распределяют между дихлорметаном и насыщенным раствором бикарбоната натрия, отделяют и обрабатывают органический слой, получают 0,97 г (86 ) 4-хлорпиридо 3,2-пиримидина в виде каштанового твердого продукта, т.пл. 335(разложение), который используют без дополнительной характеристики. 4-Анилинопиридо 3,2-пиримидин-мезилат Раствор 84 мг 4-хлорпиридо 3,2-пиримидина (0,5 ммоля), 56 мг (0,6 ммоля) анилина и 62 мг триэтиламина (0,6 ммоля) в 2 мл этанола кипятят с обратным холодильником в атмосфере азота в течение 2 часов. Сырую реакционную смесь очищают препаративной(тонкослойная хроматография) на пластинах с диоксидом кремния, элюируют один раз 3 метанола в хлороформе. Экстрагируют основную полосу и выпаривают досуха при пониженном давлении, твердый остаток растворяют в 5 мл ацетона, фильтруют и медленно при перемешивании прибавляют 32 мкл (0,5 ммоля) метансульфоновой кислоты. Остаток собирают фильтрованием, промывают ацетоном и сушат в вакуумной печи получают 91 мг (57 ) 4 анилинопиридо 3,2-пиримидин-мезилата в виде матовых желтых игл. 1 Н-ЯМР (диметилсульфоксид)11,75 (1 Н, с.шир) 9,11 (1 Н, дд,1,5 4,3 Гц) 8,97 (1 Н, с) 8,32 (1 Н, дд,1,5 8,4 Гц) 8,12 (1 Н, дд,4,3 8,5 Гц) 7,88 (2 Н, д,8,2 Гц) 7,49 (2, т,8,0 Гц) 7,32 (1, т,7,0 Гц) 2,34 (3 Н, с). Пример 2 4-Бензиламинопиридо 3,2-пиримидин Раствор 0,10 г (0,60 ммоля) свежеприготовленного 4-хлорпиридо 3,2-пиримидина (полученного, как описано в предыдущем эксперименте) и 0,13 мл (1,20 ммоля) бензиламина в 15 мл пропан-2-ола, содержащий следы концентрированной соляной кислоты, нагревают в течение 30 минут при 50 , затем концентрируют досуха. Остаток распределяют между водой и этилацетатом, органический слой отделяют и обрабатывают,хроматографируют на силикагеле. Этилацетат элюирует головную фракцию, тогда как смесь метанола с этилацетатом (19) элюирует 4-(бензиламино)пиридо 3,2-пиримидин (0,11 г, 77 ) 1 Н-ЯМР (дейтер. хлороформ)8,67 (1, с) 6,50 (1, дд,4,3 1,5 Гц) 8,10 (1 Н, дд,8,5 1,5 Гц) 7,63 (1 Н, дд,8,8 4,3 Гц) 7,55 (1, шир.) 7,41-7,29 (5, м) 4,86 (2, д,5,9 Гц). Пример 3 4-(3-Броманилино)пиридо 3,2-пиримидин Проводят реакцию полученного, как описано в предыдущем примере, хлорпиридо 3,2-пиримидина с 3 броманилином в пропан-2-оле, содержащем следы концентрированной соляной кислоты при 50 в течение 30 минут, затем продукт хроматографируют на силикагеле и получают с выходом 874-(3 бромфенил)аминопиридо 3,2-пиримидин. 1 Н-ЯМР (дейтер. хлороформ)9,19 (1 Н, ш) 8,83 (1 Н,с) 8,80 (1 Н, дд,4,3 1,5 Гц) 8,29 (1 Н, шир.) 8,19 (1 Н, дд,8,5 1,5 Гц) 7,83 (1 Н, м) 7,76 (1 Н, дд,8,5 4,3 Гц) 7,29-7,27 (2 Н, м). 4568 1 Пример 4 4-(3-Броманилино)-6-фторпиридо 3,2-пиримидин 2-Циано-6-фтор-3-нитропиридин Смесь 10,0 г (0,054 моля) 6-хлор-2-циано-3-нитропиридина и 9,48 г (0,163 моля) фторида калия в 200 мл ацетонитрила кипятят с обратным холодильником в течение 18 часов при перемешивании, затем выливают в воду и экстрагируют этилацетатом. Экстракт промывают водой и обрабатывают, остаток хроматографируют на силикагеле, элюируют смесью этилацетата с петролейным эфиром (37), получают, после удаления растворителя при пониженном давлении, 7,2 г (79 ) 2-циано-6-фтор-3-нитропиридина. 1 Н-ЯМР (дейтер. хлороформ)8,79 (1 Н, дд,9,0 6,0 Гц) 7,48 (1, дд,9,0 3,0 Гц). 6-Фтор-3-нитропиридин-2-карбоксамид Раствор 1,40 г 2-циано-6-фтор-3-нитропиридина (8,39 ммоля) в 30 мл 90 -й серной кислоты нагревают при 70 в течение 90 мин., затем охлаждают, выливают на лед и подщелачивают концентрированным аммиаком. Экстракция этилацетатом и обработка дают 0,94 г (61 ) 6-фтор-3-нитропиримидин-2 карбоксамида. 1 Н-ЯМР (дейтер. хлороформ)8,70 (1, дд,8,9 6,5 Гц) 8,30 и 8,03 (1, 1 Н шир. с) 7,62 (1, дд,8,9 2,9 Гц). 6-Фтор-3 Н-пиридо 3,2-пиримид-4-он Раствор 1,50 г (8,10 ммоля) 6-фтор-3-нитропиридин-2-карбоксамида в этилацетате гидрируют на 5 -м палладии-на-угле (0,30 г) при 60 фунт/дюйм 2 ( 4,219 кг/см 2) в течение 2 часов. После удаления катализатора фильтрованием растворитель отгоняют при пониженном давлении, получают остаток сырого 3-амино-6 фторпиримидин-2-карбоксамида, который используют непосредственно на следующей стадии. Добавляют 60 мл триэтилортоформиата, после чего смесь нагревают и кипятят с обратным холодильником при перемешивании в течение 18 часов. Охлажденную смесь разбавляют равным объемом петролейного эфира, полученный осадок собирают фильтрованием и тщательно промывают петролейным эфиром, получают 6-фтор 3 Н-пиридо 3,2-пиримид-4-он (1,26 г, 84 ). 1 Н-ЯМР (диметилсульфоксид)12,72 (1 Н, шир. с) 8,31 (1, дд,8,6 7,7 Гц) 8,20 (1, с) 7,66 (1, дд,8,6 3,0 Гц). 4-(3-Броманилино)-6-фторпиридо 3,2-пиримидин Суспензию 0,2 г (1,21 ммоля) 6-фтор-3 Н-пиридо 3,2-пиримид-4-она в 30 мл хлорокиси фосфора кипятят с обратным холодильником при перемешивании до тех пор, пока она не станет гомогенной (2 часа), а затем еще 1 час. Удаляют избыток хлорокиси фосфора при пониженном давлении, остаток распределяют между дихлорметаном и насыщенным водным раствором дикарбоната натрия. Обработка органической части дает сырой 4-хлор-6-фторпиридо 3,2-пиримидин (100 ) в виде нестабильного твердого продукта, который используют непосредственно на следующей стадии. Раствор 0,20 г (1,1 ммоля) 4-хлор-6-фторпиридо 3,2 пиримидина и 0,12 мл (2,18 ммоля) 3-броманилина в 20 мл пропанола-2, содержащего 1 каплю конц. соляной кислоты, кипятят с обратным холодильником в течение 15 минут, затем охлаждают, выливают в воду и экстрагируют этилацетатом. Экстракт обрабатывают и хромографируют остаток на силикагеле, элюируя смесью этилацетат/петролейный эфир (12) после удаления растворителя при пониженном давлении получают 0,18 г (52 ) 4-(3-броманилино)-6-фторпиридо 3,2-пиримидина. 1 Н-ЯМР (дейтер. хлороформ)8,82 (1 Н, с) 8,65 (1, шир. с) 8,31 (1, т,7,4 Гц) 8,27 (1, шир. с) 7,77 (1, м) 7,41 (1, дд,8,9 2,2 Гц) 7,29 (2, шир.с). Пример 5 4-(3-Броманилино)-6-хлорпиридо 3,2-пиримидин 6-Хлор-3-нитропиколинамид Раствор 1,00 г (5,45 ммоля) 6-хлор-3-нитропиколинонитрила в 15 мл 90 -й серной кислоты нагревают при 70 в течение 3,5 часов, а затем выливают в ледяную воду. Смесь экстрагируют четыре раза этилацетатом, а затем объединенные экстракты обрабатывают, получая 0,80 г (73 ) 6-хлор-3-нитропиколинамида. 1 Н-ЯМР (диметилсульфоксид)8,55 (1, д,8,5 Гц) 8,31 и 8,04 (1, 1, 2 шир. с) 7,93 (1 Н, д,8,5 Гц). 6-Хлор-3-пиридо 3,2-пиримидин-4-он Раствор 0,30 г 6-хлор-3-нитро-пиколинамида (1,49 ммоля) в 30 мл этилацетата гидрируют при 60 фунт/дюйм 2 (4,219 кг/см 2) на 0,10 г 5 -го палладия-на-угле в течение 20 минут. После удаления катализатора фильтрованием раствор концентрируют досуха, получают 3-амино-6-хлорпиколинамид в виде желтого масла, которое непосредственно используют на следующей стадии. Его растворяют в 30 мл триэтилортоформиата и смесь кипятят с обратным холодильником в течение 18 часов. Добавляют 30 мл петролейного 17 4568 1 эфира к охлажденному раствору, отфильтровывают полученный в результате осадок сырого 6-хлор-3 пиридо 3,2-пиримидин-4-она (0,27 г, 99 ) и сушат в вакуумной печи. 4-(3-Броманилино)-6-хлорпиридо 3,2-пиримидин Суспензию вышеуказанного хиназолона (0,20 г 1,10 ммоля) в 30 мл хлорокиси фосфора кипятят с обратным холодильником в течение 3 часов, затем концентрируют досуха при пониженном давлении. Остаток распределяют между дихлорметаном и насыщенным раствором бикарбоната натрия, обрабатывают органическую часть, получают 0,16 г (73 ) 4,6-дихлорпиридо 3,2-пиримидина в виде каштанового твердого продукта, который используют непосредственно на следующей стадии. Раствор 0,16 г (0,80 ммоля) сырого дихлорпиридопиримидина и 0,17 мл (1,60 ммоля) 3-броманилина в 25 мл пропанола-2, содержащего следы конц. соляной кислоты, нагревают при 50 в течение 30 минут. Охлажденную смесь выливают в насыщеный раствор бикарбоната натрия и экстрагируют этилацетатом, экстракт обрабатывают и хроматографируют на силикагеле. Элюирование смесью этилацетата с петролейным эфиром (14) дает 3-бромалин, тогда как смесь этилацетат/петролейный эфир (11) элюирует 0,17 г (63 ) 4-(3-броманилино)-6-хлорпиридо 3,2 пиримидина. 1 Н-ЯМР (дейтер. хлороформ)8,90 (1 Н, шир. с) 8,84 (1 Н, с) 8,30 (1 Н, дд,2,1 2,20 Гц) 8,17 (1, д,8,8 Гц) 7,82-7,78 (1 Н, м) 7,73 (1, д,8,8 Гц) 7,32-7,29 (2 Н, м). Пример 6 4-(3-Броманилино)-6-аминопиридо 3,2-пиримидин Реакция 0,12 г (0,38 ммоля) 4-(3-броманилино)-6-фторпиридо 3,2-пиримидина (описанного в предыдущем эксперименте) с насыщенным раствором аммиака в этаноле в сосуде под давлением при 100 в течение 18 часов дает 87 мг (72 ) 6-амино-4-3-броманилинопиридо 3,2-пиримидина. 1 Н-ЯМР (дейтер. хлороформ)8,76 (1, шир. с) 8,64 (1, с) 8,23 (1, шир. с) 7,93 (1, д,9,0 Гц) 7,81 (1, дт,7,7 Гц,1,8 Гц) 7,28-7,22 (2, м) 7,00 (1, д,9,0 Гц) 4,90 (2 Н, шир. с). Пример 7 4-(3-Броманилино)-6-метиламинопиридо 3,2-пиримидин Реакция 50 мг (0,16 ммоля) 4-(3-броманилино)-6-фторпиридо 3,2-пиримидина (описанного в предыдущем эксперименте) с 32 мг (0,47 ммоля) солянокислого метиламина и 70 мкл (0,55 ммоля) триэтиламина в 10 мл этанола в сосуде под давлением при 100 в течение 18 часов приводит к 43 мг (81 ) 6-метиламино 4-(3-броманилино)пиридо 3,2-пиримидина. 1 Н-ЯМР (дейтер. хлороформ)8,81 (1 Н, шир. с) 8,61 (1 Н, с) 8,19 (1, т,1,8 Гц) 7,86 (1, д,9,1 Гц) 7,83 (1, дт,7,7 Гц,1,8 Гц) 7,28-7,21 (2, м) 6,92 (1, к,9,1 Гц) 4,97 (1, к,5,0 Гц) 3,13(3, к,5,0 Гц). Пример 8 4-(3-Броманилино)-6-диметиламинопиридо 3,2-пиримидин Смесь 0,15 г (0,47 ммоля) 4-(3-броманилино)-6-фторпиридо 3,2-пиримидина (описанного в предыдущем эксперименте), 0,11 г (1,41 ммоля) солянокислого диметиламина и 0,23 мл (1,64 ммоля) триэтиламина в 15 мл этанола нагревают в сосуде под давлением при 100 в течение 18 часов. Растворитель отгоняют при пониженном давлении и распределяют остаток между этилацетатом и водой. Обрабатывают органическую часть и остаток хроматографируют на силикагеле. Элюирование этилацетатом/петролейным эфиром(11) дает головную фракцию, тогда как этилацетат элюирует 0,14 г (86 ) 4-(3-броманилино)-6 диметиламинопиридо 3,2-пиримидина. 1 Н-ЯМР (дейтер. хлороформ)8,72 (1 Н,шир. с) 8,56 (1 Н, с) 8,17(1, т,1,9 Гц) 7,85 (1, д,9,3 Гц) 7,77 (1, дт,7,5 Гц,1,9 Гц) 7,27-7,18 (2, м) 7,08 (1, д,9,3 Гц) 3,21 (6 Н, с). Пример 9 4-(3-Броманилино)-6-метоксипиридо 3,2-пиримидин Прибавляют 0,11 г (0,34 ммоля) 4-(3-броманилино)-6-фторпиридо 3,2-пиримидина (описанного в предыдущем эксперименте) к раствору метоксида натрия (приготовленному при добавлении металлического натрия (31 мг, 1,38 ммоля) к 15 мл безводного метанола). После нагревания в сосуде под давлением при 90 в течение 3 часов раствор концентрируют досуха и остаток распределяют между этилацетатом и водой. Обработка органической части приводит к 92 мг (82 ) 4-(3-бромфенил)-амино-6-метоксипиридо 3,2 пиримидина. 1 Н-ЯМР (дейтер. хлороформ)8,73 (1 Н, с) 8,66 (1, шир. с) 8,18 (1, м) 8,05 (1, д,8,9 Гц) 7,837,80 (1, м) 7,30-7,24 (2, м) 7,23 (1, д,8,9 Гц) 4,12 (3, с). 4568 1 Пример 10 4-Анилинопиридо 4,3-пиримидин-4 трет.-бутоксикарбониламино)пиридин К смеси 2 г (21,24 ммоля) 4-аминопиридина, 3,57 г (63,72 ммоля) гидроксида калия, 10 мл воды и 4 мл 2 метил-2-пропанола на льду прибавляют 6,95 г (31,87 ммоля) ди-трет.бутил-дикарбоната. Полученный в результате двухфазный раствор перемешивают при 25 в течение 1 недели, затем прибавляют 20 мл воды. Раствор экстрагируют 1 раз метиленхлоридом и 2 раза этилацетатом. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении получают 4,08 г (99 ) 4-(-трет.бутоксикарбониламино)пиридина. 1 Н-ЯМР (диметилсульфоксид)9,84 (1, с) 8,35 (2, д,6 Гц) 7,44 (2, д,7 Гц) 1,49 (9, ). 4-(-трет.-бутоксикарбониламино)никотиновая кислота Медленно прибавляют 24 мл (2,1852,51 ммоля) н-бутиллития к раствору 4,08 г (21 ммоля) 4-(-трет.бутоксикарбониламино)пиридина в 50 мл тетрагидрофурана при перемешивании в атмосфере азота при 78 . Раствору дают нагреться до 0 , перемешивают 3 часа, затем охлаждают снова до -78 и выливают в 100 мл эфира, содержащего сухой лед. Раствор нагревают до комнатной температуры при постоянном перемешивании. Прибавляют воду и нейтрализуют смесь уксусной кислотой. Полученный твердый продукт собирают вакуумным фильтрованием и сушат в вакуумной печи получают 2,72 г (54 ) 4 трет.бутоксикарбониламиноникотиновой кислоты в виде коричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)11,75 (1, шир. с) 8,95 (1, с) 8,50 (1, д,6,0 Гц) 8,20 (1, д,6,0 Гц) 1,49 (9, с). 4-Аминоникотиновая кислота Смесь 2,72 г (11,4 ммоля) 4-(-трет.-бутоксикарбониламино)никотиновой кислоты, 10 мл трифторуксусной кислоты и 20 мл метиленхлорида перемешивают при комнатной температуре в течение 12 часов. Отгоняют летучие компоненты при пониженном давлении и полученную в результате сырую 4-аминоникотиновую кислоту используют непосредственно в следующей реакции. 3-Пиридо 4,3-пиримидин-4-он Нагревают 2,72 г (11,4 ммоля) сырой аминоникотиновой кислоты в 20 мл формамида при 170 в течение 12 часов. Отгоняют летучие компоненты при пониженном давлении (0,8 мм рт.ст.). Твердый остаток затем очищают при среднем давлении на колонке с силикагелем, элюируя смесью 10 метанола в хлороформе получают 780 мг (47 ) 3-пиридо 4,3-пиримидин-4-она в виде беловато-желтого твердого вещества. 1 Н-ЯМР (диметилсульфоксид)12,64 (1, шир. с) 9,28 (1, с) 8,83 (1, д,5,5 Гц) 8,30 (1 Н, с) 7,58(1 Н, д,5,8 Гц). 3-Пиридо 4,3-пиримидин-4-тион Прибавляют 2,59 г (5,83 ммоля) пятисернистого фосфора к 780 мг (5,3 ммоля) 3-пиридо 4,3 пиримидин-4-она в 5 мл пиридина. Смесь кипятят с обратным холодильником в течение 5 часов. При охлаждении образуется осадок и надосадочный слой сливают. Твердый продукт суспендируют в 20 мл воды, а затем фильтруют получают 676 мг (78 ) 3-пиридо 4,3-пиримидин-4-тиона в виде черного твердого продукта. 1 Н-ЯМР (диметилсульфоксид)14,53 (1, шир. с) 9,65 (1 Н, с) 8,84 (1, д,7,0 Гц) 8,32 (1 Н, с) 7,64(1, д,8,0 Гц). 4-Метилтиопиридо 4,3-пиримидин Перемешивают 12 часов при 25 в атмосфере азота смесь 676 мг (4,14 ммоля) 3-пиридо 4,3 пиримидин-4-тиона, 1,4 мл (10,31 ммоля) триэтиламина, 4 мл диметилсульфоксида и 0,48 мл (7,72 ммоля) иодметана. Смесь выливают в воду и экстрагируют этилацетатом. Органические экстракты сушат над сульфатом магния, отгоняют растворитель при пониженном давлении, получают 1,15 г (выход количественный) 4-метилтиопиридо 4,3-пиримидина в виде коричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,52 (1, с) 9,16 (1, с) 8,95 (1 Н, д,6 Гц) 7,86 (1 Н, д,8 Гц) 2,75(1 Н, с). 4-Анилинопиридо 4,3-пиримидин Смесь 174 мг (0,97 ммоля) 4-метилтиопиридо 4,3-пиримидина и 186,2 мг (1,99 ммоля) анилина в 2 мл этанола кипятят с обратным холодильником в течение 12 часов. При охлаждении до 0 образуется твердый продукт, который отфильтровывают получают 34,5 мг (16 ) 4-анилинопиридо 4,3-пиримидина.(2 Н, д,7,5 Гц) 7,66 (1, д,5,5 Гц) 7,45 (2, т,8,0 Гц) 7,23 (1 Н, т,7,3 Гц). Пример 11 4-(3-Броманилино)пиридо 4,3-пиримидин Смесь 171 мг (0,96 ммоля) 4-метилтиопиридо 4,3-пиримидина (см. предыдущий эксперимент) и 1 мл 3 броманилина нагревают при 100 в течение 2 часов. При охлаждении осаждается твердый продукт, его собирают вакуумной фильтрацией, затем перекристаллизовывают из этанола, получая 30 мг (10 ) 4-(3 броманилино)пиридо 4,3-пиримидина. 1 Н-ЯМР (диметилсульфоксид)10,33 (1 Н, с) 9,86 (1, с) 8,84 (1 Н, д,5,8 Гц) 8,79 (1, с) 8,22 (1 Н, с) 7,89 (1, д,7,2 Гц) 7,69 (1 Н, д,5,8 Гц) 7,40 (2, дт,8,0,1,5 Гц). Пример 12 4-(3-Броманилино)-7-фторпиридо 4,3-пиримидин 3-Циано-4,6-диаминопиридин Гидрируют 15,1 г (0,071 моля) сырого 2-бром-3-циано-4,6-диаминопиридина (см. также следующий эксперимент) в 200 мл смеси тетрагидрофуран/метанол (21), содержащей 7,0 г (0,071 моля) ацетата калия и 4 г 5 -го палладия-на-угле при 55 фунт/дюйм 2 ( 3,867 кг/см 2) при 20 в течение 7 дней. После фильтрации через целит, промывки смесью тетрагидрофуран/метанол и удаления растворителей получают твердый продукт, который растворяют в разбавленной соляной кислоте и воде. Устанавливаютраствора 10 с помощью концентрированного раствора гидроксида натрия и охлаждают получают 6,58 г (69 ) 3-циано-4,6 диаминопиридина в виде твердого желтого продукта, т.пл. 197-198 С. При экстракции маточной жидкости 4 раза по 200 мл этилацетата получают дополнительно 2,12 г (22 ) продукта. 1 Н-ЯМР (диметилсульфоксид)7,91 (1, с) 6,26 и 6,24 (2, 2, шир. с) 5,63 (1 Н, с). 4,6-Диамино-3-пиридилкарбоксамид Прибавляют 4,30 г (0,032 моля) 3-циано-4,6-диаминопиридина к 25 мл 90 -й серной кислоты, затем перемешивают при 60-70 в течение 3 часов. Полученный раствор прибавляют к холодному концентрированному (40 ) раствору гидроксида натрия, получают смесь 4,6-диамино-3-пиридилкарбоксамида и неорганических солей. Аналитически чистый образец получают путем хроматографии на оксиде алюминия(10-50 метанола в хлороформе) получают светло-желтый твердый продукт. 1 Н-ЯМР (диметилсульфоксид)8,15 (1, с) 6,91 (2, шир. с) 7,7-6,3 (2 Н, шир. м) 5,78 (2, шир. с) 5,56 (1, с). 7-Амино-4-оксо-3-пиридо 4,3-пиримидин Нагревают 9,2 г сырого 4,6-диамино-3-пиридилкарбоксамида в очищенном триэтоксиметане (60 мл перегнан над натрием) при 170 в течение 1,5 дней. После удаления растворителя остаток растворяют в горячем 2 М растворе гидроксида натрия, фильтруют, нейтрализуют конц. соляной кислотой и охлаждают получают 3,57 г (69 в расчете на нитрил) 7-амино-4-оксо-3-пиридо 4,3-пиримидина в виде светлокоричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)11,79 (1, шир. с) 8,74 (1, с) 7,79 (1, с) 6,67 (2 Н, шир. с) 6,38 (1 Н,с). 7-Фтор-4-оксо-3-пиридо 4,3-пиримидин Раствор 1,00 г (6,17 ммоля) 7-амино-4-оксо-3-пиридо 4,3-пиримидина в 25 мл 60 -й тетрафтороборной кислоты при 0 обрабатывают 0,85 г (12,3 ммоля) твердого нитрита натрия, добавляемого порциями в течение 2-х часов, затем перемешивают при 0 еще 1 час и при 20 в течение 30 минут. Полученную смесь охлаждают на льду, нейтрализуют насыщенным водным раствором карбоната натрия и экстрагируют 4 раза по 100 мл этилацетата. Экстракт промывают водой, затем фильтруют через силикагель (этилацетат) получают 0,48 г (47 ) 7-фтор-4-оксо-3-пиридо 4,3-пиримидина в виде твердого крема. 1 Н-ЯМР (диметилсульфоксид)12,69 (1 Н, шир. с) 9,01 (1 Н, с) 8,31 (1 Н, с) 7,34 (1 Н, с). 4-(3-Броманилино)-7-фторпиридо 4,3-пиримидин Суспензию 0,23 г (1,39 ммоля) 7-фтор-4-оксо-3-пиридо 4,3-пиримидина в 10 мл хлорокиси фосфора перемешивают при кипячении с обратным холодильником в течение 3,5 часов, затем концентрируют в вакууме. Полученное масло охлаждают на льду, разбавляют 100 мл метиленхлорида, 40 мл насыщенного водного раствора карбоната натрия и льдом, перемешивают 2 часа при 20 . Отделяют метиленхлоридный экстракт и водную часть дополнительно экстрагируют 2 раза по 100 мл метиленхлорида, затем сушат объе 20 4568 1 диненные экстракты над сульфатом натрия и фильтруют, получают сырой 4-хлор-7-фторпиридо 4,3 пиримидин. Прибавляют 1,26 г 3-броманилина (7,35 ммоля), 20 мг солянокислого 3-броманилина и 5 мл безводного изопропанола, затем полученный раствор концентрируют в вакууме, чтобы удалить метиленхлорид, и перемешивают 1 час при 20 . При добавлении разбавленного раствора бикарбоната натрия и воды продукт кристаллизуется. После фильтрации, промывки водой и метиленхлоридом получают 297 мг чистого 4-(3-броманилино)-7-фторпиридо 4,3-пиримидина (67 ) в виде твердого крема. 1 Н-ЯМР (диметилсульфоксид)10,38 (1 Н, шир. с) 9,59 (1 Н, с) 8,72 (1 Н, с) 8,17 (1 Н, с) 7,85 (1 Н, м) 7,38 (3, м). Пример 13 7-Амино-4-анилинопиридо 4,3-пиримидин 4,6-Диамино-2-бром-3-цианопиридин Барботируют 2 часа бромистый водород в смесь 16,3 г малононитрила (0,247 моля) и 400 мл толуола при 0 . Осаждается светло-коричневый продукт. Затем реакционную смесь нагревают 2 часа при 100 , причем наблюдается интенсивное выделение газа. После охлаждения до комнатной температуры желтый твердый продукт отделяют фильтрованием, промывают толуолом и сушат на воздухе. Смешивают 25,96 г твердого продукта с 500 мл воды, устанавливаютсуспензии 9-10 добавлением 15 мл концентрированного аммиака. После перемешивания при комнатной температуре в течение 1 часа смесь фильтруют. При перекристаллизации из этанола получают твердый желтый продукт. После сушки при 60 в вакуумной печи получают 12,95 г (49 ) 4,6-диамино-2-бром-3-цианопиридина. 1 Н-ЯМР (диметилсульфоксид)6,67 (2 Н, шир. с) 5,59 (1 Н, с). 2,4-Диамино-5-цианопиридиний-ацетат Гидрируют 12,77 г (60 ммолей) 4,6-диамино-2-бром-3-цианопиридина в 240 мл смеси тетрагидрофуран/метанол (21), содержащей 5,9 г (60 ммолей) ацетата калия и 0,5 г 20 -ного палладия-на-угле, при давлении 18 фунтов/дюйм 2 (1,266 кг/см 2) при 25 в течение 4 часов. Смесь фильтруют через целит и отгоняют растворитель при пониженном давлении получают 11,15 г твердого продукта, который перемешивают со 100 мл тетрагидрофурана при комнатной температуре в течение 20 минут. Смесь снова фильтруют и фильтрат выпаривают досуха, получая целевой продукт. После сушки в вакуумной печи собирают 10,65 г(92 ) 2,4-диамино-5-цианопиридиний-ацетата в виде желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)7,90 (1 Н, с) 6,26 (4 Н, шир. с) 5,62 (1 Н, с) 1,90 (3, с). 7-Амино-4-тионо-3-пиридо 4,3-пиримидин Смесь 0,199 г (1,0 моль) 2,4-диамино-5-цианопиридиний-ацетата, 1,95 мл триэтилортоформиата и 1,95 мл уксусного ангидрида кипятят с обратным холодильником в атмосфере азота при перемешивании в течение 3 часов. Затем отгоняют растворитель и остаток растворяют в 10 мл метанола, содержащего 0,81 г (15 ммолей) метоксида натрия. Через смесь барботируют сероводород в течение 5 минут, затем смесь кипятят с обратным холодильником в течение ночи. После отгонки растворителя остаток растворяют в горячей воде и кипятят с активированным углем. После фильтрации нейтрализуют фильтрат уксусной кислотой пока он еще горячий,чтобы вызвать образование желтого твердого продукта. После охлаждения собирают твердый продукт фильтрованием и сушат его в вакуумной печи в течение ночи. Выделяют 84 г (51 ) 7-амино-4-тионо-3 пиридо 4,3-пиримидина в виде светло-желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,82 (1 Н, с) 9,34 (1, с) (1, с) 8,37 (1, с) 7,80 (2 Н, д,7,5 Гц) 7,38 (2, т,7,5 Гц) 7,12 (1, т,7,5 Гц) 6,61 (2 Н, шир. с) 6,43 (1 Н, с). 7-Амино-4-метилтиопиридо 4,3-пиримидин Прибавляют 6 мл (43 ммоля) триэтиламина к раствору 0,77 г (4,3 ммоля) 7-амино-4-тионо-3 пиридо 4,3-пиримидина в 7 мл диметилсульфоксида при перемешивании в атмосфере азота при 25 . После перемешивания двух фаз в течение 20 минут прибавляют 0,26 мл (4,2 ммоля) метилиодида. Через 2 часа реакционную смесь выливают при перемешивании в смесь воды со льдом. Мгновенно образуется твердый продукт. После дополнительного охлаждения при 0 отфильтровывают твердый продукт и сушат его в вакуумной печи, получая 0,564 г (68 ) 7-амино-4-метилтиопиридо 4,3-пиримидина. 1 Н-ЯМР (диметилсульфоксид)8,98 (1, с) 8,71 (1 Н, с) 6,94 (2, шир. с) 6,49 (1 Н, с) 2,63 (3, с). 7-Амино-4-анилинопиридо 4,3-пиримидин Смесь 0,136 г (0,7 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 0,5 мл (5,5 ммоля) анилина в атмосфере азота кипятят с обратным холодильником при 180 в течение 2 часов. Реакционную смесь охлаждают до 25 , при этом образуется осадок. Твердый продукт отфильтровывают и перекристаллизовывают из изопропанола, сушат в вакуумной печи в течение ночи. Выделяют 84 мг (51 ) 7-амино-4 анилинопиридо 4,3-пиримидина в виде светло-желтого твердого продукта. Н-ЯМР (диметилсульфоксид)9,82 (1, с) 9,34 (1 Н, с) 8,37 (1 Н, с) 7,80 (2, д,7,5 Гц) 7,38 (2, т,7,5 Гц) 7,12 (1, т,7,5 Гц) 6,61 (2, шир. с) 6,43 (1 Н,с). Пример 14 7-Амино-4-(3-гидроксианилино)пиридо 4,3-пиримидин Смесь 299 мг (1,56 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 1,60 г (14,7 ммоля) 3 аминофенола перемешивают при 160 в течение 15 минут. Полученный в результате продукт хроматографируют на силикагеле (9 метанола/метиленхлорид), получают 108 мг (18 ) 7-амино-4-(3 гидроксианилино)пиридо 4,3-пиримидина в виде светло-оранжевого продукта. 1 Н-ЯМР (диметилсульфоксид)9,69 (1, с) 9,44 (1, шир. с) 9,33 (1, с) 8,38 (1 Н, с) 7,37 (1, т,2,1 Гц) 7,21 (1, шир. д,8,4 Гц) 7,14 (1, т,8,0 Гц) 6,59 (2, шир. с) 6,53 (1, ддд,7,9 2,2 0,8 Гц) 6,43 (1, с). Пример 15 7-Амино-4-(3-метоксианилино)пиридо 4,3-пиримидин Смесь 226 мг (1,18 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 1,00 мл (8,90 ммоля) м-анизидина перемешивают в атмосфере азота при 190 в течение 1,5 часов. Полученный продукт хроматографируют на силикагеле (5-7 этанола/этилацетат), получают 136 мг(3, с). Пример 16. 7-Амино-4-(2-метоксианилино)пиридо 4,3-пиримидин Смесь 227 мг (1,18 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 1,00 мл (8,87 ммоля) о-анизидина перемешивают в атмосфере азота при 180 в течение 2,5 часов. Полученный в результате продукт хроматографируют на силикагеле (5 этанола/этилацетат), получают 147 мг (47 ) 7-амино-4-(2 метоксианилино)пиридо 4,3-пиримидина в виде желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,44 (1, шир. с) 9,25 (1, с) 8,22 (1 Н, с) 7,54 (1 Н, дд,7,7 и 1,4 Гц) 7,24 (1 Н, ддд,8,1 7,4 1,5 Гц) 7,10 (1, дд,8,2 и 1,2 Гц) 6,98 (1, дт,1,3 Гц,7,5 Гц) 6,52 (2 Н,шир. с) 6,41 (1 Н, с) 3,79 (3, с). Пример 17 7-Амино-4-(3-аминоанилино)пиридо 4,3-пиримидин Смесь 307 мг (1,60 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 2,00 г (14,5 ммоля) 3-нитроанилина перемешивают при 200 в течение 1,5 часов и суспендируют сырой продукт в 250 мл смеси метанол/тетрагидрофуран (41), гидрируют на 2 г 5 -го палладия-на-угле при давлении 60 фунт/дюйм 2 (4,219 кг/см 2) и 20 в течение 24 часов. Раствор фильтруют через целит,тщательно промывают горячим метанолом и затем абсорбируют оксидом алюминия и хроматографируют на оксиде алюминия (4-8 этанола/хлороформ), чтобы получить 66 мг (16 ) 7-амино-4-(3 аминоанилино)пиридо 4,3-пиримидина в виде зеленого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,57 (1 Н, шир. с) 8,33 (1, с) 7,04 (1, т,2,0 Гц) 6,99 (1, т,8,0 Гц) 6,88 (1, шир. д,8,0 Гц) 6,55 (2, шир. с) 6,40 (1, с) 6,34 (1, дд,7,9 и 1,3 Гц) 5,10 (2, шир. с). Пример 18. 7-Амино-4-(4-аминоанилино)пиридо 4,3-пиримидин 7-Амино-4-(4-ацетамидоанилино)пиридо 4,3-пиримидин Смесь 138 мг (0,72 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 1,50 г (10,0 ммоля) 4 аминоацетанилида перемешивают в атмосфере азота при 200 в течение 1 часа. Полученный продукт хроматографируют на оксиде алюминия (8-10 метанол/метиленхлорид) получают 110 мг (52 ) 7-амино-4-(4 ацетамидоанилино)пиридо 4,3-пиримидина в виде светло-желтого продукта. 1 Н-ЯМР (диметилсульфоксид)9,94, 9,79 (1 Н, 1 Н, 2 шир. с) 9,31 (1 Н, с) 8,34 (1, с) 7,69 (2, д,8,9 Гц) 7,57 (2, д,8,9 Гц) 6,57 (2, шир. с) 6,43 (1, с) 2,05 (3, с). 7-Амино-4-(4-аминоанилино)пиридо 4,3-пиримидин Раствор 0,30 г (1,02 ммоля) 7-амино-4-(4-ацетамидоанилино)пиридо 4,3-пиримидина в 10 мл 2 М водного раствора гидроксида натрия и 10 мл метанола перемешивают при 100 в течение 7 часов. Полученный в 22 4568 1 результате продукт хроматографируют на оксиде алюминия (3-4 этанола/хлороформ) получают 86 мг(33 ) 7-амино-4-(4-аминоанилино)пиридо 4,3-пиримидина в виде оранжевого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,58 (1, с) 9,24 (1, с) 8,25 (1, с) 7,31 (2, д,8,6 Гц) 6,58 (2, д,8,6 Гц) 6,48 (2, шир. с) 6,39 (1, с) 5,00 (2, шир. с). Пример 19 7-Амино-4-(3-диметиламиноанилино)пиридо 4,3-пиримидин Смесь 245 мг (1,28 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 1,60 г (11,8 ммоля) ,-диметил-1,3-фенилендиамина перемешивают в атмосфере азота при 190 в течение 1 часа и хроматографируют полученный продукт (дважды) на оксиде алюминия (3 этанола/хлороформ) получают 113 мг (32 ) 7-амино-4-(3-диметиламиноанилино)пиридо 4,3-пиримидина в виде светло-желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,66 (1, шир. с) 9,33 (1, с) 8,36 (1, с) 7,22 (1 Н, шир. д,7,8 Гц) 7,16 (2, м) 6,57 (2, шир. с) 6,51 (1, ддд,8,0 2,3 1,2 Гц) 6,42(1 . с) 2,91 (6, с). Пример 20 7-Амино-4-(4-диметиламиноанилино)пиридо 4,3-пиримидин Смесь 256 мг (1,33 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 1,95 г (14,4 ммоля) ,диметил-1,4-фенилендиамина перемешивают в атмосфере азота при 190 в течение 20 минут. Полученный в результате продукт хроматографируют на оксиде алюминия (3-7 этанола/хлороформ) получают 198 мг (53 ) 7-амино-4-(4-диметиламиноанилино)пиридо 4,3-пиримидина в виде оранжевого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,67 (1, шир. с) 9,27 (1, с) 8,27 (1 Н, с) 7,51 (2 Н, д,8,9 Гц) 6,75(2, д,8,9 Гц) 6,51 (2, шир. с) 6,39 (1, с) 2,89 (6, с). Пример 21 7-Амино-4(2-нитроанилино)пиридо 4,3-пиримидин Смесь 220 мг (1,15 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 2,00 г (14,5 ммоля) 2 нитроанилина нагревают до 100 , затем в горячий раствор при перемешивании вводят избыток сухого газообразного хлористого водорода и перемешивают смесь при 160 в течение 20 минут. Полученный в результате продукт нейтрализуют избытком бикарбоната натрия, растворенного в смеси метанола с хлороформом, сушат над силикагелем и хроматографируют на силикагеле (2-4 метанола/метиленхлорид) получают 108 мг (33 ) 7-амино-4-(2-нитроанилино)пиридо 4,3-пиримидина в виде желто-коричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)10,40 (1 Н, шир. с) 8,20 (1 Н, шир. с) 8,12 (1, шир. с) 8,01 (2, шир. с) 7,75 (1, шир. с) 6,70 (2, шир. с) 6,43 (1, шир. с). Пример 22 7-Амино-4-(3-нитроанилино)пиридо 4,3-пиримидин Смесь 127 мг (0,66 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 1,70 г (12,3 ммоля) 3-нитроанилина перемешивают в атмосфере азота при 200 в течение 1,5 часов. Полученный в результате продукт хроматографируют на оксиде алюминия (5-20 этанола/хлороформ) получают 81 мг (39 ) 7-амино-4-(3-нитроанилино)пиридо 4,3-пиримидина в виде коричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)10,17 (1, шир. с) 9,37 (1, с) 8,87 (1, шир. с) 8,48 (1, с) 8,33 (1,шир. д,7,5 Гц) 7,95 (1, ддд,8,2 2,1 1,0 Гц) 7,67 (1, т,8,2 Гц) 6,70 (2, шир. с) 6,47 (1,с). Пример 23 7-Амино-4-(3-фторанилино)пиридо 4,3-пиримидин Смесь 215 мг (1,12 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 1,16 г (10,4 ммоля) 3 фторанилина перемешивают при 160 в течение 30 минут. Полученный в результате продукт хроматографируют на силикагеле (6-7 метанола/метиленхлорид), получают 185 мг (65 ) 7-амино-4-(3 фторанилино)пиридо 4,3-пиримидина в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,94 (1, шир. с) 9,36 (1, с) 8,46 (1, с) 7,91 (1, шир. д,11,9 Гц) 7,63 (1, шир. д,8,1 Гц) 7,41 (1 Н, дд,15,7 и 7,7 Гц) 6,93 (1, дт,8,5 Гц 2,4 Гц) 6,68 (2,шир. с) 6,38 (1, с). 4568 1 Пример 24 7-Амино-4-(3-хлоранилино)пиридо 4,3-пиримидин Смесь 208 мг (1,08 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 1,21 г (9,48 ммоля) 3-хлоранилина перемешивают при 150 в течение 20 минут. Полученный в результате продукт хроматографируют на оксиде алюминия(60 ) 7-амино-4-(3 хлоранилино)пиридо 4,3-пиримидина в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,92 (1 Н, шир. с) 9,35 (1, с) 8,45 (1, с) 8,08 (1, шир. с) 7,79 (1,шир. д,8,0 Гц) 7,40 (1, т,8,1 Гц) 7,16 (1, дд,7,9 Гц и 1,3 Гц) 6,68 (2, шир. с) 6,46 (1, с). Пример 25 7-Амино-4-(3,4-дихлоранилино)пиридо 4,3-пиримидин Смесь 247 мг (1,29 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 1,50 г (9,26 ммоля) 3,4 дихлоранилина перемешивают при 165 в течение 30 минут. Полученный в результате продукт хроматографируют на силикагеле (7-8 метанола/метиленхлорид) получают 252 мг (64 ) 7-амино-4-(3,4 дихлоранилино)пиридо 4,3-пиримидина в виде светло-желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,97 (1, шир. с) 9,34 (1, с) 8,47 (1, с) 8,29 (1, шир. с) 7,86 (1,шир. д,8,6 Гц) 7,62 (1, д,8,8 Гц) 6,70 (2 Н, шир. с) 6,46 (1 Н, с). Пример 26 7-Амино-4-(2-броманилино)пиридо 4,3-пиримидин Смесь 198 мг (1,03 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 1,00 мл (9,18 ммоля) 2-броманилина перемешивают в атмосфере азота при 180 в течение 2,5 часов полученный продукт хроматографируют на оксиде алюминия (1 этанола/хлороформ) получают 108 мг (33 ) 7-амино-4-(2-броманилино)пиридо 3,4-пиримидина в виде светло-желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,91 (1, шир. с) 9,27 (1, с) 8,20 (1, с) 7,73 (1, д,7,9 Гц) 7,50(1, м) 7,44 (1 Н, т,6,9 Гц) 7,25 (1, м) 6,59 (2, шир. с) 6,42 (1 , с). Пример 27 7-Амино-4-(3-броманилино)пиридо 4,3-пиримидин Смесь 167 мг (0,87 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 0,75 мл (7,8 ммоля) 3-броманилина перемешивают в атмосфере азота при 190 в течение 2,5 часов и перекристаллизовывают образовавшийся при охлаждении осадок из изопропанола. 1 Н-ЯМР (диметилсульфоксид)9,91 (1 Н, шир. с) 9,34 (1 Н, с) 8,45 (1, с) 8,19 (1 Н, с) 7,84 (1, д,8,0 Гц) 7,34 (1, т,8,0 Гц) 7,29 (1, д,8,2 Гц) 6,68 (2, шир. с) 6,45 (1, с). Пример 28 7-Амино-4-(4-броманилино)пиридо 4,3-)пиримидин Смесь 264 мг (1,36 ммоля) 7-амино-4-металтиопиридо 4,3-пиримидина и 1,00 г (5,81 ммоля) 4 броманилина перемешивают в атмосфере азота при 200 в течение 15 минут. Полученный в результате продукт хроматографируют на силикагеле (10-15 этанола/этилацетат), получают 200 мг (46 ) 7-амино-4(4-броманилино)пиридо 4,3-пиримидина в виде светло-желтого продукта. 1 Н-ЯМР (диметилсульфоксид)9,88 (1, шир. с) 9,34 (1, с) 8,40 (1, с) 7,83 (2, д,8,8 Гц) 7,55(2, д,8,8 Гц) 6,64 (2, шир. с) 6,44 (1 Н, с). Пример 29 7-Амино-4-(3-иоданилино)пиридо 4,3-пиримидин Смесь 72 мг (0,37 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 1,25 г (5,71 ммоля) 3-иоданилина перемешивают при 160 в течение 30 минут. Полученный в результате продукт хроматографируют на силикагеле (5-7 метанола/метиленхлорид) получают 83 мг (61 ) 7-амино-4-(3-иоданилино)пиридо 4,3 пиримидина в виде светло-коричневых розеток. 1 Н-ЯМР (диметилсульфоксид)9,84 (1 Н, шир. с) 9,34 (1, с) 8,44 (1 Н, с) 8,30 (1 Н, шир. с) 7,90 (1 Н,дд,7,9 и 0,8 Гц) 7,47 (1, д,7,7 Гц) 7, 18 (1, т,8,0 Гц) 6,66 (2, шир. с) 6,46 (1 Н, с). Пример 30 7-Амино-4-(2-трифторметиланилино)пиридо 4,3-пиримидин Смесь 300 мг (1,56 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина, 1,00 г (5,06 ммоля) солянокислого 2-аминобензотрифторида и 2,00 г (12,4 ммоля) 2-аминобензотрифторида перемешивают при 160 в течение 10 минут. Полученный в результате продукт нейтрализуют избытком бикарбоната натрия, 24 4568 1 растворяют в смеси метанола с хлороформом, сушат над силикагелем и хроматографируют на силикагеле (67 метанола/метиленхлорид) получают 194 мг (41 ) 7-амино-4-(2-трифторметиланилино)пиридо 4,3 пиримидина в виде твердого крема т. пл. метанол/хлороформ/петролейный эфир 126-130 разложение. 1 Н-ЯМР (диметилсульфоксид)10,60 (1, шир. с) 9,17 (1, шир. с) 8,13 (1, шир. с) 7,76 и 7,69 (1,1, м, м) 7,45 (2, м) 6,66 (2, шир. с) 6,36 (1, с). Пример 31 7-Амино-4-(3-трифторметиланилино)пиридо 4,3-пиримидин Смесь 234 мг (1,22 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 3-амино-бензотрифторида (2 мл, 16,0 ммоль) перемешивают в атмосфере азота при 190-200 в течение 2 часов, затем полученный продукт хроматографируют на силикагеле (5-10 этанола/этилацетат) и затем на оксиде алюминия (5-7 этанола/хлороформ) получают 157 мг (42 ) 7-амино-4-(3 трифторметиланилино)пиридо 4,3-пиримидина в виде твердого крема. 1 Н-ЯМР (диметилсульфоксид)10,04 (1, с) 9,37 (1, с) 8,46 (1, с) 8,31 (1, с) 8,19 (1, д,8,2 Гц) 7,62 (1 Н, т,8,0 Гц) 7,45 (1, д,7,7 Гц) 6,69 (2 Н, шир. с) 6,47 (1 Н, с). Пример 32 7-Амино-4-(4-трифторметиланилино)пиридо 4,3-пиримидин Смесь 390 мг (2,03 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина, 0,40 г (2,02 ммоля) солянокислого 4-аминобензотрифторида и 1,61 г (10,0 молей) 4-аминобензотрифторида перемешивают в течение 2 минут при 180 . Полученный продукт нейтрализуют избытком бикарбоната натрия, растворяют в смеси метанола с хлороформом, сушат над оксидом алюминия и хроматографируют на оксиде алюминия (4-7 метанола/хлороформ) получают 7-амино-4-(4-трифторметиланилино)пиридо 4,3-пиримидин (390 мг, 63 ) в виде твердого крема. Аналитически чистый материал получают при дополнительной хроматографии на силикагеле (5 метанола/метиленхлорид) получают светло-желтые иглы. 1 Н-ЯМР (диметилсульфоксид)10,09 (1, шир. с) 9,40 (1, с) 8,48 (1 Н, с) 8,13 (2, д,8,2 Гц) 7,74(2, д,8,7 Гц) 6,72 (2, шир. с) 6,40 (1, с). Пример 33 4-(3-Броманилино)-7-метиламинопиридо 4,3-пиримидин Смесь 74 мг (0,23 ммоля) 7-фтор-4-(3-броманилино)пиридо 4,3-пиримидина, 7 мл (50 ммолей) триэтиламина и 3,0 г (44 ммоля) солянокислого метиламина в 30 мл изопропанола, находящуюся в стальном автоклаве, перемешивают при 95(масляная баня) в течение 5 часов. Полученную смесь концентрируют в вакууме,подщелачивают водным раствором карбоната натрия, разбавляют водой и экстрагируют 3 раза по 100 мл этилацетата. Хроматография этого экстракта на силикагеле (3 метанола/метиленхлорид) дает 4-(3 броманилино)-7-метиламино-пиридо 4,3-пиримидин (50 мг, 65 ) в виде светло-желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,93 (1, шир. с) 9,37 (1, с) 8,47 (1, с) 8,18 (1 Н, с) 7,84 (1, д,7,8 Гц) 7,34 (1, т,7,9 Гц) 7,30 (1, шир. д,8,1) 7,19 (1, к,4,7 Гц) 6,35 (1 Н, с) 2,85 (3, д,4,8 Гц). Пример 34 4-(3-Броманилино)-7-диметиламинопиридо 4,3-пиримидин Смесь 101 мг (0,32 ммоля) 7-фтор-4-(3-броманилино)пиридо 4,3-пиримидина, 4,4 мл триэтиламина (32 ммоля) и 2,58 г (32 ммоля) солянокислого диметиламина в 30 мл изопропанола, находящуюся в стальном автоклаве, перемешивают при 100(масляная баня) в течение 4 часов. Полученный раствор концентрируют в вакууме, подщелачивают водным раствором карбоната натрия и разбавляют водой получают твердый продукт. После фильтрации и перекристаллизации из смеси метанола с хлороформом получают 102 мг (94 ) 7 диметиламино-4-(3-броманилино)пиридо 4,3-пиримидина в виде светло-желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,93 (1, шир. с) 9,42 (1, с) 8,48 (1 Н, с) 8,19 (1, с) 7,85 (1 Н, д,7,7 Гц) 7,35 (1, т,7,9 Гц) 7,30 (1, шир. д,7,8 Гц) 6,53(1 Н, с) 3,16 (6, ). Пример 35 4(3-Бромфенил)метиламино-7-метиламинопиридо 4,3-пиримидин Смесь 100 мг (0,31 ммоля) 7-фтор-4-(3-броманилино)пиридо 4,3-пиримидина, 4,4 мл (32 ммоля) триэтиламина и 2,12 г (32 ммоля) солянокислого метиламина в 30 мл изопропанола, находящуюся в стальном автоклаве,перемешивают при 100(масляная баня) в течение 5 часов. Полученную смесь концентрируют в вакууме,подщелачивают водным раствором карбоната натрия, разбавляют водой и экстрагируют 3 раза по 100 мл этилацетата. Хроматография этого экстракта на силикагеле (1-2 метанола/метиленхлорид) дает 23 мг(21 ) 4(3-бромфенил)метиламино-7-метиламинопиридо 4,3-пиримидина в виде светло-желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)8,14 (1 Н, с) 7,79 (1 Н, с) 7,30 (1, т,8,0 Гц) 7,20 (1, ддд,7,8 1,8 0,8 Гц) 7,03 (1, шир. к,4,9 Гц) 7,01 (1, т,1,9 Гц) 6,82 (1, ддд,7,8 1,8 0,9 Гц) 6,25 (1,с) 3,40 (3, с) 2,73 (3, д,4,9 Гц). Пример 36 7-Ацетиламино-4-(3-броманилино)пиридо 4,3-пиримидин Смесь 0,154 г (0,49 ммоля) 7-амино-4-(3-броманилино)пиридо 4,3-пиримидина, 0,14 мл (1,5 ммоля) уксусного ангидрида, 0,14 мл триэтиламина (1,0 ммоль) и каталитического количества 4-(,диметиламино)пиридина перемешивают в атмосфере азота при комнатной температуре в течение 18 часов. Затем реакцию прекращают добавлением воды со льдом. Собирают темный осадок фильтрованием на воронке Бюхнера и очищают препаративной(0,25 7 метанола/хлороформ). При перекристаллизации из этанола получают 13,5 мг (7,7 ) 7-ацетиламино-4-(3-броманилино)пиридо 4,3-пиримидина. 1 Н-ЯМР (диметилсульфоксид)10,92 (1, с) 10,22 (1, с) 9,64 (1, с) 8,70 (1 Н, с) 8,28 (1, с) 8,21(1, с) 7,88 (1, д,7,7 Гц) 7,41-7,34 (3, м) 2,16 (3, с). Пример 37 4-(3-Броманилино)-7-метоксипиридо 4,3-пиримидин Раствор 100 мг (0,31 ммоля) 7-фтор-4-(3-броманилино)пиридо 4,3-пиримидина в 30 мл 1 М раствора метоксида натрия в метаноле перемешивают при кипячении с обратным холодильником в течение 42 часов. Полученную смесь концентрируют при пониженном давлении, разбавляют водой и нейтрализуют разбавленной соляной кислотой получают 92 мг (89 ) 7-метокси-4-(3-броманилино)пиридо 4,3-пиримидина в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)10,22 (1, шир. с) 9,57 (1, с) 8,63 (1, с) 8,19 (1, с) 7,86 (1, шир. д,7,9 Гц) 7,39 (1, т,7,9 Гц) 7,35 (1, дд,7,9 1,5 Гц) 6,96 (1 Н, с) 4,00 (3, с). Пример 38 4-Бензиламинопиридо 4,3-пиримидин Смесь 160,4 мг (0,902 ммоля) 4-метилтиопиридо 4,3-пиримидина и 106,3 мг (0,992 ммоля) бензиламина в 2 мл этанола нагревают при 80 в течение 12 часов, затем растворитель отгоняют при пониженном давлении. Полученный в результате твердый продукт суспендируют в метиленхлориде, фильтруют и полученный в результате твердый продукт очищают препаративнойна силикагеле, элюируя 5 метанола в хлороформе. После удаления растворителя при пониженном давлении получают 36 мг (17 ) 4 бензиламинопиридо 4,3-пиримидина. 1 Н-ЯМР (диметилсульфоксид)9,60 (1, с) 9,37 (1, т,5,8 Гц) 8,72 (1, д,5,8 Гц) 8,57 (1, с) 7,54 (1, д,5,8 Гц) 7,37 (2, д,7,0 Гц) 7,33 (2, т,7,3 Гц) 7,25 (1, т,7,2 Гц) 4,81 (2, д,5,8 Гц). Пример 39 4-(-1-Фенилэтиламино)пиридо 4,3-пиримидин К смеси 85 мг (0,48 ммоля) 4-метилтиопиридо 4,3-пиримидина и 2,5 мл этанола прикапывают 0,13 мл(1,0 ммоль) -метилбензиламина. Полученную смесь кипятят с обратным холодильником при 80 в течение 20 часов. Удаляют растворитель при пониженном давлении, получают масло, которое кристаллизуют из метанола получают 41,6 мг (35 ) 4-(-1-фенилэтиламино)пиридо 4,3-пиримидина т. пл. 138-138,5 . 1 Н-ЯМР (диметилсульфоксид)9,77 (1, д,0,7 Гц) 9,00 (1, д,7,7 Гц) 8,73 (1 Н, д,5,8 Гц) 8,54 (1, с) 7,53 (1, дд,5,8 0,5 Гц) 7,45 (2, д,7,2 Гц) 7,33 (1, т,7,6 Гц) 7,23 (1 Н, тт,7,5 1,2 Гц) 5,63 (1, п,7,2 Гц) 1,61 (3, т,7,0 Гц). Пример 40 7-Амино-4-бензиламинопиридо 4,3-пиримидин Смесь 8,78 г (45 ммолей) 2,4-диамино-5-цианопиридиний-ацетата, (10,66 г, 0,204 моля) муравьиной кислоты и 45 мл (0,41 моля) бензиламина нагревают при 200 в атмосфере азота в течение 2 часов. При охлаждении она затвердевает. Прибавляют 500 мл воды и перемешивают смесь твердая смола/вода в течение 20 минут при 0 . Жидкость декантируют. Твердый продукт промывают водой, затем перекристаллизовывают из 25 мл изопропанола. После сушки в вакуумной печи в течение ночи получают 8,29 г (73 ) 7-амино 2-бензиламинопиридо 4,3-пиримидина в виде светло-желтого твердого вещества. 1 Н-ЯМР (диметилсульфоксид)9,10 (1 Н, с) 8,85 (1, т,5,8 Гц) 8,25 (1, с) 7,21-7,36 (5, м) 6,46 4568 1 Пример 41 7-Амино-4-(-1-фенилэтиламино)пиридо 4,3-пиримидин Смесь 0,072 мл (0,55 ммоля) -1-фенилэтиламина и 97 мг (0,5 ммоля) 7-амино-4-метилтиопиридо 4,3 пиримидина (описанного в предыдущем эксперименте) нагревают при 180 в атмосфере азота в течение 1,5 часов. Затем охлаждают реакционную смесь до комнатной температуры, получая осадок. Смесь прибавляют к воде и хлороформу, обрабатывают ультразвуком и фильтруют. Разделяют фазы и водную фазу экстрагируют хлороформом. Объединенные экстракты промывают водой, рассолом и сушат над сульфатом магния. Отгоняют растворитель при пониженном давлении и очищают остаток с помощью препаративной(5 метанола в хлороформе) и перекристаллизации из хлороформа получают 14,5 мг (11 ) 7-амино 4-(-1-фенилэтиламино)пиридо 4,3-пиримидина т. пл. 231,8-232,1 . 1 Н-ЯМР (диметилсульфоксид)9,23 (1 Н, с) 8,50 (1 Н, д,8,0 Гц) 8,19 (1 Н, с) 7,41 (2 Н, д,7,0 Гц) 7,31 (2 Н, т,8,0 Гц) 7,21 (1 Н, тт,7,4 и 1,2 Гц) 6,45 (2 Н, с) 6,33 (1 Н, с) 5,56 (1 Н, п,7,2 Гц) 1,55(3, д,7,0 Гц). Пример 42 7-Амино-4-(2-аминобензиламино)пиридо 4,3-пиримидин Смесь 136 мг (0,71 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 1,70 г (13,8 ммоля) в 5 мл изопропанола перемешивают при кипячении с обратным холодильником в течение 1 часа, полученный в результате продукт хроматографируют на силикагеле (7-20 этанола в этилацетате) и оксиде алюминия (6-10 этанола/хлороформ) получают 89 мг (47 ) 7-амино-4-(2 аминобензиламино)пиридо 4,3-пиримидина в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,08 (1, с) 8,68 (1 Н, т,5,8 Гц) 8,26 (1 Н, с) 7,05 (1 Н, д,7,4 Гц) 6,96 (1 Н, т,7,6 Гц) 6,63 (1 Н, д,7,9 Гц) 6,51 (1 Н, т,7,4 Гц) 6,46 (2 Н, шир. с) 6,35 (1 Н, с) 5,20(2 Н, шир. с) 4,56 (2 Н, д,5,8 Гц). Пример 43 7-Амино-4-(3-диметиламинобензиламино)пиридо 4,3-пиримидин Смесь 236 мг (1,23 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 1,36 г (9,07 ммоля) 3-диметиламинобензиламина в 5 мл изопропанола перемешивают в атмосфере азота при кипячении с обратным холодильником в течение 1 часа, полученный продукт хроматографируют на силикагеле (10-15 этанола/этилацетат), затем на оксиде алюминия (1 этанола/хлороформ) и получают 145 мг (40 ) 7-амино-4-(3-диметиламинобензиламино)пиридо 4,3-пиримидина в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,11 (1, с) 8,79 (1 Н, т,5,9 Гц) 8,26 (1 Н, с) 7,11 (1 Н, дд,8,0 7,7 Гц) 6,73 (1, шир. с) 6,63 (1, д,7,6 Гц) 6,60 (1 Н, дд,8,1 и 2,2 Гц) 6,44 (2, шир. с) 6,35 (1, с) 4,67 (2, д,5,8 Гц) 2,86 (6, с). Пример 44 7-Амино-4-(3-нитробензиламино)пиридо 4,3-пиримидин Смесь 228 мг (1,19 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем примере) и 0,81 г (5,33 ммоля) 3-нитробензиламина перемешивают в атмосфере азота при 150-160 в течение 1,5 часов полученный в результате продукт хроматографируют на силикагеле (5-10 этанола/этилацетат) получают 151 мг (43 ) 7-амино-4-(3-нитробензиламино)пиридо 4,3-пиримидина в виде желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,11 (1, с) 8,98 (1, т,5,5 Гц) 8,26 (1, с) 8,22 (1, шир. с) 8,12(2, д,5,8 Гц). Пример 45 7-Амино-4-(3-метоксибензиламино)пиридо 4,3-пиримидин Смесь 136 мг (0,71 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем примере) и 1,37 г (10,0 ммоля) 3-метоксибензиламина в 3 мл изопропанола перемешивают в атмосфере азота при кипячении с обратным холодильником в течение 3 часов. Выпаривание растворителя и хроматография на силикагеле (5-10 этанола/этилацетат) приводят к получению 153 мг (77 ) 7-амино-4-(3 метоксибензиламино)пиридо 4,3-пиримидина в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,11 (1, с) 8,83 (1, т,5,7 Гц) 8,26 (1 Н, с) 7,24 (1, дт,0,8 Гц 8,1 Гц) 6,92 (2, м) 6,81 (1, дт,8,2 Гц 1,2 Гц) 6,46 (2, шир. с) 6,37 (1, с) 4,71 (2, д,5,8 Гц) 3,73 (3, с). 4568 1 Пример 46 7-Амино-4-(4-хлорбензиламино)пиридо 4,3-пиримидин-мезилат Осаждают 56 мг (0,20 ммоля) свободного основания (полученного из 2,4-диамино-5-цианопиридинийацетата, муравьиной кислоты и 4-хлорбензиламина при 200 , как описано в предыдущем примере) из ацетонового раствора с помощью 105 мкл (0,23 ммоля) метансульфоновой кислоты получают полимезилатную соль. 1 Н-ЯМР (диметилсульфоксид)10,59 (1, т,5,6 Гц) 9,24 (1, с) 8,69 (1, с) 7,42 (4 Н, с) 6,42 (1,с) 5,8 (6, очень шир. с) 4,89 (2, д,5,8 Гц) 2,41 (7,5 Н, с). Пример 47 7-Амино-4-(2-бромбензиламино)пиридо 4.3-пиримидин Смесь 225 мг (1,17 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 0,84 г (4,52 ммоля) 2-бромбензиламина перемешивают в атмосфере азота при 140 в течение 1 часа, полученный продукт хроматографируют на силикагеле (1-5 этанола/этилацетат), получают 175 мг(45 ) 7-амино-4-(2-бромбензиламино)пиридо 4,3-пиримидина в виде светло-коричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,16 (1, с) 8,85 (1, т,5,7 Гц) 8,24 (1 Н, с) 7,64 (1, д,7,8 Гц) 7,34 (1, дд,7,7 и 7,1 Гц) 7,31 (1, дд,7,7 и 2,4 Гц) 7,21 (1, ддд,7,8 6,9 2,4 Гц) 6,50 (2, шир. с) 6,39 (1 Н, с) 4,74 (2 Н, д,5,7 Гц). Пример 48 7-Амино-4-(3-бромбензиламино)пиридо 4,3-пиримидин Смесь 228 мг (1,19 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 0,84 г (4,52 ммоля) 3-бромбензиламина перемешивают в атмосфере азота при 140 в течение 1 часа. Полученный в результате продукт хроматографируют на силикагеле (2-10 этанола/этилацетат) получают 203 мг (52 ) 7-амино-4-(3-бромфенил)метиламинопиридо 4,3-пиримидина в виде светлокоричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,09 (1, с) 8,86 (1 Н, т,5,8 Гц) 8,26 (1 Н, с) 7,54 (1, с) 7,44 (1, д,7,8 Гц) 7,36 (1, д,7,6 Гц) 7,29 (1, т,7,7 Гц) 6,48 (2, с) 6,37 (1, с) 4,73 (2, д,5,8 Гц). Пример 49. 7-Амино-4-(4-бромбензиламино)пиридо 4,3-пиримидин Смесь 234 мг (1,22 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 0,84 г (4,52 ммоля) 4-бромбензиламина перемешивают в атмосфере азота при 140 в течение 1 часа, полученный в результате продукт хроматографируют на силикагеле (10 этанола/этилацетат), получают 192 мг (48 ) 7-амино-4-(4-бромбензиламино)пиридо 4,3-пиримидина в виде твердого крема. 1 Н-ЯМР (диметилсульфоксид)9,09 (1, с) 8,87 (1, т,5,7 Гц) 8,25 (1, с) 7,51 (2, д,8,3 Гц) 7,31 (2, д,8,3 Гц) 6,46 (2, шир. с) 6,37 (1 Н, с) 4,70 (2, д,5,8 Гц). Пример 50 7-Амино-4-(2-трифторметилбензиламино)пиридо 4,3-пиримидин Смесь 225 мг (1,17 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 0,90 мл (6,42 ммоля) 2(трифторметил)бензиламина перемешивают в атмосфере азота при 150 в течение 1 часа. Полученный в результате продукт хроматографируют на силикагеле (5 этанола/этилацетат), получают 0,22 г (59 ) 7 амино-4-(2-трифторметилбензил)аминопиридо 4,3-пиримидина в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,16 (1, с) 8,88 (1, т,5,7 Гц) 8,23 (1, с) 7,75 (1, д,7,7 Гц) 7,62,(1 Н, т,7,5 Гц) 6,51 (2, шир. с) 6,39 (1, с) 4,92 (2, д,5,5 Гц). Пример 51. 7-Амино-4-(3-трифторметилбензиламино)пиридо 4,3-пиримидин Смесь 225 мг (1,17 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 0,63 мл (4,40 ммоля) 3(трифторметил)бензиламина перемешивают в атмосфере азота при 140 в течение 1 часа. Полученный в результате продукт хроматографируют на силикагеле (3-5 этанола/этилацетат), получают 0,24 г (63 ) 7 амино-4-(3-трифторметилфенил)метиламинопиридо 4,3-пиримидина в виде светло-коричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,10 (1 Н, с) 8,92 (1 Н, т,5,7 Гц) 8,26 (1 Н, с) 7,71 (1 Н, с) 7,66 (1 Н, д,7,4 Гц) 7,62 (1 Н, д,7,8 Гц) 7,57 (1 Н, т,7,6 Гц) 6,49 (2, шир. с) 6,38 (1 Н, с) 4,82 (2 Н, д,5,8 Гц). 4568 1 Пример 52 7-Амино-4-(4-трифторметилбензиламино)пиридо 4,3-пиримидин Смесь 225 мг (1,17 ммоля) 7-амино-4-метилтиопиридо 4,3-пиримидина и 0,63 мл (4,42 ммоля) 4(трифторметил)бензиламина перемешивают в атмосфере азота при 140 в течение 1 часа. Полученный в результате продукт хроматографируют на оксиде алюминия (5-10 этанола/хлороформ), затем на силикагеле(56 ) 7-амино-4-(4-трифторметилфенил)метиламинопиридо 4,3-пиримидина в виде светло-коричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,12 (1 Н, с) 8,94 (1 Н, т,5,8 Гц) 8,24 (1 Н, с) 7,69 (2 Н, д,8,1 Гц) 7,56 (2, д,8,1 Гц) 6,48 (2 Н, шир. с) 6,38 (1, с) 4,82 (2 Н, д,5,8 Гц). Пример 53 7-Амино-4-(тиен-2-ил-метиламино)4,3-пиримидин-димезилат Соединение получают из 190 мг (0,98 ммоля) 2,4-диамино-5-цианопиридиний-ацетата, 0,23 г (4,4 ммоля) муравьиной кислоты и 1,07 мл (10 ммолей) тиенилметиламина, как описано в предыдущем эксперименте. Сырой продукт превращают в димезилатную соль, как описано ранее, и перекристаллизовывают из изопропанола получают 7-амино-4-(тиен-2-ил-метиламино)пиридо 4,3-пиримидин-димезилат с выходом 19 . 1 Н-ЯМР (диметилсульфоксид)10,67 (1 Н, т,5,8 Гц) 9,21 (1 Н, с) 8,77 (1 Н, с) 7,48 (1 Н, дд,5,1 и 1,2 Гц) 7,16 (1, дд,3,4 и 0,7 Гц) 7,02 (1 Н, дд,4,8 3,4 Гц) 6,42 (1 Н, с) 5,06 (2 Н, д,5,7 Гц) 2,41 (6,с). Пример 54 7-Ацетиламино-4-бензиламинопиридо 4,3-пиримидин 7-Ацетиламино-4-метилтиопиридо 4,3-пиримидин Прибавляют 0,70 мл (9,84 ммоля) ацетилхлорида к раствору 0,20 г (1,04 ммоля) 7-амино-4 метилтиопиридо 4,3-пиримидина (описанного в предыдущем эксперименте) и 1,51 мл триэтиламина (10,8 ммоля) в тетрагидрофуране при 0 , затем смесь перемешивают при 20 в течение 4-х часов, прибавляют 50 мл воды, затем раствор экстрагируют 3 раза по 50 мл этилацетатом. Выпаривание и хроматография на оксиде алюминия (1 этанола/хлороформ) дают 0,12 г (49 ) 7-ацетиламино-4-метилтиопиридо 4,3 пиримидина в виде желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)11,05 (1, с) 9,30 (1, с) 9,02 (1, с) 8,38 (1, с) 2,71 (3, с) 2,18 7-Ацетиламино-4-бензиламинопиридо 4,3-пиримидин Смесь 0,40 г (1,71 ммоля) 7-ацетиламино-4-метилтиопиридо 4,3-пиримидина и 0,8 мл (9,15 ммоля) бензиламина перемешивают в атмосфере азота при 140 в течение 1 часа, полученный в результате продукт хроматографируют на силикагеле (этилацетат), получают 0,31 г (62 ) 7-ацетиламино-4 бензиламинопиридо 4,3-пиримидина в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)10,79 (1, с) 9,42 (1, с) 9,23 (1, т,5,8 Гц) 8,49 (1, с) 8,18 (1,с) 7,39 (1, дт,6,9 Гц,1,7 Гц) 7,34 (1, тт,7,3 и 1,7 Гц) 7,25 (1, тт,7,1 и 1,7 Гц) 4,80 (2, д,5,8 Гц) 2,15 (3, с). Пример 55 4-Анилинопиридо 3,4-пиримидин 4-Карбоксамидоникотиновая кислота Прибавляют 8,3 г (55,6 ммоля) ангидрида 3,4-пиридиндикарбоновой кислоты к 12 мл конц. аммиака в 60 мл воды, перемешивают при 0 в течение 5 минут. Во время прибавления образуется паста, которую перемешивают в течение 1 часа при комнатной температуре. Белого цвета пасту продувают азотом в течение 30 минут и разбавляют 10 мл воды при образовании прозрачного раствора. Затем барботируют сернистый ангидрид через раствор в течение 15 минут, понижая егодо 2. При охлаждении образовавшийся твердый продукт отфильтровывают, промывают водой и сушат в печи получают 7 г (76 ) 4-карбоксамидоникотиновой кислоты в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)8,93 (1, с) 8,76 (1, д,5,0 Гц) 8,08 (1, с) 7,62 (1 Н, с) 7,45 (1,5,0 Гц). Изохинолинимид Нагревают 280 мг (1,68 ммоля) 4-карбоксамидоникотиновой кислоты примерно при 200 в течение 5 часов, получают 177,2 мг (71 ) имида изохинолиновой кислоты в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)11,68 (1 Н, с) 9,12-9,03 (2 Н, м) 7,80 (1 Н, д,5,1 Гц). 29 4568 1 3-Аминоизоникотиновая кислота Прибавляют 1,71 г брома к 30 мл 10 -го раствора гидроксида калия при охлаждении на льду. Полученный раствор прибавляют к тонко измельченному изохинолинимиду (1,46 г, 9,86 ммоля). При добавлении смесь начинает пениться. После растворения всего твердого продукта прибавляют 7 мл 15 -го водного раствора гидроксида калия и нагревают смесь при 80 в течение 1 минуты, затем охлаждают. Смесь нейтрализуют сернистым ангидридом и охлаждают до 0 до тех пор, пока не осядет продукт. Твердый продукт собирают фильтрованием и промывают водой, сушат в вакуумной печи получают 485 мг (36 ) 3 аминоизоникотиновой кислоты в виде белого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,5-8,8 (2, шир. с) 8,20 (1 Н, с) 7,70 (1 Н, д,5 Гц) 7,46 (1, д,.5 Гц). 3-Пиридо 3,4-пиримид-4-он Смесь 485 мг (3,51 ммоля) 3-аминоизоникотиновой кислоты в 3 мл формамида нагревают при 160 в течение 12 часов. После охлаждения отфильтровывают полученный твердый продукт и промывают его водой, сушат в вакуумной печи получают 373 мг (72 ) 3-пиридо 3,4-пиримид-4-она. 1 Н-ЯМР (диметилсульфоксид)12,60 (1 Н, шир. с) 8,68 (1, д,5,3 Гц) 8,23 (1 Н, с) 7,96 (1, д,5,1 Гц). 4-Тиопиридо 3.4-пиримидин К раствору 366 мг (2,49 ммоля) 3-пиридо 3,4-пиримид-4-она в 4 мл пиридина прибавляют 1,25 г (2,74 ммоля) пятисернистого фосфора. Смесь кипятят с обратным холодильником в течение 4 часов в атмосфере азота. Полученную черную смолу растворяют в воде и получают твердый продукт. Его отфильтровывают и промывают водой, сушат в вакуумной печи получают 369,8 мг (91 ) 4-тиопиридо 3,4-пиримидина в виде желтого твердого продукта. 1 Н-ЯМР(диметилсульфоксид)14,48 (1 Н, шир. с) 9,13 (1, с) 8,70 (1, д,5,4 Гц). 4-Метилтиопиридо 3,4-пиримидин Смесь 369,8 мг (2,26 ммоля) 4-тиопиридо 3,4-пиримидина, 0,6 мл (4,5 ммоля) триэтиламина, 2 мл диметилсульфоксида и 0,24 мл (3,96 ммоля) иодметана перемешивают в атмосфере азота при 25 в течение 12 часов. Смесь выливают в воду и полученный твердый продукт отфильтровывают и сушат в вакуумной печи получают 222 мг (55 ) 4-метилтиопиридо 3,4-пиримидина в виде коричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)9,51 (1, с) 9,18 (1 Н, с) 8,79 (1 Н, д,8 Гц) 7,97 (1, д,8 Гц). 4-Анилинопиридо 3,4-пиримидин Смесь 75 мг (0,42 ммоля) 4-метилтиопиридо 3,4-пиримидина и 1 мл анилина нагревают при 100 в атмосфере азота в течение 2 часов. Затем реакционную смесь хроматографируют на двуокиси кремния, используя жидкостную хроматографию среднего давления, и элюируя градиентной системой (от хлороформа до 5 метанола в хлороформе). Концентрируют фракции при пониженном давлении и полученный твердый продукт перекристаллизовывают из эфира, получая 21,2 мг (23 ) 4-анилинопиридо 3,4-пиримидина в виде желтого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)10,09 (1, с) 9,18 (1 Н, с) 8,74 (1 Н, д,5,3 Гц) 8,46 (1, д,5,8 Гц) 7,89 (2, д,8,5 Гц) 7,45 (2 Н, т,7,9 Гц) 7,21 (1, т,7,4). Пример 56 4-(3-Броманилино)пиридо 3,4-пиримидин Смесь 75 мг (0,42 ммоля) 4-метилтиопиридо 3,4-пиримидина (см. предыдущий эксперимент) и 1 мл 3 броманилина нагревают в атмосфере азота при 100 в течение 2 часов. Затем реакционную смесь хроматографируют на двуокиси кремния, используя жидкостную хроматографию среднего давления и элюируя градиентной системой (от хлороформа до 5 метанола в хлороформе). Фракции концентрируют при пониженном давлении и полученный в результате твердый продукт перекристаллизовывают из эфира, получая 66 мг (52,7 ) 4-(3-броманилино)пиридо 3,4-пиримидина в виде светло-коричневого твердого продукта. 1 Н-ЯМР (диметилсульфоксид)10,15 (1, с) 9,21 (1, с) 8,80 (1, с) 8,76 (1 Н, д,5,8 Гц) 8,44 (1, д,5,6 Гц) 8,25 (1, с) 7,93 (1, д,7,7 Гц) 7,45-7,37 (2, м). Пример 57 4-(3-Броманилино)-6-фторпиридо 3,4-пиримидин 5(трет.-бутоксикарбонил)амино-2-фторпиридин 5-Амино-2-фторпиридин получают при гидрировании на палладии-на-угле 2-фтор-5-нитропиридина, полученного из 2-хлор-5-нитропиридина при взаимодействии с фторидом калия в ацетонитриле с тетрафенил 30
МПК / Метки
МПК: A61P 35/00, A61P 15/00, C07D 495/04, C07D 471/04, A61K 31/519, C07D 487/04
Метки: роста, активностью, тирозинкиназы, ингибирующей, бициклические, пиримидина, тирозинкиназу, эпидермального, ингибирования, обладаю, фактора, способы, обладающая, производные, композиция, рецептора, фармацевтическая
Код ссылки
<a href="https://by.patents.su/30-4568-sposoby-ingibirovaniya-tirozinkinazy-receptora-epidermalnogo-faktora-rosta-biciklicheskie-proizvodnye-pirimidina-farmacevticheskaya-kompoziciya-obladayushhaya-ingibiruyushhejj-tiro.html" rel="bookmark" title="База патентов Беларуси">Способы ингибирования тирозинкиназы рецептора эпидермального фактора роста, бициклические производные пиримидина, фармацевтическая композиция, обладающая ингибирующей тирозинкиназу рецептора эпидермального фактора роста активностью, и композиция, обладаю</a>
Предыдущий патент: Асинхронный электродвигатель, регулируемый, Парфеновича
Следующий патент: Эндопаразитицидное средство
Случайный патент: Игла швейной машины