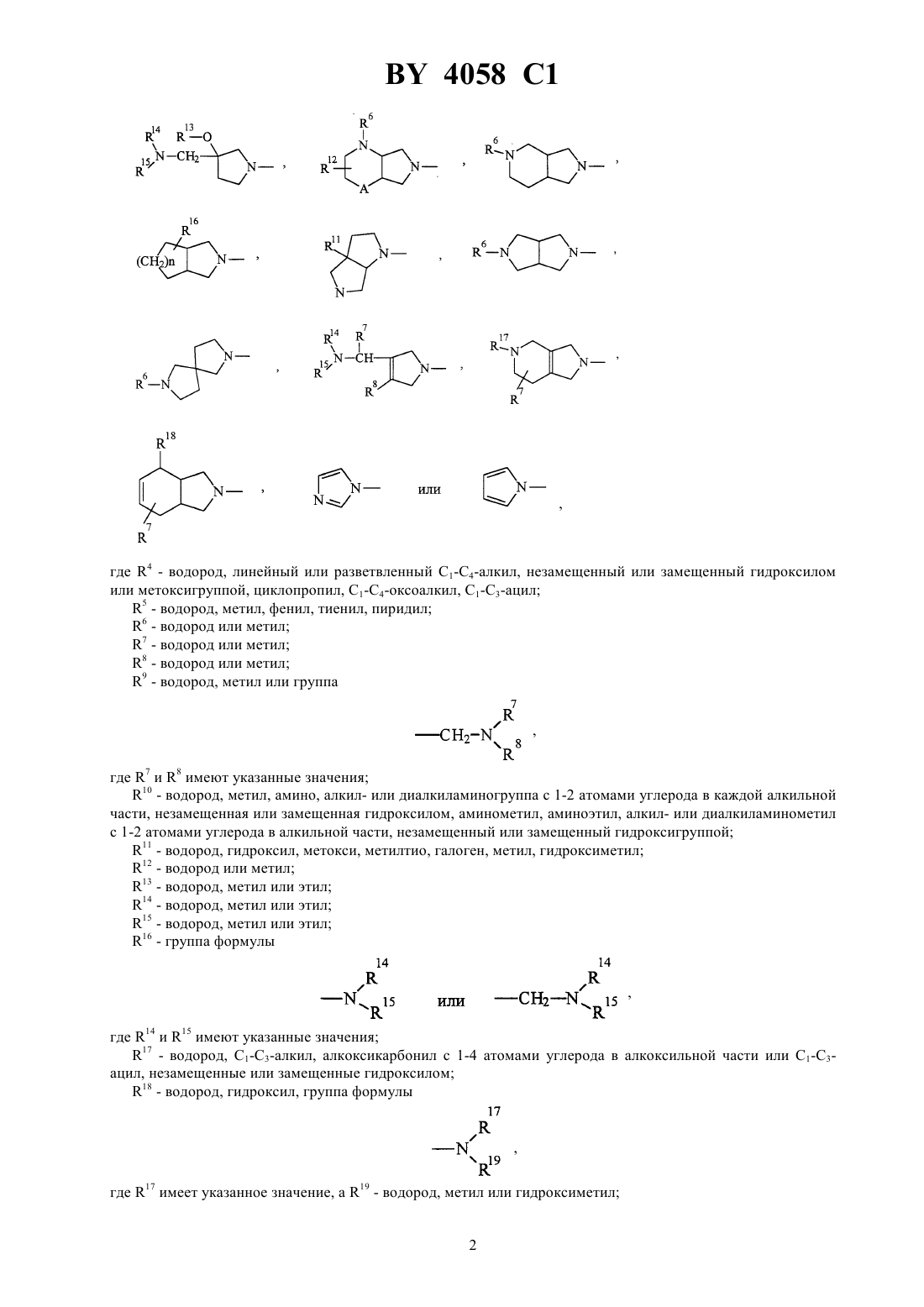
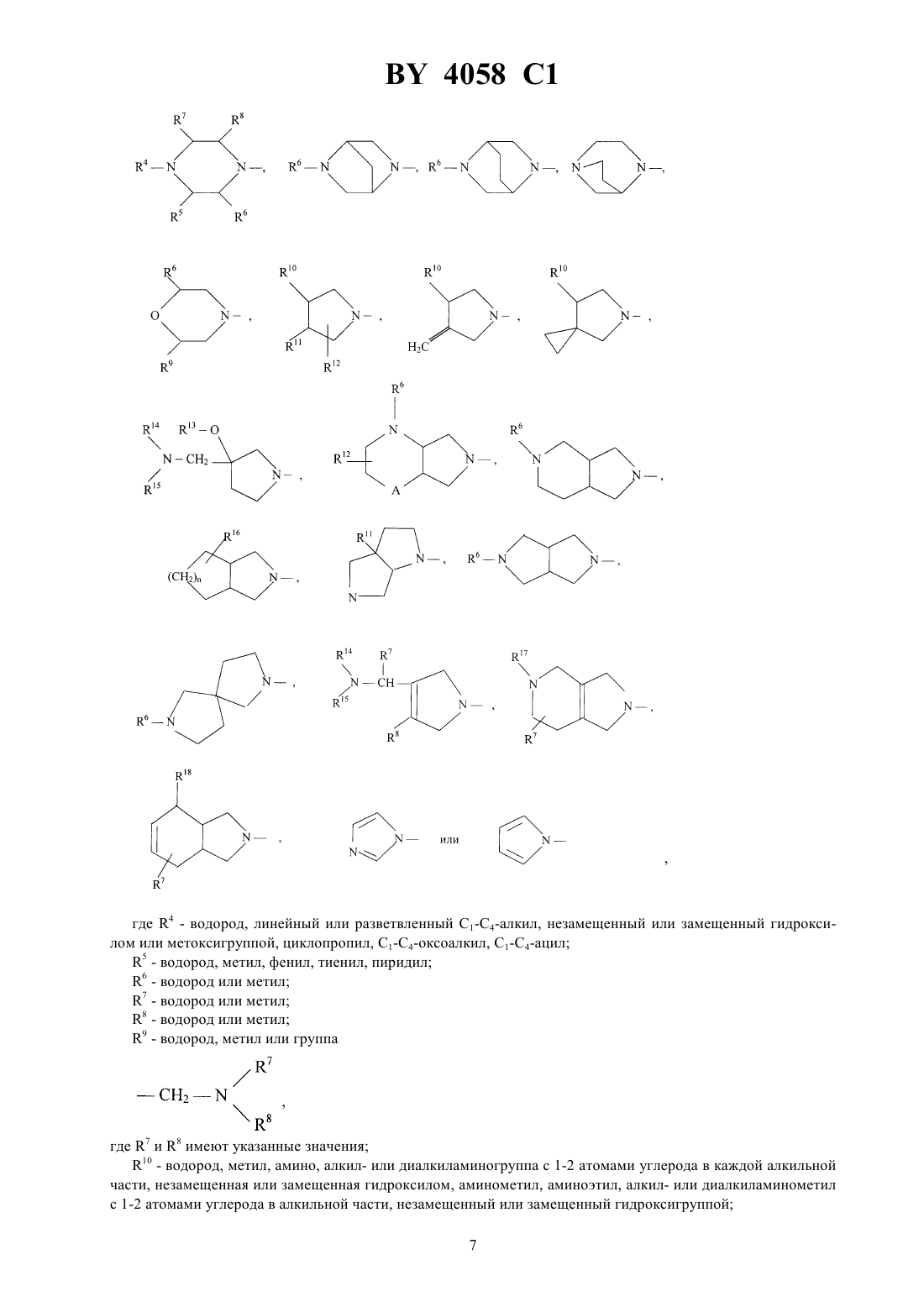
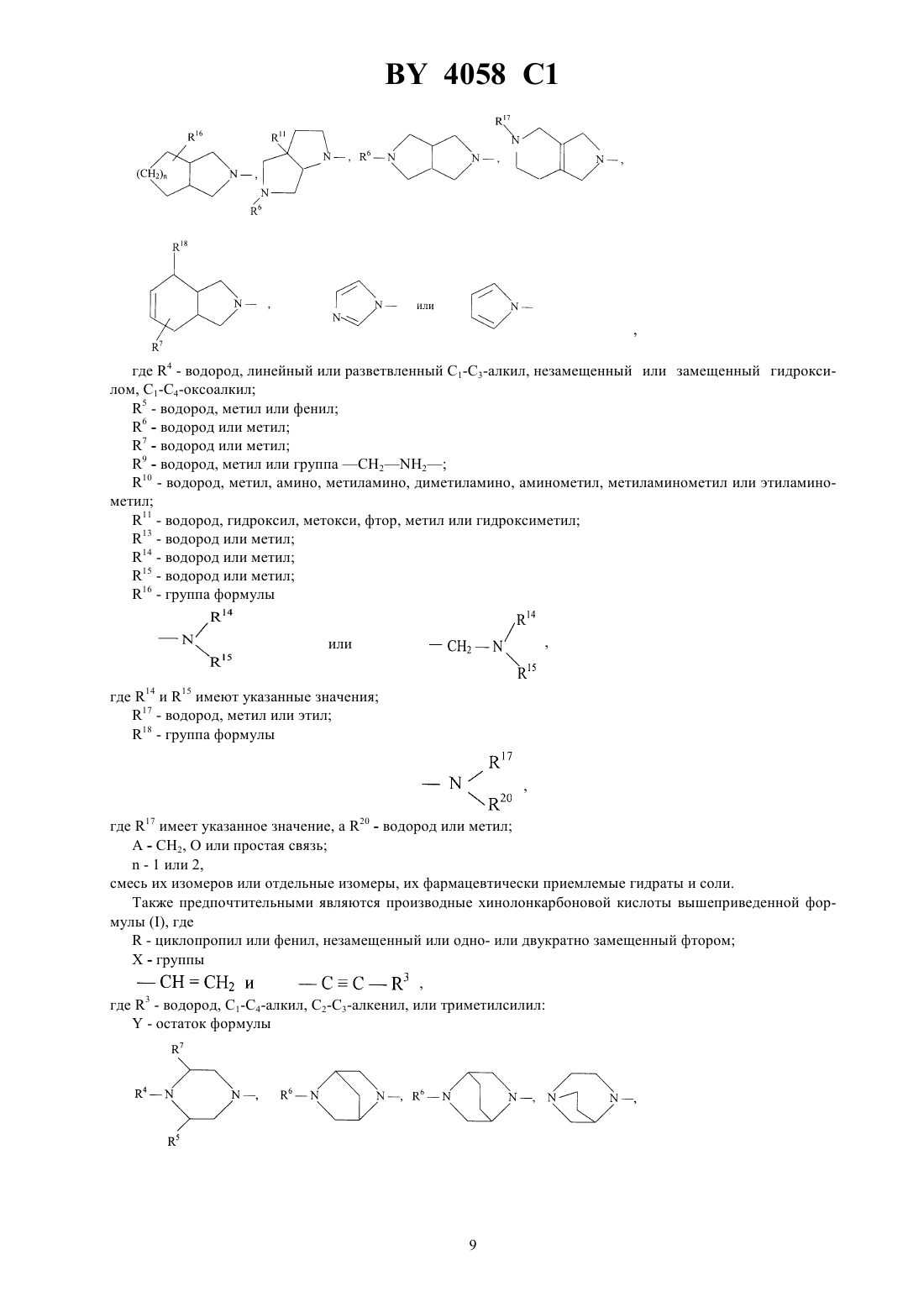
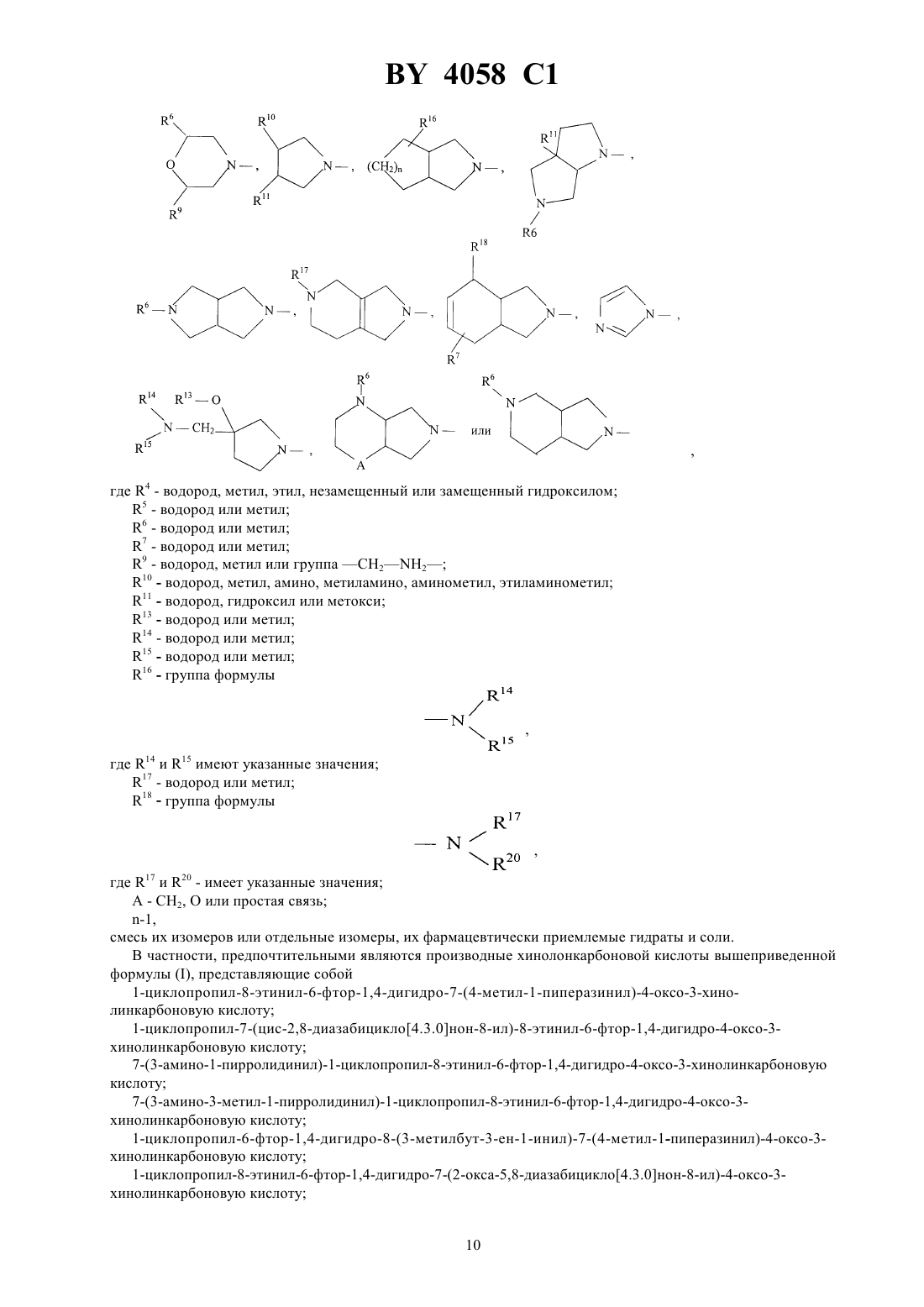
Производные хинолонкарбоновой кислоты, смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли
Номер патента: 4058
Опубликовано: 30.09.2001
Авторы: Ханс-Йоахим Цейлер, Томас Химмлер, Уве Петерсен, Карл Георг Метцгер, Клаус Грохе, Томас Шенке, Райнер Эндерманн, Клаус-Дитер Бремм, Андреас Кребс
Текст
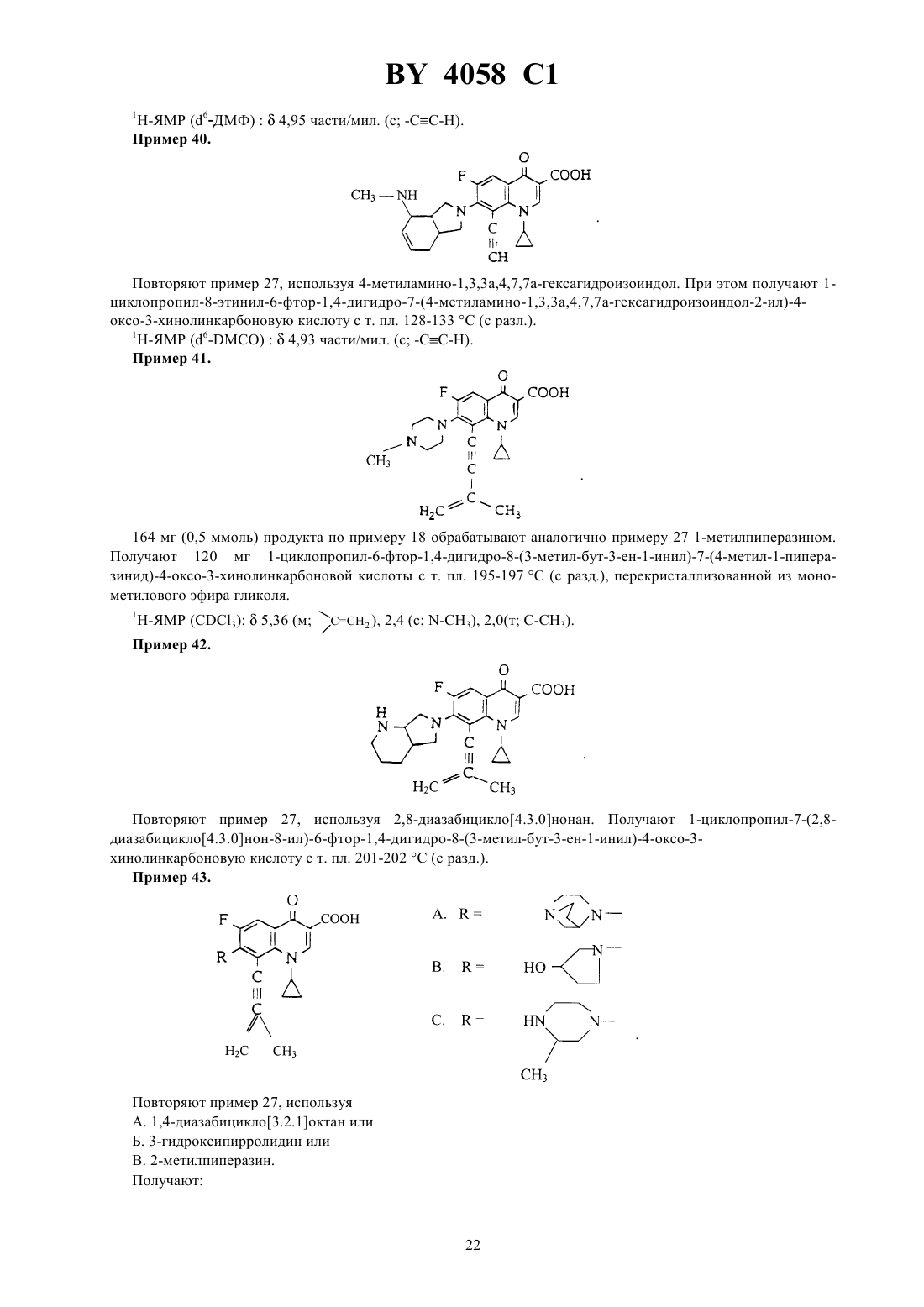
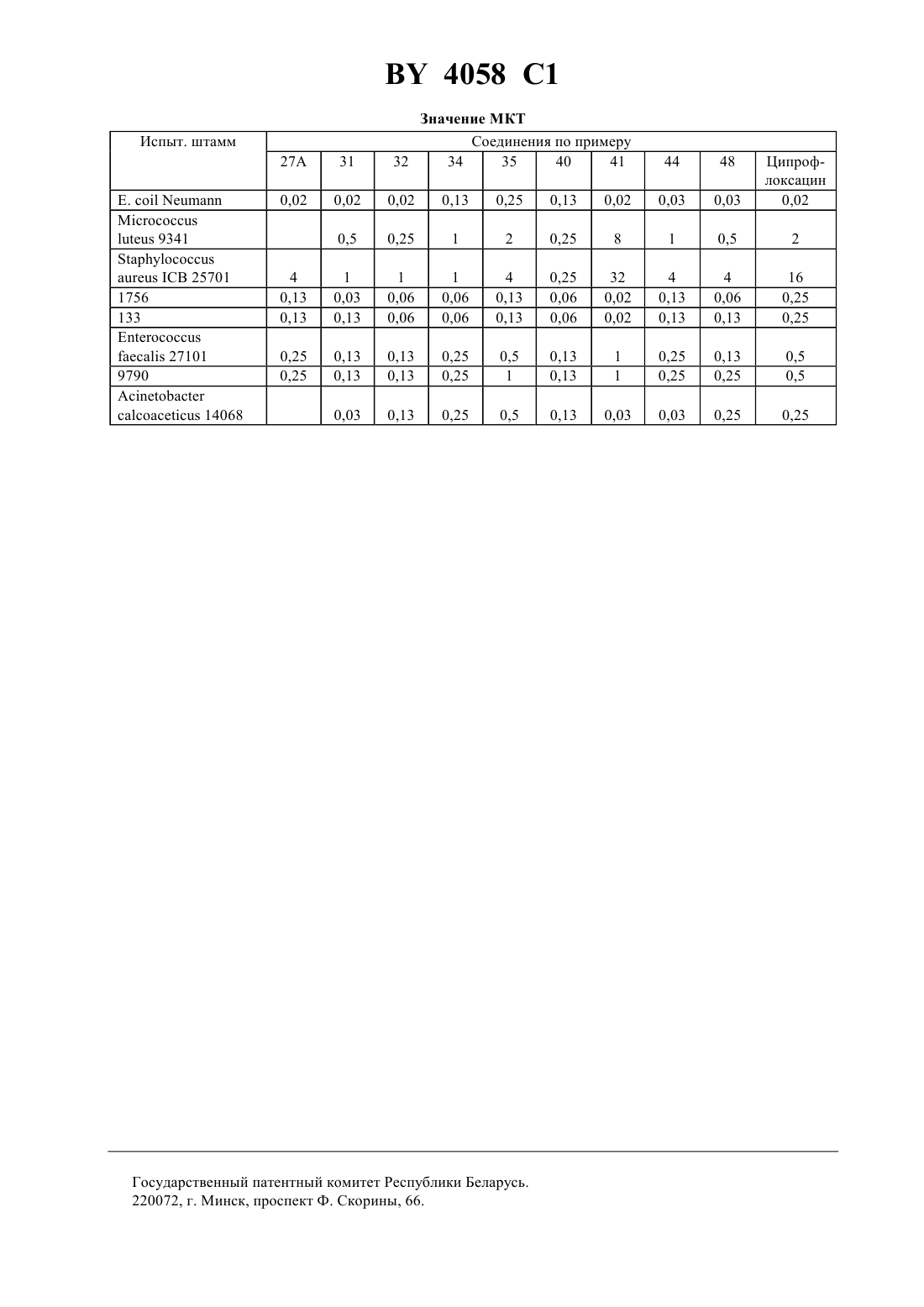
ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ ПРОИЗВОДНЫЕ ХИНОЛОНКАРБОНОВОЙ КИСЛОТЫ, СМЕСЬ ИХ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫЕ ИЗОМЕРЫ, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ ГИДРАТЫ И СОЛИ(57) 1. Производные хинолонкарбоновой кислоты общей формулы гдеС 3-С 6-циклоалкил, незамещенный или замещенный галоидом или 1-С 3-алкилом, фенил, незамещенный или одно-, дву- или трехкратно замещенный галоидом Х - группы где 1 - водород, С 1-С 3-алкил, С 1-С 3-алкокси, алкоксиметил с 1-3 атомами углерода в алкильной части 2 - водород или галоид 3 - водород, галоид, С 1-С 6-алкил, С 2-С 3-алкенил, С 1-С 3-алкокси, алкоксиметил с 1-3 атомами углерода в алкоксильной части, незамещенные или одно-, дву- или трехкратно замещенные галоидом, или триметилсилил- остаток формулы, где 4 - водород, линейный или разветвленный С 1-С 4-алкил, незамещенный или замещенный гидроксилом или метоксигруппой, циклопропил, С 1-С 4-оксоалкил, С 1-С 3-ацил 5 - водород, метил, фенил, тиенил, пиридил 6 - водород или метил 7 - водород или метил 8 - водород или метил 9 - водород, метил или группа,где 7 и 8 имеют указанные значения 10 - водород, метил, амино, алкил- или диалкиламиногруппа с 1-2 атомами углерода в каждой алкильной части, незамещенная или замещенная гидроксилом, аминометил, аминоэтил, алкил- или диалкиламинометил с 1-2 атомами углерода в алкильной части, незамещенный или замещенный гидроксигруппой 11 - водород, гидроксил, метокси, метилтио, галоген, метил, гидроксиметил 12 - водород или метил 13 - водород, метил или этил 14 - водород, метил или этил 15 - водород, метил или этил 16 - группа формулы,где 14 и 15 имеют указанные значения 17 - водород, С 1-С 3-алкил, алкоксикарбонил с 1-4 атомами углерода в алкоксильной части или С 1-С 3 ацил, незамещенные или замещенные гидроксилом 18 - водород, гидроксил, группа формулы,где 17 имеет указанное значение,19 - водород, метил или гидроксиметил 2,где 17 и 19 имеют указанные значения А - СН 2, О или простая связь- 1 или 2,смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли. 2. Производные хинолонкарбоновой кислоты общей формулыпо п. 1, гдеС 3-С 5-циклоалкил или фенил, незамещенный или одно- или двухкратно замещенный галоидом Х - группы где 1 - водород, С 1-С 2-алкил, метокси или метоксиметил 2 - водород 3 - водород, С 1-С 2-алкил, незамещенный или одно-, дву- или трехкратнозамещенный фтором, С 2-С 3 алкенил, метокси или триметилсилил- остаток формулы,где 4 - водород, линейный или разветвленный С 1-С 3-алкил, незамещенный или замещенный гидроксилом,С 1-С 4-оксоалкил 5 - водород, метил или фенил 6 - водород или метил 7 - водород или метил 9 - водород, метил или группа 2-210 - водород, метил, амино, метиламино, диметиламино, аминометил, метиламинометил или этиламинометил 11 - водород, гидроксил, метокси, фтор, метил или гидроксиметил 13 - водород или метил 14 - водород или метил 15 - водород или метил 16 - группа 3,где 14 и 15 имеют указанные значения 17 - водород, метил или этил 18 - группа формулы,где 17 имеет указанное значение,20 - водород или метил А - 2, О или простая связь- 1 или 2,смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли. 3. Производные хинолонкарбоновой кислоты общей формулыпо п. 1,где- циклопропил или фенил, незамещенный или одно- или двухкратно замещенный фтором Х - группы где 4 - водород, метил, этил, незамещенный или замещенный гидроксилом 5 - водород или метил 6 - водород или метил 7 - водород или метил 9 - водород или группа 2-2 10 - водород, метил, амино, метиламино, аминометил, этиламинометил 11 - водород, гидроксил или метокси 13 - водород или метил 14 - водород или метил 15 - водород или метил 16 - группа формулы,где 14 и 15 имеют указанные значения 17 - водород или метил 18 - группа формулы,где 17 и 20 имеют указанное значение А - СН 2, О или простая связь- 1,смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли. 4. Производные хинолонкарбоновой кислоты общей формулыпо п. 1, представляющие собой 1 циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту,ее фармацевтически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 5. Производные хинолонкарбоновой кислоты общей формулыпо п. 1, представляющие собой 1 циклопропил-7-(цис-2,8-диазабицикло 4.3.0 нон-8-ил)-8-этинил-6-фтор-1,4-дигидро-4-оксо-3 хинолинкарбоновую кислоту, ее фармацевтически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 6. Производные хинолонкарбоновой кислоты общей формулыпо п. 1, представляющие собой 7-(3 амино-1-пирролидинил)-1-циклопропил-8-этинил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту,ее фармацевтически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 7. Производные хинолонкарбоновой кислоты общей формулыпо п. 1, представляющие собой трифторацетат 7-(3-амино-3-метил-1-пирролидинил)-1-циклопропил-8-этинил-6-фтор-1,4-дигидро-4-оксо-3 хинолинкарбоновой кислоты. 8. Производные хинолонкарбоновой кислоты общей формулыпо п. 1, представляющие собой 1 циклопропил-6-фтор-1,4-дигидро-8-(3-метилбут-3-ен-1-инил)-7-(4-метил-1-пиперазинил)-4-оксо-3 хинолинкарбоновую кислоту, ее фармацевтически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 9. Производные хинолонкарбоновой кислоты общей формулыпо п. 1, представляющие собой 1 циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(2-окса-5,8-диазабицикло 4.3.0 нон-8-ил)-4-оксо-3 хинолинкарбоновую кислоту, ее фармацевтически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 10. Производные хинолонкарбоновой кислоты общей формулыпо п. 1, представляющие собой 1 циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(7-метил-3,7-диазабицикло 3.3.0 окт-3-ил)-4-оксо-3 хинолинкарбоновую кислоту, ее фармацевтически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 11. Производные хинолонкарбоновой кислоты общей формулыпо п. 1, представляющие собой 1 циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4-метил-1, 3, 3 а, 5, 7, 7 а-гексагидроизоиндол-2-ил)-4-оксо-3 хинолинкарбоновую кислоту, ее фармацевтически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 12. Производные хинолонкарбоновой кислоты общей формулыпо п. 1, представляющие собой 1 циклопропил-7-(цис-8-диазабицикло 4.3.0 нон-8-ил)-6-фтор-1,4-дигидро-4-оксо-8-винил-3 хинолинкарбоновую кислоту, ее фармацевтически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 13. Производные хинолонкарбоновой кислоты по пп. 1-12, обладающие антибактериальной активностью. 14. Производные хинолонкарбоновой кислоты общей формулы гдеи Х имеют указанные в пп. 1-3 значения, а Х 1 означает галоген, в частности фтор или хлор, представляющие собой промежуточные соединения для получения производных хинолонкарбоновой кислоты общей формулыпо пп. 1-13. 15. Производные хинолонкарбоновой кислоты общей формулы,гдеозначает этил или 2,4-дифторфенил, представляющие собой промежуточные соединения для получения производных хинолонкарбоновой кислоты общей формулыпо пп. 1-13. Изобретение относится к новым химическим веществам с ценными свойствами, в частности к производным хинолонкарбоновой кислоты, обладающим, в частности, антибактериальной активностью. Известна 1-циклопропил-6-фтор-1,4-дигидро-4-оксо-7-(1-пиперазинил)-хинолин-3-карбоновая кислота,обладающая антибактериальной активностью (торговый продукт ципрофлоксацин, заявка ЕР 0230881, МПК А 61 К 31/495, 1987). Задачей изобретения является создание новых производных хинолонкарбоновой кислоты, обладающих лучшей антибактериальной активностью, чем известное производное. Данная задача решается предлагаемыми производными хинолонкарбоновой кислоты общей формулы гдеС 3-С 6-циклоалкил, незамещенный или замешенный галоидом или С 1-С 3-алкилом, фенил, незамещенный или одно-, дву- или трехкратно замещенный галоидом Х - группы где 1 - водород, С 1-С 3-алкил, С 1-С 3-алкокси, алкоксиметил с 1-3 атомами углерода в алкильной части 2 - водород или галоид 3 - водород, галоид, С 1-С 6-алкил, С 2-С 3-алкенил, С 1-С 3-алкокси, алкоксиметил с 1-3 атомами углерода в алкоксильной части, незамещенные или одно-, дву- или трехкратно замещенные галоидом, или триметилсилил- остаток формулы, где 4 - водород, линейный или разветвленный С 1-С 4-алкил, незамещенный или замещенный гидроксилом или метоксигруппой, циклопропил, С 1-С 4-оксоалкил, С 1-С 4-ацил 5 - водород, метил, фенил, тиенил, пиридил 6 - водород или метил 7 - водород или метил 8 - водород или метил 9 - водород, метил или группа,где 7 и 8 имеют указанные значения 10 - водород, метил, амино, алкил- или диалкиламиногруппа с 1-2 атомами углерода в каждой алкильной части, незамещенная или замещенная гидроксилом, аминометил, аминоэтил, алкил- или диалкиламинометил с 1-2 атомами углерода в алкильной части, незамещенный или замещенный гидроксигруппой 7 4058 1 11 - водород, гидроксил, метокси, метилтио, галоген, метил, гидроксиметил 12 - водород или метил 13 - водород, метил или этил 14 - водород, метил или этил 15 - водород, метил или этил 16 - группа формулы или, где 14 и 15 имеют указанные значения 17 - водород, С 1-С 3-алкил, алкоксикарбонил с 1-4 атомами углерода в алкоксильной части или С 1-С 3 ацил, незамещенные или замещенные гидроксилом 18 - водород, гидроксил, группа формулы,где 17 - имеет указанное значение,19 означает водород, метил или гидроксиметил группа формулы,где 17 и 19 имеют указанные значения 2, О или простая связь- 1 или 2,смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли. Предпочтительными являются производные хинолонкарбоновой кислоты вышеприведенной формулы ,гдеС 3-С 5-циклоалкил или фенил, незамещенный или одно-, или двукратно замещенный галоидом Х - группы где 1 - водород, С 1-С 2-алкил, метокси или метоксиметил 2 - водород 3 - водород, С 1-С 2-алкил, незамещенный или одно-, дву- или трехкратно замещенный фтором, С 2-С 3 алкенил, метокси или триметилсилил- остаток формулы,где 4 - водород, линейный или разветвленный С 1-С 3-алкил, незамещенный или замещенный гидроксилом, С 1-С 4-оксоалкил 5 - водород, метил или фенил 6 - водород или метил 7 - водород или метил 9 - водород, метил или группа СН 22 10 - водород, метил, амино, метиламино, диметиламино, аминометил, метиламинометил или этиламинометил 11 - водород, гидроксил, метокси, фтор, метил или гидроксиметил 13 - водород или метил 14 - водород или метил 15 - водород или метил 16 - группа формулы, или где 14 и 15 имеют указанные значения 17 - водород, метил или этил 18 - группа формулы, где 17 имеет указанное значение,20 - водород или метил А - СН 2, О или простая связь- 1 или 2,смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли. Также предпочтительными являются производные хинолонкарбоновой кислоты вышеприведенной формулы , где- циклопропил или фенил, незамещенный или одно- или двукратно замещенный фтором Х - группы,где 4 - водород, метил, этил, незамещенный или замещенный гидроксилом 5 - водород или метил 6 - водород или метил 7 - водород или метил 9 - водород, метил или группа СН 22 10 - водород, метил, амино, метиламино, аминометил, этиламинометил 11 - водород, гидроксил или метокси 13 - водород или метил 14 - водород или метил 15 - водород или метил 16 - группа формулы,где 14 и 15 имеют указанные значения 17 - водород или метил 18 - группа формулы,где 17 и 20 - имеет указанные значения А - СН 2, О или простая связь-1,смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли. В частности, предпочтительными являются производные хинолонкарбоновой кислоты вышеприведенной формулы , представляющие собой 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту 1-циклопропил-7-(цис-2,8-диазабицикло 4.3.0 нон-8-ил)-8-этинил-6-фтор-1,4-дигидро-4-оксо-3 хинолинкарбоновую кислоту 7-(3-амино-1-пирролидинил)-1-циклопропил-8-этинил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту 7-(3-амино-3-метил-1-пирролидинил)-1-циклопропил-8-этинил-6-фтор-1,4-дигидро-4-оксо-3 хинолинкарбоновую кислоту 1-циклопропил-6-фтор-1,4-дигидро-8-(3-метилбут-3-ен-1-инил)-7-(4-метил-1-пиперазинил)-4-оксо-3 хинолинкарбоновую кислоту 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(2-окса-5,8-диазабицикло 4.3.0 нон-8-ил)-4-оксо-3 хинолинкарбоновую кислоту 10 4058 1 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(7-метил-3,7-диазабицикло 3.3.0 окт-3-ил)-4-оксо-3 хинолинкарбоновую кислоту 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4-метил-1,3,3 а,5,7,7 а-гексагидроизоиндол-2-ил)-4-оксо-3 хинолинкарбоновую кислоту 1-циклопропил-7-(цис-8-диазабицикло 4.3.0 нон-8-ил)-6-фтор-1,4-дигидро-4-оксо-8-винил-3 хинолинкарбоновую кислоту,а также фармацевтически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина вышеперечисленных соединений. Соединения общей формулыполучают тем, соединения общей формулы,гдеи Х имеют вышеуказанные значения, а 1 означает галоген, в частности фтор или хлор, подвергают взаимодействию с соединением общей формулы,гдеимеет вышеуказанное значение, в случае необходимости в присутствии связывающего кислоту средства. Если применяют, например, в качестве исходных соединений 1-циклопропил-8-этинил-6,7-дифтор-1,4 дигидро-4-оксо-3-хинолинкарбоновую кислоту и 1-метилпиперазин, то реакция протекает по следующей схеме. 8-(1-хлорвинил)-хинолонкарбоновые кислоты получаются также при взаимодействии 8-этинилхинолонкарбоновых кислот с соляной кислотой при температуре от 10 до 100 С, предпочтительно при 2060 С. Применяемые в качестве промежуточных соединения формулыявляются новыми и поэтому представляют собой дополнительный объект изобретения. Они могут быть получены взаимодействием соединений общей формулы гдеи Х 1 имеют вышеуказанные значения,Х 2 означает галоген, в частности йод, бром или хлор, с соединением формулыМХ ,где Х имеет вышеуказанное значение М-3, , 2, где- означает С 1-С 4-алкил, - водород или С 1-С 4-алкил, - бром или хлор,в присутствии катализатора - переходного металла с отщеплением имеющихся защитных групп. Применяемые для реакции металлорганические винил- и алкинилсоединения являются либо известными,либо могут быть получены описанными в литературе методами. Так, например, винил-триалкилоловосоединения из соответствующих винилиодидов, - бромидов или - хлоридов получают таким обра 11 4058 1 зом, что путем взаимодействия с магнием получают винильные соединения Гриньяра и переводят последние взаимодействием с триалкилхлоридом олова в желаемые производные винил-олова. Металлорганические алкильные соединения получают известным способом, например, тем, что 1-алкин металлируют н-бутил-, вторбутил или третбутиллитием при температуре между -20 С и -78 С в апротонном растворителе, например тетрагидрофуране, и затем подвергают взаимодействию с металлгалоидным соединением, например с хлоридом цинка, бромидом магния, йодидом меди или триалкилхлоридом олова. Предпочтительно проводят взаимодействие при температуре -78 С. Кроме предпочтительного растворителя тетрагидрофурана применяются также и другие эфиры, такие как диэтиловый эфир, дипропиловый эфир или третбутил-метиловый эфир или смесь этих эфиров с апротонным алифатическим или ароматическим растворителями, такими как н-гексан или толуол. Как среди винильных соединений, так и среди алкильных соединений предпочтительны производные хлорида, цинка, триалкилолова. Под алкилом в соединениях триалкилолова понимают С 1-С 6-алкил, предпочтительны метил и н-бутил. Соединения триалкилвинилолова могут быть получены описанным в литературе способом путем гидростаннилирования алкинов тоиалкилхлоридами олова в присутствии переходных металлов в качестве катализаторов . , . 55 (1990) 1857-1867. Металлорганические винил- и алкенилсоединения взаимодействуют с производными 8 галогенхинолонкарбоновой кислоты общей формулыв присутствии подходящего катализатора по принципу известных способов. Под галогеном здесь подразумевается йод, бром или хлор предпочтительны бром и хлор, особенно предпочтителен бром. В качестве катализаторов выступают, например, соединения таких переходных металлов, как кобальт,рутений, родий, иридий, никель, палладий или платина. Предпочтительны соединения платины, палладия и никеля, особенно предпочтителен палладий. Такие переходные металлы могут применяться в виде их солей, например, таких как 2, 2 или 2 или в виде комплексов с подходящими лигандами. Предпочтительно применение комплексов. В качестве лигандов применяются предпочтительно фосфины, например трифенилфосфин, три(о-толил)фосфин, триметилфосфин, трибутилфосфин и три(2-фурил)фосфин, предпочтителен трифенилфосфин. В качестве предпочтительных комплексных катализаторов следует назвать бис(трифенилфосфин)никельхлорид,бис(трифенилфосфин)палладийхлорид,трис(три-фенилфосфин)палладий(0) и тетракис(трифенилфосфин)палладий(0). Комплексные катализаторы применяются в количествах от 0,1 до 20 мольв расчете на вводимый эфир 8-галогенхинолонкарбоновой кислоты, предпочтительно в количестве от 0,5 до 10 моль , особенно предпочтительно от 1 до 5 моль . Реакции сочетания проводятся в подходящем инертном растворителе, например, в бензоле, толуоле, ксилоле, диметилформамиде, диметилацетомиде, диметоксиэтане или смеси этих растворителей предпочтительными являются диметилформамид и толуол. Растворители перед употреблением сушат известными методами. Реакции сочетания проводятся при температурах между 20 С и 200 С предпочтительны температуры между 50 С и 130 С. Длительность взаимодействия определяется реактивностью реагентов и составляет, в общем, от 2 до 40 ч предпочтительным является время реакции 4 - 24 ч. Взаимодействие проводят в атмосфере защитного газа. В качестве защитного газа применяются инертные газы, например гелий, аргон или азот предпочтительным является азот. Реакция сочетания проводится, как правило, при нормальном давлении. Само собой разумеется, что реакцию можно проводить при пониженном или повышенном давлении. Применяемые в качестве промежуточных соединений амины общей формулыбольшей частью являются известными. Хиральные амины могут применяться как в виде рацематов, так и в виде энантиомерных или диастереомерных соединений. Замещенные 1,3,3 а,4,7,7 а-гексагидро-изоиндолы являются большей частью новыми. Они могут быть получены, например, взаимодействием по Дильсу-Альдеру диенов общей формулы ,где 9 имеет указанное выше значение и 21 или идентичен с 18, или является функциональной группой, с диенофилами общей формулы , 12 где 22 является водородом или защитной группой, такой как триметилсилил, бензил , алкилфенилметил с 14 атомами углерода в алкильной части, метоксибензил или бензгидрил, с последующим восстановлением карбонильной группы, а также отщеплением имеющейся защитной группы. Для реакции Дильса-Альдера применяются в качестве разбавителя все инертные органические растворители, К ним относятся предпочтительно эфиры, такие как, например, диизопропиловый эфир, ди-нбутиловый эфир, диметоксиэтан, тетрагидрофуран и анизол, углеводороды, такие как, например, гексан, метилциклогексан, толуол, ксилол и мезитилен, и галогенированные углеводороды, такие как, например, хлороформ, 1,2-дихлорэтан и хлорбензол. Реакция Дильса-Альдера может также проводиться и без растворителя. Температура реакции может варьироваться в широком диапазоне. В основном работают при температуре между -20 С и 200 С, предпочтительно между -20 С и 150 С. Реакция Дильса-Альдера проводится, как правило, при нормальном давлении, однако можно применить давление до 1,5 ГПа. Восстановление карбонильных групп можно проводить с помощью комплексных гидридов. В качестве гидридов могут применяться, например, литийалюминийгидрид, литийборгидрид, литийтриэтилборгидрид, натрий-бис-2-метоксиэтокси-алюминийгидрид или натрий-боргидрид в присутствии катализатора кислот Льюиса, таких как, например, триметилсилан, эфират трифторида бора или алюминийхлорид. В качестве разбавителя могут применяться эфиры, например, диэтиловый эфир, тетрагидрофуран, диоксан или диметоксиметан, и углеводороды, например, гексан, метилциклогексан и толуол или их смеси. Температура варьируется в широком диапазоне между -40 С и 180 С, предпочтительно между 0 С и 140 С. Восстановление проводят обычно при нормальном давлении, однако можно его проводить также при пониженном или повышенном давлении. Рекомендуется применять давление между 100 и 1000 КПа, чтобы можно было достичь высоких температур с легкокипящими растворителями. Комплексные гидриды применяются, по меньшей мере, в стехиометрическом количестве. Однако обычно применяются в избытке, предпочтительно между 30 и 300 . Отщепление возможно имеющейся защитной группы протекает по общеизвестным методам. Исходные соединения общих формулиизвестны или могут быть получены известными в органической химии методами. Если применяют, например, 1-(трет.-бутилоксикарбониламино)-1,3-бутадиен и маленимид в качестве исходных соединений и литийалюминийгидрид в качестве восстановителя, то реакция протекает по следующей схеме. Все стадии получения соединений можно проводить с применением подходящего растворителя, например тетрагидрофурана, без выделения промежуточных продуктов. Если применяют в качестве исходных соединений, например, 1-(трет.-бутилоксикарбоксикарбониламино)-1,3-пентадиен и -триметилсилилмалеинимид, то реакция протекает по следующей схеме Путем ЯМР-спектроскопии можно доказать, что все заместители у 6-ти членного кольца находятся в цисположении по отношению друг к другу. Взаимодействие соединений общей формулыс соединениями общей формулы , при котором соединениямогут применяться также в виде соли, например гидрохлорида, осуществляется предпочтительно в разбавителе, таком как диметилсульфоксид, ,-диметилформамид, -метилпирролидон, триамидгексаметил-фосфоновой кислоты, сульфолан, ацетонитрил, вода, спирт - метанол, этанол, н-пропанол,изопропанол, монометиловый эфир гликоля или пиридин. Точно также могут применяться смеси этих разбавителей. В качестве связывающего кислоту средства могут применяться все обычные неорганические или органические связующие кислоту средства. К ним относятся, например, гидроксиды щелочных металлов, карбонаты щелочных металлов, органические амины и амидины. Особенно подходят триэтиламин, 1,4 диазабицикло 2.2.2-октан, 1,8-диазабицикло 5.4.0 ундек-7-ен или избыток амина . Температура реакции может варьироваться в широком диапазоне. В основном работают между 20 и 200 С, предпочтительно между 80 и 180 С. Взаимодействие можно проводить при нормальном давлении и при повышенном давлении. В основном работают при давлении между 1 и 100 бар, предпочтительно между 1 и 10 бар. При осуществлении реакции вводят на 1 моль соединениядо 15 молей, предпочтительно от 1 до 6 моль соединения . Свободные аминогруппы могут быть во время взаимодействия защищены подходящей защитной группой, например трет.-бутоксикарбонильным остатком, и по окончанию реакции опять освобождены обработкой подходящей кислотой, например хлористоводородной или трифторуксусной. Согласно изобретению, эфиры могут быть получены взаимодействием щелочной соли соответствующей кислоты, которая при необходимости может быть защищена у атома азота защитной группой, такой как трет.-бутоксикарбонильный остаток, с подходящими производными галогеналкила в растворителе, таком как диметилформамид, диметилацетамид, -метилпирролидон, диметилсульфоксид или тетраметилмочевина при температуре от около 0 до 100 С, предпочтительно от 0 до 50 С. Получение кислотноаддитивной соли предложенных соединений протекает обычным образом, например растворением бетаина в достаточном количестве водной кислоты и осаждением соли смешивающимся с водой органическим растворителем, таким как метанол, этанол, ацетон, ацетонитрил. Можно также нагревать эквивалентные количества бетаина и кислоты в воде или спирте, таком как монометиловый эфир гликоля, и затем упаривать досуха, или отфильтровывать выпавшую соль. Физиологически переносимыми солями являются, например, соли соляной кислоты, серной кислоты, уксусной кислоты, гликолевой кислоты, молочной кислоты, янтарной кислоты, лимонной кислоты, винной кислоты, метансульфокислоты, 4 толуолсульфокислоты, галактуроновой кислоты, эмбоновой кислоты, глютамиловой кислоты или аспарагиновой кислоты. Щелочные и щелочноземельные соли кислот, согласно изобретению, получают, например, растворением бетаина в недостаточном количестве основания щелочного или щелочноземельного металла, фильтрацией растворившегося бетаина и упариванием фильтрата досуха. Фармацевтически применимыми являются соли натрия, калия или кальция. Взаимодействием щелочной или щелочноземельной соли с подходящей солью серебра, как нитрат серебра, получают соответствующие соли серебра. Ниже приведенные примеры поясняют получение промежуточных соединений для получения производных хинолонкарбоновой кислоты общей формулы . Пример 1. Этиловый эфир 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8-винил-3-хинолинкарбоновой кислоты. 3,72 г этилового эфира 8-бром-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 4,4 г трибутилвинилстаннана и 0,46 г тетракис(трифенилфосфин)палладия(0) кипятят с обратным холодильником в 40 мл абсолютного толуола в течение 2-3 ч в атмосфере азота. В горячем состоянии фильтруют, выпавший при комнатной температуре продукт отфильтровывают, промывают толуолом и сушат. 14 4058 1 Получают 2,55 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8-винил-3 хинолинкарбоновой кислоты (79 от теории) Т. пл. 178-179 С. Пример 2. 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8-винил-3-хинолинкарбоновая кислота. 0,9 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8-винил-3-хинолинкарбоновой кислоты нагревают с обратным холодильником в течение 4 ч в смеси из 8 мл ледяной уксусной кислоты, 0,6 мл воды и 0,2 мл концентрированной серной кислоты. Реакционную смесь обрабатывают при температуре кипения 10 мл воды. Твердое вещество отфильтровывают при комнатной температуре, промывают водой и сушат. Получают 0,58 г 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8-винил-3-хинолинкарбоновой кислоты(71 от теории). Т. пл. 182-184 С. Пример 3. Этиловый эфир 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(триметилсилил-этинил)-4-оксо-3-хинолинкарбоновой кислоты. 22,2 г этилового эфира 8-бром-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 30,2 г трибутилстаннил-триметилсилил-ацетилена и 3,48 г тетракис(трифенилфосфин)палладия(0) кипятят с обратным холодильником в течение 3 ч в 300 мл абсолютного толуола в атмосфере азота. После охлаждения до приблизительно -18 С реакционную смесь фильтруют, твердое вещество промывают толуолом и сушат. Получают 18,3 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(триметилсилил-этинил)4-оксо-3-хинолинкарбоновой кислоты (80 от теории). Т. пл. 171172 С. Пример 4. Этиловый эфир 1-циклопропил-8-этинил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. 18,8 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(триметилсилил-этинил)-4-оксо-3 хинолинкарбоновой кислоты и 9,7 г фторида калия размешивают в смеси из 300 мл диметилформамида, 200 мл хлороформа и 15 мл воды в течение 3 ч при комнатной температуре. Затем фильтруют, фильтрат разбавляют 120 мл воды и подкисляют разбавленной водной соляной кислотой. После встряхивания с хлороформом органические фазы сушат над сульфатом натрия и сгущают. Полученный остаток перекристаллизовывают из метанола. Получают 9 г этилового эфира 1-циклопропил-8-этинил-6,7-дифтор-1,4-дигидро-4-оксо-3 хинолинкарбоновой кислоты (59 от теории). Т. пл. 186187 С. Пример 5. 1-циклопропил-8-этинил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота. 10,3 г этилового эфира 1-циклопропил-8-этинил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты кипятят с обратным холодильником в смеси из 100 мл ледяной уксусной кислоты, 8 мл воды и 3 мл концентрированной серной кислоты в течение 4 ч. После охлаждения до комнатной температуры отфильтровывают твердое вещество, промывают водой и сушат. Получают 5,7 г 1-циклопропил-8-этинил-6,7 дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты (67 от теории). Т. пл. 233 С. Пример 6. Этиловый эфир 1-циклопропил-6,7-дифтор-8-(1-гексинил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. 1,9 г этилового эфира 8-бром-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 3,5 г 1-трибутилстаннил-гекс-1-ина и 0,29 г тетракис(трифенилфосфин)-палладия(0) кипятят с обратным холодильником в 20 мл абсолютного толуола в течение 3 ч в атмосфере азота. Реакционную смесь сгущают, остаток перемешивают с 30 мл гексана и полученное твердое вещество перекристаллизовывают из циклогексана. Получают 0,7 г этилового эфира 1-циклопропил-6,7-дифтор-8-(1-гексинил)-1,4-дигидро-4-оксо 3-хинолинкарбоновой кислоты (36 от теории). 1 Н-ЯМР (200 МГц, 3)0,95 (т 3 Н), 1,1-1,7 (м 11 Н), 2,50 (т 2 Н), 4,1-4,3 (м 1,4 Н), 4,38 (кв 2 Н). 8,14 (дд 1 Н) части/мил. Пример 7. 1-циклопропил-6,7-дифтор-8-(1-гексинил)-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота. 0,7 г этилового эфира 1-циклопропил-6,7-дифтор-8-(1-гексинил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты кипятят с обратным холодильником в смеси из 6 мл ледяной уксусной кислоты, 0,5 мл воды и 0,1 мл концентрированной серной кислоты в течение 3 ч. После разбавления реакционной смеси 100 мл воды отфильтровывают твердое вещество и сушат. Получают 0,5 г 1-циклопропил-6,7-дифтор-8-(1 гексинил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты (85 от теории). Т. пл. 118 - 121 С. 1 Н-ЯМР (200 МГц, СС 3)0,96 (т 3 Н), 1,1-1,7 (м 8 Н), 4,3-4,5 (м 1 Н), 8,20 (дд 11 Н), 8,85 (с 1 Н) части/мил. Пример 8. Этиловый эфир 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(3,3-диметилибутин-1-ил)-4-оксо-3-хинолинкарбоновой кислоты. 4058 1 Повторяют пример 6 с той разницей, что применяют 1-трибутилстаннил-3,3-диметил-бут-1-ин. При этом получают 0,87 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(3,3-диметилбутин-1-ил)-4-оксо 3-хинолинкарбоновой кислоты (46 от теории). Т. пл. 170-172 С. Пример 9. 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(3,3-диметилбутин-1-ил)-4-оксо-3-хинолинкарбоновая кислота. Омыление 0,75 г эфира по примеру 8 проводят аналогично примеру 7 и получают 0,56 г 1-циклопропил 6,7-дифтор-1,4-дигидро-8-(3,3-диметилбутин-1-ил)-4-оксо-3-хинолинкарбоновой кислоты (81 от теории). Т. пл. 199-201 С. Пример 10. Этиловый эфир 1-(2,4-дифторфенил)-6,7-дифтор-1,4-дигидро-8-(триметилсилилэтинил)-4-оксо-3 хинолинкарбоновой кислоты. 6,7 г этилового эфира 8-бром-1-(2,4-дифторфенил)-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты (пример 20), 10,8 г трибутилстаннил-триметилсилил-ацетилена и 0,87 г тетракис(трифенилфосфин)палладия(0) нагревают до кипения в 50 мл абсолютного толуола в течение 24 ч в атмосфере азота. При 18 С продукт выкристаллизовывается из реакционной смеси. Получают 4,8 г этилового эфира 1-(2,4 дифторфенил)-6,7-дифтор-1,4-дигидро-8-(триметилсилилэтинил)-4-оксо-3-хинолинкарбоновой кислоты(69 от теории). Т. пл. 173-174 С. Пример 11. Этиловый эфир 1-(2,4-дифторфенил)-8-этинил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Раствор 4,6 г этилового эфира 1-(2,4-дифторфенил)-6,7-дифтор-1,4-дигидро-8-(триметилсилилэтинил)-4 оксо-3-хинолиновой кислоты в 20 мл хлороформа прикапывают при комнатной температуре к раствору 2 г фторида калия в смеси растворителей из 3 мл воды 25 мл хлороформа и 50 мл диметилформамида. Перемешивают в течение 1 ч при 20 С, затем реакционную смесь обрабатывают дополнительно хлороформом,многократно встряхивают с водой, органическую фазу сушат и сгущают. Полученный остаток перекристаллизовывают из метанола. Получают 3,4 г этилового эфира 1-2,4-дифторфенил-8-этинил-6,7-дифтор-1,4 дигидро-4-оксо-3-хинолинкарбоновой кислоты (87 от теории). Т. пл. 189 С. Пример 12. 1-(2,4-дифторфенил)-8-этинил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота. 1,17 г этилового эфира 1-(2,4-дифторфенил)-8-этинил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты кипятят с обратным холодильником в смеси из 9 мл ледяной уксусной кислоты, 0,75 мл воды и 0,2 мл концентрированной серной кислоты в течение 1 часа. Выкристаллизовавшееся при комнатной температуре твердое вещество отфильтровывают и сушат. Получают 0,98 г 1-(2,4-дифторфенил)-8-этинил 6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты (90 от теории). Т. пл. 220 С (с разл.). Пример 13. Этиловый эфир 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8-(пропин-1-ил)-3-хинолинкарбоновой кислоты. 7,5 г этилового эфира 8-бром-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 9,1 г 1-трибутилстаннил-проп-1-ина и 1,16 г тетракис(трифенилфосфин)-палладия(0) кипятят с обратным холодильником в 80 мл абсолютного толуола в течение 8 ч. Выкристаллизовавшееся при -18 С твердое вещество отфильтровывают и сушат. Получают 2,05 г этилового эфира 1-циклопропил-6,7-дифтор-1,4 дигидро-4-оксо-8-(пропин-1-ил)-3-хинолинкарбоновой кислоты (31 от теории). Т пл. 180-182 С. 1 Н-ЯМР (200 МГц, 3)1,1-1,35 (м 4 Н), 1,40 (т 3 Н), 2,16 (д 3 Н), 4,1-4,3 (м 1 Н), 4,35 (кв 2 Н),8,15 (с 1 Н) части/мил. Пример 14. 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8(пропин-1-ил)-3-хинолинкарбоновая кислота. 1,4 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8-(пропин-1-ил)-3-хинолинкарбоновой кислоты кипятят с обратным холодильником в смеси из 20 мл ледяной уксусной кислоты 1,5 мл воды и 0,5 мл концентрированной серной кислоты в течение 1 ч. После разбавления 10 мл воды отфильтровывают выпавший продукт и сушат. Получают 1,05 г 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8(пропин-1-ил)-3-хинолинкарбоновой кислоты (82 от теории). Т. пл. 212-213 С. 1 Н-ЯМР (200 МГц, С 3)1,4 (м 4 Н), 2,26 (д 3 Н), 4,4-4,6 (м 1 Н), 8,16 (дд 1 Н), 8,81 (с 1 Н) части/мил. Пример 15. Этиловый эфир 1-этил-6,7-дифтор-1,2-дигидро-8-(триметилсилил-этинил)-4-оксо-3-хинолинкарбоновой кислоты. 5,4 г этилового эфира 8-бром-1-этил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты (пример 22), 10,8 г трибутилстаннил-триметилсилил-ацетилена и 0,87 г тетракис(трифенилфосфин)палладия(0) 16 4058 1 кипятят с обратным холодильником в 50 мл абсолютного толуола в атмосфере азота в течение 24 ч. Полученное твердое вещество отфильтровывают и сушат. Получают 4,53 г этилового эфира 1-этил-6,7-дифтор 1,4-дигидро-8-(триметилсилил-этинил)-4-оксо-3-хинолинкарбоновой кислоты (80 от теории). Т. ил. 151152 С. Пример 16. Этиловый эфир 1-циклопропил-6,7-дифтор-1,4-дигидро-8-триметилсилил-этинил)-4-оксо-3-хинолинкарбоновой кислоты. 1,64 г этилового эфира 8-хлор-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 3 г трибутилстаннил-триметилсилил-ацетилена и 0,29 г тетракис(трифенилфосфин)-палладия(0) кипятят с обратным холодильником в 20 мл абсолютного толуола в течение 42 ч в атмосфере азота. Реакционную смесь охлаждают до -18 С и фильтруют. После высушивания отфильтрованного остатка получают 0,74 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(триметилсилил-этинил)-4-оксо-3-хинолинкарбоновой кислоты (38 от теории). Пример 17. Этиловый эфир 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(3-метил-бут-3-ен-1-инил)-4-оксо-3-хинолинкарбоновой кислоты. 1,86 г этилового эфира 8-бром-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 2,8 г трибутилстаннил-3-метил-бут-3-ен-1-ина и 0,29 г тетеракис(трифенилфосфин)-палладия(0) кипятят с обратным холодильником в 20 мл абсолютного толуола в течение 6 ч в атмосфере азота. Реакционную смесь фильтруют в горячем состоянии, сгущают и остаток перемешивают с гексаном. После фильтрования и сушки получают 1,43 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(3-метилбут-3-ен-1-инил)-4-оксо-3-хинолинкарбоновой кислоты (80 от теории). Т. пл. 169-171 С. Пример 18. 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(3-метил-бут-3-ен-1-инил)-4-оксо-3-хинолинкарбоновая кислота. 0,715 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(3-метил-бут-3-ен-1-инил)-4-оксо-3 хинолинкарбоновой кислоты кипятят с обратным холодильником в смеси из 10 мл ледяной уксусной кислоты,0,5 мл воды и 0,2 мл концентрированной серной кислоты в течение 1,5 ч. Реакционную смесь выливают в 100 мл воды. Выпавшее твердое вещество отфильтровывают, промывают водой и сушат. Получают 0,53 г 1 циклопропил-6,7-дифтор-1,4-дигидро-8-(3-метил-бут-3-ен-1-инил)-4-оксо-3-хинолонкарбоновой кислоты (80 от теории). Т. пл. 204-206 С. Пример 19. Этиловый эфир 2-(3-бром-2,4,5-трифторбензоил)-3-(2,4-дифторфениламино)-акриловой кислоты. 40 г (0,1 моль) этилового эфира 2-(3-бром-2,4,5-трифторбензоил)-3-этоксиакриловой кислоты подвергают взаимодействию с 14,5 г (0,11 моль) 2,4-дифтор-анилина в 180 мл этанола при охлаждении льдом. Смесь выдерживают в течение ночи при 10 С, отфильтровывают выпавший осадок, промывают холодным этанолом и сушат в вакууме. Выход 38 г (81 от теории). Т. пл. 102-103 С (с разл.) из изопропанола. Пример 20. Этиловый эфир 1-(2,4-дифторфенил)-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. 38 г (82 ммоль) этилового эфира 2-(3-бром-2,4,5-трифторбензоил)-3-(2,4-дифторфениламино)-акриловой кислоты обрабатывают 7,6 г фторида натрия в 200 мл диметилформамида и кипятят с обратным холодильником в течение 2 ч. Смесь выливают в ледяную воду, осадок отфильтровывают, хорошо промывают водой и сушат при температуре 180 С в камерной сушилке с циркуляцией воздуха. Выход 34,7 г (95 от теории). Т. пл. 208-210 С (с разл.) из монометилового эфира гликоля. Кислым омылением этого эфира получают 8-бром-1-(2,4-дифторфенил)-6,7-дифтор-1,4-дигидро-4-оксо-3 хинолинкарбоновую кислоту с т. пл. 210-211 С (с разл.). Пример 21. Этиловый эфир 2-(3-бром-2,4,5-трифторбензоил)-3-этиламино-акриловой кислоты. 20 г (0,05 моль) этилового эфира 2-(3-бром-2,4,5-трифторбензоил)-3-этоксиакриловой кислоты обрабатывают в 40 мл этанола при охлаждении льдом 5,5 г 50 водного раствора этиламина. Оставляют на ночь при 10 С, обрабатывают суспензию 200 мл воды, отфильтровывают выпавший осадок, промывают водой и сушат при 60 С в вакууме. Выход 17,3 г (91 от теории). Т. пл. 101-102 С (с разл.) из изопропанола. Пример 22. Этиловый эфир 8-бром-1-этил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Повторяют пример 20, используя 16 г (42 ммоль) этилового эфира 2-(3-бром-2,4,5-трифторбензоил)-3 этиламино-акриловой кислоты. Выход 14,6 г (96 от теории). Т. пл. 172-173 С (с разл.) из монометилового эфира гликоля. Кислым омылением получают из этого эфира 8-бром-1-этил-6,7-дифтор-1,4-дигидро-4-оксо-3 хинолинкарбоновую кислоту с т. пл. 215-217 С (с разл.). 17 4058 1 Пример 23. 4-метиламино-1,3,3 а,4,7,7 а-гексагидроизоиндола. Метод 14,4 г (60 ммоль) 70 -го 1-(трет.-бутилоксикарбонил-амино)-1,3-бутадиена в виде раствора в 30 мл абсолютного тетрагидрофурана прикапывают к 10,1 г (60 ммоль) -триметилсилил-малеинимида в 30 мл абсолютного тетрагидрофурана. После окончания экзотермической реакции кипятят еще один час с обратным холодильником. Охлажденную смесь прикапывают в атмосфере азота к 7,6 г (0,2 моль) литийалюминийгидрида в 200 мл абсолютного тетрагидрофурана. Затем кипятят в течение 14 ч с обратным холодильником. К охлажденной реакционной смеси прикапывают последовательно 7,6 г воды в 23 мл тетрагидрофурана, 7,6 г 10 -ной натриевой щелочи и 22,8 г воды. Соли отфильтровывают, и фильтрат сгущают в вакууме. Остаток(10,3 г) перегоняют при 87 С/0,8 мбар. Дистиллят помещают в 80 мл абсолютного пентана, фильтруют, и продукт кристаллизуют при охлаждении до -70 С. Выход 3,3 г Т. пл. 72-82 С. Обработкой эквимолярным количеством 2 н. соляной кислоты получают 4-метиламино-1,3,3 а,4,7,7 агексагидроизоиндол-дигидрохлорид с т. пл. 265-268 С (из метанола). Метода) 4-(трет.-бутилоксикарбониламино)-1,3-диоксо-1,3,3 а,4,7,7 а-гексагидроизоиндол. 48,0 г (0,5 моль) мелеинимида растворяют в 200 мл абсолютного тетрагидрофурана и прикапывают 120 г(0,5 моль) приблизительно 70 -ного 1-(трет.-бутилоксикарбониламино)-1,3-бутадиена в виде раствора в 500 мл абсолютного тетрагидрофурана, при этом температуру поддерживают в пределах 20-30 С. В течение ночи перемешивают при комнатной температуре, затем сгущают и перекристаллизовывают из этилацетата. Получают 57 г продукта с т. пл. 177-182 С. Из маточника дополнительно получают 13 г с т. пл. 158-160 С. б) 4-метиламино-1,3,3 а,4,7,7 а-гексагидроизоиндол. 27,1 г (0,71 моль) литийалюминийгидрида вносят в атмосфере азота в 30 мл абсолютного тетрагидрофурана и прикапывают раствор 57 г (0,21 моль) 4-(трет.-бутилоксикарбониламино)-1,3-диоксо-1,3,3 а,4,7,7 агексагидроизоиндола в 570 мл абсолютного тетрагидрофурана. Затем кипятят в течение ночи с обратным холодильником. После охлаждения последовательно прикапывают 27,1 г воды в 82 мл тетрагидрофурана, 27,1 г 10 натриевой щелочи и 81,3 г воды. Соли отфильтровывают, промывают тетрагидрофураном и фильтрат сгущают в вакууме. Остаток перегоняют в глубоком вакууме. Выход 19.1 г. Пример 24. 4-амино-1,3,3 а,4,7,7 а-гексагидроизоиндол. 13,3 г (50 ммоль) 4-трет.-бутилоксикарбониламино-1,3-диоксо-1,3,3 а,4,7,7 а-гексагидроизоиндола (из примера 23, метод ) перемешивают в 166 мл трифторуксусной кислоты в течение ночи при комнатной температуре. Затем отгоняют при 10 мбар трифторуксусную кислоту и остаток отделяют в глубоком вакууме от остатков кислоты. Затем помещают в абсолютный тетрагидрофуран и прикапывают в атмосфере азота к раствору 11,3 (0,3 моль) литийалюминийгидрида в 300 мл абсолютного тетрагидрофурана. Затем кипятят в течение 16 ч с обратным холодильником. После охлаждения последовательно прикапывают 11,3 г воды в 34 мл тетрагидрофурана, 11,3 10 натриевой щелочи и 34 мл воды. Осадок отфильтровывают и промывают тетрагидрофураном. Фильтрат сгущают и остаток перегоняют. Выход 2,2 г, содержание 92(определен хроматографически). Т. пл. 70 С/0,2 мбар. Пример 25. 7-метил-4-метиламино-1,3,3 а,4,7,7 а-гексагидроизоиндол. Аналогично примеру 23, метод , 21,9 г (0,12 моль) 1-(трет.-бутилоксикарбониламино)-1,2-пентадиена подвергают взаимодействию с 20,3 г (0,12 моль) -триметилсилил-малеинимида и затем восстанавливают 15,2 г (0,4 моль) литийалюминийгидридом. Сырой продукт перекристаллизовывают из тетрагидрофурана. Выход 6,2 г. Т. пл. 106-108 С. Пример 26. 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(3-метоксипропин-1-ил)-4-оксо-3-хинолинкарбоновая кислота. А) 1,86 г (5 ммоль) этилового эфира 8-бром-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3 хинолинкарбоновой кислоты подвергают взаимодействию в 20 мл абсолютного толуола с 2,5 г (7 ммоль) 1 трибутилстаннил-3-метоксипропина и 0,29 г (соотв. 5 мольн. ) тетракис-(трифенилфосфоний)-палладия(0) и кипятят в течение 4 часов с обратным холодильником в атмосфере азота. Реакционную смесь сгущают, остаток перемешивают с гексаном, твердое вещество отфильтровывают и очищают хроматографически на силикагеле. Выход 0,74 г (41 от теории) этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(3 метоксипропин-1-ил)-4-оксо-3-хинолинкарбоновой кислоты. Т. пл. 144-146 С. Б) 0,36 г (1 ммоль) продукта со стадии А кипятят с обратным холодильником в смеси из 3 мл ледяной уксусной кислоты, 0,2 мл воды и 0,05 мл концентрированной серной кислоты в течение 1 ч. Смесь выливают в воду, осадок отфильтровывают и перекристаллизовывают из этанола. Выход 153 мг (46 от теории) 1 циклопропил-6,7-дифтор-1,4-дигидро-8-(3-метоксипропин-1-ил)-4-оксо-3-хинолинкарбоновой кислоты. Т. пл. 170-172 С.(т 1 Н), 8,37 (с 1 Н) части/мил. Нижеследующие примеры поясняют получение производных хинолонкарбоновой кислоты общей формулыПример 27.) 2,32 г (8 ммоль) 1-циклопропил-8-этинил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты кипятят с обратным холодильником в смеси из 60 мл ацетонитрила и 30 мл диметилформамида с 0,92 г (8 ммоль) 1,4-диазабицикло 2.2.2-октана и 1,2 г (12 ммоль) -метилпиперазина в течение 1 ч. Суспензию сгущают, остаток перемешивают с ацетонитрилом, отфильтровывают нерастворившиеся кристаллы и сушат. Выход 1,83 г (62 от теории) 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4-метил-1-пиперазинил)-4 оксо-3-хинолинкарбоновой кислоты. Т. пл. 228-230 С (с разл.) 1 Н-ЯМР (6-)4,95 части/мил, (с -СС-Н). Б) Аналогично получают с 2-метилпиперазином 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(3-метил 1-пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту. 1 Н-ЯМР (6-)5,03 части/мил, (с -СС-Н). Масс-спектр м/е 369 (М, 325 (М-С 2), 300, 293, 269, 244, 44 (С 2). Аналогично примеру 27 получают из продуктов по примерам 14, 7 и 9 соединения общей формулы.(18 ммоль) 3-(2,2 диметилпропилиденамино)пирролидина кипятят с обратным холодильником в смеси из 120 мл ацетонитрила и 60 мл диметилформамида в течение 1 ч. Раствор сгущают, остаток перемешивают с 100 мл воды (рН 7),осадок отфильтровывают, промывают водой и затем для полного отщепления защитной группы суспендируют в 50 мл воды и обрабатывают в течение 1 ч в ультразвуковой ванне. Затем фильтруют, промывают водой и сушат в вакууме при температуре 80 С. Выход 3,8 г (82 от теории) гидрата 7-(3-амино-1 пирролидинил)-1-циклопропил-8-этинил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Т. пл. 193-196 С (с разл.) Пример 33.СО-О-С(СН 3)3 ВНС 3 СООН . А) Повторяют пример 27, используя 3-трет.-бутоксикарбонил-амино-3-метил-пирролидин. При этом получают 7-(3-трет.-бутоксикарбонил-амино-3-метил-1-пирролидинил)-1-циклопропил-8-этинил-б-фтор-1,4 дигидро-4-оксо-3-хинолинкарбоновую кислоту с т. пл. 244-246 С (с разд.). 1 Н-ЯМР (6-)4,92 части/мил. (с -СС-Н). Б) 500 мг продукта со стадии А растворяют в 5 мл трифторуксусной кислоты при охлаждении льдом, раствор сгущают в вакууме, остаток кристаллизуют путем трехкратного перемешивания с 1 мл этанола, соль отфильтровывают, промывают этанолом и сушат. Выход 270 г (52 от теории) триацетата 7-(3-амино-3 метил-1-пирролидинил)-1-циклопропил-8-этинил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Т. пл. 242-244 С (с разл. ). Пример 34. Повторяют пример 27, используя 2-окса-5,8-диазабицикло 4.3.0 нонан. При этом получают 1 циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(2-окса-5,8-диазабицикло 4,3,0 нон-8-ил)-4-оксо-3 хинолинкарбоновую кислоту с т. пл. 290 С (с разд.), спекается уже при 179 С. 1 Н-ЯМР (6-) 5,0 части/мил. (с -СС-Н). Пример 35. Повторяют пример 27, подвергая взаимодействию 2-оксо-5,3-диазабицикло 4.3.0 нонан с продуктом по примеру 14 с получением 1-циклопропил-6-фтор-1,4-дигидро-7-(2-оксо-5,8-диазабицикло 4.3.0 нон-8-ил)-3 хинолинкарбоновой кислоты с т. пл. 241-242 С (с разл.).) 303 мг (1 ммоль) продукта по примеру 14, 240 мг 3-трет.-бутоксикарбонил-амино-3 метилпирролидина и 134 мг (1,2 ммоль) 1,4-диазабицикло 2.2.2 октана нагревают с обратным холодильником в смеси из 6 мл ацетонитрила и 3 мл диметилформамида в течение 2 часов. Сгущают в вакууме, перемешивают с 30 мл воды и сушат при 80 С в вакууме. Выход 420 мг (87 от теории)7-(3-трет.бутилоксикарбонил-амино-3-метил-1-пирролидинил)-1-циклопропил-6-фтор-1,4-дигидро-4-оксо-8-(пропин 1-ил)-3-хинолинкарбоновой кислоты. Т. пл. 195-196 С (с разл.). 1 Н-ЯМР (6- )1,42 (с СН 3 у пирролидина), 2,21 части/мил. (с СН 3-СС-). Б) 180 мг продукта со стадии А растворяют при 0 С в 1,6 мл трифторуксусной кислоты и раствор сгущают спустя 1,25 ч. Остаток хроматографически очищают (силикагель, дихлорметанметан 17 водный аммиак 3081). Выделяют 10 мг 7-(3-амино-3-метил-1-пирролидинил)-1-циклопропил-6-фтор-1,4 дигидро-4-оксо-8-(пропин-1-ил)-3-хинолинкарбоновой кислоты с т. пл. 209-210 С (с разд.). Масс-спектр м/е (М), 309, 298, 267 (100 ), 133, 70. Пример 37. Повторяют пример 27, превращая продукт по примеру 12 с -метилпиперазином в 8-этинил-6-фтор-1(2,4-дифторфенил)-1,4-дигидро-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту с т. пл. 193-195 С (с разд.). 1 Н-ЯМР (3)3,35 части/мил. (с -СС-Н). Пример 38. Повторяют пример 27, используя 3-метил-3,3-диазабицикло 4.3.0 нонан. Полученную сырую 1 циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(3-метил-3,8-диазаби-цикло 4.3.0 нон-8-ил)-4-оксо-3 хинолинкарбоновую кислоту очищают хроматографически (силикагель, дихлорметанметан 20 водный аммиак 241). 1 Н-ЯМР (СС 13)4,15 части/мил. (с -СС-Н). Пример 39. Повторяют пример 27, используя 4-метиламино-1,3,3 а,4,7,7 а-гексагидроизоиндол. При этом получают 1 циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4-метиламино-1,3,3 а,4,7,7 а-гексагидроизоиндол-2-ил)-4 оксо-3-хинолинкарбоновую кислоту с т. пл. 128-133 С (с разл.). 1 Н-ЯМР (6-)4,93 части/мил. (с -СС-Н). Пример 41. 164 мг (0,5 ммоль) продукта по примеру 18 обрабатывают аналогично примеру 27 1-метилпиперазином. Получают 120 мг 1-циклопропил-6-фтор-1,4-дигидро-8-(3-метил-бут-3-ен-1-инил)-7-(4-метил-1-пиперазинид)-4-оксо-3-хинолинкарбоновой кислоты с т. пл. 195-197 С (с разд.), перекристаллизованной из монометилового эфира гликоля. 1 100 мг продукта по примеру 27 растворяют в 40 мл соляной кислоты и перемешивают 2 часа при 30 С. Получают суспензию, которую сгущают. Остаток перемешивают с небольшим количеством изопропанола. Осадок отфильтровывают, промывают изопропанолом и сушат в вакууме при 90 С. Выход 0,1 г (83 от теории) гидрохлорида 8-(1-хлоривинил)-1-циклопропил-6-фтор-1,4-дигидро-7-(4-метил-1-пиперазинил)-4 оксо-3-хинолонкарбоновой кислоты 1 А) 100 мг продукта по примеру 28 нагревают с 53 мл 4 н. соляной кислоты в течение 5 часов при 60 С. Смесь сгущают, остаток перемешивают с диэтиловым эфиром и сушат в вакууме при 70 С. Выход 90 мг гидрохлорида цис-транс-8-(1-хлор-1-пропенил)-1-циклопропил-6-фтор-1,4-дигидро-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновой кислоты. Т. пл. 236-237 С (с разл.). Масс-спектр м/е 419 (М), 71, 58 (100 ), 43, 36. 1 Н-ЯМР (6-ДМСО)8 б,12 кв и 6,35 кв (-ССН-СН 3 два сигнала для цис-транс-форм). Б) Аналогично с соединением по примеру 29 получают гидрохлорид цис-транс-8-(1-хлор-1-гексенил)-1 циклопропил-6-фтор-1,4-дигидро-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновой кислоты. Масс-спектр м/е 461 (М, 425 (М-НС), 71, 58 (100 ), 43, 36. Пример 46. 370 мг продукта по примеру 36 А растворяют в 9 мл полуконцентрированной соляной кислоты и раствор сгущают в глубоком вакууме. Выход 340 мг гидрохлорида цис-транс-7-(3-амино-3-метил-пирролидинил)-8(1-хлор-1-пропенил)-1-циклопропил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. 1 10 мг продукта по примеру 37 нагревают в 4,5 мл 2,5 н. соляной кислоты в течение 1 часа при 60 С. Смесь сгущают и получают гидрохлорид 8-(1-хлорвинил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-7-(4 метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновой кислоты. Масс-спектр м/е 477 (М), 442 (М-С), 36 (100 , ). Пример 48.. 291 мг (1 моль) продукта по примеру 2 в смеси из 20 мл ацетонитрила и 10 мл диметилформамида смешивают с (2,2 ммоль) 1,4-диазабицикло 2.2.2 октана и 360 мг (2,3 ммоль) 3-(2,2-диметил-пропилиденамино)-пирролидина и смесь кипятят с обратным холодильником в течение 32 ч. Сгущают, перемешивают темный маслянистый остаток с 10 мл воды и отфильтровывают выпавшее темное вещество (103 мг), очищают хроматографией (силикагель дихлорметанметанол 17 водной аммиак 3081). Выход 58 мг 145 мг (0,5 ммоль) продукта по примеру 2 в смеси из 10 мл ацетонитрила и 5 мл диметилформамида смешивают с 60 мг (0,54 ммоль) цис-2,8-диазабицикло-4.3.0 нонана и полученную смесь кипятят в течение 4 ч с обратным холодильником. Раствор сгущают, перемешивают с 5 мл воды и доводят разбавленной соляной кислотой до рН 7. Осадок отфильтровывают, промывают водой и сушат в вакууме при 90 С. Выход 120 мг (61 от теории) 1-циклопропил-7-(цис-2,8-диаза-бицикло 4.3.0 нон-8-ил)-6-фтор-1,4-дигидро-4 оксо-8-винил-3-хинилинкарбоновой кислоты. Т. пл. 205-207 С (с разл.). 1 Н-ЯМР (С 3 СОО)85.05 (д 1 Н). 5,7 (д 1 Н) (группа сигналов для -СНСН 2). Пример 50. Повторяют пример 27, используя продукт по примеру 26. Получают 1-циклопропил-6-фтор-1,4-дигидро 7-(4-метил-1-пиперазинил)-8-(3-метокси-пропин-1-ил)-4-оксо-3-хинолинкарбоновую кислоту с т. пл. 187189 С. 1 Н-ЯМР (3)8,95 (с 1 Н), 8,0 (д 1). 4,37 (с О-СН 2), 4,35 (м 1), 3,58 (м 4 Н), 3,43 (с О-СН 3),2,58 (м 4 Н), 2,38 (с -СН 3), 1,33 (м 2 Н), 1,02 части/мил. (м 2 Н). 24 Повторяют пример 27, используя 3,7-диазабицикло 3.3.0 октан. После хроматографии продукта реакции на силикагеле смесью дихлорметанметанол 17 -ный аммиак (3081) в качестве элюента получают 1 циклопропил-7-(3,7-диазабицикло 3.3.0 окт-3-ил)-8-этинил-6-фтор-1,4-дигидро-4-оксо-3 хинолинкарбоновую кислоту в виде застывшей пены. 1 Н-ЯМР (6-ДМСО)4,9 (с -ССН). Соединения, согласно изобретению, проявляют выраженную антибактериальную активность и при незначительной токсичности обладают широким спектром действия против граммположительных и граммотрицательных микроорганизмов, в частности против энтеробактерий прежде всего против таких, которые резистентны к различным антибиотикам, например пенициллину, цефалоспорину, аминогликозиду, сульфамиду,тетрациклину. Эти ценные свойства делают возможным их применение в медицине, а также в качестве консервантов неорганических и органических материалов, особенно органических материалов всех видов, например полимеров, смазочных средств, красок, волокон, кожи, бумаги и дерева, продуктов и воды. Соединения, согласно изобретению, активны по отношению к очень широкому спектру микроорганизмов. С их помощью борются с граммположительными и граммотрицательными микроорганизмами, а также используют для профилактики или лечат вызываемые этими возбудителями заболевания. Соединения, согласно изобретению, отличаются выраженной активностью по отношению к находящимся в состоянии покоя и резистентным микроорганизмам. На покоящиеся бактерии, т.е. на те, которые не проявляют заметного роста, соединения действуют при концентрации, значительно ниже половины концентрации известных соединений. Это относится не только к вводимым количествам, но также и к скорости умерщвления. Такие результаты наблюдаются для граммположительных и граммотрицательных бактерий, В частности для,,и. Соединения, согласно изобретению, проявляют неожиданное повышение активности также против бактерий, которые являются менее восприимчивыми к сравнительным средствам, в частности против резистентных,,и. Вследствие высокой активности против бактерий и бактериоподобных микроорганизмов соединения, согласно изобретению, хорошо подходят для профилактики и химиотерапии местных и системных инфекций в медицине и ветеринарии. Соединения пригодны также для борьбы против протозоонозом и гельминтозом. Предложенные соединения могут применяться в различных фармацевтических формах. Особенно предпочтительными являются таблетки, драже, капсулы, пилюли, гранулы, суппозитории, растворы, суспензии и эмульсии, пасты, мази, гели, кремы, лосьоны, пудра и спрей. Минимальная концентрация торможения (МКТ) определялась методом последовательного разбавления на агаре. Для каждого испытуемого вещества приготовляли ряд агаровых пластин, которые при двойном разбавлении имели уменьшающуюся концентрацию вещества. Агаровые пластины размещались в инокуляционном аппарате типа Денлей и прививались выращенными в течение ночи культурами возбудителей, которые были разбавлены настолько, чтобы каждая точка прививки содержала около 10 образующих колонию частиц. Привитые агаровые пластины инкубировали при 37 С и определяли рост зародышей спустя приблизительно 20 часов. Значение МКТ (г/мл) указывает самую низкую концентрацию активного вещества, при которой не наблюдается невооруженным глазом никакого роста. В нижеследующей таблице приведены значения МКТ соединений, согласно изобретению, в сравнении с торговым продуктом циплофлоксацином (1-циклопропил-6-фтор-1,4-дигидро-4-оксо-7-(1-пиперазинил)-3 хинолинкарбоновой кислотой (Европейский патент 0 176 846 В 1, С 07 С 101/34, 1986). Значение МКТ Соединения по примеру 32 34 35 40 41 Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66. 26
МПК / Метки
МПК: C07D 215/233, A61P 31/04, A61K 31/47
Метки: гидраты, кислоты, или, производные, приемлемые, отдельные, соли, смесь, хинолонкарбоновой, изомеров, изомеры, фармацевтически
Код ссылки
<a href="https://by.patents.su/26-4058-proizvodnye-hinolonkarbonovojj-kisloty-smes-ih-izomerov-ili-otdelnye-izomery-ih-farmacevticheski-priemlemye-gidraty-i-soli.html" rel="bookmark" title="База патентов Беларуси">Производные хинолонкарбоновой кислоты, смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли</a>
Предыдущий патент: Клеящий штифт и способ его получения
Следующий патент: Свертываемые жалюзи, используемые в качестве затемняющего экрана
Случайный патент: Смесь для комплексного диффузионного насыщения стальных деталей