Биологически активные полимерсвязанные антрациклины и способ их получения, производные антрациклина и способ их получения, фармацевтическая композиция
Номер патента: 3827
Опубликовано: 30.03.2001
Авторы: АНГЕЛУЧЧИ Франческо, СЮАРАТО Антонино, ГРАНДИ Мария
Текст
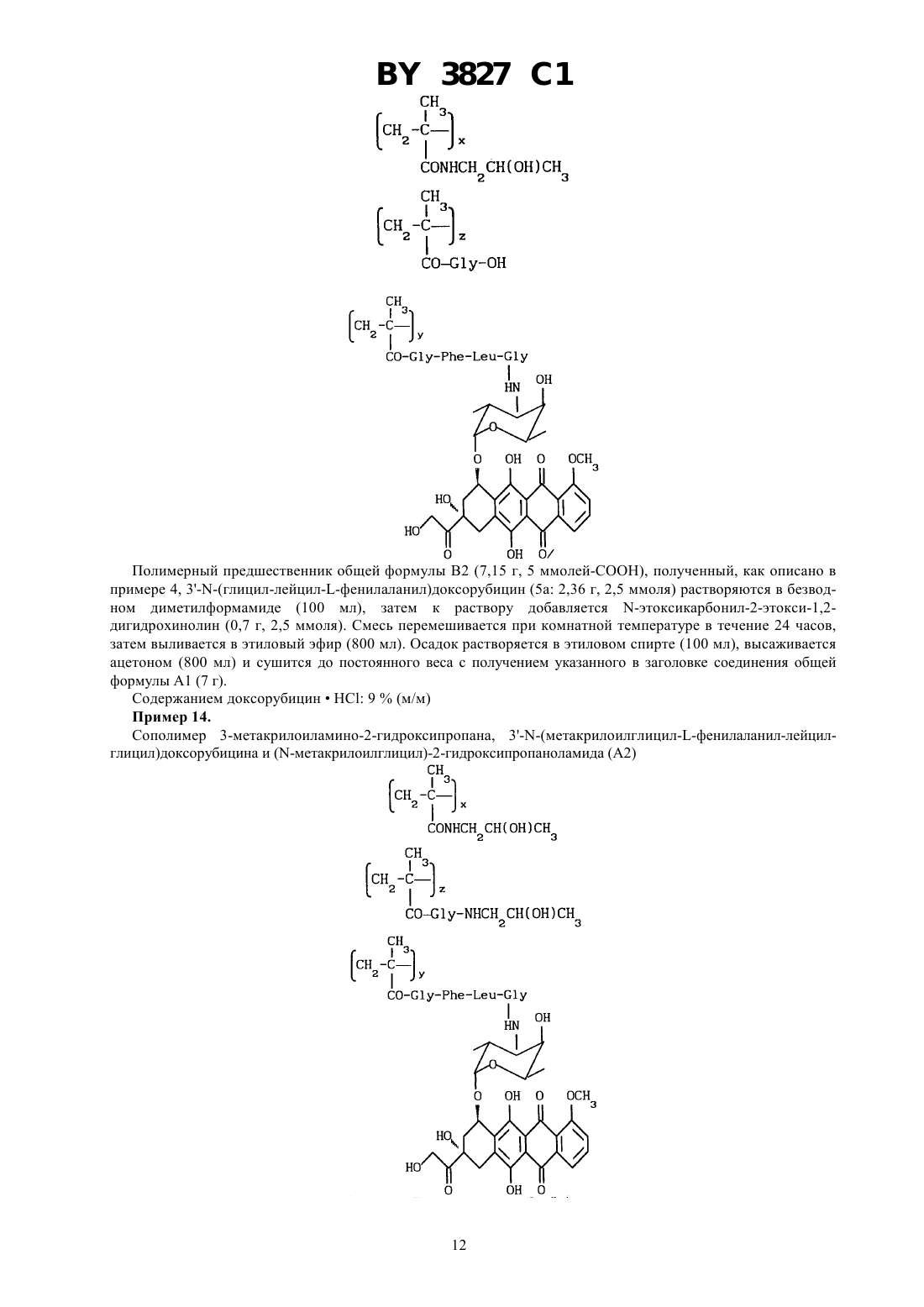
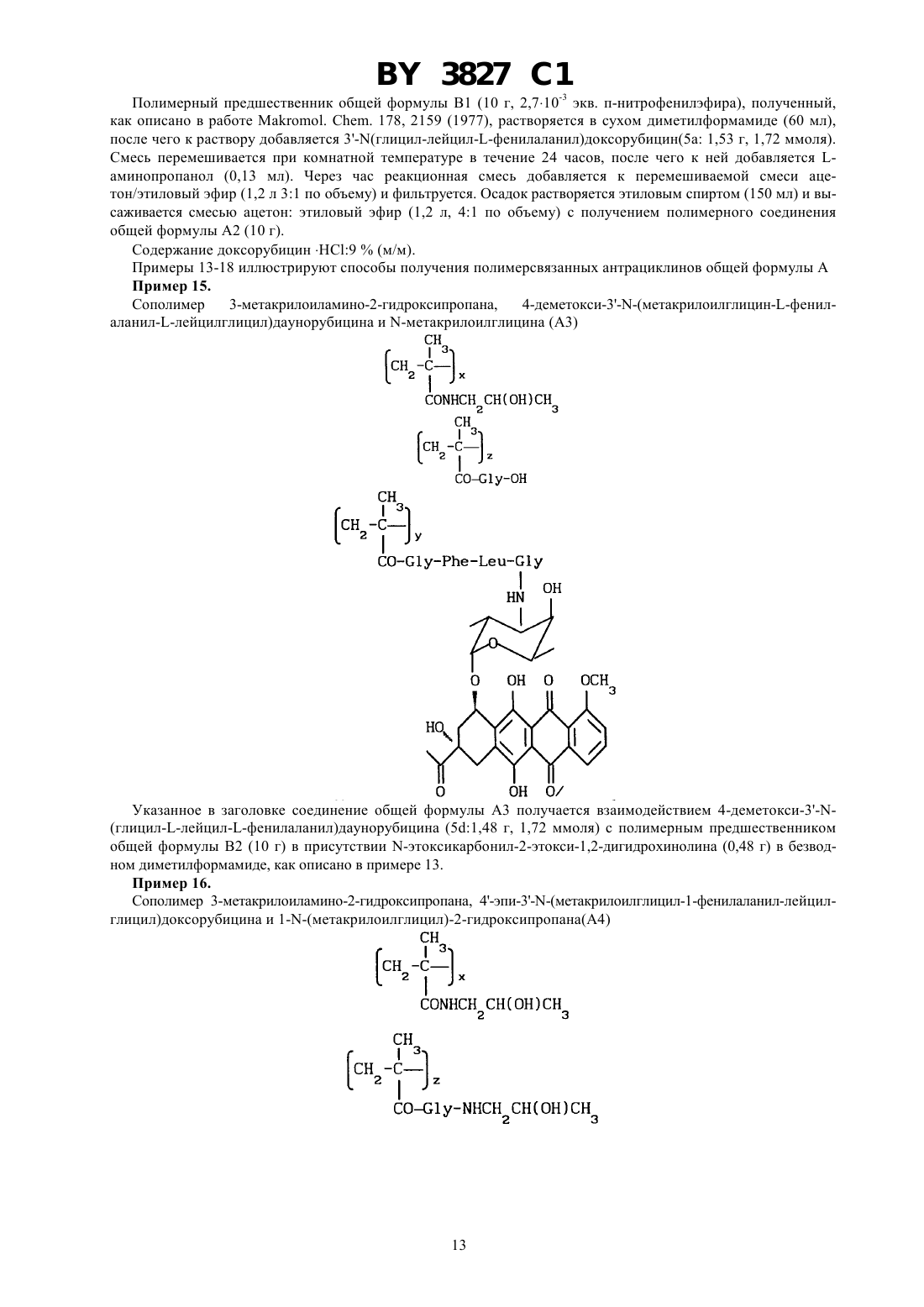
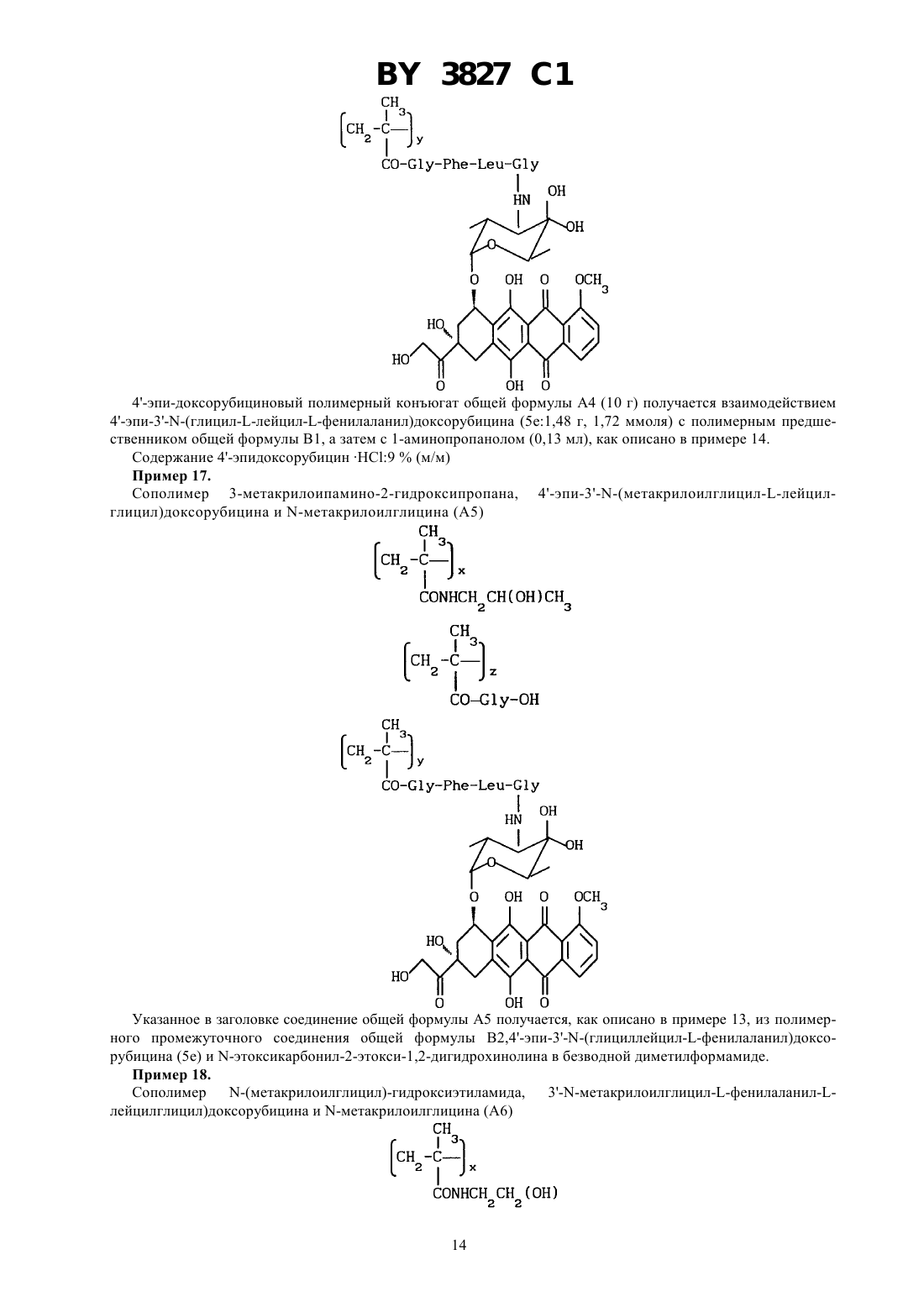
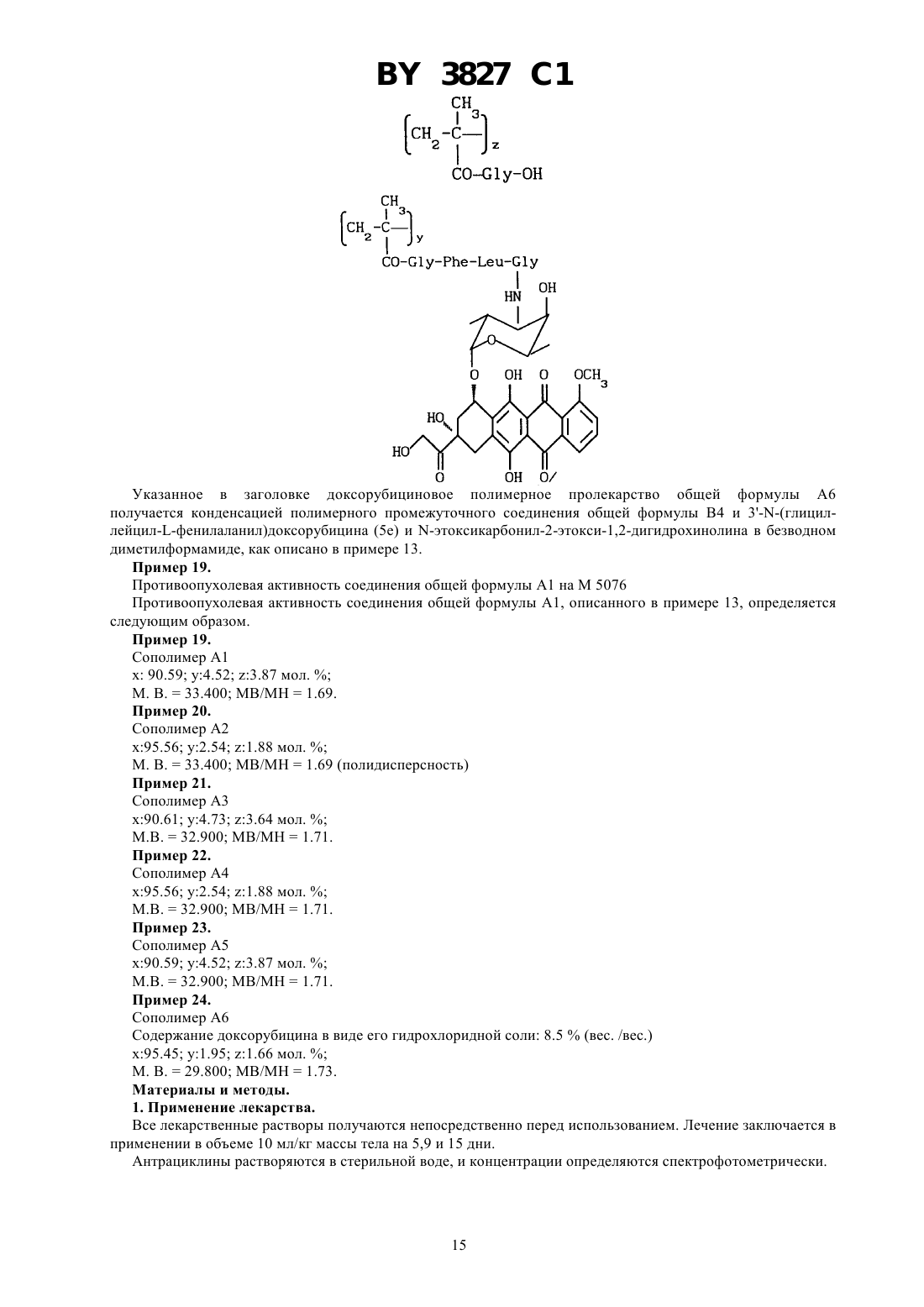
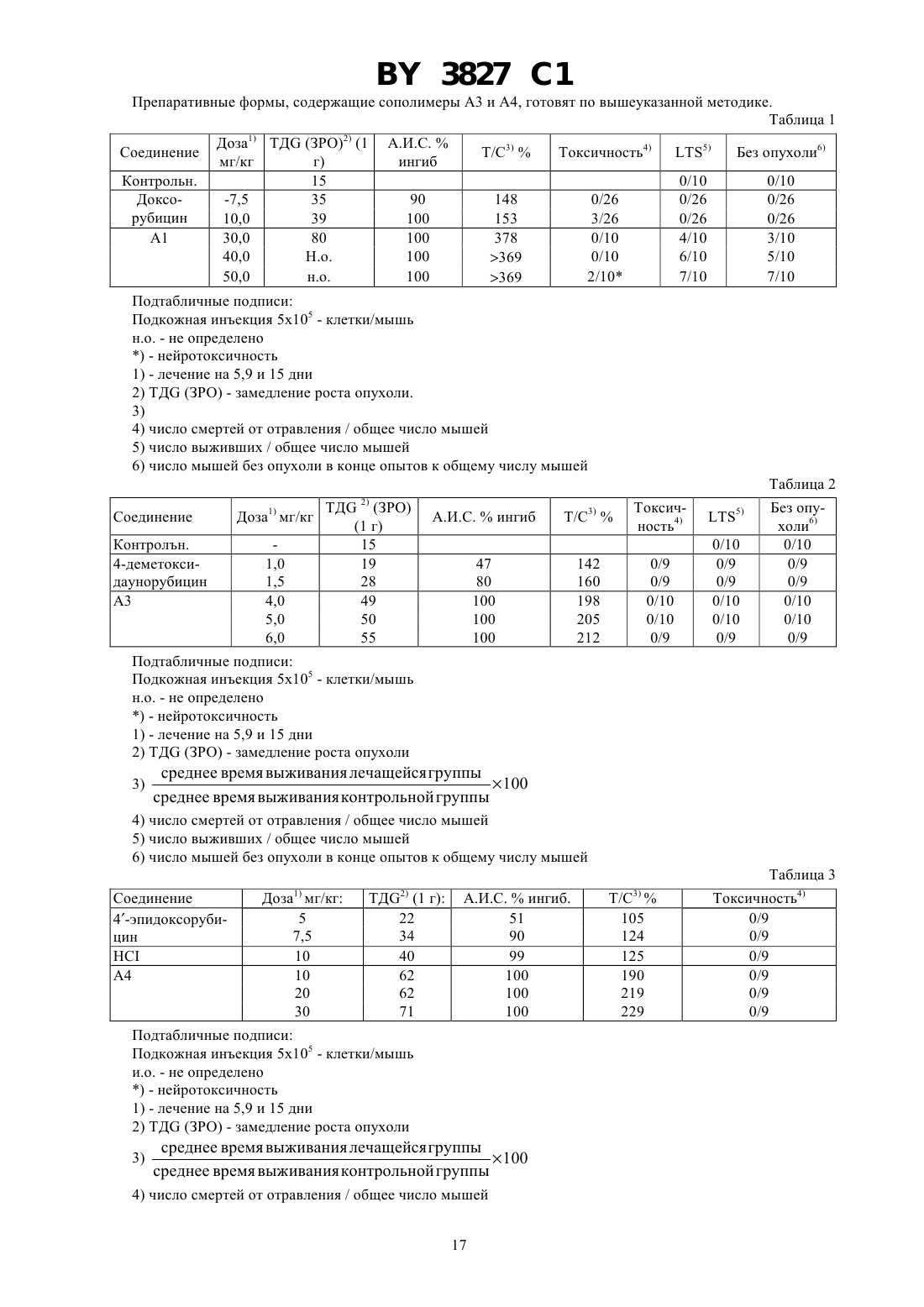
ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ БИОЛОГИЧЕСКИ АКТИВНЫЕ ПОЛИМЕРСВЯЗАННЫЕ АНТРАЦИКЛИНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОИЗВОДНЫЕ АНТРАЦИКЛИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ(71) Заявитель ФАРМАЦИЯ энд АПДЖОН С.п.А.(73) Патентообладатель ФАРМАЦИЯ энд АПДЖОН С.п.А.(57) 1. Биологически активные полимерсвязанные антрациклины, полученные взаимодействием, полимерного промежуточного соединения общей формулы (В) где 0 или 1 х составляет от 70 до 98 мол.составляет от 2 до 30 мол.1 - -СН 2 СН(ОН)СН 3 или -СН 2 СН 2 Н группа и 2 - 2,4-дихлорфенокси-, п-нитрофенокси- или гидроксигруппа с производными антрациклина общей формулы , где- пептидный спейсер, выбранный из , , , или - - остаток антрациклинаминогликозида формулы где один изиявляется водородом, а другой - гидроксигруппой или йодом, - водород или ОСН 3, - водород или гидроксигруппа 3827 1 в среде безводного полярного растворителя при 15-30 С в течение 8-24 ч, при этом если 2 является гидроксигруппой, в присутствии -этоксикарбонил-2-этокси-1,2-дигидрохинолина,и при необходимости с последующей обработкой полученных полимерсвязанных антрациклинов 2 гидроксипропиламином. 2. Полимерсвязанные антрациклины по п. 1, состоящие из единиц, представленных общими формулами, гдесоставляет от 1 до 29 мол. ,у составляет от 1 до 29 мол. , - гидроксигруппа или остаток формулы 1,1, ,иопределены в п. 1. 3. Полимерсвязанные антрациклины по п. 1, отличающиеся тем, что антрациклинаминогликозид формулыпо п. 1 представляет собой доксорубицин, 4-эпидоксорубицин, 4-деметоксидаунорубицин, идарубицин или 4-йод-4-дезоксидоксорубицин. 4. Полимерсвязанные антрациклины по п. 2, отличающиеся тем, что х составляет от 90 до 98 мол. , у составляет от 1 до 10 мол. , асоставляет от 1 до 10 мол. . 5. Способ получения полимерсвязанных антрациклинов по п. 1, включающий взаимодействие полимерного промежуточного соединения общей формулы (В) где х, , , 1 и 2 определены в п. 1,с производными антрациклина общей формулы , гдеи - определены в п. 1,в среде безводного полярного растворителя при 15-30 С в течение 8-24 часов,при этом если 2 является гидроксигруппой, в присутствии -этоксикарбонил-2-этокси-1,2 дигидрохинолина,и при необходимости, с последующей обработкой полученных полимерсвязанных антрациклинов 2 гидроксипропиламином. 6. Производные антрациклина общей формулы , гдеи - определены в п. 1. 7. Способ получения производных антрациклина общей формулы , гдеи - определены в п. 1,включающий взаимодействие -защищенного пептида общей формулы 2 3 ,где 3 является тритилом Р является п-нитрофеноксигруппойопределен в п. 1,с антрациклинаминогликозидом 2- общей формулыпо п. 1 с получением промежуточного соединения общей формулы 3 , где 3 является тритилом, и - определены в п. 1,с последующим удалением защитной группы 3. 8. Фармацевтическая композиция, обладающая противоопухолевой активностью, содержащая активное начало и фармацевтически приемлемый разбавитель или носитель, отличающаяся тем, что в качестве активного начала содержит соединение по одному из пп. 1-4, 6 в эффективном количестве.(56)1590045 3, 1990.2024483 С 1,1994.0298385 2, 1989.0392487 2, 1990.92/10212. Настоящее изобретение относится к растворимым синтетическим полимерсвязанным антрациклинам, их получению и к содержащим их фармацевтическим композициям. Доксорубицин, 4-эпидоксирубицин и 4-деметоксидаунорубицин являются примерами антрациклинов,которые известны в науке и которые в настоящее время используются для клинического лечения злокачественных опухолей смотри, например, Аркамон А., Доксорубицин,. Т. 17, , 1981. Получены многие полимерные производные доксорубицина, наделенные противоопухолевой активностью. Среди них наиболее перспективным для клинического применения является растворимый полимерсвязанный доксорубицин, который состоит из гидрофильных остатков и пептидных цепей, с которыми связаны доксорубицин и 2-гидроксипропиламин. Это производное полимерсвязанного доксорубицина получается конденсацией гидрохлорида доксорубицина с метакриловым полимерным предшественником, содержащим пептидные цепи, активированного как п-нитрофениловый эфир, в диметилсульфоксиде в присутствии триэтиламина, с последующим аминолизом оставшихся эфирных групп 1-амино-2-гидроксипропаном. Инкубация этого материала с лизосомными энзимами (тритосомами) крыс разрывает амидную связь между концевой аминокислотой и доксорубицином Копечек Дж. и др.10, 335, 1989, Дункан . и др..39, 1125, 1990, Дункин Р. и др. .10, 51, 1989, 18, 123, 1993 и 19, 331,1992. Проблема для традиционных способов, например, как описано выше, заключается в том, что трудно удалить доксорубицин из доксорубицинового полимерного конъюгата. Это обусловлено образованием комплексов между связующим и свободным доксорубицином, установлено, что материал ведет себя как одно целое при диализе, молекулярной фильтрации и гель-хроматографии Фейджен Дж. и др. .1, 301, 1985. Полимерсвязанные антрациклиновые системы настоящего изобретения основаны на метакриловых полимерах, несущих гидрофильные остатки, пептидные концевые цепи, соединенные только с аминогруппой антрациклина, и остатки глицина либо в виде свободной кислоты, либо в виде амидного производного. Эти системы имеют преимущество над существующим аналогом в том, что антрациклин может быть легко высвобожден от полимера, с которым он связан. К тому же полимерсвязанные антрациклины изобретения имеют более широкую противоопухолевую активность и более низкую токсичность, чем соответствующие свободные антрациклины. Таким образом, настоящее изобретение относится к полимерсвязанному антрациклину формулы А, который состоит, по сути, из трех единиц, представленных общими формулами 1, 2 и 3 где- глицин,- 0 или 1,х - 70-98 мол. ,у - 1-29 мол. , - 1-29 мол. ,1-С 1-6-алкилгруппа, замещенная одной или более гидроксигруппами, - остаток аминокислоты или пептидный,- - остаток аминогликозидантрациклина 2-, и- гидрокси или остаток формулы 1, как определено выше. Аминогликозидантрациклин, остатком которого является (-, представлен здесь как 2-, гдеобозначает структуру антрациклинаминогликозида минус аминогруппа сахарного остатка. Полимерсвязанный антрациклин, предпочтительно, содержит от 90 до 98 мол.единиц общей формулы 1, от 0 до 10 мол.единиц общей формулы 2 и от 1 до 10 мол.единиц общей формулы 3. Ферментативныйгидролиз пептидных цепей приводит к высвобождению только активного лекарства -2, тогда как единица общей формулы 3 остается нетронутой. Соответствующими алкилгруппами, которые могут представлять 1, являются С 1-4 алкилгруппы, замещенные одной или более гидроксигруппами, примеры включают в себя гидроксиэтил-, 2-гидроксипропил и 3-гидроксипропилгруппы. Пептидный спейсердолжен быть восприимчив к внутриклеточному гидролизу. Спейсер может быть устойчивым к внеклеточному гидролизу. Пептидный спейсер может быть длиной от 1 до 10, например, 2-4 аминокислотных остатков. Обычно пептидный спейсер является трипептидом или тетрапептидом. Каждый из составных аминокислотных остатков пептидного спейсера у, который является хиральным,может присутствовать в виде оптического - или -изомера или в виде /-смеси. Здесь используется традиционная трехбуквенная система обозначения аминокислот, где символы означают -конфигурацию хиральной аминокислоты, если не указано особо. Пептидный спейсер у может присутствовать в виде рацемической смеси или в виде оптически чистого изомера. Предпочтительно,выбирается из (глицин-фенилаланин-глицин) (глицинлейцин-глицин), или с глицин-остатком, связанным в каждом случае с аминогликозидантрациклином. Аминогликозидантрациклиновый остаток - является подходящим остатком антрациклинаминогликозида 2- следующей формулы в которой один изи-водород, а другой -гидроксигруппа или йод, - водород или ОСН 3, а- водород или гидроксигруппа. Предпочтительными примерами антрациклинаминогликозида 2- является доксорубицин, 4 эпидоксорубицин, 4-деметоксидаунорубицин, идарубицин и 4-йодо, 4-дезоксидоксорубицин. Изобретение также представляет способ получения полимерсвязанного антрациклина А, который состоит, по сути, из единиц общих формул 1, 2 и 3 как определено выше. Способ содержит) взаимодействие полимерного промежуточного соединения В, где В состоит, в основном, из единиц следующих общих формул 1 и 4 где х,и 1 в формуле 1 являются такими, как определено выше, - от 30 до 2 мол. , а 2-гидроксигруппа или уходящая группа, с антрациклиновым производным общей формулы (5)-(5) в которой - иявляются такими, как определено выше,) взаимодействие продукта со стадии , где 2 - уходящая группа, с соединением общей формулы 21, в которой 1 - такой, как определено выше, в случае, когда требуется получить полимерсвязанный антрациклин, где , единица общей формулы 3 представляет 1. Уходящей группой, которую может представлять 2, является пригодная фенил-оксигруппа, которая замещается на фенильном кольце одной или более электронотнимающих групп. Примерами пригодных электронотнимающих групп включают в себя нитрогруппу (-2) и галоген 2, предпочтительно, является уходящей группой. в которой- электронотнимающая группа, например, -2 или галоген, такой как фтор или хлор,целое число от 1 до 5, обычно от 1 до 3, предпочтительно, 1 или 2. Предпочтительно, 2 - пнитрофеноксигруппа или 2,4-дихлорфеноксигруппа. Соединения общей формулы (5) легко отделяются от полимерного конъюгата формулы А благодаря своей высокой олефильности. Так, как описано выше, настоящий подход к получению полимерсвязанных антрациклинов позволяет преодолеть главный недостаток традиционной конденсации антрациклинов с полимерами, а именно трудность в отделении свободного антрациклина от полимерного конъюгата. Полимерные промежуточные соединения В, состоящие, в основном, из единиц общих формул 1 и 4, как определено ранее, получаются радикальной сополимеризацией метакрильных соединений следующих формул 6 и 7 где , 1 и 2 - такие, как определено выше. Некоторые полимеры, состоящие, в основном, из единиц общих формул 1 и 4, известны из литературы например, полимер В 1, состоящий из единиц общей формулы 1, в которойпредставляетСН 2 СН(ОН)СН 3,0, и единиц общей формулы 4, в которой 2 представляет п-нитрофенольный остаток,получается радикальной сополимеризацией ждним -(2-гидкиппил)-мткилмид 6 123,0 с -метакрилоилглицил-п-нитрофенилэфиром 7 а 2-642, как описано в работе Дж. Копечек, . ., 178, 2159, 1977. Полимерные промежуточные соединения, состоящие из единиц общих формул 1 и 4, в которых 2 представляет гидроксильную группу, могут быть получены радикальной гомогенной полимеризацией. Некоторые мономеры общих формул 6 и 7 являются известными. Соединения общей формулы 6, в котором 0 и 1 - алкил, несущий гидроксильную группу, получаются взаимодействием метакрилоилхлорида с алифатическим алкилом, несущим вторичные гидроксигруппы. С другой стороны, соединения общей формулы 6, в которой 0 и 1 - остаток алкила, несущего первичную гидроксильную группу, могут быть получены из метакриловой кислоты и аминосоединений в присутствии катализатора конденсации, такого как 1 этоксикарбонил-2-этокси-1,2-дигидрохинолин. 5 3827 1 Пептидил-антрациклиновые производные общей формулы 5 являются дополнительным аспектом настоящего изобретения. Способы их получения являются известными. Например, так как это важно для взаимодействия соответствующего -защищенного пептида с антрациклином, -защитная пептидильная группа должна выбираться из таких групп, которые удаляются в условиях, способных придать стабильность антрациклину. Примером является трифенилметильная группа. Пентидилантрациклиновые соединения общей формулы 5 могут быть получены способом, который содержит взаимодействие -защищенного пептида общей формулы 8 или 9 5 ,(8) 3 ,(9) где 3 - кислоточувствительная защитная аминогруппа,- уходящая группа,- аминокислотный остаток или пептидный спейсер, как указано выше, с антрациклинаминогликозидом 2 - как указано выше, с получением промежуточного соединения общей формулы 10 3 ,10) где -, -3 - такие, как определено выше, и удаления защитной группы 3 с получением пептидилантрациклина общей формулы 5 в форме свободного основания. Р может быть уходящей группой, как определено и подтверждено примерами выше для 2. Кроме того, Р может быть пентафторфенилокси- или -гидроксисукцинимидогруппой. Примеры кислоточувствительной защитной группы 3 включают в себя тритил- и дифениламиногруппы. Пептидил-производные общих формул 8 и 9 получаются следующими стандартными методами синтеза,которые известны из литературы о пептидах. Защита аминофункции кислоточувствительной группой, такой как трифенилметил, обычно осуществляется в соответствии с работой Теодоропулоса и др. . . . 47,1324(1982). Реакционные условия, выдерживаемые для получения соединений общих формул 8, 9 и 10, предназначаются для того, чтобы избежать рацемизации, полученные пептидил-производные сохраняют поэтому конфигурацию исходных аминокислот. Для получения антрациклиновых производных общей формулы 5, соединение общей формулы 9 может взаимодействовать с гидрохлоридной солью антрациклина в безводном полярном растворителе, таком как диметилформамид, в присутствии эквивалентных количеств органического основания, такого как триэтиламин, например, при комнатной температуре в течение 15 часов с получением промежуточного соединения общей формулы 10, которое очищается хроматографией, а затем деблокируется от производного соединения общей формулы 5, например, в водной 75 -ной уксусной кислоте при комнатной температуре. Необходимо отметить, что реакция антрациклинов, несущих гидроксильную группу в положении С-14,таких как доксорубицин и 4-эпидоксорубицин, в виде гидрохлоридной соли, с активированными пептидилпроизводными общей формулы 9 в присутствии органического основания, необходимого для деблокирования 3-аминогруппы антрациклинов в полярном растворителе, дает смесь производного общей формулы 10 антрациклинов, замещенных как по аминогруппе сахарного остатка, так и в С-14 положении. Бис-(3-, 14 О-пептидил)-производные удаляются из смеси хроматографией. Соединения общей формулы 10 могут быть также получены конденсацией -защищенного пептида общей формулы 8 с антрациклином в форме гидрохлоридной соли в безводном полярном растворителе, таком как диметилсульфоксид в присутствии эквивалентного количества катализатора конденсации, такого как 1 этоксикарбонил-2-этокси-1-дигидрохинолин. Этот метод не дает бис-пептидил-производных антрациклинов,несущих С-14 гидроксигруппы. Конденсация промежуточного продукта В с пентидилантрациклиновыми производными общей формулы 5, необязательно следующая за замещением остающихся уходящих групп, дает полимерсвязанные антрациклины, состоящие, в основном, из единиц общих формул 1, 2 и 3. Должно быть подчеркнуто, что этот метод позволяет избежать образования эфирных связей между первичными гидроксильными группами и концевыми глицил-активированными эфирами. Полимерсвязанные лекарства общей формулы А, в которой остатокединицы общей формулы 3 представляет группу 1, как описано ранее, получаются, предпочтительно, взаимодействием промежуточного соединения В, в котором 2 - уходящая группа, как определено выше, с антрациклиновым производным общей формулы 5 в безводном полярном органическом растворителе, таком как диметилформамид или диметилсульфоксид. Реакция может обычно идти в течение от 8 до 24 ч. Реакция обычно проводится при температуре от 15 до 30 С, предпочтительно, при комнатной температуре в течение 15 ч, затем оставшиеся уходящие группы замещаются взаимодействием конъюгата с соединением общей формулы 21, как указано выше, в течение периода времени от 0,5 до 3 ч при комнатной температуре. Полимерсвязанные лекарства общей формулы А, в которой остатокединицы общей формулы 2 представляет гидроксильную группу, получаются, предпочтительно, взаимодействием промежуточного соединения общей формулы В, в которой 2 - гидроксильная группа, с антрациклиновым производным общей формулы 5 в безводном полярном органическом растворителе, таком как диметилформамид или диметил 6 3827 1 сульфоксид. Реакция обычно длится в течение 8-24 ч. Реакция обычно проводится при температуре от 15 до 30 С, предпочтительно, при комнатной температуре в течение 15 ч. Например, для получения полимерсвязанного антрациклина, в котором- остаток 1, как указано выше, промежуточное соединение общей формулы В, в которой 2 - уходящая группа, такая как пнитрофенокси, обрабатывается пептидилантрациклином общей формулы 5, при комнатной температуре в течение 15 ч. Соединение В, соответственно используется в количестве 14 масса/объем, а соединение 5 в количестве 2,2 масса/объем (м/о). Затем добавляется соединение общей формулы 21, как указано выше, обычно при 0,1 м/о, и реакционная смесь выдерживается при комнатной температуре в течение 3 ч. Конъюгат высаживается ацетоном, растворяется абсолютным этиловым спиртом, обычно при концентрации 8(м/м), и высаживается снова ацетоном с получением требуемого полимерсвязанного антрациклина. В описанном выше способе удается избежать образования эфирных связей между С-14 гидроксилированным антрациклином и концевым глицил-активированным эфиром благодаря отсутствию какого-либо органического основания в процессе конденсации. В другом примере, для получения полимерсвязанного антрациклина общей формулы А, в которойгидроксильная группа, промежуточное соединение общей формулы В, как указано выше, в котором 2 - гидроксильная группа, обрабатывается в безводном диметилсульфоксиде пептидилантрациклина общей формулы 5 при комнатной температуре, в течение 15 ч. Соединение В соответственно используется при 14 м/о, а соединение 5 при 2,3 м/о. Конъюгат затем высаживается ацетоном, растворяется в абсолютном этиловом спирте, обычно при концентрации 8 м/м) и высаживается снова ацетоном с получением полимерсвязанного антрациклина общей формулы А, как определено выше. Содержание антрациклина в конъюгатах общей формулы А определяется анализом агликона, высвобождаемого из связанного антрациклина посредством кислотного гидролиза, так, адриамидинон является агликоновым остатком диксорубицина, а 4-эпирубицин и 4-деметоксидауномицином является агликоновым остатком деметоксидаунорубицина. Полимерсвязанные антрациклины настоящего изобретения показывают хорошую водорастворимость,биосовместимость, стабильность при физиологическом рН и высвобождаются из свободного активного лекарства, -2, после инкубации с лимосомными энзимами (ферментами). Соединения формулы А проявляют повышенную противоопухолевую активность в экспериментальных образцах и пониженную общую токсичность по сравнению со свободным антрациклином. Полимерсвязанные антрациклины общей формулы А имеют противоопухолевую активность. Человек или животное могут поэтому подвергаться лечению способом, заключающимся в применении ими терапевтически эффективного количества полимерсвязанного антрациклина общей формулы А. Состояние пациента (человека или животного) может быть таким образом улучшено. Приемлемый интервал дозировки зависит от способа применения лекарства и возраста, массы и состояния лечащегося пациента. Полимерсвязанные антрациклины общей формулы А обычно применяются парентеральным способом, например, внутримышечно, внутривенно или при введении шариков. Пригодный интервал дозировки составляет от 5 до 800 мг/м 2 антрациклинового эквивалента, например от 20 до 500 мг/м 2. Пригодный режим определяет применение раствора 25 мг антрациклинового эквивалента /м 2 внутривенно при объеме 10 мл/кг массы тела в течение 2-недельного периода через 5,9 и 15 дней. Полимерсвязанные антрациклины общей формулы А могут быть включены в рецептуру фармацевтической композиции вместе с фармацевтически приемлемым носителем или разбавителем. Обычно полимерсвязанные антрациклины включаются в рецептуры для парентерального применения, например, при растворении в стерильной воде или в воде для инъекций. Нижеследующие примеры дополнительно иллюстрируют изобретение. Примеры 1-6 относятся к способам синтеза для получения мономеров общих формул 6 и 7 и полимерных промежуточных соединений общей формулы В. Пример 1. Метакрилоилглицил-п-нитрофениловый эфир (7 а 5,28 г, 20 ммолей), полученный, как описано в работе. 178, 2159 (1977), растворяется в безводном тетрагидрофуране (20 мл) и обрабатывается 1 амино-2-гидроксипропаном (3,2 мл, 40 ммолей). Через 20 мин при комнатной температуре растворитель удаляется при пониженном давлении, и указанное в заголовке соединение общей формулы 6 (3,3 г, выход 82,5 ) получается после кристаллизации смесью ацетон /этиловый эфир. ТСХ (тонкослойная хроматография) на -пластине 254 , вымывающая система метиленхлорид/ацетон (90 10 по объему),0,47. Пример 2. К перемешиваемой смеси 1-этоксикарбонил-2-этокси-1,2-дигидрохинолина (37 г, 0,15 ммоля) в безводном толуоле (150 мл) по каплям в течение 15 мин добавляется растворенная в безводном толуоле (300 мл) метекриловая кислота (14 мл, 0,165 моля). Реакционная смесь перемешивается при комнатной температуре в течение 24 ч. Указанное в заголовке соединение общей формулы 6 с получается после высаживания п-гексаном. ТСХ на -пластине 254 , вымывающая система метиленхлорид/ацетон (90 10 по объему)0,35 Пример 3. Указанное в заголовке соединение общей формулы 7 получается из метакрилоилглицина (2,66 г, 20 ммолей), полученного, как описано в работе. 178, 2159, (1977), и 2,4-дихлорфенола (3,26 г,20 ммолей) в безводном тетрагидрофуране (50 мл) в присутствии ДСС (4,2 г, 21 ммоль). Соединение общей формулы 7 В (4,7 г, выход 82 ) кристаллизуется из этилацетата и п-гексана, ТСХ на -пластине 254-метакрилоиламид-2-гидроксипропан (25,2 г, 0,18 моля) метакрилоилглицин (2,86 г, 20 ммолей) и ,азоизобутиронитрил (5,9 г) растворяются в безводном метиловом спирте (164 мл). Смесь выдерживается при 60 С в атмосфере азота в течение 20 ч, затем реакционная смесь добавляется к ацетону (2000 мл) при перемешивании. Осадок собирается, промывается ацетоном и сушится до постоянного веса с получением указанного в заголовке полимера В 2 (2,6 г). Содержание карбоксильных групп 10 мол.Пример 5. Сополимер -(метакрилоилглицил)-2-гидроксипропаноламида и -(метакрилоилглицил)-2,4-дихлорфенилового эфира (В 3) Соединение общей формулы 6 (14,4 г, 72 ммоля) и соединение общей формулы 7 (5,19 г, 18 ммолей) полимеризуются в безводном ацетоне (300 мл) в присутствии , -азоизобутиронитрила (1 г, 6 ммолей), как описано в работе 178, 2159 (1977), до указанного в заголовке соединения общей формулы В 3. Полимерный материал извлекается фильтрацией из реакционной смеси, растворяется в абсолютном этиловом спирте и переосаждается ацетоном. Содержание хлора, расчетное - 6,89 мол. , экспериментальное - 2,84 мол.Пример 6. Сополимер -(метакрилоилглицил)-гидроксиэтиламида и -метакрилоилглицина (В 4)(4) Указанное в заголовке полимерное промежуточное соединение общей формулы В 4 получается из метакрилоиламида-2-гидроксиэтана (6 с 23,2 г, 0,18 ммоля), метакрилоилглицина (2,86 г, 20 ммолей) и , 8 3827 1 азоизобутиронитрила (5,9 г) в безводном метиловым спирте (164 мл), как описано в примере 2. Содержание карбоксильных групп- 10 . Примеры 7-12 относятся к способам получения пептидилантрациклинов общей формулы 5. Пример 7.(1982), растворяется в безводном тетрагидрофуране (150 мл) и к нему добавляется безводный гидроксибензотриазол (8 г). Смесь охлаждается при 0 С и обрабатывается 1,3-дициклогексилкарбодиимидом(11,7 г, 50 ммолей), через 10 мин к ней добавляется по каплям раствор 1-лейцилглицинэтилэфир-птолуолсульфонатной соли (20 г, 50 ммолей) в смеси безводного тетрагидрофурана (100 мл) и метилморфолина (7 мл). Реакционная смесь выдерживается при 0 С в течение 1 часа и при комнатной температуре - до утра, затем фильтруется, и растворитель удаляется при пониженном давлении. Сырой материал, растворенный этилацетатом, промывается один за другим охлажденным 5 -ным водным раствором лимонной кислоты (3 х 100 мл), охлажденным 5 водным раствором бикарбоната натрия и водой, затем концентрируется и хроматографируется на силикагеле с вымыванием смесью метиленхлорида и метанола (99 1 по объему) с получением -тритилфенилаланиллейцилглицинэтилового эфира (18 г, 30 ммолей), который превращается в соответствующую кислоту общей формулы 8 а) (17 г) обработкой в 95 -ном этиловом спирте (400 мл) 1 гидроокисью натрия (30 мл) в течение 2 часов при комнатной температуре. ТСХ на), 6,8-7,4 (м, 22, , , 4-С 65). Соединение общей формулы 8 а растворяется в безводном тетрагидрофуране (450 мл) и к нему добавляется п-нитрофенол (5,5 г, 40 ммолей). Смесь охлаждается при 0 С, к ней добавляется по каплям раствор 1,3-дициклогексилкарбодиимида (8,24 г, 40 ммолей), и смесь выдерживается до утра при 4 С. После этого реакционная смесь фильтруется, и растворитель удаляется при пониженном давлении. Остаток растворяется этилацетатом и охлаждается при 0 С. Через час смесь фильтруется и растворитель удаляется с получением, после кристаллизации из этилового эфира, указанного в заголовке соединения общей формулы 9 а (20 г, выход 97 ) ТСХ напластине 254(С 6 Н 5)3 ОС 6 Н 42 (9) Промежуточный -тритилфенилаланиллейцилглицилэтиловый эфир (6 г, 10 ммолей), полученный,как описано в примере 7, обрабатывается 75 -ным водным раствором уксусной кислоты при комнатной температуре в течение часа с получением -фенилаланиллейцилглицилэтилового эфира, который конденсируется -тритилглицином (3 г, 10 мм), в присутствии -гидроксибензотриазола и 1,3-дициклогексилкарбодиимида с получением, после гидролиза этилового эфира и активации п-нитрофенолом, как описано в примере 7, указанного в заголовке соединения общей формулы 9 (3,8 г, выход 50 ) ТСХ- пластине 254 , вымывающая система - этиловый эфир,0,63. АД-МС м/з 755 МН Пример 9. 3(глициллейцилфенилаланил)доксорубицин (5 а) 9 Проводится реакция доксорубицингидрохлорида (2,9 г, 5 ммолей), растворенного в безводном диметилформамиде (50 мл) и триэтиламине (0,5 мл) с -тритил-фенилаланиллейцилглицил-п-нитрофенилэфиром(9 а 3,5 г, 5 ммолей), полученным, как описано в примере 7. Реакционная смесь выдерживается до утра при комнатной температуре, затем высаждается смесью 11 этилового эфира и -гексана. Твердое вещество очищается на силикагельной колонке с вымыванием смесью метиленхлорида и метанола (98 2 по объему) с получением -защищенного пептидилдок-сорубицина общей формулы 10 а (4,6 г). ТСХ на- пластине 254 , вымывающая система метилен-хлорид/ метиловый спирт (95 5 по объему),0,35. АД-М м/с 1103 МН Соединение общей формулы 10 а, растворяется в 75 -ном водном растворе уксусной кислоты (250 мл) в течение часа, затем раствор разбавляется смесью 11 воды и метиленхлорида (2500 мл) и доводится до рН 7 твердым бикарбонатом натрия. Органическая фаза отделяется, и растворитель удаляется при пониженном давлении с получением указанного в заголовке соединения общей формулы 5 а (3,45 г, выход 80 ) ТСХ на- пластине 254 , вымывающая система - метиленхлорид /метиловый спирт/ уксусная кислота/вода (80 20 7 3) по объему,0,5. АД-МС м/з МН Н 1-ЯМР (400 МГц, ) 0,8 (д,6,4 Гц, 3 Н), 0,83 (д,6,4 Гц, 3,), 1,10 (д,6,8 Гц,3, 6 СН 3), 1,3-1,6 (м, 4,и 2 экв. ), 1,83 (ддд,2,8 Гц,13,2 Гц,13,2 Гц, 1 Н, 2 ахн), 2,09 Проводится реакция доксорубицингидрохлорида (2,9 г 5 ммолей) с -тритил-глицилфенилаланил-лейцилглицил-п-нитрофениловым эфиром (9 3,8 г, 5 ммолей), полученным, как описано в примере 8, и затем реакционная смесь обрабатывается 75 -ным водным раствором уксусной кислоты, как описано в примере 9, с получением указанного в заголовке соединения общей формулы 5 (4 г, выход 90 ) ТСХ на Указанное в заголовке соединение общей формулы 5 с (3 г, выход 75 ) получается из 4 деметоксидаунорубицингидрохлорида (2,9 г, 5 ммолей) и -тритил-фенилаланиллейцилглицил-пнитрофенилэфира (9 а 3,5 г, 5 ммолей) аналогично методике, описанной в примере 9. ТСХ на пластине 254 , вымывающая система - метиленхлорид/метиловый спирт/уксусная кислота/ вода Указанное в заголовке соединение общей формулы 5 (3,25 г, выход 68 ) получается из 4 эпидоксорубицингидрохлорида (2,9 г, 5 ммолей) и -тритил-фенилаланиллейцилглицил-р-нитрофенилэфира Полимерный предшественник общей формулы В 2 (7,15 г, 5 ммолей-СООН), полученный, как описано в примере 4, 3(глицил-лейцилфенилаланил)доксорубицин (5 а 2,36 г, 2,5 ммоля) растворяются в безводном диметилформамиде (100 мл), затем к раствору добавляется -этоксикарбонил-2-этокси-1,2 дигидрохинолин (0,7 г, 2,5 ммоля). Смесь перемешивается при комнатной температуре в течение 24 часов,затем выливается в этиловый эфир (800 мл). Осадок растворяется в этиловом спирте (100 мл), высаживается ацетоном (800 мл) и сушится до постоянного веса с получением указанного в заголовке соединения общей формулы А 1 (7 г). Содержанием доксорубицин 9(м/м) Пример 14. Сополимер 3-метакрилоиламино-2-гидроксипропана, 3(метакрилоилглицилфенилаланил-лейцилглицил)доксорубицина и (-метакрилоилглицил)-2-гидроксипропаноламида (А 2) Полимерный предшественник общей формулы В 1 (10 г, 2,710-3 экв. п-нитрофенилэфира), полученный,как описано в работе . . 178, 2159 (1977), растворяется в сухом диметилформамиде (60 мл),после чего к раствору добавляется 3-(глицил-лейцилфенилаланил)доксорубицин(5 а 1,53 г, 1,72 ммоля). Смесь перемешивается при комнатной температуре в течение 24 часов, после чего к ней добавляется аминопропанол (0,13 мл). Через час реакционная смесь добавляется к перемешиваемой смеси ацетон/этиловый эфир (1,2 л 31 по объему) и фильтруется. Осадок растворяется этиловым спиртом (150 мл) и высаживается смесью ацетон этиловый эфир (1,2 л, 41 по объему) с получением полимерного соединения общей формулы А 2 (10 г). Содержание доксорубицин НС 9(м/м). Примеры 13-18 иллюстрируют способы получения полимерсвязанных антрациклинов общей формулы А Пример 15. Сополимер 3-метакрилоиламино-2-гидроксипропана,4-деметокси-3(метакрилоилглицинфенилаланиллейцилглицил)даунорубицина и -метакрилоилглицина (3) Указанное в заголовке соединение общей формулы 3 получается взаимодействием 4-деметокси-3-(глициллейцилфенилаланил)даунорубицина (51,48 г, 1,72 ммоля) с полимерным предшественником общей формулы В 2 (10 г) в присутствии -этоксикарбонил-2-этокси-1,2-дигидрохинолина (0,48 г) в безводном диметилформамиде, как описано в примере 13. Пример 16. Сополимер 3-метакрилоиламино-2-гидроксипропана, 4-эпи-3(метакрилоилглицил-1-фенилаланил-лейцилглицил)доксорубицина и 1(метакрилоилглицил)-2-гидроксипропана(А 4) 4-эпи-доксорубициновый полимерный конъюгат общей формулы А 4 (10 г) получается взаимодействием 4-эпи-3(глициллйцилфенилаланил)доксорубицина (5 е 1,48 г, 1,72 ммоля) с полимерным предшественником общей формулы В 1, а затем с 1-аминопропанолом (0,13 мл), как описано в примере 14. Содержание 4-эпидоксорубицин НС 9(м/м) Пример 17. Сополимер 3-метакрилоипамино-2-гидроксипропана, 4-эпи-3(метакрилоилглициллейцилглицил)доксорубицина и -метакрилоилглицина (А 5) Указанное в заголовке соединение общей формулы А 5 получается, как описано в примере 13, из полимерного промежуточного соединения общей формулы В 2,4-эпи-3(глициллейцилфенилаланил)доксорубицина (5 е) и -этоксикарбонил-2-этокси-1,2-дигидрохинолина в безводной диметилформамиде. Пример 18. Сополимер -(метакрилоилглицил)-гидроксиэтиламида, 3 метакрилоилглицилфенилаланил-лейцилглицил)доксорубицина и -метакрилоилглицина (А 6) Указанное в заголовке доксорубициновое полимерное пролекарство общей формулы А 6 получается конденсацией полимерного промежуточного соединения общей формулы В 4 и 3(глициллейцилфенилаланил)доксорубицина (5 е) и -этоксикарбонил-2-этокси-1,2-дигидрохинолина в безводном диметилформамиде, как описано в примере 13. Пример 19. Противоопухолевая активность соединения общей формулы А 1 на М 5076 Противоопухолевая активность соединения общей формулы А 1, описанного в примере 13, определяется следующим образом. Пример 19. Сополимер А 1 х 90.59 у 4.52 3.87 мол.М. В.33.400 МВ/МН 1.69. Пример 20. Сополимер А 2 х 95.56 у 2.54 1.88 мол.М. В.33.400 МВ/МН 1.69 (полидисперсность) Пример 21. Сополимер 3 х 90.61 у 4.73 3.64 мол.М.В.32.900 МВ/МН 1.71. Пример 22. Сополимер А 4 х 95.56 у 2.54 1.88 мол.М.В.32.900 МВ/МН 1.71. Пример 23. Сополимер А 5 х 90.59 у 4.52 3.87 мол.М.В.32.900 МВ/МН 1.71. Пример 24. Сополимер А 6 Содержание доксорубицина в виде его гидрохлоридной соли 8.5(вес. /вес.) х 95.45 у 1.95 1.66 мол.М. В.29.800 МВ/МН 1.73. Материалы и методы. 1. Применение лекарства. Все лекарственные растворы получаются непосредственно перед использованием. Лечение заключается в применении в объеме 10 мл/кг массы тела на 5,9 и 15 дни. Антрациклины растворяются в стерильной воде, и концентрации определяются спектрофотометрически. 3827 1 Лиофилизованные полимеры растворяются в воде с получением исходного раствора 25 мг антрациклинового эквивалента на 1 мл в соответствии с приведенной концентрацией, дальнейшее разбавление проводится в воде. 2. Твердая опухоль. М 5076 мышиная ретикулосаркома получается серийным внутримышечным проходом и трансплантируется (510 клетки/мышь) подкожно в С 75 В 1/6 мыши для оценки активности на первичной опухоли. 3. Оценка противоопухолевой активности и токсичности. Рост опухоли определяется измерением с помощью циркуля, и масса опухоли определяется согласно Герану и др. (смотри. . 3,1 (1972). Противоопухолевая активность определяется временем (дни) достижения 1 г массы опухоли и выражается как замедление роста опухоли (3 РО). Среднее увеличение времени выживания (Т/С ) рассчитывается с использованием следующей формулы Т/С(среднее время выживания (Т/С ) /среднее время выживания контрольной группы) 100 Токсичность оценивается на основании снижения массы тела и грубого вычисления, главным образом, по уменьшению селезенки и печени. Нейротоксичность определяется как число мышей с дефектом двигательной функции. Результаты приводятся в табл. 1. Пример 20. Противоопухолевая активность соединения общей формулы 3 от М 5076. Противоопухолевая активность соединения общей формулы 3, описанного в примере 15, определяется с использованием метода и материалов из примера 19. Результаты приводятся в таблице 2. Противоопухолевая активность соединения общей формулы А 4 (сополимер 3-метакрилоиламино-2 гидроксипропана, 4-эпи-3(метакрилоилглицил-лейцилглицил)доксорубицина и 1(метакрилоилглицил)2-гидроксипропана)в сравнении с 4-эпидоксорубицинНС Противоопухолевая активность определяется по одинаковой программе (графику) для 4 эпидоксорубицинНС и соединения формулы А 4. Против мышиной ретикулосаркомы соединение общей формулы А 4 является более активным, чем свободное лекарство при всех испытанных дозах (смотри таблицу 3). Токсичность соединения общей формулы А 4 (сополимер 3-метакрилоиламино-2-гидроксипропана, 4 эпи-3(метакрилоилглицилфенилаланиллейцилглицил)доксорубицина и 1(метакрилоилглицил 2-гидроксипропана) в сравнении с 4-эпидоксорубицинНС. Токсичность оценивается на здоровой С 57-мыши, при обработке внутривенно, единичными зонами 4-эпидоксорубицинНС (13,2-16,15-19-20,6-25,2 и 33,2 мг/кг) и соединения А 4 (50-63-79-100-120-140 мг/кг). Для определения 10 и 50 в здоровой С 57 В-мыши используется анализ с определением вероятности эффекта после 3-недельного восстановления. Терапевтический индекс рассчитывается с использованием следующей формулы. Эффективная доза 50 является дозой, вызывающей 50 снижение роста опухоли. Безопасность животных наблюдается в течение 90 дней. Значения 10 и 50 в С 57 В-мыши приведены в табл. 4. Малая токсичность соединения А 4 позволяет применять более высокие дозы продукта и получать равные или лучшие результаты, чем с 4-эпидоксорубицинНС, и получать лучший терапевтический индекс. Терапевтический индекс для 4-эпидоксорубицинНС и соединение А 4 равняется, соответственно, 3 и 40. Пример препаративной формы композиции. Раствор для инъекций Ингредиенты - количество мг на ампулу. Сополимер А 1-500 (эквивалент 45 мг доксорубицингидрохлорида). Лактоза - 250 Полисорбат - 80 Вода для инъекций - по потребности до 20,0 мл. Лактозу, полисорбат и сополимер растворяют при перемешивании в воде для инъекций (ВДИ) и деаэрируют пропусканием водорода (80 от требуемого конечного объема воды). Полученный раствор доводят до конечного объема добавлением необходимого количества ВДИ. Раствор фильтруют в стерильных условиях через микропористую мембрану 0,22 мкм. По 20 мл раствора асептически помещают в стерильные типа 1 ампулы из бесцветного стекла, имеющие емкость 50-57 мл. Раствор замораживают в ампулах при температуре от -40 до -45 С в течение 4-5 часов. Затем продукт лиофилизуют и сушат на конечной стадии в течение 4-6 часов при 40 С. Ампулы запаивают. Лиофилизованный продукт перед введением разбавляют либо стерильной водой, или хлоридом натрия для инъекций. 16 3827 1 Препаративные формы, содержащие сополимеры 3 и А 4, готовят по вышеуказанной методике. Таблица 1 Соединение Контрольн. Доксорубицин 1 Подтабличные подписи Подкожная инъекция 5 х 105 - клетки/мышь н.о. - не определено) - нейротоксичность 1) - лечение на 5,9 и 15 дни 2) ТД (ЗРО) - замедление роста опухоли. 3) 4) число смертей от отравления / общее число мышей 5) число выживших / общее число мышей 6) число мышей без опухоли в конце опытов к общему числу мышей Таблица 2 Соединение Контролън. 4-деметоксидаунорубицин А 3 Подтабличные подписи Подкожная инъекция 5 х 105 - клетки/мышь н.о. - не определено) - нейротоксичность 1) - лечение на 5,9 и 15 дни 2) ТД (ЗРО) - замедление роста опухоли 3) среднее время выживания лечащейся группы 100 среднее время выживания контрольной группы 4) число смертей от отравления / общее число мышей 5) число выживших / общее число мышей 6) число мышей без опухоли в конце опытов к общему числу мышей Таблица 3 Соединение 4-эпидоксорубицин Подтабличные подписи Подкожная инъекция 5 х 105 - клетки/мышь и.о. - не определено) - нейротоксичность 1) - лечение на 5,9 и 15 дни 2) ТД (ЗРО) - замедление роста опухоли 3) среднее время выживания лечащейся группы 100 среднее время выживания контрольной группы 4) число смертей от отравления / общее число мышей 17 Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66.
МПК / Метки
МПК: C07K 9/00, A61P 35/00, A61K 47/48, C07H 15/24, C07K 17/08
Метки: антрациклина, активные, способ, полимерсвязанные, получения, антрациклины, композиция, фармацевтическая, производные, биологически
Код ссылки
<a href="https://by.patents.su/18-3827-biologicheski-aktivnye-polimersvyazannye-antracikliny-i-sposob-ih-polucheniya-proizvodnye-antraciklina-i-sposob-ih-polucheniya-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Беларуси">Биологически активные полимерсвязанные антрациклины и способ их получения, производные антрациклина и способ их получения, фармацевтическая композиция</a>
Предыдущий патент: Способ получения обеззараженных личинок речных раков и их подращивание в системе оборотного водоснабжения
Следующий патент: Устройство для лечения корневого канала зуба
Случайный патент: Оптическая сканирующая система