Имидазолилзамещенные производные циклогексана и их соли
Номер патента: 2794
Опубликовано: 30.06.1999
Авторы: Томас КРЭМЕР, Маттиас МЮЛЛЕР-ГЛИМАНН, Штефан ВОЛЬФАЙЛЬ, Вальтер ХЮБШ, Иоганесс-Петер Шташ, Петер ФАЙ, Станислав КАЦДА, Андреас КНОРР, Рудольф ХАНКО, Юрген ДРЕССЕЛЬ, Ульрих Мюллер, Мартин БОЙК
Текст
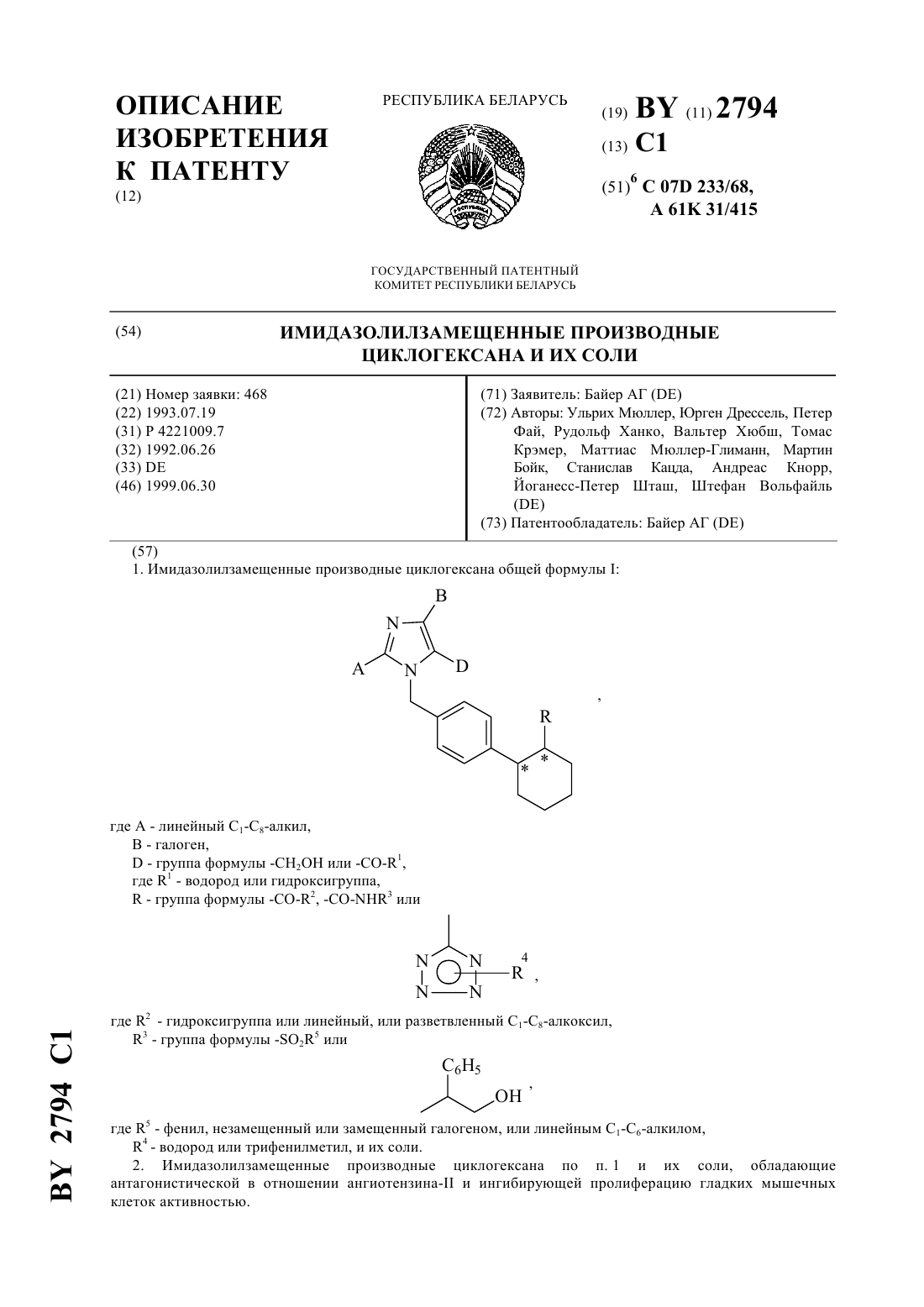
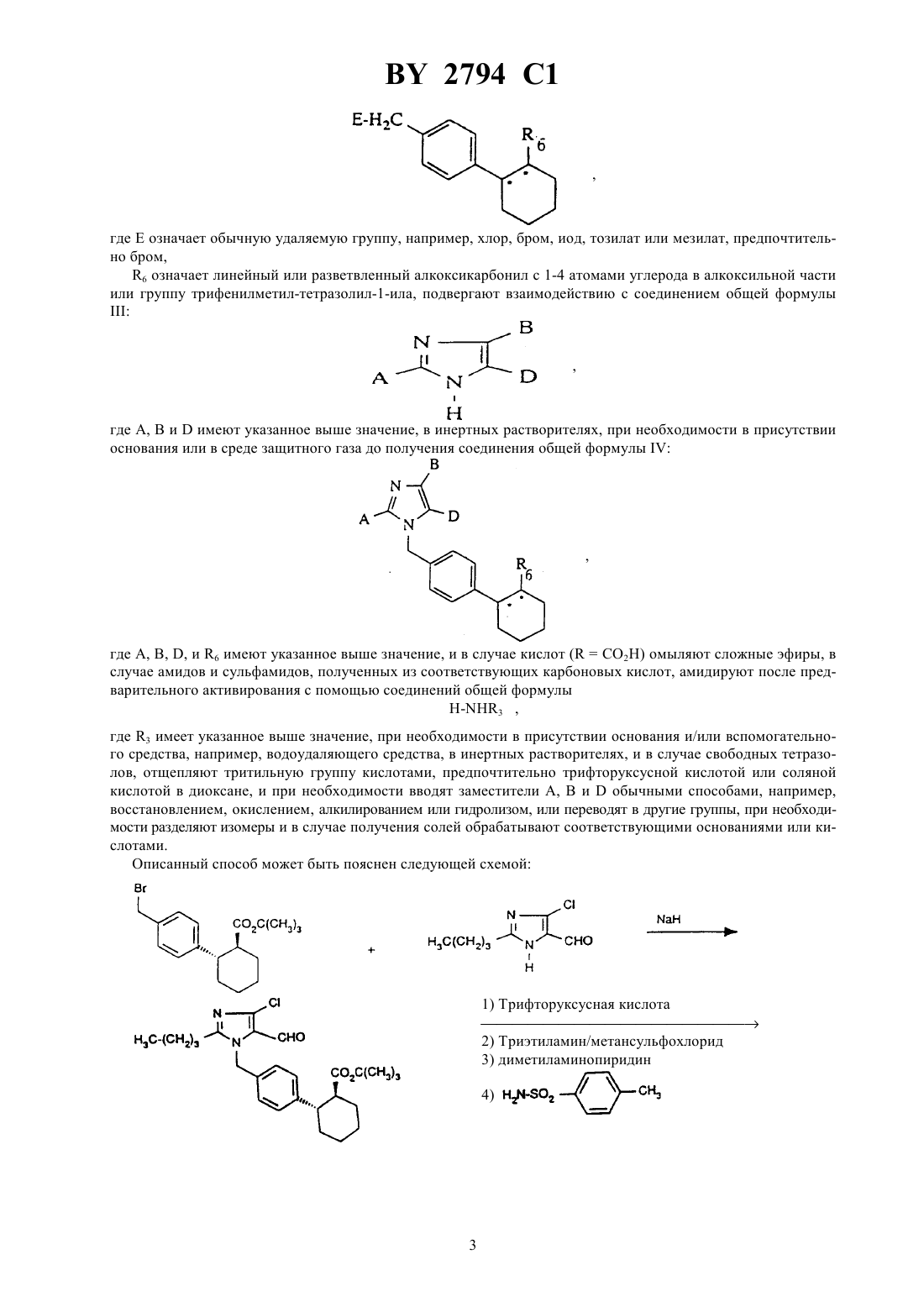
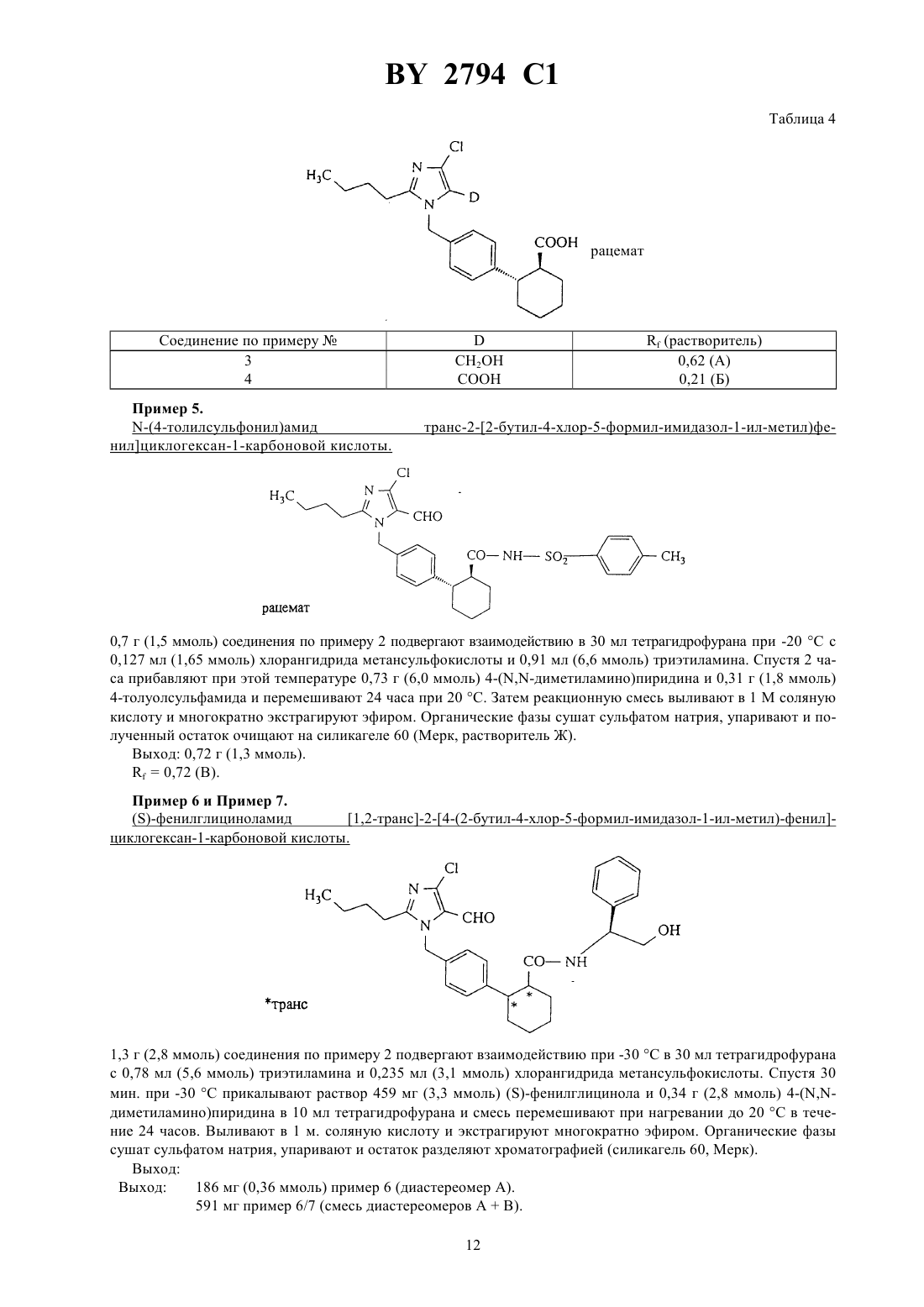
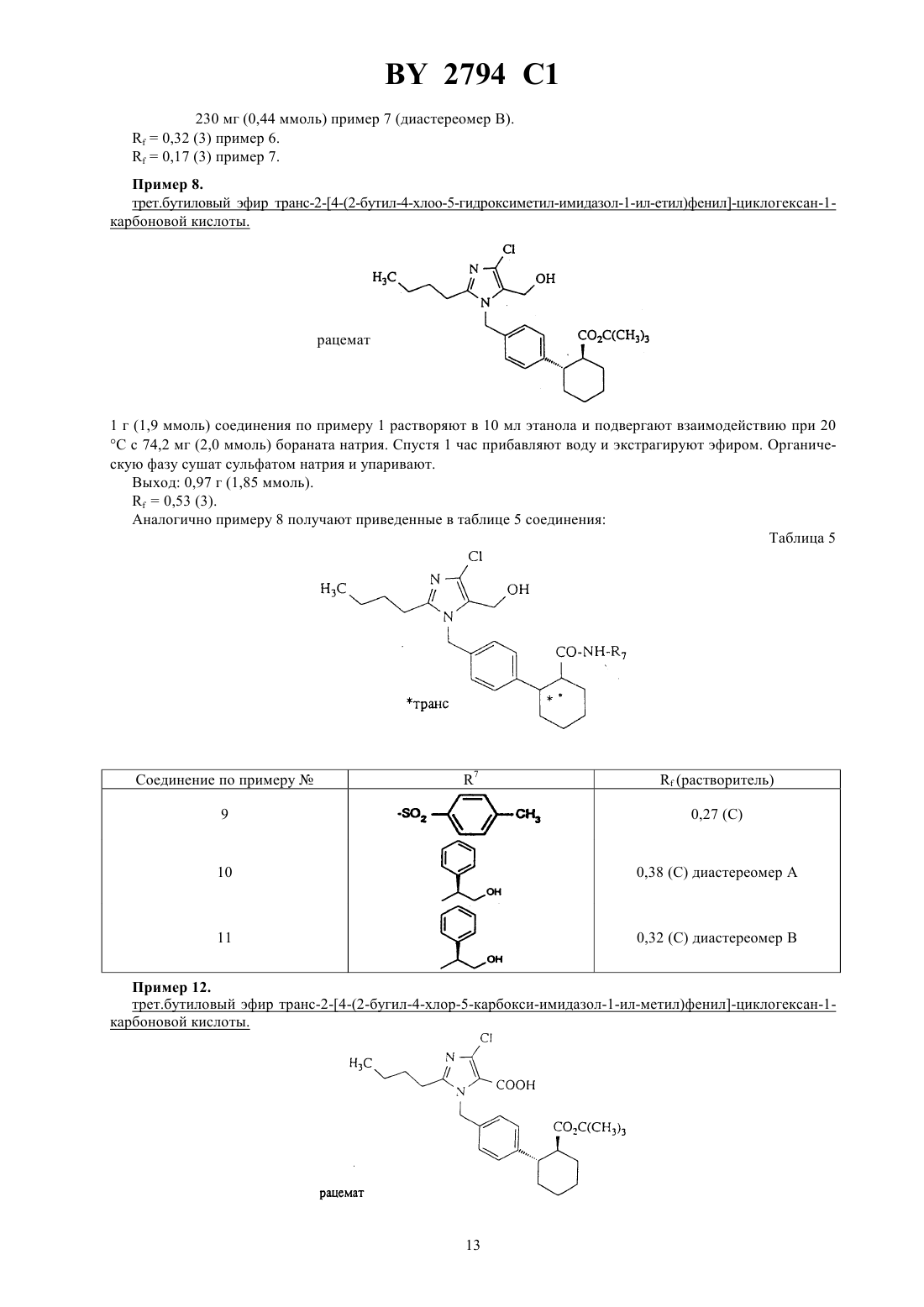
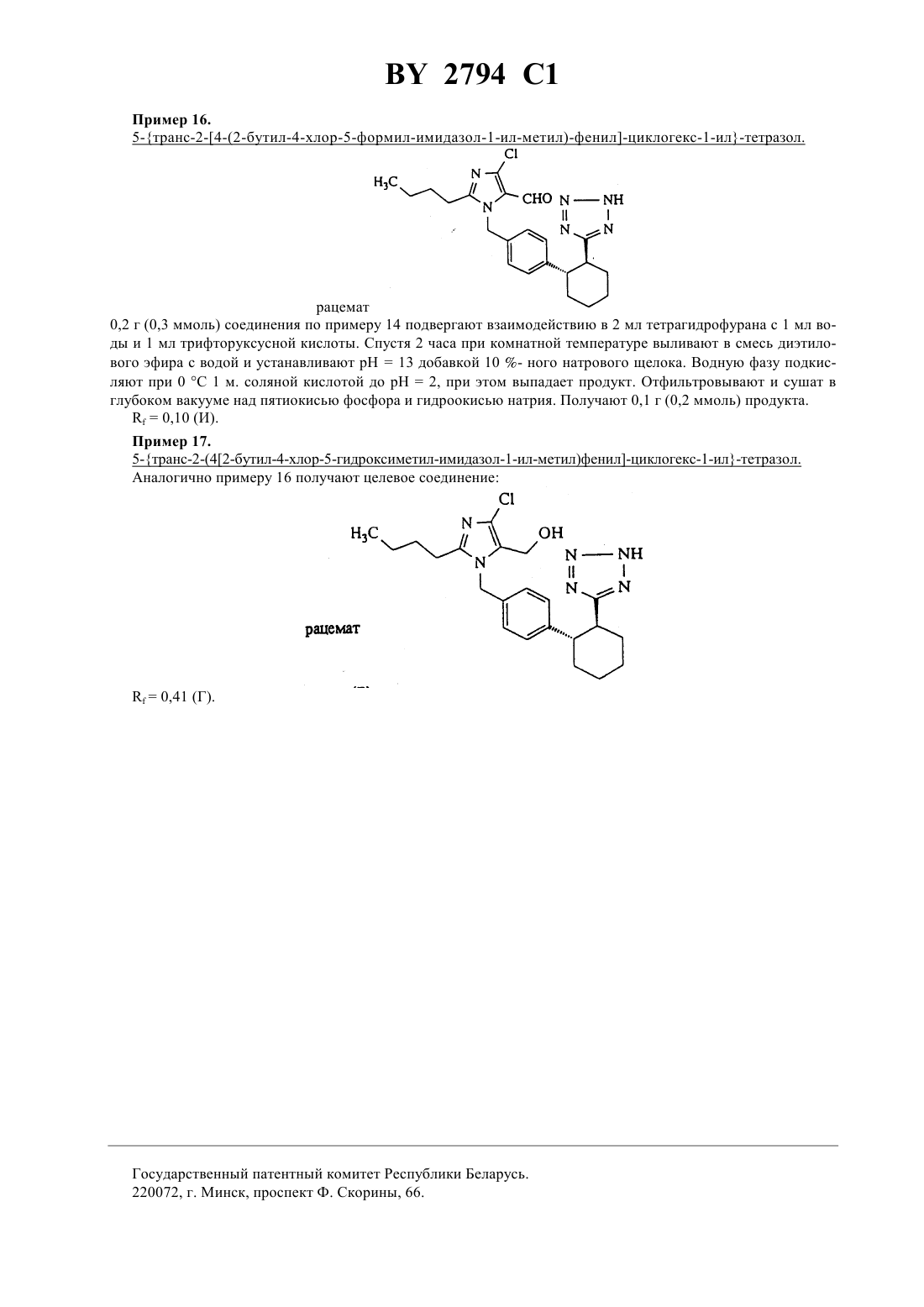
61 31/415 ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ ИМИДАЗОЛИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА И ИХ СОЛИ(57) 1. Имидазолилзамещенные производные циклогексана общей формулы, где 5 - фенил, незамещенный или замещенный галогеном, или линейным 1-6-алкилом,4 - водород или трифенилметил, и их соли. 2. Имидазолилзамещенные производные циклогексана по п. 1 и их соли, обладающие антагонистической в отношении ангиотензина- и ингибирующей пролиферацию гладких мышечных клеток активностью.(56) 1. Патент СССР 999966, МПК 3 С 07 233/68, 1983. Настоящее изобретение относится к новым химическим соединениям с ценными свойствами, в частности к соединениям общей формулы, где А - линейный алкил с 1-8 атомами углерода,В - галоген- группа формулы -СН-)ОН или 1, где 1 означает водород или гидроксигруппу,- остаток формулы 2, 3 или, где 2 означает гидроксил или линейный или разветвленный алкоксил с 1-8 атомами углерода,а 3 - остаток формулы -25 или, где 5 означает фенил, который может быть замещен галогеном или линейным алкилом с 1-6 атомами углерода, 4 - водород или трифенилметильную группу, или их соли. В общем имеются в виду соли с органическими или неорганическими основаниями или кислотами. В рамках настоящего изобретения предпочитают физиологически переносимые соли. Физиологически переносимыми солями имидазолилзамещенных производных циклогексана могут представлять собой соли предлагаемых соединений с минеральными кислотами, карбоновыми кислотами или сульфокислотами. Особенно предпочтительными являются, например, соли с хлористоводородной кислотой,бромистоводородной кислотой, серной кислотой, фосфорной кислотой, метансульфокислотой, этансульфокислотой, толуолсульфокислотой, бензолсульфокислотой, нафталиндисульфокислотой, уксусной кислотой,пропионовой кислотой, молочной кислотой, винной кислотой, лимонной кислотой, фумаровой кислотой,малеиновой кислотой или бензойной кислотой. Физиологически переносимыми солями могут быть также соли с металлами или аммониевые соли тех предлагаемых соединений, которые содержат свободную карбоксильную группу. Особенно предпочтительными являются натриевые, калиевые, магниевые или кальциевые соли, а также аммониевые соли, которые образованы с аммиаком или органическими аминами, например, этиламином, ди- или триэтиламином, дициклогексиламином, диметиламиноэтанолом, аргинином, лизином или этилендиамином. В рамках настоящего изобретения предлагаемые соединения могут иметься в разных стереоизомерных формах, при этом предлагаемые соединения имеются или в виде изображения и зеркального изображения(энантиомеры), или не в виде изображения и зеркального изображения (диастереомеры). Изобретение относится как к энантиомерам, так и к диастереомерам, а также к их соответствующим смесям. Как рацемические формы, так и диастереомеры можно разделять известными приемами на чистые стереоизомерные формы (см. ,,, 1962). Новые соединения обшей формулы (1) можно получать, например, за счет того, что соединение общей формулы, где Е означает обычную удаляемую группу, например, хлор, бром, иод, тозилат или мезилат, предпочтительно бром,6 означает линейный или разветвленный алкоксикарбонил с 1-4 атомами углерода в алкоксильной части или группу трифенилметил-тетразолил-1-ила, подвергают взаимодействию с соединением общей формулы, где А, В иимеют указанное выше значение, в инертных растворителях, при необходимости в присутствии основания или в среде защитного газа до получения соединения общей формулы, где А, В, , и 6 имеют указанное выше значение, и в случае кислот (СО 2 Н) омыляют сложные эфиры, в случае амидов и сульфамидов, полученных из соответствующих карбоновых кислот, амидируют после предварительного активирования с помощью соединений общей формулы-3 ,где 3 имеет указанное выше значение, при необходимости в присутствии основания и/или вспомогательного средства, например, водоудаляющего средства, в инертных растворителях, и в случае свободных тетразолов, отщепляют тритильную группу кислотами, предпочтительно трифторуксусной кислотой или соляной кислотой в диоксане, и при необходимости вводят заместители А, В иобычными способами, например,восстановлением, окислением, алкилированием или гидролизом, или переводят в другие группы, при необходимости разделяют изомеры и в случае получения солей обрабатывают соответствующими основаниями или кислотами. Описанный способ может быть пояснен следующей схемой В качестве растворителя при осуществлении вышеуказанного способа можно использовать инертные органические растворители, не изменяющиеся в условиях реакций. К ним относятся простые эфиры как, например, простой диэтиловый эфир, диоксан, тетрагидрофуран, диметиловый эфир гликоля, углеводороды,например, бензол, толуол, ксилол, гексан, циклогексан, нефтяные фракции, галогенированные углеводороды как, например, дихлорметан, трихлорметан, тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол,или эфир уксусной кислоты, триэтиламин, пиридин, диметилсульфоксид, диметилформамид, триамид гексаметилфосфорной кислоты, ацетонитрил, ацетон или нитрометан. Кроме того, можно также использовать смеси указанных растворителей. Особенно предпочтительно используют диметилформамид и тетрагидрофуран. В качестве оснований пригодны известные органические и неорганические основания. Предпочтительно используют гидроокиси щелочных металлов как, например, гидроокись натрия или калия, гидроокиси щелочно-земельных металлов как, например, гидроокись бария, карбонаты щелочных металлов как, например,карбонат натрия или калия, или карбонаты щелочноземельных металлов как, например, карбонат кальция,или алкоголяты щелочных или щелочно-земельных металлов как, например, метанолат или этанолат натрия или калия или трет.бутилат калия, или органические амины (триалкил(С 1 - С 6)амины), например, триэтиламин, или гетероциклы, например, 1,4-диазабицикло 2.2.2 октан, 1,8-диазабицикло 5.4.0 ундек-7-ен, пиридин, диаминопиридин, метилпиперидин или морфолин. Можно использовать в качестве оснований щелочные металлы, например, натрий, или их гидриды, например, гидрид натрия. Предпочтительными являются гидрид натрия, карбонат калия, триэтиламин, пиридин и трет.бутилат калия. Обычно основание используют в количестве от 0,05 моль до 10 моль, предпочтительно 1-2 моль, в пересчете на 1 моль соединения формулы . Способ обычно проводят при температуре от -30 С до 100 С, предпочтительно от -10 С до 60 С, и при атмосферном давлении. Однако, способ можно также осуществлять при повышенном или пониженном давлении (например, 0,5-5 бар). В качестве оснований для омыления пригодны обычные неорганические основания. К ним предпочтительно принадлежат гидроокислы щелочных или щелочно-земельных металлов, такие, как, например, гидроокись лития, натрия, калия или бария, или карбонаты щелочных металлов, такие, как, например, карбонаты натрия, калия или бикарбонат натрия, или алкоголяты щелочных металлов, как, например, метанолат натрия,этанолат натрия, метанолат калия, этанолат калия или трет.бутанолат калия. Особенно предпочтительно используют гидроокись лития, натрия или гидроокись калия. В качестве растворителей пригодны для гидролиза вода или обычно используемые для гидролиза органические растворители. К ним предпочтительно принадлежат спирты как метанол, этанол, пропанол, изопропанол, бутанол или трет.бутанол, или простые эфиры, как, например, тетрагидрофуран или диоксан, или диметилформамид, или диметилсульфоксид. Особенно предпочтительно используют спирты, как, например,метанол, этанол, пропанол или изопропанол. Кроме того, можно также использовать смеси упомянутых растворителей. Гидролиз предпочтительно осуществляют кислотами, как, например, трифторуксусной кислотой, уксусной кислотой, хлористоводородной кислотой, смесью хлористоводородной кислоты с диоксаном, бромистоводородной кислотой, метансульфокислотой, серной кислотой или надхлорной кислотой, предпочтительно трифторуксусной кислотой или хлористоводородной кислотой в диоксане. Гидролиз обычно осуществляют при температуре от 0 С до 100 С, предпочтительно от 20 С до 80 С. Обычно гидролиз проводят при атмосферном давлении. Однако, его можно также осуществлять при пониженном или повышенном давлении (например, при давлении от 0,5 до 5 бар). При осуществлении омыления основание обычно используют в количестве от 1 до 3 моль, предпочтительно от 1 до 1,5 моль, в пересчете на 1 моль сложного эфира. Особенно предпочтительно используют молярное количество реагентов. При проведении реакции сначала получают карбоксилаты предлагаемых соединений в качестве промежуточных продуктов, которые можно выделять. Предлагаемые кислоты получают путем обработки карбоксилатов обычными неорганическими кислотами. К ним предпочтительно принадлежат минеральные кислоты, как, например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота или трифторуксусная кислота. При этом при получении карбоновых кислот целесообразным оказа 4 2794 1 лось подкисление щелочной реакционной смеси омыления на второй стадии без выделения карбоксилатов. Затем кислоты можно выделять известными приемами. Амидирование и сульфонамидирование соединений общей формулыобычно осуществляют в одном из вышеуказанных растворителей, предпочтительно в тетрагидрофуране или дихлорметане. Амидирование и сульфонамидирование могут протекать, в случае необходимости, через стадию активирования галогенангидридов кислоты или смешанных ангидридов, которые можно получать путем взаимодействия с тионилхлоридом, трихлоридом фосфора, пентахлоридом фосфора, трибромидом фосфора, оксалилхлоридом, или метансульфохлоридом. Амидирование и сульфонамидирование обычно проводят при температуре от 50 С до 80 С, предпочтительно от -30 С до 20 С, и атмосферном давлении. Кроме вышеупомянутых оснований в качестве основания пригодны также предпочтительно триэтиламин и/или диметиламинопиридин, 1,5-диазабицикло 3.4.0 ундецен-5 и 1,4-диазабицикло 2.2.2 октан. Основание используют в количестве от 0,5 моль до 10 моль, предпочтительно от 1 моль до 5 моль, в пересчете на 1 моль соединений общей формулы . В качестве связывающего кислоту агента для амидирования можно использовать карбонаты щелочных или щелочно-земельных металлов, как, например, карбонат натрия, карбонат калия, гидроокислы щелочных или щелочно-земельных металлов, как, например, гидроокись натрия или калия, или органические основания, как, например, пиридин, триэтиламин, -метилпиперидин или бициклические амидины, как, например,1,5-диазабицикло 3.4.0-нонен-5 или 1,5-диазабицикло 3.4.0 ундецен-5. Предпочтительно используют триэтиламин. В качестве агента дегидратации пригодны карбодиимиды, как, например, диизопропилкарбодиимид, дициклогексилкарбодиимид, гидрохлорид -(3-диметиламинопропил)этилкарбодиимида, карбонильные соединения, как, например, карбонилдиимидазол, 1,2-оксазолиевые соединения, как, например, 3-сульфонат 2 этил-5-фенил-1,2-оксазолия, ангидрид пропанфосфорной кислоты, изобугилхлороформат, гексилфторфосфат бензотриазолилокси-трис-(диметиламино)фосфония, амид сложного дифенилового эфира фосфоновой кислоты или хлорангидрид метансульфокислоты, в случае необходимости, в присутствии основания, как, например, триэтиламина, -этилморфолина, -метилпиперидина, дициклогексилкарбодиимида и оксисукцинимида (см. , , . . . . 95, 875 (1973) ., . .. 225, 507 (1982) и , К. , . . . . 13, 403 (1979), 17, 187 (1981. Связывающие кислоту агенты и агенты дегидратации обычно используют в количестве 0,5-3 моль, предпочтительно 1-1,5 моль, в пересчете на 1 моль соответствующей карбоновой кислоты. Получение производных заместителей А, В ипроисходит обычно известными из литературы способами, причем ниже поясняется восстановление альдегидов или алкоксикарбонильных соединений до спиртов(а), окисление альдегидов до карбоновых кислот (б) и алкилирование (в) а) Восстановление алкоксикарбонильных соединений или альдегидов до соответствующих спиртов обычно проводят гидридами, как, например, алюмогидридом лития или боргидридом натрия, предпочтительно алюмогидридом лития, в среде инертных растворителей, как, например, простых эфиров, углеводородов или спиртов или в среде их смесей, предпочтительно в среде простых эфиров, как, например, простого диэтилового эфира, тетрагидрофурана или диоксана, или спиртов, как, например, этанола, в случае альдегидов предпочтительно боргидридом натрия в этаноле, при температуре 0 С - 150 С, предпочтительно 20 С 100 С, при атмосферном давлении. б) Окисление альдегидов до карбоновых кислот обычно проводят в одном из вышеприведенных растворителей, предпочтительно трет.бутаноле, с перманганатом калия в присутствии гидрофосфата натрия и сульфита натрия при температуре -З 0 С до 20 С, предпочтительно от 20 С до 20 С и атмосферном давлении. в) Алкилирование обычно проводят в среде одного из вышеприведенных растворителей, алкилирующим агентом, таким, как, например, алкилгалогенид с 1-8 атомами углерода, сложный эфир сульфокислоты, незамещенные или замещенные диалкилсульфаты с 1-6 атомами углерода или диарилсульфаты с 1-10 атомами углерода, предпочтительно метилйодид, сложный эфир п-толуолсульфокислоты или диметилсульфат. Производные циклогексана общей формулыявляются новыми и могут быть получены тем, что соединения общей формулы, сначала переводят гидрированием с палладием на угле в одном из вышеприведенных растворителей, например, метаноле, в среде водорода в соединения общей формулы, и во второй стадии, еслитетразолил, этерифицируют обычными способами, и еслитетразолил, подвергают взаимодействию с хлорсульфонилизоцианатом в дихлорметане до получения соответствующих цианосоединений, затем вводят тетразолильную группу с помощью смеси азида натрия и триэтиламмонийхлорида в присутствии одного из вышеприведенных оснований, предпочтительно ,-диметилформамида, в среде азота, дальнейшим взаимодействием с трифенилметилхлоридом в присутствии одного из вышеприведенных растворителей или оснований, предпочтительно дихлорметана и триэтиламина, вводят трифенилметильную группу и затем проводят бромирование по метиленовой группе, при необходимости в присутствии катализатора. Восстановление двойной связи проводят при температуре от 0 С до 40 С, предпочтительно при 20 С и давлении 1 бар. Этерификацию проводят в одном из вышеприведенных растворителей, предпочтительно толуоле и тетрагидрофуране, после описанного выше предварительного активирования соответствующей карбоновой кислоты, предпочтительно через хлорангидриды карбоновой кислоты, и последующего взаимодействия с соответствующим алкоголятом при температуре от 0 С до 60 С, предпочтительно при 10 С до 35 С и атмосферном давлении. Превращение до цианосоединений и тетразолильных соединений проводят обычно при температуре кипения растворителя и атмосферном давлении. Введение трифенилметильной группы в тетразолильное кольцо происходит обычно при 0 С. Бромирование проводят предпочтительно -бромсукцинимидом, в среде одного из вышеприведенных растворителей, предпочтительно четыреххлористого углерода, при температуре от 40 С до 100 С, предпочтительно 60 С до 90 С и атмосферном давлении. В качестве катализатора для бромирования пригодны, например, азобисизобутиронитрил, перекись дибензоила, предпочтительно азобисизобутиронитрил, причем катализатор используют в количестве 0,01 моль- 0,1 моль, предпочтительно 0,01 моль - 0,05 моль, в пересчете на 1 моль соединения общей формулы . Соединения общей формулы также являются новыми и могут быть получены, например, тем, что соединения общей формулы,где 1 имеет указанное выше значение, подвергают взаимодействию в одном из вышеуказанных растворителей, предпочтительно толуоле, с 1,3-бутадиеном в присутствии гидрохинона при температуре от 180 С до 230 С, предпочтительно при 200 С и давлении примерно 20 бар. Соединения общей формулыизвестны или могут быть получены известными способами (см. ,,1977, стр. 572). Соединения общих формулиявляются новыми и могут быть получены, например, одним из вышеописанных способов. Соединения общей формулыизвестны (см. евр. пат.324 377,25, 163 23, 45 пат. США 4 355 040) или могут быть получены известными способами. Амины общей формулыявляются известными или могут быть получены известным способом (см.11/104, Р.В. Вицгерт, Успехи химии 32, 3 (1963) РЖХ 32,(1969)4, 87). Соединения общей формулы (1) согласно изобретению обладают неожиданным ценным фармакологическим спектром действия. Предлагаемые соединения имеют специфическое антагонистическое действие в отношении ангиотензина ,так как они тормозят связь ангиотензинас рецепторами. Они подавляют сосудосуживающие и стимулирующие секрецию альдостерона эффекты ангиотензина . Кроме того, они ингибируют пролиферацию гладких мышечных клеток. Поэтому их можно использовать в лекарствах для лечения повышенного артериального давления и артериосклероза. Кроме того, их можно использовать для лечения коронарных заболеваний сердца, недостаточности сердца, нарушения мозговой деятельности, ишемии мозговых заболеваний, нарушения периферического кровообращения, нарушения функций почки и надпочечника, бронхоспазмические и васкулярно вызванных заболеваний дыхательных путей, ретенции натрия и отеков. 6 2794 1 Исследование задержки индуцированного агонистами сокращения. Самок и самцов кроликов умерщвляли ударом в затылок и обескровливали, в некоторых случаях наркотизировали нембуталом (около 60-80 мг/кг внутривенно) и умерщвляли путем открытия грудной клетки. Грудную аорту вынимали, прилегающую к ней соединительную ткань удаляли, аорту подразделяли на кольцевые участки шириной 1,5 мм, каждый из которых при начальной нагрузке около 3,5 г подавали в 10 мл ванны, содержащей имеющий температуру 37 С аэрированный карбогеном питательный раствор Кребса/Хэнзелайта следующего состава 119 ммоль/л хлористого натрия 2,5 ммоль/л дигидрата хлористого кальция 1,2 ммоль/л дигидрогенфосфата калия 10 ммоль/л глюкозы 4,8 ммоль/л хлористого калия 1,4 ммоль/л семигидрата сульфата магния и 25 ммоль/л бикарбоната натрия. Сокращения определяли изометрически при помощи ячеек марки Статам УС 2 через мостиковые усилители, сигналы преобразовывали в цифровые величины при помощи аналогово-цифрового преобразователя и оценивали. Кривые по дозам агониста и действию составляли ежечасно. При этом каждую кривую составляли на основании 3-4 отдельных концентраций исследуемого соединения, которое вводили в ванну в промежутках 4 минут. После окончания составления кривой и последующих циклов промывки (16 раз в течение около 5 сек/мин вышеупомянутым питательным раствором) проводилась 28-минутная фаза покоя или инкубации, за которую, как правило, сокращения снова достигали исходного значения. Каждая третья кривая использовалась в качестве базовой величины для оценки каждого исследуемого в дальнейших опытах соединения, которое при составлении дальнейших кривых подавалось в ванны в повышающихся дозах, начиная с проведения периода инкубации. При этом каждый кольцевой сегмент аорты стимулировался тем же агонистом. Агонисты и их стандартные концентрации(объем аппликации на отдельную дачу 100 мкл) КС 1 22,7 32,7 42,7 52,7 ммоль/л 1-норадреналин 310-9 310-8 310-7 310-6 г/мл Серотонин 10-8 10-7 10-6 10-5 г/мл В-НТ 920 10-7 10-6 10-5 г/мл метоксамин 10-7 10-6 10-5 г/мл-9 ангиотензин 31010-8 310-8 10-7 г/мл Для определения КТ 50 (концентрации, при которой исследуемое соединение вызывает 50 -ное торможение) исходили из эффекта, получаемого при 3-ей субмаксимальной концентрации агониста. Предлагаемые соединения тормозят в зависимости от дозы индуцируемое ангиотензиномсокращение изолированной аорты кролика. Индуцированное деполяризацией калия или другими агонистами сокращение вообще не тормозилось или только слабо тормозилось при наличии высоких концентраций. Результаты опыта приведены в нижеследующей таблице 1. Таблица 1 Торможение сосудистых сокращений на изолированных аортных кольцах кроликовСоединение по примеруКТ 50 (нм) при сокращениях, индуцированных ангиотензином 4 1400 9 920 13 240 Определение антигипертенсивной активности у ненаркотизированных гипертенсивных крыс. Оральная антигипертенсивная активность предлагаемых соединений исследовалась у ненаркотизированных крыс при помощи хирургически индуцированного одностороннего стеноза артерий почки. Для этой цели правую артерию почки сужали при помощи серебряной скобки шириной в просвете 0,18 мм. При таком виде гипертонии активность ренина плазмы крови повышена в течение первых шести недель после вмешательства. Артериальное кровяное давление этих животных бескровно измеряли при помощи хвостовой манжеты в определенных временных промежутках после дачи исследуемого соединения. Исследуемые соединения в виде тилозной суспензии давали в различных дозах внутрижелудочно (орально) при помощи соответствующего зонда. Предлагаемые соединения снижали артериальное кровяное давление гипертенсивных крыс в клинически релевантных дозах. Кроме того, в зависимости от концентрации предлагаемые соединения тормозили специфическую связь радиоактивного ангиотензина . Взаимодействие предлагаемых соединений с рецептором ангиотензинана мембранных фракциях коры надпочечника (крупного рогатого скота). Свежую кору надпочечника крупного рогатого скота тщательно очищали от мозгового вещества и оболочки, после чего в 0,32 М раствора сахарозы при помощи мешалки типа Ультра-турракс (фирмы Янке унд Кункель, г. Штауфен, ДЕ) измельчали до крупного мембранного гомогената, который на двух стадиях цен 7 2794 1 трифугирования очищали с получением мембранных фракций. Исследования по определению связывания с рецептором проводили на частично очищенных мембранных фракциях с применением радиоактивного ангиотензина . Анализируемая среда объемом 0,25 мл содержала частично очищенные мембраны (50-80 мкг),3 Н-ангиотензина(3-5 нМ), буферный раствор (50 мМ Трис, рН 7,2), 5 мМ 2, а также исследуемые соединения. После 60-минутной инкубации при комнатной температуре несвязанную радиоактивность проб отделяли при помощи влажных стекловолокнистых фильтров, а связанную радиоактивность спектрофотометрически определяли в сцинтиляционной среде после промывки протеина холодным буферным раствором(50 мМ Трис/, рН 7,4, 5 полиэтиленгликоля с молекулярным весом 6000). Данные обрабатывали при помощи компьютерных программ для получения значений К или КТ 50 (К исправленные для используемой радиоактивности значения КТ 50 КТ 50 концентрация, при которой исследуемое соединение вызывает 50 ное торможение специфической связи радиолиганда). Результаты опыта приведены в нижеследующей таблице 2. Таблица 2 Соединение по примеруКТ (нМ) 9 120 13 72 16 440 Исследования торможения пролиферации гладких мышечных клеток предлагаемыми соединениями. С целью определения антипролифераторного действия соединений использовались гладкие мышечные клетки, полученные из аорт крыс или свиней при помощи технически Медиа-Эксплантат (см. . . . .. 50, стр. 172, 1971). Клетки высеивали в пригодных чашках, содержащих, как правило, 96 углублений, и культивировали в среде 199, содержащей 7,5 телячей эмбриональной сыворотки, 7,5 сыворотки новорожденного теленка, 2 мМ -глутамина и 15 мМ буфера , рН 7,4, в атмосфере, содержащей 5 СО 2,при температуре 37 С в течение 2-3 дней. Затем клетки синхронизировали путем удаления сыворотки на 2-3 дней и затем культивировали в присутствии ангиотензина , сыворотки и других необходимых факторов. Одновременно добавляли исследуемые соединения. Через 16-20 часов добавляли 1 мк 3 Н-тимидина и через дальнейшие 4 часа определяли встроение этого вещества в ДНК клеток, осажденных путем обработки трихлоруксусной кислотой. Для определения значений по КТ 50 рассчитывали концентрацию исследуемого соединения, которая при последовательном разведении обеспечивает полумаксимальнуго задержку включения тимидина, вызываемого 1 -ной тельячей эмбриональной сывороткой . Результаты опыта приведены в нижеследующей таблице 3. Таблица 3 Соединение по примеруТорможениепри 10-66 41 7 100 10 12 11 100 Новое активное вещество можно переводить известными приемами в обычные препараты, такие, как, например, таблетки, драже, пилюли, грануляты, аэрозоли, сиропы, эмульсии, суспензии и растворы с использованием инертных, нетоксичных, фармацевтически пригодных носителей или растворителей. При этом активное соединение должно иметься в терапевтически эффективной концентрации, например, в концентрации около 0,5-90 от веса соответствующей композиции, т.е. в количестве, достаточном для обеспечения указанной ниже дозировки. Препараты получают, например, путем смешивания активного вещества с растворителями и/или носителями, в случае необходимости при использовании эмульгаторов и/или диспергаторов, причем, например, в случае использования воды в качестве разбавителя, органические растворители можно использовать в качестве вспомогательных растворителей. Аппликацию осуществляют обычным образом, предпочтительно орально или парентерально, в частности черезъязычно или внутривенно. В случае парентерального применения можно использовать растворы активного вещества с применением пригодных жидких носителей. Для достижения эффективных результатов при внутривенной аппликации целесообразно использовать активное вещество в количестве около 0,001-1 мг/кг, предпочтительно около 0,01-0,5 мг/кг веса тела, а при оральной аппликации дозировка составляет около 0,01-20 мг/кг, предпочтительно 0,1 - 10 мг/кг веса тела. Но в случае необходимости может быть целесообразным применение активного вещества и в других количествах, а именно в зависимости от веса тела или вида аппликации, от индивидуального поведения к лекарству, вида препарата, момента или промежутка, когда осуществляют его аппликацию. Так, например, в 8 2794 1 некоторых случаях может быть достаточным использование активного вещества в количестве, меньшем указанного минимального количества, в то время как в других случаях активное вещество следует использовать в количестве, большем указанного максимального количества. В случае аппликации большего количества рекомендуется распределять его по нескольким дневным дозам. В нижеследующих примерах использовались для определения(тонкослойная хроматография) следующие растворители Адихлорметанметанол 51 Бдихлорметанметанол 31 Вдихлорметанметанол 201 Гдихлорметанметанол 101 Дпетролейный эфирэтилацетат 101 Епетролейный эфирэтилацетат 51 Жпетролейный эфирэтилацетат 21 3 петролейный эфирэтилацетат 11 Идихлорметанметанол 501 Нижеследующие примеры поясняют получение исходных соединений. Пример 1. транс -6-(4 -толил)-циклогекс-3-ен-1-карбоновая кислота. Известным способом (см. . . . . 11, 493 (1976 275 г (1,695 моль) 3-(4-толил)акриловой кислоты подвергают взаимодействию с 580 мл 1,3-бутадиена (количество определено в конденсированном виде) в 480 мл толуола с добавлением 3 г гидрохинона в течение 22 часов примерно при 200 С и 20 бар. Смесь разбавляют толуолом и экстрагируют 0,5 м. водного натрового щелока. Затем подкисляют водные фазы 1 м. соляной кислотой и экстрагируют диэтиловым эфиром. Эфирные растворы сушат над сульфатом натрия,упаривают и опять растворяют в толуоле. После кипячения в течение 15 минут в присутствии 5 г активированного угля фильтруют в горячем виде и упаривают растворитель до приблизительно 120-160 мл при 0-4 С выкристаллизовывается 124 г (573 моль) продукта. Фильтрат еще немного сгущают и опять охлаждают для дополнительной кристаллизации. При повторении этой операции выпадает в общей сложности еще 42 г(194 ммоль) продукта.0,39 (Г) 24,8 г (221 ммоль) трет.бутанолата калия при 0 С и продолжают перемешивать 20 часов при 20 С. Затем прибавляют воду и диэтиловый эфир и несколько раз экстрагируют. Органическую фазу сушат над сульфатом натрия, упаривают и остаток очищают хроматографией на силикагеле марки 60 (продукт фирмы Мерк, элюент В). Выход 39,6 г (130 ммоль)0,47 (Д) Способ Б. 20,0 г (91,6 ммоль) соединения по примерув 7 мл концентрированной серной кислоты суспендируют в 100 мл диэтилового эфира и смешивают при -30 С 80 мл (713 ммоль) изобутена в автоклаве. Смесь нагревают в закрытом автоклаве до 20 С и реакцию осуществляют в течение 20 часов. Затем охлаждают опять до-30 С, открывают автоклав и при перемешивании реакционную смесь подают в смесь 300 мл 3 м. натриевой щелочи и 400 мл диэтилового эфира при 20 С. Водную фазу экстрагируют диэтиловым эфиром, органический раствор сушат над сульфатом натрия и упаривают. Выход 23,3 г (84,9 ммоль). Пример . трет. бутиловый эфир транс-2-(4-бромметилфенил)-циклогексан-1-карбоновой кислоты. 11,70 г (42,6 ммоль) соединения по примеруподвергают взаимодействию с 7,59 г (42,6 ммоль) бромсукцинимида и 1,4 г азобисизобутиронитрила при кипячении с обратным холодильником в 100 мл тетрахлорметана. Спустя 4 часа смесь охлаждают, отфильтровывают выпавший сукцинимид и упаривают фильтрат. 9 100,0 г (458,0 ммоль) соединения по примерув 1 л дихлорметана подвергают взаимодействию с 84,3 г(595,5 г) хлорсульфонилизоцианата в 100 мл дихлорметана при кипячении в течение часа (50, 18 (1970. Затем к охлаждающейся реакционной смеси прикалывают 72 мл (938,9 ммоль) ,диметилформамида и перемешивают 18 часов. Выливают на 350 г льда, после таяния льда разделяют фазы и экстрагируют дихлорметаном. Высушенные карбонатом калия органические фазы упаривают и остаток перегоняют. Получают 57,8 г (290,2 ммоль) продукта. Т. кип. 122-131 С (0,2 мбар).0,81 (дихлорметан). Пример . 5-транс-2-(4-толил)-циклогекс-1-илтетразол. 15,34 г (69,6 ммоль) соединения по примерув 230 мл безводного ,диметил-формамида подвергают взаимодействию с 22,6 г (348 ммоль) азида натрия и 47,9 г (348 ммоль) хлорида триэтиламмония при кипячении в атмосфере азота спустя 20 часов выливают после охлаждения в диэтиловый эфир и 1 м. серную кислоту и экстрагируют затем 10 -ного натрового щелока. Водную фазу при 0 С доводят до рН 1,5 с помощью 1 м. соляной кислоты и отфильтровывают выпавший осадок, промывают водой и сушат в высоком вакууме над пятиокисью фосфора и гидроокисью натрия. Выход 11,2 г (46,2 ммоль).0,23 (В). Пример . 5-транс-2-(4-толил)-циклогекс-1-ил-2-трифенилметил-тетразол. 11,0 г (45,7 ммоль) соединения по примерув 170 мл дихлорметана подвергают взаимодействию с 13,4 г(48,2 ммоль) трифенилметилхлорида и 7,57 мл (54,6 ммоль) триэтиламина при 0 С. Перемешивают около 20 часов, причем смесь нагревается до комнатной температуры. Экстрагируют диэтиловым эфиром и водной лимонной кислотой. Органические фазы сушат сульфатом натрия и упаривают. Выход 22,1 г (45,5 ммоль).0,67 (Е). Пример . 5-транс-2-(4-бромметилфенил)-циклогекс-1-ил-2-трифенилметил-тетразол. 22,1 г (45,5 ммоль) соединения по примерув 300 мл тетрахлорметана подвергают взаимодействию с 8,1 г(45,5 ммоль) -бромсукцинимида и 0,3 г азобисизобутиронитрила при кипячении с обратным холодильником в течение 3 часов. Затем охлаждают до комнатной температуры и потом до 0 С и отфильтровывают осадок. Фильтрат упаривают и получают сырой продукт (26,2 г), который без дальнейшей очистки подвергают дальнейшей обработке.0,47 (Д). Нижеследующие примеры поясняют получение имидазолилзамещенных производных циклогексана формулы . Пример 1. трет.бутиловый эфир транс-2-4-(2-бугил-4-хлор-5-формил-имидазол-1-ил-метил)фенил-циклогексан-1 карбоновой кислоты. 8,16 г (43,7 ммоль) 2-бугил-4-хлор-5-формил-имидазола (евр. пат.324 377) перемешивают в 10 мл диметилформамида с 1,32 г (43,7 ммоль) гидрида натрия (80 -ный, стабилизированный парафином) до окончания выделения водорода при температуре около 0 С. Затем прикапывают раствор 18,4 г (43,7 ммоль) соединения по примерув 100 мл диметилформамида и перемешивают 20 часов при 20 С. Для обработки добавляют воду и экстрагируют эфиром. Органические фазы сушат над сульфатом натрия и упаривают. Полученный остаток очищают хроматографией на силикагеле 60 (Мерк, растворитель (Д. Выход 7,81 г (17,0 ммоль).0,67 (Е). Пример 2 транс-2-4-(2-бутил-4-хлор-5-формил-имидазол-1-ил-метил)фенил-циклогексан-1-карбоновал кислота 2,7 г (5,2 ммоль) соединения по примеру 1 подвергают взаимодействию в 40 мл диоксана с 16 мл концентрированной соляной кислоты. После проведения реакции в течение 18 часов при 20 С разбавляют эфиром,смешивают с 1 м. водного натрового щелока и экстрагируют в делительной воронке при встряхивании. Водную щелочную фазу (рН 13-14) освобождают в вакууме от органического растворителя и устанавливают рН 2 при 0 С с помощью 2 м. соляной кислоты. Выпавший осадок отфильтровывают, промывают водой и сушат в глубоком вакууме над гидроокисью натрия и пятиокисью фосфора. Выход 2,0 г (5,0 ммоль).0,28 (В). Аналогично примеру 2 получают приведенные в таблице 4 соединения Соединение по примеру 3 4 Пример 5. транс-2-2-бутил-4-хлор-5-формил-имидазол-1-ил-метил)фе 0,7 г (1,5 ммоль) соединения по примеру 2 подвергают взаимодействию в 30 мл тетрагидрофурана при -20 С с 0,127 мл (1,65 ммоль) хлорангидрида метансульфокислоты и 0,91 мл (6,6 ммоль) триэтиламина. Спустя 2 часа прибавляют при этой температуре 0,73 г (6,0 ммоль) 4-(,-диметиламино)пиридина и 0,31 г (1,8 ммоль) 4-толуолсульфамида и перемешивают 24 часа при 20 С. Затем реакционную смесь выливают в 1 М соляную кислоту и многократно экстрагируют эфиром. Органические фазы сушат сульфатом натрия, упаривают и полученный остаток очищают на силикагеле 60 (Мерк, растворитель Ж). Выход 0,72 г (1,3 ммоль).0,72 (В). Пример 6 и Пример 7. 1,3 г (2,8 ммоль) соединения по примеру 2 подвергают взаимодействию при -30 С в 30 мл тетрагидрофурана с 0,78 мл (5,6 ммоль) триэтиламина и 0,235 мл (3,1 ммоль) хлорангидрида метансульфокислоты. Спустя 30 мин. при -30 С прикалывают раствор 459 мг (3,3 ммоль) -фенилглицинола и 0,34 г (2,8 ммоль) 4-(,диметиламино)пиридина в 10 мл тетрагидрофурана и смесь перемешивают при нагревании до 20 С в течение 24 часов. Выливают в 1 м. соляную кислоту и экстрагируют многократно эфиром. Органические фазы сушат сульфатом натрия, упаривают и остаток разделяют хроматографией (силикагель 60, Мерк). Выход Выход 186 мг (0,36 ммоль) пример 6 (диастереомер А). 591 мг пример 6/7 (смесь диастереомеров АВ). 12 1 г (1,9 ммоль) соединения по примеру 1 растворяют в 10 мл этанола и подвергают взаимодействию при 20 С с 74,2 мг (2,0 ммоль) бораната натрия. Спустя 1 час прибавляют воду и экстрагируют эфиром. Органическую фазу сушат сульфатом натрия и упаривают. Выход 0,97 г (1,85 ммоль).0,53 (3). Аналогично примеру 8 получают приведенные в таблице 5 соединения Таблица 5 Соединение по примеру 2794 1 1,0 г (1,9 ммоль) соединения по примеру 1 растворяют в 9 мл трет.буганола и подвергают взаимодействию при 20 С с 7,7 мл 1,25 м. водного раствора гидрофосфата натрия и 11,5 мл 1 м. водного раствора перманганата калия. Через 10 минут останавливают реакцию добавлением насыщенного водного раствора сульфита натрия, устанавливают рН 3,51 М соляной кислотой и экстрагируют этилацетатом. После отгонки растворителя вносят в диэтиловый эфир и экстрагируют 2 м. водного натового щелока. Водную фазу освобождают в вакууме от остатков растворителя и при 0 С устанавливают рН 11 добавкой м. соляной кислоты, выпавший осадок отфильтровывают, промывают водой и сушат в глубоком вакууме над смесью гидроокиси натрия и пятиокиси фосфора. Выход 120 мг (0,2 ммоль).0,28 (Г). Эфирная фаза содержит после экстракции щелочью 81 исходного продукта. Пример 13. рацемат 0,2 г (0,3 ммоль) соединения по примеру 14 подвергают взаимодействию в 2 мл тетрагидрофурана с 1 мл воды и 1 мл трифторуксусной кислоты. Спустя 2 часа при комнатной температуре выливают в смесь диэтилового эфира с водой и устанавливают рН 13 добавкой 10 - ного натрового щелока. Водную фазу подкисляют при 0 С 1 м. соляной кислотой до рН 2, при этом выпадает продукт. Отфильтровывают и сушат в глубоком вакууме над пятиокисью фосфора и гидроокисью натрия. Получают 0,1 г (0,2 ммоль) продукта.0,10 (И). Пример 17. 5-транс-2-(42-бутил-4-хлор-5-гидроксиметил-имидазол-1-ил-метил)фенил-циклогекс-1-ил-тетразол. Аналогично примеру 16 получают целевое соединение Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66. 15
МПК / Метки
МПК: C07D 233/68, A61K 31/415
Метки: циклогексана, имидазолилзамещенные, соли, производные
Код ссылки
<a href="https://by.patents.su/15-2794-imidazolilzameshhennye-proizvodnye-ciklogeksana-i-ih-soli.html" rel="bookmark" title="База патентов Беларуси">Имидазолилзамещенные производные циклогексана и их соли</a>
Предыдущий патент: Захват пилы
Следующий патент: Водная стабильная способная к перекачиванию суспензия для приготовления моющих и чистящих средств
Случайный патент: Термоконтейнер