Пиридо[3,2-е]пиразиноны, обладающие антиастматическим и антиаллергенным действием , способы их получения, лекарственный препарат и способ его получения
Номер патента: 3732
Опубликовано: 30.12.2000
Авторы: Томас БЮХНЕР, Штефан Селеньи, Уте АХТЕРРАТ-ТУКЕРМАНН, Бернхард Кучер, Норберт ХОФГЕН
Текст
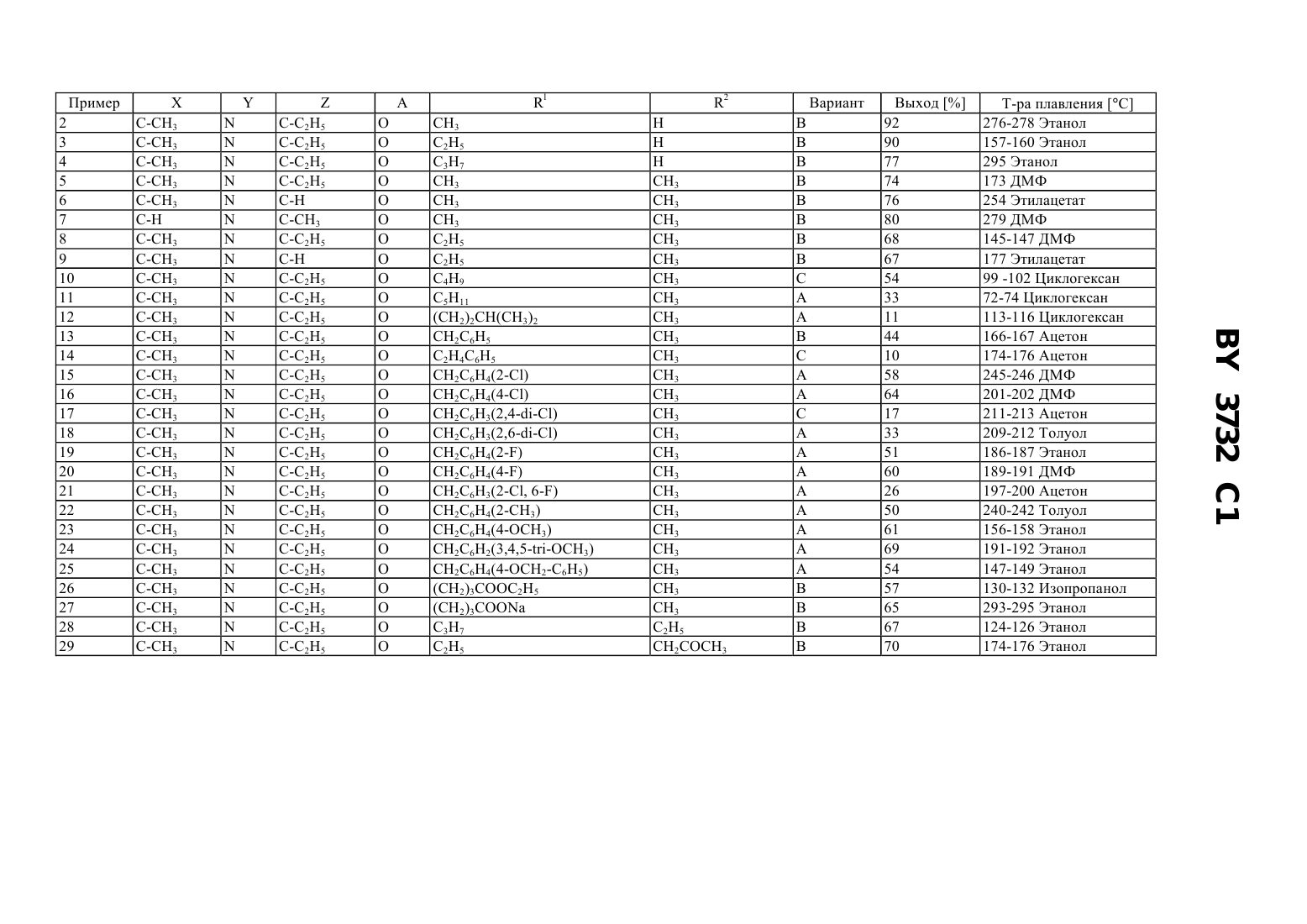
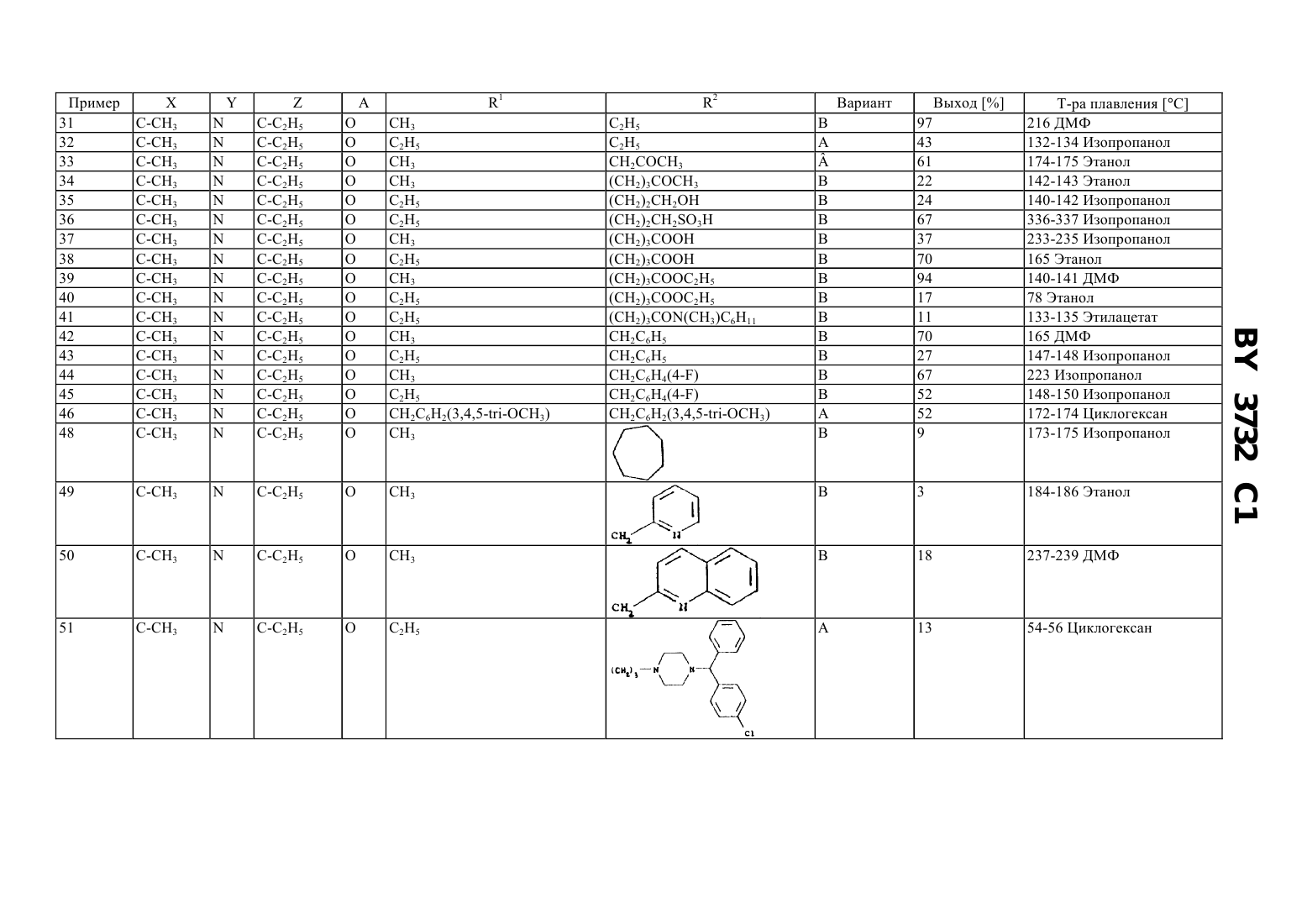
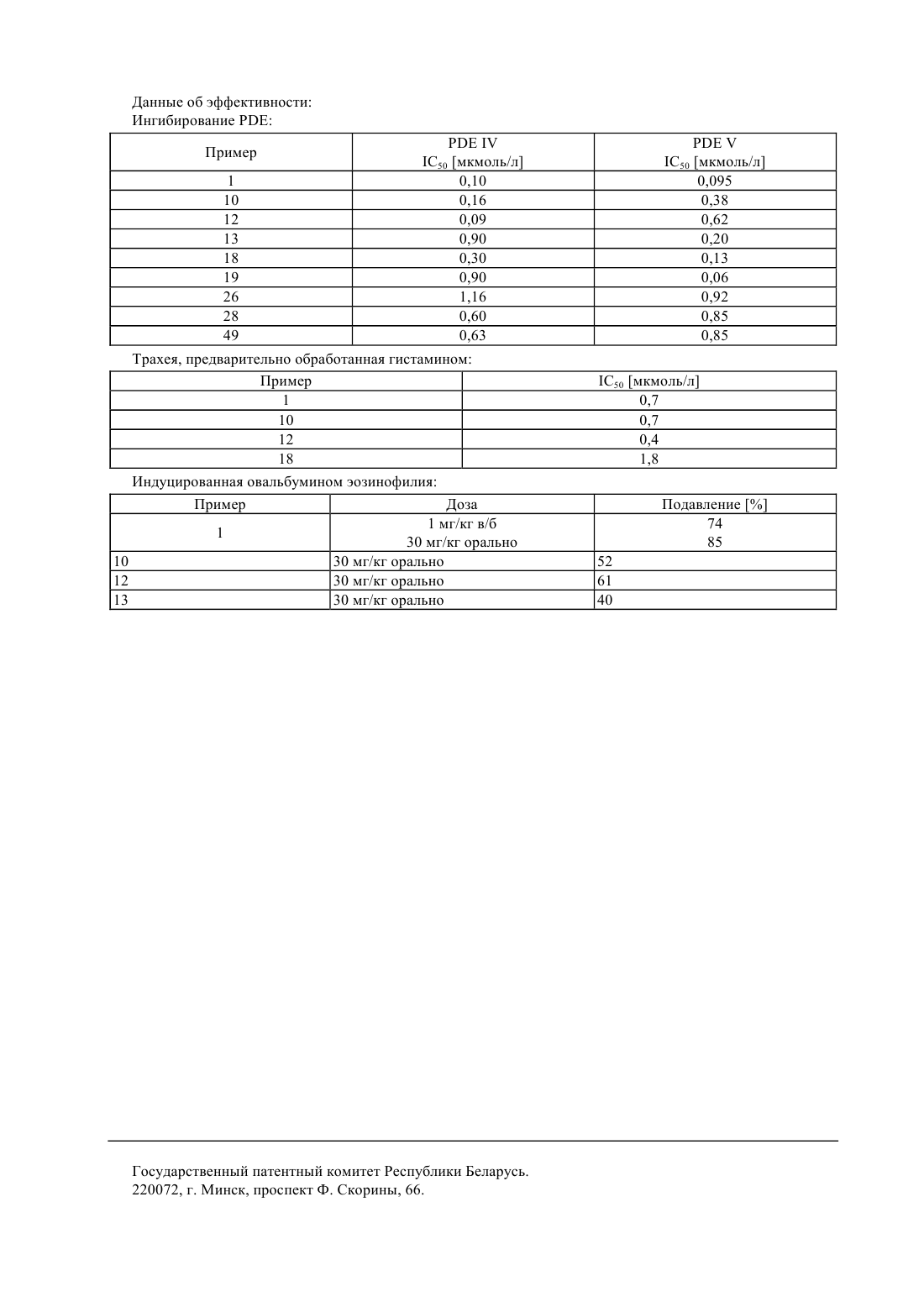
61 31/495 ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ(71) Заявитель АСТА МЕДИКА АКТИЕНГЕЗЕЛЛЬШАФТ(73) Патентообладатель АСТА МЕДИКА АКТИЕНГЕЗЕЛЛЬШАФТ,и-или С 4, причем, по меньшей мере, один из ,иозначает 1 - неразветвленный или разветвленный С 1-С 10-алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2 С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6 алкоксигруппой фенил, фенилокси, С 5-С 9-гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2,С, СО 5 или 6, где 2 неразветвленный или разветвленный С 2-С 10-алкенил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей гидрокси, С 1-С 6 алкокси, С 2-С 6-алкенилокси, С 2-С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6-алкоксигруппой фенил, фенилокси, С 5-С 9-гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2, С, СО 5 или 6, где 2 неразветвленный или разветвленный С 2-С 10-алкинил, необязательно замещенный одним или несколькими заместителями, выбранными из группы,включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2-С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6-алкоксигруппой фенил, фенилокси, С 5-С 9 гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2, С, СО 5 или 6, где 2 С 5-С 7 циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы,включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2-С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6-алкоксигруппой фенил, фенилокси, С 5-С 9 гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2, С, СО 5 или 6, где 2 3732 1 2 - Н, неразветвленный или разветвленный С 1-С 10-алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей гидрокси, С 1-С 6-алкокси, С 2-С 6 алкенилокси, С 2-С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6 алкилом, С 1-С 6-алкоксигруппой фенил, фенилокси, С 5-С 9-гетероарил, амино, моно- или ди(С 1 С 6)алкиламино, галоген, О 2, С, СО 5 или 6, где 2 неразветвленный или разветвленный С 2 С 10-алкенил, необязательно замещенный одним или несколькими заместителями, выбранными из группы,включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2-С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6-алкоксигруппой фенил, фенилокси, С 5-С 9 гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2, С, СО 5 или 6, где 2 неразветвленный или разветвленный С 2-С 10-алкинил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2-С 6 алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6 алкоксигруппой фенил, фенилокси, С 5-С 9-гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2,С, СО 5 или 6, где 2 С 5-С 7-циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2-С 6 алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6 алкоксигруппой фенил, фенилокси, С 5-С 9-гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2,С, СО 5 или 6, где 2 4 - водород или разветвленный С 1-С 6-алкил 5 - водород, разветвленный С 1-С 6-алкил, разветвленный С 1-С 6-алкокси, моно- или ди(С 1-С 6 алкил)аминогруппа 6 - гидрокси и их физиологически совместимые соли, обладающие антиастматическим и антиаллергенным действием. 2. Способ получения пиридо 3,2-епиразинонов формулыили их физиологически совместимых солей путем взаимодействия соединений формулы где , , , А и 2 имеют значения, указанные в п. 1,с соединением формулы 1-На,где На - галоген,1 имеет значения, указанные в п. 1,в присутствии неорганических или органических основных катализаторов, и, при необходимости, перевода основных или кислых соединений формулыв соли. 3. Способ получения пиридо 3,2-епиразинонов формулыили их физиологически совместимых солей путем взаимодействия соединений формулы где , , , А и 1 имеют значения, указанные в п. 1,с соединением формулы 2-На,где На - галоген,2 имеет значения, указанные в п. 1,в присутствии неорганических или органических основных катализаторов, и, при необходимости, перевода основных или кислых соединений формулыв соли. 2 3732 1 4. Лекарственный препарат с антиастматическим и антиаллергенным действием, содержащий активное вещество в смеси с нейтральным физиологически совместимым наполнителем и/или разбавителем или другим вспомогательным веществом, отличающийся тем, что в качестве активного вещества содержит одно или несколько соединений формулыв эффективном количестве. 5. Способ получения лекарственного препарата по п. 4, включающий доведение активного вещества до терапевтически применяемой формы или перевод активного вещества в фармацевтическую форму с использованием фармацевтических наполнителей и/или разбавителей или других вспомогательных веществ, отличающийся тем, что в качестве активного вещества используют одно или несколько соединений формулы ., где А означает атом азота или СН, Б и Д - атом азота или СН или замещенный атом углерода , 1 и 2 атомы водорода или различные органические заместители. Эти соединения обладают положительным инотропным пролонгированным действием. Из публикации (, 10, 1972, стр. 344-350) известен также способ получения соединений с формулой,-(2)12,гдеможет соответствовать 3-диметиламинопропилу-(1), 2-морфолиноэтилу-(1), 2 пирролидиноэтилу-(1) или 2-диметиламиноэтилу. Фармокологическое действие этих соединений не приводится. В 2 описаны 4,5-дигидро-4-оксо-пирроло 1,2-ахиноксалин и аза-производные с общей формулой, где 1, 2, 3 и 4 представляют собой ряд органических заместителей. Эти соединения обладают антиаллергенным, антиастматическим, анксиолитическим, сосудорасширяющим и гипотензивным действием, а также положительным инотропным действием, причиной которого является селективное ингибирование фосфодиэстеразы-Ш (-). В 3 описаны имидазохиноксалиноны с общей формулой, где А - 5-членный гетероцикл с двумя или тремя атомами азота в кольце, 1 - 2 или С 3, Х - различные цепи вплоть до четырех звеньев, частично содержащие азот. Эти соединения являются антагонистами глутамат-рецептора и обладают психотропным действием, а также антиишемической активностью. В патентных заявках Японии 06 128 261 и 06 128 262 сообщается о способе получения соединений с общей формулой, где 1, 2, 3 и 4 представляют собой различные органические заместители. Данные о фармакологическом действии отсутствуют. Из европейского патента 0 623 620 известен способ получения соединений с общей формулой, где А - анеллированные ароматические или гетероароматические циклические системы и 1 замещенные аминогруппы. Некоторые из этих соединений являются 5 НТ 3-агонистами. В европейском патенте 0 518 530 приводится способ получения соединений с общими формулами где 1, 2 и 3 соответствуют различным органическим заместителям, 1-5 - атомы углерода или азота,причем по крайней мере два из них - атомы азота. Эти соединения являются антагонистами рецепторов, возбуждаемых аминокислотами. Из 4 известно о способе получения соединений с общей формулой, где А означает насыщенные или ненасыщенные алкиленовые группы с 1-5 атомами углерода, 1, 2, 3,4, 5 различные органические заместители, 6-функциональная группа содержащая карбонильную группу. Эти соединения являются антагонистами рецепторов, возбуждаемых аминокислотами. Задачей изобретения является получение пиридо 3,2-епиразинонов с высокой антиастматической и антиаллергенной активностью, разработка способов их получения, лекарственный препарат на их основе и способ его получения. Для решения поставленной задачи предлагаются пиридо 3,2-епиразиноны формулы 4,и - или 4, причем, по меньшей мере, один из , иозначает 1 - неразветвленный или разветвленный С 1-С 10-алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2 С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6 алкоксигруппой фенил, фенилокси, С 5-С 9-гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2,С, СО 5 или 6, где 2 неразветвленный или разветвленный С 2-С 10-алкенил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей гидрокси, С 1-С 6 алкокси, С 2-С 6-алкенилокси, С 2-С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6-алкоксигруппой фенил, фенилокси, С 5-С 9-гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2, С, СО 5 или 6, где 2 неразветвленный или разветвленный С 2-С 10-алкинил, необязательно замещенный одним или несколькими заместителями, выбранными из группы,включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2-С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6-алкоксигруппой фенил, фенилокси, С 5-С 9 гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2, С, СО 5 или 6, где 2 С 5-С 7 циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы,включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2-С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6-алкоксигруппой фенил, фенилокси, С 5-С 9 гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2, С, СО 5 или 6, где 2 2 - Н, неразветвленный или разветвленный С 1-С 10-алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей гидрокси, С 1-С 6-алкокси, С 2-С 6 алкенилокси, С 2-С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6 алкилом, С 1-С 6-алкоксигруппой фенил, фенилокси, С 5-С 9-гетероарил, амино, моно- или ди(С 1 С 6)алкиламино, галоген, О 2, С, СО 5 или 6, где 2 неразветвленный или разветвленный С 2 С 10-алкенил, необязательно замещенный одним или несколькими заместителями, выбранными из группы,включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2-С 6-алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6-алкоксигруппой фенил, фенилокси, С 5-С 9 гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2, С, СО 5 или 6, где 2 неразветвленный или разветвленный С 2-С 10-алкинил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2-С 6 алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6 алкоксигруппой фенил, фенилокси, С 5-С 9-гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2,С, СО 5 или 6, где 2 С 5-С 7-циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей гидрокси, С 1-С 6-алкокси, С 2-С 6-алкенилокси, С 2-С 6 алкинилокси, незамещенный или одно- или многократно замещенный галогеном, С 1-С 6-алкилом, С 1-С 6 алкоксигруппой фенил, фенилокси, С 5-С 9-гетероарил, амино, моно- или ди(С 1-С 6)алкиламино, галоген, О 2,С, СО 5 или 6, где 2 4 - водород или разветвленный С 1-С 6-алкил 5 - водород, разветвленный С 1-С 6-алкил, разветвленный С 1-С 6-алкокси, моно- или ди(С 1-С 6 алкил)аминогруппа 6 - гидрокси и их физиологически совместимые соли, обладающие антиастматическим и антиаллергенным действием. Другим объектом изобретения является способ получения пиридо 3,2 епиразинонов формулыи их физиологически совместимых солей путем взаимодействия соединений формулы 3732 1 где , , , А и 2 имеют значения, указанные выше, с соединением формулы 1-,гдегалоген,1 имеет значения, указанные выше,в присутствии неорганических или органических основных катализаторов, и, при необходимости, перевода основных или кислых соединений формулыв соли. Еще одним объектом изобретения является способ получения пиридо 3,2-епиразинонов формулыи их физиологически совместимых солей путем взаимодействия соединений формулы где , , , А и 1 имеют значения, указанные выше, с соединением формулы 2-На,где На - галоген,2 имеет значения, указанные в п. 1,в присутствии неорганических или органических основных катализаторов, и, при необходимости, перевода основных или кислых соединений формулыв соли. Кроме того, объектом изобретения является лекарственный препарат с антиастматическим и антиаллергенным действием, содержащий активное вещество в смеси с нейтральным физиологически совместимым наполнителем и/или разбавителем или другим вспомогательным веществом. В качестве активного вещества он содержит одно или несколько соединений формулыв эффективном количестве. Еще одним объектом изобретения является способ получения лекарственного препарата с антиастматическим и антиаллергенным действием, включающий доведение активного вещества до терапевтически применяемой формы или перевод активного вещества в фармацевтическую форму с использованием фармацевтических наполнителей и/или разбавителей или других вспомогательных веществ. В качестве активного вещества используют одно или несколько соединений формулы . Соединения формулы , содержащие асимметричный атом углерода, как правило, образуют рацематы и могут быть разделены на оптически активные изомеры с помощью известных способов, например, с применением оптически активной кислоты. Возможно также использовать в качестве исходного материала оптически активное соединение, причем конечный продукт будет содержать соответствующие оптически активные соединения или диастереомеры. Таким образом, в изобретении описаны соединения формулы , которые содержат асимметричный атом углерода, -форму, -форму и смесь ,-форм, а также в случае большего количества асимметричных атомов углерода, диастереомерные формы. В зависимости от условий эксперимента и исходных материалов можно получить соединения формулыкак в свободной форме, так и в виде солей. Полученные соли могут быть переведены в свободные основания по известной методике, например, с использованием щелочи или ионообменной хроматографии, и в свободные кислоты с использованием органических и неорганических кислот. Синтез соединений формулыиз соединений формулыможно проводить как без растворителя, так и с подходящим растворителем или диспергатором. В качестве растворителя или диспергатора, используют, например, ароматические углеводороды, такие как бензол, толуол, ксилол, мезитилен низшие алифатические кетоны, такие как ацетон, метилэтилкетон, диэтилкетон эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан сульфоксиды, такие как диметилсульфоксид третичные амиды кислот, такие как диметилформамид, диметилацетамид, тетраметилмочевина, гексаметилфосфотриамид, -метилпирролидон галогенсодержащие углеводороды, такие как хлорбензол, дихлорбензол, четыреххлористый углерод низшие спирты, такие как метанол, этанол, изопропанол смеси указанных растворителей, а также смеси с водой. Реакцию проводят, например, в интервале температур 20-200 С, предпочтительно в интервале 50-130 С. Компонент 1- может содержать С, В и . Реакцию проводят предпочтительно в присутствии акцепторов кислот карбонатов щелочных металлов(карбонат натрия, карбонат калия), ацетатов щелочных металлов, гидроксидов щелочных металлов или третичных оснований (триэтиламин, пиридин). В качестве исходных веществ используют предпочтительно соединения формулыв виде их металлических солей. Преимущественно используют соли щелочных металлов. Соли щелочных металлов получают, например, обработкой гидридами щелочных металлов, амидами щелочных металлов, алкоголятами щелочных металлов или щелочными металлами в растворителе (низший спирт, ароматический углеводород, третичные амиды кислот) или в водной щелочи (например, ). 6 3732 1 Синтез соединения формулыиз соединения формулыможно проводить как без растворителя, так и с подходящим растворителем или диспергатором. В качестве растворителя. или диспергатора, например, используют ароматические углеводороды, такие как бензол, толуол, ксилол, мезитилен низшие алифатические кетоны, такие как ацетон, метилэтилкетон, диэтилкетон эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан сульфоксиды, такие как диметилсульфоксид третичные амиды кислот, такие как диметилформамид, диметилацетамид, тетраметилмочевина, гексаметилфосфотриамид, -метилпирролидон галогенсодержащие углеводороды, такие как хлорбензол, дихлорбензол, четыреххлористый углерод низшие спирты,такие как метанол, этанол, изопропанол смеси указанных растворителей, а также смеси с водой. Реакцию проводят, например, в интервале температур 20-200 С, предпочтительно в интервале 50-130 С. Компонент 2- может содержать С, В и . Реакцию проводят предпочтительно в присутствии акцепторов кислот карбонатов щелочных металлов(карбонат натрия, карбонат калия), ацетатов щелочных металлов, гидроксидов щелочных металлов или третичных аминов (триэтиламин, пиридин). В качестве исходных веществ используют предпочтительно соединения формулыв виде их металлических солей. Преимущественно используют соли щелочных металлов. Соли щелочных металлов получают, например, обработкой гидридами щелочных металлов, амидами щелочных металлов, алкоголятами щелочных металлов или щелочными металлами в растворителе (низшие спирты, ароматические углеводороды, третичные амиды кислот) или в водной щелочи (например, ). Из полученных таким образом соединений формулыпутем их обработки неорганическими и органическими кислотами можно получить соответствующие соли, пригодные для составления лекарственных препаратов. Согласно изобретению, соединения формулыи их соли обладают биологической активностью. Новые соединения обладают фармакологическим действием и прежде всего высокой антиастматической и антиаллергенной активностью, в основе которой лежит селективное ингибирование фосфодиэстеразы/. Согласно изобретению, соединения обладают сильным ингибированием фосфодиэстеразыии сильным действием на предварительно обработанные гистамином трахеи (морских свинок), а также значительной активностьюна спровоцированную астму, например, на поздней стадии астмы (эозинофилии) у морских свинок. Методики Определение фосфодиэстеразнойактивностиактивность определяли по известной методике ( М.М.,. . . . . 10. 6992 (1979, модифицированной Бауером ( .,3,5-25. - . . 311 193-198 (1980. Реакционная смесь содержит 40 Трис- (рН 7,4), 52 0,5 М цАМФ или цГМФ,3 НцАМФ или 3 НцГМФ (приблизительно 20 000 имп./мин на одну пробу) и необходимые компоненты для повышения чувствительности по отношению к отдельным изоферментам (см. ниже). Конечный объем составляет 200 м/л. Исследуемые соединения готовят в виде концентрированного (запасного) раствора в диметилсульфоксиде. Концентрация диметилсульфоксида в реакционной смеси не более 1 об. . Такая концентрация диметилсульфоксида не влияет на определение -активности. После предварительной инкубации реакционной смеси в течение 5 мин при 37 С реакцию начинают, добавляя субстрат (цАМФ или цГМФ). Затем пробы инкубируют в течение 15 мин при 37 С. Реакцию останавливают добавлением 50 л 0,2 НС. Пробы охлаждают во льду в течение 10 мин. После инкубации реакционной смеси с 25 г 5-нуклеотидазы( ) в течение 10 мин при 37 С пробы наносят на колонки с -сефадексом-А-25 ( колонки, -). Колонки промывают 2 мл 30 формиата аммония (р 6,0). Радиоактивность полученных фракций определяют сцинтилляционным методом.- активность (цАМФ-специфичную) определяют по методу Шудта ( С.....,. - . . 344., 682-690 (1991 с использованием цитозоля полиморфноядерных лейкоцитов человека. В качестве субстрата используют цАМФ. Активность , наличие которой связано с возможным присутствием примесей тромбоцитов, полностью подавляют добавлением мотапизона (1 М) - специфического ингибитора -.- (цГМФ-специфичную) выделяют из тромбоцитов по методу ( С...,. . . 42., 153-162 (1991. В качестве субстрата используют цГМФ. Действие на трахеи, предварительно обработанные гистамином Морских свинок обескровливают под наркозом. Трахеи отделяют от окружающих тканей и разрезают на пять равных частей (длиной по крайней мере в 3 хрящевых кольца). Полученные части трахей подвешивают в ванне с питательной средой (-). Величину сокращения кусочков трахей измеряют с помощью динамометра. Для уравновешивания трахеи выдерживают в питательной среде в течение 15 мин после под 7 3732 1 вешивания. Затем при добавлении изопреналина (1 х 10-7 моль/л) получают трахеи в состоянии полного растяжения. Вслед за этим ванну промывают и добавляют раствор метахолина (10 х 10-5 моль/л), что приводит к максимальному сокращению трахей. После промывки ванны в раствор добавляют гистамин (1 х 10-4 моль/л). Через 10 мин достигается максимум сокращения. Затем в ванну добавляют исследуемые соединения с увеличивающейся концентрацией и снижающую сокращение активность определяют в процентах по отношению к контрольному опыту (необработанные трахеи). Среднюю активность рассчитывают с помощью регрессионного анализа. С целью проверки функциональности органов в конце опыта в ванну еще раз добавляют изопреналин (1 х 15 моль/л) и наблюдают способность трахей к растяжению. Определение поздней стадии астмы (эозинофилии) у морских свинок Самцов морских свинок (250-300 г,,) сенсибилизируют путем подкожной инъекции овальбумина (10 г 100 мг гидроксида алюминия) и через две недели проводят повторную сенсибилизацию (10 г 100 мг гидроксида алюминия). Через неделю животных обрабатывают в течение 20 с путем аэрозольного распыления 0,5 раствора овальбумина. Через 24 ч животных усыпляют высокой дозой пентобарбитала и проводят бронхоальвеолярную промывку 2 х 5 мл раствором поваренной соли. Промывочные растворы собирают и центрифугируют в течение 10 мин. Осадок суспендируют в 1 мл физиологического раствора и количество эозинофилов подсчитывают микроскопически в счетной камере с использованием набора Бектона-Дикинсона. Число эозинофилов подсчитывают для каждой свинки, затем определяют среднее число для каждой группы животных. Подавление эозинофилии исследуемыми соединениями определяют по формуле(А - С) - (В - С) / (А - С) х 100 подавления,Ачисло эозинофилов для контрольной группы животных, необработанных исследуемым соединением,с провоцированной овальбумином астмой,Вчисло эозинофилов для группы животных, обработанных исследуемым соединением, с провоцированной овальбумином астмой,Счисло эозинофилов для контрольной группы здоровых животных, необработанных овальбумином. За 2 ч до провоцирования астмы аллергеном вводят исследуемые соединения через рот (р.о.) (в 1 метоцеле) или внутрибрюшинно (в 0,5 метоцеле). Контрольной группе животных вводят 1 метоцел р.о. или 0,5 метоцел за 2 ч до провоцирования астмы. Ниже приводятся средние величины активности соединения, полученного согласно примеру 1 ингибирование ( ) 500,1 моль/л- ингибирование ( ) 500,095 моль/л. Обработанные гистамином трахеи 500,7 моль/л. Провоцированная овальбумином эозинофилия (морские свинки) 1 мг/кг 74 подавления. Примеры получения соединений формулыиз соединений формулы . Пример 1. 1-этил-8-метокси-3-метил-5-пропил-имдазо 1,5-апиридо 3,2-епиразинон Вариант А 10 г (0,038 моль) 1-этил-8-метил-имидазо 1,5-апиридо 3,2-епиранозина вводят в 200 мл диметилформамида. При 20 С добавляют порциями при перемешивании 3 г (0,095 моль) гидрида натрия (80 -ный). После перемешивания смеси в течение 2 ч прикалывают в течение 15 мин н-пропилбромид. Полученный раствор нагревают при перемешивании в течение 2 ч при 70-80 С и выдерживают 8 ч при 100 С. После охлаждения до 20 С удаляют растворитель в вакууме. Закристаллизовавшийся при этом продукт растирают прежде всего с 150 мл теплой воды при температуре раствора около 50 С, а затем перекристаллизовывают из циклогексана. Выход 8,5 г (74 от теор.) Температура плавления 136-137 С.А 0 149 2 СНз ВариантВыход 62 Температура плавления 201-203 С (этанол). Вариант В 10 г (0,038 моль) 1-этил-8-метокси-3-метил-имидазо 1,5-апиридо 3,2-епиразинона добавляют в 200 мл диметилацетамида, затем порциями при перемешивании 3 г (0,095 моль) гидрида натрия (80 -ный) при 20 С. Затем смесь перемешивают в течение 2 ч и прикалывают 8,5 г (0,07 моль) н-пропилбромида в течение 15 мин. Полученный раствор перемешивают 15 ч при 20-25 С. Затем удаляют растворитель в вакууме. Очистку закристаллизовавшегося продукта проводят, как описано в варианте А. Выход 8,1 г (70 от теор.) 8 3732 1 Температура плавления 135-137 С. Вариант С 10 г (0,038 моль) 1-этил-8-метокси-3-метил-имидазо 1,5-апиридо 3,2-епиразинона нагревают в смеси с 6,9 г (0,05 моль) сухого карбоната калия в 80 мл диметилформамида при перемешивании в течение 1 ч при 120. Затем прикалывают 8,5 г (0,07 моль) н-пропилбромида при перемешивании в течение 15 мин. Затем реакционную смесь перемешивают в течение 7 ч при 120-130 С. После охлаждения отфильтровывают неорганическую соль и из фильтрата удаляют растворитель упариванием в вакууме. Очистку закристаллизовавшегося продукта проводят перекристаллизацией из циклогексана. Выход 8,0 г (69 от теор.) Температура плавления 135-137 С. При использовании указанных вариантов методики можно синтезировать ряд соединений формулы , характеристика которых приведена ниже (табл. ). 3732 1 Примеры получения соединений формулыиз соединений формулыШ Пример 30. 8-циклопентилокси-1-этил-3-метил-5-пропил-имидазо 1,5-апиридо 3,2-е-пиразинон Вариант А 3,2 г (0,011 моль) 1-этил-8-гидрокси-3-метил-имидазо 1,5-апиридо 3,2-е-пиразинона добавляют к 60 мл диметилформамида. Затем при 20 С порциями при перемешивании добавляют 0,9 г (0,03 моль) гидрида натрия (80 -ный). После перемешивания реакционной смеси в течение 2 ч прикапывают 2,1 г (0,02 моль) циклопентилхлорида в течение 15 мин. Полученный раствор нагревают при перемешивании в течение 2 ч при 70-80 С и далее выдерживают в течение 8 ч при 100 С. После охлаждения до 20 С растворитель удаляют упариванием в вакууме. Закристаллизовавшийся продукт растирают с 50 мл теплой воды (около 50 С) и затем перекристаллизовывают из этилацетата. Выход 3,0 г (77 от теор.) Температура плавления 138-140 С. ХС-СН 3-25 АО 1 пиридилметил 2 СН 3 Форма соли дигидрохлорид Вариант А Выход 51 Температура плавления 237-240 С. Вариант В 3,2 г (0,011 моль) 1-этил-8-гидрокси-3-метил-имидазо 1,5-апиридо 3,2-е-пиразинона добавляют к 60 мл диметилформамида. Затем при 20 С порциями при перемешивании добавляют 0,9 г (0,03 моль) гидрида натрия (80 -ный). После перемешивания реакционной смеси в течение 2 ч прикалывают 2,1 г (0,02 моль) циклопентилхлорида в течение 15 мин. Полученный раствор нагревают при перемешивании в течение 2 ч при 70-80 С и далее выдерживают в течение 8 ч при 100 С. После охлаждения до 20 С растворитель удаляют упариванием в вакууме. Очистку закристаллизовавшегося продукта проводят, как указано в варианте А. Выход 2,7 г (70 от теор.). Температура плавления 138-140 С. При использовании указанных вариантов методики можно синтезировать ряд соединений формулы , характеристика которых приведена ниже (табл. ). Данные об эффективности Ингибирование 50 мкмоль/л 1 0,10 10 0,16 12 0,09 13 0,90 18 0,30 19 0,90 26 1,16 28 0,60 49 0,63 Трахея, предварительно обработанная гистамином Пример 1 10 12 18 Индуцированная овальбумином эозинофилия Пример Доза 1 мг/кг в/б 1 30 мг/кг орально 10 30 мг/кг орально 12 30 мг/кг орально 13 30 мг/кг орально Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66.
МПК / Метки
МПК: C07D 471/14, A61K 31/495
Метки: обладающие, антиаллергенным, способы, пиридо[3,2-е]пиразиноны, способ, получения, лекарственный, действием, антиастматическим, препарат
Код ссылки
<a href="https://by.patents.su/13-3732-pirido32-epirazinony-obladayushhie-antiastmaticheskim-i-antiallergennym-dejjstviem-sposoby-ih-polucheniya-lekarstvennyjj-preparat-i-sposob-ego-polucheniya.html" rel="bookmark" title="База патентов Беларуси">Пиридо[3,2-е]пиразиноны, обладающие антиастматическим и антиаллергенным действием , способы их получения, лекарственный препарат и способ его получения</a>
Предыдущий патент: Термовременной индикатор для контроля процесса стерилизации
Следующий патент: Способ немедикаментозного лечения больных с психологическо-вегетативными расстройствами
Случайный патент: Светопоглощающее углеродосодержащее покрытие корпусной детали приемника оптического излучения и способ его получения