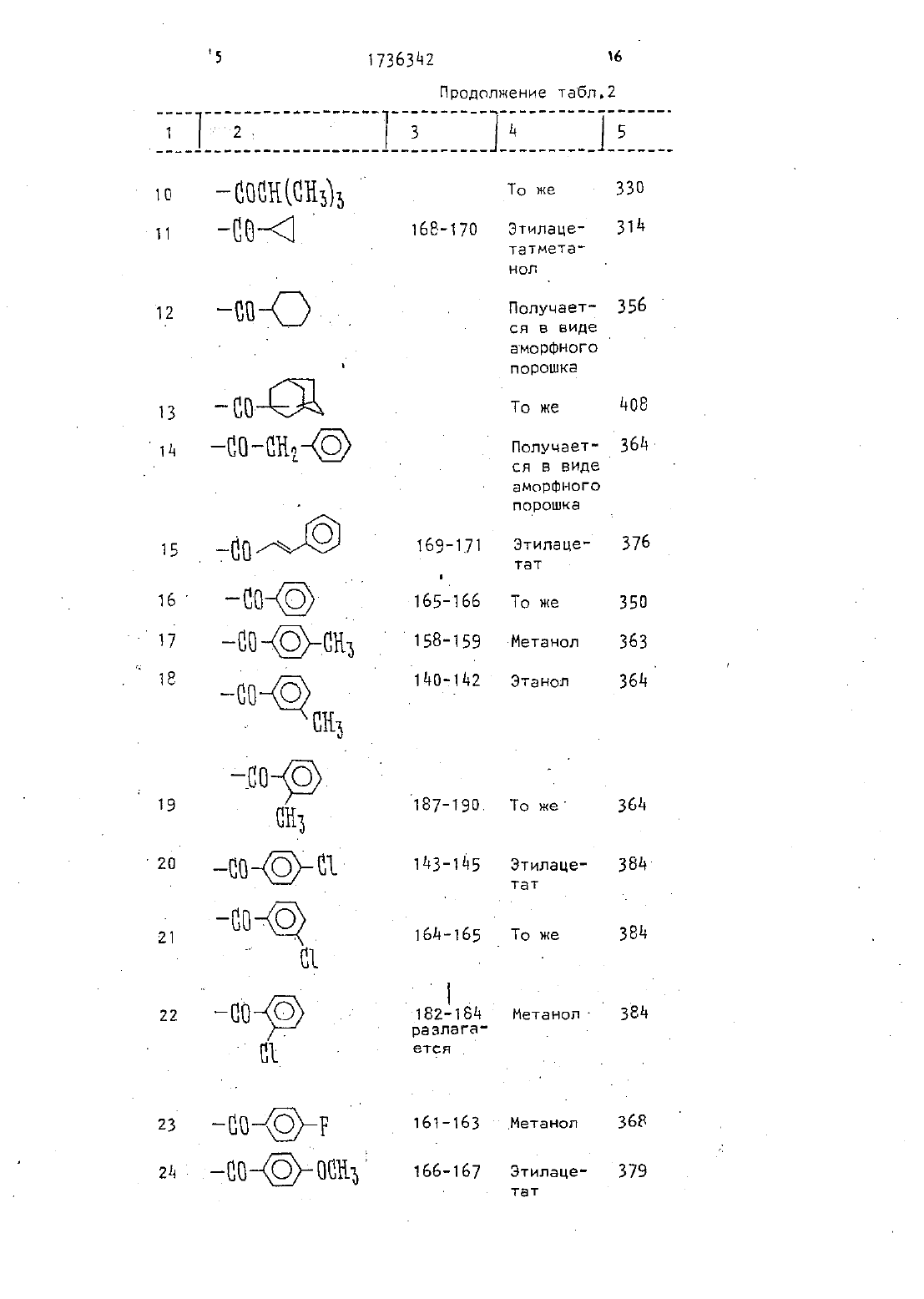Способ получения производных 5-дезокси-5-фторцитидина
Номер патента: 261
Опубликовано: 30.12.1994
Авторы: Морио Фуджию, Масанори Мива, Исао Умеда, Хидео Ишитсука, Казутеру Иокосе
Текст
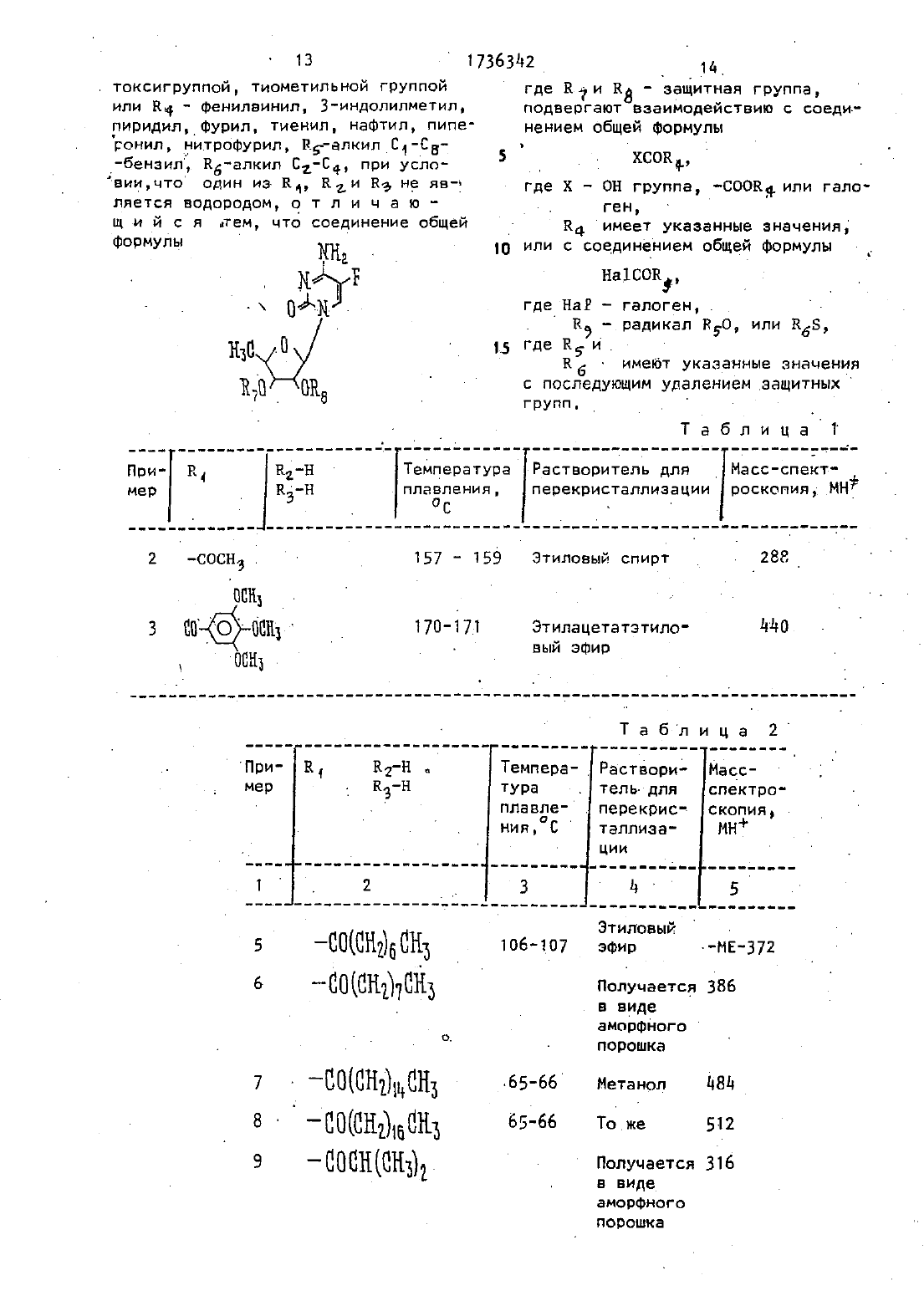
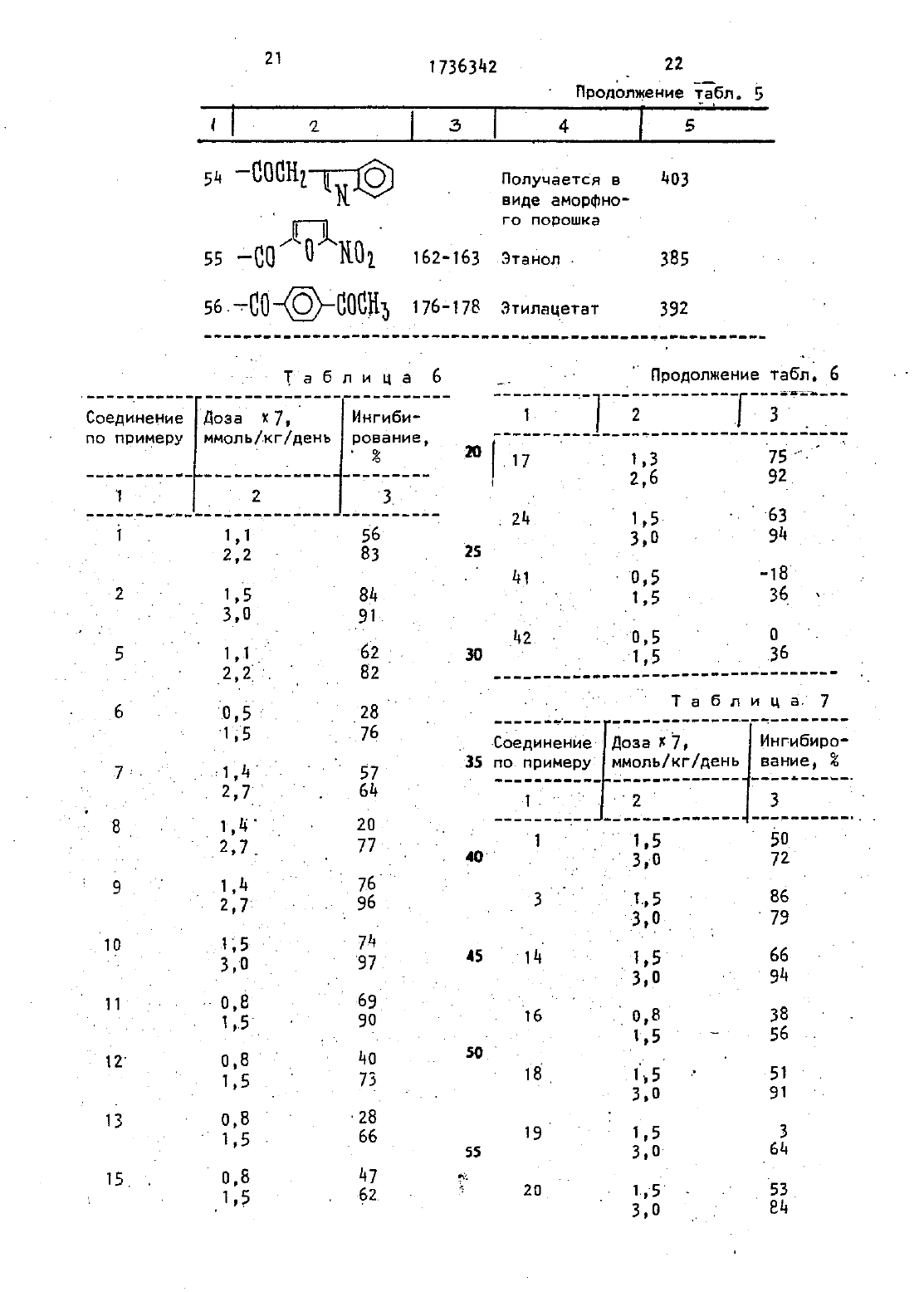
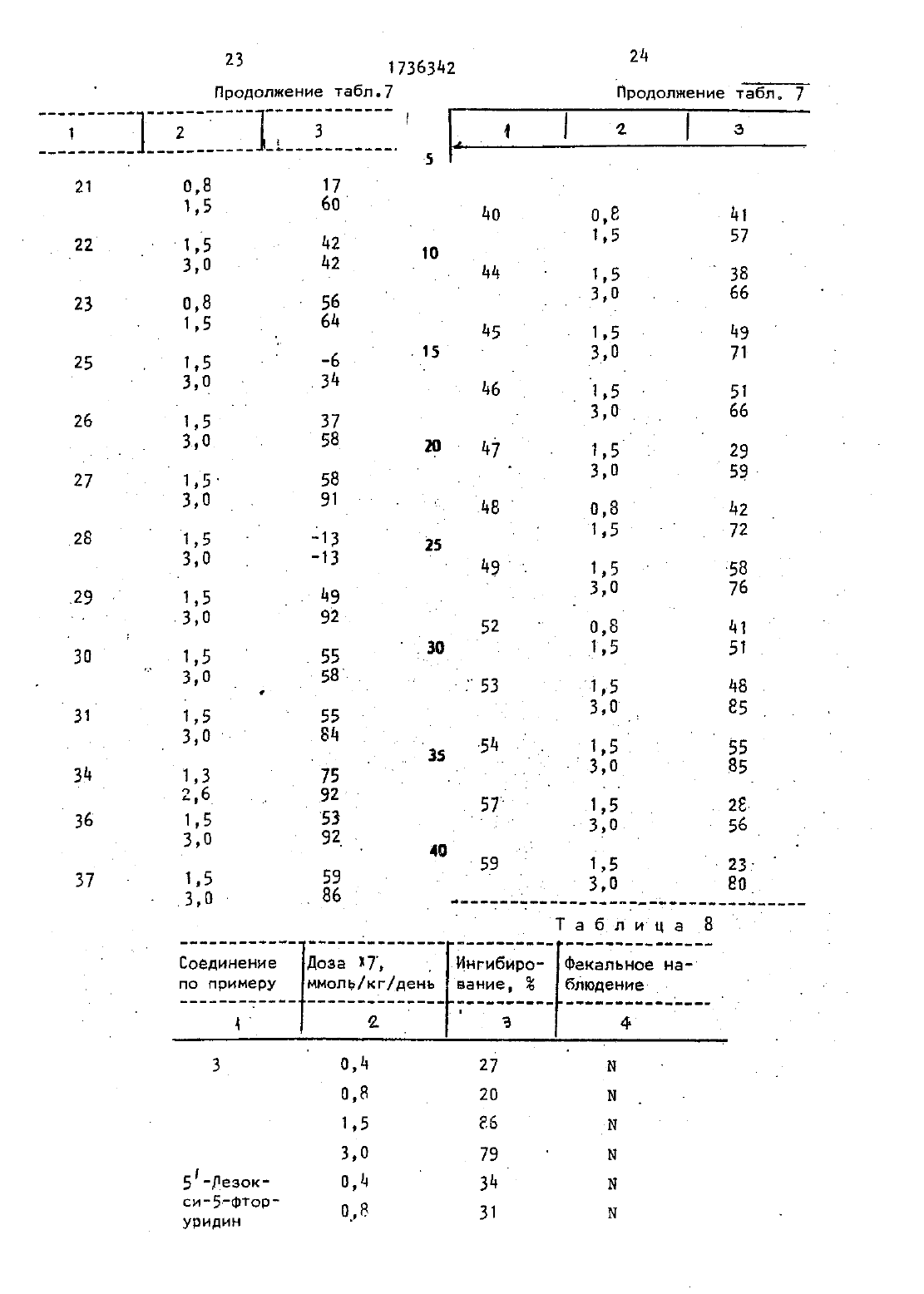
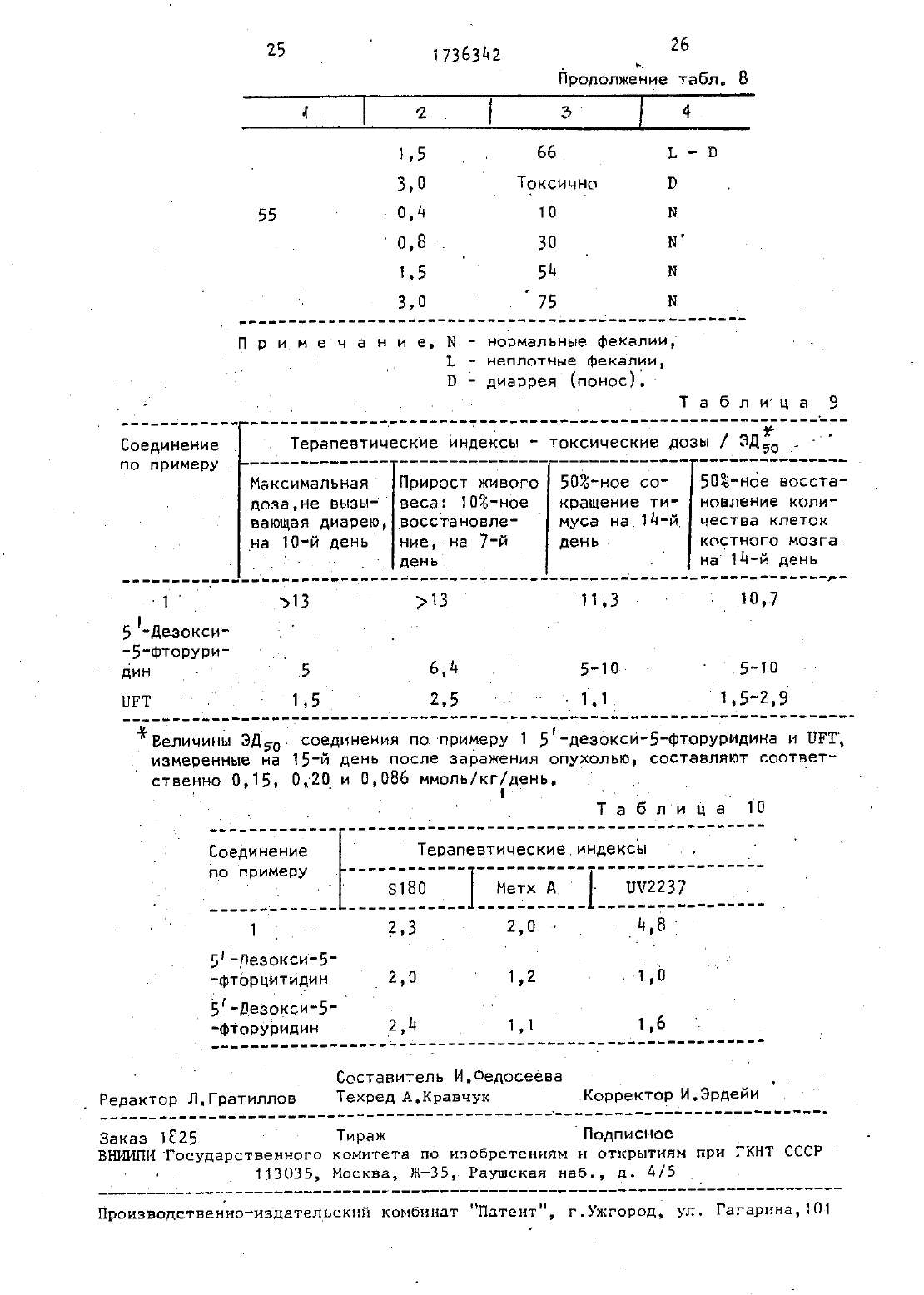
Изобретение относится к способу ПОЛУЧЕНИЯ НОВЫХ ПРОИЗВОДНЫХ 5 ФТОр цитидина, именно 5-дезокси-5-Фторцитидина общей Формулы- где Ед, В 2 и Кг независимо ДРУГ от друга радикал,К 4 СО- или К 50 С 0 или Вб 5 С 0 -. где К 4 - алкил С,-Сд 1 цикпоапкип С 3 С 10 г . алкенил, бензил, этенфенил,фенил, воможно замещенныйтт атомом хлора или фтора, метильной группой, одной,двумя или тремнметонсигруппами, нитрогруппой, ацетономгруппой, тиометильной группой, илиК 4-фенилвинил 3-индолилметил, пиридил фурил тиенил, нафтил пиперонил, нитрофурил алкил С-Св, бензил 6 алкил С 2-64, при условии. что один из Вд,К 1 и В 3 не является водородомобпадающих противоопухолевыми свойствами.Известен ряд производных 5-Фторцитидина (15)0 бЛадаЮЩИХ Например 5-дезокси-5-фторуридиН противоопухолевыми свойствами. .Цель изобретения - получениеновых производных 5-фторцитидина обладающих преимуществами в фармакологическомотношении перед известными структурными аналогами подобного действия.Цель достигаетсяописываемым способом, заключающимся в том, что соединение общей Формулы сгде Х - ОН-группа, СООК 4 или галоген,а К 4 имеет указанные значения, илис соединением общей формулынагсокэ, где На - атом галогена, 7 Н - радикал кдо или Е 5, где Н 5.и Ед имеют указанные значения, с последующим удалением защитных группА). В Т 5 мл диметилформамида раСТБОРНЮТ 2 д 5 мг 5-дезокси-5-фторцитидина, 35 д мг трет-рутипдиметилсилил-хлорида и-28 д мг имидазола. Смесь перемешивают в течение 18 чпри комнатной температуре в атмосфе ре азота. Затем реакционную смесь выливают в воду- и экстрагируют этилацетатом. Экстракт промывают водой,высушивают над безводным сульфатом НЭТПИЯ ИКОНЦеНТрИрУЮТ При ПОНИЖЕННОЙ давлении, получая д 31 мг 237-бис-О-А-(трет -бутипдиметилсилил)-5-дезокси-5-Фторцитидина, (масс-спектроскопия д 73 (М). й - .йу д Е), Раствор д 90 мг 5 Ч-деаокси-5-фторцитидина д 18 мг моногидрата па ратолуолсульфоновой кислоты и ЭЕЧ мкл2,2-диметоксипропана в 10 мл ацетона перемешивают в течение 1,5 ч при комнатнойтемпературе. К раствору добавляют 900 мг гидрокарбоната натрия И смесь ПВВЕМЕШИВВЮТ Е ТЕЧЗНИЗ дч при комнатной температуре. Выпадающий осадок отфильтровывают и промывают, ацетоном Объединенный фильтрат кон центрируют при пониженном давлении. Остаток очищают колоночной хромато графией над силикагелью (дихлорметан метанол), чтобы получить 570 мг 51-лезокси-5-фтор-23-0-изопропилиденцитидина, масс-спектроскопия 286 (МН) т. пл.пикрата 169-171 С.П р и м е р 1. А. В 150-мл дихлорметанарастворяют 9 д 6 г 23 ебис-0-(трет-бутилдиметилсилип)-5-дезокси-5-Фторцитидина полученного по известному примеру (А), 3,д 8 г ангидрида н-масляной кислоты в 293 г д-диметипаминопиридина. Смесь перемешивают в течение ночи затем промывают водой, высушивают над безводным сульфатом натрия и коНцеНТОируют при пониженном давлении, чтобы получить 9,75 г Ыл-бутирил-2,3-бис-0-(трет-бутилдиметилсилип)-5-дезокси-5 фторцитидина, чмасс-спектроскопия 5 цд(мн).Б Продукт реакции по примеру 1(А)того тетрабутиламмония. Реакционную смесь перемешивают в течение 1,5 ч при комнатной температуре. После удаЛЗНИН ПЭСТВОРИТЕЛЯ ПРИ ПОНИЖЗННОМ давлении остаток очищают с помощью колоночной хроматографии над силикагелью(этилацетат - метанол), заиз метанола чтобы получить д,5 г Ычгбутирил-5-дезокси-5-фторцитидина т. пл. 156-Т 57 С масс-спектроскопияСледующие соединения были получены по способу, аналогичному примеру 1 (таблд 1).П р и м е р 4. А. В.150 мл сухого пиридинарастворяют 1 д,19 г 2,3-бис-0-(трет-бутилдиметилсилил)-5-деэокси-5-Фторцитидина, полученного по известному примеру(А). К раствору добавляют по каплям при перемешивании 38 д г хлорангидрида н-масляной кислоты. Реакционную смесь Перемешивают в течение ночи.ПиридиН удаляют при пониженном давлении и остаток разделяют на части между водой иэтилацетатом. Этилацетатный слой промывают водой, высушивают над безводным сульфатом натрия и концентрируют при. пониженном давлении. Остаток очищают с помощью колоночной хроматографии над силикагелью (н-гексан-этилацетат), чтобы получить М 4-бутирилт- БПродукт реакции по примеру д(д) обрабатывают по способу аналогичному примеру 1 (Б), чтобы получить бесцветные кристаллы ПФ-бутирип 5Следующие соединения получают по способу, аналогичному приМеВУ дводного диоксана растворяют 735 мг 5-деаокси-5-фторцитидина и 10 д г ангидрида масляной кислоты. Смесь.НЭД СИЛИКЭГЕПЕМ, перемешивают в течение 18 ч при комнатной температуре. После удаления растворителя Остаток очищают в с помощью колоночной хроматографии чтобы получить бесцветные кристаллы 20 мг Ы бутирил-5 К-дезокси-5-фторцитидина, т. пл. 156-157 С масс-спектроскопия 316 (мнт), а П р и м е р дм. Д. В 50 мл сухого пиридина растворяют д,9 г 5-деэокси-5-фторцитидина и 5,58 мл хлористого триметилсипила. Смесь перемешивают в течение 2 ч. К реакционной смеси добавляют 2,09 мл этилового эфира хлортиомуравьиной кислоты. После перемешивания смеси в течение 2,5 ч пиридин выпаривают при пониженном давлении. Остаток разделяют затем на части между водой и этилацетатом. Органический слой промывают водой, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении. К остатку добавляют 5 г лимонной кислоты и 80 мл метанола. Смесь перемешивают в течение 1 ч. После удаления растворителя при пониженном давлении остаток очищают с помощью колоночной хроматографии над силикагелью (метанол-дихлорметан), за который следует перекристаллизация из дихлормеТаня, чтобы получить 2,66 г 5-де 3 окси-Ы 4- (этилтио)-карбонил-5-фторцитидина, т. пл.-138-13 ЭС (разл.) масс-спектроскопия ЗЗЦ (МН).Б. К перемешиваемому раствору Т г 5 дЕ 3 ОКСИ 5 ФТор 230-изопропилит денцитидинв полученного по известномупримерУ в 8 мл пиридина добавляют при 0 С 365 мкл этилового эфи ре хлортиомуравьиной кислоты, а за тем смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении и остаток раэ ДЕЛЯЮТ На ЧЭСТИ МЕЖДУ ЭТИПЭЦЕТВТОЫ И водой. Органический слой промывают раствором гидрокарбоната натрия и водой и высушивают над безводным сульФатом натрия. После удаления растворителя остаток очищают с помощью коПОНОЧНПЙ ХПОМЭТОГПЗФИИ Над СИЛИКВГЭПЬЮВ. К раствору продукта реакции поном этаноле добавляют Дауэкс 50 (Н)при 50-60 С с перемешиванием в течение Й ч, Дауэкс 50 отфйпътровывают и фильтрат концентрируютдосуха при пониженном давлении, Остаток очищают с помощью колоночной хроматографии над силикагелью (СНСГ 3 - ацетон),аа ко торой следует перекристаллизация из дихлорметана чтобы получить 5-дезокси-Ы 4-(этилтио)-карбонил-5-фторцитидин т пл. 138-139 С (разл.),масс-спектроскопия ЗЗЦ (МН)Следующие соединения получают потриэтиламина обрабатывают 0,37 мл диэтилового эфира хлорфосфорной кислоты в течение 1 ч. К реакционной смеси добавляют 2,3-бис-0-1 трет 10цитидина (10 г), полученного по известному примеру (А)д 0,36 мл три- этипаминаи 0,05 г ддиметиламинопиридина. После перемешивания смесив течение 12 ч при комнатной температуре, ацетонитрил выпаривают при пониженном давлении. Остаток раздетляют на части между водой И диэтило- вым эфиром. Органический слой промываютводой высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученныйпорошок растворяют в 6,3 мл тетрагид рофурана содержащего 1,65 г фтористого тетрабутиламмония и реакционную смесь перемешивают в течение 1 ч.ПОСЛЕ удаления БВСТВОВИТЕЛЯ ПРИ ПОниженном давлении остатокочищают с помощью колоночной хроматографии надсиликагелем (изопропанол-дихлорме танУ закоторой следует перекристаллизация из этилацетата, чтобы получить 0,5 г 57-дезокси-5-фтор-ЫСледующее соединение получают по способу,-аналогичному в примере д 8П р и.м е р 50. В 5 л сухого пи ОИДИНЭ Вастворяют 0,355 Г 3 фуранкарбоновой кислоты и 0,96 г 2 д 6-три(трет-бутилдиметилсилил)-5-дезокси-5-фторцитидина, полученного по известному примеру (Д), и 0,80 г Ч-диметипаминопиридина. После перемешивания смеси в течение 12.ц при. комнатной температуре, пиридин выпаривают при пониженном давлении, Затем остаток обрабатывают, как в примере ЦВ, чтобы получитЬ.055 г 5-дезокси-5-фтор-Ы 4-(3-фуроил)-цитидина, т.пл. 173-17 дС (этанол), масс спектроскопия зцо (МН). 0 Следующие соединения получают поП р-и м е р 57. А. К перемешиваемому раствору 2 д,5 г 5-дезокси-5-Фторуридина в 150 мл сухого пириди-у на добавляют по кзплям 2 д 5 мл хло ристого бензоила в течение 10 мин при 0 С и смесь перемешивают в течение5 ч при комнатной температуреПосле УДЭЛЕНИЯ ПИРИдИНа при пониженном давпении остаток разделяют на части меж дУ Водой И этилацетатом. Органичес 30кий слой промывают насыщенным растворомгидрокарбоната натрия и водой, высушиваютнад безводным суль Фатом натрия и концентрируют при по- .ниженном давлении. Остаток перекрисТаллизовывают из этилацетата вместе с н-гексаном, чтобы получить 36,9 гщ 3 ди-О-бензоил-5-дезокси-5-фторуоидина,масс-спектроскопия55 (МЮ. и 0,23 мл хлористого фосфорила в20 мл ацетонитрила добавляют 500 мг 2,3 ди-0-бензоип-5-дизокси-5-шторуридина полученного при 0 С После перемешивания реакционной смеси в течение 1,5 ч при комнатной л тмпераТУре к смеси-добавляют при 0 С 2,5 мл 28-ной гидроокиси аммония, а затем смесь перемешивают.в те Ацетонитрил и аммиак удаляют при поляютс помощью 1 Цраствора НС 1 а затем экстрагируют этилацетатом. 0 р ганический слой промывают водой высушивают над безводным сульфатом натВИП И концентрируют при пониженном давлении. Остаток перекристаллизовывают-из этилацетата, чтобы получить 155 мг 2 3-ди-0-бензоил-5-дезокси-5-фторцитидина,т. пл. 192-19 дС, масс-спектроскопия д 76 (МНЫа)9 т 1 17363 ц 2 П р и м е р 58. А. К охлаждаемо му льдом уксусномх ЭНГИДПИДУ 19,57 МЛ)добавляют по каплям 286 МКЛ 99 Н 0 Й муравьиной кислоты. Раствор ПЕРЭМЕ шивают в течение 15 мин при 0 С и в течение 50 мин при 5006, а затем охлаждают до 0 С. К раствору ДОБЭВПЯ ют д 73 мг 2,3-бис-О-(трет-Бутилдиметилсилил)-5-дезокси-5-фторцитиди на, полученного по известному примеру (А), в 5 мл сухого пиридина при ос. Реакционную смесь перемешивают в течение 10 мин при ОС и в течение 26 ч при комнатной температуре. После удаления растворителя при пониженном давлении остаток раз-деляют на части между водой и этил ацетатом. Органический слой промывают насыщенным раствором гидрокарбоната натрия И водой, а затем высушивают над безводным сульфатом натрия. Этипацетат выпаривают при пониженном.давлении И остаток очищают с помощью колоночной хроматографии над силикагелью (Н-гексан-этилацетат),за которой следует перекристаллизация из смеси н-гексана и этилацетата,чтобы получить 1 дд мг 2,3-бис-0-(трет-бутилдиметилсилил)-5-дезокси-5-фтор-Ы формилцитидина т, пл. 188 С (разл.) масс-спектроскопия 502 (инт).Б. Продукт реакции по примеру 58 (А) обрабатывают по способу, аналогичному В примере 1 (Б), чтобы получить аморфный порошок 5-дезокси-5-фтор-Ы 4-формилцитидина, массспектроскопия 274 (МН), П р и м е р 59. В 5 мл сухогопиридина растворяют 2 д 5 мг 5-дезок си-5-Фторцитидина. К раствору добавляют 130 мкл хлористого Бензоила сперемешиванием при 000, Реакционную смесь перемешивают в течение 1 ч при ООС. После удаления растворителя при пониженном давлении остаток очищают с помощью колоночной хроматографиинад силикагелъю (дихлорметан-метанол), за которой следует перекристаллиза ция из этилацетата, чтобы получить51 мг бесцветных кристаллов 3-О-бензоил-5-дезокси-5-Фторцитидина, т.пл. 127-129 С, масс-спектроскопияП р и м е р 60. В 0,5 мл сухого пиридина растворяют 35 мг продукта реакции по примеру 59. К раствору добавляют 13,8 мкл хлористого триме 10тилсилила. После перемешивания в течение 2 ч при комнатной температуредобавляют 126 мкл хлористого бензоИЛЭ. РЭЭКЦИОННУЮ СМЕСЬ ПЕПВМЕШИЭЮТ в течение 1 ч. После удаления растворителя при пониженном давлении остаток растворяют в 0,5 мл сухого метанола. К раствору добавляют 15 мг карбоната калия и реакционную смесь0 С. После удаления растворителя при пониженном давлении остаток разделяют на части между водой и этилЭЦЕТЭТОМ. Органический слой высушивают над безводным сульфатом магния И КОНЦЕНТРИПУЮТ ПРИ ПОНИЖЕННОМ давпении. Остаток очищают с помощью колоночной хроматографии над силикагелью (дихлорметанметанол) чтобы получить 15 мг аморфного порошка ЫЧ 33-О-дибензоил-5 деэокси-5-фторцитидина, масс-спектроскопия цэц (мн) .П р и м е р 61. В 5 мл сухого пиридина растворяют 2 д 5 мг 5-деаокси-5-фторцитидина 00 мкл хлорис того бензоила и 122 мг Ц-диметипаминопиридина. После перемешивания В Течение 3 ч при комнатной температуре удаляют пиридин при пониженном давлении. Остаток разделяют на части между этилацетатом и водой. Этилацетатный слой высушивают над сульфатом магния и концентрируют при пониженном давлении. Остаток пеВекристаллизовывают из метанола,чтобы получить 280 мг Ы 12-03 ОПротивоопухолевые активности предлагаемых соединений представляются следующим образом.но от первого дня по 7-й день включительно. Животные приносятся в Жертву на 1 Чй день и опухоли вырезаются ивзвешиввются. Процент ингибирования роста опухоли, представленный в табл. 6, вычисляется по Формуле
МПК / Метки
МПК: C07H 19/06
Метки: получения, способ, производных, 5-дезокси-5-фторцитидина
Код ссылки
<a href="https://by.patents.su/13-261-sposob-polucheniya-proizvodnyh-5-dezoksi-5-ftorcitidina.html" rel="bookmark" title="База патентов Беларуси">Способ получения производных 5-дезокси-5-фторцитидина</a>
Предыдущий патент: Способ концентрирования раствора мочевины и устройство для его осуществления
Следующий патент: Аппарат для формовки зубных протезов
Случайный патент: Фотоэлектрический модуль