Способ выделения фактора VIII из других белков в плазме крови
Текст
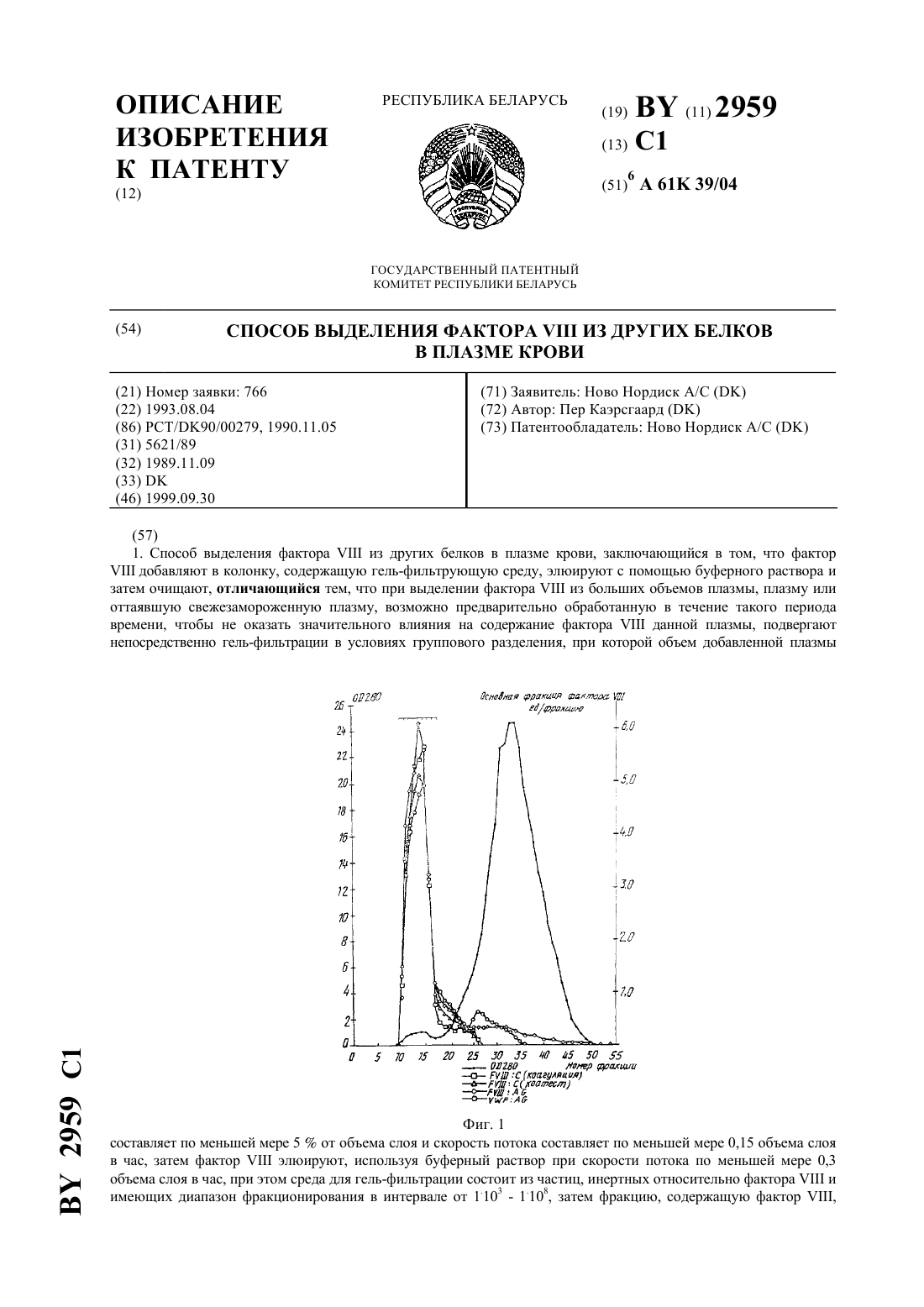
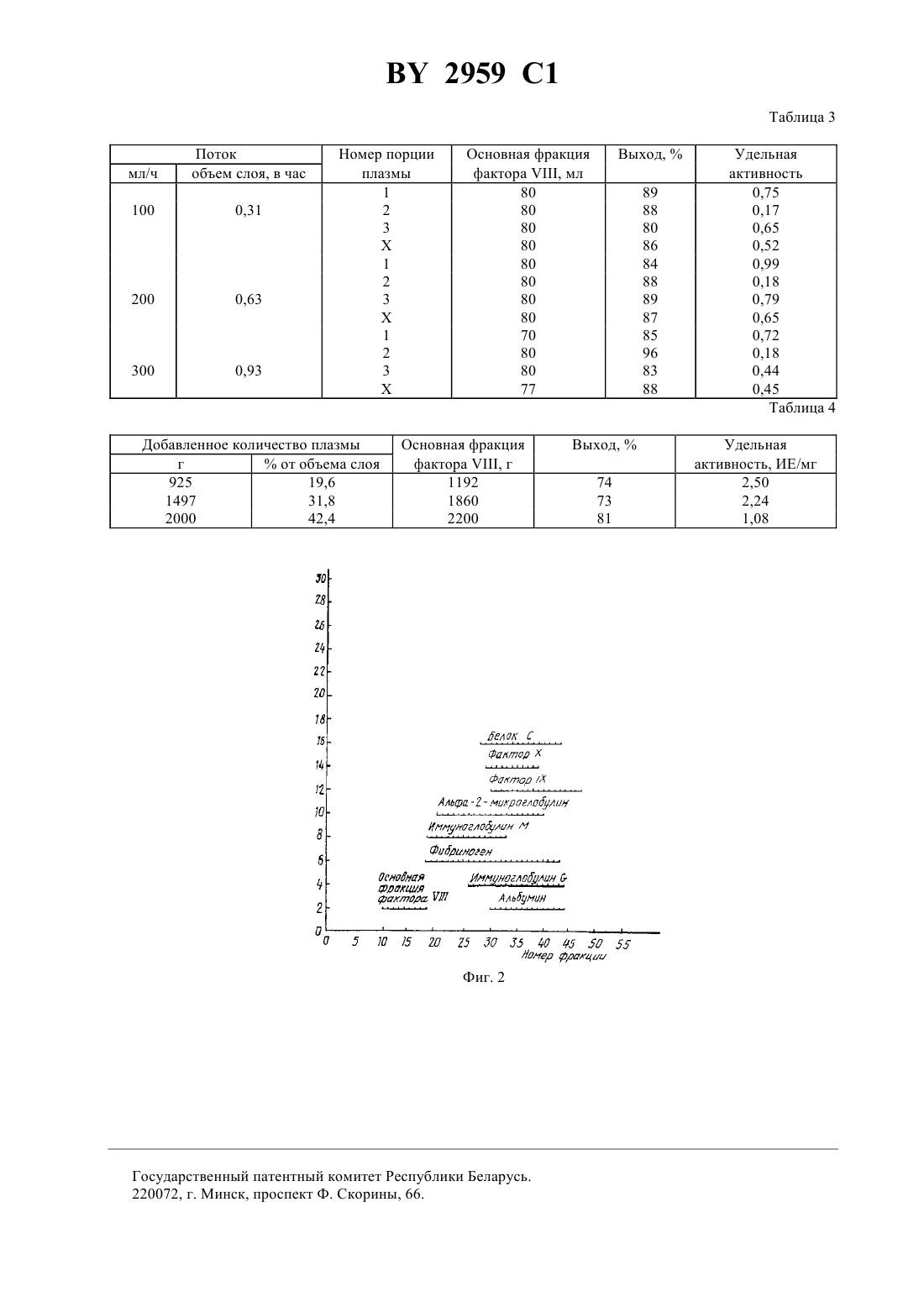
ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ СПОСОБ ВЫДЕЛЕНИЯ ФАКТОРАИЗ ДРУГИХ БЕЛКОВ В ПЛАЗМЕ КРОВИ(71) Заявитель Ново Нордиск А/С(73) Патентообладатель Ново Нордиск А/С(57) 1. Способ выделения фактораиз других белков в плазме крови, заключающийся в том, что фактордобавляют в колонку, содержащую гель-фильтрующую среду, элюируют с помощью буферного раствора и затем очищают, отличающийся тем, что при выделении фактораиз больших объемов плазмы, плазму или оттаявшую свежезамороженную плазму, возможно предварительно обработанную в течение такого периода времени, чтобы не оказать значительного влияния на содержание фактораданной плазмы, подвергают непосредственно гель-фильтрации в условиях группового разделения, при которой объем добавленной плазмы Фиг. 1 составляет по меньшей мере 5 от объема слоя и скорость потока составляет по меньшей мере 0,15 объема слоя в час, затем факторэлюируют, используя буферный раствор при скорости потока по меньшей мере 0,3 объема слоя в час, при этом среда для гель-фильтрации состоит из частиц, инертных относительно фактораи имеющих диапазон фракционирования в интервале от 1.103 - 1.108, затем фракцию, содержащую фактор ,2959 1 элюированный в одном общем пике в свободном объеме, причем коагулирующая активность определена коагуляционным или хромогенным анализом, собирают. 2. Способ по п. 1, отличающийся тем, что среда для гель-фильтрации состоит из материала геля,имеющего диапазон фракционирования в интервале от 1.104 - 8.107. 3. Способ по п. 2, отличающийся тем, что среда для гель-фильтрации состоит из материала геля,имеющего диапазон фракционирования в интервале от 5.104 - 4.107. 4. Способ по одному из пп. 1-3, отличающийся тем, что объем добавленной плазмы составляет 15-40 от объема слоя. 5. Способ по одному из пп. 1-4, отличающийся тем, что скорость потока составляет 0,5-20 объема слоя в час. 6. Способ по одному из пп. 1-5, отличающийся тем, что для получения стабильного препарата полученный факторзатем подвергают очистке способом, аналогичным обычной очистке повторно растворенного криопреципитата, например, хроматографической очисткой и лиофилизацией с использованием обычных наполнителей. Изобретение относится к способу выделения биологических соединений, таких, как сложные белки, в частности коагулирующего фактораиз жидких содержимых организма, таких, как плазма крови, с использованием гель-фильтрации на первой стадии выделения. Фактор , также известный в качестве интигемофильного фактора А или , представляет собой белок плазмы крови, который принимает участие в процессе коагуляции крови. Факторциркулирует в плазме крови в исключительно низкой концентрации в виде нековалентного комплекса из двух протеинов,имеющий активность коагулянта (фактор ) и активность кофактора ристоцетина (фактор ВанВиллебранда , соответственно, упомянутого комплекса, имеющего мол.м. порядка 1-20 х 106 . У лиц, страдающих от нарушения кровотечения - гомофилин А факторотсутствует или нарушен,он поражает примерно 5 из 100000 людей. Фактор Виллебранда связывается с активированными тромбоцитами таким образом, что агрегация активированных тромбоцитов усиливается. Этот эффект может детектироваться вне организма агрегацией индуцированных ристоцетином тромбоцитов. Наряду с болезнью Виллебранда, пролонгированное время кровотечения наблюдается у пациентов из-за отсутствия или пониженного уровня биологической активности фактора Виллебранда. Лечение больных, страдающих от гемофилии А, и пациентов, страдающих от тяжелых случаев заболевания болезнью Виллебранда, в настоящее время проводится концентратами, содержащими фактор/. Это лечение значительно повышает жизнеспособность и трудоспособность и способствует увеличению продолжительности жизни этих пациентов. Фармацевтические препараты, содержащие в себе фактор(фактори/или ), могут получаться из крови или плазмы крови. Производство таких препаратов может осуществляться различными известными способами, которые характеризуются низким выходом особенно фактора . Общим почти для всех является стадия первоначальной очистки, включающая криопреципитацию. Посредством криопреципитации замороженная плазма оттаивает при температуре 0-4 С, что способствует повышению выхода преципитата, содержащего фактор , который может собираться, например, центрифугированием. Даже если криопреципитация проводится относительно простым способом, она имеет существенный недостаток, так как при использовании в большом объеме, т.е. пулов плазмы крови, содержащих более 5 кг, дает низкий выход фактора(30-45 от содержания плазмы). Это означает, что выход конечного продукта является низким независимо от того, какие стадии очистки будут использоваться в дальнейшем. Далее, стадия инактивации вируса включается в производство препаратов, содержащих фактор . Приемы инактивации вирусов в значительной степени повышают безопасность препаратов относительно вирусов, однако в большинстве случаев служат причиной дальнейшего понижения выхода фактора . Очень низкий общий выход факторапривел к нехватке этих препаратов, и поэтому существует необходимость в разработке новых способов очистки факторас высоким выходом в соответствии с требованиями в фактореили лечения больных гемофилией. Новые способы выделения факторанепосредственно из плазмы крови с высоким выходом могли бы представлять большой интерес, поскольку вплоть до 70 содержимого факторав плазме крови теряется при криопреципитации или в процессе таковой. Была сделана попытка выделить факторнепосредственно из плазмы крови, пользуясь афинной хроматографией (. . 61 (2), 234-237, 1989), однако выход составил менее 60 и удельная активность - порядка 1 иммунизирующей единицы фактора /мг протеина фракции выделенного фактора . Гель-фильтрация, также называемая гель-проникающей хроматографией или хроматографией 2 2959 1 исключения размера, представляет собой процесс с управляемой диффузией, который используется для сепарации растворенных веществ в соответствии с размером частиц. Растворенные вещества пропускаются через аппарат колонного типа, заполненный в качестве насадочного материала инертными частицами пористого геля, размер пор которого исключает прохождение самых крупных молекул, между тем как менее крупные молекулы диффундируют в стационарную фазу внутри частиц геля. Таким образом, самые крупные молекулы, будучи полностью исключенными из частиц геля, подвергаются элюции вначале свободным объемом, между тем как менее крупные молекулы тратят более продолжительное время,проходя через аппарат колонного типа, и элюируют в соответствии с уменьшением размера при увеличении объемов элюирования. Гель-фильтрация может осуществляться двумя различными способами. 1. Способ группового разделения. В способе группового разделения растворенные вещества (сорбаты) разделяются на две группы,имеющие большое различие размеров молекул, причем одна группа элюируется в свободном объеме, а другая группа элюируется позже в гораздо большем объеме элюирования, часто близком к общему объему слоя. Этот способ используется в основном для разделения белков и растворенных солей или для обмена буферного вещества и называется обессоливанием. Для обессоливания используются жесткие гели, имеющие малый размер пор. Этот процесс может осуществляться с использованием больших количеств материала (объем, составляющий 20-30 от объема слоя) и с использованием высокой скорости потока (примерно один объем буферного вещества в час). Таким образом, производительность аппарата колонного типа достаточно велика. 2. Способ фракционирования. Этим способом разделяются растворенные вещества, имеющие одинаковую молекулярную массу. Этот способ часто используется для разделения белков. Для этой цели используются частицы геля, имеющие большие поры, и выбирается такая гелевая фильтрующая среда, которая гарантирует элюирование белков между свободным объемом и объемом элюирования, соответствующим общему объему слоя. Эти вещества элюируются более строго, чем при групповом разделении и возможном перекрывании одного другим. Кроме того, высокие скорости потока являются нежелательными, так как это не позволяет эффективно отделять белки. Нагрузка аппарата колонного типа должна поддерживаться низкой для разделения различных белков. Таким образом, гель-фильтрация, используемая в способе фракционирования, может применяться только для сепарации белков в качестве последнего этапа, где объем фракционирования мал. Уже делались попытки выделить факториз плазмы крови способом гель-фильтрации (. . .., 7236, 1968, 1007-1008 и . . . 48, 1969, 957-962). Высокая степень очистки была достигнута во время экспериментов, однако выход составил лишь около 40-50 . Было установлено, что чистота полученной фракции, содержащей фактор , зависит от исходной плазмы, так как большое содержание липидов и хилемикрон способствовало образованию мутной фракции фактора , имевшей пониженную специфическую активность. Применявшаяся техника гель-фильтрации не позволяла производить обработку больших количеств плазмы, даже если предварительные эксперименты показывали, что гель-фильтрация гораздо более концентрированной первой фракции Кона казалась возможной. Кроме того, было ранее установлено, что фактормог бы выделяться из других белков плазмы крови при использовании глевой среды - Сефарозы 6 В. Однако хроматография с применением гель-фильтрации казалась возможной только в больших объемах, когда повторно растворенный криопреципитат использовался в качестве исходного материала. Был раскрыт процесс для разделения компонентов крови, использующий гель-фильтрацию и использующий пористые стеклянные шарики. Этот процесс специально предназначается для разделения иммунологически активных материалов от других компонентов в иммунной сыворотке или плазме крови. После этого предпринималось несколько попыток использовать гель-фильтрацию для очистки фактора, однако эти попытки сосредотачивались на гель-фильтрации частично очищенных фракций плазмы крови (повторно растворенного криопреципитата и далее его очищенных фракций). Все исследования проводились при использовании либо малых нагрузок аппарата колонного типа, либо малых скоростей потоков, или комбинаций таковых. Гель-фильтрация в качестве способа фракционирования белков была известна с 1959 года и широко используется в биохимических исследовательских лабораториях для характеристики белков и для очистки белков с малым объемом проб, например менее 1 л. Гель-фильтрация вплоть до предлагаемого способа не использовалась в большом масштабе для фракционирования плазмы крови при разделении белков. Единственным применением являлось обессоливание этанола и солей из альбуминных растворов. Таким образом, как утверждалось ранее, основной причиной, почему гель-фильтрация не стала главным способом для фракционирования плазмы крови, является низкий выход белка на объем аппарата колонного типа. К сожалению, массы белков, которые могут обрабатываться, ограничены размерами аппаратов колонного типа, при этом нельзя пренебрегать разведением пробы. Поэтому способ не используется широко для фракционирования плазмы крови. Известен процесс выделения прокоагулянта белка фактораиз препарата плазмы крови, содержащего фактор- компоненты с большой молекулярной массой и компоненты с малой молекулярной массой,3 2959 1 последовательной высокоразрешающей хроматографией по размеру молекул путем приготовления, на первой стадии, буферного водного раствора препарата плазмы крови и отделения компонентов с низким молекулярным весом, посредством введения композиции в хроматографическую колонну высокоразрешающей жидкостной хроматографии, заполненную пористыми шариками, имеющими размер от около 13 мк до около 35 мк, и элюирования буферным водным элюентом. Для хорошего разделения в данном случае предлагается использование колонок, имеющих отношение высоты к ширине не ниже, чем между 10 и 40, что снижает пропускную способность, но не гарантирует хорошее отделение фактораот белков плазмы крови с низкой молекулярной массой. Однако первое отделение не гарантирует хорошего разделения белков, показывающих активность фактора , от других белковых компонентов препарата плазмы крови, которая получается только проведением второй жидкостной хроматографии высокого давления (ЖХВД). Таким образом, вплоть до настоящего времени считалось, что гель-фильтрация является неприемлемым способом для разделения белков при фракционировании плазмы крови, когда обрабатываются более крупные объемы, например более 5 л. Неожиданно было установлено, что выбирая материалы для гель-фильтрации, которые были разработаны для высоких скоростей потока, представляется возможным выделить факторв виде чистой фракции с высоким выходом непосредственно из плазмы крови посредством очень мягкого механического разделения, не принимая в расчет первоначальную криопреципитацию. Изобретение относится к способу выделения факторав виде комплекса факторииз других белков плазмы крови с использованием гель-фильтрации. Способ, согласно изобретению, заключается в том, что выделенная плазма или размороженная свежезамороженная плазма крови подвергается групповому разделению способом гель-фильтрации при использовании большой нагрузки и высокой скорости потока, причем среда для гель-фильтрации состоит из частиц, которые являются инертными относительно фактораи имеют диапазон фракционирования в интервале от 1 х 103 до 1 х 108 и более предпочтительно от 1 х 104 до 8 х 107. Диапазон фракционирования может, например, находиться в интервале от 5 х 104 до 4 х 107. В предпочтительном варианте осуществления изобретения объем добавленной плазмы крови составляет по меньшей мере 5 от объема слоя. Количество добавленной плазмы крови предпочтительно составляет 15-40 от объема слоя. Способ, согласно изобретению, осуществляется при скорости потока, равном по меньшей мере 0,3 объема слоя в час, более предпочтительно - 0,5-2 объемов слоя в час. В изобретении используется среда для гель-фильтрации, имеющая такую жесткость, которая дает быстрое элюирование. Более того, гель обязательно должен быть химически иммунологически инертным относительно факторапри проведении гель-фильтрации. Эксперименты показали, что способ, согласно изобретению, может осуществляться при использовании таких гелей, как Сефароза -4, Сефароза -6,Сефароза 4, Сефароза 6, Сефакрил -400, Сефакрил -500, Фрактогель 65 и Матрекс Целлюфин 2000, причем все эти гели пригодны для использования в изобретении. Подобные гели имеют размер частиц (смоченных), находящийся в интервале от около 32 мк до около 200 мк. Согласно одному из вариантов осуществления предлагаемого способа, замороженная плазма крови оттаивается, при этом гарантируется, что весь факторрастворяется, после чего размороженная плазма подается в аппарат колонного типа сразу после полного растворения фактора . Предпочтительно, чтобы температура не поднималась слишком высоко во избежание слишком экстенсивного разложения фактора. Перед подачей в колонну плазма крови может быть предварительно обработана, например, гепарином,цитратом, сахарозой, аминокислотой, солями или другими стабилизаторами и выборочно отфильтрована,центрифугирована, концентрирована посредством ультрафильтрации, подвергнута предварительному осаждению с использованием обычных предварительно осаждающих агентов или предварительно обработана другим образом, но так, чтобы предварительная обработка не оказывала значительного влияния на содержание фактораплазмы крови. Предлагаемый способ неожиданно обнаружил высокий выход фактора . Обычно более 70 фактораплазмы крови восстанавливается в конечном продукте, и этот способ позволяет получать очень чистые препараты, имеющие удельную активность от 1 до примерно 4 иммунизирующих единиц фактора С/мг белка. В некоторой степени это можно объяснить тем, что при использовании предлагаемого способа фактортакже отделяется от протеолитических ферментов, которые обычно могут служить причиной разложения факторав процессе выделения. Предлагаемый способ позволяет обрабатывать большие количества плазмы крови при условии, что плазма поступает на гель-фильтрацию при использовании больших нагрузок и высоких скоростей потока, в результате получают высокую степень восстановления факторапри высокой степени чистоты. Таким образом, предлагается очень эффективный способ, имеющий промышленную применимость. Фракция (фракции), содержащая факторпосле гель-фильтрации, или объединенные фракции после многих гель-фильтраций затем могут концентрироваться и далее очищаться с использованием известных в технике способов, таких, как ультрафильтрация, преципитация, ионный обмен, аффинная хроматография и т.п. 4 2959 1 Оставшиеся белки плазмы крови, такие, как альбумин, иммуноглобулины, протромбиновый комплекс,антитромбини другие, также могут быть выделены из более поздних фракций гель-фильтрации при использовании известных способов, таких, как преципитация спиртом, преципитация полиэтиленгликолем,хроматография и т.п. Определение активности фактораможет осуществляться либо при использовании двухстадийного анализа, либо одностадийного анализа. Установлено, что одностадийный и двухстадийный анализы могут давать различные показатели активности факторав дроби. Более того, известно, что повторное определение при использовании одинакового анализа на одинаковой пробе могут давать в результате вариации в определении активности фактора . В данном описании используется выражение плазма, что означает кровь, из которой удалены все форменные элементы и тромбоциты, например, посредством центрифугирования. Факторозначает связанный с факторомантиген, и - обозначает связанный с фактором Ван-Виллебранда антиген. Объем слоя определяется как объем уплотненной среды, содержащей гель, и межстеночной жидкости. Свободный объем определяется как объем буферного раствора между частицами геля, а объем элюирования представляет собой объем буферного раствора, используемого для элюирования специфического материала. Выражение нагрузка аппарата колонного типа используется, чтобы обозначать объем материала, добавленного к слою, подсчитанного как процент от объема слоя. Выражение диапазон фракционирования обозначает диапазон молекулярных масс (глобулярных) белков или более крупных молекул, для которых материал геля используется в качестве носителя. На фиг. 1 показан график, иллюстрирующий элюирование факторапосредством гель-фильтрации,согласно изобретению, определенное в разных опытах на фиг. 2 - порядок элюирования различных белков плазмы крови посредством гель-фильтрации согласно изобретению. Пример 1. Гель-фильтрация плазмы для выделения фактора . Аппарат колонного типа с диаметром колонки 2,6 см заполнялся Сефарозой С-4 В в качестве насадочного материала на высоту 60 см. Замороженная плазма из датского банка крови оттаивалась до температуры 25 С на водяной бане. После добавления 1 иммунирующей единицы гепарина/мл 50 мл (16 от объема слоя) плазмы направлялось в аппарат колонного типа со скоростью потока 100 мл/ч, после чего аппарат колонного типа элюировался с использованием усиленного потока буферного раствора со скоростью 200 мл/ч, соответствующего 0,63 объема слоя в час. Приведение в равновесие аппарата колонного типа и элюирование проводились с использованием буферного раствора, 0,02 М цитрата, 0,13 Мс рН 7,4. Затем к буферному раствору добавлялось 2,55 мл 1 М 2 на литр, в результате концентрация свободных ионов кальция (Са 2) составляла примерно 7 х 10-5 М. Концентрация свободных ионов кальция проверялась с использованием селективного электрода кальция фирмыГмбХ (Франкфурт на Майне, ФРГ). Фракции собирались и для каждой фракции определялись 280 ( - оптическая плотность), фактор С (с использованием как одностадийного коагуляционного анализа, так и двухстадийного хромогенного анализа), фактор ,альбумин, иммуноглобулин , фабриноген, иммуноглобулин М, альфа-2-макроглобулин, фактор , фактор, протеин С и антитромбрин . При измерении посредством 280 белок элюировался при небольшом пике в свободном объеме (фракции 10-1 В), который сопровождается большим пиком с широкой вершиной(фракция 19-60,на фиг. 1). Факторактивностью 82 , как было определено двухстадийным анализом, и факторактивностью 91 , как было определено одностадийным коагуляционным анализом, элюировались в одном общем пике в свободном объеме (основная фракция фактора ) совместно с самым ранним малым пиком белка. Остаток фактораэлюировался в небольшом последующем хвосте пика непосредственно за основной фракцией фактора(фракция 19-26). Фактор А иэлюировались вместе с факторомв пике, имеющем до некоторой степени более широкие последующие хвосты. Все другие определяемые белки плазмы крови элюировались во фракции после основной фракции фактора- с большим широким пиком протеина (см. фиг. 2). Белки плазмы крови отделялись от фактораи имели следующие молекулярные массы антитромбин 65,000 белок С 62,000 фактор 59,000 фактор 57,000 альфа-2-макроглобулин 718,000 иммуноглобулин 900,000 фибриноген 340,000 иммуноглобулин 150,000 альбумин 67,000 . Определение активности факторас использованием двухстадийного хромогенного анализа проводилось с использованием способа хромогенного субстрата (КАВфактор ). Первоначальный способ, в котором используют тестируемые пробирки при 37 С, модифицировали, чтобы проводить способ с использованием плашек или микротитрования с пониженным использованием 5 2959 1 реагентов. Использовали 50-микролитровую или стандартную пробу, которую после смешивания с 75 мкл раствора фосфолипида, фактора а, фактора Х и 2, инкубировали при температуре 37 С в течение 15 мин, после чего добавлялось 50 мкл субстрата. После дальнейшей инкубации при 37 С в течение 20 мин эта реакция гасилась путем добавления 50 мкл 1 М лимонной кислоты. Проявление цвета считывалось при 405 нм, в то время как опорное считывание - при 492 нм. Определение активности факторапри использовании одностадийного анализа проводилось с использованием АРТТ-способа (- время образования частично активированного тромбопластина). Согласно этому способу, 100-микролитровая проба (или стандарт) отмеривалась пипеткой в кюветы, после чего туда добавлялась 100-микролитровая проба недостающей плазмы(недостающая плазма фактора , общая диагностика) и этот раствор выдерживался в термостате при 37 С в течение 5 мин. Затем добавлялось 100 мкл 0,03 М 2 и определялось время до наступления коагуляции этого раствора. Для количественных определений получают калибровочные кривые, описанные на серии разведений внутреннего стандарта, который градуируется по стандарту Всемирной организации здравоохранения (3-й Внутренний стандарт фактора , плазмы крови человека, 3,9 иммунизирующей единицы/мл). Описанный двухстадийный анализ имеет пониженный (примерно в 10 раз) предел детектирования по сравнению с одностадийным анализом. При добавлении гепарина лучше использовать двухстадийный анализ, так как любое возможное влияние гепарина на анализ может быть устранено разбавлением. Факторопределялся способом ферментного иммуносорбентного анализа, использующего антитела от пациента ингибитора факторав качестве покрывающего материала на плашках или микротитрования (, , 4000 , ) и использующего фрагменты пероксилазы,маркированной (2) от того же самого пациента ингибитора для определения связанного фактора(. ., 53 (3), 1985, 346-350). Стандартные кривые получались с использованием смешанной нормальной плазмы, градуированной по стандарту ВОЗ (1 . 1982). Фактортакже определялся при использовании ферментного иммуносорбентного анализа(фирма ДАКО, Дания) в качестве покрывающего материала и пероксилазу, маркированнуюкроличий,противопоказанный для человека, фактор Ван-Виллебранда - (фирма ДАКО, Дания), для определения связанного фактора Ван-Виллебранда . Получались стандартные кривые при использовании одинаковой нормальной плазмы, как и для ферментного иммуносорбентного анализа для определения фактора . Факторопределялся при использовании одностадийного коагуляционного анализа аналогично тому,как определялся фактор , только, пользуясь недостающей плазмой фактора . Иммуноглобулинопределялся при использовании радиальной иммунодиффузии (, 2. 1965, 235-254), при этом альбумин, фибриноген, альфа-2-макроглобулин, фактор , белок С и антитромбинопределялись,пользуясь ракетным иммуноэлектрофорезом (. , 15, 1966, с. 45-52). 280 определялась с использованием спектрофотометра ( 601 фирмы), а белок, содержащий фактор Кджелдаля, определялся (согласно . . 2-е издание, 1, . 3,5,2) без преципитации трикарбоновой (трихлоруксусной) кислотой. Удельная активность очищенных фракций вычислялась в виде отношения концентрации факторалибо к 280, либо к концентрации белка,который определен, пользуясь фактором Кджелдаля. При использовании 280 для вычисления удельной активности результаты различных экспериментов не могут сравниваться непосредственно, если только не используется одинаковая исходная плазма, так как фракция, заключающая в себе фактор , часто является мутной. Различные среды для гель-фильтрации, применявшиеся в этих экспериментах, находились из следующих далее источников. Сефароза -6, сефароза -4, сефароза -2, сефароза 6, сефароза 4, сефакрил-400 и сефакрил -500 были получены из фармацевтического предприятия (, ), биогель 5-сверхтонкий материал был получен от фирмы БиоРад (, ), фрактогель-65 был получен от фирмы Мерк (, , ) и целлюфин Матракс 2000 был получен от фирмы Амикон (, ). Пример 2. Гель-фильтрация плазмы, чтобы выделить фактор , пользуясь различными средами для гель-фильтрации. Аппарат колонного типа, имеющий диаметр колонки 2,6 см, заполнялся различными средами для гельфильтрации, имеющими различный диапазон фракционирования и различную структуру. Во всех случаях окончательная высота уплотненного слоя составляла 60 см. Плазма крови оттаивалась, как описано в примере 1, и добавлялась 1 иммунизирующая единица гепарина на 1 мл. Для каждой среды при проведении гель-фильтрации колонка нагружалась 50 мл плазмы (16 объема слоя). Загрузка аппарата колонного типа буферным раствором проводилась так, как описано в примере 1. Во всех случаях скорость потока была одинаковой, как констатировалось в примере 1, за исключением опыта, в котором применялся биогель 5, в этом опыте скорость потока понижалась до 50 мл/ч благодаря повышенному противодавлению. Фракции накапливались и для каждой фракции определялись, пользуясь Коатестом, 280 и фактор. Удельная активность основной фракции факторавычислялась в виде отношения фактора 6 2959 1 С/мл к 280. Эксперименты повторялисьраз, для каждой нагрузки использовались различные плазмы и вычислялись средние значения выхода и удельной активности. Основная фракция факторавыбиралась одинаковым методом, как описано в примере 1, и выход определялся по содержанию факторав основной фракции факторав процентном содержании факторадобавленной плазмы. Диапазон фракционирования и размер частиц различных сред и вычисленные средние значения приводятся в табл. 1. Пример 3. Гель-фильтрация плазмы для выделения факторас использованием различных нагрузок аппарата колонного типа. Аппарат колонного типа с диаметром колонки 2,6 см заполнялся в качестве посадочного материала сефарозой 4 до высоты 60 см. Плазма крови оттаивалась, как это описано в примере 1. После размораживания рН плазмы доводилось до 7,0, для чего использовалась 0,5 М НС, добавлялась 1 иммунизирующая единица гепарина и плазма фильтровалась через 10-микронный нейлоновый фильтр. В аппарат колонного типа вводилось 30 мл, 40 мл, 50 мл, 60 мл и 70 мл плазмы, соответственно. Все операции и элюирование проводились с использованием буферного раствора, как это описано в примере 1, хотя рН буферного раствора доводилось до 7,0. Фракции собирались и для каждой фракции определялись 280 и фактор , пользуясь Коатестом. Удельная активность основной фракции факторавычислялась в виде отношения фактора С/мл к 280. Эти эксперименты повторялись три раза, используя три различных плазмы крови для каждой нагрузки, и вычислялись средние значения . Объем основной фракции фактора(мл) представляет объем фракции, заключающей в себе фактор , которая может накапливаться перед большим широким пиком белка (280), затем элюируется и отделяется тем же способом, как описано в примере 1. Выход представляет содержание факторав основной фракции факторав виде процентного содержания факторадобавленной плазмы. Вычисленные показатели приведены в табл. 2. Пример 4. Гель-фильтрация плазмы для выделения факторапри использовании различных скоростей элюирования. В указанный аппарат колонного типа, аналогичный тому, который использовался в примере 3, добавлялось 50 мл плазмы, размороженной как описано выше. После размораживания рН плазмы доводилось до 7,0 при использовании 0,5 М НС 1, затем добавлялась 1 иммунизирующая единица гепарина/мл и плазма фильтровалась через 10-микронный нейлоновый фильтр. Используя три различные части плазмы, проверялись три скорости потока 100, 200 и 300 мл/ч, соответственно. Во время добавления плазмы и последующего элюирования использовался одинаковый поток. Элюирование проводилось при использовании одного и того же буферного раствора, который описан в примере 3. Фракции собирались и для каждой фракции определялись 280 и фактор . Удельная активность и выход в основной фракции факторарассчитывались так, как указано в примере 3. Вычислялись средние значенияобъема основной фракции фактора , выхода к удельной активности. Эти результаты приведены в табл. 3. Пример 5. Гель-фильтрация плазмы для выделения факторапри различных нагрузках аппарата колонного типа. Аппарат колонного типа, имеющий диаметр колонки 2,6 см, заполнялся Сефарозой 4 до высоты столба 60 см. Замороженная плазма из Датского банка крови оттаивалась при 30 С в водной бане. 925 г, 1497 г и 2000 г, соответственно, подавались в аппарат колонного типа. Во время добавления и элюирования плазмы поток подавался в количестве примерно 42000 мл/ч, пользуясь шланговым насосом модели Мастерфлакс (, , ), что соответствует примерно 0,89 объема слоя в час. Для элюирования использовался одинаковый буферный раствор, описанный в примере 1. Осуществлялся непрерывный контроль 280,использовался фармацевтический монитор модели -1. Когда 280 начинала повышаться в свободном объеме, начиналось накопление основной фракции фактора , и оно заканчивалось тогда, когда 280 показывала, что начинает элюироваться большой пик белка. В основной фракции фактора , пользуясь одностадийным коагуляционным анализом, определялись составляющие фракции фактора , а белок определялся методом Кижелдаля. Удельная активность вычислялась в виде отношения общего числа единиц факторав основной фракции факторак общему числу миллиграммов белка в основной фракции фактора . Выход факторавычислялся в процентах как содержание факторав основной фракции факторапо отношению к содержанию факторав добавленной плазме. Результаты приводятся ниже в табл. 4. Пример 6. Гель-фильтрация плазмы или выделения факторав промышленном аппарате колонного типа. Аппарат колонного типа, имеющий диаметр колонны 29 см, заполнялся Сефарозой 4. После выхода на режим при использовании буферного раствора, описанного в примере 1, высота столба геля составляла 53 см. 10 кг замороженной плазмы из Датского банка крови оттаивалось и нагревалось до 30 С, после чего она добавлялась в аппарат колонного типа. Это добавленное количество составляло 28,8 от объема слоя. Во время добавления и элюирования плазма поступала в количестве 30 л/ч, соответствующем 0,86 объемов слоя в час, при этом использовался уравновешивающий буферный раствор. Величина 280 контролировалась непрерывно при помощи фармацевтического монитора модели -1. Во время первой индикации скачка 280 в свободном объеме осуществлялось накопление основной фракции фактора . 7 2959 1 Всего было собрано 11,73 кг основной фракции фактора . Затем определялось содержание факторапосредством одностадийного коагуляционного анализа, а белок определялся по методу Кджелкаля. В основной фракции факторабыло обнаружено всего 8798 иммунизирующих единиц фактораи менее чем 2346 мг белка, что составило выход факторапорядка 880 иммунизирующих единиц на килограмм плазмы, соответствующий 88 выходу продукта, имеющего удельную активность более чем 3,75 иммунизирующих единиц на миллиграмм протеина. Основная фракция фактора , полученная в соответствии с предлагаемым способом, может затем подвергаться очистке известковым способом для получения стабильного препарата. Например, очищают повторно растворенный криопреципитат путем хроматографической очистки и лиофилизации с использованием обычного наполнителя. Препарат повторно составляется с использованием подходящего традиционного наполнителя. Таблица 1 Среда для гельфильтрации А В С Добавленное количество плазмыот объема слоя номер порции 1 9,4 2 3 Основная фракция фактора , мл 70 70 70 70 70 70 70 70 80 80 80 80 80 80 80 83 80 100 100 93 Номер порции плазмы 1 2 3 Добавленное количество плазмы гот объема слоя 925 19,6 1497 31,8 2000 42,4 Основная фракция фактора , мл 80 80 80 80 80 80 80 80 70 80 80 77 Основная фракция фактора , г 1192 1860 2200 Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66. 9
МПК / Метки
МПК: A61K 39/04
Метки: выделения, плазме, фактора, способ, других, крови, белков
Код ссылки
<a href="https://by.patents.su/9-2959-sposob-vydeleniya-faktora-viii-iz-drugih-belkov-v-plazme-krovi.html" rel="bookmark" title="База патентов Беларуси">Способ выделения фактора VIII из других белков в плазме крови</a>
Предыдущий патент: Способ обнаружения полезного сигнала в белом аддитивном шуме
Случайный патент: Транспортное средство для перевозки молодняка птиц и яиц на инкубацию