Способ получения инъекционной формы эритропоэтина
Номер патента: 1246
Опубликовано: 14.06.1996
Авторы: Фритц Демме, Вернер Грубер, Хайнрих Воог, Ханс-Йерг Маркль
Текст
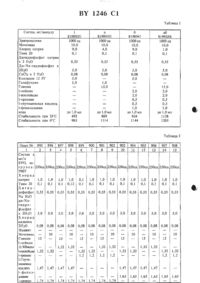
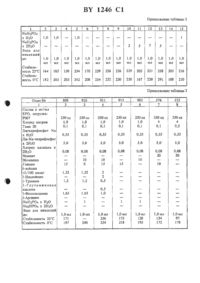
ЕРО, который предпочтительно используется в составе, изобретение поясняется подробнее.Эритропоэтин /ЕРО/ представляет собой глнкопротенн, который стимулирует образование гемоглобина, соответственно, эритроцитов в костном мозгу. Этот липопротеин образуется главным образом в почках, в очень незначительных количествах находится в сыворотке и при физиологических условиях частично вылетяется в моче.Отсутствие ЕРО при почечнойнедостаточности обусловлено ренальной анемией. Благодаря введению ЕРО в физиологических количествах, т.е. несколько микрограмм, за одну или несколько дозировок, можно снова возбуждать в таких случаях образование эритроцитов. Так как организм чувствительно реагирует на незначительные изменения дозы, то дозировка должна быть достаточно точно воспроизводима. Обычно ЕРО ит-гьицируют или внутримышечно или внутривенно в виде водного раствора или вводят в виде распыляемого раствора через слизистую оболочку носа.Однако, известно, что ЕРО, и именно как прежде всего полученный из человеческой мочи продукт, как также получаемые между тем путем генной инженерии продукты, в водном растворе нестабильны и даже при хранении при -80 С наступают большие потери активнести. Эти оба вида продуктов отличаются несколько по образу гликозилирования и по активности, прямое сравнение с содержащимся в сыворотке ЕРО до сих пор неизвестно.Эти потери активности сводятся, с одной стороны, к разрушению /разложению/ ЕРО за счет каталитических эффектов поверхности служащих для хранения ампул благодаря следам тяжелых металлов, кислороду воздуха и т.д., с другой стороны, однако, также за счет отложения ЕРО-молекул на стенках сосуда,причем также может происходить частично денатурация. Так как, как сказано выше, в каждой дозировочной единице должны содержаться только несколько микрограммов, потери за счет адсорбции уже спустя короткое время хранения могут быть значительными.В Европейском патенте А-178576 поэтому описано ишибироватше этого отложешая на стенках сосуда благодаря добавке подшмерных соединений, как альбумин сыворотки человека идш крупного рогатого скота, лецитин, декстран,целлюлозащолиэгилеъплтжодть и т.д., и таким образом достижеьше примерно спустя 2 часа хранения при 20 С ЕРО в количестве 75-98, в противоположность чему обнаруживают только 16 без такой добавки. При этом, впрочем,измерялось только обнаружетше радиоактивной маркировки /4 С/, так что эти опыты ничего не говорят о стабилизации ЕРО огг разложения.Согласно найденному нами, стабилизации в течение длительного времени с помощью таких средств, однако, нельзя достигать, т.к. ЕРОактивность в тесте на мыши сильно падает, к тому же эти средства при инфекции вызывают иммуногенные реакции.Из 1, далее, известны стабилизаторы, в особенности для сублимационно высушенных ЕРО-препаратов. Наряду с полимерными веществами ПЭГ 4000, желатиной и декстраном 40, названы различные сахара и многоатомные спирты, дающие при окислении моносахариды аминокислоты неорганические соли и тиолъные соединения. Комбинации этих веществ с человеческим сывороточным альбумином, желатиной и декстраном также указанны. Также в этом литературном источнике определяется только обнаружение радиоактивностей спустя 2 месяца хранения сублимационно высушенных продуктов. Оно указывается равным 8799, в противоположность 60 без добавок. Так как лиофилизированный материал используется непосредственно после получения в качестве стандарта, то не указано, какие еще потери активности при приготовлении препаратов. Также эти препараты обладают высокой потерей активности в тесте на мышах.Поэтому была поставлена задача создания хорошо совместимого ЕРО-препарата, которьпй стабилен при хранении, т.к. сохраняет ин виво активность, не приводит к адсорбциям на стенках ампул или шприцов и легко может переводиться в инъекцируемую форму.Неожиданно эта задача решается благодаря подробнее охарактеризованной в формуле изобретения комбинации различных компонентов. Как показали наши опыты, индивидуальные вещества этими свойствами не обладают, идш обладают только в незначительной мере.Решающей для стабилизации является добавка мочевины и различных аминокислот. Мочевина используется в количестве 10-15 г/л. В качестве аминокислот следует назвать,например, глицин, аланин, аргинин, 1-лейцин,Ъизолейцин, 2-фенилаланин, глютаминовая кислота или 1-треонин. Смеси различных аминокислот, по-видимому, имеют особенно предпочтительный эффект. Их используют в количествах 05-18 г/л, причем общее количество должно составлять предпочтительно 424 г/ л.Далее, необходим физиологически совместимый буфер, который в необходимых для инъекционных растворов незначительных концентрациях / примерно 20-100 ммоль/л/ устанавливает необходимую для ЕРО рН-область б,5-7,4, в особенности 70-72. Кроме фосфатных буферов применимы также глицинат, карбонат, цитрат и другие, причем в качестве противоионов могут служить, кромеионов натрия и калия, также ионы аммония. Буферирование дополнительно вызывается содержащимися аминокислотами.Прилипание ЕРО к стенкам ампул и шприцам существенно снижается за счет добавки незначительных количеств детергента. Так как препарат должен предпочтительно вводиться путем инъекции, это вещество должно быть физиологически, в особенности внутривенно,совместимо, оказываются пригодными концентрации О,1-0,2 г/л. Неионные смачиватели, как различные виды полнмакроголов, в особенности полиэтиленсорбитанлаурат /Твин 20 ИЛИ 80/ или сорбитантриолеат /рап 35 или 80/ или полигликолевый эфир глицеринолеиловой кислоты /1.аЬ-гаН 1 Е/ оказываются пригодными для этой цели, однако, в разной мере могут использоваться дРУГие совместимые вещества.Для уменьшения влияния на ЕРО ионов тяжелых металлов, которые почти Неизбежно увлекаются при обработке, например, из исполъзуемьтх меташпгческик инструментов, далее, оказывается пригодным добавление раствора 0,01-5 г/л растворимой кальциевой соли,предпочтительно примерно 0,02-0,2 г/л, хлорида кальция. Также могут использоваться другие физиологически совместимые комплексообразователи, например, Шатрата ЕДТА ТА, ПЗНТО тенат.В качестве растворителя используют чистую воду для инъекционных целей, к которой для установления изотонии добавляются еще 0,510 г/л хлорида натрия или соответствующих веществ, как Маннит, сорбит и т.д.Для получения предлагаемых согласно изобретению препаратов все вспомогательные вещества растворяют в необходимом количестве воды, примешивают ЕРО-препарат примерно 100000-500000 единиц/л, стерильно фильтруют в соответствующие ампулы, замораживают и осторожно лиофилизируют при низких температурах. Полученные препараты устойчивы в атмосфере азота в течение 2-х лет при ОС и в течение 1 года при комнатной температуре. При реконструировании с помощью водыони растворяются за несколько секунд без помутнения и таким образом могут прямо вводиться путем внутривенной или внутримышечной инъекции или после разбавления изотоническими растворами / например, раствором клорида натрня/ вливаться. .Процессу замораживания придают особое значение. Вспомогательные вещества по ряду и количеству выбираются так, чтобы эвтектическая точка замораживаемого раствора находилась между -50 С и -30 С. С помощью управляемой компьютером программы оптимизации определялись следующие оптимальные условия для З-к фаз лиофилизацииосновная сушка температура рассола 10 С,давление 104 мбар, время 48-60 часов.дополнительная сушка температура рассола 20 С, давление 103 мбар, время 4-6 часов.При этом существенным является распознавание с помощью измерительного устройства Ар, а также измерение электропроводности,когда закончится основная сушка, чтобы лиофилизируемый продукт слишком быстро не нагревался и чтобы избегать оттаивания замороженного раствора и связанной с этим потери активности.Используемые вспомогательные вещества выбираются так, чтобы осуществлялось образование равномерно структурированного лиофилизируемого замерзшего тела и во время лиофилизации получался пористый скелет/осадок на фильтры, из которого возможна оптимальная сублимация льда, прежде всего также к концу основной сушки. Дополнительная сушка осуществляется, как указано выше,только при 20 С в течение 4-6 часов. Эта осторожная обработка является важной, так как иначе приводят к потере активности в случае слишком лиофилизированного матернала.Как правило, таким образом лиофилизированные продукты имеют содержание воды по К.Фишеру притворно 2-5 . Это остаточное содержание воды зависит от рода и количества вспомогательных веществ, которые используются в соответствующей рецептуре.Водные растворы стабилизированного ЕРО можно также непосредственно заливать в ампулы и без лиофшшзации в виде готовой к употреблению формы использовать. Устойчивость, однако, благодаря этому по сравнению с лиофилизатом сокращается примерно до 1 года при 0 С и нескольких месяцев при комнатной температуре.Нижеследующие примеры должны более подробно пояснить вышеописанноеСухое вещество для инъекции с 2000 единиц эритропоэтина / состав для 35000 ампул/.В стерильном, снабженном мешалкой, емкостью 100 л У 2 А резервуаре с двойной рубашкой растворяют вспомогательные вещества1-треонин 35,0 г /0,5 г/л/ Ъглутамииовая кислота 35,0 г /0,5 г/л/ Ъфенилаланин 70,0 г /1,0 г/л/ вода для инъекционных целей до 70,0 л. К 30 л этого вспомогательного раствора до бавляют 214,3 мл сырьевой загрузки эритро поэтина с титром ЕРО 140000 ед/мл идоливают до конечного объема 35 л и переме шивают. С помощью остального раствора вспомогательных веществ ополаскивают систему фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор в асептических условиях заливают в склянки для инъекции емкостью 1 мл и сублимационно высушивают в установке для лиофилизации при следующих критериях время замораживания 12-14 часов при -40 С основная сушка температура рассола 10 С,давление 101 мбар, время 48-60 часов дополнительная сушка температура рассола 20 С, давление 103 мбар, время 4-6 часов. Получают таким образом объемистое, с открытыми порами сухое вещество для инъекции, которое стабильно по крайней мере 2 года в холодильнике и 1 год при комнатной температуре и в течение нескольких часов растворяется в 2 мл воды для инъекционных целей без помутнения и лишенным частиц. Пример 2. Лиофилизат с 200 единицами эритропоэтинавода для инъекционных целей до 70,0 л.Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством БРОбиологически активного вещества. Вторые 35 л используют для споласкивания системы фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор в асептических условиях разливают в склянки для инъекции емкостью 1 мл и лиофилизируют при тех же критериях, как указано в примере 1. Получают таким образомбелого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться без больших потерь активности 2 года в холодильнике или 1 год при комнатной температуре. Пример 3. Лиофилизат с 1000 единицами эритропоэтина / состав для 35000 ампулл эритропоэтин 233,33 мл 35 Мйо единиц 500000 ед/л 100,0 г /1,43 г/л/1-глутаминовая кислота 103,0 г / 1,47 г/л/ Ъфеиилаланин 115,5 г /1,64 г/л/ вода для инъекционных целей до 70,0 л. Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством БРОбиологически активного вещества. Вторые 35 л используют для ополаскивания системы для фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор при ЗССПТИЧЕСКИХ УСЛОВИЯХ заливают В СКЛЯШШ ДЛЯ ИНЪСКЦИИ ВМХОСТЬЮ 1 МЛ И лиофилизуют при тех же критериях, как описано в примере 1. Получают таким образом белого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться 2 года в холодильнике или 1 под при комнатной температуре, без больших потерь активности. Пример 4. Лиофилизат с 500 единицами эритропоэтинахлорид кальция х 2 Н 2 О 5,6 г /0,08 г/л/ мочевина 840,0 г /12,О г/л/ Е-лейцин 92,4 г /1,32 г/л/ Ъглутаминовая кислота 105,0 г / 1,5 г/л/ Ъфенилаланин 119,0 г /1,7 г/л/ вода для инъекционных целей до 70,0 л.Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством ЕРОбиологически активного вещества. Вторые 35 Л ИСПОЛЬЗУЮТ ДЛЯ СПОЛЗСКИБННИЯ СИСТЕМЫ ДЛЯ фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор разливают при асептических условиях в склянки для инъекции емкостью 1 мл и лиофилизируют при тех же критериях, как указано в примере 1. Получают таким образом белою цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться без больших потерь активности 2 года в холодильнике или 1 под при комнатной температуре.вода для инъекционных целей до 70,0 л.Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством ЕРОбиологически активного вещества. Вторые 35 л используют для споласкивания системы для фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор разливают при асептических условиях в склянки для инъекций емкостью до 1 мл и лиофилизируют при тех же критериях, как указано в примере 1. Получают таким образом белого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться без больших потерь активности 2 года в холодильнике или 1 год при комнатной температуре.Для того, чтобы испытать эффективность Цзктивность/ различных стабилизаторов, стандартную рецептуру с 1000 ед. ЕРО/мл, кото 10рая содержит в качестве основного стабилизатора мочевину, смешивают со смесью поливинилпирролидона с белком, соответственно,рЗЗЛИЧНЫМИ НМИНОКИЛОТВМИ И ПРОДУКТЫ ЛИофилизируют. Результаты представлены в таблице 1.Стабилгьность ЕРО после б недель хранения лиофилизата при З 5 С, соответственно, 0 С, в тесте на селезенке мыши согласно методикеСамкам В 6 С 3 Р 1 - мышей весом примерно по 20 г / Центральный Институт для покупателей подопытных животных, Ганновер/ в два последовательных дня вводили путем инъекции интраперитонеально 60 мг/ кг фенилгидразингидрохлорида. Спустя следующие З дня извлекали селезенку, клетки селезенки суспендировали в стерильной Кошр 1 е-срсде/ модифицированная Еа 31 е среда 1 Э 111 Ьессо 584, Омг/ л 1-глутамина 0,1 ммоль/л 2-меркаптозтанола 20 зародышевой телячьей сыворотки/ и разбавляли до 4 х 106 ядросодер жащих клеток/ мл. Суспензию, к которой прежде добавляют тест-вещество, соответственно, ЕРО-стандарт, смотря по обстоятельстБЗМ, В ПРИГОДНЫХ КОНЦСНТРНЦИЯХ,растворенные в ВЗА-буфере, распределяют на пластинках для микротитра /0,2 мл/ углубление/. После инкубации / 22 часа, З 7 С, воздух 15 И, С 02/ на углубление добавляют 20 мкл ЗН-меттш-тимндиновою раствора с ша) и снова инкубируют 2 часа при 37 С. После этого содержимое переводят с помощью клеточного Наше втегв и промывают диснишированной водой. Встроение ЗН-тимидина определяют с помощью Б-сцинтилляционного счетчика и ОЦВНИВНЮТ ПО ОТНОШЕНИЮ К стандартным препаратам.В качестве рабочего стандарта используют Р 009-ЕРО-стандарт Института Генетики,Кембридж, Массачусетс, США, который содержит 112 ед. ЕРО мл / и 503 нг протеина/мл//уравненный по отношению к ЕРО-стандарту ШПО 1 птегпат 1 опа 1 Кегегепсо Ргерага 11 опа 1 от Егйтгоройепп Нишап, Цгшсгу Еог Ьйосвзау / 2 по 1.Р.0., езтаыйзпеа 1971/. Стандартные концентрации находятся в области 10-100 шУ/мл.Испытывающиеся на ЕРО-активность лиофилизаты сначала на ампулу, растворяли в 2 мл воды для инъекционных Целей, осуществляли дальнейшие разбавления - также как в случае рабочего стандарта - с помощью В А-буфера /875 г аСТ, 1,95 г СаС 1 х 2 Н 2 О,1,00 г В А / бычий сывороточный альбумин фирма Са 1 Ь 1 ос 1 иш / вода для инъекционных целей до 1 л. ЗН-Метил-тимидин /уделтьная активность 2 Сп/моль/ получали от Меч Епашпо Мпспае.
МПК / Метки
МПК: A61K 37/24
Метки: получения, инъекционной, способ, эритропоэтина, формы
Код ссылки
<a href="https://by.patents.su/8-1246-sposob-polucheniya-inekcionnojj-formy-eritropoetina.html" rel="bookmark" title="База патентов Беларуси">Способ получения инъекционной формы эритропоэтина</a>
Предыдущий патент: Способ борьбы с грибками
Следующий патент: Трансдермальная терапевтическая система для нанесения лекарственного средства и способ ее получения
Случайный патент: Композиция для получения сухих завтраков с использованием мясного сырья