Штамм Escherichia coli, предназначенный для получения 2’-дезоксинуклеозид-5’-трифосфатов
Номер патента: 9693
Опубликовано: 30.08.2007
Авторы: ЕРОШЕВСКАЯ Людмила Анатольевна, Зинченко Анатолий Иванович, Титович Ольга Иринеушевна
Текст
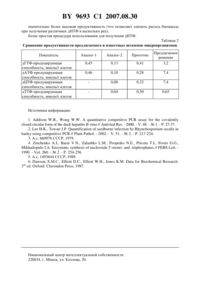
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ШТАММ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПОЛУЧЕНИЯ 2-ДЕЗОКСИНУКЛЕОЗИД-5-ТРИФОСФАТОВ(71) Заявитель Государственное научное учреждение Институт микробиологии Национальной академии наук Беларуси(72) Авторы Титович Ольга Иринеушевна Ерошевская Людмила Анатольевна Зинченко Анатолий Иванович(73) Патентообладатель Государственное научное учреждение Институт микробиологии Национальной академии наук Беларуси(57) Штамм бактерийБИМ В-389 Д, предназначенный для получения 2 дезоксинуклеозид-5-трифосфатов. Изобретение относится к микробиологии и биотехнологии и представляет собой новый штаммБМ-602, который способен трансформировать 2-дезоксинуклеозид-5-монофосфаты (дНМФ) в соответствующие 2-дезоксинуклеозид-5-трифосфаты (дНТФ) и может быть использован для получения дНТФ общей формулы где В - тимин-1-ил, цитозин-1-ил, аденин-9-ил или гуанин-9-ил. Указанные соединения являются биологически активными и широко используются в области молекулярной биологии, биохимии и медицине, в том числе при диагностике инфекционных заболеваний методом полимеразной цепной реакции 1, 2. Известен штамм бактерий-600, продуцирующий сложный комплекс нуклеотидкиназ и бесклеточный экстракт которого способен в результате этого,трансформировать 2-дезоксигуанозин-5-монофосфат (дГМФ) в 2-дезоксигуанозин-5 трифосфат (дГТФ) и 2-дезоксиаденозин-5-монофосфат (дАМФ) в 2-дезоксиаденозин-5 трифосфат (дАТФ) с выходами 80 и 82 соответственно 3. 9693 1 2007.08.30 Недостатком указанного штамма является сравнительно низкая дНТФ-продуцирующая способность (продуктивность), составляющая 0,45-0,46 ммоль продукта/г клеток. Это приводит к затрате 2,2 г клеток на получение 1 ммоля целевого продукта. Кроме того, с применением этого штамма продемонстрировано получение только пуриновых дНТФ,причем со сравнительно невысоким выходом целевых продуктов. Известен штамм дрожжей-91, экстракт клеток которого способен трансформировать все природные и ряд модифицированных дНМФ в дНТФ 4. Недостаток указанного штамма состоит в относительно низкой продуктивности клеток (составляющей в случае дАТФ - 0,1 ммоль продукта/г клеток, дГТФ - 0,13 ммоль/г,дЦТФ - 0,08 ммоль/г и дТТФ - 0,04 ммоль/г) и сравнительно невысоких выходах целевых продуктов (составляющих в случае дАТФ - 67 , дГТФ - 84 , дЦТФ - 56 и дТТФ -26 ). Из известных штаммов, применяемых для биокаталитического получения дНТФ, наиболее близким по эффективности к предлагаемому штамму является штаммВ, инфицированный фагом Т 4 ,82 5 (прототип). Продуктивность клеток штамма-прототипа в реакциях синтеза дНТФ из соответствующих дНМФ составляет для дАТФ - 0,28 ммоль продукта/г клеток, дГТФ - 0,41 ммоль/г, дЦТФ - 0,32 ммоль/г и дТТФ 0,30 ммоль/г. Процедура использования штамма для получения дНТФ предусматривает разрушение исходной биомассы клеток путем обработки ее лизоцимом и ультразвуком с последующей иммобилизацией комплекса нуклеотидкиназ на аминопропилсилохроме или аминоэтилцеллюлозе, активированных глутаровым альдегидом. Недостатками штамма-прототипа является сравнительно невысокая продуктивность его клеток в отношении синтеза дНТФ, а также сложность процедуры его использования для получения целевых продуктов. Задачей предлагаемого изобретения является получение нового штамма бактерийБМ-602 с повышенной продуктивностью его клеток в отношении синтеза дНТФ из соответствующих дНМФ. ШтаммБМ-602 получен из музейного штаммаБИМ В 200 Д - продуцента нуклеозидфосфорилаз, который никогда ранее для получения дНТФ не использовался, путем отбора наиболее активных вариантов при многократном рассеве исходной культуры на плотной агаризованной среде Адамса с ДНК (5 мг/мл) в качестве единственного источника углерода. Штамм депонирован в Белорусской коллекции непатогенных микроорганизмов ГНУ Институт микробиологии НАН Беларуси под коллекционным номером БИМ В-389 Д и характеризуется следующими свойствами. Морфологические признаки. Клетки - прямые палочки размером (1,1-1,5)(2,0-6,0) мкм. Встречаются отдельно или парами. Подвижные перитрихиальное жгутикование грамотрицательные. На МПА и агаризованной среде Адамса (37 С, 3 сут) колонии гладкие, слабо выпуклые. Цвет колоний серый. Поверхность блестящая, рельеф однородный. Края колоний ровные. Культуральные признаки и физиолого-биохимические свойства. Диапазон температуры роста 30-40 С. Оптимальный диапазон температуры 36,537,5 С. Оптимум роста наблюдается при рН среды 7,05-7,5. Факультативный анаэроб. Каталазоположителен, оксидазоотрицателен, уреазоотрицателен, индолположителен. Декарбоксилирует лизин и аргинин. Ацетоин (реакция Фогес-Проскауэра) не продуцирует. Не гидролизует желатин, мочевину, пектин. 9693 1 2007.08.30 В процессе роста сбраживает до кислоты с выделением газа -глюкозу, мальтозу, арабинозу, маннит, сорбит, трегалозу, лактозу, мелибиозу. Усваивает сахарозу, глицерин. В качестве единственного источника углерода может утилизировать ацетат, но не цитрат. Использует аммонийную и нитратную формы азота. Ауксотроф по -триптофану. Гемолитическими свойствами не обладает. Не токсичен для теплокровных животных. На бульоне Хоттингера к 24 ч (37 С) рост выражен в виде легкого помутнения. На дне пробирок образуется комковатый осадок, который полностью взмучивается при встряхивании (-форма). Содержание ГЦ в составе ДНК 50,60,5 мол.(определено оптическим методом). Штамм сохраняет жизнеспособность не менее года при хранении в холодильнике (46 С) на полноценной агаризованной среде (мясо-пептонный бульон, среда Хоттингера) под слоем вазелинового масла, а также в лиофилизированном (криопротектор - 10 -ное обезжиренное молоко) состоянии. КлеткиБМ-602 после разрушения обладают способностью синтезировать пуриновые и пиримидиновые дНТФ из соответствующих дНМФ. дНТФ-синтезирующая активность клеток, измеренная в реакции получения дАТФ составляет 7,4 ммоль/ч/г клеток. Для культивированияБМ-602 с целью получения клеток, пригодных для синтеза дНТФ, применяют питательную среду (рН 7,0-7,2) следующего состава, г/л 24 (безводный) 6,0 Н 2 РО 4 (безводный) 3,0-триптофан 0,005. Культивирование проводят в колбах Эрленмейера объемом 1,0 л, содержащих 0,2 л питательной среды, на термостатированных биологических качалках с частотой колебания платформы 170-190 об/мин при 37 С в течение 8-10 ч. По окончании культивирования клетки осаждают центрифугированием при 5000 в течение 10 мин, отмывают от среды 50 мл 50 мМ Трис-НС-буфера (рН 8,0). Биомассу клеток определяют весовым методом, высушивая аликвоту при 105 С до постоянной массы. дНТФ-синтезирующую активность клеток измеряют путем определения количества дАТФ, образующегося при инкубации УЗ-лизата клеток с дАМФ. С этой целью суспензию, содержащую 5(в расчете на сухую массу) клеток, 50 мМ Трис-НС-буфер (рН 8,0),10 мМ 2, 1 мМ ЭДТА, обрабатывают ультразвуком при мощности 0,5 кВт в течение 3-5 мин при температуре 2-4 С. Остатки разрушенных клеток отделяют центрифугированием в течение 10 мин при 8000 . Реакционную смесь (1 мл), содержащую 9,93 мг дАМФ (30 мкмоль), 12,6 мг ацетилфосфата, 0,1 М Трис-НС-буфер (рН 8,0), 20 мМ 2 и 10 мкл УЗ-лизата клеток, инкубируют при 37 С в течение 1 ч. После инкубации реакционную смесь хроматографируют на тонкослойной пластинке -254 фирмы(Германия) в системе растворителей изо-пропанол-25 -ный аммиак-вода (1172). Целевой продукт обнаруживают в УФ-свете, идентифицируя сравнением с положением образца-свидетеля, и элюируют 0,05 М К-фосфатным буфером (рН 7,0). Оптическую плотность элюата измеряют на спектрофотометре. Концентрацию дАТФ рассчитывают используя коэффициент молярной экстинции при длине волны 259 нм, равный 15400. дАТФ-синтезирующая активность штаммаБМ-602 в сравнении с другими штаммами микроорганизмов представлена в табл. 1. 3 9693 1 2007.08.30 Из данных табл. 1 следует, что эффективность штаммаБМ-602 в несколько раз выше любого из проверенных штаммов микроорганизмов. Таблица 1 Сравнительная оценка показателя активности наиболее активных из 65 проверенных штаммов микроорганизмов Штамм микроорганизмов Предлагаемый штамм получен впервые и никогда ранее не использовался для получения дНТФ. Использование штаммаБМ-602 иллюстрируется следующими примерами конкретного выполнения. Пример 1. Использование клетокБМ-602 для получения ДГТФ. Культивирование штаммаБМ-602 проводят методом глубинного культивирования в колбах Эрленмейера объемом 1,0 л, содержащих 0,2 л питательной среды,следующего состава, г/л 24 (безводный) 6,0 Н 2 РО 4 (безводный) 3,0-триптофан 0,005. Режим автоклавирования - 113 С 15 мин. Выращивание проводят на биологических качалках с частотой колебания платформы 170-190 об/мин при температуре 37 С в течение 8 ч. По окончании культивирования клетки осаждают центрифугированием при 5000 в течение 10 мин, отмывают от среды 50 мл 50 мМ Трис-НС-буфера (рН 8,0) и определяют содержание биомассы весовым методом, высушивая ее аликвоту при 105 С до постоянной массы. Далее 9 г клеток (в расчете на сухую массу) суспендируют в 180 мл 50 мМ Трис-НСбуфера (рН 8,0), содержащего 10 мМ 2, 1 мМ ЭДТА, и обрабатывают ультразвуком на дезинтеграторе микроорганизмов -10 фирмы(Польша) при мощности 0,5 кВт в течение 5 мин при температуре 2-4 С. Остатки разрушенных клеток отделяют центрифугированием в течение 10 мин при 8000 . Реакционную смесь (1 л), содержащую 10,41 г дГМФ (30 ммоль), 12,6 г ацетилфосфата, 2 г (4 ммоль) АТФ, 0,1 М Трис- буфер (рН 8,0), 20 мМ 2 и 180 мл УЗ-лизата,4 9693 1 2007.08.30 полученного из 9 г клетокБМ-602, инкубируют при 37 С в течение 3 ч. Реакцию останавливают прогреванием реакционной смеси на кипящей водяной бане 3-5 мин, быстро охлаждают и фильтруют через бумажный фильтр. Количество дГТФ, образовавшегося в реакционной смеси, определяют с помощью хроматографии на тонкослойной пластинке -254 фирмы(Германия) в системе растворителей изо-пропанол-25 -ный аммиак-вода (1172). Целевой продукт обнаруживают в УФ-свете, элюируют 0,05 М К-фосфатным буфером (рН 7,0) и спектрофотометрируют. При расчете концентрацию дГТФ используют коэффициент молярной экстинции при длине волны 252 нм, равный 13700 6. Выход реакции синтеза дГТФ составляет 96 мол. . Выделение целевого продукта осуществляют с помощью ионообменной хроматографии на смоле 18 в-форме в градиенте 0,10,5 Мпри рН 3. Фракции,содержащие продукт, объединяют, нейтрализуют 2 Мдо рН 7,0 и упаривают на роторном испарителе до концентрации дГТФ 10-15 мг/мл. дГТФ осаждают в виде натриевой соли 5 объемами охлажденного до -14 С этанола в течение 16 ч. Сформировавшийся осадок собирают центрифугированием, затем проводят дополнительную очистку дГТФ путем переосаждения этанолом, предварительно растворив осадок в небольшом количестве воды. Осадок дГТФ промывают 96 -ным этанолом и лиофильно сушат. Получают 15,82 г дГТФ (27,6 ммоль), что соответствует 92 -му выходу в расчете на взятый в реакцию дГМФ. При хроматографировании на тонкослойных пластинах -254 фирмы(Германия) в системе растворителей изо-пропанол-25 -ный аммиак-вода (1172) хроматографическая подвижность целевого продукта (0,84) совпала с подвижностью контрольного образца дГТФ. УФ-спектр (рН 7)нм 252 (13700)нм 222 250/2601,100,04 А 280/А 2600,660,03. Спектры поглощения целевого продукта совпали со спектрами аутентичного дГТФ и спектрами дГТФ, описанными в литературе 6. дГТФ-продуцирующая способность клеток штаммаБМ-602 составила 3,2 ммоль продукта/г клеток. Пример 2. Использование клетокБМ-602 для получения дАТФ. Синтез дАТФ проводят в условиях примера 1, за исключением того, что в реакционную смесь вносят 9,93 г (30 ммоль) дАМФ и 80 мл УЗ-лизата, полученного из 4 г клетокБМ-602. При расчете концентрацию дАТФ используют коэффициент молярной экстинции при длине волны 259 нм, равный 15400 6. Выход реакции синтеза дАТФ составляет 99 мол. . После изолирования дАТФ из реакционной смеси получают 15,88 г дАТФ (28,5 ммоль), что соответствует 95 -му выходу в расчете на взятый в реакцию дАМФ. При хроматографировании на тонкослойных пластинах -254 фирмы(Германия) в системе растворителей изо-пропанол-25 -ный аммиак-вода (1172) хроматографическая подвижность целевого продукта (0,69) совпала с подвижностью контрольного образца дАТФ. УФ-спектр (рН 7)нм 259 (15400)нм 226 А 250/А 2600,800,03 А 280/А 2600,150,02. 5 9693 1 2007.08.30 Спектры поглощения целевого продукта совпали со спектрами аутентичного дАТФ и спектрами дАТФ, описанными в литературе 6. дАТФ-продуцирующая способность клеток штаммаБМ-602 составила 7,4 ммоль продукта/г клеток. Пример 3. Использование клетокБМ-602 для получения ДЦТФ. Синтез дЦТФ проводят в условиях примера 1, за исключением того, что в реакционную смесь вносят 9,22 г (30 ммоль) дЦМФ и 80 мл УЗ-лизата, полученного из 4 г клетокБМ-602. При расчете концентрацию дЦТФ используют коэффициент молярной экстинции при длине волны 272 нм, равный 9100 6. Выход реакции синтеза дЦТФ составляет 99 мол. . После изолирования дЦТФ из реакционной смеси получают 15,2 г дЦТФ (28,5 ммоль),что соответствует 95 -му выходу в расчете на взятый в реакцию дЦМФ. При хроматографировании на тонкослойных пластинах -254 фирмы(Германия) в системе растворителей изо-пропанол-25 -ный аммиак-вода (1172) хроматографическая подвижность целевого продукта (0,76) совпала с подвижностью контрольного образца дЦТФ. УФ-спектр (рН 7)нм 272 (9100) А 250/А 2600,820,03 А 280/А 2600,980,04. Спектры поглощения целевого продукта совпали со спектрами аутентичного дЦТФ и спектрами дЦТФ, описанными в литературе 6. дЦТФ-продуцирующая способность клеток штаммаБМ-602 составила 7,4 ммоль продукта/г клеток. Пример 4. Использование клетокБМ-602 для получения ДТТФ. Синтез дТТФ проводят в условиях примера 1, за исключением того, что в реакционную смесь вносят 9,66 г (30 ммоль) дТМФ и 600 мл УЗ-лизата, полученного из 30 г клетокБМ-602. При расчете концентрацию дТТФ используют коэффициент молярной экстинции при длине волны 267 нм, равный 9600 6. Выход реакции синтеза дТТФ составляет 65 мол. . После изолирования дТТФ из реакционной смеси получают 9,87 г дТТФ (18 ммоль),что соответствует 60 -му выходу в расчете на взятый в реакцию дТМФ. При хроматографировании на тонкослойных пластинах -254 фирмы(Германия) в системе растворителей изо-пропанол-25 -ный аммиак-вода (1172) хроматографическая подвижность целевого продукта (0,80) совпала с подвижностью контрольного образца дТТФ. УФ-спектр (рН 7)нм 267 (9600) А 250/А 2600,650,02 А 280/А 2600,700,03. Спектры поглощения целевого продукта совпали со спектрами аутентичного дТТФ и спектрами дТТФ, описанными в литературе 6. дТТФ-продуцирующая способность клеток штаммаБМ-602 составила 0,65 ммоль продукта/г клеток. В табл. 2 суммированы данные по дНТФ-продуцирующей способности предлагаемого штамма и известных штаммов микроорганизмов. Из табл. 2 видно, что предлагаемый штамм имеет преимущество при синтезе любого из четырех природных дНТФ. Таким образом, получен штамм, обладающий следующими преимуществами по сравнению со штаммом-прототипом 6 9693 1 2007.08.30 значительно более высокая продуктивность (что позволяет снизить расход биомассы при получении различных дНТФ в несколько раз) более простая процедура использования для получения дНТФ. Таблица 2 Сравнение продуктивности предлагаемого и известных штаммов микроорганизмов Показатель дГТФ-продуцирующая способность, ммоль/г клеток дАТФ-продуцирующая способность, ммоль/г клеток дЦТФ-продуцирующая способность, ммоль/г клеток дТТФ-продуцирующая способность, ммоль/г клеток Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 7
МПК / Метки
МПК: C12P 19/00, C12N 1/20
Метки: escherichia, штамм, предназначенный, coli, 2’-дезоксинуклеозид-5’-трифосфатов, получения
Код ссылки
<a href="https://by.patents.su/7-9693-shtamm-escherichia-coli-prednaznachennyjj-dlya-polucheniya-2-dezoksinukleozid-5-trifosfatov.html" rel="bookmark" title="База патентов Беларуси">Штамм Escherichia coli, предназначенный для получения 2’-дезоксинуклеозид-5’-трифосфатов</a>
Предыдущий патент: Оптический матричный пространственный модулятор света
Следующий патент: Микромеханическое электрореле
Случайный патент: Способ формирования пазов на торце детали