Производные бензола
Текст
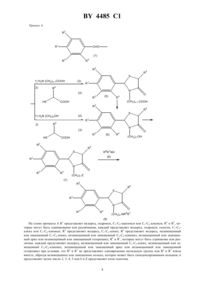
(71) Заявитель ЧУГАИ СЕЙЯКУ КАБУСИКИ КАЙСА(73) Патентообладатель ЧУГАИ СЕЙЯКУ КАБУСИКИ КАЙСА(57) 1. Производные бензола общей формулы 2 где 5 - водород, незамещенный или замещенный С 1-С 6-алкил, незамещенный или замещенный С 1-С 6 алкокси или незамещенный или замещенный фенил, где заместители выбраны из группы, включающей этоксикарбонил, изопропилоксикарбонил, карбокси, гидрокси, пирролидинкарбонил, диметиламинокарбонил, морфолинокарбонил, -диметиламиноэтилметиламинокарбонил, метокси, или 5-членное кольцо, содержащее два атома кислорода, при этом атом углерода, с которым оно присоединено, является спироатомом 4485 1 или фрагмент, выбранный из группы, включающей фрагменты формул , , , , , , , ,и 6 и 7 одинаковы или различны, каждый представляет водород или незамещенный или замещенный С 1 С 6-алкил, где заместители выбраны из группы, включающей метилендиоксифенокси, метоксифенокси, диметоксифенокси, триметоксифенокси, диметоксифенил, фторфенокси, фенил, гидрокси, фенокси, метилендиоксифенил, при условии, что 6 и 7 оба не являются метильными группами, или 6 и 7, взятые вместе, образуют незамещенный или замещенный пиперидинил, незамещенный или замещенный пиперазинил,незамещенный или дизамещенный тетрагидроизохинолинил, где заместители выбраны из группы, включающей бензил, -бензотиазолилметиламино, метилендиоксифенокси, хлорфенил, гидрокси, триметоксибензил, дифенилметил, метокси, - 2, 3, 4, 5 или 6,или их фармацевтически приемлемые соли. 2. Соединение по п. 1, где 1 - гидрокси, С 1-С 9-ацилокси или С 1-С 6-алкокси, или его фармацевтически приемлемая соль. 3. Соединение по п. 2, где 1 - гидрокси, С 1-С 9-ацилокси или С 1-С 6-алкокси, 2 и 3 одинаковы или различны, каждый представляет водород или С 1-С 4-алкил, 4 - водород или метил,- 2, 3, 4 или 5, или его фармацевтически приемлемая соль. 4. Соединение по п. 3, где 1 - гидрокси, С 1-С 9-ацилокси или С 1-С 6-алкокси, 2 и 3 одинаковы или различны, каждый представляет метил, этил, изопропил или трет-бутил, 4 - водород или метил,- 2, 3, 4 или 5,или его фармацевтически приемлемая соль. 5. Соединение по п. 4, где 1 - гидрокси, С 1-С 9-ацилокси или С 1-С 6-алкокси, 2 - трет-бутил, 3 - трет-бутил, 4 водород,- 2, 3, 4 или 5, или его фармацевтически приемлемая соль. 6. Соединение по п. 5, где 1 - гидрокси или метокси, 2 - трет-бутил, 3 - трет-бутил, 4 - водород,- 2,3, 4 или 5, или его фармацевтически приемлемая соль. 7. Соединение по п. 5, где 1 - гидрокси, 2 - трет-бутил, 3 - трет-бутил, 4 - водород,- 2, 3, 4 или 5,или его фармацевтически приемлемая соль. 2 4485 1 8. Соединение по п. 7, где- 3, или его фармацевтически приемлемая соль. 9. Соединение по п. 5, где 1 - С 1-С 9-ацилокси, 2 - трет-бутил, 3- трет-бутил, 4 - водород,- 2, 3, 4 или 5, или его фармацевтически приемлемая соль. 10. Соединение по п. 5, где 1 - С 1-С 6-алкокси, 2 - трет-бутил, 3- трет-бутил, 4 - водород,- 2, 3, 4 или 5, или его фармацевтически приемлемая соль. 11. Соединение по п. 10, где 1 - метокси, или его фармацевтически приемлемая соль. 12. Соединение по п. 5, где 1 - гидрокси, С 1-С 9-ацилокси или С 1-С 6-алкокси, 2 - трет-бутил, 3- третбутил, 4 - водород, 6 и 7 одинаковы или различны, каждый представляет водород или незамещенный или замещенный С 1-С 6-алкил,- 2, 3, 4 или 5, или его фармацевтически приемлемая соль. 13. Соединение по п. 12, где- 3, или его фармацевтически приемлемая соль. 14. Соединение по п. 12, где 6 и 7 одинаковы или различны, каждый представляет водород или незамещенный или замещенный С 1-С 6-алкил,- 2, 3, 4 или 5, или его фармацевтически приемлемая соль. 15. Соединение по п. 14, где- 3, или его фармацевтически приемлемая соль. 16. Соединение по п. 14, где 6 - незамещенный или замещенный С 1-С 6-алкил, 7 выбран из 2-(3,4 метилендиоксифенокси)этила, 3-(3,4-метилендиоксифенокси)пропила, 4-(3,4-метилендиоксифенокси)-н-бутила и 3,4-диметоксифенилметила, или 6 и 7, взятые вместе, образуют 4-(-2-бензотиазолилметиламино)пиперидил, 4-фенилметилпиперидил, 4-(3,4-метилендиоксифенокси)пиперидил или 4-(2,3,4-триметоксифенилметил)пиперазинил, или его фармацевтически приемлемая соль. 17. Соединение по п. 16, где- 3, или его фармацевтически приемлемая соль. 18. Соединение по п. 16, где 6 - метил или этил, или его фармацевтически приемлемая соль. 19. Соединение по п. 18, где- 3, или его фармацевтически приемлемая соль. 20. Соединение по п. 18, где 6 - метил, или его фармацевтически приемлемая соль. 21. Соединение по п. 20, где- 3, или его фармацевтически приемлемая соль. 22. Соединение по п. 1, выбранное из группы, включающей 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси)этиламинопропил-1,3-тиазолидин-4-он-3 метил 2-(3,4-метилендиоксифенокси)этиламинопропил-3,5-дитрет-бутил-4-гидроксибензолсульфонамид 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-метокси-1,3-тиазолидин-4-он 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-изопропоксикарбонилметил-1,3-тиазолидин-4-он 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-(2-гидроксиэтокси)-1,3-тиазолидин-4-он спиро 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси) этиламинопропил-1,3-тиазолидин-4-он-5,21,3 диоксолан 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-,-диметилкарбамоилметил-1,3-тиазолидин-4-он 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3-1-(4-бензил)пиперидилпропил-1,3-тиазолидин-4-он и 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3-1-4-(3,4-метилендиоксифенокси)пиперидилпропил-1,3 тиазолидин-4-он,или его фармацевтически приемлемые соли. 23. Соединение по п. 1, выбранное из группы, включающей 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси)этиламинопропил-1,3-тиазолидин-4-он 4485 1 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-изопропоксикарбонилметил-1,3-тиазолидин-4-он 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-(2-гидроксиэтокси)-1,3-тиазолидин-4-он спиро 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси) этиламинопропил-1,3-тиазолидин-4-он-5,21,3 диоксолан 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-,-диметилкарбамоилметил-1,3-тиазолидин-4-он и 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3-1-(4-бензил)пиперидилпропил-1,3-тиазолидин-4-он,или его фармацевтически приемлемые соли. 24. Соединение по п. 1, представляющее собой 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил-2-(3,4-метилендиоксифенокси)этиламинопропил-1,3-тиазолидин-4-он, или его фармацевтически приемлемая соль. 25. Соединение по п. 1, представляющее собой -2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил-2-(3,4-метилендиоксифенокси)этиламинопропил-1,3-тиазолидин-4-он, или его фармацевтически приемлемая соль. 26. Соединение по п. 1, представляющее собой (-)-2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил-2-(3,4-метилендиоксифенокси)этиламинопропил-1,3-тиазолидин-4-он, или его фармацевтически приемлемая соль. 27. Соединение по п. 1, представляющее собой 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3 метил-2-(3,4-метилендиоксифенокси)этиламинопропил-5-метил-1,3-тиазолидин-4-он, или его фармацевтически приемлемая соль. 28. Соединение по п. 1, представляющее собой 2,5-цис-2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3-метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-метил-1,3-тиазолидин-4-он, или его фармацевтически приемлемая соль. 29. Соединение по п. 1, представляющее собой 2,5-транс-2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3-метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-метил-1,3-тиазолидин-4-он, или его фармацевтически приемлемая соль. 30. Соединение по п. 1, представляющее собой (-)-2,5-цис-2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3-метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-метил-1,3-тиазолидин-4-он, или его фармацевтически приемлемая соль. 31. Соединение по п. 1, представляющее собой -2,5-цис-2-(3,5-дитрет-бутил-4-гидроксифенил)-3-3-метил 2-(3,4-метилендиоксифенокси)этиламинопропил-5-метил-1,3-тиазолидин-4-он, или его фармацевтически приемлемая соль. Область изобретения. Данное изобретение относится к соединениям общей формулыи их фармацевтически приемлемым солям или каждому их возможному стереоизомеру и оптическому изомеру, которые оказывают ингибирующее действие на кальциевые перегрузки в дополнение к сосудорасширяющей активности (антагонизм кальцию) и ингибирующему действию на липидное переокисление и являются полезными в качестве профилактических или лечебных средств в случае ишемических болезней и гипертензии (артериальной гипертонии). Предпосылки изобретения. Процесс повреждений клеток вследствие ишемии в широком смысле подразделяется на две категории 1) повреждения, вызываемые снижением уровня внутриклеточногоили увеличением внутриклеточной концентрации кальция и проч. при недостаточном доступе кислорода во время ишемии, и 2) повреждения,вызываемые увеличением притока кальция или продуцирования свободных радикалов, и др. с последующей реперфузией или восстановлением кровяных сосудов после ишемии (.,,29, 379 /1992/). В качестве типичных ишемических болезней могут быть приведены сердечнососудистые заболевания, такие как различные формы стенокардии, нестабильная стенокардия и аритмия, вызываемая восстановлением коронарных сосудов с помощью // и др. или цереброваскулярные заболевания, такие как преходящее нарушение мозгового кровообращения травматические повреждения головы и осложнения после мозговой хирургии. При лечении вариантной стенокардии или нестабильной стенокардии 5 4485 1 используются нитросоединения, примерами которых являются нитроглицерин и никорандил, и кальциевые антагонисты, примерами которых являются дилтиазем, нифедипин и верапамил, а для облегчения инфаркта миокарда или коронарных реперфузионных повреждений с последующим // и др. исследуется использование ингибиторов 5-липоксигеназы или акцепторов радикалов. В качестве профилактических и лечебных средств для случаев ишемических сосудистомозговых заболеваний исследовались и использовались глицеол (зарегистрированная торговая марка), озагрел, низофенон, тиклопидин, никаравен и др. с целью снижения случаев отека мозга или спазм мозговых сосудов на острой стадии травм мозговых сосудов. На хронической стадии использовались и используются усилители мозгового кровоснабжения, такие как антагонисты кальция, примерами которых являются никардипин, циннаризин и флунаризин, усилители мозгового кровоснабжения (циркуляции) со стимулирующим действием на метаболизм, такие как винпоцетин,ницерголин, пентоксифиллин и ифенпродил, или церебральные метаболические активаторы, такие как идебенон, , и госпатенат кальция, для того, чтобы увеличить проток крови или улучшить метаболическое состояние в тканях, которые пережили ишемические повреждения. На основе обширных и интенсивных исследований по поиску эффективных профилактических и лечебных средств для случаев ишемических болезней или гипертензии, которые способны были бы подавлять генерацию активного кислорода и увеличение внутриклеточной концентрации кальция, которые считаются главными причинами ишемических болезней и гипертензии, настоящие изобретатели обнаружили соединения, представленные формулой , обладающие сосудорасширяющей активностью (кальциевый антагонизм), ингибирующим действием на липидное переокисление и кальциевые перегрузки, и в результате создали настоящее изобретение. Раскрытие изобретения. Настоящее изобретение предоставляет производные бензола общей формулы 2 где 5 - водород, незамещенный или замещенный С 1-С 6-алкил, незамещенный или замещенный С 1-С 6-алкокси или незамещенный или замещенный фенил, где заместители выбраны из группы, включающей этоксикарбонил, изопропилоксикарбонил, карбокси, гидрокси, пирролидинкарбонил, диметиламинокарбонил, морфолинокарбонил, диметиламиноэтилметиламинокарбонил, метокси, или 5-членное кольцо, содержащее два атома кислорода, при этом атом углерода, которым оно присоединено, является спироатомом или фрагмент, выбранный из группы, включающей фрагменты формул , , , , , , , ,и 6 и 7 одинаковы или различны, каждый представляет водород или незамещенный или замещенный С 1 С 6-алкил, в котором заместители выбраны из группы, включающей метилендиоксифенокси, метоксифенокси, диметоксифенокси, триметоксифенокси, диметоксифенил, фторфенокси, фенил, гидрокси, фенокси, метилендиоксифенил, при условии, что 6 и 7 оба не являются метильными группами, или 6 и 7, взятые вместе, образуют незамещенный или замещенный пиперидинил, незамещенный или замещенный пиперазинил, незамещенный или дизамещенный тетрагидроизохинолинил, в которых заместители выбраны из группы, включающей бензил, -бензотиазолилметиламино, метилендиоксифенокси, хлорфенил, гидрокси,триметоксибензил, дифенилметил, метокси- 2, 3, 4, 5 или 6,или их фармацевтически приемлемые соли. Предпочтительная реализация изобретения Соединение, представленное формулой , может быть получено с помощью следующих процессов -. На схеме процесса 1 представляет водород, гидрокси, С 1-С 9-ацилокси или С 1-С 6-алкокси 2 и 3, которые могут быть одинаковыми или различными, каждый представляет водород, гидрокси, галоген, С 1-С 6 алкил или С 1-С 6-алкокси 4 представляет водород, С 1-С 6-алкил 5 представляет водород, незамещенный или замещенный С 1-С 6-алкил, незамещенный или замещенный С 2-С 6-алкенил, незамещенный или замещенный арил или незамещенный или замещенный гетероцикл 6 и 7, которые могут быть одинаковы или различны, каждый представляет водород, незамещенный или замещенный С 1-С 6-алкил, незамещенный или замещенный С 2-С 6-алкенил, незамещенный или замещенный арил или незамещенный или замещенный гетероцикл при условии, что 6 и 7 не представляют одновременно метильную группу или 6 и 7 взяты вместе, образуя незамещенное или замещенное кольцо, которое может быть сконденсированным кольцомпредставляет целое число 2, 3, 4, 5 или 6 ипредставляет атом галогена. 8 На схеме процесса В 1, 2, 3, 4, 5, 6, 7 иимеют те же значения, что определены ранее 8 представляет незамещенный или замещенный арил или незамещенный или замещенный гетероцикл ипредставляет атом хлора или атом брома. Процесс С На схеме процесса С 6, 7,иимеют те же значения, что определены ранее. На схеме процесса ,,,,,,иимеют те же значения, что определены ранее. Процесс Е 2 На схеме процесса 1, 2, 3, 4, 6, 7,иимеют те же значения, что определены ранее 9 представляет С 1-С 6-алкилпредставляет целое число от 1 до 7. На схеме процесса,,,,,,иимеют те же значения, что определены ранее. Процесс 2 на схеме процесса,,,,,,иимеют значения, определенные ранее. Процесс Н 4485 1 На схеме процесса 1, 2, 3, 4, 6, 7, ,иимеют значения, определенные ранее 10 и 11, которые могут быть одинаковыми или различными, каждый представляет водород, незамещенный или замещенный С 1-С 6-алкил, незамещенный или замещенный С 2-С 6-алкенил, незамещенный или замещенный арил или незамещенный или замещенный гетероцикл, или 10 и 11, взятые вместе, образуют незамещенное или замещенное кольцо, которое может быть сконденсированным кольцом. Процесс 2 На схеме процесса 1, 2, 3, 4, 6, 7,иимеют значения, определенные ранее и 9 представляет незамещенный или замещенный С 1-С 6-алкил. На схеме процесса 1, 2, 3, 4, 5, 6, 7 иимеют значения, определенные ранее. Процесс К На схеме процесса К, 2, 3, 4, 6, 7 иимеют значения, определенные выше 12 представляет карбоксильную группу или сульфонильную группу и 13 представляет карбонильную и сульфонильную группу,Процесс На схеме процесса,,,, 6, 7 иимеют значения, определенные ранее и 13 представляет карбонильную группу. На схеме процесса,,,,, 7 иимеют ранее указанные значения. Процесс На схеме процесса 1, 2, 3, 4, 6, 7 иимеют значения, определенные ранее А представляет фрагмент, выбранный из группы следующих фрагментов, представленных формулами , , ,и ипредставляет атом хлора или атом брома. Процесс 2 На схеме процесса О 1, 2, 3, 4, 6, 7,иимеют значения, определенные выше. Процесс Р 4485 1 На схеме процесса 1, 2, 3, 4, 5, 6, 7 иимеют ранее указанные значения. Процесс 2 На схеме процесса,,,,иимеют значения, определенные ранее. Условия реакций, подобранные для каждого из процессов А-, приведены в следующей ниже таблице. Процесс А(1)(6)(7)(9) Условия реакции для каждой стадии процесса А Стадия(7)(9) инертный раствори- инертный раствори- Инертный растворитель Растворитель инертный раство- то же, что тель (предпочтитель- (предпочтительно ацетель (предпочтиритель (предпочти- слева тельно тетрагидро- но дихлорметан, хло- тон, ацетонитрил, ДМФ тельно бензол или или ДМСО) фуран или толуол) роформ или толуол) диэтиловый эфир) Температура комнатная темпера- то же самое, -20 С до дефлег-10 С до дефлегма- -10 С до дефлегмации реакции тура до дефлегма- что слева мации (предпочти- ции (предпочтительно (предпочтительно от ции (предпочтительно от от комнатной до тем- комнатной до температельно температура-10 С до комнатной пературы дефлегма- туры дефлегмации) дефлегмации) ции) температуры) Время реакции 0,5-24 ч (предпоч- 0,5-24 ч 0,5-24 ч (предпоч- 0,5-24 ч (предпочти- 1-48 ч (предпочтительтительно 3-12 ч) галоидирующий агент неорганическое основание (предпочтитель(предпочтительно трехбромистый фос- но карбонат калия или фор или тионилхло- карбонат натрия)рид) ПримечаниеРацемическая смесь (5) может разделяться с использованием оптически активного органического основания, такого как бруцин, цинхонидин, эфедрин или хинин, давая оптически активную форму соединения (5).Хотя может использоваться любой метод, обычно применяемый для восстановления карбоновой кислоты в спирт, реакция предпочтительно осуществляется с помощью сначала превращения (5) в смешан 16 4485 1 ный ангидрид с использованием этилхлоркарбоната и др., с последующим восстановлением с помощью боргидрида натрия. Боргидрид натрия используется в количестве от 1 до 30 молярных эквивалентов,предпочтительно 10 молярных эквивалентов.Реакция предпочтительно осуществляется в присутствии йодида калия. Процесс В Условия реакции для каждой стадии процесса В Стадия(7)(11) Растворитель инертный растворитель (предпочтительно ацетонитрил или ацетон) Температура реакции от 0 С до дефлагмации (предпочтительно от комнатной до температуры дефлагмации) Время реакции 2-48 ч (предпочтительно 5 - 24 ч) Основание то же, что слева то же, что слева неорганическое основание(предпочтительно, карбонат калия или карбонат натрия) ПримечаниеРеакция предпочтительно осуществляется в присутствии йодида калия. Процесс СРеакция предпочтительно осуществляется в присутствии йодида калия. Процесс С(8)(16)(17)(9) Условия реакции каждой стадии процесса С Стадия(17)(9) Растворитель инертный растворитель спиртовый растворитель инертный растворитель(предпочтительно ацето(предпочтительно метанол (предпочтительно бензол нитрил или ацетон) или этанол) или толуол) Температура реакции-10 -50 С (предпочтитель- от комнатной температуры от 0 С до дефлегмации до дефлегмации (предпоч(предпочтительно от ком- но от 0 С до комнатной тительно температура денатной до температуры де- температуры) флегмации) флегмации) Время реакции 0,5-24 ч (предпочтительно 2-48 ч (предпочтительно но 0,5-24 ч (предпочтительно 1-5 ч) 6-24 ч) 1-5 ч) Основание неорганическое основание органический амин (пред(предпочтительно карбонат почтительно метиламин калия или карбонат натрия) или этиламин) или гидразингидрат) Процесс(9)(18) Растворитель вода или кислота (кислотой предпочтительно является уксусная или соляная кислота) Температура реакции от -10 С до температуры дефлегмации (предпочтительно 0-50 С) Время реакции от 2 до 15 дней (предпочтительно 4-10 дней) Кислота неорганическая кислота (предпочтительно 47 бромистоводородная кислота) Процесс(19)(21)(22) Условия реакции каждой стадии процессаСтадия(21)(22) Растворитель инертный растворитель (предпочтитель- инертный растворитель (предпочтительно дихлорметан, хлороформ или диэти- но ацетон, ацетонитрил ДМФ или ДМСО) ловый эфир) Температура от -10 С до температуры дефлегмации от -10 С до температуры дефлегмации(предпочтительно от комнатной до темпера- (предпочтительно от комнатной до температуры дефлегмации) туры дефлегмации) 17 0,5-48 часов (предпочтительно 4-24 ч) 1-48 ч (предпочтительно 5-24 ч) галоидирующии агент (предпочтительно неорганическое основание (предпочтитрехбромистый фосфор или тионилхло- тельно карбонат калия или карбонат натрия) рид) ПримечаниеРеакция предпочтительно осуществляется в присутствии йодида калия. Процесс(22)(23) Растворитель вода или спиртовый растворитель (предпочтительно метанол, содержащий воду,или этанол, содержащий воду) Температура реакции от -10 С до температуры дефлегмации (предпочтительно от комнатной до температуры дефлегмации) Время реакции 1-48 ч (предпочтительно 6-24 ч) Основание или кислота водный раствор неорганического основания, например, гидроокиси натрия или гидроокиси калия, или неорганическая кислота, например, серная или соляная кислота Процесс(22)(24) Растворитель инертный растворитель (предпочтительно ТГФ, диэтиловый эфир или толуол) Температура реакции от -78 С до температуры дефлегмации (предпочтительно от -78 С до комнатной температуры) Время реакции 0,1 - 24 ч (предпочтительно 5 ч) Восстанавливающий литийалюминийгидрид, боргидрид лития,комплекс боран-ТГФ и др. агент Процесс(25)(27)(28) Условия реакции на каждой стадии процессаСтадия(27)(28) Растворитель инертный растворитель (предпочтительно инертный растворитель (предпочтительно,дихлорметан, хлороформ или диэтиловый ацетон, ацетонитрил, ДМФ или ДМСО) эфир) Температура реакции от -10 С до температуры дефлегмации от -10 С до температуры дефлегмации(предпочтительно от 0 С до температуры (предпочтительно от комнатной до температуры дефлегмации) дефлегмации) Время реакции 0,5 - 25 ч (предпочтительно, 2-12 ч) 1 - 48 ч (предпочтительно, 5-24 ч) Реагент галоидирующий агент (предпочтительно неорганическое основание (предпочтитионилхлорид) тельно карбонат калия или карбонат натрия) ПримечаниеРеакция предпочтительно осуществляется в присутствии йодида калия. Процесс(29)(30)(31)(32) Условия реакции на каждой стадии процессаСтадия(31)(8) (32) то же, что и слева инертный растворитель Растворитель инертный растворитель(предпочтительно ацетон,(предпочтительно дихлорацетонитрил, ДМФ или метан, хлороформ или диДМСО) этиловый эфир) Температура реакции от -5 С до дефлегмации то же, что и слева от -10 С до дефлегмации(предпочтительно от ком(предпочтительно от 5 С до натной до температуры декомнатной) флегмации) Время реакции 0,5-12 ч (предпочтительно 1 2-72 ч (предпочтительно 6- 1 - 48 ч (предпочтительно 5- 3 ч) 24 ч) 24 ч) Другие галоидирующий агент неорганическое основание(предпочтительно сульфу(предпочтительно карбонат рилхлорид) калия или карбонат натрия) ПримечаниеРеакция предпочтительно осуществляется в присутствии йодистого калия. 18(9)(33) Растворитель инертный растворитель (предпочтительно дихлорметан, хлороформ или ТГФ) Температура реакции от -10 С - температура дефлегмации (предпочтительно от 0 до 50 С) Время реакции 0,5-48 ч (предпочтительно 2-10 ч) Реагент сульфурирующий агент (предпочтительно пятисернистый фосфор или реагент Лоуссона) Процесс К(34)(35) Условия реакции процесса К Стадия(34)(35) Растворитель инертный растворитель (предпочтительно ТГФ, диэтиловый эфир, дихлорметан или хлороформ) Температура реакции от -10 С до температуры дефлегмации (предпочтительно от 0 С до температуры дефлегмации) Время реакции 0,5-48 ч (предпочтительно 1-24 ч) Галоидирующий агент тионилхлорид, оксалилхлорид, треххлористый фосфор, трехбромистый фосфор и др.(Примечание Реакция предпочтительно осуществляется в присутствии каталитического количества ДМФ) Основание неорганическое основание или органическое основание (предпочтительно пиридин или триэтиламин) Процесс(35)(36) Растворитель инертный растворитель (предпочтительно дихлорметан или хлороформ) Температура реакции от -10 С - температура дефлегмации (предпочтительно 0-50 С) Время реакции 0,5-48 ч (предпочтительно 2-10 ч) Сульфурирующий агент пятисернистый фосфор или реагент Лоуссона Процесс М(36)(37) Растворитель инертный растворитель (предпочтительно ТГФ) Температура реакции от -10 С - температура дефлегмации (предпочтительно от 0 С до температуры дефлегмации) Время реакции 0,5-48 ч (предпочтительно 5-24 ч) Основание неорганическое или органическое основание (предпочтительно гидрид натрия или диизопропиламид лития) Алкилирующий агент алкилгалогенид (предпочтительно этилиодид) Процесс(38)(40)(41) Условия реакции каждой стадии процессаСтадия(40)(41) Растворитель инертный растворитель (предпочтительно инертный растворитель (предпочтительно ДМФ, ДМСО, ацетон или ацетонитрил) ацетон или ацетонитрил) Температура-10 С - температура дефлегмации (пред-10 С - температура дефлегмации (предпочпочтительно от комнатной до температуры тительно от комнатной температуры до темдефлегмации) пературы дефлегмации) 0,5 ч - 4 суток (предпочтительно от 3 ч до 3 1-48 ч (предпочтительно, 5-24 ч) Время реакции дней) Основание неорганическое основание (предпочтинеорганическое основание (предпочтительно тельно карбонат калия или карбонат накарбонат калия или карбонат натрия) трия) ПримечаниеРеакция предпочтительно осуществляется в присутствии йодистого калия. 19(42)(43)(44)(45) Условия реакции на каждой из стадий процесса О Стадия(44)(45) инертный растворитель Растворитель инертный растворитель инертный растворитель(предпочтительно метанол (предпочтительно дихлор- (предпочтительно ДМФ,ДМСО, ацетон или ацетоили этанол) метан, хлороформ или динитрил) этиловый эфир) Температура реакции 0 С до дефлегмации (пред- -10 С до дефлегмации(предпочтительно от компочтительно от комнатной (предпочтительно от комдо температуры дефлегма- натной до температуры де- натной до температуры дефлегмации) флегмации) ции) Время реакции 1-24 ч (предпочтительно 5- 0,5-24 ч (предпочтительно 1- 1-48 ч (предпочтительно 5-24 20 ч) 7 ч) ч) неорганическое основание Реагент неорганическое основание галоидирующий агент(предпочтительно карбонат (предпочтительно трехкалия или карбонат натрия) бромистый фосфор или тио- калия или карбонат натрия) нилхлорид) ПримечаниеРеакция предпочтительно осуществляется в присутствии йодистого калия. Процесс(9)(46) Растворитель органическая кислота (предпочтительно уксусная кислота) Температура реакции-5-40 С (предпочтительно комнатная температура) Время реакции 0,5-48 ч (предпочтительно 6-12 ч) Окисляющий агент перекись водорода или органическая надкислота Процесс(1)(47)(48)(49) Условия реакции на каждой стадии процессаСтадия(48)(49) Растворитель инертный растворитель инертный растворитель инертный растворитель(предпочтительно метанол (предпочтительно ТГФ или (предпочтительно ТГФ или или ТГФ) дихлорметан) хлороформ) Температура реакции от -10 С до дефлегмации от -10 С до дефлегмации 0 С до дефлегмации (предпочтительно комнатная тем(предпочтительно от 0 С до (предпочтительно от 0 С до пература) комнатной температуры) комнатной температуры) Время реакции 0,5-48 ч (предпочтительно 0,5-24 ч (предпочтительно 1- 0,5-24 ч (предпочтительно 11-5 ч) 5 ч) 5 ч) Основание неорганическое основание или органическое основание(предпочтительно пиридин или триэтиламин) Соединение формулы , согласно настоящему изобретению, содержит один или два асимметричных атома углерода в своей структуре, и чистые стереоизомеры или оптические изомеры могут получаться с помощью методов, известных в технике. Например, каждый энантиомер может отделяться с помощью хроматографии с использованием ВЭЖХ колонки для оптического разделения или с помощью фракционной кристаллизации с использованием оптически активной кислоты, предпочтительно кислого -(-)-1,1-бинафтил 2,2-диил-фосфата. Упомянутые выше приемы разделения оптических изомеров применимы не только к конечным продуктам, но также и к промежуточным продуктам, имеющим карбоксильную группу. В последнем случае могут применяться обычно используемые оптически активные основания, такие как бруцин. Аналогичным образом диастереомерные смеси, включающие как цис-, так и транс-стереоизомеры, могут разделяться на индивидуальные оптические изомеры, т.е. цис, цис(-), транс и транс(-), с помощью общепринятых методов, известных специалистам в данной области. Само собой разумеется, что стереоизомеры и оптические изомеры соединений формулытакже включаются в объем настоящего изобретения. Примеры. Настоящее изобретение теперь будет проиллюстрировано более подробно со ссылкой на ссылочные примеры, примеры и примеры фармакологических испытаний. 20 4485 1 В ниже следующих ссылочных примерах, примерах и таблицах 1-24 включительно, данные ЯМР измерялись с помощью-200 или-270, за исключением случаев, помеченных звездочкой, в которых измерения осуществлялись с использованием-24 (60 МГц). В указанных выше и представленных далее таблицах используются условные обозначения и сокращения,которые расшифровываются следующим образом- и- шир.с. (широкий синглет)- д (дублет)- Гц (герц)- м. (мультиплет)ЯМР- кв.(квартет)- квинт (квинтет)- . (синглет)- т. (триплет) Ссылочный пример 1. Получение 2-(3,5-диизопропил-4-гидроксифенил)-3-(3-гидроксипропил)-1,3-тиазолидин-4-он В бензоле (50 мл) суспендировались 3,5-диизопропил-4-гидроксибензальдегид (5,00 г) и 3-аминопропанол (1,82 г) в атмосфере азота. К реактору подсоединялась ловушка Дина-Старка, и суспензия нагревалась в условиях дефлегмации (с обратным холодильником) в течение 1,5 часов. После оставления смеси охлаждаться добавлялась меркаптоуксусная кислота (2,23 г), затем смесь дополнительно нагревалась с обратным холодильником в течение 2 часов. После удаления бензола с помощью выпаривания к остатку добавлялась вода (50 мл), и смесь экстрагировалась хлороформом. Органический слой сушился над безводным сульфатом натрия, и растворитель удалялся при пониженном давлении. Остаток очищался на силикагельной хроматографической колонке (элюент хлороформметанол,991), давая 1,97 г (24 ) целевого соединения в виде бесцветного масла, ЯМР(СДС 3, 60 МГц)1,23 (12 Н, д.,6,6 Гц), 1,0-1,8 (2 Н, м.), 2,5-3,8 (7 Н, м.), 3,73 (2 Н, шир.с.), 5,50 (2 Н,шир.с.), 6,92 (2 Н, с.). Каждый из спиртов, показанных в таблицах 1-3, получался в соответствии с процедурой ссылочного примера 1 с использованием в каждом случае соответствующего замещенного бензальдегида и соответствующего аминоалкилового спирта вместо 3,5-диизопропил-4-гидроксибензальдегида и 3-аминопропанола. Таблица 1-аланин (20,0 г). К реактору подсоединялась ловушка Дина-Старка, и суспензия нагревалась с обратным холодильником в течение 1 ч. После оставления смеси охлаждаться добавлялась -меркаптоуксусная кислота (23,6 г), и смесь дополнительно нагревалась с обратным холодильником в течение 24 ч. После удаления бензола выпариванием к остатку добавлялась вода (500 мл), и смесь экстрагировалась хлороформом. Органический слой сушился над безводным сульфатом натрия, и растворитель удалялся при пониженном давлении. Остаток очищался с помощью колоночной хроматографии на силикагеле (элюент хлороформ-метанол, 982), давая 54,6 г (67 ) 2-(3,5-дитрет-бутил-4-гидрокси-фенил)-3-(2-карбоксиэтил)-1,3-тиазолидин-4-она в виде бесцветных кристаллов, т.пл. 164165 С. ЯМР (СДС 3, 200 МГц)1,42 (18 Н, с.), 2,2-2,5 (1, м.), 2,5-2,8 (1, м.), 3,0-3,3 (1, м.), 3,5-4,0 (3 Н, м.),5,33 (1, с.), 5,64 (1, с.), 7,09 (2 Н, с.), 8,5 (1, шир.с.). К раствору получающегося в результате 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(2-карбоксиэтил)-1,3 тиазолидин-4-она (100 мг) в тетрагидрофуране (3 мл) добавлялись по каплям триэтиламин (27 мг) и этилхлорформиат (28 мг) при -10 С в атмосфере азота с последующим перемешиванием при -10 - 5 С в течение 1 ч. К смеси добавлялся боргидрид натрия (100 мг), смесь перемешивалась при комнатной температуре в течение 3 часов, затем выливалась в смесь льда и воды и экстрагировалась этилацетатом. Органический слой сушился над безводным сульфатом натрия, и растворитель выпаривался при пониженном давлении. Остаток очищался с помощью колоночной хроматографии на силикагеле (элюент хлороформметанол, 982), давая 70 мг(73 ) продукта, который был идентичен продукту ссылочного примера 15. 4485 1 Ссылочный пример 17. Получение 2-(3,5-диизопропил-4-гидроксифенил)-3-(3-хлорпропил)-1,3-тиазолидин-4-она К раствору в дихлорметане (50 мл) 2-(3,5-диизопропил-4-гидроксифенил)-3-(3-гидроксипропил)-1,3 тиазолидин-4-она (1,97 г), полученного в ссылочном примере 1, добавлялся тионилхлорид (1,04 г) в атмосфере азота, затем смесь нагревалась с обратным холодильником в течение 1 ч. Растворитель выпаривался при пониженном давлении, и к остатку добавлялись солевой раствор и хлороформ. Органический слой отделялся и сушился над безводным сульфатом натрия, и растворитель выпаривался при пониженном давлении. Остаток очищался с помощью колоночной хроматографии на силикагеле (элюент дихлорметан), давая 1,25 г (60 ) целевого соединения в виде бледно-желтых кристаллов, т.пл. 105-106 С. ЯМР (СДС 3, 60 МГц)1,23 (12 Н, д.,6,6 Гц), 1,5-2,1 (2 Н, м.), 2,6-3,8 (6 Н, м.), 3,67 (2 Н, шир.с.), 5,20(1, 1, с.), 5,50 (1, шир.с.), 6,88 (2 Н, с.). Ссылочные примеры 18-28. Каждое соединение, показанное в таблицах 4 и 5, получалось согласно процедуре ссылочного примера 17 с использованием в каждом случае соответствующего спирта. Таблица 4 Ссылочный пример 29. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3-бромпропил)-1,3-тиазолидин-4-она К раствору 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3-гидроксипропил)-1,3-тиазолидин-4-она (2,00 г),полученного в ссылочном примере 15, в диэтиловом эфире (20 мл) добавлялся трехбромистый фосфор (0,74 г) в атмосфере азота, затем смесь перемешивалась при комнатной температуре в течение 6 часов. После завершения реакции смесь выливалась в смесь лед-вода (100 мл), и продукт экстрагировался диэтиловым эфиром. Органический слой промывался солевым раствором и сушился над безводным сульфатом натрия. Рас 25 4485 1 творитель выпаривался при пониженном давлении, и остаток очищался с помощью колоночной хроматографии на силикагеле (элюент хлороформ), давая 1,31 г (56 ) целевого соединения в виде бледно-желтых кристаллов. Т.пл. 130-131 С. ЯМР (СДС 3, 60 МГц)1,43 (18 Н, с.), 1,6-2,2 (2 Н, м.), 2,6-3,6 (2 Н, м.), 3,28 (2 Н, т.,6,5 Гц), 3,70 (2 Н,шир.с.), 5,28 (1, с.), 5,53 (1, шир.с.), 7,05 (2 Н, с.) Каждый из бромидов, показанных в табл. 6, получался в соответствии с процедурой ссылочного примера 29 с использованием в каждом случае соответствующего спирта. Таблица 6 Пример 1. Получение 2-(3,5-диизопропил-4-гидроксифенил)-3-3 метил 2(3,4-метилендиоксифенокси)этиламинопропил-1,3-тиазолидин-4-она К раствору 2-(3,5-диизопропил-4-гидроксифенил)-3-(3-хлорпропил)-1,3-тиазолидин-4-она (0,50 г), полученного в ссылочном примере 17, и -метил 2-(3,4-метилендиоксифенокси)этиламина (0,30 г) в диметилформамиде (10 мл) добавлялись карбонат натрия (0,29 г) и йодистый калий (0,30 г) в атмосфере азота, и смесь перемешивалась при 80 С в течение 24 ч. Растворитель удалялся с помощью выпаривания при пониженном давлении, к остатку добавлялась вода (20 мл) и смесь экстрагировалась хлороформом. Органический слой промывался последовательно водой и солевым раствором, затем сушился над безводным сульфатом натрия. Растворитель выпаривался при пониженном давлении и остаток очищался с помощью колоночной хроматографии на силикагеле (элюент хлороформметанол 973), давая 0,26 г (36 ) целевого соединения в виде бледно-коричневого масла. ЯМР (СДС 3, 60 МГц)1,23 (12 Н, д.,6,6 гц), 1,4-1,9 (2 Н, м.), 2,17 (3 Н, с.), 2,3 -3,8 (8 Н, м.), 3,67 (2 Н,шир.с.), 3,87 (2 Н, т.,5,7 Гц), 5,00 (1, шир.с.), 5,57 (1, с.), 5,80 (2 Н, с.), 6,0-6,7 (3 Н, м.), 6,90 (2 Н, с.). Примеры 2-25. Каждое соединение, показанное в табл. 7-10, получалось в соответствии с процедурой примера 1, с использованием соответствующего хлорида и соответствующего амина в каждом случае.
МПК / Метки
МПК: C07D 249/08, C07D 285/22, A61P 9/12, C07D 277/10, A61K 31/41, A61P 9/10, C07C 311/18, C07C 235/50, C07D 417/06, C07D 233/04, C07C 233/78, C07C 261/04
Метки: производные, бензола
Код ссылки
<a href="https://by.patents.su/30-4485-proizvodnye-benzola.html" rel="bookmark" title="База патентов Беларуси">Производные бензола</a>
Предыдущий патент: Способ профилактики патологического течения беременности у женщин, проживающих на загрязненных радионуклидами территориях
Следующий патент: Стероиды, обладающие противовоспалительной, иммуносупрессивной и противоаллергической активностью, способ их получения, фармацевтическая композиция на их основе
Случайный патент: Створчатое гинекологическое зеркало