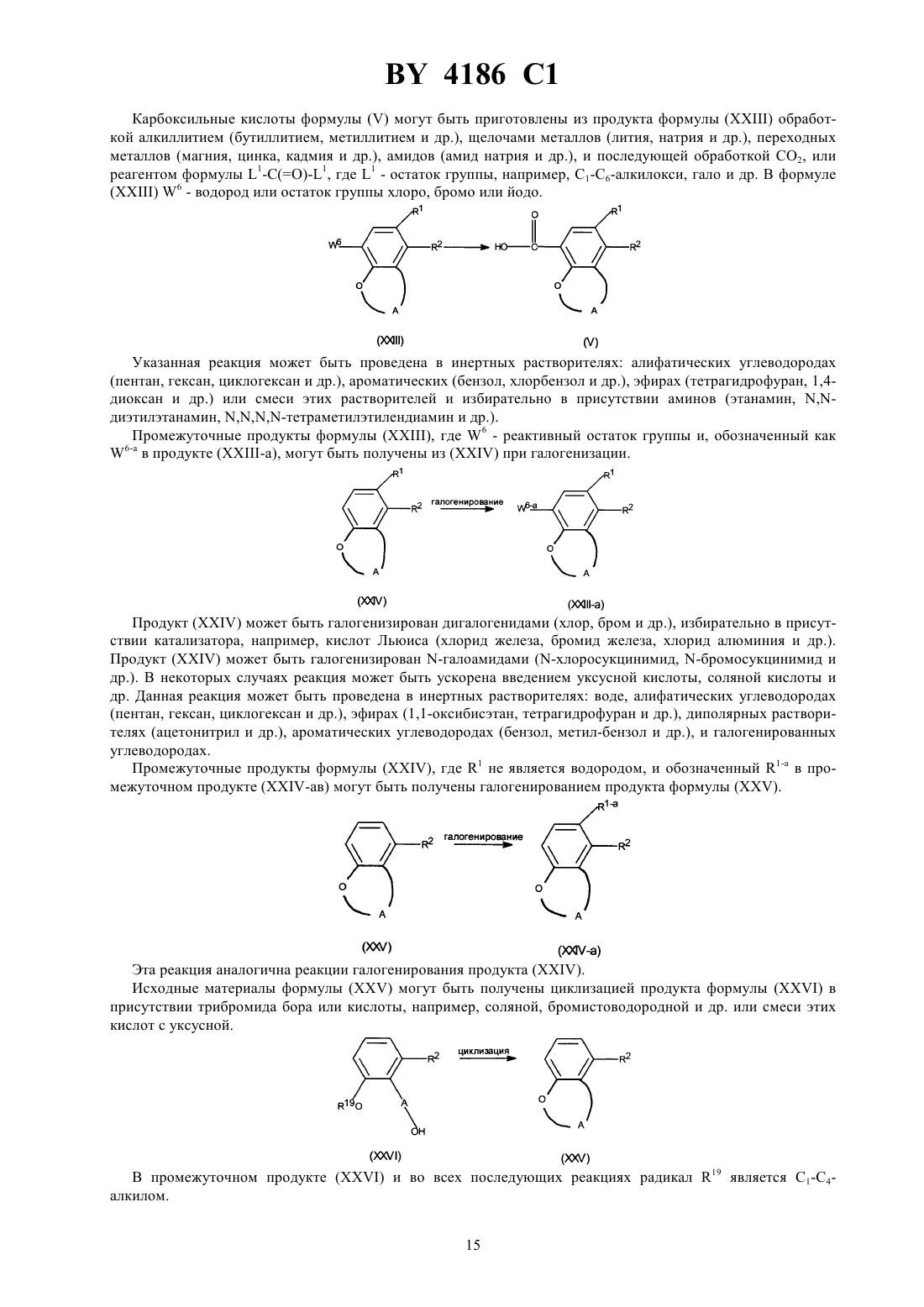
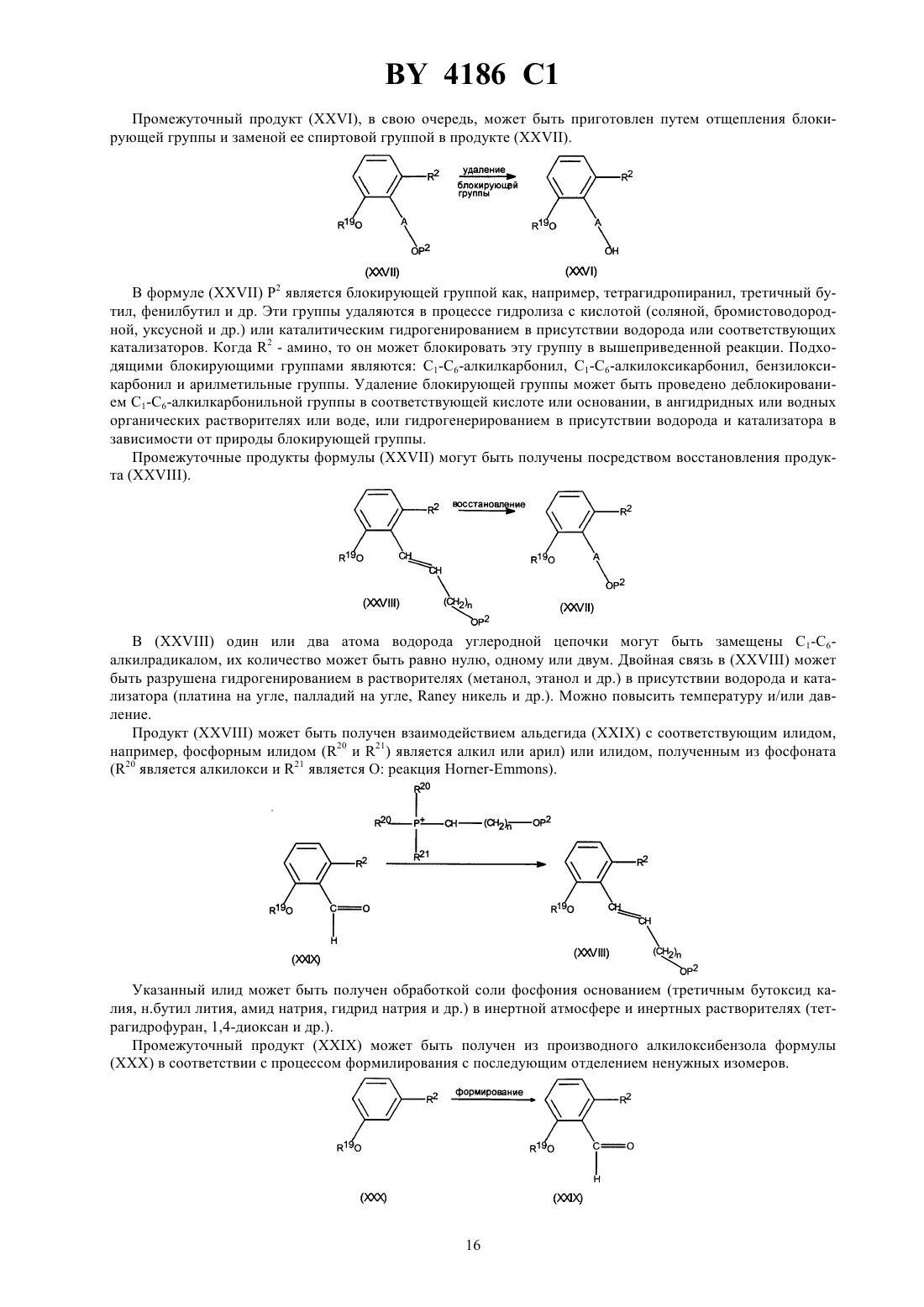
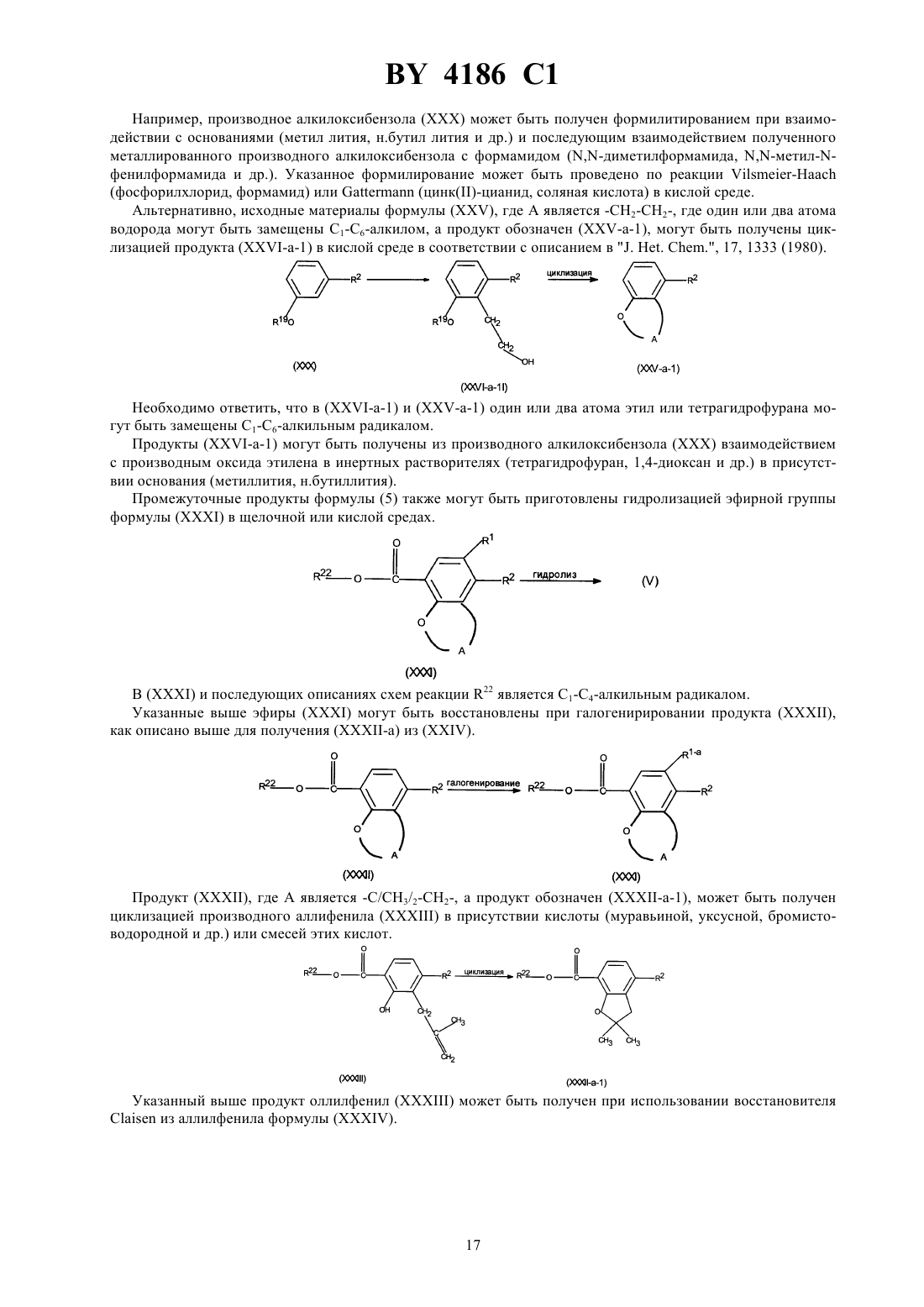
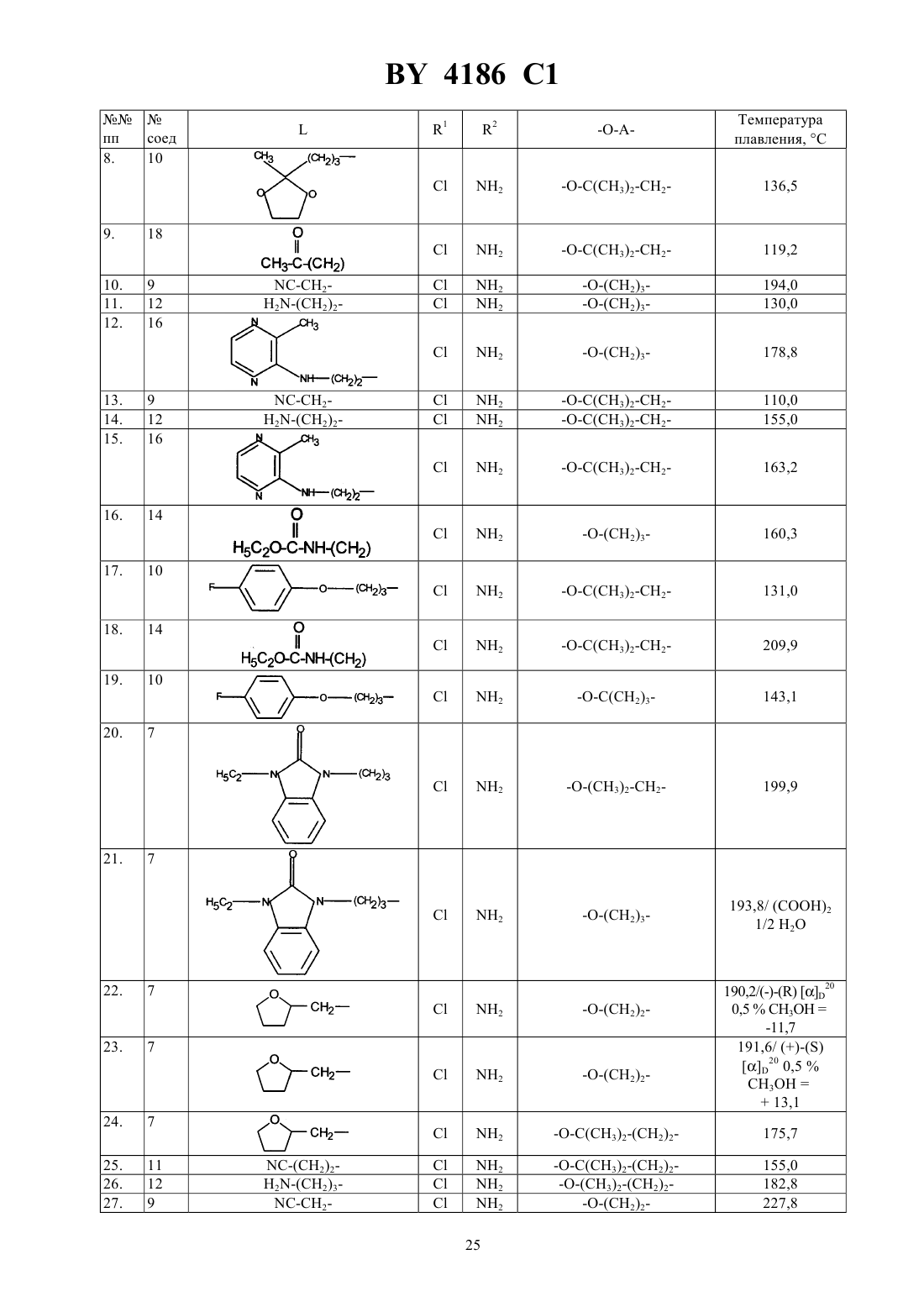
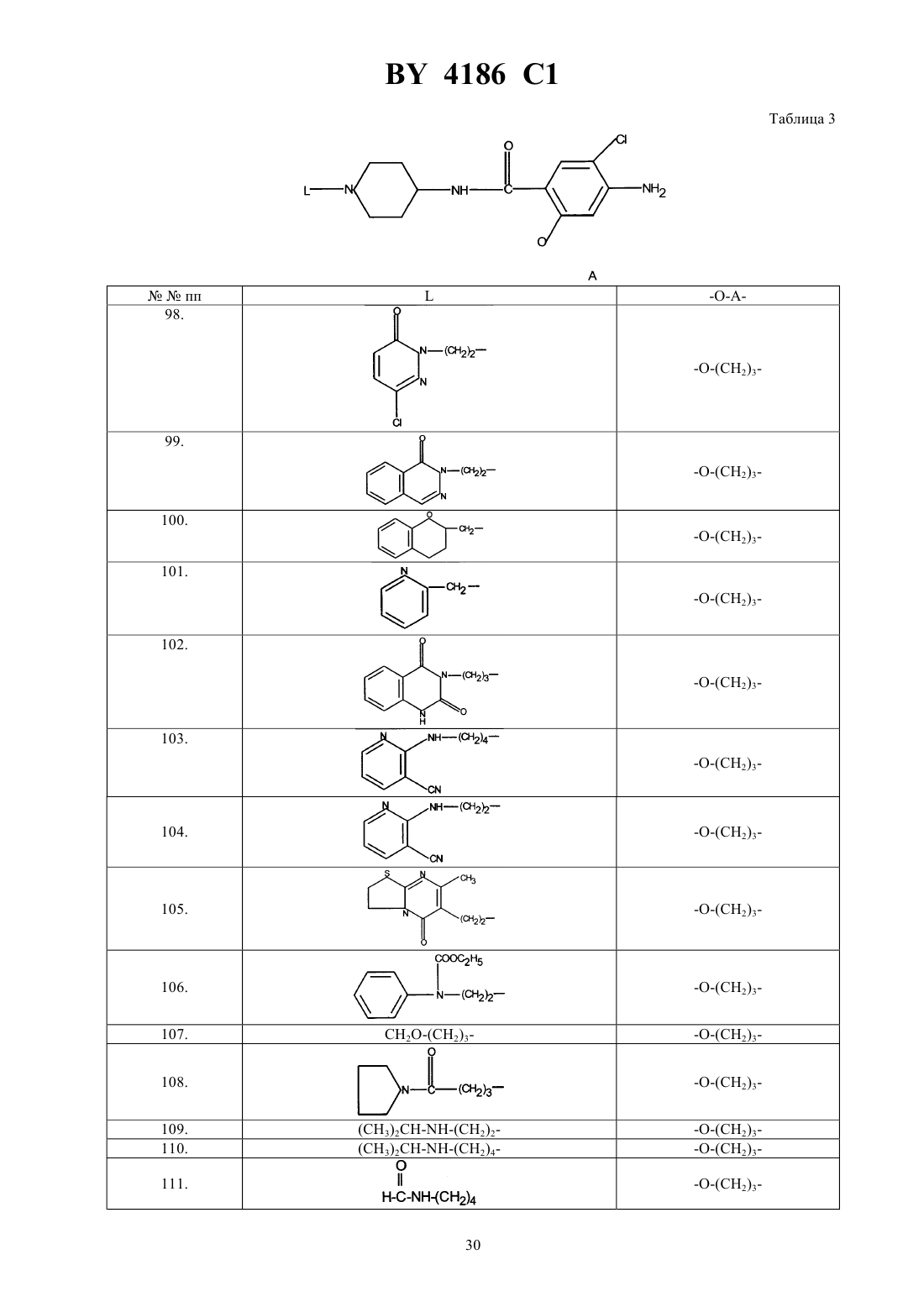
Производные N-(4-пиперидинил) (дигидробензофуран или дигидро-2H-бензопиран)карбоксиамида, способ их получения, фармацевтическая композиция на их основе, промежуточные соединения
Номер патента: 4186
Опубликовано: 30.12.2001
Авторы: ДЕ КЛЕЙН, Михел Анна Йозеф, ВАН ДАЛЕ, Георгес Хенри Паул, БОСМАНС, Ян-Паул Рене Мари Андре
Текст
ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ ПРОИЗВОДНЫЕ -(4-ПИПЕРИДИНИЛ) (ДИГИДРОБЕНЗОФУРАН ИЛИ ДИГИДРО-2-БЕНЗОПИРАН)КАРБОКСИАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ,ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ(57) 1. Способ получения производных бензопиран)карбоксиамида формулы(71) Заявитель ЯНССЕН ФАРМАЦЕВТИКА Н. В. (ВЕ)(72) Авторы ВАН ДАЛЕ, Георгес Хенри Паул БОСМАНС, Ян-Паул Рене Мари Андре ДЕ КЛЕЙН, Михел Анна Йозеф(73) Патентообладатель ЯНССЕН ФАРМАЦЕВТИКА Н. В. (ВЕ)-2-2-2-2(-3),в которых один или два атома водорода могут быть замещены 1-С 6-алкилом,1 - водород или галоген,2 - водород, амино- или моно(1-С 6-алкил)аминогруппы,3 - водород или 1-С 6-алкил, - 3-С 6-циклоалкил, 3-С 6-алкенил, при необходимости замещенный арилом, или радикал формулы(-3),в которых каждый- 1-С 6-алкандиил,4 - водород, цианогруппа, 3-С 6-циклоалкил, арил, диарилметил или ,5 - водород, 1-С 6-алкил, гидрокси-1-С 6-алкил, 3-С 6-циклоалкил, арил или , -или ,7 - водород, 1-С 6-алкил, арил, 1-С 6-алкилокси- или гидроксигруппа, - 8, или прямая связь, где 8 - водород или арил каждый арил - фенил, незамещенный или замещенный 1-3 заместителями, каждый из которых выбран из галогена или 1-С 6-алкилоксигруппы,каждый- тетрагидрофуранил, 1,3-диоксоланил, замещенный 1-С 4-алкилом 3,4-дигидро-1(2 Н)бензопиранил пиперидинил пиридинил, при необходимости замещенный цианогруппой пиразинил, замещенный 1-С 4-алкилом индолил 2,3-дигидро-2-оксо-1 Н-бензимидазолил, при необходимости замещенный 1-С 4-алкилом 2-оксо-1-имидазолидинил,замещенный 1-С 4-алкилом 3,4-дигидро-4-оксо-1,2,3 бензотриазин-3-ил, замещенный тремя 1-С 4-алкилоксигруппами 1-окси-2(1 Н)-фталазинил 2,3-дигидро-5-оксо 4186 1 5 Н-тиазол 3,2-пиримидин-6-ил, замещенный 1-С 4-алкилом 5-оксо-5 Н-тиазол 3,2-пиримидин-6-ил, замещенный 1-С 4-алкилом 1,6-дигидро-6-оксо-1-пиридазинил, замещенный 1-С 4-алкилом или галогеном или 1,2,3,4-тетрагидро-2,4-диоксо-3-хиназолинил,или их солей, или их стереоизомеров, заключающийся в том, что соединение формулы,гдеимеет вышеуказанные значения, а- атом галогена или сульфонилоксигруппа, в инертном растворителе, и, при необходимости, в присутствии основания и/или соли йода, и выделяют целевой продукт в свободном виде или в виде терапевтически активной нетоксичной соли обработкой основания соответствующей кислотой или, обратно, превращают соль в свободное основание обработкой щелочью, и/или соединение формулы , содержащее функциональную гидроксигруппу, может быть О-алкилировано действием соответствующего алкилирующего агента в присутствии основания и растворителя, или соединение формулы , несущее защитное диоксалановое кольцо, может быть деацетилировано до соответствующих оксо-соединений действием кислой водной среды, или соединение формулы , содержащее в качестве заместителя -группу,может быть превращено в соответствующий амин действием водорода в присутствии соответствующего катализатора, при необходимости, в присутствии основания, или соединение формулы , содержащее аминогруппу, может быть алкилировано действием соответствующего алкилирующего агента, или соединение формулы , содержащее аминогруппу, может быть получено путем обработки карбамата основанием, или соединение формулы , содержащее эфирную группу, может быть превращено в соответствующую карбоновую кислоту обработкой водным раствором щелочи или кислоты. 2. Производные -(4-пиперидинил)(дигидробензофуран или дигидро-2-бензопиран)карбоксиамида общей формулы- радикал формулы (в-1), где 4 - водород, циано, 3-С 6-циклоалкил, арил, диарилметил или Не, или- радикал формулы (в-2), где Х является О или , 5 - водород, 1-С 4-алкил, 3-С 6-циклоалкил, арил или Не, или- радикал формулы (в-3), где- 8 или прямая связь, 8 - водород или арил и 7 - водород, 1-С 4 алкил, арил, 1-С 4-алкилокси или гидрокси. 5. Соединения по п. 2, где А - радикал формулы (а-1) или (а-2), где атом углерода, находящийся рядом с атомом кислорода при необходимости замещен одним или двумя 1-С 4-алкильными заместителями. 6. Соединение по п. 4, где- 3-С 5-циклоалкил, 3-С 6-алкенил, возможно замещенный арилом, или- радикал формулы (в-1), где А - 1-С 4-алкандиил и 4-циано, 3-С 6-циклоалкил, диарилметил или Не, или- радикал формулы (в-2), где А - 1-С 4-алкандиил, Х - О илии 5 - водород, 1-С 4-алкил, 3-С 6 циклоалкил, арил или Не, или- радикал формулы (в-3), где А - 1-С 4-алкандиил,-или прямая связь и 7 - 1-С 4-алкил, арил,1-С 4-алкилокси или гидрокси. 7. Соединение по п. 6, где Не- пиперидинил, пиридинил, при необходимости замещенный цианогруппой,пиразинил, при необходимости замещенный 1-С 4-алкилом, или- тетрагидрофуранил, 1,3-диоксоланил, замещенный 1-С 4-алкилом, или- 2,3-дигидро-2-оксо-1 Н-бензимидазолил, при необходимости замещенный 1-С 4-алкилом, 3,4 дигидро-1(2 Н)-бензопиранил, 2-оксо-1-имидазолидинил, замещенный 1-С 4-алкилом, 3,4-дигидро-4-оксо 1,2,3-бензотриазин-3-ил, замещенный тремя 1-С 4-алкилоксигруппами, 1-оксо-2(1 Н)-фталазинил, 1,6 дигидро-6-оксо-1-пиридазинил, замещенный 1-С 4-алкилом или галогеном, 1,2,3,4-тетрагидро-2,4-диоксо-32 4186 1 хиназолинил, 2,3-дигидро-5-оксо-5 Н-тиазол-3,2-а-пиримидин-6-ил, замещенный 1-С 4-алкилом, 5-оксо-5 Нтиазол-3,2-а-пиримидин-6-ил, замещенный 1-С 4-алкилом. 8. Соединение по п. 7, где- тетрагидрофуранил, 1,3-диоксоланил, при необходимости замещенный 1-С 4-алкилом, 3,4-дигидро-1(2 Н)-бензопиранил, пиперидинил, пиридинил, при необходимости замещенный цианогруппой, пиразинил, при необходимости замещенный 1-С 4-алкилом, индолил, 2,3-дигидро-2-оксо-1 Нбензимидазолил, при необходимости замещенный 1-С 4-алкилом, 2-оксо-1-имидазолидинил, замещенный 1-С 4-алкилом, 3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-ил, замещенный тремя 1-С 4-алкилоксигруппами, 1 оксо-2(1 Н)-фталазинил, 2,3-дигидро-5-оксо-5 Н-тиазол 3,2-а-пиримидин-6-ил, замещенный 1-С 4-алкилом,5-оксо-5 Н-тиазол 3,2-а-пиримидин-6-ил, замещенный 1-С 4-алкилом, 1,6-дигидро-6-оксо-1-пиридазинил,замещенный 1-С 4-алкилом или галогеном и 1,2,3,4-тетрагидро-2,4-диоксо-3-хиназолинил. 9. Соединение по п. 7,где 1 - водород или хлор,2 - водород, амино или (1-метилэтил)амино,3 - водород, и- радикал формулы (в-1), где 4 - циано, циклопентил, тетрагидрофуранил, пиперидинил, 7-метил-5 оксо-5 Н-тиазол 3,2-а-пиримидин-6-ил, 3-этил-2,3-дигидро-2-оксо-1 Н-бензимидазолил, 1,6-дигидро-3-метил 6-оксо-1-пиридазинил, или- радикал формулы (в-2), где Х - О илии- водород или 4-фторфенил, или- радикал формулы (в-3), где-или прямая связь и 7 - метил, этокси или 3,4,5-триметоксифенил. 10. Соединение по п. 2, выбранное из группы, состоящей из 5-амино-6-хлор-3,4-дигидро 1(тетрагидро-2-фуранил)метил-4-пиперидинил-2 Н-1-бензопиран-8-карбоксиамида,(-)5-мино-6-л-3,4-дигидро 1-(ттгид-2-фуранил)метил-4-пиперидинил-2 Н-1 бензопиран-8-карбоксиамида,4-амино-5-хлор-2,3-дигидро 1-(тетрагидро-2-фуранил)метил-4-пиперидинил-7 бензофуранкарбоксимида,(-)4-амино-5-хлор-2,3-дигидро 1(тетрагидро-2-фуранил)метил-4-пиперидинил-7 бензофуранкарбоксиамида,4-амино-5-хлор-2,3-дигидро 1-(тетрагидро-2-фуранил)метил-4-пиперидинил-7 бензофуранкарбоксиамида,этил 2-4-(5-амино-6-хлор-3,4-дигидро-2 Н-1-бензопиран-8-ил)карбониламино-1 пиперидинилэтилкарбамата,5-амино-6-хлор 1-4-(3-этил-2,3-дигидро-2-оксо-1 Н-бензимидазол-1-ил)бутил-4-пиперидинил-3,4 дигидро-2 Н-1-бензопиран-8-карбоксиамида,этил-4-(5-амино-6-хлор-3,4-дигид-2-1-бнзопиран-8-ил)карбониламино-1-пиперидинбутаноата,5-амино-6-хлор-3,4-дигидро 1-(4-оксопентил)-4-пиперидинил-2 Н-1-бензопиран-8-карбоксиамида, и 4-амино-5-хлор-2,3-дигидро-2,2-диметил 1-(4-оксопентил)-4-пиперидинил-7 бензофуранкарбоксиамида,или их стереоизомеры или их фармацевтически приемлемые кислотно-аддитивные соли. 11. Фармацевтическая композиция, стимулирующая работу гастрокишечной системы, содержащая активный ингредиент и инертный носитель, отличающаяся тем, что в качестве активного ингредиента она содержит соединение по любому из пп. 2-10 в количестве 5-20 мг на дозированную единицу. 12. Соединения формулы,где 1, 2, 3 и А имеют указанные в п. 1 значения, в качестве промежуточных продуктов для получения производных -(4-пиперидинил)(дигидробензофуран или дигидро-2 Н-бензопиран)карбоксиамида, обладающих действием, стимулирующим гастрокишечную систему. 4186 1 Настоящее изобретение касается производных -(-4-пиперидинил)(дигидробензофуран или дигидро-2 Нбензопиран)карбоксиамида, обладающих способностью стимулировать гастрокишечную систему, также изобретение касается способов получения этих соединений и фармацевтических композиций на их основе. Известен ряд производных замещенного (3-гидрокси-4-пиперидинил)бензамида как стимуляторов активности гастрокишечных систем ЕР-А-0,076,530, ЕР-А-0,299,566 и 0,309,043. В 0,307,172, -0,124,783, ДЕ-3,702,005, 0,147,044, 0,234,872 и -4,772,459. Также известны производные бензофурана, бензопирана и бензоксипина, в которых атом азота может быть замещенным алкиламино группой или моно- или бициклическим гетерокольцом в алкильной цепочке (0,234,872, -4772459). Эти соединения предназначены для использования в качестве антирвотных, антипсихических или нейролептических веществ. 84 03 281 описывает -азабициклоалкилбензамиды и анилиды, используемые в качестве соперников допаминов, понижающих давление или успокаивающих активаторов. 88 01 866 описывает -гетероциклилбензогетероциклические амиды, используемые как антирвотные вещества при химиотерапии раковых заболеваний. Производные -(4-пиперидинил)(дигидробензофуран или дигидро-2 Н-бензопиран)карбоксиамида настоящего изобретения отличаются структурно и фармакологически благодаря своей возможности активно стимулировать гастрокишечную систему. Объектом настоящего изобретения является способ получения производных -(4-пиперидинил)(дигидробензофуран или дигидро-2 Н-бензопиран)карбоксиамида формулы-СН 2-СН 2-СН 2-СН 2(а-3),в которых один или два атома водорода могут быть замещены 1-С 6-алкилом 1 - водород или галоген 2 - водород, амино- или моно(1-С 6-алкил)аминогруппы 3 - водород или 1-С 6-алкил- 3-С 6-циклоалкил, 3-С 6-алкенил, при необходимости замещенный арилом, или радикал формулы(-3),в которых каждый- 1-С 6-алкандиил и 4 - водород, циано-группа, 3-С 6-циклоалкил, арил, диарилметил или 5 - водород, 1-С 6-алкил, гидрокси 1-С 6-алкил, 3-С 6 циклоалкил, арил или-или 7 - водород, 1-С 6-алкил, арил, 1-С 6-алкилокси- или гидроксигруппа- 8, или прямая связь, где 8 - водород или арил каждый арил - фенил, незамещенный или замещенный 1-3 заместителями, каждый из которых выбран из галогена или 1-С 6-алкилоксигруппы, каждый тетрагидрофуранил, 1,3-диоксоланил, замещенный 1-С 4-алкилом 3,4-дигидро-1(2 Н)-бензопиранил пиперидинил пиридинил, при необходимости замещенный цианогруппой пиразинил, замещенный 1-С 4 алкилом индолил 2,3-дигидро-2-оксо-1 Н-бензимидазолил, при необходимости замещенный 1-С 4-алкилом 2-оксо-1-имидазолидинил, замещенный 1-С 4-алкилом 3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-ил, замещенный тремя 1-С 4-алкилоксигруппами 1-окси-2(1 Н)-фталазинил 2,3-дигидро-5-оксо-5 Н-тиазол 3,2 пиримидин-6-ил, замещенный 1-С 4-алкилом 5-оксо-5 Н-тиазол 3,2-пиримидин-6-ил, замещенный 1-С 4 алкилом 1,6-дигидро-6-оксо-1-пиридазинил, замещенный 1-С 4-алкилом или галогеном или 1,2,3,4 тетрагидро-2,4-диоксо-3-хиназолинил, или их солей, или их стереоизомеров, заключающийся в том, что соединение формулы,где 1, 2, 3 и А имеют вышеуказанные значения,подвергают -алкилированию действием соединения формулы 4,гдеимеет вышеуказанные значения, а- атом галогена или сульфонилоксигруппа,в инертном растворителе, и, в случае необходимости, в присутствии основания и/или соли йода, и выделяют целевой продукт в свободном виде или в виде терапевтически активной нетоксичной соли обработкой основания соответствующей кислотой или, обратно, превращают соль в свободное основание обработкой щелочью, и/или соединение формулы , содержащее функциональную гидроксигруппу, может быть Оалкилировано действием соответствующего алкилирующего агента в присутствии основания и растворителя,или соединение формулы , несущее защитное диоксалановое кольцо, может быть деацетилировано до соответствующих оксо-соединений действием кислой водной среды, или соединение формулы , содержащее в качестве заместителя группу, может быть превращено в соответствующий амин действием водорода в присутствии соответствующего катализатора, при необходимости, в присутствии основания, или соединение формулы , содержащее аминогруппу, может быть алкилировано действием соответствующего алкилирующего агента, или соединение формулы , содержащее аминогруппы, может быть получено путем обработки карбамата основанием, или соединение формулы , содержащее эфирную группу, может быть превращено в соответствующую карбоновую кислоту обработкой водным раствором щелочи или кислоты. Другим объектом изобретения являются производные -(4-пиперидинил)(дигидробензофуран или дигидро-2-бензопиран)карбоксиамида общей формулы где , , 1, 2 и 3 имеют указанные выше значения, обладающие действием, стимулирующим гастрокишечную систему. В предпочтительном варианте 1 - водород или галоген, 2- водород, амино или 1-С 6-алкиламино, и 3 водород- 3-С 6-циклоалкил или 3-С 6-алкенил, возможно замещенный арилом, или- радикал формулы(в-1), где 4 - водород, циано, 3-С 6-циклоалкил, арил, диарилметил или Не, или- радикал формулы (в-2), где Х является О или , 5 - водород, 1-С 4-алкил, 3-С 6-циклоалкил, арил или Не, или- радикал формулы (в-3), где- 8 или прямая связь, 8 - водород или арил и 7 - водород, 1-С 4 алкил, арил, 1-С 4-алкилокси или гидрокси А - радикал формулы (а-1) или (а-2), где атом углерода, находящийся рядом с атомом кислорода при необходимости замещен одним или двумя 1-4-алкильными заместителями. В одном из вариантов- 3-С 5-циклоалкил, 3-С 6-алкенил, возможно замещенный арилом, или- радикал формулы (в-1), где А - 1-С 4-алкандиил и 4-циано, 3-С 6-циклоалкил, диарилметил или Не, или- радикал формулы (в-2), где А - 1-С 4-алкандиил, Х - О илии 5 - водород, 1-С 4-алкил, 3-6 циклоалкил, арил или Не, или- радикал формулы (в-3), где А - 1-С 4-алкандиил,-или прямая связь и 7 - 1-С 4-алкил, арил,1-С 4-алкилокси или гидрокси. Предпочтительно Не - пиперидинил, пиридинил, при необходимости замещенный цианогруппой, пиразинил, при необходимости замещенный 1-С 4-алкилом, или- тетрагидрофуранил, 1,3-диоксоланил, замещенный 1-С 4-алкилом, или- 2,3-дигидро-2-оксо-1 Н-бензимидазолил, при необходимости замещенный 1-С 4-алкилом, 3,4 дигидро-1(2 Н)-бензопиранил, 2-оксо-1-имидазолидинил, замещенный 1-С 4-алкилом, 3,4-дигидро-4-оксо 1,2,3-бензотриазин-3-ил, замещенный тремя 1-С 4-алкилоксигруппами, 1-оксо-2(1 Н)-фталазинил, 1,6 дигидро-6-оксо-1-пиридазинил, замещенный 1-С 4-алкилом или галогеном, 1,2,3,4-тетрагидро-2,4-диоксо-3 хиназолинил, 2,3-дигидро-5-оксо-5 Н-тиазол-3,2-а-пиримидин-6-ил, замещенный 1-С 4-алкилом, 5-оксо-5 Нтиазол-3,2-а-пиримидин-6-ил, замещенный 1-С 4-алкилом. В одном из вариантов- тетрагидрофуранил, 1,3-диоксоланил, при необходимости замещенный 1-С 4 алкилом, 3,4-дигидро-1(2 Н)-бензопиранил, пиперидинил, пиридинил, при необходимости замещенный цианогруппой, пиразинил, при необходимости замещенный 1-С 4-алкилом-алкилом, индолил, 2,3-дигидро-2 оксо-1 Н-бензимидазолил,при необходимости замещенный 1-С 4-алкилом-алкилом,2-оксо-1 имидазолидинил, замещенный 1-С 4-алкилом, 3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-ил, замещенный тремя 1-С 4-алкилом алкилоксигруппами, 1-оксо-2(1 Н)-фталазинил, 2,3-дигидро-5-оксо-5 Н-тиазоло 3,2-апиримидин-6-ил, замещенный 1-С 4-алкилом, 5-оксо-5 Н-тиазол 3,2-а-пиримидин-6-ил, замещенный 1-С 4 алкилом, 1,6-дигидро-6-оксо-1-пиридазинил, замещенный 1-С 4-алкилом или галогеном и 1,2,3,4 тетрагидро-2,4-диоксо-3-хиназолинил 1 - водород или хлор 5 4186 1 2 - водород, амино или (1-метилэтил)амино,3 - водород, и- радикал формулы (в-1), где 4 - циано, циклопентил, тетрагидрофуранил, пиперидинил, 7-метил-5 оксо-5 Н-тиазоло 3,2-а-пиримидин-6-ил, 3-этил-2,3-дигидро-2-оксо-1 Н-бензимидазолил, 1,6-дигидро-3-метил-6-оксо 1-пиридазинил, или- радикал формулы (в-2), где Х - О илии- водород или 4-фторфенил, или- радикал формулы (в-3), где-или прямая связь и- метил, этокси или 3,4,5-триметоксифенил. Наиболее предпочтительным соединением по изобретению является 5-амино-6-хлор-3,4-дигидро 1-(тетрагидро-2-фуранил)метил-4-пиперидинил-2 Н-1-бензопиран-8 карбоксиамид,(-)5-мино-6-л-3,4-дигидро 1-(ттгид-2-фуранил)метил-4-пиперидинил-2 Н-1 бензопиран-8-карбоксиамид,4-амино-5-хлор-2,3-дигидро 1-(тетрагидро-2-фуранил)метил-4-пиперидинил-7 бензофуранкарбоксимид,(-)4-амино-5-хлор-2,3-дигидро 1(тетрагидро-2-фуранил)метил-4-пиперидинил-7 бензофуранкарбоксиамид,4-амино-5-хлор-2,3-дигидро 1-(тетрагидро-2-фуранил)метил-4-пиперидинил-7 бензофуранкарбоксиамид,этил 2-4-(5-амино-6-хлоро-3,4-дигидро-2 Н-1-бензопиран-8-ил)карбониламино-1 пиперидинилэтилкарбамат,5-амино-6-хлор 1-4-(3-этил-2,3-дигидро-2-оксо-1 Н-бензимидазол-1-ил)бутил-4-пиперидинил-3,4 дигидро-2 Н-1-бензопиран-8-карбоксиамида,этил-4-(5-амино-6-хлоро-3,4-дигид-2-1-бнзопиран-8-ил)карбониламино-1-пиперидинбутаноата,5-амино-6-хлор-3,4-дигидро 1-(4-оксопентил)-4-пиперидинил-2 Н-1-бензопиран-8-карбоксиамида и 4-амино-5-хлор-2,3-дигидро-2,2-диметил 1-(4-оксопентил)-4-пиперидинил-7 бензофуранкарбоксиамид, или их стереоизомеры или их фармацевтически приемлемые кислотноаддитивные соли. Еще одним объектом изобретения является фармацевтическая композиция, стимулирующая работу гастрокишечной системы, содержащая активный ингредиент и инертный носитель. В качестве активного ингредиента она содержит соединение по изобретению в количестве 5-20 мг на дозированную единицу. Еще одним объектом изобретения являются соединения формулы,где 1, 2, 3 и А имеют вышеуказанные значения, в качестве промежуточных продуктов для получения производных -(4-пиперидинил)(дигидробензофуран или дигидро-2 Н-бензопиран)карбоксиамида, обладающих действием, стимулирующим гастрокишечную систему. Как указано выше галоген представляет собой фтор, хлор, бром и йод заместители. С 1-С 4-алкил представляет прямую или разветвленную цепочку, замещенную углеводородными радикалами, имеющими от 1 до 6 атомов углерода, например, метил, этил, пропил, бутил, гексил, 1-метилэтил, 2-метилпропил и др. С 3-С 6 циклоалкил представляет циклопропил, циклобутил, циклопентил и циклогексил. С 3-С 6-алкенил представляет прямую или разветвленную цепочку углеводородных радикалов, содержащих одну двойную связь и имеющих от 3 до 6 атомов углерода, например, 2-пропенил, 3-бутенил, 2-бутенил, 2-пентенил, 3-пентенил, 3 метил-2-бутенил и др. Когда С 3-С 6-алкенил заменяется на гетероатом, тогда атом углерода в С 3-С 6-алкениле присоединяется к гетероатому. С 1-С 6-алкендиниил представляет собой прямую или разветвленную цепочку с двойной связью углеводородных радикалов и содержащую от 1 до 6 атомов углерода, например, 1,2 этандиил, 1,3-пропендиил, 1,4-бутандиил, 1,5-пентандиил, 1,6-гександиил и разветвленные изомеры. Соли, которые могут образовывать соединения формулыпредназначены для получения терапевтически активных нетоксичных солевых добавок. Они могут быть получены традиционным способом, путем воздействия на соответствующее основания неорганических кислот (соляной, бромистоводородной, серной,азотной, фосфорной и др.) или органических кислот (уксусной, пропановой, 2-гидрокси-пропановой, гидроксиуксусной, 2-гидроксипропановой, 2-оксопропановой, этандиоловой, пропандиоловой, бутандиоловой, //2-бутендиоловой, (Е)-2-бутендиоловой, 2-гидроксибутандиоловой, 2,3-гидроксибутандиоловой, 2-гидрокси 1,2,3-пропантрикарбоксильной, метансульфоновой, этансульфоновой, бензолсульфоновой, 4-метилбензосульфоновой, циклогексансульфоминной, 2-гидроксибензойной, 4-амино-2-гидроксибензойной и др.). При воздействии щелочей на соли могут быть получены основания. 4186 1 Соединения формулы , содержащие протонные кислоты, могут быть также превращены действием органических или неорганических оснований, в терапевтически активные нетоксичные соли металлов или аминосодержащие соли. 7 может быть гидрокси, и в этом случаев радикале (в-3) имеет прямую связь.-оксиды соединений формулыпредназначены для получения таких соединений формулы , где один или несколько атомов азота окисляются до -оксидных форм. В соединениях формулы , где 4 и 5 представляет собой , последний может быть частично или полностью насыщенным или ненасыщенным. Когда в формуле , гдечастично насыщен или ненасыщен, он замещается на гидрокси, меркапто или амино, то могут также существовать и их таутомерные формы. В частностиможет быть 1) избирательно замещенным 5- или 6-членным гетероциклом, содержащим 1,2,3 или 4 гетероатома, не связанных с кислородом, серой и азотом, чтобы не присутствовало более 2-х атомов кислорода и/или серы,или мов кислорода и/или серы, или 2) избирательно замещенным 5- или 6-членным гетероциклом, содержащим 1,2 или 3 гетероатома, не связанных с кислородом, серой или азотом, чтобы при соединении с избирательно замещенным 5- или 6 членным кольцом через 2 атома углерода или один атом углерода и один атом азота, имел в соединенном кольце только один атом углерода, или 3) избирательно замещенный 5- или 6-членный гетероцикл, содержащий 1,2 или 3 гетероатома, не связанных с кислородом серой или азотом, чтобы при соединении с избирательно замещенным 5- или 6 членным гетероциклом через 2 атома углерода или 1 атом углерода или 1 атом азота имел в соединенном кольце 1 или 2 гетероатома, не связанных с кислородом, серой или азотом, гдеможет быть моноциклическим кольцом, избирательно замещенным и иметь до 4-х заместителей, и где , являясь бициклической системой, может быть избирательно замещенным и иметь до 6-заместителей (заместители те же, что указаны выше). Особенностью подгруппыявляется то, что она в своем составе имеет циклический эфир или кольцо тиоэфира, содержащих один или два атома кислорода и/или атома серы, поэтому, когда эти атомы присутствуют, они не занимают смежных позиций. Циклический эфир или кольцо тиоэфира могут взаимодействовать с 5- или 6-членным карбоциклическим кольцом. Циклический эфир или кольцо тиоэфира могут быть замещены одним или более С 1-С 6-алкилом, С 1-С 6-алкилокси, С 1-С 6-алкилокси С 1-С 6-алкилом или гидрокси С 1-С 6 алкилом. Эти радикалы подгруппыобозначены как 1. Типичные циклические эфиры и тиоэфиры радикала 4 представляяв соединениях данного изобретения, могут быть представлены следующими формулами, где каждый Х 1 и Х 2 независимо являются О или 1 или 2 каждый 11 - водород, С 1-С 4-алкил, С 1-С 4-алкилоксиС 1-С 4-алкил или гидрокси С 1-С 4-алкил и 12 - водород, гало или С 1-С 4-алкил. Особенностью циклических эфиров является то, что они отделены от групп, состоящих из 1,3 диоксоланила, избирательно замещенного С 1-С 4-алкилом, 1,3-диоксанила, избирательно замещенным С 1-С 4 алкилом тетрагидрофуранила, избирательно замещенным С 1-С 4-алкилом, тетрагидропиранила, избирательно замещенным С 1-С 4-алкилом, 2,3-дигидро-1,4-бензодиоксинила, 2,3-дигидробензофурана и 3,4-дигидро 1(2 Н)бензопиранила, с тетрагидрофуранилом предпочтительнее. Другой особенностью группыявляется то, что она может содержать гетероциклические кольца, которые не связаны с группами, состоящими из пирролидинила, пиперидинила, пиридинила, избирательно заме 7 4186 1 щенных 1 или 2-мя заместителями, каждый из которых не связан с гало, гидрокси, циано, С 1-С 6-алкилом,трифторметилом, С 1-С 6-алкилокси, аминокарбонилом, моно и ди/С 1-С 6-алкил/аминокарбонилом, амино, и моно и ди/С 1-С 6/алкил/амино и С 1-С 6-алкилоксикарбонилом пиримидинилом, избирательно замещенного 1 или 2-мя заместителями, каждый из которых не связан с гало, гидрокси, циано, С 1-С 6-алкилом, С 1-С 6 алкилокси, амино и моно и ди/С 1-С 6-алкил/амино пиридазинилом, избирательно замещенным с С 1-С 6 алкилом или гало пиразинилом, избирательно замещенным 1 или 2-мя заместителями, каждый из которых не связан с гало, гидрокси, циано, С 1-С 6-алкилом, С 1-С 6-алкилокси, амино моно- и ди/С 1-С 6-алкил/амино и С 1-С 6-алкилоксакарбонилом пирролилом, избирательно замещенного С 1-С 6-алкилом пиразолилом, избирательно замещенного С 1-С 6-алкилом имидазозолилом, избирательно замещенного С 1-С 6-алкилом, триазолилом, избирательно замещенного С 1-С 6-алкилом охинолинилом, избирательно замещенного двумя заместителями, каждый из которых не связан гало, гидрокси, циано, С 1-С 6-алкилом С 1-С 6-алкилокси амино моно и ди/С 1-С 6-алкил/амино и трифторметилом изохинолинилом, избирательно замещенного 2-мя заместителями,каждый из которых не связан с гало, гидрокси, циано, С 1-С 6-алкилом С 1-С 6-алкилокси амино, моно и ди/С 1 С 6-алкил/амино и трифторметилом хиноксалинилом, избирательно замещенного двумя заместителями, каждый из которых не связан с С 1-С 6-алкилом, гидрокси, гало, циано и С 1-С 6-алкилокси хиназолинилом, избирательно замещенного С 1-С 6-алкилом бензимидозалилом, избирательно замещенного С 1-С 6-алкилом индолилом, избирательно замещенного С 1-С 6-алкилом 5,6,7,8-тетрагидрохинолинилом, избирательно замещенного двумя заместителями, не связанными с гало, гидрокси, циано С 1-С 6-алкилом С 1-С 6-алкилокси амино-, моно- и ди/С 1-С 6-алкил/амино и трифторметилом 5,6,7,8-тетрагидрохиноксалинилом, избирательно замещенного двумя заместителями, каждый из которых не связан с С 1-С 6-алкилом, гидрокси, гало, циано и С 1-С 6-алкилокси тиазолилом, избирательно замещенного С 1-С 6-алкилом оксазолилом, избирательно замещенного С 1-С 6-алкилом бензоксазрилом, избирательно замещенного С 1-С 6-алкилом, бензотиазолилом, избирательно замещенного С 1-С 6-алкилом. Эта подгруппарадикалов обозначена Не 2. Следующей особенностью гетероциклов, в составе этой подгруппы, является то, что они содержат пиперидинил, пиридинил, избирательно замещенный двумя заместителями, не связанными с С 1-С 4-алкилом, циано, гало и трифторметилом, пиразинилом, избирательно замещенного циано, гало, С 1-С 4-алкилоксикарбонилом и С 1-С 4-алкилом, и пиридазинилом, избирательно замещенного гало. Существенной особенностью подгруппыявляется то, что она содержит 5- или 6-членные циклические амиды, содержащие 1, 2 или 3 атома азота. Этот гетероцикл, совмещенный с 5- или 6-членным карбоциклом или гетероциклом, содержащим один или два атома азота или один атом серы или кислорода. Эта подгруппаобозначена символом 3. Типичные моноциклические амиды в 4 и 5, входящие в состав , в соединениях данного изобретения могут быть представлены следующими формулами, где Х 3 представляет О или 13 - водород, С 1-С 6-алкил или арилС 1-С 6-алкил,14 - водород, гало, С 1-С 6-алкил или арил,1 - -СН 2-СН 2-, -СНСН-, , -С(О)-СН 2- или -СН 2-СН 2-СН 2-,где один или два атома водорода, каждый независимо, могут быть замещены С 1-С 6-алкилом и 2 представляет собой -2-2-2-(13)- или -СН 2-СН 2-СН 2-,где один или два атома водорода могут быть замещены С 1-С 6-алкилом. Типичные бициклические амиды в 4 и 5, входящие в состав , могут быть представлены следующими формулами где Х 4 и Х 5, каждый независимо, представляет О иликаждый 15 независимо представляет водород, С 1-С 6-алкил или арилС 1-С 6-алкил,каждый 16 независимо представляет водород, гало, С 1-С 6-алкил или С 1-С 6-алкилокси,17 представляет водород, гало, С 1-С 6-алкил или арил, и каждый 18 независимо представляет водород,С 1-С 6-алкилокси или С 1-С 6-алкил, где радикалы (-5), (-6), (-7) и (-8) могут быть присоединены к соответствующемуили Х посредством замещения либо водорода, либо радикалов 15 и 16, 3 представляет СНСН-СНСН- -/СН 2/4-, /2/3-, , -СНСН-О-, -(2)2-, -Н-(СН 2)3-, , 2-, или ,4 представляет -СНСН-СНСН-, -СНСС-СНСН-, СССН-СНСН-, , , , , или . Следующей особенностью гетероциклов в этой подгруппе является то, что они отделены от групп, состоящих из 2,3-дигидро-2-оксо-1 Н-бензимидазолила, избирательно замещенного С 1-С 6-алкилом, 2-оксо-1 имидазолидинилом, избирательно замещенного С 1-С 4-алкилом, 2,5-диоксо-1-имидазолидинила, избирательно замещенного С 1-С 4-алкилом, 3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-ила, избирательно замещенного 1,2 или 3 С 1-С 4-алкилоксигруппами, 1-оксо-2(1 Н)-фталазинилом, 2,3-дигидро-5-оксо-5 Н-тиазоло (3,2 а)пиримидин-6-ила, избирательно замещенного С 1-С 4-алкилом, 5-оксо-5 Н-тиазоло(3,2-а)пиримидин-6-ила,избирательно замещенного С 1-С 4-алкилом, 1,6-дигидро-6-оксо-1-пирадазинилом, избирательно замещенного С 1-С 4-алкилом или гало, и 1,2,3,4-тетрагидро-2,4-диоксо-3-хиназолинила. Представляют интерес те соединения формулы , где 1 является водородом или гало и/или 2 является водородом, амино или С 1-С 6-алкиламино, и/или 3 является водородом. Представляют интерес также соединения формулыте, где 1 является водородом или гало, и/или 2 является водородом, амином или С 1-С 6-алкиламино, и/или 3 является С 1-С 4-алкилом. Не менее интересными соединениями являются те, гдеявляется С 3-С 6-циклоалкилом или С 3-С 6 циклоалкилом, избирательно замещенным арилом, илиявляется радикалом формулу (в-1), где 4 является водородом, циано, С 3-С 6-циклоалкилом, арилом, ди(арил)метилом или , илиявляется радикалом формулы (в-2), где Х является О,илии 5 является водородом, С 1-С 4 алкилом, С 3-С 6-циклоалкилом, арилом или , илиявляется радикалом формулы (в-3), гдеявляется 8 или прямой связью, 8 является водородом или арилом и 7 является водородом, С 1-С 4-алкилом, арилом, С 1-С 4-алкилокси или гидрокси. Наиболее интересными соединениями являются те, где А является радикалом формулы (а-1) или (а-2),где атом углерода примыкает к атому кислорода и является избирательно замещенным одним или двумя С 1 С 4-алкильными заместителями. Наиболее предпочтительными из указанных выше соединений являются те, гдепредставляет собой С 5 С 6-циклоалкил или С 3-С 6-алкенил, избирательно замещенный арилом, илиявляется радикалом формулы (в-1), гдеявляется С 1-С 4-алкандиилом и 4 является циано, С 3-С 6 циклоалкилом, диарилметилом или ,илиявляется радикалом формулы (в-2), гдеявляется С 1-С 4-алкандиилом, Х является О илии 5 является водородом, С 1-С 4-алкилом, С 3-С 6-циклоалкилом, арилом или ,илиявляется радикалом формулы (в-3), гдеявляется С 1-С 4-алкандиилом,являетсяили прямой связью и 7 является С 1-С 4-алкилом, арилом, С 1-С 4-алкилокси или гидрокси. Предпочтительными являются также те соединения, где- является пирролидинилом, пиперидинилом,пиридинилом, избирательно замененного С 1-С 6-алкилом или циано, пиразинилом, избирательно замещенного С 1-С 6-алкилом, бензимидазолилом, избирательно замещенного С 1-С 6-алкилом, или индолилом, избирательно замещенного С 1-С 6-алкилом, или 9 4186 1 является радикалом формулы (с-1), (с-2) или (с-4), илиявляется радикалом формулы (-1), (-3),(-5), (-8), (-9), (-12) или (-13). Особенно предпочтительными являются те соединения, гдеявляется тетрагидрофуранилом, избирательно замещенного С 1-С 4-алкилом, 1,3-диоксаланилом, избирательно замещенного С 1-С 4-алкилом, 1,3 диоксаланилом, избирательно замещенного С 1-С 4-алкилом, 3,4-дигидро-1(2 Н)-бензопиранилом, пирролидинилом, пиперидинилом, пиридинилом, избирательно замещенного циано, пиразинилом, избирательно замещенного С 1-С 4-алкилом, бензимидазолилом, индолилом, 2,3-дигидро-2-оксо-1 Н-бензимидазилилом, избирательно замещенного С 1-С 4-алкилом, 2-оксо-1-имидазолидинилом, избирательно замещенного С 1-С 4-алкилом,3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-илом, избирательно замещенного тремя С 1-С 4-алкилоксигруппами,1-оксо-2(1 Н)фталазинилом, 2,3-дигидро-5-оксо-5 Н-тиазоло-(3,2-а)пиримидин-6-илом, избирательно замещенного С 1-С 4-алкилом, 5-оксо-5 Н-тиазоло-(3,2-а)пиримидин-6-илом, избирательно замещенного С 1-С 4 алкилом, 1,6-дигидро-6-оксо-1-пиридазинилом, избирательно замещенного С 1-С 4-алкилом или гало, и 1,2,3,4-тетрагидро-2,4-диоксо-3-хиназолинилом. Наиболее предпочтительными являются соединения, где 1 является водородом или хлором, и/или 2 является водородом, амино или (1-метилэтил)амино, и/или 3 является водородом, и/илиявляется радикалом формулы (в 1), где 4 является циано, циклопентилом, тетрагидрофуранилом, пиперидинилом, 7-метил-5-оксо-5 Н-тиазоло/3,2 а/пиримидин-5-илом, 3-этил-2,3-дигидро-2-оксо-1 Н-бензимидазолилом, 1,6-дигидро-3-метил-оксо-1-пиридазинилом, или- радикал формулы (в-2), где Х является О илии 5 является водородом или 4-фторфенилом, или- радикал формулы (в-3), гдеявляетсяили прямой связью и 7 является метило, этокси или 3,4,5 триметоксифенилом. Самым предпочтительными являются соединения 5-амино-6-хлоро-3,4-дигидро/1-/(тетрагидро-2-фуранил)метил/4-пиперидинил/-2 Н-1-бензопиран-8 карбоксамид,/-/-//-5-амино-6-хлоро-3,4-дигидро/1-/(тетрагидро-2-фуранил)метил/-4-пиперидинил/-2 Н-1-бензопиран 8-карбоксимамид,4-амино-5-хлоро-2,3-дигидро/1-/(тетрагидро-2-фуранил)метил/-пиперидинил/-7 бензофуранкарбоксиамид,/-/-//-4-амино-5-хлоро-2,3-дигидро/1-/(тетрагидро-2-фуранил)метил/-4-пиперидинил/-7 бензофуранкарбоксиамид,/-/-//-4-мин-5-л-2,3-дигиди/1-/(ттгид-2-фунил)мтил/-4-пиперидинил/-7 бензофуранкарбоксиамид,//-//-4-амино-5-хлоро-2,3-дигидро/1-/(тетрагидро-2-фуранил)метил/-4-пиперидинил/-7 бензофуранкарбоксиамид,этил/2-/4-//(5-амино-6-хлоро-3,4-дигидро-2 Н-1-бензопиран/8-ил)карбонил/амино/-1 пиперидинил/этил/карбамат,5-мино-6-лор/1-/4-(3-этил-2,3-дигидро-2 оксо-1 Н-бензимидазол-1-ил)бутил/-4-пиперидинил/-3,4 дигидро-2 Н-1-бензопиран-8-карбоксиамид,этил 4-//(5-амино-6-хлоро-3,4-дигидро-2 Н-1-бензопиран-8-ил/карбонил/амино/-1-пиперидинбутаноат,5-амино-6-хлоро-3,4-дигидро/1-(4-оксопентил/-4-пиперидинил/2 Н-1-бензопиран-8-карбоксиамид, и 4-амино-5-хлоро-2,3-дигидро-2,2-диметил/1-4-оксопентил)-4-пиперидинил/-7 бензофуранкарбоксиамид,стереоизомеры и фармацевтически подходящие кислые соли. Для упрощения представления соединений формулыи некоторых исходных и промежуточных материалах радикал формулы обозначен символом . Соединения формулымогут быть получены путем -алкилирования пиперидина формулыс промежуточным продуктом формулы 4186 1 в данной реакции и в следующих схемах реакций является остатком группы, например, гало, преимущественно, хлоро, бромо или йодо, или сульфонилоксигруппы, например, метансульфонилокси, 4 метилбензолсульфонилокси и др. остатки групп.-алкилированиеспроводится в инертных растворителях, например, вода, ароматические углеводороды бензол, метилбензол, диметилбензол, хлорбензол, метоксибензол и др., а также спирты, например,метанол, этанол, 1-бутанол и др. галогенпроизводные углеводородов, например, дихлорметан, трихлорметан и др., сложные эфиры, этилацетат, -бутиролактон и др. кетоны 2-пропанон, 4-метил-2-пентанон и др. Простые эфиры 1,4-диоксан, 1,1-оксибисэтан, тетрагидрофуран и др. Полярные растворители ,диметилформамид, ,-диметилацетамид, диметилсульфооксид, гексаметилфосфорный триамид, 1,3 диметил-3,4,5,6-тетрагидро-2/1 Н/-пиримидинон, 1,3-диметил-2-имидазолидинон, 1,1,3,3-тетраметилмочевина,нитробензол, 1-метил-2-пирролидинон и др., а также смеси этих растворителей. Введение соответствующих оснований, например, таких, как щелочи, карбонаты щелочноземельных металлов, гидрокарбонаты, карбоксилаты, амиды, оксиды, гидроксиды или алкоксиды, например, карбонат натрия, гидрокарбонат натрия, карбонат калия, окись кальция, ацетат натрия, амид натрия, гидроксид натрия,метоксид натрия и др., или органических оснований, например, амины, ,-диметил-4-пиридинамин, ,диэтилэтанамин, -(1-метилэтид)-2-пропанамин, 1,4-диазобицикло/2,2,2/октан, 4-этилморфолин и др., обеспечит нейтрализацию кислоты в процессе реакции. В некоторых случаях введение солей йодидов, преимущественно йодидов щелочных металлов или эфиров, как в примерах 1,4,7,10,13,16 гексаоксациклооктадеканов и др. может быть применено. Перемешивание и незначительное повышение температуры может увеличить скорость реакции. Дополнительно можно провести -алкилирование в инертной атмосфере (кислород-аргон или азот). Альтернативно -алкилирование может быть проведено в условиях перемешивания реагентов, с использованием оснований, соответствующей инертной атмосфере и в присутствии катализатора, например, триалкилфенилметиламмония, тетралкиламмония, тетраалкилфосфония,тетраарилфосфоний-галоида, гидроксида, гидросульфата и др. Продукты реакции могут быть изолированы от реакционной смеси, и, если необходимо, в дальнейшем очищены применением экстракции, дистилляции, растирания и хроматографии. Соединения формулымогут быть получены в результате реакции амидирования амина формулы карбоновой кислотой формулы или функциональными производными, такими как галоиды, симметричные или смешанные эфиры, предпочтительно реакционно-активные эфиры. Функциональные производные могут быть приготовлены известным способом, например, взаимодействием карбоксильной кислоты формулыс тионилхлоридом, фосфористым трихлоридом, фосфорным хлоридом и др., или взаимодействием карбоновой кислотыс ацетилхлоридом, этилкарбохлоридом и др. Продуктыимогут взаимодействовать в присутствии реагентов, образующих амиды, дициклогексилкарбодиимида, 2-хлоро-1-метилпиридиний йодида и др. Реакции могут быть завершены перемешиванием реагентов в инертных растворителях дихлорметане,трихлорметане, метилбензоле, 1,1-оксибисэтане, тетрагидрофуране, или в диполярных растворителях, ,диметилформамиле, ,-диметилацетамиде и др. Могут быть использованы основания, особенно третичные амины, например, ,-диэтилэтанамин. Вода, спирт или кислота могут быть удалены из реакционной смеси традиционными способами, например, азеотропной дистилляцией, комплексообразованием или солеобразованием. В дальнейшем может быть целесообразным блокировать амино или гидроксигруппы в процессе реакции. К таким блокирующим группам относятся С 1-С 6-алкилкарбонил, С 1-С 6-алкилоксикарбонил, арилметил, третичный бутил и др. Соединения формулыальтернативно могут быть получены проведением реакции -алкилирования с применением соответствующих кетонов или альдегидов формулы О- и когда -Н, то два двойных атома водорода в С 1-С 6-алкендииле или С 3-С 6-циклоалкендииле наполовину замещаются (О) с пиперидином формулы Проведение реакции -алкилирования может быть завершено смешением реагентов в инертных растворителях. Реакционная смесь может быть перемешана и/или подогрета для увеличения скорости реакции. Могут быть применены растворители вода, С 1-С 6-алканолы, сложные эфиры, простые эфиры, диполярные растворители, карбоновые кислоты или смесь таких растворителей. Термин известный процесс восстановления при -алкинировании означает, что реакция проводится в присутствии либо цианоборгидрида натрия, боргидрида натрия, муравьиной кислоты или ее солей и других ускоряющих агентов, либо в условиях воздействия атмосферы водорода, повышенной температуры и/или давления и наличия катализатора, например,палладия на угле, платана на угле и др. Чтобы предотвратить нежелаемую гидрогенизацию определенных функциональных групп реагентов и реакционных продуктов, можно добавить подходящий катализатор, например тиофен, хинолин, серу и др. В некоторых случаях целесообразно добавлять соли щелочных металлов, например фторид калия, ацетат калия и др. Соединения формулы , гдеявляется радикалом формулы (в-2) и 5 является арилом или , то 5,представленный 5-а, может альтернативно быть получен последующей реакцией алкилирования Ви 1 и 2 являются остатками групп гало, а именно хлоро или бромо, С 1-С 6-алкилокси или С 1-С 6-алкилтио (метокси или метилтио). 2 может быть также сульфонилоксигруппой или пиридиновой группой. Реакция алкилирования продуктас (1-в-2-а) всможет быть завершена в соответствии с известным процессом путем смешения реагентов без растворителей или в инертных органических растворителях, например в углеводородах (бензол, метилбензол, диметилбензол и др.), в низших спиртах (метанол, этанол, 1-бутанод) и др., в кетонах (2-пропанон, 4-метил-2-пентанон и др.), в эфирах(1,4-диоксан, 1,1-оксибисэтан, тетрагидрофуран и др.), в полярных растворителях (,-диметилформамил-диметилацетамид, диметилсульфоксид, нитробензол, 1-метил-2-пирролидинон и др.) или в смеси двух или более таких растворителей. Возможно введение соответствующих оснований, например щелочей или карбонатов щелочноземельных металлов, гидрокарбонатов, гидроксидов, адкоксидов, гидридов, амидов или оксидов (карбонат натрия, гидрокарбонат натрия, карбонат калия, гидроксид натрия, метоксид натрия, гидрид натрия, амид натрия, карбонат кальция, гидроксид кальция, оксид кальция и др.), или неорганические основания, например третичный амин (,-диэтилэтанамин, -/1-метилэтил/-2-пропанамин, 4 этилморфолин и др.), чтобы нужная кислота нейтрализовалась в процессе реакции. В некоторых случаях целесообразно применение солей йодидов, преимущественно йодидов щелочных металлов или эфиров(1,4,7,10,13,16-гексациклооктандеканы и др.). В соединениях формулы , гдеявляется радикалом формулы (в-4), соединение (1-в-4) может быть получено взаимодействием пиперидина формулыс амином формулы В 9 и 10 имеют те же обозначения как описано выше. 3 является соответствующим остатком группы, например гало (хлоро или бромо, гидрокси, С 1-С 6-алкилокси или С 1-С 6-алкилтио, т.е. метокси или метилтио). В соединениях формулы , гдеявляется радикалом формулы (в-4),является 8, соединение (1-в 4-а) может быть получено взаимодействием амида формулыс амином формулы . 4 является соответствующим остатком группы, например гидрокси, С 1-С 6-алкилокси(метокси). 12 Взаимодействиес , аспроводятся в реакционноинертных растворителях, например углеводородах (бензол, метилбензол), кетонах (ацетон), галогенированных углеводородах (дихлорметан,трихлорметан), эфира (1,1-оксибисэтан, тетрагидрофуран и др.), полярных растворителях (,диметилацетамид, ,-диметилформамид) или смесях этих растворителей. Соответствующие основания,например карбонаты щелочных металлов, гидрид натрия или органические основания, например ,диэтилэтанамин или -/1-метилэтил/-2-пропанамин могут быть использованы для нейтрализации кислоты в процессе реакции. Некоторое повышение температуры способствует повышению скорости реакции. В соединениях формулы , где- радикал формулы (а-3), аявляется 8, соединение формулы (1-в-3-а) может быть приготовлено взаимодействием карбоновой кислоты формулыили ее функциональных производных с амином формулы .. Взаимодействиес (Х) проводится аналогично описанному выше взаимодействиюс . В соединениях формулы , где- радикал формулы (в-1) и где 4 представляет собой циано, арил или, радикал 4-а и соединение (1-в-1) могут быть получены взаимодействием пиперидина формулыс алкеном формулыв инертных растворителях, например, ароматических углеводородах (бензол, метилбензол и др.), спиртах (метанол, этанол, 2-пропанол и др.), кетонах (2-пропанон и др.), эфирах (тетрагидрофуран и др.), или смесях этих растворителей. В соединениях формулы , где- радикал формулы (в-2) и где Х является О и 5 - водород или С 1-С 6 алкил в обозначенный как радикал 5-в, соединение (1-в-2-с) может быть получено взаимодействием пиперидина формулыс эпоксидом формулы. В процессе реакции может использоваться перемешивание, нагрев реагентов в инертных растворителях,например в воде, кетонах (2-пропанон, 4-метил-2-пентанон), эфирах (тетрагидрофуран, 1,1-оксибисэтан),спиртах (метанол, этанол, 1-бутанол диполярных растворителях) (,-диметилформамид, ,диметилацетамид и др.) или в смеси этих растворителей. Соединения формулымогут быть превращены в соединения с другими функциональными группами в соответствии с - . Несколько примеров таких процессов будут даны ниже. Соединения формулы , содержащие гидроксигруппы, могут быть О-алкилированы, согласно - , например, перемешиванием в присутствии соответствующих алкилирующих агентов, и, если нужно, в присутствии оснований и растворителей. Соединения формулы , содержащие блокирующее диоксалановое кольцо могут быть деацетилированы,чтобы получить оксо-соединения. Указанное деацетилирование может быть проведено известными методами, например взаимодействием исходных материалов в воднокислой среде. Соединения формулы , содержащие цианозаместители, могут быть превращены в соответствующие заместители аминов посредством перемешивания или, если нужно, нагревом исходных циано-соединений в водородной среде в присутствии катализатора, например платины на угле,никеля и в присутствии либо оснований, например, амин, т.е. (,-диэтилэтанамин и подобные или гидроксидов) гидроксид натрия и др. Подходящими растворителями являются также спирты (метанол, этанол и др.), эфиры (тетрагидрофуран и др.) или смеси таких растворителей. Соединения формулы , содержащие аминогруппы могут быть приготовлены обработкой карбоматов основаниями, например гидроксидами (гидроксид калия, гидроксид натрия и др.). Подходящими растворителями являются спирты (метанол, 2-пропанол и др.), эфиры (тетрагидрофуран и др.). Аминогруппы могут быть алкилированы в соответствии с - , например, алкилированием, восстановительным -алкилированием и др. методами, описанными выше. 4186 1 Соединения формулы , содержащие эфирные группы, могут быть превращены в карбоновые кислоты в соответствии с известными методами омыления, например обработкой исходных соединений водными растворами кислот или щелочей. Соединения формулы , где 1 - гало, могут быть превращены в соединения с 1-водород в соответствии с известными методами гидролиза, например перемешиванием или, если нужно, нагревом исходных соединений в инертных растворителях в присутствии водорода и катализатора (палладий на угле и др.). Соединения формулымогут быть превращены в соединения с -оксидными группами в соответствии с -путем перехода 3-х валентного азота в -оксид. Реакция ПП-окисления может быть проведена при взаимодействии исходных соединений формулыс соответствующими органическими или неорганическими перекисями (перекиси натрия, калия, бария, перекись бензокарбоновой кислоты, перекись 3-хлорбензокарбоновой кислоты, перекись уксусной кислоты, гидроперекись бутила и др.)-оксиление может проводиться в соответствующих растворителях воде, низших спиртах (метанол, этанол, бутанол, пропанол и др.), углеводородах (бензол, метилбензол, диметилбензол и др.), кетонах (2 пропано, 2-бутанол и др.), галогенированных углеводородах (дихлорметан, трихлорметан и др.) или смесях таких растворителей. Для увеличения скорости реакции можно использовать нагрев реакционной смеси. Некоторые из указанных выше промежуточных продуктов или исходных материалов являются уже известными, а некоторые новые. Они могут быть приготовлены в соответствии с известными методами. Некоторые из них описаны в ЕР-А-0,389,037. Методы приготовления некоторых промежуточных продуктов будут описаны ниже. Промежуточные продукты формулымогут быть получены из замещенного пиперидина формулы при взаимодействии с реагентом формулыили функциональными производными с последующей амидизацией, описанной для приготовления исходного продуктаизви последующим удалением группы Р 1 из продукта , полученного в соответствии с - , например проведением гидролиза в кислой или щелочной среде или каталитического гидрирования, в зависимости от природы Р 1 В реакцииси в последующих схемах реакций группа Р 1 удаляется при гидрировании или гидролизе. Предпочтительнее гидролизованные группы, например метилфенил, С 1-С 4-алкилоксикарбонил, этоксикарбонил, бензилоксикарбонил и др. Промежуточные продукты формулы , где 3-водород, представленной формулой (-а), могут быть альтернативно приготовлены взаимодействием изоцианата формулыс промежуточным продуктом формулыполучен продукт , где 3 - водород. Продукт представлен формулой (-). В формуле 5-щелочной метил (литий, натрий и др.) или галоген магния (хлорид или бромид магния). Реакция может быть проведена в инертных растворителях (тетрагидрофуран, 1,1-оксибисэтан, 1,2 диметоксиэтан, пентан, гексан и др.). Взаимодействие может быть проведено, как описано в 27, 1971 (1986) или в . ., 32, 1273 (1967). Полученный таким образом промежуточный продукт (-) может быть получен аналогично продукту формулы (-а), как описано выше. Промежуточный продукт формулыможет быть получен из замещенного пиперидина формулыалкилированием с реагентом -с последующим алкилированием, описанного для исходного продукта изии последующим удалением группы Р 1 из продукта . 4186 1 Карбоксильные кислоты формулымогут быть приготовлены из продукта формулыобработкой алкиллитием (бутиллитием, метиллитием и др.), щелочами металлов (лития, натрия и др.), переходных металлов (магния, цинка, кадмия и др.), амидов (амид натрия и др.), и последующей обработкой СО 2, или реагентом формулы 1-(О)-1, где 1 - остаток группы, например, С 1-С 6-алкилокси, гало и др. В формуле 6 - водород или остаток группы хлоро, бромо или йодо. Указанная реакция может быть проведена в инертных растворителях алифатических углеводородах(пентан, гексан, циклогексан и др.), ароматических (бензол, хлорбензол и др.), эфирах (тетрагидрофуран, 1,4 диоксан и др.) или смеси этих растворителей и избирательно в присутствии аминов (этанамин, ,диэтилэтанамин, -тетраметилэтилендиамин и др.). Промежуточные продукты формулы , где 6 - реактивный остаток группы и, обозначенный как 6-ав продукте (-), могут быть получены изпри галогенизации. Продуктможет быть галогенизирован дигалогенидами (хлор, бром и др.), избирательно в присутствии катализатора, например, кислот Льюиса (хлорид железа, бромид железа, хлорид алюминия и др.). Продуктможет быть галогенизирован -галоамидами (-хлоросукцинимид, -бромосукцинимид и др.). В некоторых случаях реакция может быть ускорена введением уксусной кислоты, соляной кислоты и др. Данная реакция может быть проведена в инертных растворителях воде, алифатических углеводородах(пентан, гексан, циклогексан и др.), эфирах (1,1-оксибисэтан, тетрагидрофуран и др.), диполярных растворителях (ацетонитрил и др.), ароматических углеводородах (бензол, метил-бензол и др.), и галогенированных углеводородах. Промежуточные продукты формулы , где 1 не является водородом, и обозначенный 1-а в промежуточном продукте (-ав) могут быть получены галогенированием продукта формулы . Эта реакция аналогична реакции галогенирования продукта . Исходные материалы формулымогут быть получены циклизацией продукта формулыв присутствии трибромида бора или кислоты, например, соляной, бромистоводородной и др. или смеси этих кислот с уксусной. В промежуточном продуктеи во всех последующих реакциях радикал 19 является С 1-С 4 алкилом. 15 4186 1 Промежуточный продукт , в свою очередь, может быть приготовлен путем отщепления блокирующей группы и заменой ее спиртовой группой в продукте . В формулеР 2 является блокирующей группой как, например, тетрагидропиранил, третичный бутил, фенилбутил и др. Эти группы удаляются в процессе гидролиза с кислотой (соляной, бромистоводородной, уксусной и др.) или каталитическим гидрогенированием в присутствии водорода или соответствующих катализаторов. Когда 2 - амино, то он может блокировать эту группу в вышеприведенной реакции. Подходящими блокирующими группами являются С 1-С 6-алкилкарбонил, С 1-С 6-алкилоксикарбонил, бензилоксикарбонил и арилметильные группы. Удаление блокирующей группы может быть проведено деблокированием С 1-С 6-алкилкарбонильной группы в соответствующей кислоте или основании, в ангидридных или водных органических растворителях или воде, или гидрогенерированием в присутствии водорода и катализатора в зависимости от природы блокирующей группы. Промежуточные продукты формулымогут быть получены посредством восстановления продукта . Водин или два атома водорода углеродной цепочки могут быть замещены С 1-С 6 алкилрадикалом, их количество может быть равно нулю, одному или двум. Двойная связь вможет быть разрушена гидрогенированием в растворителях (метанол, этанол и др.) в присутствии водорода и катализатора (платина на угле, палладий на угле,никель и др.). Можно повысить температуру и/или давление. Продуктможет быть получен взаимодействием альдегидас соответствующим илидом,например, фосфорным илидом (20 и 21) является алкил или арил) или илидом, полученным из фосфоната Указанный илид может быть получен обработкой соли фосфония основанием (третичным бутоксид калия, н.бутил лития, амид натрия, гидрид натрия и др.) в инертной атмосфере и инертных растворителях (тетрагидрофуран, 1,4-диоксан и др.). Промежуточный продуктможет быть получен из производного алкилоксибензола формулы в соответствии с процессом формилирования с последующим отделением ненужных изомеров. 4186 1 Например, производное алкилоксибензоламожет быть получен формилитированием при взаимодействии с основаниями (метил лития, н.бутил лития и др.) и последующим взаимодействием полученного металлированного производного алкилоксибензола с формамидом (,-диметилформамида, ,-метил-фенилформамида и др.). Указанное формилирование может быть проведено по реакции (фосфорилхлорид, формамид) или(цинк-цианид, соляная кислота) в кислой среде. Альтернативно, исходные материалы формулы , где А является -СН 2-СН 2-, где один или два атома водорода могут быть замещены С 1-С 6-алкилом, а продукт обозначен (1), могут быть получены циклизацией продукта (1) в кислой среде в соответствии с описанием в . . ., 17, 1333 (1980). Необходимо ответить, что в (1) и (1) один или два атома этил или тетрагидрофурана могут быть замещены С 1-С 6-алкильным радикалом. Продукты (1) могут быть получены из производного алкилоксибензолавзаимодействием с производным оксида этилена в инертных растворителях (тетрагидрофуран, 1,4-диоксан и др.) в присутствии основания (метиллития, н.бутиллития). Промежуточные продукты формулы (5) также могут быть приготовлены гидролизацией эфирной группы формулыв щелочной или кислой средах. Ви последующих описаниях схем реакции 22 является С 1-С 4-алкильным радикалом. Указанные выше эфирымогут быть восстановлены при галогенирировании продукта ,как описано выше для получения (ХХХ-а) из . Продукт , где А является -С/СН 3/2-СН 2-, а продукт обозначен (-а-1), может быть получен циклизацией производного аллифенилав присутствии кислоты (муравьиной, уксусной, бромистоводородной и др.) или смесей этих кислот. Указанный выше продукт оллилфенилможет быть получен при использовании восстановителяиз аллилфенила формулы . Указанная реакция завершается в присутствии инертного растворителя и некотором повышении температуры, в особенности до температуры разлива реакционной смеси. Подходящие растворители алифатические или ароматические углеводороды (метилбензол, фенилбензол и др.), галогенированные углеводороды (хлорбензол и др.), спирты (циклогоксанол и др.), эфиры (1,1-оксибисетан, 1,1-оксибисбензол и др.), амины (,диметиланилин и др.), диполярные растворители (,-диметилформамид, 1-метил-2-пирролидинон др.). Эфир аллилфенила формулыможет быть восстановлен проведением О-алкилированием производного фенола формулыс аллилирующим реагентом формулыв соответствии с известными процессами О-алкилирования. В формулеопределяется, как указано выше, для продукта . Указанная реакция Оалкилирования может быть завершена с применением различных реагентов. В частности, в инертных растворителях, например вода, ароматические растворители (бензол и др.), С 1-С 6-алканолы (этанол и др.), кетоны (2-пропанон и др.), эфиры (тетрагидрофуран и др.) или диполярные растворители (,диметилформамид и др.), добавление соответствующих оснований, например, такие как карбонат калия,гидроксид натрия или гидрид натрия и др. могут быть использованы избирательно для того, чтобы связать кислоту, которая выделяется в процессе реакции. Промежуточный продукт формулы , где А является -2-2-2-, где один или два атома водорода могут быть замещены С 1-С 6-алкилом, а продукт, обозначен формулой (ХХХ-а-2-), может быть получен реакцией восстановления 2 Н-бензопирана формулыв соответствии с описанным выше получением продукта формулы . Следует помнить, что в формуле (ХХХ-а-2) и в формулахиодин или два атома водорода пирана или углеродной цепочки могут быть замещены С 1-С 6-алкилом. Промежуточный продукт формулыможет быть получен по реакции с восстановителемиз фенилэфира формулыс последующей реакцией циклизации. Указанная реакция может быть проведена в соответствии с реакционным процессом, описанным в ,, . 2, . 393-418. Преимущественно, реакция завершается в инертных рас 18 4186 1 творителях при температуре выше 100 С. Подходящие растворители углеводороды (фенилбензол, дифенилметан, нафталин, декагидронафталин и др.), галогенированные углеводороды (хлорбензол, и др.), спирты(циклогексанол и др.), эфиры (1,1-оксибисбензол и др.) или диполярные растворители (,диметилацетамид, ,-диметилформамид и др.). Описанные выше промежуточные продукты могут быть получены известными методами (-один из другого с заменой функциональных групп, как описано выше для соединений формулы . Промежуточные продукты формулыи , где 1, 2, 3 А и Р 1 имеют описанные выше значения,могут быть или новыми соединениями или известными. Соединения формулымогут иметь асимметричные углеродные атомы, их точное положение может быть указано стереохимическим расположениеми . На данном этапе не все возможные структуры соединений указаны. Стереоизомерные структуры соединений и смесей не входят в рамки данного изобретения. Стереоизомерные структуры промежуточных продуктов описаны выше в схемах реакций и в соединениях формулыи могут быть получены известными методами. Например, диастереоизомеры могут быть выделены физическими методами дистилляцией, кристаллизацией, хроматографически (распределение методом противотока, жидкостная хроматография) и др. Чистые энантиомеры могут быть получены кристаллизацией их диастереомерных солей с активными агентами, хроматографическими методами разделения диастереомерных производных или неподвижных хиральных фаз и др. Альтернативно энантиомерные чистые структуры могут быть получены из энантиомерных чистых изомерных структур исходных материалов при условии, что процесс реакции протекает стереоспецифически. Соединения формулыи промежуточные продукты формулы , -оксидные структуры и фармацевтически проходящие соли стимулируют активность гастрокишечной системы, в особенности толстых кишок. Эти свойства подтверждены результатами испытаний , описанных ниже. Стимулирующий эффект соединений формулыиподтвержден различными методами испытаний,представленными в, 234, 775-783 (1985) и, 8, 243-250 (1986). Кроме того, соединения формулыи , -оксидные структуры, фармацевтически подходящие кислые примеси солей и некоторые стереоизомерные структуры обладают закрепляющими свойствами. Некоторые группы соединений данного изобретения, особенно те, где радикал А не замещен С 1-С 6-алкилом, имеют слабую 5 НТ 3 антагонистическую активность. Для большинства соединений данного изобретения не отмечается рецепторносвязующего родства с серотонергиком -51 и серотонергиком -5 НТ 2 и характерна малая или отсутствие домамин энергетической антагонистической активности. Полезные свойства соединений, оказывающих активное воздействие на гастрокишечную систему, могут иметь несколько вариантов для лечебных целей. Для приготовления фармацевтических соединений данного изобретения активные ингредиенты (основания, кислые примеси солей) вводятся в смеси с соответствующим носителем. Полученные фармацевтические композиции представляют собой единичные дозы для приема оральным, ректальным или другим родственным способом. Например, для орального способа могут быть использованы жидкие носители (вода, гликоли, масла,спирты) при изготовлении жидких препаратов типа суспензий, сиропов, их элекстров или растворов. В качестве твердых носителей могут быть использованы сахар, крахмал, каолин, смазки, связующие, дезинтегрирующие агенты для приготовления порошков, пилюль, капсул и таблеток. Для лучшего растворения могут быть добавлены другие ингредиенты. В растворы могут быть введены, например, соляные растворы или растворы глюкозы или их смесь. В суспензии вводятся агенты. В композициях, предназначенных для подкожного введения, носитель может включать добавки, активизирующие проникновение, и/или смачивающие агенты. Эти добавки не должны оказывать вредного влияния на кожу. Композиции могут быть применены в виде наложенных повязок, смазок и др. кислые добавки солей , благодаря их водной растворимости, наиболее пригодны для изготовления водных растворов композиций. Рассмотренные здесь дозы,рассчитанные как единичные, предназначены для обеспечения терапевтического эффекта в сочетании с нужным фармацевтическим носителем. Дозы приведены в таблицах. Соединения данного изобретения обладают возможностью стимулировать активность толстых кишок,нормализовать и улучшать работу гастрокишечной системы и перистальтику желудка и/или малых и/или больших кишок. Соединения предназначены также для лечения теплокровных животных, страдающих от нарушений гастрокишечной системы, например, гастропаралича, вспученности, язвы, псевдонепроходимости и особенно при нарушении кишечной проходимости. Для лечения указанных нарушений наиболее подходящими являются соединения формулы , -оксиды, фармацевтически подходящие кислые примеси солей или стерео 19 4186 1 изомерные структуры. Особенностью соединений данного изобретения является также терапевтическое воздействие на активность верхнего отдела кишечника и пищевода при нарушении их работы. Эффективность действия соединений зависит от вводимых доз, которые определены в результате испытаний и составляют от 0,001 до 10 мг/кг, наиболее предпочтительны от 0,01 мг/кг до 1 мг/кг веса тела. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. А. Приготовление промежуточных продуктов. Пример 1. а) В раствор из 310 частей тил 4-(ацетиламино)-2-гидроокси-бензоата в 2820 частях ,диметилформамида была добавлена небольшими порциями 71 часть дисперсии гидрида натрия в минеральном масле (50 ) и, после перевешивания в течение одного часа при комнатной температуре, добавлены один кристалл йодида калия и 172 части 3-хлоро-3-метил-1-бутина в атмосфере азота. Полученная смесь перемешивалась в течение 24 ч при 90 С, а затем выливалась в 10 водный раствор . Полученный продукт экстрагировали в дихлорметане. Экстракт был высушен, отфильтрован и выпарен. Полученный осадок был перемешан в петролейном эфире и растворен в дихлорэтане. Этот раствор был промыт водой, 10 раствороми снова водой, а затем высушен, отфильтрован и выпарен. Осадок был очищен в хроматографических колонках (силикагель, 22). Очищенная фракция была выпарена. Из двух фракций получена 41 часть (10,1 ) метил 4-(ацетиламино)-2-(1,1-диметил-2-пропинилокси)бензоата (промежут. прод. 1). б) Смесь из 36 частей (промежуточного продукта 1) к 188 частей ,-диметилацетамида была перемешана в течение 24 ч при температуре розлива. Реакционная смесь была выпарена, а осадок растворен в дихлорметане. Раствор был промыт водой, 5 раствороми снова водой, а затем высушен, отфильтрован и выпарен. Полученный осадок был очищен в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН 991). Очищенная фракция была выпарена. Получено 23,7 частей (66,2 ) метил 5-(ацетиламино)-2,2 диметил-2 Н-1-бензопиран-8-карбоксилата (промежут. прод. 2). в) Смесь из 23,7 частей промежуточного продукта 2 и 148 частей метанола была сразу же гидрогенизирована при нормальном давлении и комнатной температуре в присутствии палладий-угольного катализатора(10 ). После определения количества атомов водорода продукт был удален, а катализатор был отфильтрован и выпарен. Получено 21,2 части (88,9 ) метил 5-(ацетиламино)-3,4-дигидро-2,2-диметил-2 Н-1 бензопиран-8-карбоксилата (промежут. прод. 3). г) Смесь из 21,2 промежуточного продукта 3, 10,3 частей хлоросукцинимида и 158 частей ацетонитрила была перемешена в течение 2 ч при температуре розлива. Реакционная смесь была выпарена и осадок растворен в дихлорметане. Этот раствор был промыт водой, высушен, отфильтрован и выпарен. Осадок был очищен в хроматографических колонках (силикагель 22/3 991). Очищенная фракция была выпарена. Получено 23 части (95,8 метил 5-(ацетиламино)-6-хлоро-3,4-дигидро-2,2 диметил-2 Н-1-бензопиран-8 карбоксилата (промежут. прод. 4). д) Смесь из 20 частей промежуточного продукта 4, 36 частей гидроксида калия и 250 частей воды была перемешана в течение 16 ч при температуре розлива. После охлаждения раствор был декантирован и осадок был промыт дихлорметаном дважды. Водный остаток был подкислен 69,9 частями НС (концентр.). Осадок был отфильтрован, промыт водой и высушен в вакууме при 70 С. Получено 13 частей (79,4 ) 5-амино-6-хлор-3,4-дигидро-2,2-диметил-2 Н-1-бензопиран 8-карбоксильной кислоты. Температура плавления 165 С (пром. прод. 5). Пример 2. а) Смесь из 58 частей метил 4-(ацетиламино)-2,3-дигидро-2,2-диметил-7-бензофуранкарбоксилата, 123 частей гидроксида калия и 1100 частей воды была перемешана в течение 3 ч при температуре розлива. После охлаждения реакционная смесь была подкислена до рН 7 соляной кислотой. Осадок был отфильтрован и высушен в вакууме при 80 С. Получено 36 частей (79,0 ) 4-амино-2,3-дигидро-2,2-диметил-н.бензофуранкарбоксильной кислоты (пром. прод. 6). б) Смесь из 36 частей промежуточного продукта 6, 66,2 частей сульфокислоты и 142 части метанола была перемешана в течение 30 минут при температуре розлива. После охлаждения в реакционную смесь было добавлено основание из метанола с насыщенным аммиаком, а затем смесь выпарена. Осадок был растворен в дихлорметане и воде. Органическая часть была отделена, промыта водой, высушена, отфильтрована и выпарена. Другая часть осадка была выкристаллизована из ацетонитрила при 0 С. Продукт был отфильтрован и высушен в вакууме при 40 С. Получено 20 частей (53,2 ) метил-4-амино-2,3-дигидро-2,2-диметил-7-бензофуранкарбоксилата (пром. прод. 7). в) Смесь из 15,3 частей промежуточного продукта 7, 23,3 частей 2-йодопропана, 9,13 частей ,диэтилэтанамина и 72,1 части гексаметилфосфорного триамида была перемешана в течение 28 часов при 130 С. После охлаждения реакционная смесь была вылита в воду. Продукт был экстрагирован дихлорметаном и экстракт затем промыт водой, высушен и выпарен. Осадок был очищен в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН 991). Очищенная фракция была выпарена, а осадок был выкристаллизован из 2,2-оксибиспропана при 0 С. Продукт был отфильтрован и высушен в вакууме при 40 С. Получено 10 частей (54,2 ) метил-2,3 дигидро-2,2-диметил-4-/(1-метилэтил)амино/-7-бензофуранкарбоксилата (пром. прод. 8). 4186 1 г) Смесь из 9 частей промежуточного продукта 8, 3,2 частей гидроксида натрия и 60 частей воды была перемешана в течение 1 ч при температуре розлива. После охлаждения реакционная смесь была подкислена до рН 6 НС (конц.). Осадок был промыт водой и высушен в вакууме при 60 С. Получено 7,2 части (76,0 ) 2,3-дигидро-2,2-диметил-4/(1-метилэтил)амино/-7-бензофуранкарбоксильной кислоты (пром. прод. 9). Пример 3. а) В суспензию из 17 ч. 4-амино-5-хлор-2,3-дигидро-7-бензофуранкарбоксильной кислоты (приготовленной в соответствии с ЕР-А-0,389,037) в 435 ч. трихлорметана добавляют последовательно 9,13 ч. ,диметилэтанамина и 8,68 ч. этилхлорформиата. Хранят суспензию при температуре ниже 5 С. После перемешивания в течение 2 ч с одновременным охлаждением на льду всю суспензию добавляют к раствору из 14,5 ч. этил-4-амино-1-пиперидинокарбоксилата в 218 ч. трихлорметана при температуре ниже 5 С. Перемешивание продолжают при комнатной температуре. Реакционную смесь промывают 5 раствором(дважды) и водой (дважды), а затем высушивают, отфильтровывают и выпаривают. Осадок последовательно в 3 приема перетирают с 2,2-оксибиспропаном, а затем выкристаллизовывают из ацетонитрила. Продукт отфильтровывают, промывают ацетонитрилом и высушивают. Получают 19,7 ч. (66,9 ) продукта. Дополнительное количество продукта 1,2 ч. (4,1 ) получают из слоев 2,2-оксибиспропана. Всего получено 20,9 ч. (71 ) этил 4-//(4-амино-5-хлор-2,3-дигидро-7-бензофуранил)карбонил/амино/-1-пиперидинкарбоксилата т. пл. 158,6 С (пром. прод. 10). б) Раствор из 18,4 ч. промежуточного продукта 10 и 28 ч. гидроксида натрия в 125 ч. 2-пропанола перемешивают в течение 4 ч при температуре кипения. Затем растворитель выпаривают и добавляют 100 ч. воды. Смесь выпаривают снова, а остаток перемешивают в 100 ч. воды в течение 15 мин с одновременным подогревом на водяной бане. После охлаждения твердый состав отфильтровывают, промывают водой и растворяют в кипящем 2-пропаноле. К раствору добавляют 40 ч. воды. Продукт выкристаллизованный при охлаждении, отфильтровывают, промывают водой и высушивают. Получают 12,35 ч. (83,5 ) 4-амино-5-хлор-2,3 дигидро(4-пиперидинил)-7-бензофуранкарбоксиамида т. пл. 190,3 С (пром. прод. 11). Все промежуточные продукты, приведенные в табл. 1, приготовлены аналогичным образом. Таблица 1 Пример 4. К перемешанной и охлажденной (в ледяной бане) смеси из 20 ч. (-)тетрагидро-2-фуранметанола и 39,2 ч. пиридина добавляют по капле 24,7 ч. хлорида метансульфохлорида. Перемешивание проводят при комнатной температуре в течение 16 ч. К реакционной смеси добавляют дихлорметан и смесь промывают раствором 1 НС, высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель СН 2 С 2 ОН 99,50,5). Очищенную фракцию выпаривают. Получают 26,7 ч. (75,6 ) (-)-тетрагидро-2-фуранметанол метансульфоната (эфир) 20-15078 (конц.1 ) в СН 2 С 2) (пром. прод. 19). Аналогичным образом приготовлен тетрагидро-2-фуранметанол метансульфонат (эфир) 2016,17 (конц. 1 в СН 2 С 2) (пром. прод. 20). Пример 5. К раствору из 10 ч. 3-(циклогексилокси)-1-пропанол в 160 ч. дихлорметана добавляют 11,2 ч. ,диэтилэтанамин и по каплям 8,14 ч. хлорида метансульфонила. Всю смесь перемешивают в течение 9 ч при комнатной температуре. Реакционную смесь промывают 23 (водный) и водой, затем высушивают, от 21 4186 1 фильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН 991). Очищенную фракцию выпаривают, а осадок был выпарен вместе с метилбензолом. Продукт отфильтровывают и сушат. Получают 8,6 ч. (57,8 ) 3-(цикло-гексилокси)-1-пропанолметансульфоната (эфир) (пром. прод. 21). Пример 6. Раствор из 5,5 ч. 3,3-бис(4-фторфенил)-1-пропанола и 2,92 ч. тионилхлорида в 39,9 ч. дихлорметана перемешивают при 60 С в течение 4 ч. Реакционную смесь выпаривают, а затем смешивают с метилбензолом и еще раз выпаривают. Осадок растворяют в этилацетате и этот раствор промывают 23 (водн.) водой и(насыщ.), а затем высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель, (С 2 Н 5)2 О/Н-гексан 298). Очищенную фракцию выпаривают, получают 4,5 ч.(76,7 ) 1-/3-хлор-1-(4-фторфенил)пропил/-4-фторбензола (пром. прод. 22). Б. Получение целевых соединений. Пример 7. Раствор из 2,96 ч. промежуточного прод. 11, 3,2 ч. раствора карбоната натрия и 160 ч. 4-метил-2 пентанона перемешивают в течение 30 мин при температуре кипения в присутствии водопоглотителя. В этот раствор добавляют 3,6 ч. тетрагидро-2-фуранметилового сложного эфира метансульфоновой кислоты и все это перемешивают при температуре кипения в течение 48 ч. Реакционную смесь смешивают с дихлорметаном и полученный раствор промывают водой, высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель, СН 2 С 2/СН 3 ОН 955). Очищенную фракцию выпаривают,а осадок выкристаллизовывают из ацетонитрила. Продукт отфильтровывают и высушивают. Получают 1,63 ч.(42,9 ) 4-амино-5-хлор-2,3-дигидро/1-/(тетрагидро-2-фуранил)метил-4-пиперидинил/-7/бензофуранкарбоксиамида т. пл. 175,4 С (соед. 3). Пример 8. Смесь из 3,09 ч. промежуточного продукта 12, 13, 28 ч. карбоната натрия и 160 ч. 4-метил-2-пентанона перемешивают при температуре кипения в присутствии водопоглотителя. Затем добавляют 2,74 ч. 6-(2 хлорэтил)-7-метил-5 Н-тиазол(3,2-а-)-пиримидин-5-пиримидина и 0,1 ч. йодида калия и все это перемешивают при температуре кипения в течение 36 ч. Реакционную смесь выпаривают, а осадок растворяют в трихлорметане и воде. Органическую часть осадка отделяют, промывают водой, высушивают, отфильтровывают и выпаривают. Другую часть осадка очищают в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН 9010). Очищенную фракцию выпаривают, а осадок кипятят в ацетонитриле. После охлаждения продукт отфильтровывают и высушивают. Получают 2,7 ч. (53,8 ) 5-амино-6-хлор-3,4-дигидро/1-/2(7-метил-5-окси-5 Н-тиазол-/3,2-а/пиримидин-6-ил)этил/-4-пиперидин/-2 Н-1-бензопиран-8-карбоксиамида т. пл. 211,8 С (соед. 2). Пример 9. Смесь из 21,7 частей промежуточного продукта 12, 5, 7 ч. хлорацетонитрила, 9,2 ч. ,-диэтиламина и 430 ч. ,-диметилформамида перемешивают сразу же после приготовления при 60 С. Реакционную смесь выпаривают и к осадку добавляют 23 (водн.). Продукт экстрагируют дихлорметаном (трижды). Полученные экстракты высушивают, отфильтровывают и выпаривают. Из осадка готовят суспензию в ацетонитриле. Первую фракцию продукта отфильтровывают, а фильтрат выпаривают. Осадок очищают в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН (Н 3 973). Очищенную фракцию выпаривают, а осадок смешивают с ацетонитрилом и получают вторую фракцию, а затем обе фракции высушивают в вакууме. Получают 22,1 ч. (90,5 ) 5-амино-6-хлор(1-(цианометил)-4-пиперидинил)-3,4-дигидро-2 Н-1-бензопиран-8 карбоксиамида, т. пл. 194 С (соед. 10). Пример 10. Смесь из 4,3 ч. 2-(3-хлорпропил)-2-метил-1,3-диоксолана 7,4 ч. промежуточного продукта 13, 4,7 ч. ,диэтилэтанамина, необходимого количества катализатора йодида калия и 106 ч. ,-диметилформамида перемешивают при 70 С в течение 17 ч. Реакционную смесь выпаривают и к осадку добавляют а 2 СО 3(водн.). Продукт экстрагируют дихлорметаном, а экстракт высушивают, отфильтровывают и выпаривают, а затем очищают в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН (Н 3) 973). Очищенную фракцию выпаривают и осадок растирают с 2,2-оксибиспропаном. Продукт отфильтровывают и высушивают. Получают 2,1 ч. (20,2 ) 4-амино-5-хлор-2,3-дигидро-2,2-диметил/1-/3-(2-метил-1,3-диоксан-2-ил)пропил/4-пиперидинил/-7-бензофуран карбоксиамида, т. пл. 136,5 С (соед. 8). Пример 11. Смесь из 6 ч. промежуточного продукта 14, 1,13 ч. пропенитрила и 78 ч. 2-пропанола перемешивают в течение 4 ч при температуре кипения. Реакционную смесь выпаривают, а осадок суспендируют в 2,2 оксобиспропане. Полученный осадок отфильтровывают и высушивают в вакууме при 60 С. Получают 608 ч. 4186 1 Пример 12. Смесь из 22 ч. соединения 10 в 356 ч. тетрагидрофурана и 79 ч. метанола обрабатывают при нормальном давлении и комнатной температуре 6 ч. катализатораникеля. После окончания реакций катализатор фильтруют, а фильтрат выпаривают. Полученный осадок очищают в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН (Н 3) 937). Очищенную фракцию выпаривают, а осадок растирают в 2,2 оксибиспропане, а затем перемешивают в небольшом количестве ацетонитрила. Продукт отфильтровывают и высушивают. Получают 14 ч. (63,0 ) 5-амино/1-(2-аминоэтил)-4-пиперидинил)-6-хлор-3,4-, дигидро 2 Н-1-бензопиран-8-карбоксиамида т. пл. 130 С (соед. 11). Пример 13. Смесь из 16,7 ч. соединения 55, 19 ч. гидроксида калия и 92 ч. 2-пропанола перемешивают в течение 3 ч при температуре кипения. Реакционную смесь выпаривают и осадок повторно выпаривают с водой (дважды) и затем растворяют в дихлорметане, метаноле и воде, водную часть осадка отделяют и экстрагируют в дихлорметане. Оставшиеся 2 органические части осадка высушивают и отфильтровывают. Получают 8,3 ч.,-диэтилэтанамина и по капле раствор из 0,77 ч. этилхлороформиата в 40 ч. трихлорметана при температуре ниже 10 С. После перемешивания в течение 30 мин при комнатной температуре, реакционную смесь промывают водой, высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН (Н 3 955). Очищенную фракцию выпаривают, а осадок кристаллизуют из ацетонитрила. Продукт фильтруют и высушивают. Получают 1,4 ч. (50,7 ) этил/2-/4-//(5-амино-6 хлор-3,4-дигидро-2 Н-1-бензопиран-8-ил)карбонил/амино/-1-пиперидинил/-этил/карбамата т. пл. 160,3 С (соед. 16). Пример 15. Смесь из 3,67 ч. соединения 14, 1,85 ч. 2-хлор-1 Н-бензимидазола 4,7 ч. ,-диметилацетамида,необходимого количества катализатора йодида калия и 2,10 ч. карбоната натрия перемешивают в течение 3 ч при 120 С. После охлаждения реакционную смесь разбавляют водой, высушивают, фильтруют и выпаривают. Осадок очищают в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН (Н 3) 955. Очищенную фракцию выпаривают, а осадок превращают в раствор соли этандиоата (12) в этаноле. Продукт отфильтровывают и высушивают. Получают 0,56 ч. (8,3 ) 4-амино-М-/1-/2-(1 Н-бензимидазол-2-иламино)/этил/-4-пипидинил/-5-л-2,3-дигид-2,2-димтил-7-бензофуранкарбоксиамид этандиоата (12) полугидрата, т. пл. 211,7 С (соед. 70). Пример 16. Смесь из 3,1 ч. 2-хлор-3-метилпиразина, 4,4 ч. соединения 14 и 0,79 ч. окиси кальция перемешивают в течение 24 ч при 120 С. После охлаждения реакционную смесь растворяют в дихлорметане и Н 4 ОН (разб.). Водную часть осадка отделяют и повторно экстрагируют в дихлорметане. Обе органические части осадка высушивают, отфильтровывают и выпаривают, фильтруют и выпаривают. Осадок очищают в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН (Н 3) 982). Очищенную фракцию выпаривают, а осадок растворяют в 2,2-оксибиспропане. Продукт отфильтровывают и высушивают. Получают 3,3 ч. (59,9 ) 4 амино-4-хлор-2,3-дигидро-2,2-диметил/1-/2//(3-метил-2-пиразинил)амино/этил/-4-пиперидинил/-7 бензофуранкар боксиамида, т. пл. 163,2 С (соед. 15). Пример 17. Через раствор из 3,5 ч. промежуточного продукта 11 в 19,8 ч. этанола и 25 ч. воды барботируют оксиран в течение 1 ч при комнатной температуре. Реакционную смесь выпаривают, а осадок очищают в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН (Н 3) 955). Очищенную фракцию выпаривают, а осадок выкристаллизовывают из ацетонитрила. Продукт фильтруют и высушивают в вакууме при 70 С. Получают 1,64 ч. (40,2 ) 4-амино-5-хлор-2,3-дигидро/1-(2-тидроксиэтил)-4-пиперидинил)-7-бензофуранкарбоксиамида т. пл. 185,7 С (соед. 49). Пример 18. К смеси из 12,2 ч. соединения 8 и 83 ч. воды добавляют 1,53 ч. сульфокислоты. После перемешивания в течение 4,5 ч при комнатной температуре реакционную смесь выливают в смесь из 4 О (разб.) и льда. Затем продукт экстрагируют дихлорметаном, а экстракт высушивают, фильтруют и выпаривают. Осадок очищают в хроматографических колонках (силикагель, СН 2 С 2/СН 3 ОН (3) 973). Очищенную фракцию выпаривают, а осадок растирают в 2,2-оксибиспропане. Затем продукт отфильтровывают и высушивают. Получают 2,3 ч. (40,3 ) 4-амино-5-хлор-2,3-дигидро-2,2-диметил/1-(4-оксопентил)-4-пиперидинил)-7-бензофуранкарбоксиамида т. пл. 119,2 С (соед. 9). Пример 19. а) Смесь из 7,6 ч. соединения, 3,5 ч. уксуснокислого калия и 158 ч. метанола гидрогенизируют при нормальном давлении и температуре 50 С с 2 ч. палладийугольного катализатора 10 . После определения ко 23 4186 1 личества атомов водорода, катализатор отфильтровывают, а фильтрат выпаривают. Получают 6,91 ч. (100 ) 4-амино-2,3-дигидро-Н-/1-/тетрагидро-2-фуранил)метил/-4-пиперидинил/-7-бензофуранкарбоксиамида (соед. 75). б) Смесь из 8 ч. соединения 75,5 ч. 2-йодпропана, 3,1 ч. ,-диэтилэтанамина и 25,8 ч. гексаметилфосфорного триамида перемешивают в течение 20 ч при 130 С. После охлаждения реакционную смесь выливают в воду. После экстрагирования в дихлорметане экстракт промывают водой, высушивают, отфильтровывают и выпаривают. Осадок обрабатывают в 2,2-осибиспропане. После фильтрации этот раствор выпаривают, а полученный осадок обрабатывают в 2-пропаноле. 2,2-оксибиспропан добавляют для повышения степени кристаллизации. Осадок отфильтровывают и растворяют в дихлорметане. Этот раствор промывают водой, высушивают, отфильтровывают и выпаривают. Полученный осадок очищают в хроматографических колонках (силикагель СН 2 С 2/СН 3 ОН (Н 3) 973). Очищенную фракцию выпаривают, а осадок превращают в соль этандиоата (11). Продукт отфильтровывают и высушивают в вакууме при 60 С. Получают 0,3 ч. (2,7 ) 2,3-дигидро-4-/(1-метилэтил)-амино/-/1-/(тетрагидро-2-фуранил)-метил/-4-пиперидинил/-бензофуранкарбоксиамид этандиоата (11), т. пл. 211,7 С (соед. 76). Пример 20. Смесь из 5 частей соед. 63 и 230 мл НС (3) была перемешана в течение 1 ч при температуре розлива. После охлаждения реакционная смесь была выпарена. Осадок перемешивали в 5 частях воды. Затем продукт был отфильтрован, промыт небольшим количеством воды и высушен в вакууме при 70 С. Получено 1,7 частей (31,5 ) 4-//(5-амино-6-хлоро-3,4-дигидро-2 Н-1-бензопиран-8-ил)карбонил/-амино/-1-пиперидинбутановая кислота моногидрохлорида моногидрата, температура плавления 204,5 С (соед. 68). Все соединения,указанные в табл. 2 и 3, получены теми же способами, которые описаны в примерах 7-20. Таблица 2
МПК / Метки
МПК: A61K 31/16, A61K 31/4523, A61P 1/14, C07D 405/12
Метки: производные, способ, или, дигидро-2h-бензопиран)карбоксиамида, соединения, промежуточные, получения, дигидробензофуран, фармацевтическая, основе, n-(4-пиперидинил, композиция
Код ссылки
<a href="https://by.patents.su/30-4186-proizvodnye-n-4-piperidinil-digidrobenzofuran-ili-digidro-2h-benzopirankarboksiamida-sposob-ih-polucheniya-farmacevticheskaya-kompoziciya-na-ih-osnove-promezhutochnye-soedineniya.html" rel="bookmark" title="База патентов Беларуси">Производные N-(4-пиперидинил) (дигидробензофуран или дигидро-2H-бензопиран)карбоксиамида, способ их получения, фармацевтическая композиция на их основе, промежуточные соединения</a>