Моноклональное антитело, его Fab-фрагменты, гибридома, продуцирующая моноклональное антитело, и противолейкозный агент на его основе
Текст
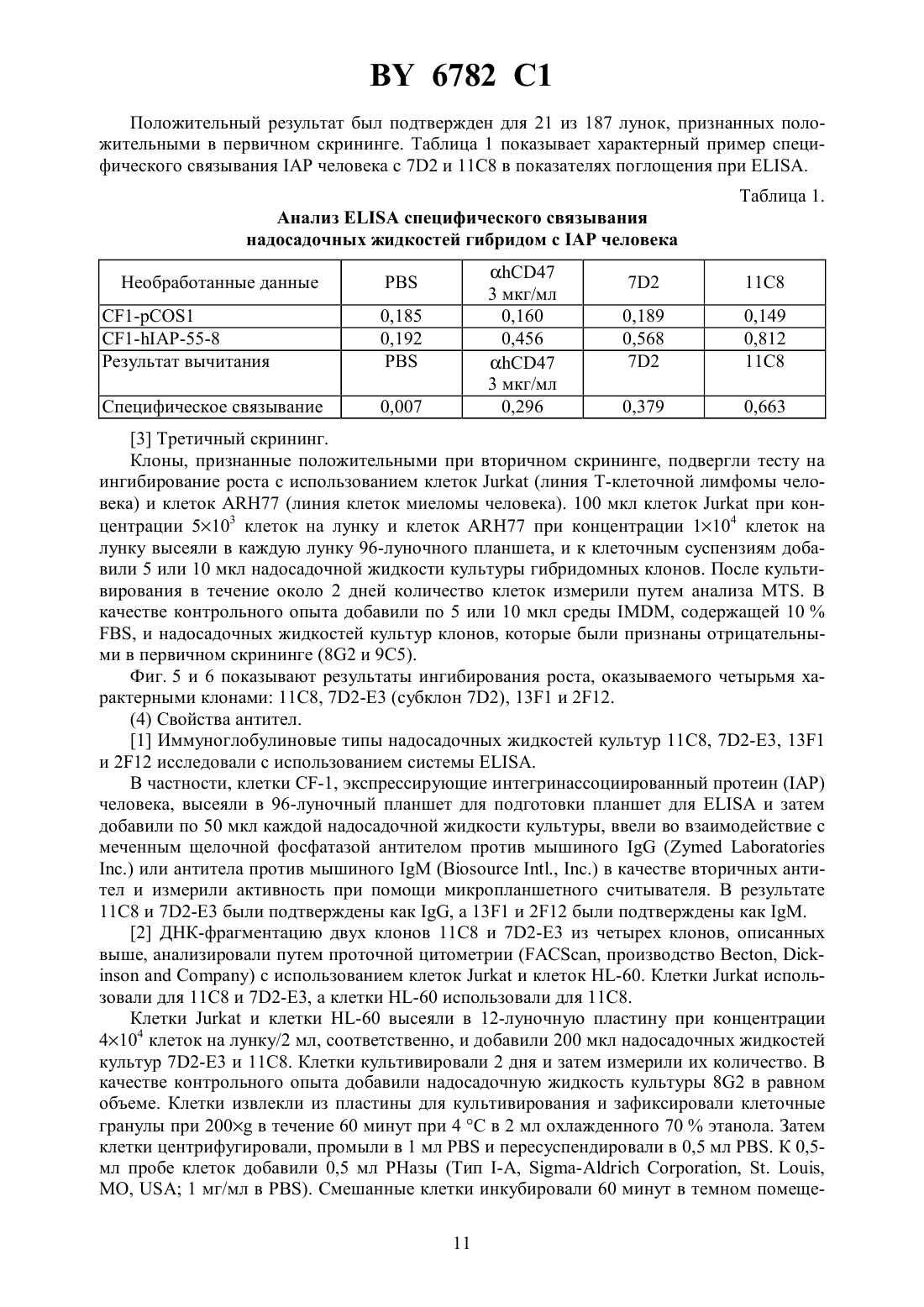
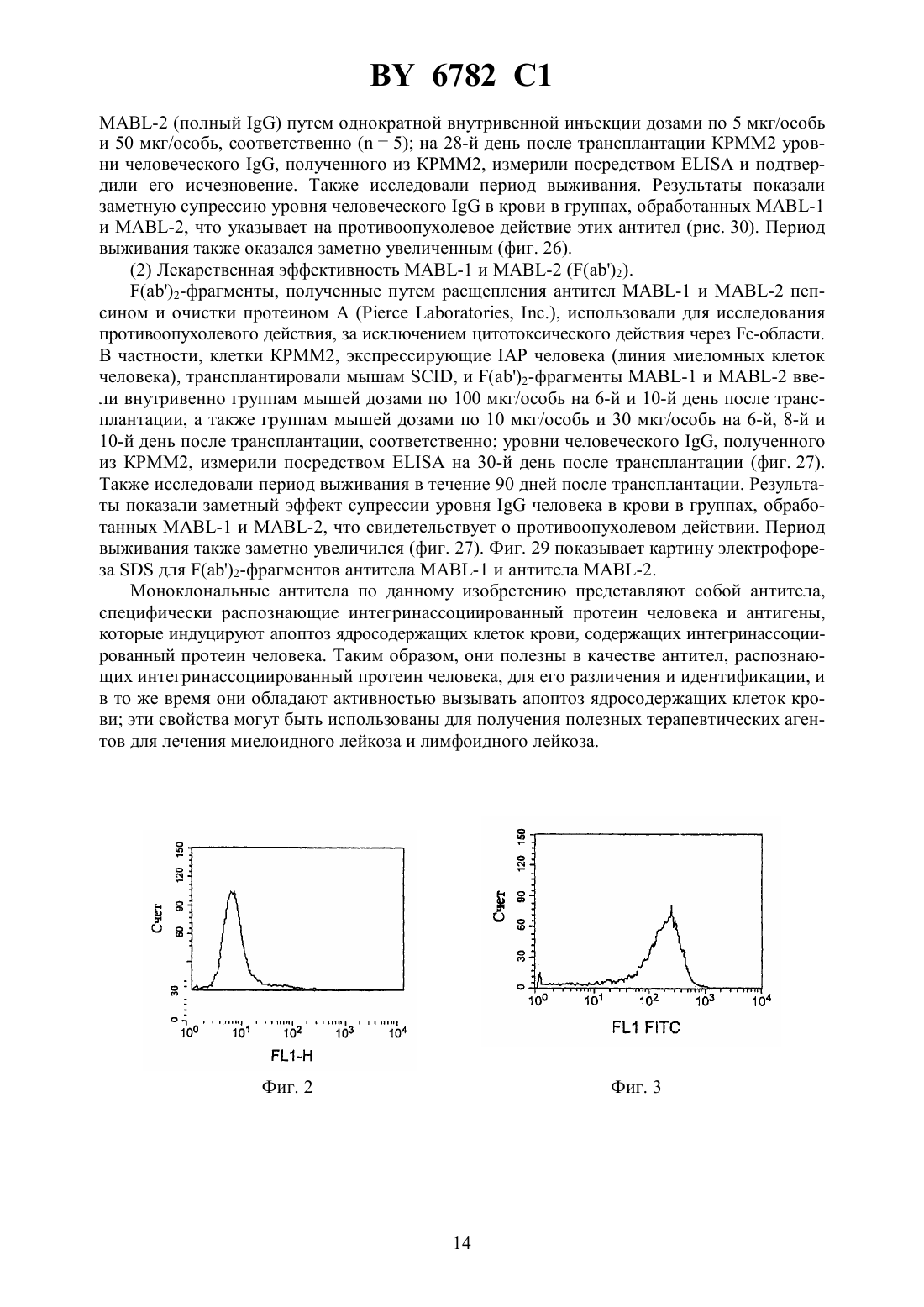
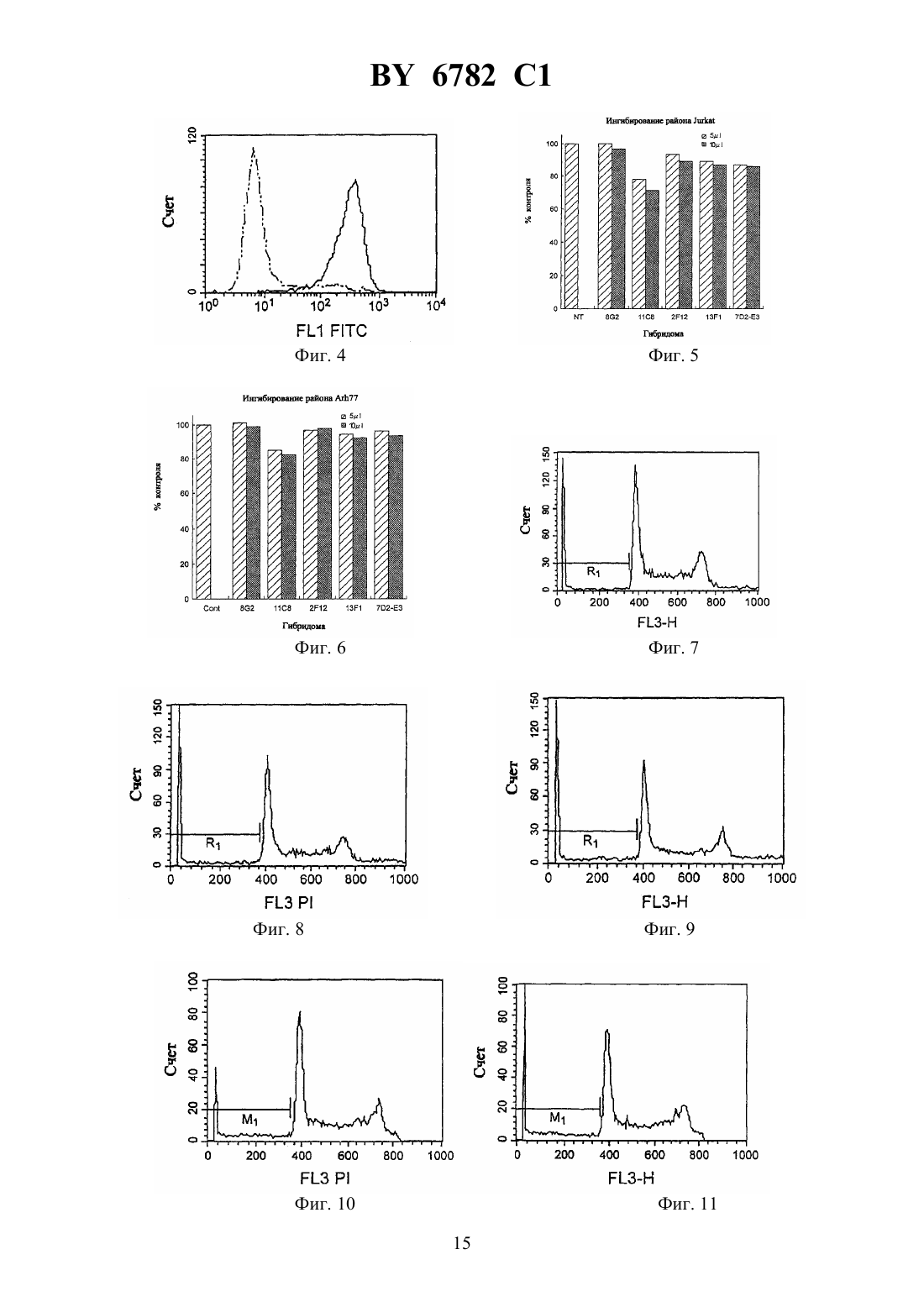
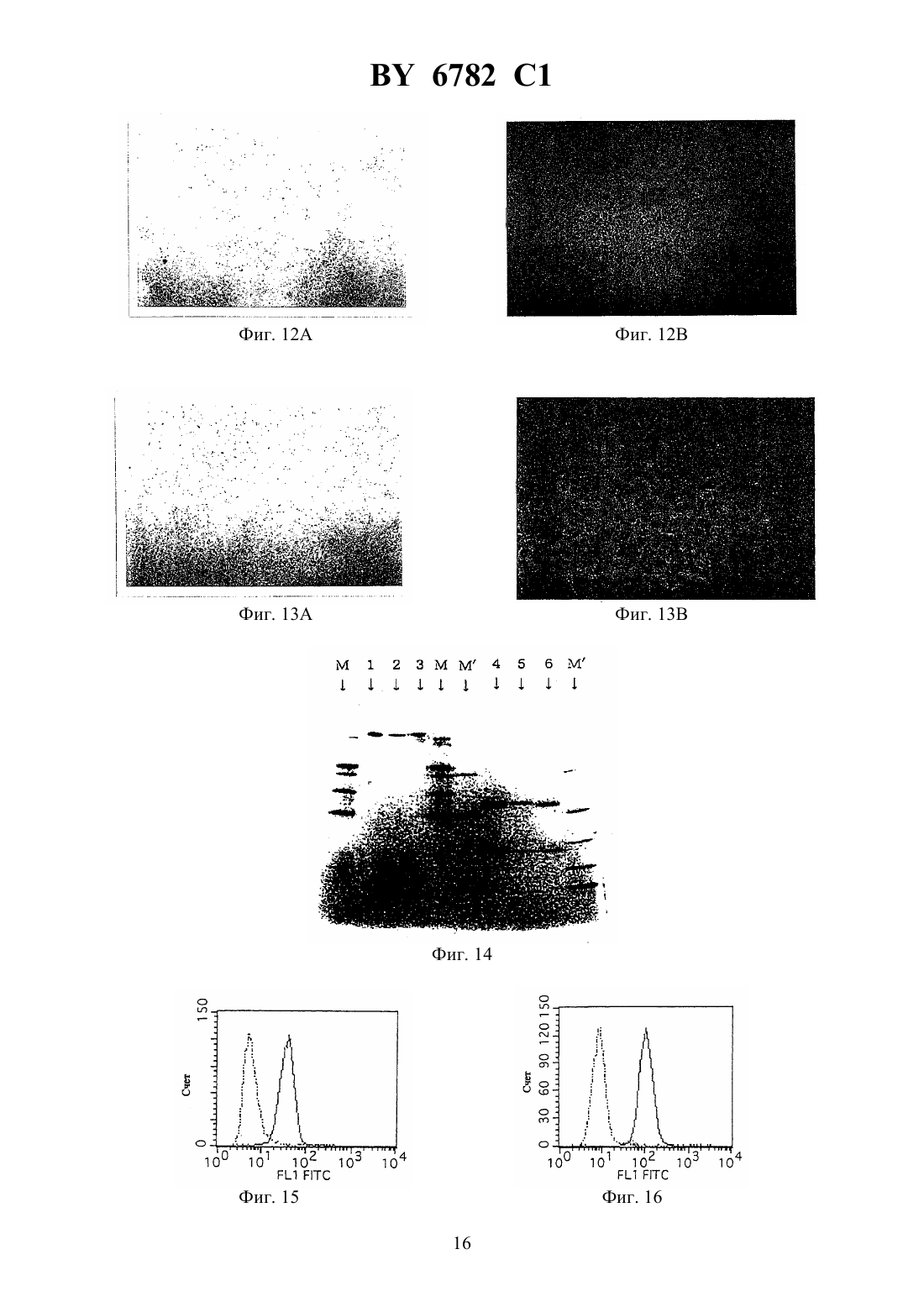
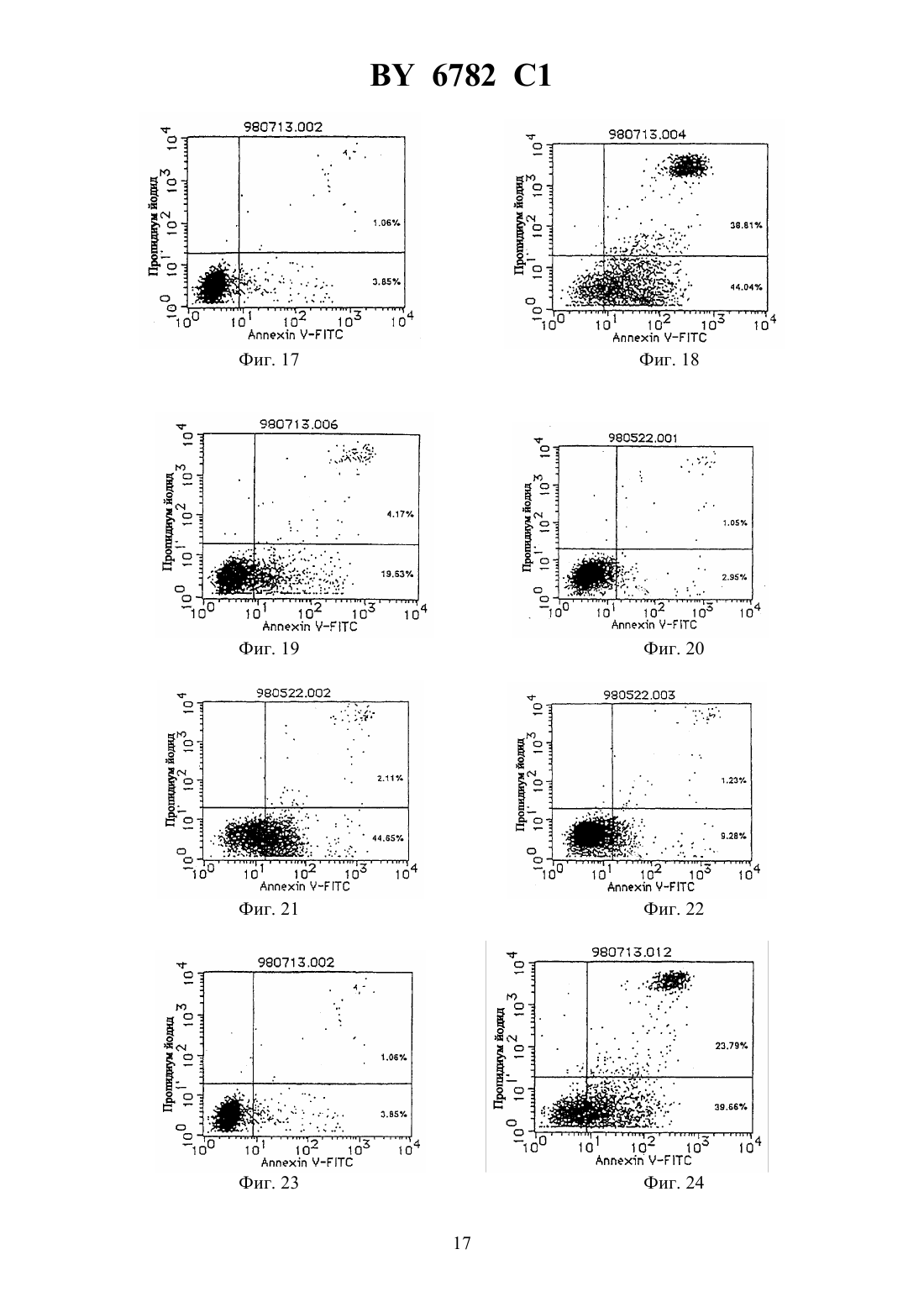
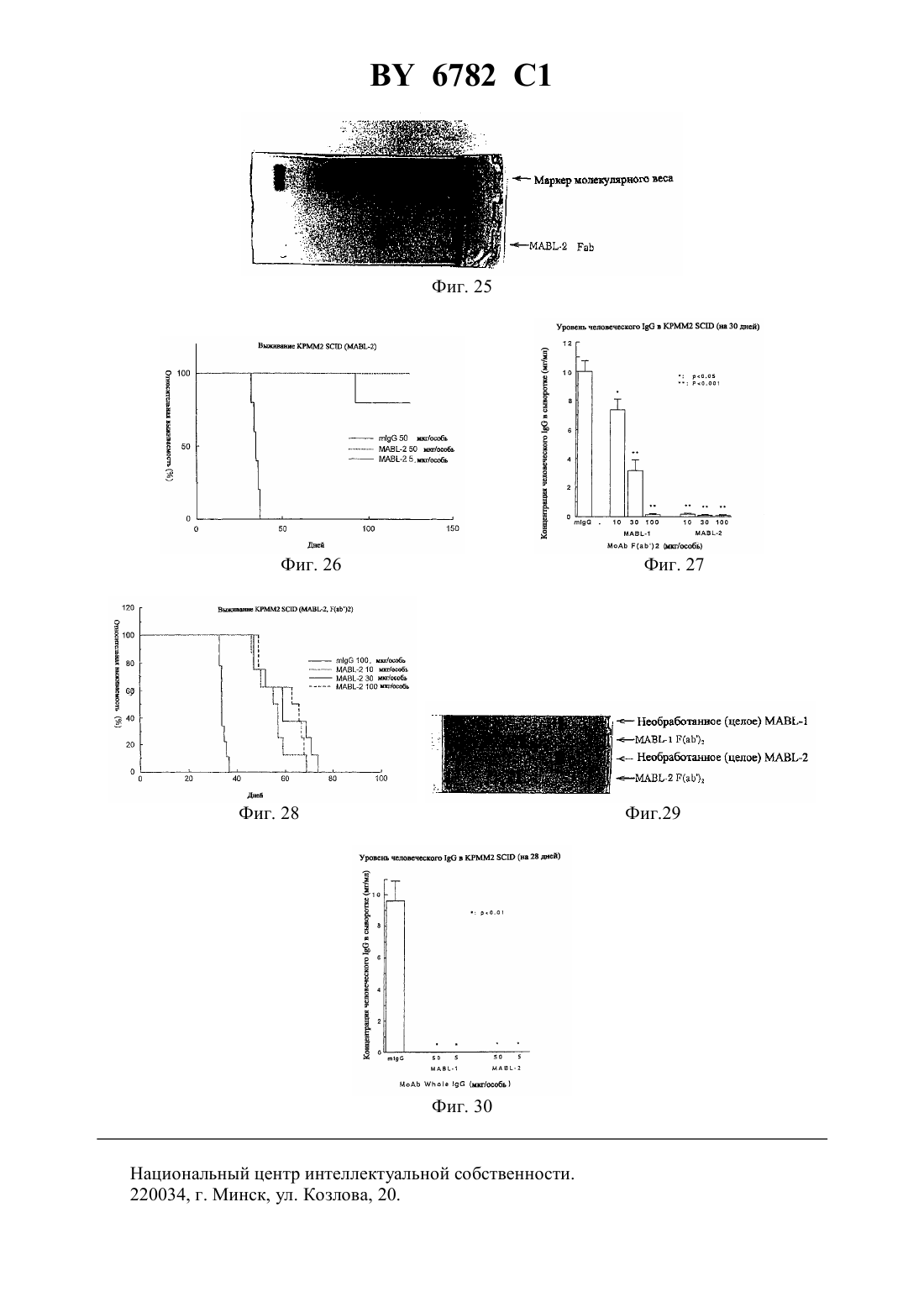
(12) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ЕГО -ФРАГМЕНТЫ,ГИБРИДОМА, ПРОДУЦИРУЮЩАЯ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, И ПРОТИВОЛЕЙКОЗНЫЙ АГЕНТ НА ЕГО ОСНОВЕ(71) Заявитель Чугай Сейяку Кабусики Кайся(73) Патентообладатель Чугай Сейяку Кабусики Кайся(57) 1. Моноклональное антитело, обладающее способностью связываться с интегринассоциированным белкоми вызывать апоптоз ядросодержащих кровяных клеток, содержащих , получаемое способом, включающим этап иммунизации млекопитающего указанным белком в качестве антигена. 2. Моноклональное антитело по п. 1, отличающееся тем, чтополучен от человека. 3. -, - или 2-фрагмент моноклонального антитела по п. 1, способный связываться си вызывать апоптоз ядросодержащих кровяных клеток, содержащих . 4. Фрагмент моноклонального антитела по п. 3, отличающийся тем, чтополучен от человека. 5. Гибридома, продуцирующая моноклональное антитело по п. 2, депонированная под номером-6100. 6782 1 6. Гибридома, продуцирующая моноклональное антитело по п. 2, депонированная под номером-6101. 7. Противолейкозный агент, связывающийся си вызывающий апоптоз ядросодержащих кровяных клеток, содержащих , включающий моноклональное антитело по пп. 1 или 2 или фрагмент моноклонального антитела по пп. 3 или 4. 8. Противолейкозный агент по п. 7, отличающийся тем, чтополучен от человека. 9. Противолейкозный агент по пп. 7 или 8, отличающийся тем, что содержит моноклональное антитело по пп. 1 или 2. 10. Противолейкозный агент по пп. 7 или 8, отличающийся тем, что содержит фрагмент моноклонального антитела по пп. 3 или 4.(56)95/06748 1. Изобретение относится к новым моноклональным антителам, обладающим свойством вызывать апоптоз ядросодержащих клеток крови с интегринассоциированным протеином, и их фрагментам, а также к гибридомам, продуцирующим моноклональные антитела. Новые антитела полезны в качестве терапевтических агентов для лечения миелоидного лейкоза и лимфоидного лейкоза. Гранулоцитные колониестимулирующие факторы, такие как рекомбинантный гранулоцитарный колониестимулирующий фактор (-), известны в данной области как гуморальные факторы, которые стимулируют дифференциацию и пролиферацию гранулоцитов. Работы, основанные на экспериментахна мышах, показывают, что введение - приводит не только к ускоренному миелопоэзу в костном мозге, но также и к заметному экстрамедуллярному гемопоэзу в селезенке и пролиферации всех гемопоэтических клеток-предшественников, включая гемопоэтические стволовые клетки, в селезенке. Механизм такого экстрамедуллярного гемопоэза в селезенке предположительно заключается в том, что стимуляция при помощи - видоизменяет гемопоэтическую микросреду селезенки и активизирует ее способность поддерживать гемопоэз, таким образом стимулируя гемопоэз. Для выяснения гемопоэтической функции селезенки авторы данного изобретения ранее сосредоточили внимание на стромальных клетках селезенки после неоднократного применения -. Авторы попытались исследовать, как гемопоэтическая функция активизируется посредством - через стромальные клетки, и выделили линию гемопоэтических стромальных клеток (клетки -1) из селезенки мыши путем неоднократного применения -. Авторы изучили гемопоэз-поддерживающую способность гемопоэтических стромальных клеток и подтвердили их колониестимулирующую активностьи способность поддерживать гемопоэтические стволовые клетки, 80,1914(1992). Однако, хотя одна линия стромальных клеток селезенки (клетки -1) была выделена,и были изучены ее цитологические характеристики, специфические антитела, которые бы распознавали поверхностные антигены этих клеток, до сих пор не были получены, и их характеристики не были выявлены. В свете вышеупомянутых открытий, относящихся к стромальным клеткам селезенки,и результатов предшествующих исследований авторы данного изобретения направили дальнейшие исследования на разработку специфических антител, которые могут узнавать стромальные клетки селезенки, осуществили попытку получить моноклональные антитела с использованием вышеупомянутых стромальных клеток селезенки в качестве сенсибилизирующего антигена и, наконец, добились успеха в получении новых моноклональных антител. 2 6782 1 Авторы глубже изучили свойства моноклональных антител, полученных, как описано выше, и обнаружили, что моноклональные антитела обладают свойством вызывать апоптоз миелоидных клеток. Эти моноклональные антитела были обозначены как антитело ВМАР-1 и далее будут называться таким образом. Авторы также исследовали антиген, распознаваемый антителом ВМАР-1, и с помощью прямой экспрессии обнаружили, что это интегринассоциированный протеин мыши( мыши) (,25524). Действие антител ВМАР-1 было изучено с использованием рекомбинантных клеток, в которые был введен ген мышиного . В частности, ген мышиногообычным путем был введен в клетки мыши , которые не экспрессировали мышиный , с получением клеточной линии, экспрессирующей мышиный(рекомбинантные клетки ),и действие антитела ВМАР-1 на экспрессирующие мышиныйклетки было исследовано посредством -анализа и ДНК-фрагментации с использованием проточной цитометрии (заявка на патент Японии 9-67499). При этих исследованиях ожидалось, что моноклональные антитела к антигену интегринассоциированного белка человека (называемого далеечеловека аминокислотная последовательность и последовательность оснований описаны в .., 123, 485-496,1993 см. также, 108, 3419-3425, 1995) должны обладать свойством индуцирования апоптоза ядросодержащих клеток крови, которые экспрессируют этот антиген (миелоидные клетки и лимфоциты), и авторы данного изобретения направили усилия на получение моноклональных антител к антигену интегринассоциированного белка человека и добились успеха в получении моноклональных антител, которые вызывают апоптоз ядросодержащих клеток крови человека, экспрессирующих этот антиген. Иными словами, задача данного изобретения состоит в создании новых моноклональных антител, обладающих свойством вызывать апоптоз ядросодержащих клеток крови(миелоидных клеток и лимфоцитов) с интегринассоциированным белком человека ( человека), и их фрагментов, а также гибридом, продуцирующих эти моноклональные антитела. Эти новые моноклональные антитела полезны в качестве терапевтических агентов для лечения миелоидного лейкоза и лимфоидного лейкоза. В предшествующих работах описаны такие функции интегринассоциированного протеина, как связывание с -цепью интегрина 3 для поддержания связывания между 3 и его лигандом витронектином (. . ., 123, 485-496 (1993, что индуцирует приток 2 в васкулярный эндотелий при адгезии нейтрофилов к васкулярному эндотелию (. . ., 268, 19931-19934 (1993, и что поддерживает миграцию нейтрофилов через васкулярный эндотелий (. . . . , 92, 3978-3982 (1995, однако сообщений о его функции относительно апоптоза ядросодержащих клеток крови не было опубликовано. Моноклональные антитела по изобретению представляют собой антитела, которые специфически распознают интегринассоциированный белок человека. Поэтому они обладают функцией различения и идентификации интегринассоциированного белка человека. Кроме того, моноклональные антитела по изобретению представляют собой антитела,которые проявляют свойство вызывать апоптоз ядросодержащих клеток крови (миелоидных клеток и лимфоцитов) с интегринассоциированным белком человека. Апоптоз представляет собой явление, при котором ДНК ядерного хроматина расщепляется на нуклеосомные единицы (что известно как образование лэддера), что приводит к гибели клетки это явление называют также суицидом клетки. Известные до настоящего времени моноклональные антитела, обладающие свойством вызывать апоптоз ядросодержащих клеток крови (миелоидных клеток и лимфоцитов),включают антитело против(, 66 233-243, 1991), антитело против 43 (, 86,502-511, 1995) и антитело против доменакласса 1 (, 90, 726-735, 1997), но 3 6782 1 свойство вызывать апоптоз ядросодержащих клеток крови при помощи антител по данному изобретению, узнающих интегринассоциированный белок, до сих пор не было известно. Поэтому моноклональные антитела по изобретению определяются как включающие любое моноклональное антитело, способное специфически узнавать интегринассоциированный белок и обладающее свойством вызывать апоптоз ядросодержащих клеток крови(миелоидных клеток и лимфоцитов) с интегринассоциированным белком. Антитела по изобретению не ограничиваются только теми антителами, которые вызывают апоптоз всех ядросодержащих клеток крови. Они также включают такие антитела,которые вызывают апоптоз по меньшей мере одного типа ядросодержащих клеток крови. В частности, в случае миелоидного лейкоза достаточно вызывать апоптоз хотя бы миелоидных клеток. Более конкретно, данное изобретение предлагает новое моноклональное антитело, обладающее способностью связываться с интегринассоциированным белкоми вызывать апоптоз ядросодержащих кровяных клеток, содержащих , полученное способом,включающим этап иммунизации млекопитающего указанным белком в качестве антитела. Предпочтительно, это моноклональное антитело отличается тем, чтополучен от человека. Изобретение предлагает также -, - или 2-фрагмент нового моноклонального антитела, способный связываться си вызывать апоптоз ядросодержащих кровяных клеток, содержащих . Предпочтительно фрагмент этого моноклонального антитела отличается тем, чтополучен от человека. Предметом изобретения является также гибридома, продуцирующая новое моноклональное антитело, депонированная под номеромВР-6100, а также гибридома, продуцирующая новое моноклональное антитело, депонированная под номеромВР 6101. Изобретение также предлагает противолейкозный агент, связывающийся си вызывающий апоптоз ядросодержащих кровяных клеток, содержащих , включающий новое моноклональное антитело или его фрагмент. Предпочтительно, противолейкозный агент отличается тем, чтополучен от человека. Далее, этот противолейкозный агент может содержать новое моноклональное антитело или его фрагмент. На фиг. 1 представлена картина электрофореза, показывающая полосу длячеловека, амплифицированного посредствомс использованием кДНК, полученной из мРНК клеточной линии -60. Слева направо показаны маркер молекулярной массы , человека (1) и -актин (2). Фиг. 2 представляет собой график, показывающий уровень экспрессиичеловека клетками 1210, которые экспрессироваличеловека, с использованием антитела против 47. Пик относится к клеткам 1210, подвергнутым трансфекции только геном 1 в качестве контроля. Фиг. 3 представляет собой второй график, показывающий уровень экспрессиичеловека клетками 1210, которые экспрессироваличеловека, с использованием антитела против 47. Пик показывает, что в клетках 1210, подвергнутых трансфекции геномчеловека, экспрессиячеловека заметно увеличена. Фиг. 4 представляет собой график, показывающий титры антител у иммунизированных мышей. Левый пик относится к интактным клеткам 1210. Правый пик представляет клетки 1210, подвергнутые трансфекции геномчеловека, и показывает, что сыворотка мыши, подвергнутая слиянию клеток, четко узнаетчеловека. Фиг. 5 представляет собой гистограмму, показывающую результаты эксперимента по ингибированию роста клеток (клетки ) с использованием надосадочной жидкости культуры гибридомы. 4 6782 1 Фиг. 6 представляет собой гистограмму, показывающую результаты эксперимента по ингибированию роста клеток (клетки 77) с использованием надосадочной жидкости культуры гибридомы. Фиг. 7 представляет собой график, показывающий эффект индуцирования апоптоза в клетках , оказываемый надосадочной жидкостью культуры (при анализе методом окрашивания ), в результате воздействия надосадочной жидкости культуры 82, в качестве контрольного опыта. 1 показывает процент апоптоза ( ), который составил 7,43 . Фиг. 8 представляет собой график, показывающий эффект индуцирования апоптоза в клетках , оказываемый надосадочной жидкостью культуры (при анализе методом окрашивания ), в результате воздействия 72-Е 3. 1 показывает процент апоптоза ( ),который составил 9,84 . Фиг. 9 представляет собой график, показывающий эффект индуцирования апоптоза в клетках , оказываемый надосадочной жидкостью культуры (при анализе методом окрашивания ), в результате воздействия 11 С 8. 1 показывает процент апоптоза ( ),который составил 9,84 . Фиг. 10 представляет собой график, показывающий эффект индуцирования апоптоза в клетках -60, оказываемый надосадочной жидкостью культуры (при анализе методом окрашивания ), в результате воздействия надосадочной жидкости культуры 82, в качестве контрольного опыта. М 1 показывает процент апоптоза ( ), который составил 6,94 . Фиг. 11 представляет собой график, показывающий эффект индуцирования апоптоза в клетках -60, оказываемый надосадочной жидкостью культуры (при анализе методом окрашивания ), в результате воздействия 11 С 8. М 1 показывает процент апоптоза ( ),который составил 12,16 . Фиг. 12 А представляет собой график, показывающий результат анализа апоптоза (методом ) в системе сокультивирования клеток КМ-102 и -60, с использованием надосадочной жидкости культуры 9 С 5, в качестве контрольного опыта. Апоптозные клетки окрасились в черный или коричневый цвет. Ядерное окрашивание выполнялось метиловым зеленым, а увеличение составляет 100. Фиг. 12 В представляет собой цветную фотомикрографию, показывающую результат анализа апоптоза (методом ) в системе сокультивирования клеток КМ-102 и 60, с использованием надосадочной жидкости культуры 9 С 5, в качестве контрольного опыта. Апоптозные клетки окрасились в черный или коричневый цвет. Ядерное окрашивание выполнялось метиловым зеленым, а увеличение составляет 100 х. Фиг. 13 А представляет собой монохромную фотомикрографию, показывающую результат анализа апоптоза (методом ) в системе сокультивирования клеток КМ-102 и -60, с использованием надосадочной жидкости культуры 11 С 8. Здесь видно больше-положительных клеток, чем на фиг. 12. Апоптозные клетки окрасились в черный или коричневый цвет. Ядерное окрашивание выполнялось метиловым зеленым, а увеличение составляет 100. Фиг. 13 В представляет собой цветную фотомикрографию, показывающую результат анализа апоптоза (методом ) в системе сокультивирования клеток КМ-102 и 60, с использованием надосадочной жидкости культуры 11 С 8. Здесь видно больше-положительных клеток, чем на фиг. 12. Апоптозные клетки окрасились в черный или коричневый цвет. Ядерное окрашивание выполнялось метиловым зеленым, а увеличение составляет 100 х. Фиг. 14 представляет собой картину электрофореза, показывающую результаты анализа по методу - иммуноглобулина , выделенного из линий гибридом 723 и 11 С 8. Показаны маркеры молекулярной массы (, ), мышиный(аутентичный образец) в условиях отсутствия редукции (1), 72-3 (2), 11 С 8 (3), мышиный(аутентичный образец) в условиях редукции (4), 72-Е 3(5) и 11 С 8 (6). 5 6782 1 Фиг. 15 показывает результаты анализа экспрессии 47 методом проточной цитометрии с использованием клеток -60. Фиг. 16 показывает результаты анализа экспрессии 47 методом проточной цитометрии с использованием клеток . Фиг. 17 показывает результаты для(10 мкг/мл) в качестве контрольного опыта для демонстрации его апоптоз-индуцирующего эффекта в клетках 1210, подвергнутых трансфекции геномчеловека (1210-) (инкубация 72 часа). Фиг. 18 показывает апоптоз-индуцирующий эффект -1 (10 мкг/мл) в клетках 1210, подвергнутых трансфекции геномчеловека (1210-) (инкубация 72 часа). Фиг. 19 показывает апоптоз-индуцирующий эффект -2 (10 мкг/мл) в клетках 1210, подвергнутых трансфекции геномчеловека (1210-) (инкубация 72 часа). Фиг. 20 показывает результаты для(10 мкг/мл) в качестве контрольного опыта для демонстрации его апоптоз-индуцирующего эффекта в клетках(инкубация 48 часов). Фиг. 21 апоптоз-индуцирующий эффект -1 (10 мкг/мл) в клетках(инкубация 48 часов). Фиг. 22 апоптоз-индуцирующий эффект -2 (10 мкг/мл) в клетках(инкубация 48 часов). Фиг. 23 результаты для(10 мкг/мл) в качестве контрольного опыта для демонстрации его апоптоз-индуцирующего эффекта в клетках 1210, подвергнутых трансфекции геномчеловека (1210-) (инкубация 72 часа). Фиг. 24 показывает апоптоз-индуцирующий эффект фрагментов-2 (10 мкг/мл) в клетках 1210, подвергнутых трансфекции геномчеловека (1210-)(инкубация 72 часа). Фиг. 25 представляет собой картину электрофорезадля -фрагментов антитела-2. Фиг. 26 показывает заметно увеличенный период выживания после обработки -2. Фиг. 27 показывает результаты анализа(иммуносорбентный анализ с применением фиксированных ферментов) для Примера 5 (2). Фиг. 28 показывает заметно увеличенный период выживания после обработки 2 фрагментами антитела -2. Фиг. 29 представляет собой картину электрофорезадля 2 -фрагментов антитела -1 и антитела -2. Фиг. 30 показывает значительное увеличение уровней человеческогов мышиной сыворотке в группах, обработанных -1 и -2, что указывает на противоопухолевое действие этих антител. Наилучший способ осуществления изобретения. Получение моноклонального антитела. Моноклональные антитела по данному изобретению в целом могут быть получены способами, описанными ниже. То есть, моноклональные антитела по изобретению могут быть получены, например, путем использования человеческого интегринассоциированного белка в качестве сенсибилизирующего антигена, иммунизацией животных антигеном известными способами иммунизации, выполнением слияния клеток известными способами слияния клеток и клонированием известным способом клонирования. Более конкретно, предпочтительным способом получения моноклональных антител по изобретению является, например, способ, в котором рекомбинантные клетки клеточной линии мышиного лейкоза 1210, которые экспрессируют человеческий интегринассоциированный протеин, используют в качестве сенсибилизирующего антигена, клетки плазмы(иммуноциты) млекопитающих, иммунизированных антигеном, сливают с клетками миеломы млекопитающих, таких как мыши, результирующие слитые клетки (гибридомы) клонируют, клоны, продуцирующие антитела по изобретению, которые узнают вышеупо 6 6782 1 мянутые клеточные линии, отбирают из результирующих клонов и культивируют, и получают целевые антитела. Описанный способ является лишь одним из возможных примеров осуществления изобретения например, сенсибилизирующий антиген не ограничивается вышеупомянутыми рекомбинантными клетками 1210, а может представлять собой сам человеческий интегринассоциированный белокиличеловека в растворимой форме целевые моноклональные антитела, которые вызывают апоптоз ядросодержащих клеток крови(миелоидных клеток и лимфоцитов), могут быть получены тем же способом, что и в рекомбинантных клетках 1210, упомянутых выше. Для получения целевого моноклонального антитела из библиотеки кДНК для антитела может также использоваться технология фагового отображения. Млекопитающие для иммунизации сенсибилизирующим антигеном в способе получения моноклональных антител особо не ограничиваются, но предпочтительно их выбирают из соображений их совместимости с миелоидными клетками, используемыми для слияния клеток, и для этой цели обычно пригодны мыши, крысы, хомяки и т.п. Иммунизация предпочтительно выполняется стандартным способом. Например, рекомбинантные клетки 1210, выражающие человеческий интегринассоциированный протеин, вводятся животному путем внутрибрюшинной инъекции и т.п. Более конкретно,соответствующий раствор или суспензию с(фосфатно-солевым буферным раствором) или физиологическим раствором предпочтительно вводят животному несколько раз с 10-дневными интервалами. Используемыми иммуноцитами, предпочтительно, являются клетки селезенки, извлеченные после последнего введения клеток. Клетками миеломы млекопитающих, используемыми в качестве родительских клеток для слияния с иммуноцитами, могут быть любые из различных клеточных линий, известных в данной области, например, Р 3 (3638.653) . ., 123, 1548 (1978), 3-1, 81, 1-7 (1978), -1 . . ., 6,511-519 (1976), -11 , 8, 405-415 (1976), 2/0-14 , 276, 269-270 (1978), . . ., 35, 1-21 (1980), 194 . . ., 148, 313-323 (1978) и 210 , 277, 131-133 (1979). Слияние иммуноцитов и миелоидных клеток может выполняться на основе традиционных способов, таких как способ.., 73, 3-46(1981). Более конкретно, клеточное слияние выполняют, например, в обычной питательной среде в присутствии промотора слияния. Промотором слияния может быть, например, полиэтиленгликоль , вирус Сендайи т.п., а кроме того, если это желательно,может добавляться адъювант, такой как диметилсульфоксид, чтобы увеличить эффективность слияния. Иммуноциты предпочтительно используют в 1-10-кратном количестве,превышающем количество миеломных клеток. Среда для клеточного слияния может представлять собой, например, среду -1640, средуи т.п., которые пригодны для роста клеточных линий миеломы, или другие среды, обычно используемые для такого клеточного культивирования она может также использоваться в сочетании с сывороточной добавкой, такой как околоплодная сыворотка теленка . Слияние клеток проводят путем тщательного перемешивания предписанных количеств иммуноцитов и миеломных клеток в среде, добавления к этой среде раствора ,подогретого до 37 С, гдеимеет среднюю молекулярную массу, например, около 1000-6000, например, как правило, при концентрации 30-60(м/о), и перемешивания. Затем добавляют подходящую среду, и надосадочную жидкость, полученную путем центрифугирования, удаляют. Эту процедуру повторяют для получения целевых гибридом. Гибридомы селекционируют путем культивирования в обычной селекционной среде,такой как среда(среда, содержащая гипоксантин, аминоптерин и тимидин). Культивирование в средепродолжают в течение времени, достаточного для гибели всех клеток, отличных от целевых гибридом (всех неслитых клеток), что составляет обычно от 7 6782 1 нескольких дней до нескольких недель. Затем применяют обычный способ ограничительного разбавления для скрининга и моноклонирования гибридом, продуцирующих целевые антитела. Гибридомы, полученные таким образом, которые продуцируют моноклональные антитела по изобретению, могут быть субкультивированы в обычной среде и могут быть помещены на длительное хранение в жидкий азот. Для получения моноклональных антител по изобретению из гибридом могут применяться любые подходящие способы, такие как способ, в котором гибридомы могут культивироваться по стандартным методикам, а антитела могут получаться из надосадочных жидкостей культур или, в альтернативе, способ, в котором гибридомы могут вводиться совместимым млекопитающим для пролиферации, а антитела затем могут получаться из их асцитических жидкостей. Первый способ пригоден для получения высокоочищенных антител, в то время как второй способ более пригоден для массового производства антител. Антитела, получаемые вышеупомянутыми способами, могут иметь высокую степень очистки, получаемую стандартными способами очистки, такими как высаливание, гельфильтрация, аффинная хроматография и т.д. Фрагменты моноклональных антител. Моноклональные антитела по данному изобретению могут представлять собой целые антитела, описанные выше, или их фрагменты. То есть, они могут представлять собой любые фрагменты моноклонального антитела по изобретению, которые специфически распознают человеческий интегринассоциированный белок и вызывают апоптоз ядросодержащих клеток крови (миеломных клеток и лимфоцитов), содержащих человеческий интегринассоциированный белок. Такие фрагменты включают , 2,и т.д. Эти фрагменты могут быть получены путем расщепления энзимом, например, папаином, пепсином, фицином и т.п. Свойства полученных фрагментов могут быть подтверждены способом, описанным выше. Пептиды и низкомолекулярные соединения, выполняющие ту же функцию, что и моноклональные антитела. Моноклональные антитела, описанные выше, которые распознают человеческий интегринассоциированный белок и вызывают апоптоз ядросодержащих клеток крови, также включают пептиды и низкомолекулярные соединения, подобным образом распознающиеи вызывающие апоптоз ядросодержащих клеток крови. Свойства моноклональных антител по изобретению. Как описано конкретно в каждом из следующих примеров, моноклональные антитела по изобретению специфически распознают человеческий интегринассоциированный белок. Моноклональные антитела по изобретению также вызывают апоптоз ядросодержащих клеток крови (миеломных клеток и лимфоцитов) с интегринассоциированным белком человека. Эти свойства могут использоваться для получения терапевтических агентов, полезных для лечения миелоидного лейкоза и лимфоидного лейкоза. Таким образом, нетрудно понять, что создание специфических систем, включающих использование моноклональных антител по изобретению в качестве антител, специфически узнающих антиген, который вызывает апоптоз ядросодержащих клеток крови, для различения и идентификации этих антигенов, или использование уникальных свойств моноклональных антител как терапевтических агентов для лечения миелоидного лейкоза и лимфоидного лейкоза, а также любые модификации и способы применения такой системы также входят в область данного изобретения настолько, насколько они могут осуществляться при помощи стандартных методик, хорошо известных специалистам в данной области. Противолейкозные агенты. Противолейкозный агент по данному изобретению базируется на том факте, что действиеактивизируется путем связывания с антителом и т.п. по изобретению. В то вре 8 6782 1 мя, как особых ограничений на дозировки антитела по изобретению не существует, предпочтительно они лежат в диапазоне от 5 мкг до 500 мг/кг. Далее изобретение будет описано более подробно при помощи нижеследующих примеров однако изобретение не ограничивается этими примерами. Пример 1 (Получение моноклонального антитела).(1) Сенсибилизирующий антиген и способ иммунизации. Сенсибилизацию антигена выполняли с использованием рекомбинантной клеточной линии в качестве сенсибилизирующего антигена, которая представляла собой клетки 1210, подвергнутые трансфекциии экспрессирующие продукт в большом количестве. Клетки 1210 получали из клеточной линии лейкозных клеток , полученных от мыши ( . -219, . .. 10179-192, 1949). Путем(полимеразной цепной реакции) с использованием праймера с характерной длячеловека последовательностью (смысловой праймер) и кДНК, полученной из мРНК клеточной линии -60 ( , .) в качестве матрицы (фиг. 1). Продуктсубклонировали в клонирующий вектор - ( ) и использовали для трансформации 109 .(., .), и, после подтверждения нуклеотидной последовательности ДНК-вставки при помощи ДНКсеквенатора (ДНК-секвенатор 373 А, выпускаемый фирмой ), ее субклонировали вектором экспрессии 1. Экспрессионный вектор 1 является производным - (, 18, 5322, 1990) и представляет собой вектор, полученный путем субклонирования неомицин-устойчивого гена с использованием в качестве промотора/энхансена фактора 1 элонгации человека. Этот субклонированный вектор экспрессиичеловека использовали для введения гена в клеточную линию 1210 с - (/), селекцию выполняли при помощи генетицина (конечная концентрация 1 мг/мл, производство/), и клетки 1210 с введенным геном клонировали способом серийного разбавления. Экспрессию антигена в полученных клонах исследовали с использованием антитела к 47, распознающегочеловека , и клоны с высокими уровнями экспрессии отобрали в качестве антиген-сенсибилизированных клеток (фиг. 2, 3). Для культивирования рекомбинантных клеток 1210 использовали в качестве среды 10 околоплодную сыворотку теленка (, производство.) и среду Дульбекко, модифицированную по способу Исков(/), и субкультивировали клетки в инкубаторе с 52 при температуре 37 . Используемыми иммунизированными животными были мыши ВА/2 (выведенные, ) той же линии, что и клетки 1210. Клетки 1210, подвергнутые трансфекции геном интегринассоциированного белкачеловека, используемые для сенсибилизации антигеном, инкубировали около 30 минут с митомицином С (., .) при концентрации 200 мкг/мл, и после приостановки роста клеток митомицин С тщательно отмыли перед суспендированием в . Клетки ввели мышам внутрибрюшинно три раза с интервалами около 10 дней, приблизительно по 5106 клеток каждый раз. После третьей иммунизации взяли кровь из глазницы, сыворотку разбавили в 50 раз , содержащим 1(альбумина бычьей сыворотки), и связывание между разбавленной сывороткой и рекомбинантными клетками 1210, используемыми для сенсибилизации антигеном, подтвердили путем поточной цитометрии (, ,) (фиг. 4) мышь, имеющую наилучшую антисывороточную активность, подвергли усиленной иммунизации путем внутрибрюшинного введения 1107 клеток через 5 дней после четвертой иммунизации. Через четыре дня после последней иммунизации мышь умертвили и извлекли селезенку. 9(2) Слияние клеток. После разрезания извлеченной из мыши селезенки на тонкие слои диссоциированные клетки селезенки центрифугировали и затем суспендировали в среде , позволили всплыть и тщательно промыли. Отдельно культивировали линию клеток мышиной миеломы 3-1, 81, 1-7 (1978) в среде ,содержащей 10 зародышевой бычьей сыворотки (, производство.), и после такого же промывания средой 1107 клеток поместили в центрифужную пробирку в смеси с 5107 клеток селезенки и подвергли клеточному слиянию по стандартной методике . . ., 42, 458-462 (1980), с использованием полиэтиленгликоля 4000 (., ). Полученные слитые клетки суспендировали в среде , содержащей 10 и агент стимуляции роста слитых клеток (- 1, производство), и распределили в 96-луночном планшете для культивирования в инкубаторе с 52 при 37 . На следующий день клетки поместили в селекционную среду, а затем в средус 10, содержащую агент стимуляции роста, и затем продолжали культивирование для поддержания роста. Чтобы исследовать действие надосадочной жидкости культуры этих слитых клеток на лейкозные клеточные линии, среду для слитых клеток заменили средой , содержащей 10, и продолжали культивирование для поддержания роста.(3) Скрининг. Последующий скрининг выполняли с использованием надосадочной жидкости культуры вышеупомянутых слитых клеток. 1 Первичный скрининг. Клетки стромальной клеточной линии мышиной селезенки (клетки -1), подвергнутые трансфекции геном интегринассоциированного протеиначеловека (рекомбинантные клетки, в которые была субклонирована та же плазмида, что и плазмида,используемая для получения клеток 1210, выражающихчеловека, для сенсибилизации антигеном), засеяли в 96-луночную пластину с концентрацией 1104 клеток на лунку и культивировали в течение ночи, после чего зафиксировали 2(периодат-лизинпараформальдегидом) для подготовки пластины . После промывки пластину подвергли блокированию в течение 1 часа при комнатной температуре с использованием 1 раствора , и после дополнительной промывки добавили 50 мкл надосадочной жидкости культуры каждой гибридомы для инкубации при комнатной температуре в течение 1 часа. После промывки добавили противомышиный(.),меченный щелочной фосфатазой, перед инкубацией при комнатной температуре в течение 1 часа. После промывки добавили субстрат 104 (- ) для получения конечной концентрации 1 мг/мл, продолжили инкубацию при комнатной температуре и измерили удельную активность с помощью микропланшетного считывателя( 3550, производство ..). В результате среди гибридом, высеянных в 2880 лунках, было подтверждено наличие гибридом в 2089 лунках, при этом 187 лунок оказались положительными при первичном скрининге. По 50 мкл мышиного 1 в качестве отрицательного контрольного опыта и антитела к человеческому 47 ( ) в качестве положительного контрольного опыта добавили при концентрации 3 мкг/мл, соответственно, перед инкубацией при комнатной температуре в течение 1 часа. 2 Вторичный скрининг. Клоны, признанные положительными в первичном скрининге, подвергли анализу системойс использованием клеток -1, выражающих интегринассоциированный белок человека, где отрицательным контрольным опытом были клетки -1, подвергнутые трансфекции только вектором экспрессии 1, чтобы оценить путем скрининга, распознают ли специфически антитела, продуцируемые гибридомами,человека. 10 6782 1 Положительный результат был подтвержден для 21 из 187 лунок, признанных положительными в первичном скрининге. Таблица 1 показывает характерный пример специфического связываниячеловека с 72 и 11 С 8 в показателях поглощения при . Таблица 1. Анализспецифического связывания надосадочных жидкостей гибридом счеловека Необработанные данные 3 Третичный скрининг. Клоны, признанные положительными при вторичном скрининге, подвергли тесту на ингибирование роста с использованием клеток(линия Т-клеточной лимфомы человека) и клеток 77 (линия клеток миеломы человека). 100 мкл клетокпри концентрации 5103 клеток на лунку и клеток 77 при концентрации 1104 клеток на лунку высеяли в каждую лунку 96-луночного планшета, и к клеточным суспензиям добавили 5 или 10 мкл надосадочной жидкости культуры гибридомных клонов. После культивирования в течение около 2 дней количество клеток измерили путем анализа . В качестве контрольного опыта добавили по 5 или 10 мкл среды , содержащей 10, и надосадочных жидкостей культур клонов, которые были признаны отрицательными в первичном скрининге (82 и 9 С 5). Фиг. 5 и 6 показывают результаты ингибирования роста, оказываемого четырьмя характерными клонами 11 С 8, 72-3 (субклон 72), 131 и 212.(4) Свойства антител. 1 Иммуноглобулиновые типы надосадочных жидкостей культур 11 С 8, 72-3, 131 и 212 исследовали с использованием системы . В частности, клетки -1, экспрессирующие интегринассоциированный протеинчеловека, высеяли в 96-луночный планшет для подготовки планшет дляи затем добавили по 50 мкл каждой надосадочной жидкости культуры, ввели во взаимодействие с меченным щелочной фосфатазой антителом против мышиного(.) или антитела против мышиного( ., .) в качестве вторичных антител и измерили активность при помощи микропланшетного считывателя. В результате 11 С 8 и 72-3 были подтверждены как ,131 и 212 были подтверждены как . 2 ДНК-фрагментацию двух клонов 11 С 8 и 72-3 из четырех клонов, описанных выше, анализировали путем проточной цитометрии (, производство ,) с использованием клетоки клеток -60. Клеткииспользовали для 11 С 8 и 72-3, а клетки -60 использовали для 11 С 8. Клеткии клетки -60 высеяли в 12-луночную пластину при концентрации 4104 клеток на лунку/2 мл, соответственно, и добавили 200 мкл надосадочных жидкостей культур 72-3 и 11 С 8. Клетки культивировали 2 дня и затем измерили их количество. В качестве контрольного опыта добавили надосадочную жидкость культуры 82 в равном объеме. Клетки извлекли из пластины для культивирования и зафиксировали клеточные гранулы при 200 в течение 60 минут при 4 в 2 мл охлажденного 70 этанола. Затем клетки центрифугировали, промыли в 1 мли пересуспендировали в 0,5 мл . К 0,5 мл пробе клеток добавили 0,5 мл РНазы (Тип -А, - , . 1 мг/мл в ). Смешанные клетки инкубировали 60 минут в темном помеще 11 6782 1 нии при 37 , а затем выдержали в темном помещении при 4 и измерили путем поточной цитометрии. Как показано на фиг. 7-9 и 10-11, надосадочные жидкости культур 72-3 и 11 С 8 увеличивают долю апоптозных клеток среди клеток ,надосадочная жидкость культуры 11 С 8 увеличивают долю апоптозных клеток среди клеток -60, соответственно. 3 Надосадочные культуральные жидкости 11 С 8 использовали в системе сокультивирования с клетками -60 с использованием питающего подслоя клеток линии миелоидных стромальных клеток человека КМ 102, чтобы определить, вызывают ли эти надосадочные жидкости культур апоптоз клеток -60. В частности, клетки КМ 102 засеяли в 2-луночную пластинку (. ) и довели до субконфлюентного состояния высеяли в них 1105 клеток -60 и культивировали около суток, после чего несвязанные клетки -60 удалили. Одновременно добавили вышеупомянутые надосадочные культуральные жидкости с получением конечной концентрации 10 и культивировали клетки в течение 2 дней. После культивирования клетки зафиксировали 10 формалином, и методом( , производство.) обнаружили клетки -60 с индуцированным апоптозом. Как показано на фиг. 12 и 13, надосадочная жидкость культуры 11 С 8 больше увеличивает апоптоз клеток -60, чем надосадочная жидкость культуры 9 С 5,которая является надосадочной жидкостью культуры клона нереактивной гибридомычеловека, используемой в качестве контрольного опыта.(5) Очистка антител. Для очистки антител, продуцируемых гибридомами, клеточные линии -продуцирующих клонов 72-3 и 11 С 8 из вышеперечисленных линий гибридом вводили внутрибрюшинно по стандартной методике мышам // (самцы, выведенные, ), получавшим пристан. Через несколько недель отобрали образовавшуюся асцитическую жидкость, отделили антитела и очистили стандартными способами. В частности, антитела выделили из полученной асцитической жидкости при помощи пластиковой колонки с протеином(.) и диализировали с(.) полосы подтвердили путем анализа -. Как показано на фиг. 14, электрофорез с использованием аутентичного образца мышиного( .) в качестве контрольного образца подтвердил полосы длядля клонов 72-3 и 11 С 8 в тех же положениях, что и для аутентичного образца мышиногокак в условиях отсутствия редукции, так и в условиях редукции. В этом примере клетки 1210, экспрессирующие интегринассоциированный белок человека, использовались в качестве сенсибилизирующего антигена в иллюстративных целях, однако возможно также получение моноклональных антител аналогичным способом с использованием других клеток, экспрессирующихчеловека, или самогочеловека, а также получение моноклональных антител из библиотеки антител посредством метода отображения фагов данное изобретение не ограничивается вышеупомянутыми моноклональными антителами, а включает все моноклональные антитела, обладающие подобными им свойствами, и все гибридомы, продуцирующие такие моноклональные антитела. Кроме того, изобретение этих моноклональных антител также включает гуманизированные антитела, человеческие антитела, химерические антитела, одноцепочечные антитела, приматизированные антитела и фрагменты антител, полученные путем расщепления антител различными ферментами (папаин, пепсин, фицин и т.д.). Гибридомы, продуцирующие моноклональные антитела против интегринассоциированного белкачеловека, представляют собой новые слитые клетки, созданные из клеток селезенки мышии клеточной линии миеломы мышей 3-1 в качестве родительских клеток антитело к(мышиная гибридома 118-8 (субклон 11 С 8), обозначено как -1) депонировано какВР-6100, а антитело к(мышиная гибридома 72-3 (субклон 72), обозначено как -2) - какВР-6101 01.09.1997 в Национальном институте биологии и технологии человека Управления технических наук 12 6782 1 и технологии Министерства международной торговли и промышленности, размещенного по адресу 1-31-, -, -, , как зарегистрированном депозитарии общедоступных микроорганизмов. Пример 2 (Идентификация подкласса антител -1 и -2). Для идентификации подклассов антител -1 и -2, полученных, как описано выше, по 500 мкл -1 и -2, доведенных до концентрации 100 нг/мл, исследовали в виде пятен посредством набора для определения изотипа , при помощи которого определили, что -1 представляет собой 1, к,-1 представляет собой 2, к. Пример 3 (клетки человеческого лейкоза, экспрессирующиечеловека).-экспрессию в различных линиях лейкозных клеток человека определяли методом проточной цитометрии с распознающимчеловека антителом против -47 (серийно выпускаемый продукт). Это антитело использовали для обнаружения по той причине, чточеловека предположительно идентичен 47 (. ., 304, 525-530, 1994). Используемыми клеточными линиями были клеткии -60 (клетки К 562, клетки 77, клеткии клетки ). Клетки использовали в количестве 2105 клеток на пробу, а антитело к 47 инкубировали с клетками при конечной концентрации 5 мкг/мл в качестве вторичного антитела использовали антитело против мышиного , меченное(,). Мышиное 1 антитело (.) использовали в качестве контрольного опыта. Результаты поточной цитометрии, показанные на фиг. 15 (-60) и фиг. 16 , подтверждают, что обе клеточные линии экспрессируют . Пример 4 (Апоптозное действие).(1) Апоптоз-индуцирующую активность антител -1 и -2 на клетках 1210, подвергнутых трансфекции геномчеловека, клеткахи клетках -60 исследовали с использованием аннексина- ( ). Результаты анализа с аннексином- показаны на фиг. 17-22, где пятна в левой нижней области показывают живые клетки, пятна в правой нижней области показывают апоптозные клетки, а пятна в правой верхней области показывают некротические клетки. Используемые антитела представляли собой мышиный(.) в качестве контрольного опыта и-1 и -2 при концентрации 10 мкг/мл, и после инкубации в течение 72 часов 4103 клеток 1210, подвергнутых трансфекции геномчеловека, и инкубации в течение 48 часов 6104 клетоких проанализировали с аннексином-. Наблюдалась гибель клеток, как показано на фиг. 17-22. Для клеток -60 использовали 10 мкг/мл -1, и анализ посредством аннексина- при 1105 клеток также показал гибель клеток.(2) Исследовали апоптоз-индуцирующую активность -фрагментов антитела -2 в клетках 1210, подвергнутых трансфекции геномчеловека. В частности, клетки 1210, подвергнутые трансфекции геномчеловека, культивировали при концентрации 4103 клеток,-фрагменты антитела -2 и мышиныйв качестве контрольного опыта использовали при концентрации 10 мкг/мл. Клетки инкубировали в течение 72 часов и провели измерение с аннексином-. В результате наблюдалась гибель множества клеток (фиг. 23, 24). -фрагменты антитела -2, используемые для эксперимента, получили путем расщепления антитела папаином ( , .) и их очистки. -фрагменты антитела -2 анализировали посредством электрофореза с(фиг. 25). Пример 5 (Исследование апоптоза).(1) Лекарственная эффективность -1 и -2 (полный ). Клетки КРММ 2, экспрессирующиечеловека (линия миеломных клеток человека),трансплантировали мышам , и на 10-й день после трансплантации ввели -1 и 13-2 (полный ) путем однократной внутривенной инъекции дозами по 5 мкг/особь и 50 мкг/особь, соответственно (5) на 28-й день после трансплантации КРММ 2 уровни человеческого , полученного из КРММ 2, измерили посредствоми подтвердили его исчезновение. Также исследовали период выживания. Результаты показали заметную супрессию уровня человеческогов крови в группах, обработанных -1 и -2, что указывает на противоопухолевое действие этих антител (рис. 30). Период выживания также оказался заметно увеличенным (фиг. 26). 2-фрагменты, полученные путем расщепления антител -1 и -2 пепсином и очистки протеином( , .), использовали для исследования противоопухолевого действия, за исключением цитотоксического действия через -области. В частности, клетки КРММ 2, экспрессирующиечеловека (линия миеломных клеток человека), трансплантировали мышам , и 2-фрагменты -1 и -2 ввели внутривенно группам мышей дозами по 100 мкг/особь на 6-й и 10-й день после трансплантации, а также группам мышей дозами по 10 мкг/особь и 30 мкг/особь на 6-й, 8-й и 10-й день после трансплантации, соответственно уровни человеческого , полученного из КРММ 2, измерили посредствомна 30-й день после трансплантации (фиг. 27). Также исследовали период выживания в течение 90 дней после трансплантации. Результаты показали заметный эффект супрессии уровнячеловека в крови в группах, обработанных -1 и -2, что свидетельствует о противоопухолевом действии. Период выживания также заметно увеличился (фиг. 27). Фиг. 29 показывает картину электрофорезадля 2-фрагментов антитела -1 и антитела -2. Моноклональные антитела по данному изобретению представляют собой антитела,специфически распознающие интегринассоциированный протеин человека и антигены,которые индуцируют апоптоз ядросодержащих клеток крови, содержащих интегринассоциированный протеин человека. Таким образом, они полезны в качестве антител, распознающих интегринассоциированный протеин человека, для его различения и идентификации, и в то же время они обладают активностью вызывать апоптоз ядросодержащих клеток крови эти свойства могут быть использованы для получения полезных терапевтических агентов для лечения миелоидного лейкоза и лимфоидного лейкоза. Фиг. 30 Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: A61P 35/02, C12N 5/20, C07K 16/28, A61K 39/395
Метки: продуцирующая, моноклональное, fab-фрагменты, противолейкозный, основе, агент, антитело, гибридома
Код ссылки
<a href="https://by.patents.su/18-6782-monoklonalnoe-antitelo-ego-fab-fragmenty-gibridoma-produciruyushhaya-monoklonalnoe-antitelo-i-protivolejjkoznyjj-agent-na-ego-osnove.html" rel="bookmark" title="База патентов Беларуси">Моноклональное антитело, его Fab-фрагменты, гибридома, продуцирующая моноклональное антитело, и противолейкозный агент на его основе</a>
Предыдущий патент: Способ заготовки зерносилоса
Следующий патент: Способ диагностики начальных стадий сердечной недостаточности
Случайный патент: Способ реконструкции пищеварительного тракта при химическом ожоге эзофагогастродуоденоеюнального комплекса