Способ определения активности фосфолипазы A2 и тестирования эффектора её липолитической активности
Номер патента: 12191
Опубликовано: 30.08.2009
Авторы: Николаевич Василий Александрович, Шарко Ольга Леонидовна, Кисель Михаил Александрович
Текст
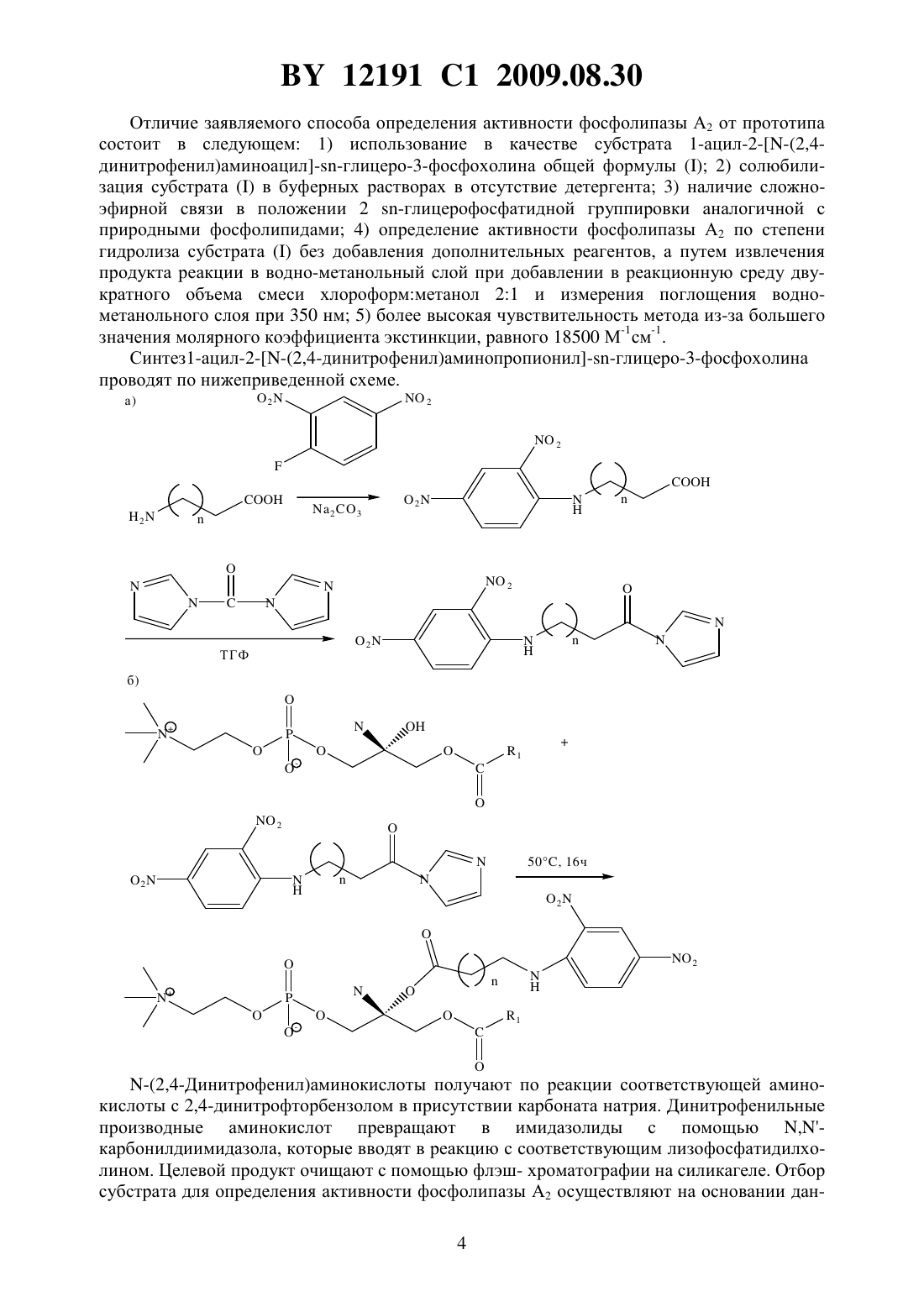
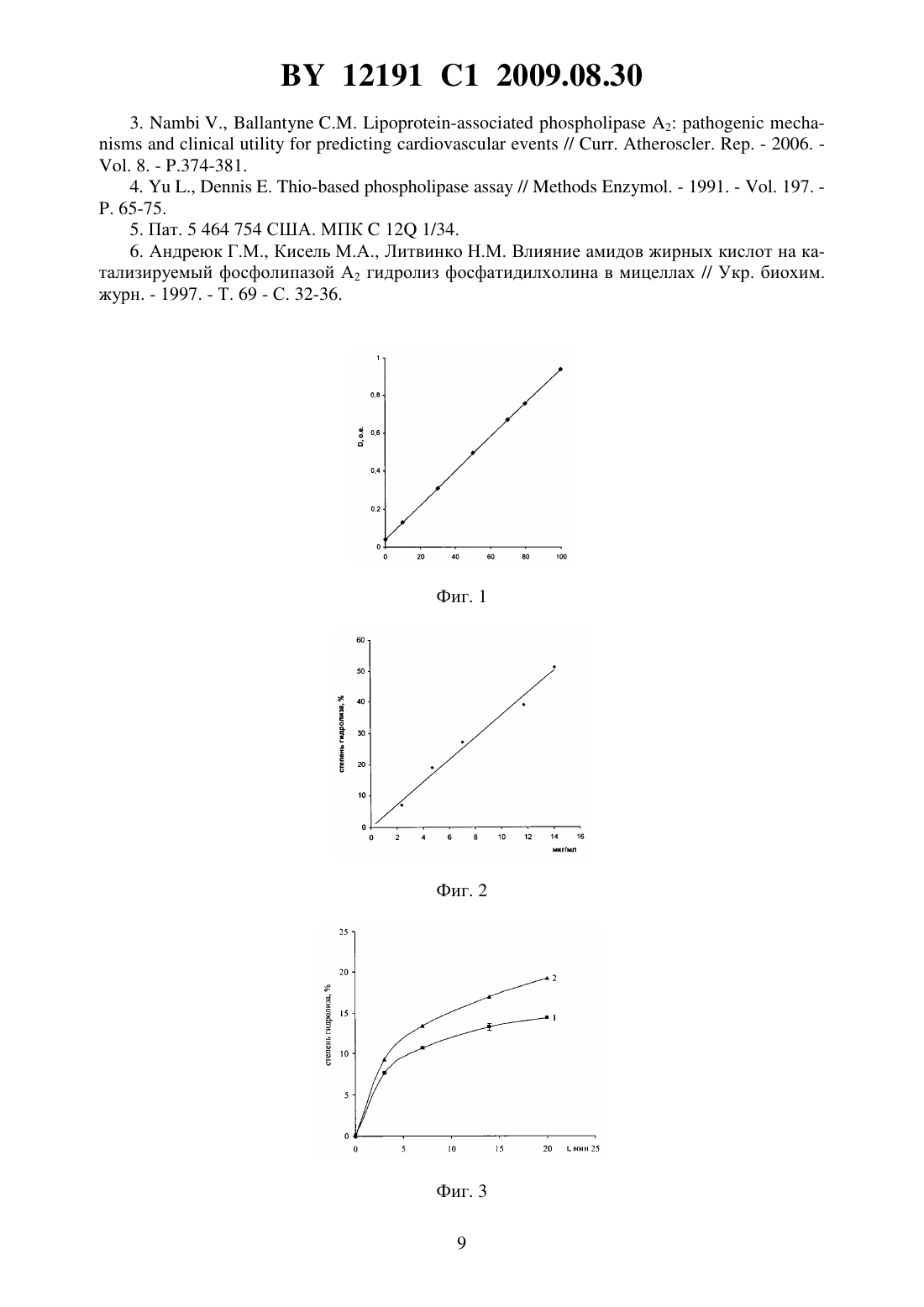
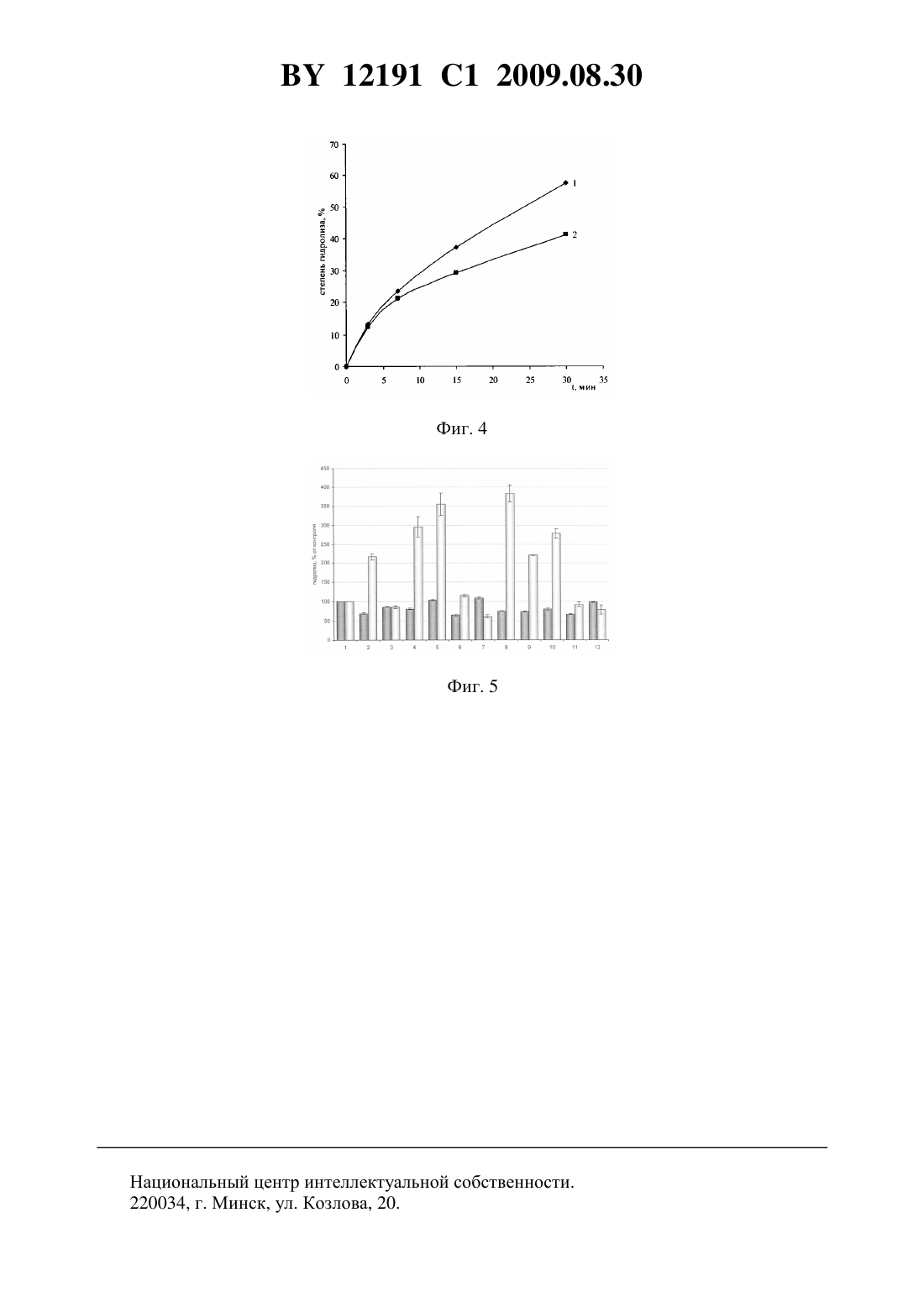
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФОСФОЛИПАЗЫ 2 И ТЕСТИРОВАНИЯ ЭФФЕКТОРА ЕЕ ЛИПОТИЧЕСКОЙ АКТИВНОСТИ(71) Заявитель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(72) Авторы Шарко Ольга Леонидовна Николаевич Василий Александрович Кисель Михаил Александрович(73) Патентообладатель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(57) 1. Способ определения активности фосфолипазы А 2 по степени гидролиза субстрата,отличающийся тем, что в качестве субстрата используют 1-ацил-2(2,4 динитрофенил)аминоацилглицеро-3-фосфохолин общей формулы 2 где- насыщенный линейный углеводород, содержащий 13-19 атомов углерода или ненасыщенный линейный углеводород, содержащий 17 атомов углерода,0 или 1, причем субстрат солюбилизируют в буферном растворе, содержащем соли кальция, добавляют водный раствор фосфолипазы А 2, реакционную смесь инкубируют, останавливают реакцию добавлением двукратного объема смеси хлороформметанол 21, отделяют центрифугированием водно-метанольный слой, определяют его оптическую плотность при 350 нм и рассчитывают степень гидролиза субстрата. 2. Способ тестирования эффектора активности фосфолипазы А 2, заключающийся в том, что определяют активность фосфолипазы А 2 по степени гидролиза субстрата по п. 1 в присутствии или в отсутствии эффектора, и при уменьшении или увеличении активности фосфолипазы А 2 в присутствии эффектора тестируют эффектор как ингибитор или активатор активности фосфолипазы А 2 соответственно. 12191 1 2009.08.30 Изобретение относится к области биоорганической химии, а именно к способу определения активности фосфолипазы А 2 с помощью 1-ацил-2(2,4-динитрофенил)аминоацилглицеро-3-фосфохолина и его применения для тестирования эффекторов ее липолитической активности. Изобретение может быть использовано в энзимологии, биотехнологии и медицине, например, для определения активности фосфолипазы А 2 в биологических жидкостях с целью поиска новых источников фермента и при диагностике панкреатита, воспалений, риска развития инсульта и коронарного атеросклероза, а также отбора эффекторов липолитической активности как потенциальных лекарственных соединений. Фосфолипазы А 2 представляют собой группу близких по действию ферментов, которые катализируют гидролиз сложноэфирной связи в положении 2 у глицерофосфолипидов, при этом образуются свободная жирная кислота и лизофосфолипид 1. Фосфолипазы А 2 находят широкое применение в полусинтетических методах получения уникальных липидов и в качестве инструмента в биохимических исследованиях. В последние годы определенное значение в диагностике придают исследованию концентрации фосфолипазы А 2 в крови и моче, что обусловлено существенной ролью этого фермента в патогенезе острого и хронического панкреатитов 2. Анализ содержания в крови фосфолипазы А 2 типа 1 характеризуется высокой чувствительностью (до 100 ) и специфичностью (до 90 ) для панкреатитов и коррелирует со степенью заболевания. Активность липопротеинассоциированной фосфолипазы А 2 является независимым предиктором инсульта и ишемической болезни сердца 3. Ингибиторы фосфолипаз А 2 рассматриваются как потенциальные лекарственные средства для профилактики и лечения указанных болезней 1. Известен ряд методов определения активности фосфолипаз А 2 с применением субстратов природного происхождения (фосфолипидные экстракты яичного желтка и мембран, очищенного фосфатидилхолина из яичных желтков и др.) и близких к ним по структуре и свойствам изотопно-меченных фосфолипидов 1. Первую группу составляют методы, основанные на регистрации отщепляющейся жирной кислоты путем измерения закисления реакционной среды или расходования щелочи на титрование кислоты. Недостатками методов этой группы являются необходимость использования высоких концентраций субстрата и фермента, отклонение от оптимума рН в ходе реакции или накопление поверхностно-активной соли жирной кислоты, искажающей энзимологический профиль процесса, завышение величины активности в присутствии липаз, фосфолипаз С ив исследуемом образце. Вторая группа методов основана на экстракции реакционной среды после проведения реакции смесью хлороформ-метанол (21), разделении липидов с помощью тонкослойной хроматографии, снятии пятен непрореагировавшего субстрата и продуктов реакции с хроматограммы и определении соотношения продуктов и исходного субстрата по содержанию в них фосфора или радиоактивности (в случае использования изотопно-меченного субстрата). Недостатки этих методов - трудоемкость в исполнении и продолжительность во времени. Существует группа методов определения активности фосфолипазы 2, в которых используются флуоресцентномеченные или спинмеченные аналоги субстрата, активность при этом регистрируется по изменению параметров спектров флуоресценции и ЭПР. Эти методы отличаются быстротой получения необходимой информации, но требуют применения дорогостоящего субстрата и специального оборудования. Кроме того, изменение надмолекулярной организации субстрата (мицелл или липосом), происходящее в ходе реакции, может существенно сказываться на спектрах флуоресценции и ЭПР, чувствительных к изменению свойств окружения метки. Еще одна группа методов основана на связывании отщепляющейся в процессе реакции жирной кислоты катионным красителем или гемоглобином, что сопровождается изменением их спектральных параметров. Существенным недостатком этой группы методов 2 12191 1 2009.08.30 является введение в реакционную среду репортерных соединений, препятствующих тестированию эффекторов анионного характера. Наиболее близким к заявляемому способу определения активности фосфолипазы А 2 является способ на основе тиоэфирных аналогов фосфатидилхолина (прототип) 4, 5. В процессе гидролиза тиоэфирных аналогов фосфатидилхолина генерируется лизофосфолипид, содержащий меркаптогруппу, который далее анализируется с помощью дитио-бисдинитробензойной кислоты (реактива Эллмана). Сущность метода определения активности фосфолипазы А 2 с помощью тиоэфирного аналога фосфатидилхолина заключается в следующем. К мицеллам, сформированным из тиоэфирного аналога фосфатидилхолина и детергента тритона Х-100 (12 моль/моль) в буферном растворе (80 мМ , рН 7,4, 150 мМ , 10 мМ СаС 2 и 1 мг/мл бычьего сывороточного альбумина), содержащем 30 глицерина, добавляют фосфолипазу А 2 и реакционную смесь инкубируют в течение 1 ч при 37 С. Затем добавляют дитио-бисдинитробензойную кислоту (реактив Эллмана) и ЭГТА, через 3 мин измеряют оптическую плотность при 405 нм. Для расчета концентрации образующегося продукта (2 тиолизофосфатидилхолина) используют коэффициент молярной экстинкции 12800 М-1 см-1,по величине которой определяют активность фермента. Недостатки этого метода 1) трудоемкость получения тиоэфирного аналога фосфатидилхолина (получают в 9 стадий с выходом около 2 ) и, как следствие, его высокая стоимость 2) необходимость применения для его солюбилизации детергента тритона Х 100 3) неприродная структура гидролизуемой связи 4) невозможность тестирования реакционноспособных эффекторов, например, -бромфенацилбромида, из-за высокой нуклеофильности меркаптогруппы, генерируемой в ходе реакции 5) необходимость добавления хромофор-генерируемого реагента после завершения реакции 6) низкий коэффициент экстинкции измеряемого хромофора. Цель изобретения - способ определения активности фосфолипазы А 2 и тестирования эффекторов ее липолитической активности путем использования хромогенного субстрата 1-ацил-2(2,4-динитрофенил)аминоацилглицеро-3-фосфохолина общей формулы 2 где 1 - насыщенный линейный углеводород, содержащий 13-19 атомов углерода или ненасыщенный линейный углеводород, содержащий 17 атомов углерода,0 или 1. Поставленная цель достигается с помощью заявляемого субстратапри его использовании для определения активности фосфолипазы А 2 по заявляемому способу, включающему солюбилизацию субстрата в буферном растворе, содержащем соли кальция,внесение водного раствора фосфолипазы А 2, инкубацию реакционной смеси при перемешивании, остановку реакции добавлением двукратного объема смеси хлороформметанол 21, отделение центрифугированием водно-метанольного слоя, определение его оптической плотности при 350 нм и расчет степени гидролиза субстрата. Заявляемый способ может быть использован для тестирования эффектора активности фосфолипазы А 2 путем определения активности фосфолипазы А 2 по степени гидролиза субстратав присутствии или в отсутствии эффектора и тестировании эффектора как ингибитора или активатора активности фосфолипазы А 2 при уменьшении или увеличении активности фосфолипазы А 2 соответственно. 3 12191 1 2009.08.30 Отличие заявляемого способа определения активности фосфолипазы А 2 от прототипа состоит в следующем 1) использование в качестве субстрата 1-ацил-2(2,4 динитрофенил)аминоацилглицеро-3-фосфохолина общей формулы 2) солюбилизация субстратав буферных растворах в отсутствие детергента 3) наличие сложноэфирной связи в положении 2 -глицерофосфатидной группировки аналогичной с природными фосфолипидами 4) определение активности фосфолипазы А 2 по степени гидролиза субстратабез добавления дополнительных реагентов, а путем извлечения продукта реакции в водно-метанольный слой при добавлении в реакционную среду двукратного объема смеси хлороформметанол 21 и измерения поглощения воднометанольного слоя при 350 нм 5) более высокая чувствительность метода из-за большего значения молярногокоэффициента экстинкции, равного 18500 М-1 см-1. Синтез 1-ацил-2(2,4-динитрофенил)аминопропионилглицеро-3-фосфохолина проводят по нижеприведенной схеме.2-(2,4-Динитрофенил)аминокислоты получают по реакции соответствующей аминокислоты с 2,4-динитрофторбензолом в присутствии карбоната натрия. Динитрофенильные производные аминокислот превращают в имидазолиды с помощью ,карбонилдиимидазола, которые вводят в реакцию с соответствующим лизофосфатидилхолином. Целевой продукт очищают с помощью флэш- хроматографии на силикагеле. Отбор субстрата для определения активности фосфолипазы А 2 осуществляют на основании дан 4 12191 1 2009.08.30 ных по максимальному распределению 1-ацил-2(2,4-динитрофенил)аминоацил-глицеро-3-фосфохолина и -(2,4-динитрофенил)аминокислот в нижний хлороформнометанольный и верхний водно-метанольный слои (90 и более) соответственно, что характерно для вышеприведенных заявляемых структур субстрата . Способ получения субстрата описан в примере 1. Пример 1 Синтез 1-ацил-2(2,4-динитрофенил)аминоацилглицеро-3-фосфохолина. а) Синтез -(2,4-динитрофенил)аминокислот. К раствору 20 ммоль аминокислоты в 10 мл 2 М карбоната натрия добавляют по каплям раствор 10 ммоль 1-фтор-2,4-динитробензола в 10 мл ацетона и перемешивают в течение 1 часа при комнатной температуре. После этого смесь подкисляют 1 М НС 1 до рН 1-2. Выпавший осадок отфильтровывают и промывают на фильтре 0,1 М НС двумя порциями по 10 мл и 10 мл охлажденного ацетона (в случае аминокапроновой кислоты 10 мл воды). Осадок сушат в вакуум-эксикаторе над КОН. б) Ацилирование лизофосфатидилхолина имидазолидами -(2,4- динитрофенил)аминокислот. К 1,5 ммоль -(2,4-динитрофенил)аминокислоты в 20 мл сухого ТГФ добавляют 1,6 ммоль ,-карбонилдиимидазола и перемешивают 1 час при комнатной температуре. Добавляют раствор 0,3 ммоль лизофосфатидилхолина в сухом хлороформе и перемешивают 30 мин при комнатной температуре. После этого упаривают растворитель и оставляют на 16 ч при 50 С. Остаток растворяют в 10 мл хлороформа и фильтруют. К смеси добавляют 10 мл воды и перемешивают в течение 15 мин. После этого добавляют 15 мл смеси хлороформ-метанол (21 по объему), отбирают органический слой, промывают смесью вода-метанол (11, по объему). Нижний слой отбирают, упаривают растворитель, сухой остаток растворяют в хлороформе и наносят на колонку с силикагелем. Элюируют смесью хлороформ-метанол, ступенчато повышая соотношение растворителей от 91 до 12. Выход 1-ацил-2(2,4-динитрофенил)аминоацилглицеро-3 фосфохолинов 65-80 . На примере -(2,4-динитрофенил)аминопропионовой кислоты показано, что ее распределение в верхний слой не зависит от содержания в среде как самой кислоты, так и исходного субстрата и лизофосфатидилхолина в соотношениях, моделирующих изменение состава реакционной среды в процессе ферментативного гидролиза в точке 0 среда содержит только субстрат , в точке х-х мольных частей -(2,4- динитрофенил)аминопропионовой кислоты, х мольных частей лизофосфатидилхолина и (100-х) мольных частей субстрата , что соответствует степени гидролиза, в точке 100 - эквимольные концентрации -(2,4-динитрофенил)аминопропионовой кислоты и лизофосфатидилхолина, равные концентрации субстратав точке 0 и соответствует степени гидролиза 100 , что иллюстрируется примером 2 и фиг. 1. Пример 2 Определение влияния 1-ацил-2(2,4-динитрофенил)-аминопропионилглицеро 3-фосфохолина и лизофосфатидилхолина на распределение -(2,4-динитрофенил)аминопропионовой кислоты при моделировании изменения их состава в ходе ферментативного процесса. Готовят серию образцов, моделирующих изменение состава реакционной смеси в процессе ферментативного гидролиза. Количество исходного 1-ацил-2(2,4- динитрофенил)аминопропионилглицеро-3-фосфохолина 0,17 мкмоль. В последующие образцы добавляют эквимолярные количества лизофосфатидилхолина и -(2,4-динитрофенил)аминопропионовой кислоты, соответственно уменьшая концентрацию исходного 1-ацил 2(2,4-динитрофенил)аминопропионилглицеро-3-фосфохолина. Каждый образец представляет собой дисперсию смеси липидов в 1 мл 0,2 М имидазол- буфера, содержащем 4 мМ Са(ОАс)2. К образцам добавляют 2 мл смеси хлороформ-метанол (21 по объему),5 12191 1 2009.08.30 смесь встряхивают, центрифугируют и определяют поглощение верхнего (водно-метанольного) слоя при 350 нм, из которого вычисляют концентрацию -(2,4-динитрофенил)аминопропионовой кислоты, используя молярный коэффициент экстинкции 18500 М-1 см-1. На фиг. 1 показана зависимость распределения -(2,4-динитрофенил) аминопропионовой кислоты (ось ординат, на которой обозначены значения концентрации -(2,4 динитрофенил)аминопропионовой кислоты) от содержания компонентов в смеси (ось абсцисс, на которой обозначено отношение продуктов реакции - (2,4-динитрофенил) аминопропионовой кислоты и лизофосфатидихолина к общему количеству компонентов в ). Из фиг. 1 видно, что накопление -(2,4-динитрофенил)аминопропионовой кислоты в верхнем слое пропорционально ее содержанию в среде. Таким образом, уменьшение субстратаи накопление продуктов в ходе реакции не влияет на извлечение -(2,4 динитрофенил)аминокислот в водно-метанольный слой. Следовательно, заявляемый способ применим на всех участках прохождения реакции, катализируемой фосфолипазой А 2. Пример 3 Определение активности фосфолипазы А 2 с помощью 1-ацил-2(2,4 динитрофенил)аминоацилглицеро-3-фосфохолина. Раствор 0,2 мкмоль 1-ацил-2(2,4-динитрофенил)аминоацилглицеро-3-фосфохолина в хлороформе упаривают под азотом и добавляют 1 мл рабочего буфера (рН 7,5 для фосфолипазы А 2 из яда кобры, рН 8,0 для фосфолипазы А 2 из поджелудочной железы свиньи). Обрабатывают в течение 1 мин в ультразвуковой ванне при комнатной температуре, затем добавляют раствор Са(ОАс)2 до концентрации 2,0-5,0 мМ. Реакцию начинают добавлением раствора 5 мкг фосфолипазы А 2 и проводят при перемешивании при заданной температуре в течение 10 мин. Реакцию останавливают добавлением 2 мл смеси хлороформ-метанол (21 по объему), смесь встряхивают, центрифугируют и определяют поглощение верхнего (водно-метанольного) слоя при 350 нм. Степень гидролиза определяют по формуле 100, исхгде- оптическая плотность- объем водно-метанольного слоя, л исх - исходное количество субстрата, моль- коэффициент экстинкции (18500 М-1 см-1)- толщина поглощающего слоя, см. При известной начальной концентрации субстрата и фиксированном времени гидролиза активность фосфолипазы А 2, прямо пропорциональную степени гидролиза, определяют по формуле 0,100 где 0 - начальная концентрация субстрата, мкмоль- время гидролиза, мин- степень гидролиза, . Адекватность заявляемого способа определения активности фосфолипазы А 2 следует из фиг. 2, на которой представлена зависимость степени гидролиза (ось ординат) от концентрации фосфолипазы А 2, выраженной в мкг/мл на оси абсцисс. Пропорциональный ход зависимости свидетельствует о том, что отщепление -(2,4-динитрофенил)аминокислоты осуществляется за счет ферментативной реакции, а не химического гидролиза. Пример 4 Зависимость гидролиза 1-ацил-2(2,4-динитрофенил)-аминопропионилглицеро-3-фосфохолинов от концентрации фосфолипазы А 2. 12191 1 2009.08.30 Раствор 0,2 мкмоль 1-ацил-2-Н-(2,4-динитрофенил)аминопропионилглицеро-3 фосфохолина в хлороформе упаривают под азотом, затем добавляют 1 мл 0,2 М имидазол буферного раствора, рН 7,5, и обрабатывают в течение 1 мин в ультразвуковой ванне при комнатной температуре. Добавляют раствор Са(ОАс)2 до концентрации 4 мМ и реакцию начинают добавлением раствора фосфолипазы А 2 (от 2 до 14 мкг). Реакцию проводят при перемешивании при 25 С в течение 10 мин. Реакцию останавливают добавлением 2 мл смеси хлороформ-метанол (21 по объему), смесь встряхивают, центрифугируют и определяют поглощение верхнего (водно-метанольного) слоя при 350 нм. Степень гидролиза рассчитывают по вышеприведенной формуле. На фиг. 3 показано сравнение кинетических кривых зависимости степени катализируемого фосфолипазой А 2 гидролиза, построенных по данным измерения соотношения лизофосфатидилхолина и исходного субстрата по содержанию в них фосфора (кривая 1) с зависимостью, построенной по данным поглощения отщепившейся -(2,4 динитрофенил)аминопропионовой кислоты в водно-метанольном слое (кривая 2). Из фиг. 3 видно, что на всех временных интервалах прохождения реакции обе кинетические кривые коррелируют. Более низкие значения точек на кривой 1 объясняются неполным извлечением лизофосфатидилхолина (около 85 ) при экстракции - стадии, необходимой для определения степени гидролиза по фосфору 6. Пример 5 Сравнение определения степени гидролиза 1-ацил-2(2,4-динитрофенил)аминопропионилглицеро-3-фосфохолина по заявляемому способу и по содержанию фосфора в субстрате и лизофосфатидилхолине после их разделения с помощью тонкослойной хроматографии (ТСХ). Раствор 2,7 мкмоль 1-ацил-2(2,4-динитрофенил)аминопропионилглицеро-3 фосфохолина в хлороформе упаривают под азотом. К субстрату добавляют 5 мл 0,2 М имидазол- буфера, рН 7,5, и обрабатывают в течение 1 мин в ультразвуковой ванне при комнатной температуре. После добавления раствора Са(ОАс)2 до концентрации 4 мМ реакцию начинают введением раствора фосфолипазы А 2 из яда кобры, содержащего 10 мкг фермента, и перемешивают при 25 С. Через определенные промежутки времени (от 3 до 20 мин) отбирают 1 мл реакционной смеси и добавляют 2 мл смеси хлороформ-метанол(21 по объему), смесь встряхивают, центрифугируют и определяют поглощение верхнего слоя при 350 нм. Степень гидролиза рассчитывают по вышеприведенной формуле. Нижний слой (для всех проб) отбирают, упаривают растворитель под азотом, растворяют в 100 мкл хлороформа и наносят на пластинку для ТСХ. Хроматографируют в системе растворителей хлороформ-метанол-вода (65254), пластинку после высушивания проявляют реагентом на органические фосфаты. Пятна, соответствующие хроматографической подвижности продукта реакции лизофосфатидилхолина и исходного субстрата, выскребают с пластинки и определяют в них содержание фосфора с помощью молибдатного реагента. Возможность тестирования эффектора фосфолипазы А 2 с помощью заявляемого способа подтверждается данными по активности фермента в присутствии известного ингибитора - -бромфенацилбромида для фосфолипазы из яда кобры 1. На фиг. 4 показана зависимость степени гидролиза (ось ординат) от времени (ось абсцисс) в отсутствие (кривая 1) и в присутствии -бромфенацилбромида (кривая 2). Из зависимости следует, что бромфенацилбромид в условиях проведения реакции по заявляемому способу проявляет свойства ингибитора, и, следовательно, заявляемый способ определения активности фосфолипазы А 2 может быть использован для тестирования эффектора ее липолитической активности. Применение заявляемого способа для тестирования эффектора фосфолипазы А 2 иллюстрируется фиг. 5, на которой представлены примеры выявления и отбора эффекторов (активаторов и ингибиторов) фосфолипаз А 2 из яда кобры (светлые столбики) и 7 12191 1 2009.08.30 поджелудочной железы свиньи (темные столбики) в ряду -арахидоноильных производных аминокислот (анионные эффекторы) и аминоспиртов. Найдено, что арахидоноильные производные -аланина (2), -аргинина (3), -аспарагина (4), -лейцина(6), -фенилаланина (8), -серина (9), -тирозина (10), -валина (11) являются ингибиторами фосфолипазы А 2 из яда змеи, а 3, -арахидоноильные производные -лейцинола (7),-валинола (12) - ингибиторами фосфолипазы А 2 из поджелудочной железы свиньи, тогда как 2, 4, 8, 9, 10 и -арахидоноильное производное -глутаминовой кислоты (5) активируют эту фосфолипазу. Способ тестирования эффектора фосфолипазы А 2 описан в примерах 6 и 7. Пример 6 Ингибирование гидролиза 1-ацил-2(2,4-динитрофенил)-аминопропионил-глицеро-3-фосфохолина фосфолипазой А 2 из яда кобры -бромфенацилбромидом. Раствор 1,6 мкмоль 1-ацил-2(2,4-динитрофенил)аминопропионилглицеро-3 фосфохолина в хлороформе высушивают под азотом и добавляют 4 мл 0,2 М имидазол буфера, рН 7,5. Смесь обрабатывают в течение 1 мин в ультразвуковой ванне при комнатной температуре, добавляют раствор Са(ОАс)2 до концентрации 4 мМ и смесь разделяют на две равные порции. К одной из них добавляют 0,8 мкмоль бромфенацилбромида в 40 мкл этанола, к другой - 40 мкл этанола. Реакцию начинают добавлением раствора фосфолипазы А 2 из яда кобры, содержащего 10 мкг фермента и перемешивают при 25 С. Через определенные промежутки времени (от 3 до 30 мин) отбирают 1 мл реакционной смеси, добавляют 2 мл смеси хлороформ-метанол (21, по объему),смесь встряхивают, центрифугируют и определяют поглощение верхнего слоя при 350 нм. Степень гидролиза рассчитывают по вышеприведенной формуле. Пример 7 Выявление эффекторов фосфолипаз А 2 среди -арахидоноильных производных аминокислот и аминоспиртов с помощью заявляемого способа. Для приготовления каждого образца раствор 1-ацил-2(2,4-динитрофенил)аминопропионилглицеро-3-фосфохолина в хлороформе, содержащий 0,2 мкмоль 1-ацил-2(2,4-динитрофенил)аминопропионилглицеро-3-фосфохолина упаривают под азотом,и добавляют 1 мл 0,2 М имидазол- буфера, рН 7,5. Обрабатывают в течение 1 мин в ультразвуковой ванне при комнатной температуре и добавляют раствор Са(ОАс)2 до концентрации 4 мМ. В каждый образец добавляют спиртовой раствор -арахидоноильного производного аминокислоты или аминоспирта (соответствующее количество этилового спирта в контрольный образец) до конечной концентрации 50 мкМ. Реакцию начинают добавлением раствора фосфолипазы А 2, содержащего 5 мкг фермента и перемешивают в течение 15 мин при 25 С. Реакцию останавливают добавлением 2 мл смеси хлороформметанол (21, по объему), встряхивают, центрифугируют, отбирают верхний слой и измеряют поглощение при 350 нм. Степень гидролиза рассчитывают по вышеприведенной формуле. Таким образом, данные, полученные из примеров 6 и 7 и представленные на фиг. 4 и 5, свидетельствуют о возможности применения заявляемого способа определения активности фосфолипазы А 2 для тестирования эффектора ее липолитической активности. Источники информации 1. Литвинко Н.М., Кисель М.А. Эндогенные фосфолипазы А 2 (структура и функция). Мн. Наука и техника, 1991. - 270 с. 2. Винокурова Л.В., Астафьева О.В., Банифатов П.В. Роль фосфолипазы А в патогенезе острого и хронического панкреатитов, ее значение в диагностике этих заболеваний // Российский гастроэнтерологический журнал. - 2001. -2. - С. 72-77. 12191 1 2009.08.30 3.., -2// . . . - 2006. . 8. - .374-381. 4..,. -//. - 1991. - . 197. . 65-75. 5. Пат. 5 464 754 США. МПК 12 1/34. 6. Андреюк Г.М., Кисель М.А., Литвинко Н.М. Влияние амидов жирных кислот на катализируемый фосфолипазой А 2 гидролиз фосфатидилхолина в мицеллах // Укр. биохим. журн. - 1997. - Т. 69 - С. 32-36. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 10
МПК / Метки
МПК: C12N 9/16
Метки: эффектора, липолитической, способ, фосфолипазы, определения, активности, тестирования
Код ссылки
<a href="https://by.patents.su/10-12191-sposob-opredeleniya-aktivnosti-fosfolipazy-a2-i-testirovaniya-effektora-eyo-lipoliticheskojj-aktivnosti.html" rel="bookmark" title="База патентов Беларуси">Способ определения активности фосфолипазы A2 и тестирования эффектора её липолитической активности</a>
Предыдущий патент: Способ оценки состояния Т-клеточного иммунитета в зоне оперативного вмешательства после лапароскопической холецистэктомии
Следующий патент: Способ оперативного лечения атрезии пищевода
Случайный патент: Оптический микрорезонаторный переключатель