Способ количественного определения 28-гомобрассиностероидов и состав для его осуществления
Номер патента: 11833
Опубликовано: 30.04.2009
Авторы: Жабинский Владимир Николаевич, Райман Михаил Эдуардович, Хрипач Владимир Александрович, Прядко Андрей Георгиевич, Литвиновская Раиса Павловна, Драч Светлана Васильевна, Свиридов Олег Васильевич, Новик Татьяна Валентиновна
Текст
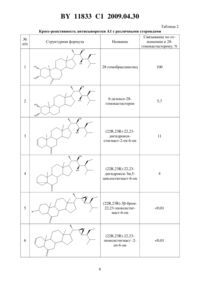
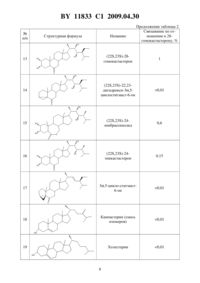
(51) МПК (2006) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ 28-ГОМОБРАССИНОСТЕРОИДОВ И СОСТАВ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ(71) Заявитель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(72) Авторы Хрипач Владимир Александрович Литвиновская Раиса Павловна Райман Михаил Эдуардович Драч Светлана Васильевна Жабинский Владимир Николаевич Свиридов Олег Васильевич Прядко Андрей Георгиевич Новик Татьяна Валентиновна(73) Патентообладатель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(57) 1. Способ количественного определения 28-гомобрассиностероидов формулы гдеозначаетили ,путем иммуноферментного анализа, отличающийся тем, что анализируемый образец смешивают с конъюгатом 28-гомокастастерон-пероксидаза хрена в полимерной лунке с иммобилизованными поликлональными антителами к 28-гомокастастерону, инкубируют,разделяют свободную и связанную антителами формы брассиностероидов, добавляют к связанной форме хромоген-субстратную смесь, измеряют оптическую плотность полученного раствора и рассчитывают количество 28-гомобрассиностероидов. 2. Состав для количественного определения 28-гомобрассиностероидов способом по п. 1, включающий 11833 1 2009.04.30 антитела к 28-гомокастастерону, иммобилизованные на полимерной лунке конъюгат 28-гомокастастерон-пероксидаза хрена буферный раствор для разведения конъюгата промывочный буферный раствор хромоген-субстратную смесь - раствор 3,3,5,5-тетраметилбензидина в субстратном буфере с перекисью водорода стоп-реагент - 5 -ный раствор 24. Изобретение относится к области иммунохимического анализа, а именно количественному определению регуляторов роста растений, 28-гомобрассиностероидов формулы гдеСО - 28-гомокастастеронСОО - 28-гомобрассинолид и предназначено для определения указанных брассиностероидов в водных растворах, в агропрепаратах на их основе, а также может быть использовано для количественной оценки их содержания в биологических объектах растительного происхождения, определения остаточных количеств в почве, сточных водах и т.п. Брассиностероиды - природные низкомолекулярные биорегуляторы, которые являются гормонами растений 1, 2. Они присутствуют во всех растительных объектах и обладают ростмодулирующим и адаптогенным действием. Содержание брассиностероидов в растениях менее 10-5 . В очень малых концентрациях они проявляют свое биологическое действие. Установлено, например, что при обработке различных сельскохозяйственных культур в дозах 5-20 мг на гектар посевов наблюдается заметный ростстимулирующий и адаптогенный эффект, приводящий к увеличению урожая, повышению качества продукции и устойчивости растений к неблагоприятным условиям и болезням 3-8. Эти свойства брассиностероидов делают их привлекательными в качестве основы для агропрепаратов. Одним из наиболее активных брассиностероидов является 28-гомобрассинолид, на основе которого разработан препарат ЭПИН-плюс 9. В связи с этим актуальной является разработка методов анализа 28-гомобрассинолида, а также его химического и биохимического предшественника 28-гомокастастерона (далее 28-гомобрассиностероиды). В качестве такого метода нами предложен метод иммуноферментного определения 28-гомобрассиностероидов. Применение иммунохимического анализа для количественного определения брассиностероидов с использованием антител описано в ряде работ. Так, для радиоиммунного анализа были получены антитела к кастастерону, на базе которых удалось создать систему для анализа брассинолида и кастастерона 10, однако из-за сложности работы с радиоактивными изотопами и необходимости комбинирования с инструментальными методами разработка не получила развития. Кроме того, полученная система имела низкую специфичность показатели перекрестных реакций с другими брассиностероидами составляли 20-50 . Предпочтительным представляется иммуноферментный анализ, поскольку он не 2 11833 1 2009.04.30 требует сложной измерительной аппаратуры и применения радиоактивных соединений (а поэтому безопасен), пригоден практически в любых условиях. Предложен иммуноферментный метод определения 24-метилбрассиностероидов 11,12, который основан на использовании антител, полученных к 24-эпибрассинолиду. Метод специфичен и позволяет с высокой степенью чувствительности определять только брассиностероидов 24-метилряда. Следует отметить, что применение иммунохимического анализа (в частности, иммуноферментного) для определения 28-гомобрассиностероидов не описано в научной и патентной литературе. Целью настоящего изобретения является способ количественного иммуноферментного определения 28-гомокастастерона и 28-гомобрассинолида, повышающий специфичность и чувствительность определения и отличающийся экологической безопасностью,простотой, надежностью и технологичностью. Поставленная цель достигается предлагаемым способом, заключающимся в смешивании анализируемых образцов брассиностероида (или калибровочных проб) с конъюгатом 28-гомокастастерон-пероксидаза хрена в полимерных (например, полистирольных) лунках с иммобилизованными на внутренней поверхности антителами к 28-гомокастастерону,последующей инкубации, разделении свободной и связанной антителами форм брассиностероидов, добавлении к связанной форме хромоген-субстратной смеси для определения активности пероксидазы, по которой рассчитывают количество определяемого 28 гомобрассиностероида. Заявляемый способ является экологически безопасным, простым, надежным и технологичным. Применение заявляемого способа обеспечивает быстрое и прямое (без многоступенчатых стадий выделения, подготовки образца и/или его модификации) определение 28-гомокастастерона и 28-гомобрассинолида. Кроме того, способ отличается высокой надежностью и чувствительностью, достаточной для обнаружения 28-гомокастастерона и 28-гомобрассинолида в концентрации 0,2-0,3 нмоль/л, которой другими методами добиться не удается. Сущность изобретения подтверждается примером конкретного выполнения. Пример 1. Проведение анализа. В полистирольные лунки планшета с иммобилизованными антителами к 28 гомокастастерону вносят по 0,05 мл калибровочных проб или анализируемых образцов брассиностероидов в дубликатах. Вносят во все лунки по 0,1 мл фосфатно-буферного раствора конъюгата 28-гомокастастерон-пероксидаза хрена в глицерине. Планшеты инкубируют в течение 2 ч при 37 С без встряхивания, затем удаляют жидкость из лунок и промывают их 3 -ным раствором , содержащим 0,0220. Во все промытые лунки добавляют по 0,15 мл хромоген-субстратной смеси (раствор 3,3,5,5-тетраметилбензидина в субстратном буфере с перекисью водорода) и инкубируют при 37 С в течение 15 минут. Останавливают реакцию добавлением во все лунки по 0,05 мл раствора стоп-реагента (5 раствор 24). Измеряют на спектрофотометре оптическую плотность раствора во всех лунках при длине волны 450 нм. Результаты анализа рассчитывали методом интерполяции по калибровочной кривой 13. Другой задачей изобретения является состав для осуществления заявляемого способа количественного определения 28-гомобрассиностероидов. Известен аналог заявляемому составу - тест-система для определения 24-метилбрассиностероидов - иммуноферментный метод определения 24-эпибрассинолида и 24 эпикастастерона 11, 12. Одним из наиболее примечательных свойств предложенной системы явилась ее высокая специфичность. При этом с высокой степенью чувствительности определяется 24-эпибрассинолид и его синтетический и биосинтетический предшествен 3 11833 1 2009.04.30 ник - 24-эпикастастерон. Однако при концентрации брассиностероидов 10-6-10-9(а именно в таких концентрациях эти вещества содержатся в растениях и проявляют свою активность) данная система практически не обнаруживает 28-гомобрассинолид и 28 гомокастастерон. Только антитела, полученные к этим брассиностероидам, и иммуноферментная метка на их основе могут позволить получить высокоспецифическую и высокочувствительную систему для определения 28-гомобрассиностероидов. Настоящее изобретение основано на использовании специфических антител к 28 гомокастастерону и меченого антигена - 28-гомокастастерона, меченного пероксидазой хрена. Заявляемая тест-система состоит из антител к 28-гомокастастерону, иммобилизованных на полимерных носителях конъюгата 28-гомокастастерон-пероксидаза хрена буферного раствора для разведения конъюгата хромоген-субстратной смеси - раствора 3,3,5,5-тетраметилбензидина в субстратном буфере с перекисью водорода стоп-реагента - 5 -ный раствор 24. Возможность осуществления количественного определения 28-гомобрассинолида и 28-гомокастастерона с помощью заявляемого состава по описанному выше способу подтверждается примерами конкретного исполнения. Пример 2. Получение и характеристики компонентов тест-системы. Стадия 1. Получение конъюгата кастастерон-БСА. Растворяют 0,031 г (0.056 ммоль) оксима (1) и 0,008 г (0.07 ммоль) -оксисукцинимида в 2 мл абсолютного диоксана. Охлаждают до 5 С и при перемешивании добавляют раствор 0.012 мг дициклогексилкарбодиимида в 0,5 мл абсолютного диоксана. Реакционную смесь перемешивают 30 мин при 5 С и 20 часов при комнатной температуре. Выпавшую в осадок дициклогексилкарбомочевину отфильтровывают, фильтрат упаривают. Осадок растворяют в этилацетате, дополнительно образовавшийся осадок дициклогексилкарбомочевины отфильтровывают, фильтрат упаривают. Получают 0,035 мг (94 ) 6-оксисукцинимидного эфира (22,23,24)-2,3,22,23-тетрагидрокси 24-этил-5-холест-6-илиденаминооксиуксусной кислоты. Маслообразное вещество. ИК спектр (пленка), (см-1) 1730 (СО), 1770 (СО), 3400 (ОН). Спектр ЯМР 1 Н , м.д.(3) 0,67 с (3 Н, 18-Ме), 0,75 с (3 Н, 19-Ме), 0,90 д (3 Н,6,6 Гц, 26 ), 0,94 д (3 Н, 6,7 Гц, 29-Ме), 0,95 д (3 Н,6 Гц, 21-), 0,97 д (3 Н,6,6 Гц, 27-Ме), 2,68 дд (1 Н, 1 2,5 Гц, 2 12,5 Гц, С 5- Н), 2,73 м (4 Н), 3,58 д (1 Н,8,4 Гц, С 22 - Н), 3,72 м (2 Н, С 2- и С 23 Н), 3,95 м (1, С 3- Н), 4,52 м (2 Н, -О-СН 2-СООН). К раствору 52 мг (0,75 мкмоль) БСА в смеси 9 мл воды и 1 мл насыщенного раствора 3 (8,3) добавляют раствор 35 мг (55 мкмоль) 6-оксисукцинимидного эфира(22,23,24)-2,3,22,23-тетрагидрокси-24-этил-5-холест-6-илиденаминооксиуксусной кислоты в 10 мл диоксана. Раствор перемешивают 20 ч при комнатной температуре. Реакционную смесь подвергают диализу при 20 С против дитиллированной воды в течение 36 часов, затем 20 ч - против 1 -ной суспензии активированного угля в воде, лиофилизуют и замораживают при температуре -20 С. Содержание гаптена в конъюгате,определенное спектрофотометрически, составляет 23 моль гаптена на 1 моль белка. Стадия 2. Получение конъюгата кастастерон-пероксидаза хрена. Растворяют 0,031 г (0,056 ммоль) оксима (1) и 0,008 г (0,07 ммоль) оксисукцинимида в 2 мл абсолютного диоксана. Охлаждают до 5 С и при перемешивании добавляют раствор 0,012 мг дициклогексилкарбодиимида в 0,5 мл абсолютного диоксана. Реакционную смесь перемешивают 30 мин при 5 С и 20 часов при комнатной температуре. Выпавшую в осадок дициклогексилкарбомочевину отфильтровывают, фильтрат упаривают. Осадок растворяют в этилацетате, дополнительно образовавшийся осадок дициклогексилкарбомочевины отфильтровывают, фильтрат упаривают. Получают 0,035 мг 4(1 Н, С 3 - Н), 4,52 м (2 Н, -О-СН 2-СООН). К раствору 6 мг пероксидазы хрена в 0,6 мл диет, воды в присутствии 2-3 капель 0,1 М раствора гидрокарбоната натрия (рН 8,35) добавляют раствор 2 мг (0,003 ммоль) 6 оксисукцинимидного эфира (22,23,24)-2,3,22,23-тетрагидрокси-24-этил-5-холест-6-илиденаминооксиуксусной кислоты, перемешивают при комнатной температуре в течение 2 ч. Очищают на колонке с сефадексом, элюент - дистиллированная вода. Собирают окрашенную желто-коричневую фракцию (10 мл), разбавляют глицерином (11) и хранят в морозильнике (при -18 С). Титр полученного конъюгата определяют как его рабочее разведение, обеспечивающее максимальную чувствительность тест-системы, которое позволяет построить калибровочный график в диапазоне 2,5-0,2 ОЕ. Типичным в проведенных экспериментах было рабочее разведение 130000-120000, т.е. специфическая активность конъюгата 28-гомокастастерон-пероксидаза хрена при таком разведении (титре) позволяет проводить иммуноферментный анализ в диапазоне концентраций анализируемого вещества 0,2100 нмоль/л. Полученный конъюгат используют для получения антител, специфичных к 28 гомобрассиностероидам (28-гомобрассинолид и 28-гомокастастерон), что подтверждается примером конкретного выполнения. Стадия 3. Получение антисыворотки к 28-гомокастастерону. Группу из шести кроликов иммунизируют конъюгатом 28-гомокастастерон-БСА с плотностью посадки 23 молекул стероида на 1 молекулу белка. Каждому кролику вводят подкожно в 15 точек спины по 1 мг конъюгата, предварительно растворенного в 0,5 мл фосфатно-буферного 0,1 М раствора поваренной соли (рН 7,4) и эмульгированного в равном объеме полного адъюванта Фрейнда. Интервалы между инъекциями составляют 2 недели. Иммунизацию продолжают в течение 6 месяцев, осуществляя периодический отбор проб крови из ушной вены животных. Полученные образцы сыворотки тестируют на наличие связывающей способности в отношении 28-гомокастастерона и определяют их титры и значения констант ассоциации (Ка). Титр определяют как рабочее разведение антисыворотки, обеспечивающее максимальную чувствительность тест-системы при таком связывании конъюгата, которое позволяет построить калибровочный график в диапазоне 2,5-0,2 ОЕ. Таблица 1 Характеристики антисыворотки, полученной при иммунизации животных конъюгатом 28-гомокастастерона с БСА Антисыворотка Ках 109 М-1 Титр 1 4,5 50000 Определение оптимального титра антисыворотки для применения в ИФА показало,что ее разбавление в 50 000 (1) раз позволяет обеспечить приемлемые условия определения как 28-гомокастастерона, так и 28-гомобрассинолида, проявивших, как и ожидалось,сравнимые параметры связывания с антителами. Специфичность. Перекрестная реакция антител, полученных к 28-гомокастастерону, с другими брассиностероидами и стероидами различных классов приведена в табл. 2. 11833 1 2009.04.30 Таблица 2 Кросс-реактивность антисыворотки 1 с различными стероидами Связывание по отСтруктурная формула Название ношению к 28 гомокастастерону,Продолжение таблицы 2 Связывание по отношению к 28 гомокастастерону,Продолжение таблицы 2 Связывание по отношению к 28 гомокастастерону,Продолжение таблицы 2 Связывание по отношению к 28 гомокастастерону,Таким образом, полученные антитела обладают специфичностью (определяется только 28-гомокастастерон и 28-гомобрассинолид) и чувствительностью, достаточной для обнаружения кастастерона и брассинолида в концентрации 0,2-0,3 нмоль/л или 5-7 пг 28 гомобрассиностероида в 50 мкл образца. Из табл. 2 видно, что заявляемый состав позволяет определять 28-гомобрассинолид и 28-гомокастастерон с высокой степенью специфичности. Коэффициент вариации результатов 10 определений 28-гомобрассиностероидов в одном и том же образце с использованием заявляемого способа и состава для его осуществления не превышает 10 . Тест на линейность. Зависимость концентрации брассиностероидов в исследуемых образцах при разведении их раствором, не содержащим 28-гомокастастерона или 28 гомобрассинолида, имеет линейный характер. Тест на открытие. При постановке теста процент открытия составил 90-110 . Чувствительность. Состав позволяет обнаружить 28-гомокастастерон и 28-гомобрассинолид в концентрации 0,2-0,3 нмоль/л или 5-7 пг в 50 мкл образца. Важным является тот факт, что брассиностероиды широко распространены в природе,они свойственны всем или абсолютному большинству растительных видов - содержание в растении менее 10-5 . Брассиностероиды регулируют рост и развитие растений. Обработка растений брассиностероидами на соответствующей стадии развития приводит к увеличению урожая и, в ряде случаев, к улучшению его качества. Замечательно, что эффект достигается при обработке растений в концентрации 5-20 мг на гектар посевов, что намного меньше, чем в случае традиционно применяемых средств повышения урожайности растений. На их основе создаются агропрепараты, применяемые как регуляторы роста и средства повышения урожайности сельскохозяйственных культур. Все это требует разработки эффективных и высокочувствительных методов определения брассиностероидов. Применение заявляемого способа и состава для его осуществления позволит проводить иммуноферментное определение одного из активных брассиностероидов - 28 гомобрассинолида и его химического и биохимического предшественника 28-гомокастастерона в концентрациях 0,2-0,3 нмоль/л или 5-7 пг в 50 мкл образца... , 1999. - 456 . 3. Патент РБ 2806, 2000. 4. Патент РБ 3488, 2000. 5. Патент РБ 3400, 2000. 6. Патент РБ 5168, 2003. 7. Патент РБ 5212, 2003. 8. Патент РБ 5698, 2003. 9. ТУ РБ 100185129.048 2002. Брассиностероиды и препаративные композиции на их основе. Введ. 2003-02-05. Каталог Технические условия. - Мн. Из-во Госстандарт РБ,2007. - Т. 2. - С. 549. 10.Т.,.,.,.,.//, 1990, . 9. - . 151. 11. Патент РБ 10512, 2007. 12. Хрипач В.А., Свиридов О.В., Прядко А.Г., Литвиновская Р.П., Драч С.В., Матвеенцев В.Д., Новик Т.В., Михайлопуло К.И., Жабинский В.Н., Завадская М.И., Аверькова М.А., Драченова О.А., Чащина Н.М. Иммуноферментный анализ (24 К)-брассиностероидов // Биоорг. химия, 2007. - Т. 33. -3. - С. 371-378. 13. Егоров Теория и практика иммуноферментного анализа. - М. Высшая школа,1991. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 10
МПК / Метки
МПК: G01N 33/50
Метки: количественного, состав, определения, способ, осуществления, 28-гомобрассиностероидов
Код ссылки
<a href="https://by.patents.su/10-11833-sposob-kolichestvennogo-opredeleniya-28-gomobrassinosteroidov-i-sostav-dlya-ego-osushhestvleniya.html" rel="bookmark" title="База патентов Беларуси">Способ количественного определения 28-гомобрассиностероидов и состав для его осуществления</a>
Предыдущий патент: Конъюгат 28-гомокастастерона с бычьим сывороточным альбумином в качестве иммуногена
Следующий патент: Конъюгат 28-гомокастастерона с пероксидазой хрена в качестве меченого антигена для иммуноферментного определения 28-гомобрассиностероидов
Случайный патент: Способ определения дефицита водного питания растения