Лупановые тритерпеноиды, ингибирующие размножение вирусов гриппа и герпеса
Текст
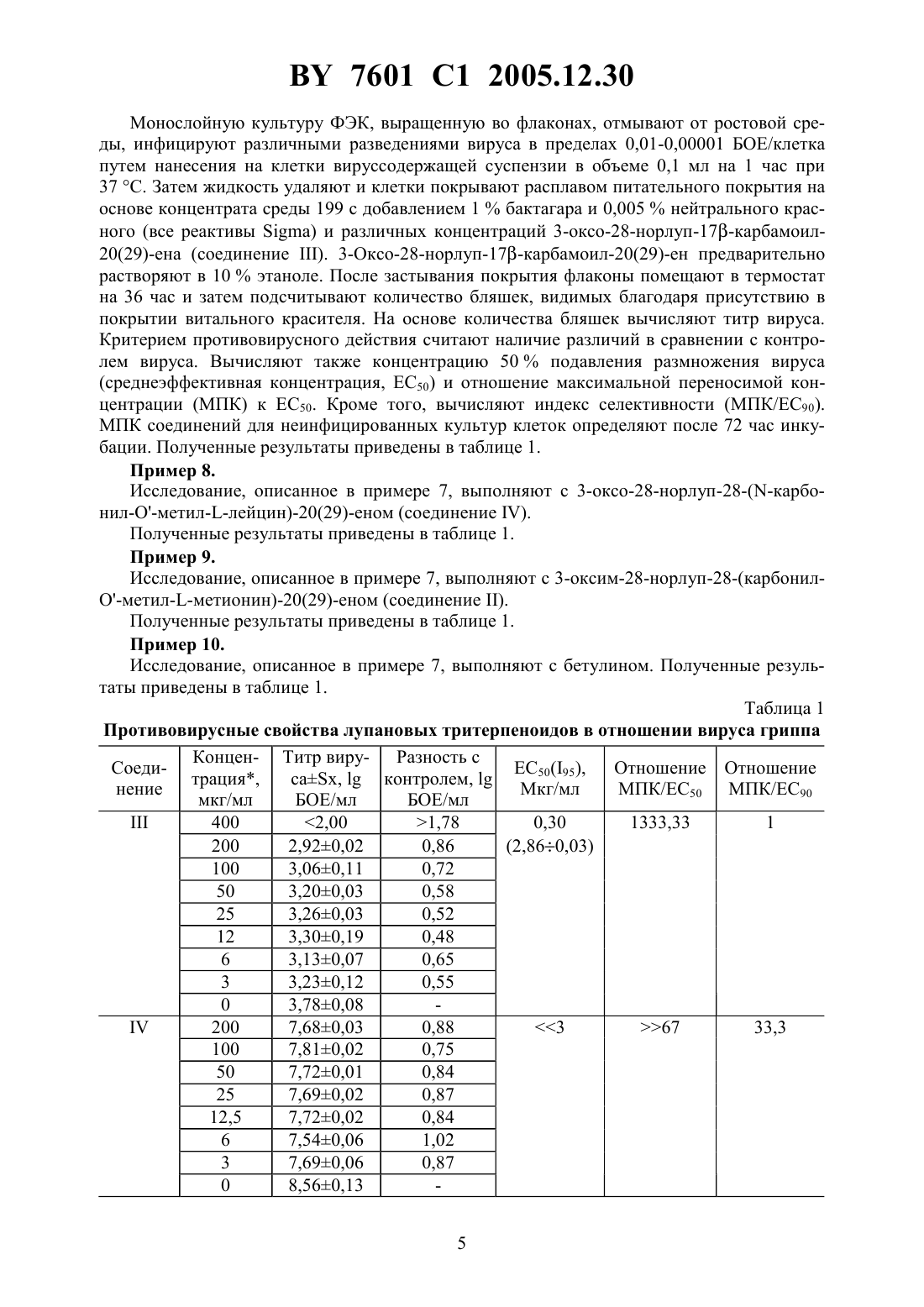
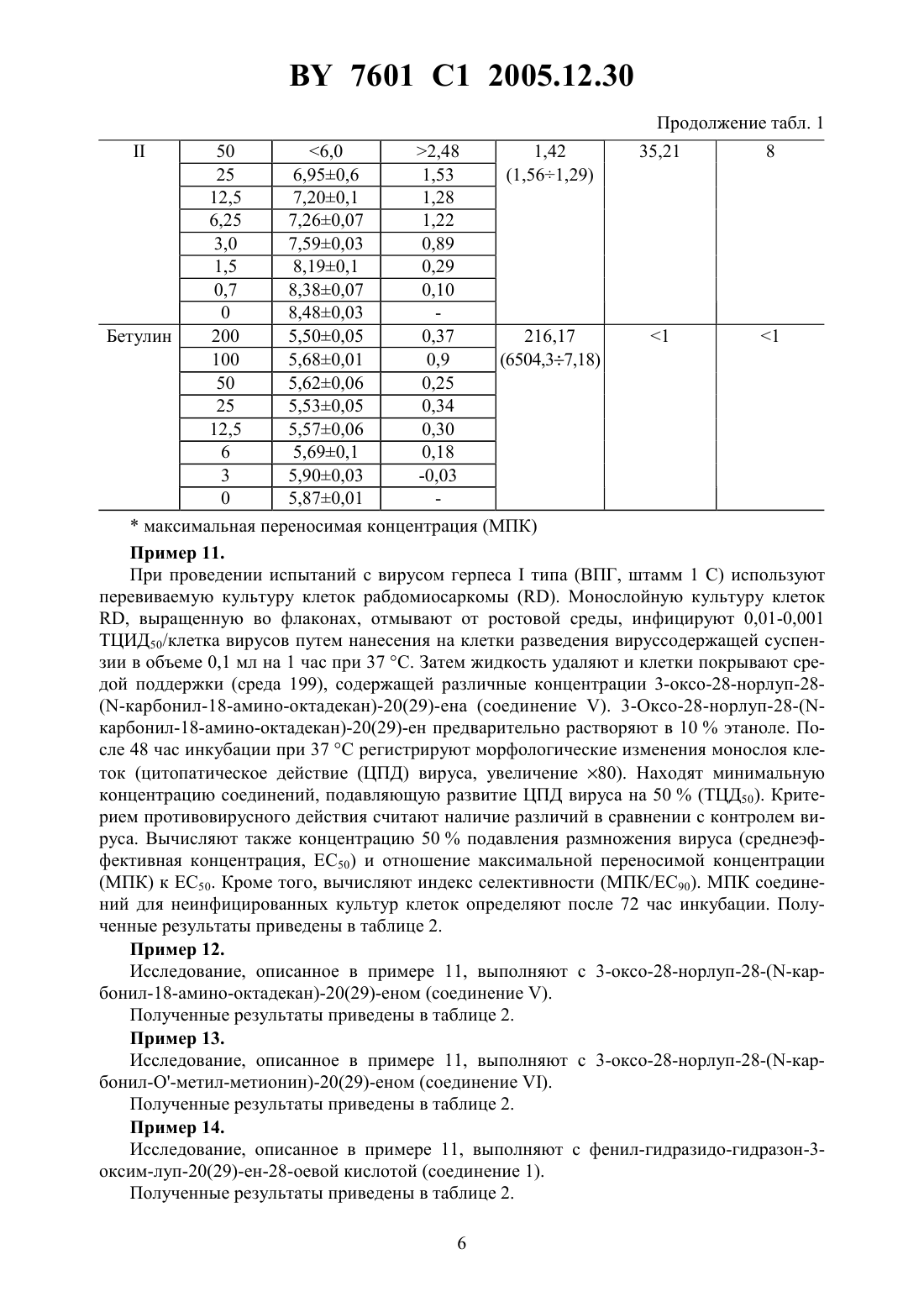
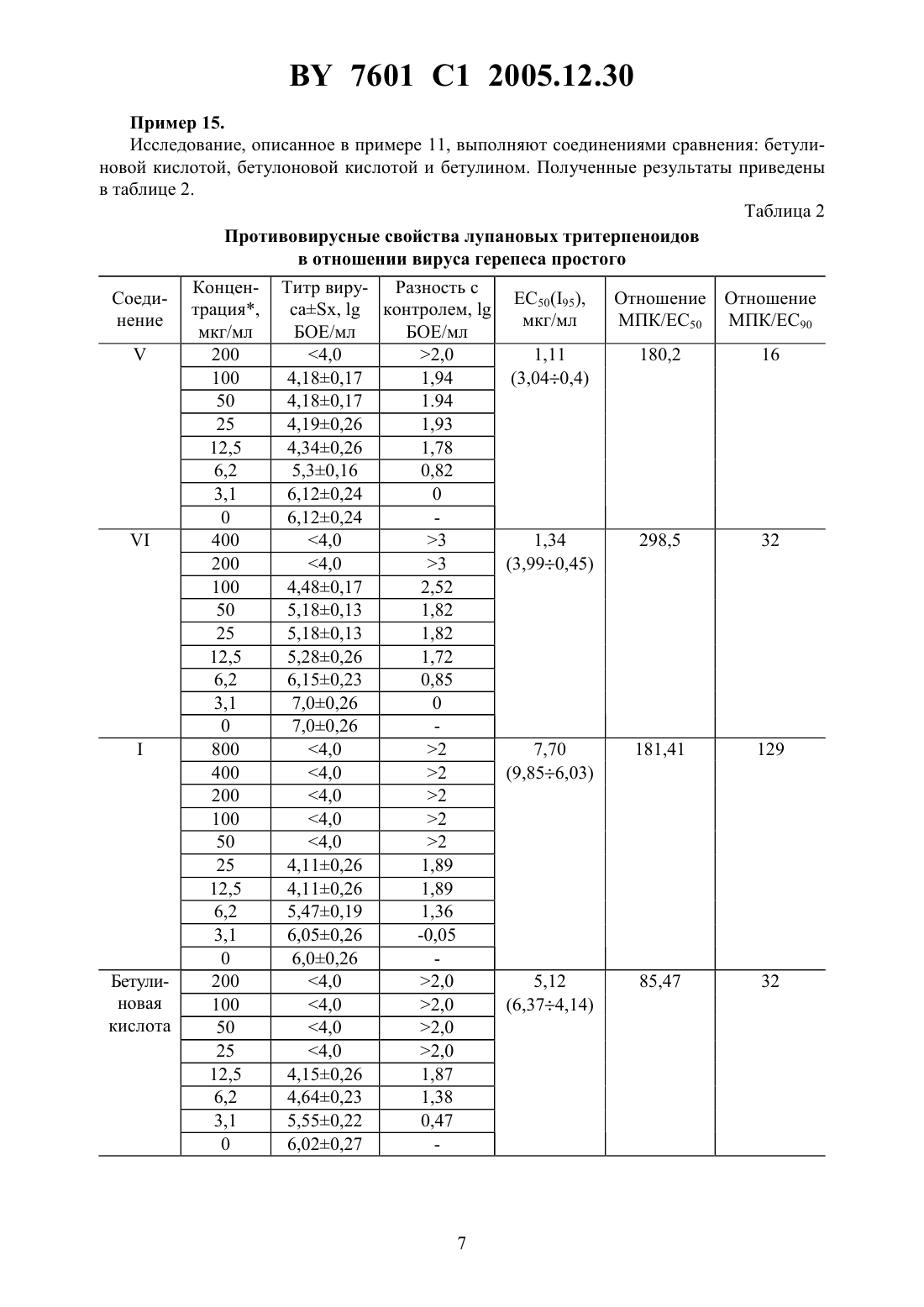
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ЛУПАНОВЫЕ ТРИТЕРПЕНОИДЫ, ИНГИБИРУЮЩИЕ РАЗМНОЖЕНИЕ ВИРУСОВ ГРИППА И ГЕРПЕСА(71) Заявители Государственное учреждение Научно-исследовательский институт эпидемиологии и микробиологии Министерства здравоохранения Республики БеларусьИнститут органической химии Уфимского научного центра Российской академии наук(72) Авторы Бореко Евгений Иванович Савинова Ольга ВладимировнаФлехтер Оксана Борисовна Нигматуллина Лена РамилевнаБалтина Лидия АшрафовнаГалин Фанур Зуфарович Толстиков Генрих АлександровичНиколаева Светлана Николаевна(73) Патентообладатели Государственное учреждение Научно-исследовательский институт эпидемиологии и микробиологии Министерства здравоохранения Республики БеларусьИнститут органической химии Уфимского научного центра Российской академии наук(57) Лупановые тритерпеноиды общей формулы-(3)223,для подавления размножения вирусов гриппа и герпеса. 7601 1 2005.12.30 Изобретение относится к новым химическим соединениям, конкретно к тритерпеноидам ряда лупана, обладающим противовирусной активностью в отношении вирусов гриппа и герпеса. Эти соединения в силу указанных свойств могут найти применение в экспериментальной биологии и медицине. Известны противовирусные свойства тритерпеноида лупанового ряда, бетулиновой кислоты, в отношении вируса герпеса простого 1. Более высокими противовирусными свойствами в отношении вируса герпеса простого обладают другие тритерпеноиды лупанового ряда, бетулоновая кислота и бетулин 2, 3. Бетулин не обладает противовирусными свойствами в отношении вирусов гриппа 4. В патентной и научно-технической литературе информация о противовирусных свойствах других тритерпеноидов лупанового ряда в отношении вирусов гриппа отсутствует. Задачей изобретения является увеличение противовирусной активности и расширение ассортимента средств, обладающих противовирусным действием. Поставленная задача достигается применением ряда новых лупановых тритерпеноидов следующего строения 32-(3)223,авторами обнаружены неочевидные свойства, позволяющие применить новые тритерпеноиды ряда лупана в качестве ингибиторов размножения вирусов гриппа и герпеса. Сущность изобретения иллюстрируется примерами. Пример 1. Получение 3-оксо-28-норлуп-17 карбамоил-20(29)ена (соединение ). К раствору 1 ммоль (0,47 г) хлорангидрида бетулоновой кислоты в 5 мл сухого хлороформа добавляют 3 мл жидкого аммиака и смесь перемешивают 20 мин при 20-22 . Растворитель упаривают в вакууме досуха. Выход 0,46 г (97 ) продукта. Тпл.197-199 . Найдено,С-79.27, Н-10.61, -3.08. 30472. Вычислено,-79.40, Н-10.46, -3.09. ИК-спектр (, см-1, вазелиновое масло) 3250, 3020-2840, 1756, 1712, 1696, 1632, 1545,1472, 1466, 1374, 1312, 1241, 1212, 1168, 1140, 1036, 1006, 988, 912, 888, 812, 744. Спектр 1 ЯМР (, м.д., 3) 0.80, 0.84, 0.90, 0.93, 0.98 (5 с, 15 Н, 53), 1.00-2.00 (м, 2, ),1.59 (с, 3 Н, 3), 2.25-2.37 (м, 3 Н, 13, 16), 3.12 (дт, 1, 19, 11.3, 4.3 Гц), 4.50 и 4.64 7601 1 2005.12.30 Пример 2. Получение 3-оксо-28-норлуп-28-(-карбонил-О-метиллейцин)-20(29)-ена (соединение ). К суспензии 1,3 ммоля гидрохлорида метилового эфира -лейцина в 5 мл сухого хлороформа при перемешивании приливают по каплям 0,23 мл триэтиламина, добавляют раствор 1 ммоль (0,47 г) хлорангидрида бетулоновой кислоты в 5 мл хлороформа и кипятят 1 час. Реакционную массу оставляют на ночь, фильтрат промывают 10 мл 10 раствора соляной кислоты, 210 мл воды, сушат над 4 и отгоняют растворитель в вакууме. Продукт реакции хроматографируют на колонке с 23, элюируя хлороформом, выход 0,51 г(С 29), 150.7 (С 20), 173.8 (С 2), 175.9 , 218.0 (С 3). Пример 3. Получение 3-оксим-28-норлуп-28-(-карбонил-О-метилметионин)-20(29)-ена (соединение ). К суспензии 1,3 ммоля гидрохлорида метилового эфира -метионина в 5 мл сухого хлороформа при перемешивании приливают по каплям 0,23 мл триэтиламина, добавляют раствор 1 ммоль (0,49 г) хлорангидрида 3-оксим-бетулоновой кислоты в 5 мл хлороформа и кипятят 1 час. Реакционную массу оставляют на ночь, фильтрат промывают 10 мл 10 раствора соляной кислоты, 210 мл воды, сушат над 4 и отгоняют растворитель в вакууме. Продукт реакции хроматографируют на колонке с 23, элюируя хлороформом. Выход 0,55 г (87 ) аморфного вещества. Найдено,С-68.56, Н-9.21, -6.62, -4.97. 365843. Вычислено,С-68.34, Н-9.31, -6.68, -5.10. ИК-спектр (, см-1, вазелиновое масло) 3020-2784, 1764, 1714, 1698, 1668, 1636, 1532, 1478, 1452, 1314, 1267, 1240,1144, 1112, 1036, 1014, 988, 936, 888, 828, 744. Спектр 1 ЯМР (, м.д., 3) 0.80, 0.85,0.91, 0.94, 0.99 (5 с, 15 Н, 5 СН 3), 1.10-2.00 (м, 2, ), 1.60 (с, 3 Н, 3), 2.04 (уш. сигнал,3 Н, Н 6), 2.27-2.40 (м, 3 Н, 13, 16), 2.95-3.08 (м, 1, Н 19), 3.68 (с, 3 Н, 1), 4.51 (уш. сигнал, 1, Н 29), 4.57-4.66 (м, 2 Н, Н 29, Н 3), 6.36 (д, 1, ,7.7 Гц), 9.50 (уш. сигнал, 1, -3). Спектр 13 ЯМР (, м.д., 3) 14.3, 15.2 (С 6), 15.7, 15.7, 19.3, 19.4,20.8, 21.3, 25.4, 26.4, 29.3, 30.1 (С 4), 30.5, 31.3 (С 5), 33.3, 33.5, 33.9, 36.7, 37.5, 37.8, 39.4,40.5, 42.3, 46.2, 47.0, 49.7, 49.8, 51.0 (С 3), 52.1 (1), 54.7, 55.5, 109.1 (С 29), 150.5 (С 20),164.5 (С 3), 172.5 (2), 176.0 . Пример 4. Получение 3-оксо-28-норлуп-28-(-карбонил-18-амино-октадекан)-20(29)-ена (соединение ). К 1 ммоль (0,47 г) хлорангидрида бетулоновой кислоты в 10 мл сухого диоксана прибавляют 1,6 ммоль (0,35 г) октадециламина и кипятят 2 часа. После охлаждения выливают в 30 мл 5 водного раствора соляной кислоты, осадок фильтруют, промывают водой до нейтральной среды. Продукт реакции хроматографируют на колонке с 23, элюируя хлороформом. Выход 0,47 г (67 ) в виде желтого аморфного вещества.0.57. Найдено,С 80.92,11.76,1.86. 48832. Вычислено,С 81.50,12.00,1.98. ИКспектр (, см-1, вазелиновое масло) 3035-2840, 1741, 1716, 1696, 1680, 1662, 1632, 1502,1474, 1450, 1386, 1316, 1255, 1240, 1221, 1160, 1136, 1040, 1008, 986, 930, 888, 824, 760. 3(29), 150.7 (20), 175.8 , 217.7 (С 3). Пример 5. Получение 3-оксо-28-норлуп-28-(-карбонил-О-метилметионин)-20(29)-ена (соединение ). К суспензии 1,3 ммоля гидрохлорида метилового эфира -метионина в 5 мл сухого хлороформа при перемешивании приливают по каплям 0,23 мл триэтиламина, добавляют раствор 1 ммоль (0,47 г) хлорангидрида бетулоновой кислоты в 5 мл хлороформа и кипятят 1 час. Реакционную массу оставляют на ночь, фильтрат промывают 10 мл 10 раствора соляной кислоты, 210 мл воды, сушат над 4 и отгоняют растворитель в вакууме. Продукт реакции хроматографируют на колонке с 23, элюируя хлороформом,выход 0,55 г (91 ) аморфного вещества. Найдено,-71.51, Н-9.80, -2.12, -5.08. 36574. Вычислено,С-71.92, Н-9.75, -2.33, -5.34. УФ-спектр , ах/нм 263 (4.18). ИК-спектр (, см-1, вазелиновое масло) 3040-2840, 1724, 1704, 1688, 1672,1652, 1633, 1504, 1472, 1448, 1364, 1312, 1256, 1236, 1184, 1135, 1112, 1040, 1004, 976, 940,888, 828, 760. Спектр 1 ЯМР (, м.д., 3) 0.80, 0.85, 0.91, 0.94, 0.99 (5 с, 15 Н, 53),1.10-2.00 (м, 25 Н, 2, ), 1.60 (с, 3 Н, 3), 2.04 (уш. сигнал, 3 Н, Н 6), 2.27-2.40 (м, 3 Н,Н 13, Н 16), 2.95-3.08 (м, 1, Н 19), 3.68 (с, 3 Н, 1), 4.51 (уш. сигнал, 1, Н 29), 4.57-4.66 (м,2 Н, Н 29, Н 3), 6.36 (д, 1, ,7.7 Гц). Спектр 13 ЯМР (, м.д., 3) 14.3, 15.2(С 6), 15.7, 15.7 19.3, 19.4, 20.8, 21.3, 25.4, 26.4, 29.3, 30.1 (С 4), 30.5, 31.3 (С 5), 33.3, 33.5,33.9, 36.7, 37.5, 37.8, 39.4, 40.5, 42.3, 46.2, 47.0, 49.7, 49.8, 51.0 (С 3), 52.1 (1), 54.7, 55.5,109.1 (С 29), 150.5 (С 20), 172.5 (С 2), 176.0 , 217.7 (С 3). Пример 6. Получение фенил-гидразидо-гидразон-3-оксим-луп-20(29)-ен-28-оевой кислоты (соединение ). Смесь эквимолярного количества (1 ммоль) гидразида 3-оксим-бетулоновой кислоты(0,48 г) и бензальдегида (0,15 мл) в 20 мл этанола кипятят 6 ч. После охлаждения выливают смесь в 50 мл 5 раствора соляной кислоты, осадок отфильтровывают, промывают водой до нейтральной реакции. Остаток хроматографируют на колонке с окисью алюминия, элюируя смесью хлороформа-ацетона (51, /), выход 0,52 г (91 ). Тпл.264-267 . Найдено,С-77.97, Н-9.53, -7.22. 375323. Вычислено,С-77.70, Н-9.36, -7.35. УФ-спектр , /нм 292 (4.44). ИК-спектр (, см-1, вазелиновое масло) 1726,1700, 1660, 1625, 1550, 1520, 1488, 1460, 1415, 1392, 1318, 1296, 1260, 1215, 1162, 1140,1098, 1028, 990, 916, 888, 840, 766. Спектр 1 ЯМР (. м.д., 3) 0.87, 0.90, 0.94, 0.99,1.01 (5, 15 Н, 53), 1.20-2.00 (м, 2, ), 1.70 (с, 3 Н, 3), 2.31-2.67 (м, 3 Н, Н 13, Н 16),2.85-3.05 (м, 1, Н 19), 4.59 и 4.73 (оба уш. сигнала, по 1, Н 29), 7.25-7.37 и 7.58-7.70 (оба м, 5 Н,аромат.), 8.38 (уш. сигнал, 1, --), 8.52 (уш. сигнал, 1, ), 9.50(уш. сигнал, 1, -3). Спектр 13 ЯМР (, м.д., 3) 14.0, 15.1, 15.8, 16.2, 18.5, 18.7,21.1, 22.4, 25.5, 27.0, 29.6, 30.5, 32.2, 33.7, 36.9, 37.1, 37.4, 38.4, 39.5, 40.6, 42.1, 46.3, 50.1,54.4, 55.0, 55.4, 108.9 (С 29), 126.8, 128.4, 128.4, 129.4, 129.4, 134.9, 145.8 (1), 150.8 (С 20),163.9 (С 3), 172.7 . Пример 7. При проведении испытаний с вирусом гриппа //34 (71) используют культуру клеток первичных фибробластов эмбрионов кур (ФЭК). Испытания проводят методом редукции количества бляшек под агаровым покрытием. 4 7601 1 2005.12.30 Монослойную культуру ФЭК, выращенную во флаконах, отмывают от ростовой среды, инфицируют различными разведениями вируса в пределах 0,01-0,00001 БОЕ/клетка путем нанесения на клетки вируссодержащей суспензии в объеме 0,1 мл на 1 час при 37 . Затем жидкость удаляют и клетки покрывают расплавом питательного покрытия на основе концентрата среды 199 с добавлением 1 бактагара и 0,005 нейтрального красного (все реактивы ) и различных концентраций 3-оксо-28-норлуп-17-карбамоил 20(29)-ена (соединение ). 3-Оксо-28-норлуп-17-карбамоил-20(29)-ен предварительно растворяют в 10 этаноле. После застывания покрытия флаконы помещают в термостат на 36 час и затем подсчитывают количество бляшек, видимых благодаря присутствию в покрытии витального красителя. На основе количества бляшек вычисляют титр вируса. Критерием противовирусного действия считают наличие различий в сравнении с контролем вируса. Вычисляют также концентрацию 50 подавления размножения вируса(среднеэффективная концентрация, ЕС 50) и отношение максимальной переносимой концентрации (МПК) к ЕС 50. Кроме того, вычисляют индекс селективности (МПК/ЕС 90). МПК соединений для неинфицированных культур клеток определяют после 72 час инкубации. Полученные результаты приведены в таблице 1. Пример 8. Исследование, описанное в примере 7, выполняют с 3-оксо-28-норлуп-28-(-карбонил-О-метиллейцин)-20(29)-еном (соединение ). Полученные результаты приведены в таблице 1. Пример 9. Исследование, описанное в примере 7, выполняют с 3-оксим-28-норлуп-28-(карбонилО-метилметионин)-20(29)-еном (соединение ). Полученные результаты приведены в таблице 1. Пример 10. Исследование, описанное в примере 7, выполняют с бетулином. Полученные результаты приведены в таблице 1. Таблица 1 Противовирусные свойства лупановых тритерпеноидов в отношении вируса гриппа Концен- Титр виру- Разность с СоедиЕС 50(95),Отношение Отношение трация,сах,контролем,нение Мкг/мл МПК/ЕС 50 МПК/ЕС 90 мкг/мл БОЕ/мл БОЕ/мл-0,03 0 5,870,01 максимальная переносимая концентрация (МПК) Пример 11. При проведении испытаний с вирусом герпесатипа (ВПГ, штамм 1 С) используют перевиваемую культуру клеток рабдомиосаркомы . Монослойную культуру клеток, выращенную во флаконах, отмывают от ростовой среды, инфицируют 0,01-0,001 ТЦИД 50/клетка вирусов путем нанесения на клетки разведения вируссодержащей суспензии в объеме 0,1 мл на 1 час при 37 . Затем жидкость удаляют и клетки покрывают средой поддержки (среда 199), содержащей различные концентрации 3-оксо-28-норлуп-28(-карбонил-18-амино-октадекан)-20(29)-ена (соединение ). 3-Оксо-28-норлуп-28-(карбонил-18-амино-октадекан)-20(29)-ен предварительно растворяют в 10 этаноле. После 48 час инкубации при 37 регистрируют морфологические изменения монослоя клеток (цитопатическое действие (ЦПД) вируса, увеличение 80). Находят минимальную концентрацию соединений, подавляющую развитие ЦПД вируса на 50(ТЦД 50). Критерием противовирусного действия считают наличие различий в сравнении с контролем вируса. Вычисляют также концентрацию 50 подавления размножения вируса (среднеэффективная концентрация, ЕС 50) и отношение максимальной переносимой концентрации(МПК) к ЕС 50. Кроме того, вычисляют индекс селективности (МПК/ЕС 90). МПК соединений для неинфицированных культур клеток определяют после 72 час инкубации. Полученные результаты приведены в таблице 2. Пример 12. Исследование, описанное в примере 11, выполняют с 3-оксо-28-норлуп-28-(-карбонил-18-амино-октадекан)-20(29)-еном (соединение ). Полученные результаты приведены в таблице 2. Пример 13. Исследование, описанное в примере 11, выполняют с 3-оксо-28-норлуп-28-(-карбонил-О-метил-метионин)-20(29)-еном (соединение ). Полученные результаты приведены в таблице 2. Пример 14. Исследование, описанное в примере 11, выполняют с фенил-гидразидо-гидразон-3 оксим-луп-20(29)-ен-28-оевой кислотой (соединение 1). Полученные результаты приведены в таблице 2. 6 7601 1 2005.12.30 Пример 15. Исследование, описанное в примере 11, выполняют соединениями сравнения бетулиновой кислотой, бетулоновой кислотой и бетулином. Полученные результаты приведены в таблице 2. Таблица 2 Противовирусные свойства лупановых тритерпеноидов в отношении вируса герепеса простого Соединение Как видно из данных таблицы 1, все заявляемые лупановые тритерпеноиды подавляют размножение вируса гриппа в культуре клеток. Наиболее выраженное снижение инфекционности вируса и широкий диапазон эффективных концентраций имеет соединение . Соединениехарактеризуется наиболее широким отношением максимальной переносимой концентрации к среднеэффективной, однако снижение инфекционности в его присутствии, как правило, не достигает 90 уровня (1 БОЕ/мл). Из таблицы 2 следует, что известные тритерпеноиды бетулин, бетулиновая и бетулоновая кислоты обладают выраженными ингибирующими свойствами в отношении вируса герпеса простого. Наиболее широкий диапазон эффективных концентраций МПК/ЕС 50 и МПК/ЕС 90 имеют бетулин (отношение МПК/50172,41) и бетулоновая кислота (отношение МПК/ЕС 9050). В то же время отношение МПК/ЕС 90 заявляемого соединенияравно 129, что в 2,6 раза выше, чем у бетулоновой кислоты. Отношение МПК/ЕС 50 соединений ,ивыше, чем у бетулина в 1,04 1,73 и 1,05 раза соответственно. Таким образом, заявляемое решение позволяет решить поставленную задачу. При использовании новых тритерпеновых соединений лупанового ряда удается получить подавление размножения вирусов гриппа и герпеса в культуре клеток. Заявляемые химические соединения могут быть использованы в исследовательской лабораторной практике непосредственно в настоящий момент для подавления размножения вирусов гриппа и герпеса и редукции вызываемых ими заболеваний. В связи с установленными свойствами заявляемые вещества имеют большое практическое значение. На их основе могут быть разработаны лекарственные формы препаратов для лечения и профилактики гриппа и герпетических поражений. Ожидается, что такие препараты будут эффективны также и при инфекциях, вызванных вариантами вируса гриппа, устойчивого к действию известного лекарственного средства ремантадина, и вируса герпеса, устойчивого к действию известного препарата, ацикловира, а также при развитии лекарственной устойчивости к известным препаратам в ходе лечения. Экспериментальные данные, свидетельствующие об эффективности тритерпеноидов в отношении варианта вируса герпеса, устойчивого к действию ацикловира, показаны на примере мороновой кислоты 4. Известно, что при лечении герпетических поражений ацикловиром достаточно быстро развивается лекарственная устойчивость возбудителя 5, 6. Следовательно, в таких случаях может быть оправдано применение средств на основе тритерпеноидов лупанового ряда в качестве препаратов для самостоятельной или комбинированной терапии. Препараты на основе лупановых тритерпеноидов могут иметь применение и при профилактике гриппа, особенно в коллективах полузакрытого типа, в частности се 8 7601 1 2005.12.30 мейных очагах. При появлении заболевших в таких коллективах для лечения, как правило,используют ремантадин как наиболее эффективный этиотропный препарат. Однако после нескольких дней приема ремантадина больной становится распространителем ремантадинустойчивого вируса гриппа, который может вызвать заболевание у остальных членов коллектива 7. При этом применение ремантадина лицами окружения с профилактической или лечебной целью может быть уже не столь эффективным. Как и в случае с герпетической инфекцией, здесь целесообразно профилактическое применение препаратов на основе тритерпеноидов ряда лупана самостоятельно или в комбинации с ремантадином. Для выработки окончательных рекомендаций по применению лупановых тритерпеноидов с целью лечения и профилактики вирусных инфекций, в том числе тех из них, которые вызываются вариантами возбудителей, устойчивыми к известным и применяющимся препаратам, необходимы изучение безвредности, разработка лекарственной формы,клинические испытания и отработка оптимальных схем применения. Информационные источники 1.,.-.,С.О.,, ..1992 15(3) 242-5 /-.-.6,214,350.10, 2001. 61 035/78. 2..,.,.,.,.,Т.,., . -.1999 289 72-8. 3.5,750,578.01 027/0001 031/0061 039/245, 12,05.1998. 4. Платонов В.Г., Зорина А.Д., Гордон М.А., Чижов Н.П., Балыкина Л.В., Михайлов Ю.Д., Иванен Д.Р., Трон Ким Кви, Шавва .Г. Исследование противогриппозной активности тритерпеноидов. Хим. фарм. журнал, 1995, 29(2), с. 42-46. 5., Сое ,.//., 1995, . 26, . 369-401. 6..,,//., 1995, . 26, . 423-438. 7. Бореко Е.И., Павлова .И. Амантадин и ремантадин в профилактике и лечении гриппа // Мед. Новости, 1999 г.,3, с. 20-25. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: C07J 53/00, C07J 63/00, A61P 31/16, A61K 31/56, A61P 31/22
Метки: тритерпеноиды, ингибирующие, лупановые, размножение, герпеса, вирусов, гриппа
Код ссылки
<a href="https://by.patents.su/9-7601-lupanovye-triterpenoidy-ingibiruyushhie-razmnozhenie-virusov-grippa-i-gerpesa.html" rel="bookmark" title="База патентов Беларуси">Лупановые тритерпеноиды, ингибирующие размножение вирусов гриппа и герпеса</a>
Предыдущий патент: Способ сварки намагниченных трубопроводов при проведении ремонтно-восстановительных работ
Следующий патент: Газостатический опорный механизм ротора
Случайный патент: Способ формирования композиционного покрытия из силикатполимерного материала