Пептидный ингибитор эластазы
Номер патента: 10709
Опубликовано: 30.06.2008
Авторы: Кирковский Валерий Васильевич, Голубович Владимир Петрович, Чемитова Лилия Михайловна, Поликарпова Валентина Ивановна
Текст
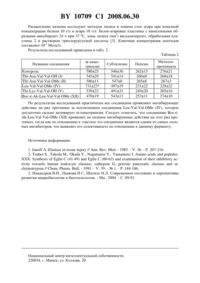
(51) МПК (2006) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ(71) Заявитель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(72) Авторы Чемитова Лилия Михайловна Голубович Владимир Петрович Поликарпова Валентина Ивановна Кирковский Валерий Васильевич(73) Патентообладатель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(57) Пептидный ингибитор эластазы, выбранный из группы, включающей с константой ингибирования, равной 16,6 мкМоль, с константой ингибирования, равной 13,3 мкМоль, с константой ингибирования, равной 11,9 мкМоль, с константой ингибирования, равной 10,6 мкМоль, с константой ингибирования, равной 7,3 мкМоль, с константой ингибирования, равной 7,3 мкМоль, с константой ингибирования, равной 6,6 мкМоль, с константой ингибирования, равной 5,3 мкМоль, и ,где- трет-бутилоксикарбонильная группа, - метильная группа,- - остаток -аминокапроновой кислоты. Данное изобретение относится к области биоорганической химии, в частности к новым пептидным ингибиторам , , ,, , , , , , ,которые могут быть использованы в медицинской практике для ингибирования действия эластазы. Протеолитический фермент эластаза участвует в развитии многих воспалительных процессов, таких как эмфизема, артриты, хронический бронхит, хронический и острый панкреатиты, новообразование (рак) поджелудочной железы и мн. др. 1. Известны синтетические пептидные ингибиторы эластазы общей формулы Х-Р 4-Р 3-Р 21- (где ХН-- -СН 3), имеющие в положении Р 1 и Р 2 остатки валина, а в положениях Р 3 и Р 4 остатки аспарагина и треонина соответственно. Наиболее распространенными ингибиторами эластазы являются и - пептидные фрагменты естественного белкового ингибитора эластазы 2. 10709 1 2008.06.30 Задачей изобретения является создание новых пептидных ингибиторов с формулами , , , , , , , , , , обладающих высокой ингибиторной активностью по отношению к эластазе. Для решения данной задачи с помощью методов теоретического конформационного анализа разработаны структуры соединений -, обеспечивающие конформационное строение молекулы, необходимое для лучшего их связывания в активном центре эластазы. На основе проведенного конформационного анализа синтезированы оригинальные пептидные ингибиторы, которые проявляют повышенную, по сравнению с соединением , ингибиторную активность по отношению к эластазе, а также соединениеобладает большей специфичностью по отношению к данному ферменту. Синтез ингибиторов проводят постепенным наращиванием пептидной цепи по -концу. При этом используют методы пептидной конденсации - карбодиимидный метод и метод смешанных ангидридов. Так, для синтеза метилового эфира С-концевого дипептида ОСН 3 к раствору -ОСН 3 в ДМФА в присутствии -метилморфолина прибавляют эквимолярное количество раствора в ТГФ, охлажденного до-10 С, в присутствии эквимолярного количества этилхлорформиата. Реакционную смесь перемешивают при температуре -10 С в течение 2 ч и оставляют на ночь в морозильной камере. Полученный ОСН 3 деблокируют действием раствора НС в ЭА, для чего к взвеси ОСН 3 в ЭА прибавляют 5 н раствор НС в ЭА при комнатной температуре. Реакционную смесь перемешивают в течение 1 часа (деблокирование всех-концевых защитных групп проводят аналогичным способом). Далее к раствору ОСН 3 в ДМФА в присутствии -метилморфолина (триэтиламина) и противорацемической добавки(-гидроксибензотриазола) прибавляют эквимолярное количество -защищенной аминокислоты (например, для соединенийитакой кислотой является , а для соединенийи- ), охлаждают до 0 С и добавляют раствор 1,1-кратного избыткав ДМФА. Реакционную смесь перемешивают в течение 3 ч при 0 С и 20 ч при комнатной температуре. Полученный метиловый эфир трипептида деблокируют. На этой стадии синтез соединениязавершен. Далее к раствору деблокированного метилового эфира трипептида в ДМФА прибавляют эквимолярное количество -ДЦГА (в случае соединениявместо -ДЦГА прибавляют Восаминокапроновую кислоту и -метилморфолин) и перемешивают в течение 15 мин. Затем к реакционной смеси прибавляют эквимолярное количество НОВТ,охлаждают до 0 С и добавляют раствор 1,1-кратного избыткав ДМФА. Реакционную смесь перемешивают в течение 2 ч при 0 С и 20 ч при 20 С. На этой стадии синтез соединений , , ,завершен. Далее проводят щелочной гидролиз полученных метиловых эфиров тетрапептидов. Для этого к раствору метилового эфира тетрапептида в МеОН прибавляют равный объем 4 н раствораи перемешивают в течение 1 ч. Затем к реакционной смеси прибавляют 15 мл ЭА и подкисляют при охлаждении 1 н раствором НС до рН 4. На этой стадии синтез соединенийизавершен. Для получения соединений ,ипроводят деблокирование полученных тетрапептидов, как описано выше. Температуры плавления соединений определяют в открытых капиллярах. Упаривание растворов проводят на ротационном вакуумном испарителе при остаточном давлении 10-15 мм рт. ст. Однородность полученных соединений проверяют методом тонкослойной хроматографии на пластинках Силуфол с использованием следующих систем хлороформметаноламмиак (641), бутанолуксусная кислотаводаэтилацетат 10709 1 2008.06.30 Активность и специфичность заявляемых пептидных ингибиторов подтверждена исследованиями их ингибирующей активности по отношению к эластазе и другим сериновым протеиназам (примеры 1 и 2). Пример 1. Кинетические исследования ингибиторной активности пептидных соединений по отношению к эластазе в сравнении с известным эластазным ингибитором . Исследования проводят на приборепри длине волны 410 нм. Используют водную суспензию эластазы фирмы . В опытную кювету помещают 0,88 мл 0,1 М Трис- буферного раствора рН 8,5 и 0,02 мл раствора субстрата (С 110-3 Моль/л в ДМСО), в кювету сравнения дополнительно вводят 0,015 мл уксусной кислоты. Кюветы находятся при постоянном термостатировании при 37 С. В отдельную пробирку помещают 0,97 мл 0,1 М Трис- буферного раствора, 0,01 мл фермента с концентрацией С 150 мкг/мл и 0,02 мл раствора ингибитора (С 110-3 Моль/л в ДМСО). Смесь инкубируют в термостате при 37 С в течение 2 мин, затем быстро отбирают 0,1 мл реакционной смеси и помещают ее в опытную кювету. Полученные значения констант ингибированиядля заявляемых соединений по сравнению с известным аналогомприведены в табл. 1. Таблица 1 п/п-6 5,3 2,010 никакого прироста поглощения не наблюдалось Результаты исследования показывают, что защищенные по -концу аминокислоты проявляют большее ингибирующее действие на эластазу, нежели их незащищенные аналоги, что может быть обусловлено наличием дополнительной гидрофобной Вос-группы на-конце, а также наличием в положении Р 3 либо остатков гидрофобных аминокислот, либо остатков аминокислот с положительным зарядом. Также можно сказать, что все вышеприведенные пептидные соединения являются ингибиторами эластазы и проявляют повышенную ингибирующую активность по отношению к данному ферменту (соединенияиполностью инактивируют действие эластазы) по сравнению с известным тетрапептидным аналогом . Пример 2. Исследование специфичности соединений , , , ,по отношению к пулу протеиназ. В работе используют бактоагар типа, казеин по Гаммерстену, образцы-химотрипсина (ЕС 3.4.21.1), пепсина (ЕС 3.4.23.1) фирмы , субтилизина Вас.( 3.4.21.62), металлопротеиназы Вас.( 3.4.24.4) Диагностикум,Москва. В качестве растворителя при работе с пепсином используют 0,2 М ацетатный буфер рН 1,5, при работе с остальными протеиназами - 0,06 М фосфатный буфер рН 7,4. 3 10709 1 2008.06.30 Расщепление казеина исследуют методом лизиса в тонком слое агара при конечной концентрации белков 10 г/л и агара 10 г/л. Белок-агаровые пластины с нанесенными образцами инкубируют 24 ч при 37 С, зоны лизиса (мм 2) визуализируют, обрабатывая пластины 2 н раствором трихлоруксусной кислоты 3. Конечная концентрация пептидов составляет 10-3 Моль/л. Результаты исследований приведены в табл. 2. Таблица 2 Название соединения Контроль По результатам исследований практически все соединения проявляют ингибирующее действие на ряд протеиназ за исключением соединения , которое достаточно сильно активирует -химотрипсин. Следует отметить, что соединение проявляет не сильное ингибирующее действие на этот ряд протеиназ, тогда как по отношению к эластазе это соединение является одним из самых сильных ингибиторов, что выявляет его селективность по отношению к данному ферменту. Источники информации 1..// . . . - 1985. - . 36. - . 207-216. 2..,.,.,.,...С (41-49)С (60-63),,// . . . - 1991. - . 39. -1. - . 184-186. 3. Никандров В.Н., Пыжова Н.С, Шатило Н.Л. Современное состояние и перспективы развития микробиологии и биотехнологии. - Мн., 2004. - С. 89-91. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 4
МПК / Метки
МПК: A61K 38/07, C07K 5/00
Метки: пептидный, ингибитор, эластазы
Код ссылки
<a href="https://by.patents.su/4-10709-peptidnyjj-ingibitor-elastazy.html" rel="bookmark" title="База патентов Беларуси">Пептидный ингибитор эластазы</a>
Предыдущий патент: Способ формирования питающей еюностомы
Следующий патент: Полевой измельчитель
Случайный патент: Арбалет