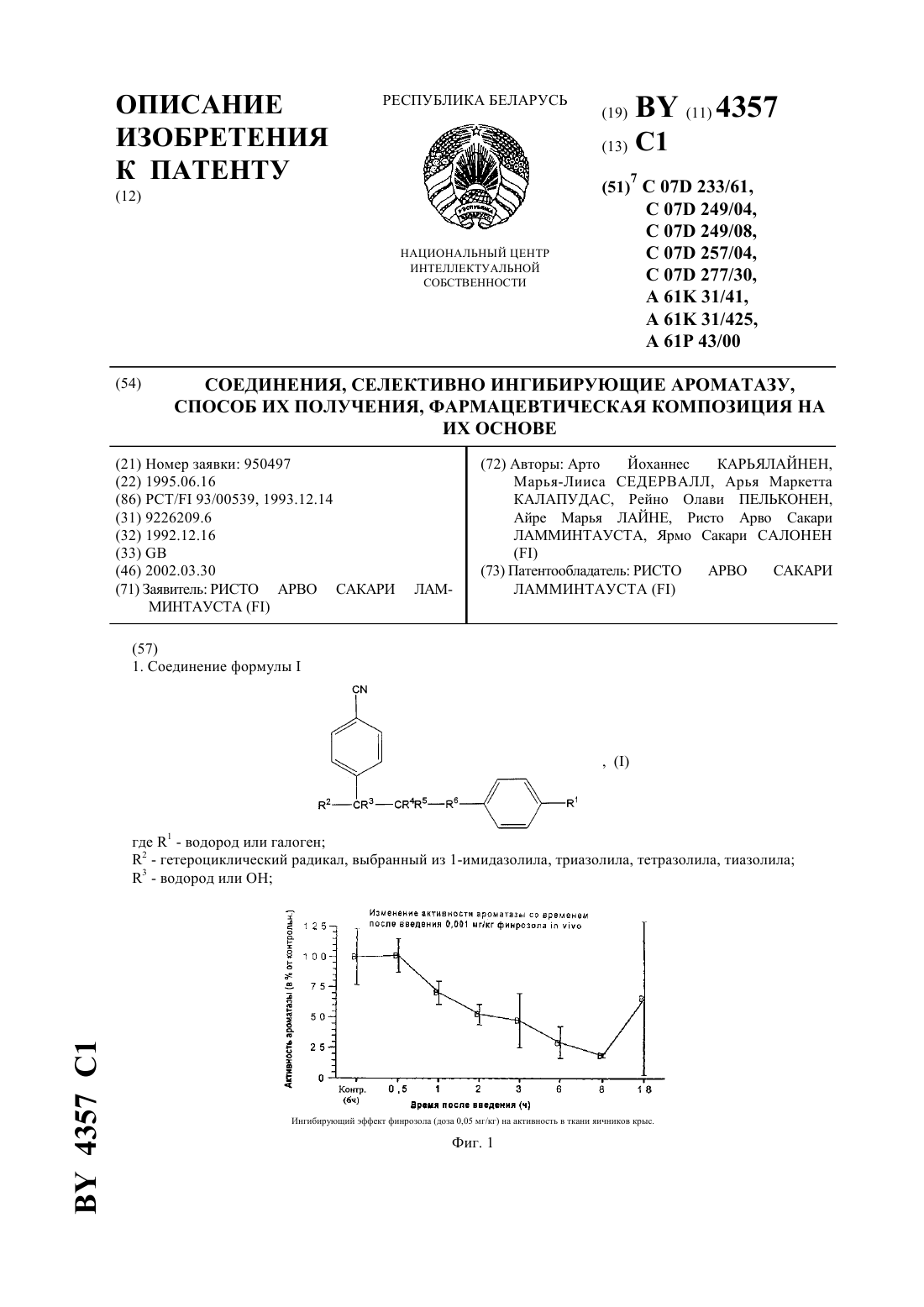
Соединения, селективно ингибирующие ароматазу, способ их получения, фармацевтическая композиция на их основе
Номер патента: 4357
Опубликовано: 30.03.2002
Авторы: Арто Йоханнес КАРЬЯЛАЙНЕН, Ярмо Сакари САЛОНЕН, Арья Маркетта КАЛАПУДАС, Рейно Олави ПЕЛЬКОНЕН, Марья-Лииса СЕДЕРВАЛЛ, РИСТО АРВО САКАРИ ЛАММИНТАУСТА, Айре Марья ЛАЙНЕ
Текст
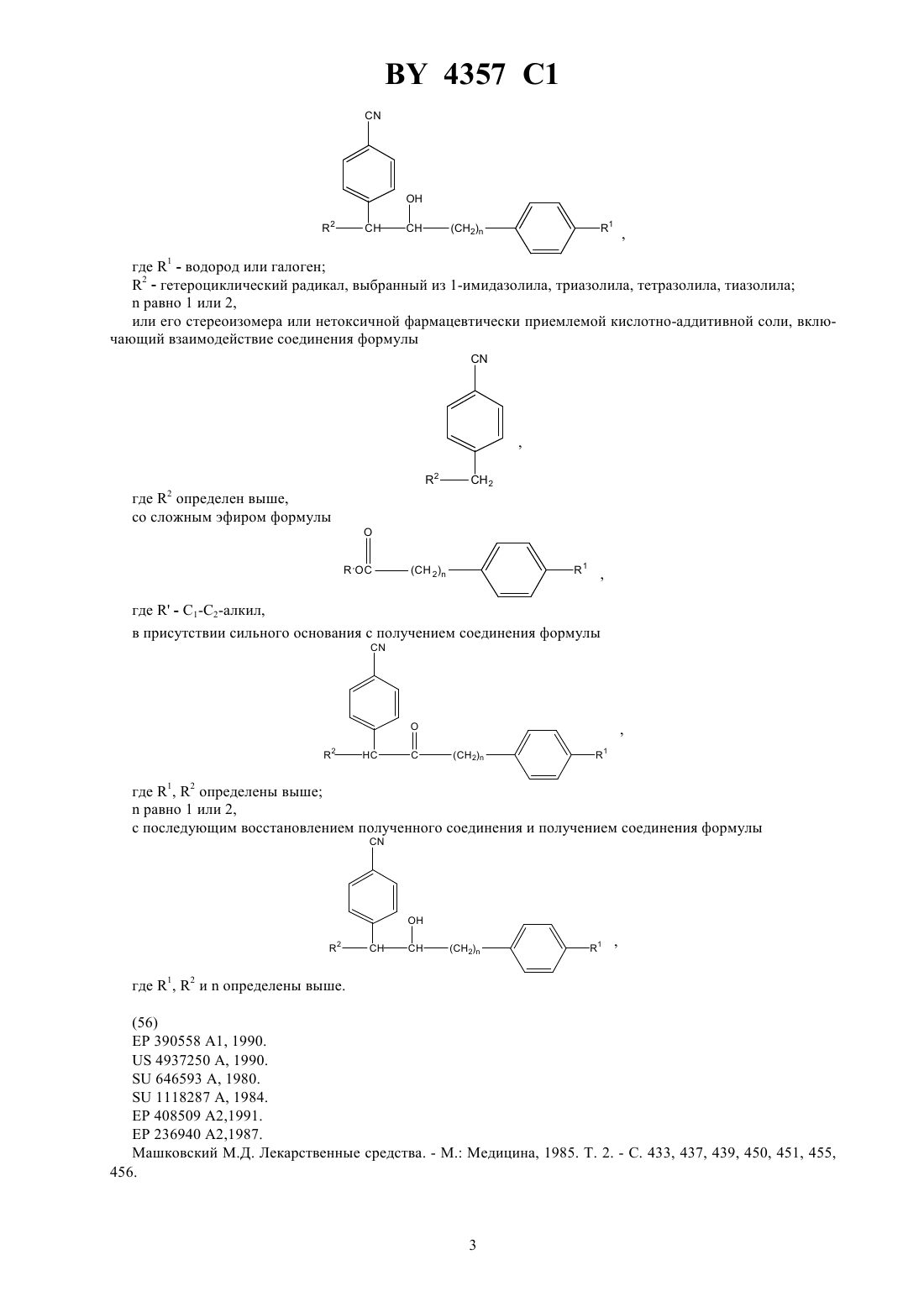
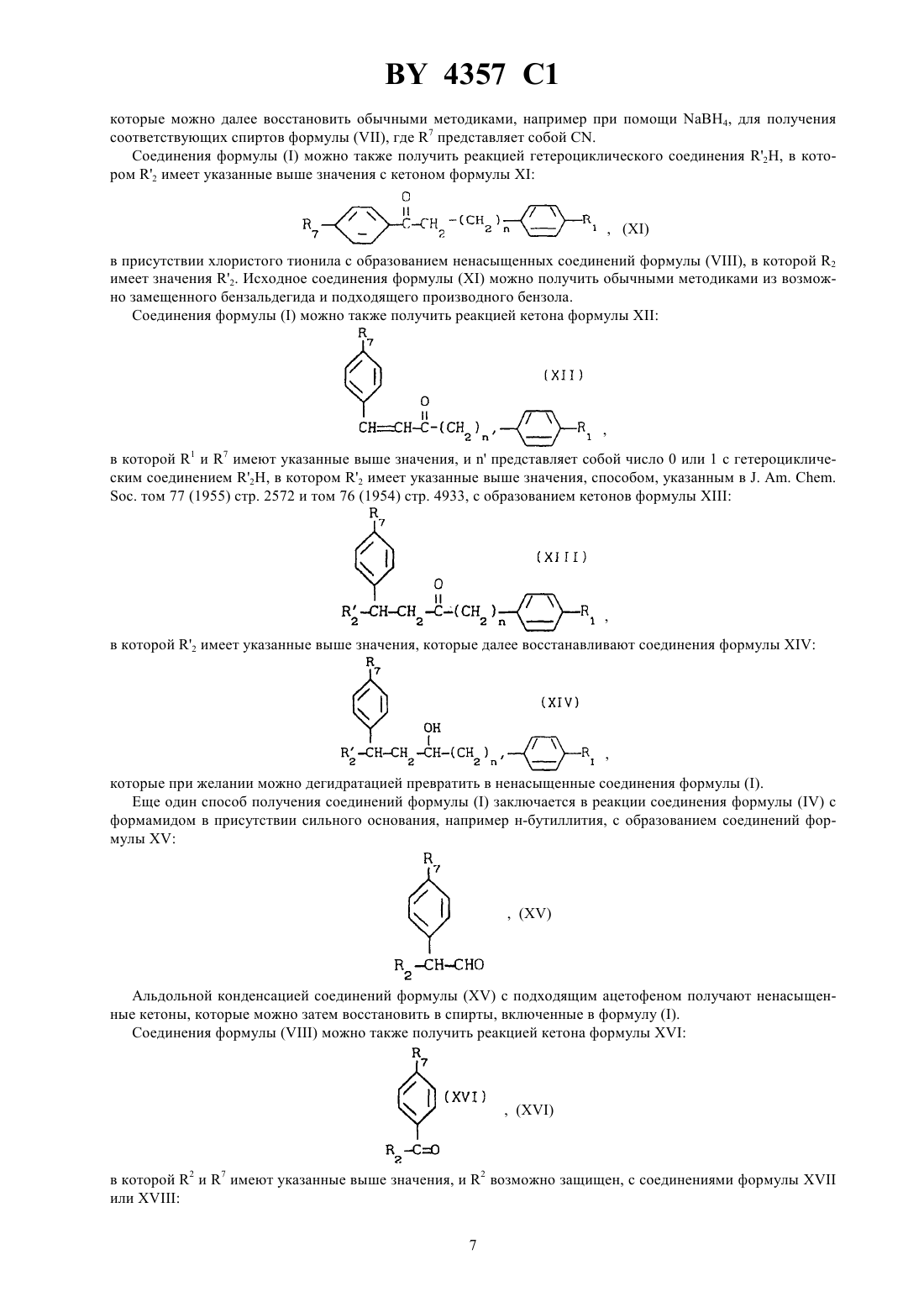
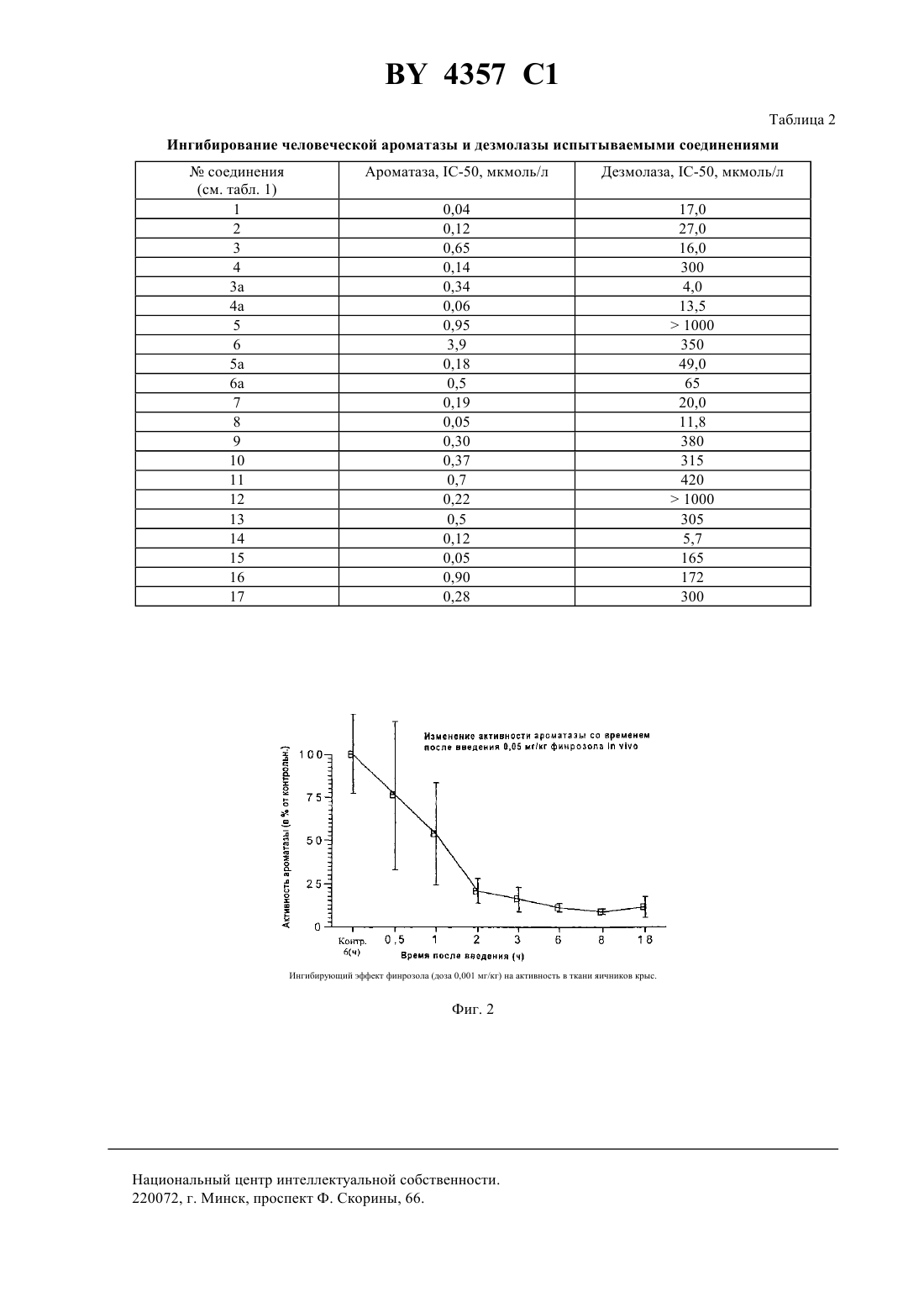
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СОЕДИНЕНИЯ, СЕЛЕКТИВНО ИНГИБИРУЮЩИЕ АРОМАТАЗУ,СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ(71) Заявитель РИСТО АРВО САКАРИ МИНТАУСТА(72) Авторы Арто Йоханнес КАРЬЯЛАЙНЕН,Марья-Лииса СЕДЕРВАЛЛ, Арья Маркетта КАЛАПУДАС, Рейно Олави ПЕЛЬКОНЕН,Айре Марья ЛАЙНЕ, Ристо Арво Сакари ЛАММИНТАУСТА, Ярмо Сакари САЛОНЕН(73) Патентообладатель РИСТО АРВО САКАРИ ЛАММИНТАУСТА где 1 - водород или галоген 2 - гетероциклический радикал, выбранный из 1-имидазолила, триазолила, тетразолила, тиазолила 3 - водород или Ингибирующий эффект финрозола (доза 0,05 мг/кг) на активность в ткани яичников крыс. 4357 1 4 - водород 5 - водород илиили 4 - водород, а 3 и 5 вместе образуют связь или 3 - водород, а 4 и 5 вместе образуют О 6 - метилен, этилен, , 2-, -- или -( )- или 4 - водород, а 5 и 6 вместе представляют или их стереоизомеры, или их нетоксичные фармацевтически приемлемые кислотно-аддитивные соли,при условии, что 6 не может быть -С(О) -, когда 2. Соединение по п. 1, в котором 3 и 4 - водород и 5 - , или 3 -и 4 и 5 - водород, и 6 - метилен или этилен, или 3, 4 и 5 водород и 6 представляет или 21 и 2 имеют значения, определенные в п. 1. 3. Соединение по п. 1, в котором 3 и 4 - водород, и 5 - , 6 - метилен или этилен или 3, 4 и 5 - водород, 6 представляет собой - или 21 и 2 имеют значения, определенные в п. 1. 4. Соединение по п. 1, в котором 4 - водород и 3 и 5 вместе образуют связь, или 3 - водород и 4 и 5 вместе образуют, и 6 - метилен или этилен или 3 и 4 - водород и 5 и 6 вместе образуют- или 3, 4 и 5 - водород и 6 представляет -- или -1 и 2 имеют значения, определенные в п. 1. 5. Соединение по любому из пп. 1-4, в котором 2 выбран из 1-имидазолила, триазолила, тетразолила и тиазолила. 6. Соединение по п. 5, в котором 2 выбран из 1-имидазолила, 1-(1,2,4-триазолила), 1- или 2-тетразолила и 5-тиазолила. 7. Соединение по п. 1, которое является 1-1-(4-цианофенил)-4-(4-фторфенил)бутил-1-имидазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 8. Соединение по п. 1, которое является 1-1-(4-цианофенил)-4-(4-фторфенил)-2-гидроксибутил-1 имидазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 9. Соединение по п. 1, которое является 1-1-(4-цианофенил)-4-(4-фторфенил)-1-бутенил-1,2,4 триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 10. Соединение по п. 1, которое является 1-1-(4-цианофенил)-3-(4-фторфенил)-2-гидроксипропил-1,2,4 триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 11. Соединение по п. 1, которое является 1-1-(4-цианофенил)-4-(4-фторфенил)-2-гидроксибутил-1,2,4 триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 12. Соединение по п. 1, которое является 1-1-(4-цианофенил)-3-(4-фторфенил)-3-гидроксипропил-1,2,4 триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 13. Соединение по п. 1, которое является 1-1-(4-цианофенил)-4-(4-фторфенил)-2-оксобутил-1,2,3 триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 14. Соединение по п. 1, которое является 1-1-(4-цианофенил)-3-(4-фторфенил)-1-пропенил-1,2,4 триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 15. Соединение по п. 1, которое является 5-1-(4-цианофенил)-3-(4-фторфенил)-1-гидроксипропилтиазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 16. Соединение по п. 1, которое является 1-1-(4-цианофенил)-3-(4-фторфенил)пропилтетразолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 17. Соединение по п. 1, которое является 2-1-(4-цианофенил)-3-(4-фторфенил)пропилтетразолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью. 18. Фармацевтическая композиция, ингибирующая ароматазу, включающая активное средство и носитель, отличающаяся тем, что в качестве активного средства она содержит соединение по любому из пп. 117 в терапевтически эффективном количестве. 19. Способ ингибирования ароматазы путем введения субъекту активного средства, отличающийся тем,что в качестве активного средства вводят соединение по любому из пп. 1 - 17 в эффективном количестве. 20. Способ получения соединения формулы, где 1 - водород или галоген 2 - гетероциклический радикал, выбранный из 1-имидазолила, триазолила, тетразолила, тиазолиларавно 1 или 2,или его стереоизомера или нетоксичной фармацевтически приемлемой кислотно-аддитивной соли, включающий взаимодействие соединения формулы, где- С 1-С 2-алкил,в присутствии сильного основания с получением соединения формулы где 1, 2 определены вышеравно 1 или 2,с последующим восстановлением полученного соединения и получением соединения формулы 4357 1 Настоящее изобретение относится к новым гетероциклическим диарилалкилсоединениям, их стереоизомерам и их нетоксичным фармацевтически приемлемым кислотно-аддитивным солям, а также к способу их получения и фармацевтическим композициям, содержащим их. Соединения настоящего изобретения имеют общую формулу,в которой 1 представляет собой водород или галоген,2 представляет собой гетероциклический радикал, выбранный из 1-имидазолила, триазолила, в часности 1-(1,2,4-триазолила), тетразолила, тиазолила,3 представляет собой водород или ,4 представляет собой ,5 представляет собойили , или 4 представляет собой водород, и 3 и 5 вместе образуют связь,или 3 представляет собой водород, и 4 и 5 вместе образуютО 6 представляет собой метилен, этилен, , 2-, -- или -- или 4 представляет собой водород, и 5 и 6 вместе образуют-,или их стереоизомеры, или их нетоксичные фармацевтически приемлемые кислотно-аддитивные соли,при условии, что 6 не может быть -С(О)-, когда. Соединения формулыи их стереоизомеры образуют соли присоединения как с органическими, так и неорганическими кислотами. Они могут, таким образом, образовывать большое количество фармацевтически приемлемых кислотно-аддитивных солей, например хлориды, бромиды, сульфаты, нитраты, фосфаты,сульфонаты, формиаты, тартраты, малеинаты, цитраты, бензоаты, салицилаты, аскорбинаты и подобные соли. Изобретение включает в свой объем фармацевтические препараты, содержащие, по меньшей мере, одно соединение формулы , его стереоизомер или нетоксичную фармацевтически приемлемую соль и совместимый фармацевтически приемлемый носитель. В Европейском патенте ЕР-А-390 558 описываются дифенилзамещенные 4(5)-имидазолилсоединения,которые, как описано, являются ингибиторами ароматазы. В патенте США 4 978 672 описываются дифенилзамещенные 1-(1,2,4-)- и 1-(1,3,4-триазолил)соединения, у которых углеродная цепь между фенильными группами предпочтительно является метилом, например 2(4-хлорфенил)-1-(1,2,4-триазолил)метилбензонитрил. В патенте США 4 937 250 описываются дифенилзамещенные 1-имидазолилсоединения. В патенте США 5 071 861 описываются дифенилзамещенные 3-пиридилсоединения и в патенте США 5073574 описываются дифенилзамещенные 1- и 2-тетразолилсоединения. Как заявлено в этих патентах США, эти соединения являются ингибиторами ароматазы. Соединения настоящего изобретения обладают селективно ингибирующими ароматазу свойствами по сравнению с их ингибирующими дезмолазу свойствами. Они, следовательно, пригодны для лечения эстрогензависимых заболеваний, например рака молочной железы или доброкачественной гиперплазии предстательной железы (ВРН). Наиболее предпочтительны соединения формулы , выбранные из группы где 3 и 4 представляет водород, и 5 представляет ОН, или 3 представляет ОН, и 4 и 5 представляет водород, и 6 является метиленом или этиленом или 3 4 и 5 представляют водород, и 6 представляет СНОН- или -СНОН-СН 2 - и 1 и 2 имеют значения, определенные выше где 3 и 4 представляют водород, и 5 представляет собой ОН, 6 представляет собой метилен или этилен, или 3 4 и 5 представляют водород 6 представляет собой -СНОН-, или -СНОН-СН 2- и 1 и 2 имеют значения, определенные выше где 4 представляет собой водород, и 3 и 5 вместе образуют связь, или 3 представляет собой водород,и 4 и 5 вместе образуют , и 6 представляет метилен или этилен или 3 и 4 представляет собой водород, и 5 и 6 вместе образуют СН- или 3, 4 и 5 представляет собой водород, и 6 представляет собой СНСН- или -С- и 1 и 2 имеют значения, определенные выше. Предпочтительным является соединение, где 2 выбран из 1-имидазолила, триазолила, тетразолила и тиазолила. 4 4357 1 Среди вышеперечисленных предпочтительны соединения, которые являются 1-1-(4-цианофенил)-4-(4-фторфенил)бутил-1 Н-имидазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью,1-1-(4-цианофенил)-4-(4-фторфенил)-2-гидроксибутил-1 Н-имидазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью 1-1-(4-цианофенил)-4-(4-фторфенил)-1-бутенил-1,2,4-триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью 1-1-(4-цианофенил)-3-(4-фторфенил)-2-гидроксипропил-1,2,4-триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью 1-1-(4-цианофенил)-4-(4-фторфенил)-2-гидроксибутил-1,2,4-триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью 1-1-(4-цианофенил)-3-(4-фторфенил)-3-гидроксипропил-1,2,4-триазолом его стереоизомером или нетоксичной фармацевтически 1-1-(4-цианофенил)-4-(4-фторфенил)-3-оксобутил-1,2,3-триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью 1-1-(4-цианофенил)-3-(4-фторфенил)-1-пропенил-1,2,4-триазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью 5-1-(4-цианофенил)-3-(4-фторфенил)-1-гидроксипропилтиазолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью 1-1-(4-цианофенил)-3-(4-фторфенил)пропилтетразолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью 2-1-(4-цианофенил)-3-(4-фторфенил)пропилтетразолом, его стереоизомером или нетоксичной фармацевтически приемлемой кислотно-аддитивной солью Селективность соединений формулырегулируется стереохимической изомерией. Абсолютная стереохимическая конфигурация соединений формулыэкспериментально не определена. Она обычно соответствует обозначению стереоизомеров как а,и т.д. без дополнительного указания на абсолютную стереохимическую конфигурацию. Стереоизомеры соединения формулыконечно включены в объем настоящего изобретения. Соединения могут быть получены разными способами. Так, соединения формулыможно получить реакцией галогенида формулы,в которойобозначает галоген, предпочтительно бром или хлор,представляет собой 1 или 2, 1 имеет указанные выше значения, и 7 представляет собойили другую функциональную группу, которую можно превратить в цианогруппу методиками, которые обычно применяют в препаративной органической химии, с тегероциклическим соединением 2, у которого 2 представляет собой 1-имидазолил, 1-(1,2,4-, 4(1,2,4-, 1-(1,2,3- или 2-(,2,3-триазолил) или 1- или 2-тетразолил, в подходящем растворителе с образованием соединений формулы Гетероциклическое соединение применяют предпочтительно в форме его соли, предпочтительно соли натрия. Исходные соединенияможно получить обычными методами из возможно замещенного бензальдегида и подходящего производного бензола. Соответствующие соединения формулы , у которых 2 представляет собой 4-(1,2,3-, 3-(1,2,4 триазолил) или 5-тетразолил, можно получить способом, описанным выше, в присутствии сильного основания, например алкиллития, когда исходное гетероциклическое соединение -защищено пригодной защитной группой. Соединения формулыможно также получить реакцией соединения формулы в которой 2 и 7 имеют указанные выше значения, и 2 возможно защищен, обычными методиками, с пригодным галогенидом формулы,в которойпредставляет собой галоген, предпочтительно бром или хлор,представляет собой число 1 или 2, и 1 имеет указанные выше значения, в присутствии сильного основания, например алкиллития, предпочтительно н-бутиллития, для образования соединений формулы , в которой 2 имеет значения 2. Другой способ получения состоит в реакции соединения формулыс подходящим альдегидом формулы,в которойи 1 имеют указанные выше значения в присутствии сильного основания, например алкиллития,предпочтительно н-бутиллития с образованием соединений формулы,которые можно далее дегидратировать обычными методиками, например кипячением с 2, РОС 3 или РС 5, возможно в подходящем растворителе, например ацетонитриле для получения соединений формулы. Соединения формулыможно далее, если нужно, каталитической гидрогенизацией превратить в соответствующие насыщенные соединения. Согласно настоящему изобретению, предлагается способ получения соединений формулы , который заключается в реакции соединений формулы , в которой 2 имеет указанные выше значения, 7 представляет собойс подходящим сложным эфиром формулы,в которойпредставляет собой низший алкил, предпочтительно метил или этил, в присутствии сильного основания, например алкиллития, предпочтительно н-бутиллития, с образованием соединений формулы 4357 1 которые можно далее восстановить обычными методиками, например при помощи 4, для получения соответствующих спиртов формулы , где 7 представляет собой . Соединения формулыможно также получить реакцией гетероциклического соединения 2, в котором 2 имеет указанные выше значения с кетоном формулы,в присутствии хлористого тионила с образованием ненасыщенных соединений формулы , в которой 2 имеет значения 2. Исходное соединения формулыможно получить обычными методиками из возможно замещенного бензальдегида и подходящего производного бензола. Соединения формулыможно также получить реакцией кетона формулы,в которой 1 и 7 имеют указанные выше значения, ипредставляет собой число 0 или 1 с гетероциклическим соединением 2, в котором 2 имеет указанные выше значения, способом, указанным в . . .,в которой 2 имеет указанные выше значения, которые далее восстанавливают соединения формулы,которые при желании можно дегидратацией превратить в ненасыщенные соединения формулы . Еще один способ получения соединений формулызаключается в реакции соединения формулыс формамидом в присутствии сильного основания, например н-бутиллития, с образованием соединений формулы Альдольной конденсацией соединений формулыс подходящим ацетофеном получают ненасыщенные кетоны, которые можно затем восстановить в спирты, включенные в формулу . Соединения формулыможно также получить реакцией кетона формулы в которой 2 и 7 имеют указанные выше значения, и 2 возможно защищен, с соединениями формулыили 7,в которойпредставляет собой низший алкил,представляет собой 1 или 2, и 1 имеет указанные выше значения, в инертном растворителе, например тетрагидрофуране, по методике, описанной в 92/10482. Соединения формулы , у которых 3 представляет собой ОН, можно получить реакцией соединения формулы 2- ,в которой 2 представляет собой 4-(1,2,3- или 3-(1,2,4-триазолил), 5-тетразолил, 2-, 4- или 5-тиазолил, представляет собой водород или защитную группу, с кетоном формулыв присутствии сильного основания, такого как алкиллитий, например н-бутиллитий, с образованием соединений формулы,которые можно затем при желании дегидратировать и гидрировать. Соединения формулыможно также получить реакцией кетона формулыс галогенидом формулы . Реакцию проводят в подходящем растворителе, например тетрагидрофуране, в присутствии алкиллития, например н-бутиллития, или магния. Соединения формулы , у которых 2 имеет значения 2 можно получить реакцией производного эпоксидного соединения формулы в которойимеет указанные выше значения ипредставляет собой 0 или 1, с соединениями формулыв присутствии сильного основания. 7, который можно превратить в цианогруппу, представляет собой, например, нитрогруппу, аминогруппу,галоген, предпочтительно бром, формил или амидогруппу карбоновой кислоты. Соединения формул , , , , ,и , у которых 7 представляет собой нитрогруппу, можно превратить в соединения формулыгидрированием с последующим диазотированием аминогруппы. Соединения формулы , , , , ,и , у которых 7 представляет собой галоген, можно превратить в соединения формулыпри помощи, например, цианидной соли, в частности цианида натрия или калия. Соединения формул , , , ,и , у которых 7 представляет собой формил, можно превратить в соединения формулыспособами, описанными в литературе. Соединения формул , , , , ,и , у которых 7 представляет собой амидогруппу карбоновой кислоты, можно превратить в соединения формулыпри кипячении их реакцией, например, с 2 или РС 5. В исходных соединениях и промежуточных продуктах, которые превращают в соединения изобретения указанными выше реакциями, присутствующие функциональные группы, например 2,и , в ядре возможно защищены обычными методами, которые обычно применяют в препаративной органической химии для защиты функциональных групп от нежелательных реакций. Защитными группами для атома азота в гетероциклических радикалах предпочтительно являются три(низший алкил)силилы, например триметилсилил. Стереоизомеры соединений формулыможно получить при помощи известных способов разделения,например селективной кристаллизацией и хроматографическими способами, например колоночной хроматографией и жидкостной хроматографией высокого разрешения. Соединения формулы , их нетоксичные фармацевтически приемлемые кислотно-аддитивные соли или их смеси можно вводить парентерально, внутривенно или перорально. Обычно эффективное количество соединения комбинируют с пригодным фармацевтическим носителем. Применяемый в описании термин эффективное количество обозначает такие количества, которые обеспечивают желаемую активность, но 8 4357 1 не вызывают вредные побочные действия. Точное количество, применяемое в конкретном случае, зависит от различных факторов, например способа введения, типа млекопитающего, состояния, для улучшения которого вводят это соединение, и конечно структуры соединения. Фармацевтические носители, которые обычно применяют с соединениями настоящего изобретения, могут быть твердыми или жидкими, их обычно отбирают в соответствии с предполагаемым способом введения. Так, например, твердые носители включают лактозу, сахарозу, желатин и агар, жидкие носители включают воду, сироп, арахисовое масло и оливковое масло. Комбинации соединения и носителя можно придать различные пригодные формы, например форму таблеток, капсул, суппозиторий, растворов, эмульсий и порошков. Соединения изобретения, в частности, ценны в качестве средств, ингибирующих ароматазу, следовательно, они пригодны при лечении эстрогензависимых заболеваний, например рака молочной железы или доброкачественной гиперплазии предстательной железы (ВРН). Эстрогены являются основными стероидами физиологии и функции нормального развития молочной железы и половых органов женщины. С другой стороны, эстрогены, как известно, стимулируют рост эстрогензависимых раковых опухолей, в частности рака молочной железы и матки. Они могут повышать риск развития рака молочной железы, если их вводить в фармакологических дозах в течение продолжительного периода времени. Чрезмерное продуцирование эстрадиола может также вызывать другие доброкачественные заболевания в гормонзависимых органах. Важность эстрогенов в качестве стимуляторов и/или регуляторов роста раковых опухолей четко подчеркивается тем фактом, что антиэстрогены имеют основное значение при лечении раковых опухолей молочной железы, обогащенных рецепторами эстрогенов. Антиэстрогены действуют путем связывания рецепторов эстрогенов, в результате чего происходит ингибирование биологического действия эстрогенов. Это достигается клинически при помощи аминоглутетимида, который является неспецифическим ингибитором синтеза стероидов. Синтез эстрогенов можно блокировать специфически ингибированием фермента ароматазы, который является ключевым ферментом в биохимическом пути синтеза эстрогенов. Ингибирование ароматазы важно, поскольку несколько типов опухолей молочной железы синтезируют эстрадиол и эстрони поэтому происходит непрерывное стимулирование роста опухоли(.,59 770-782, 1987). Способность соединений изобретения ингибировать фермент ароматазу показали способом испытания, описанным М(, . 6,2, 1965, . 94-99). Применяли ароматазу человека. Фермент получали из плаценты человека, которая богата этим ферментом. Микросомную фракцию (1000000 х г осадка) получали центрифугированием. Препарат фермента применяли без дальнейшей очистки. Испытываемые соединения, указанные в табл. 1, добавляли вместе с 1,2/3 Н/-андростен-3,17 дионом (100000 распадов в мин) и системой, генерирующей(никотин-амидадениндинуклеотидфосфат, восстановленный). Концентрации испытываемых соединений были 0,001 001 и 1,0 мМ. Инкубирование проводили при 37 С в течение 40 мин. Ароматизация 1,2/3 Н/-андростен-3,17-диона приводит к образованию 32. Тритированную воду и тритированный субстрат легко разделяют на миниколонке-, которая абсорбирует стероид и позволяет воде свободно элюироваться. Радиоактивность подсчитывали жидкостным сцинтилляционным счетчиком. Ингибирование ароматазы оценивали путем сравнения 3 Н 2 О-радиоактивности обработанных ингибиторами проб с контрольными пробами, не содержащими ингибитор. С-50-величины рассчитывали как концентрации, которые ингибируют активность фермента на 50 . Эти концентрации представлены в табл. 2. Активность по расщеплению боковой цепи холестеринадезмолазы измеряли по способу( 43 517-527, 1984). Инкубирование проводили в пластиковых пробиркахна 1,5 мл. Применяли шейкер , центрифугу и инкубатор в виде одного блока. В инкубационной емкости на 300 мкл субстрат (5 мкМ) получали по методике(. . 190 256262, 1980) и добавляли радиоактивный 3 Н-4-холестерин с числом распадов 100000 в мин (частоту соединения контролировали ТСХ) в 0,5 твина-20, 10 мМ 2 5 мкМ аценокетона и 2 мМ . Контрольные пробы содержали все указанные выше вещества, но препарат фермента был инактивирован до инкубирования добавлением 900 мкл метанола. В качестве источника фермента применяли фракцию митохондрий (1 мг белка) из плаценты человека или бычьих надпочечников. После 30 мин инкубирования при 37 С реакцию прерывали добавлением 900 мкл метанола, в каждый инкубат добавляли маркер 14 С-4-прегненолон (1500 распадов в мин) и пробирки интенсивно встряхивали. Через 10 мин после установления равновесия осажденные метанолом белки разделяли центрифугированием (8000 х г в течение 2 мин) и супернатант отсасывали в пластиковые шприцы на 1 мл и переносили в предварительно уравновешенную (75 метанола) миниколонку. Колонку промывали 1 мл 75 -ного метанола и затем 3 мл 80 -ного метанола. Элюат,полученный при помощи 80 -ного метанола, переносили в сцинтилляционный флакон и добавляли 10 мл сцинтилляционной жидкости. Радиоактивность подсчитывали с применением программы двойной метки на жидкостном сцинтилляционном счетчике (1 КВ -). Типичная активность для препарата фермента из 4357 1 плаценты и бычьих надпочечников была 0,5-3 и 50-100 пмоль образованного прегненолона /мг белка/ мин соответственно. В экспериментах по ингибированию вещества (конечная концентрация от 1 до 1000 мкМ) добавляли в инкубационную смесь в объеме 10-20 мкл, обычно в виде раствора в метаноле или этаноле. Такой же объем растворенного вещества добавляли в контрольную инкубационную пробирку, -50-величины (концентрация, вызывающая 50 -ное ингибирование) определяли графически, они представлены в табл. 2. Обычно дневная доза для пациента должна быть от около 10 до около 200 мг при пероральном введении. Острую токсичность,50,диастереометра 1-1-(4-цианофенил)-3-(4-фторфенил)-2 гидроксипропил-1,2,4-триазола определяли на молодой зрелой самке мыши штамма . Испытываемое соединение вводили перорально. Наивысшей испытываемой дозой было 400 мг/кг, она показала хорошую толерантность. Не наблюдались вредные действия соединений. Ингибирование ароматазыИнгибирующий эффект финрозола (соединение ) оценивали по измерению активности ароматазы из гомогенатов яичников крыс, предварительно обработанных агонистом рилизинг-гормона лютеинизирующего гормона для стабилизации эстрогенного цикла и обработанных введением одноразовой дозы финрозола(0,001 и 0,05) мг/кг через различные периоды времени. В качестве контрольных образцов использовали гомогенаты яичников крыс, которым вводили только носитель (0,5 карбоксиметилцеллюлоза). Активность ароматазы в гомогенатах яичников определяли посредством измерения тритированной воды 32, образующейся при ароматизации меченного радиоактивной меткой субстрата - 1-3 Нандрост-4-ен-3,17-диона (, ) в реакционной системе, содержащей генерирующую(никотин-амид-аденин-динуклеотидфосфат, восстановленный) систему. Фирозол оказывал зависящий от времени и дозы ингибирующий эффект на активность ароматазы в ткани яичников крыс, как показано на фиг. 1 и 2. Изобретение иллюстрируют следующие примеры. Спектры ЯМР на ядрах 1 Н снимали на приборе-300 . В качестве стандартного вещества применяли тетраметилсилан. В спектрахобозначает квинтет,обозначает мультиплет,обозначает триплет,обозначает дуплет,обозначает секстет,обозначает квинтет. Пример 1. 1-1-(4-цианофенил)-4-(4-фторфенил)-бутил-1 Н-имидазол 1-(4-цианобензил)имидазол (1 г, 0,0054 моль) растворяют в сухом тетрагидрофуране (30 мл) и охлаждают до -70 С. В реакционную смесь добавляют по каплям н- в гексане (0,0054 моль). После перемешивания дополнительно в течение 30 мин при -70 С в смесь добавляют бромистый 3-(4-фторфенил)пропил (1,5 г 00069 моль) в ТГФ (10 мл) и перемешивание продолжают в течение 2 ч. Затем смесь оставляют для нагревания до комнатной температуры. В смесь добавляют насыщенный водный раствор хлористого аммония,смесь встряхивают и слои разделяют. Фазу ТГФ сушат и выпаривают досуха. Остаток кристаллизуют из изопропанола в виде соли с хлористым водородом. Фильтрат очищают флэш-хроматографией. 1 Н ЯМР-спектр (-соль, МеОН-4) 1,5-1,63 ( 2 Н), 2,3-2,5 (, 2 Н) 2,7 (, 2), 5,75 (, 1 Н), 6,94-7,00 (, 2), 7,14-7,19 (, 2), 7,62 (,2), 7,63 (, 1), 7,78 (, 1), 7,8 (, 2 Н), 9,6 (, 1). Пример 2. 1-1-(4-цианофенил)-4-(4-фторфенил)-бутил-1,2,4-триазол Это соединение получают способом, описанным в Примере 1, из 1-(4-цианобензил)-1,2,4-триазола (6,0 г,0,0272 моль), н- (0,0272 моль) и 3-(4-фторфенил)пропилбромида (7,6 г, 0,035 моль). Продукт очищают сначала суспендированием остатка в 2 М водном хлористом водороде и петролейном эфире. Фазу петролейного эфира отделяют и водный слой и отделенное масло экстрагируют диэтиловым эфиром. Фазу диэтилового эфира выпаривают и остаток очищают флэш-хроматографией. 1 Н ЯМР-спектр (-соль, 3) 1,4-1,65 (, 2 Н), 2,2-2,4 (, 1 Н), 2,45-2,6 (, 1 Н), 2,67 (, 2), 6,12 (, 1 Н), 6,94 (, 2 Н), 7,06-7,10 (, 2 Н),7,67 (, 2 Н), 7,73 (, 2 Н), 8,43 (, 1 Н), 11,31 (, 1 Н). Пример 3. 1-1-(4-цианофенил)-4-фенил)-1-бутенил-1,2,4-триазол а) 1-1-(4-цианофенил)-2-гидрокси-4-фенилбутил-1,2,4-триазол 1-1-(4-цианофенил)-2-гидрокси-4-фенилбутил-1,2,4-триазол получают из 1-(4-цианобензил)-1,2,4 триазола (2,0 г, 0,0108 моль), н- (0,0108 моль) и 3-фенилпропинового альдегида (1,74 г, 0,013 моль). Продукт очищают флэш-хроматографией. 1 Н ЯМР-спектр (основание, СС 3) 1,5-1,75 (, 2), 2,6-2,75 (, 1), 2,8-2,95 (, 1), 4,3-4,5 (, 1), 5,25-5,27 (, 1), 7,0-7,35 (, 5), 7,39 и 7,51 (, 2), 7,60 (, 2), 7,89 и 7,91 (, 1), 8,08 и 8,13 (, 1). Этим же способом были получены следующие соединения, включенные в настоящее описание. 10) 1-1-(4-цианофенил)-4-фенил-1-бутенил-1,2,4-триазол 1-1-(4-цианофенил)-2-гидрокси-4-фенилбутил-1,2,4-триазол (0,42 г, 0,00132 моль) растворяют в ацетонитриле. В раствор добавляют пятихлористый фосфор (0,27 г, 0,0013 моль) и смесь кипятят с обратным холодильником в течение 2 ч. Ацетонитрил выпаривают и остаток растворяют в 2 М водном растворе едкого натра, и раствор экстрагируют хлористым метиленом. Экстракт сушат, и продукт кристаллизуют из этилацетата в виде соли с хлористым водородом (изомер а). 1 Н ЯМР-спектр (-соль, МеОН-4) 2,40 (, 2), 2,85 (, 2), 6,82 (, 1), 6,84-7,28 (, 5), 7,32 (, 2), 7,72 (, 2), 8,58 (, 1), 8,65 (, 1). Таким же образом были получены следующие соединения, включенные в изобретение. 1-1-(4-цианофенил)-4-(4-фторфенил)-1-бутенил 1,2,4-триазол, изомеры а и 1 Н ЯМР-спектр (-соль, МеОН-4) изомер а 2,42 (, 2), 2,85 (, 2), 6,85 (, 1), 7,0 (, 2), 7,16-7,21 (, 2), 7,37 (, 2), 7,74 (, 2), 8,82 (, 1),9,38(, 1). изомер 2,53 (, 2 Н), 2,83 (, 2), 6,63 (, 1), 6,98 (, 2), 7,12-7,17 (, 2), 7,33 (, 2), 7,80 (, 2), 8,62 (, 1),9,33 (, 1). 1-1-(4-цианофенил)-4-фторфенил-1-бутенил-1 Н-имидазол, изомеры а и . изомер 1 Н ЯМР-спектр (основание СС 3) 2,4 (, 2), 2,77 (, 2), 6,33 (, 1), 6,69 (, 1), 7,0 (, 2), 7,05-7,1 (, 2), 7,15 (. 2), 7,19 (, 1), 7,3(150 мл) и для подщелачивания раствора добавляют едкий натр. Смесь перемешивают при комнатной температуре в течение 6 ч. Продукт отделяют фильтрованием и промывают метанолом. 1 Н ЯМР-спектр (СС 3) 7,14 (, 2 Н), 7,40 (, 1), 7,66 (, 2 Н), 7,81 (, 1), 7,82 (, 2 Н), 8,09 (, 2 Н),) 1-(4-цианофенил)-3-(4-фторфенил)-1-пропанон 1-(4-цианофенил)-3-(4-фторфенил)проп-2-ен-1-он гидрируют в этаноле с применением в качестве катализатора 5 на угле. 1 Н ЯМР-спектр (СС 3) 3,05 (, 2 Н), 3,29 (, 2 Н), 6,98 (, 2), 7,20 (, 2 Н), 7,76 (, 2), 8,02 (, 2 Н). с) 1-(4-цианофенил)-3-(4-фторфенил)-1-пропанол 1-(4-цианофенил)-3-(4-фторфенил)-1-пропанон (6,35 г, 25 ммоль) растворяют в метаноле (50 мл). Добавляют в раствор борогидрид натрия (0,48 г. 12,6 ммоль) и смесь перемешивают при 30 С 1 ч. Смесь подкис 1 4357 1 ляют 2 М соляной кислотой и растворитель выпаривают. Остаток растворяют в этилацетате. Раствор промывают разбавленным раствором едкого натра и водой, сушат и растворитель выпаривают. Продукт применяют для следующей стадии без дальнейшей очистки. 1 Н ЯМР-спектр (СС 3) 1,94-2,10 (, 2 Н), 2,66-2,74 (, 2 Н), 4,74 (, 1 Н), 6,97 (, 2 Н), 7,13 (, 2 Н), 7,45 (, 2 Н), 7,64 (, 2 Н).) 1-хлор-1-(4-цианофенил)-3-(4-фторфенил)пропан 1-(4-цианофенил)-3-(4-фторфенил)-1-пропанол (3,43 г, 13 ммоль) растворяют в дихлорметане (20 мл). В охлажденный раствор добавляют по каплям хлористый тионил (1,2 мл 16 ммоль), и смесь перемешивают 2 ч при комнатной температуре. Смесь промывают водой, сушат и растворитель выпаривают. Остаток применяют для следующей стадии без дальнейшей очистки. 1 Н ЯМР-спектр (СС 3) 2,20-2,44 (, 2), 2,66-2,83 (, 2), 4,77 (, 1 Н), 6,99 (, 2 Н), 7,13 (, 2), 7,46 (, 2), 7,65 (, 2). е) 1-1-(4-цианофенил)-3-(4-фторфенил)пропил-1,2,4-триазол Смесь 1-хлор-1-(4-цианофенил)-3-(4-фторфенил)пропана(4,18 г, 15 ммоль) и натриевого производного 1,2,4-триазола (1,37 г, 15 ммоль) в ДМФ (30 мл) нагревают осторожно в течение 4 часов. ДМФ отгоняют. Остаток растворяют в этилацетате и промывают водой. Органический слой сушат и растворитель выпаривают. Продукт очищают флэш-хроматографией (силикагель 60 меш. 230-400, элюент смесь хлористый метиленметанол, 991). 1 Н ЯМР (-соль, -4) 2,55-2,65 (, 3), 2,78-2,84 (, 1), 5,83 (, 1), 7,00 (, 2), 1,17 (, 2), 7,68 (, 2), 6,78 (, 2), 8,75(, 1), 9,69 (, 1). 1-1-(4-цианофенил)-3-(4-фторфенил)пропил-1 Н-имидазол получают тем же способом с применением в качестве исходных соединений 1-хлор-1-(4-цианофенил)-3-(4-фторфенил)пропана и натриевого производного 1-имидазола. 1 Н ЯМР-спектр (-соль, МеОН-4) 2,59-2,80 (, 4 Н), 5,72 (, 1), 7,00 (, 2), 7,19 (, 2), 7,63 (, 2), 7,67 (. 1), 7,81 (, 2), 7,84 (,1), 9,23 (, 1). Пример 5. 1-1-(4-цианофенил)-3-(4-фторфенил)пропил-1 Н-имидазол 1-1-(4-цианофенил)-3-(4-фторфенил)пропил-1 Н-имидазол получают способом, описанным в Примере 1,с применением бромистого 4-фторфенетила в качестве алкилирующего средства. Продукт очищают флэшхроматографией. 1 Н ЯМР-спектр (-соль, МеОН-4) 2,59-2,80 (, 4 Н), 5,72 (, 1), 7,00 (, 2), 7,19 (, 2), 7,63 (, 2), 7,67 (, 1), 7,81 (, 2), 7,84 (,1), 9,23 (, 1). 1-1-(4-цианофенил)-3-(4-фторфенил)пропил-1,2,4-триазол получают тем же способом, применяя 1-(4 цианофенил)-1,2,4-триазол и бромистый 4-фторфенетил в качестве исходных соединений. Продукт очищают флэш-хроматографией. Пример 6. 1-1-(4-цианофенил)-3-(4-фторфенил)-1-пропенил-1-имидазол а) 1-1-(4-цианофенил)-3-(4-фторфенил)-2-гидроксипропил-1-имидазол 1-(4-цианофенил)-3-(4-фторфенил)-2-гидроксипропил-1-имидазол получают способом Примера 1 с применением в качестве исходных соединений 1-(4-цианобензил)имидазола и 4-фторфенилацетальдегида. Продукт очищают флэш-хроматографией. 1 Н ЯМР-спектр (-соль, МеОН-4) 2,57-2,70 (, 1), 2,75-2,82 (, 1), 4,62-4,68 (, 1), 5,64-5,66 (, 1), 6,97-7,05 (, 2), 7,17-7,24 (,2), 7,54-7,85 (, 6 Н), 9,16 и 9,21 (2, вместе 1).) 1-4-цианофенил)-3-(4-фторфенил)-1-пропенил-1 Н-имидазол 1-1-(4-цианофенил)-3-(4-фторфенил)-2-гидроксипропил-1 Н-имидазол дегидратируют по способу Примера 3). Продукт является смесью Е- и -изомеров (11). Продукт очищают флэш-хроматографией. 1 Н ЯМР-спектр (основание, 3) 3,42 и 3,52 (2, вместе 2), 6,16 и 6,50 (2, вместе 1), 6,91-7,12 (, 6 Н), 7,26 и 7,42 (2, вместе 2), 7,55 и 7,59 (2, вместе 1), 7,62 и 7,55 (2, вместе 2). Пример 7. 1-1-(4-цианофенил)-3-(4-фторфенил)-1-пропенил-1 Н-имидазол 4357 1 Имидазол (0,55 г, 8 ммоль) растворяют в сухом тетрагидрофуране. Раствор охлаждают на ледяной бане, и в охлажденный раствор добавляют по каплям 2 (0,16 мл, 2 ммоль). Смесь перемешивают в течение 10 мин. Добавляют 1-(4-цианофенил)-3-(4-фторфенил)-1-пропаном (0,34 г, 1,3 ммоль) и смесь перемешивают 4 дня при комнатной температуре. Добавляют хлористый метилен и смесь промывают водой. Органический слой сушат и растворитель выпаривают. Остаток содержит 35 продукта (1 Н ЯМР) в виде смеси (91) изомеров. Продукт очищают флэш-хроматографией (элюент смесь 22, 991). изомер 1 Н ЯМР-спектр (-соль, МеОН-4) 3,62 (, 2 Н), 6,65 (, 1), 7,05 (, 2), 7,26 (, 2), 7,63 (, 2), 7,66 (, 1), 7,69 (, 1), 7,91 (, 2), 9,16) 3-(4-цианофенил)-1-(4-фторфенил)-3-(1-триазолил)пропанон 3-(4-цианофенил)-1-(4-фторфенил)проп-2-ен-1-он (2,5 г, 10 ммоль), 1,2,4-триазол (0,7 г, 10 ммоль) и одну каплю тритона В нагревают до образования раствора. Охлажденную смесь разбавляют диэтиловым эфиром и продукт фильтруют. Продукт применяют для следующей стадии без дальнейшей очистки. 1 Н ЯМР-спектр (СС 3) 3,61 (, 1), 4,37 (, 1), 6,25 (, 1), 7,15 (, 2), 7,55 (, 2), 7,68 (, 2), 7,95 (, 1), 7,99 (, 2),8,23(, 1). с) 1-1-(4-цианофенил)-3-(4-фторфенил)-3-гидроксипропил-1,2,4-триазол 1-1-(4-цианофенил)-3-(4-фторфенил)-3-гидроксипропил-1,2,4-триазол получают из 3-(4-цианофенил)-1(4-фторфенил)-3-(1-триазолил)пропанона по способу Примера 4 с). Продукт очищают флэш-хроматографией в виде смеси диастереомеров (с, 21). 1 Н ЯМР-спектр (основание, СС 3) 2,27-2, 37 и 2,54-2,63 (2, вместе 1 Н), 2,76-2,88 (, 1 Н), 4,26 и 4,41 (2, вместе 1 Н), 5,62 и 5,91 (2,вместе 1 Н), 7,03 и 7,04 (2, вместе 2 Н), 7,22-7,31 (, 2 Н), 7,50 и 7,55 (2, вместе 2 Н), 7,65 и 7,69 (2, вместе 2 Н), 7,94 и 8,04 (2, вместе 1 Н), 8,05 и 8,22 (2, вместе 1 Н). Смесь диастереомеров растирают с диэтиловым эфиром и фильтруют. Диастереомернакапливается в нерастворимой части (содержание его выше 90 ) и диастереомерс накапливается в фильтрате (содержание его выше 80 ). Оба диастереомера очищают перекристаллизацией из толуола. 1 Н ЯМР-спектр (-соль, МеОН-4) диастереомер 2,67 (, 1 Н), 2,84 (, 1), 4,54 (, 1), 6,13 (, 1), 7,04 (, 2 Н), 7,33 (, 2 Н), 7,77 (, 2 Н), 7,81 (,2 Н), 8,79 (, 1), 9,86 (, 1). диастереомер 2,43 (, 1), 2,94 (, 1), 4,33 (, 1), 6,14 (, 1), 7,05 (, 2 Н), 7,34 (, 2 Н), 7,66 (, 2 Н), 7,75 (,2 Н), 8,69(, 1), 9,62(, 1).) 1-1-(4-цианофенил)-3-(4-фторфенил)-2-пропенил-1,2,4-триазол 1-(1-(4-цианофенил)-3-(4-фторфенил)-3-гидроксипропил-1,2,4-триазол (100 мг) нагревают с бисульфатом калия (400 мг) на масляной бане при 140 С в течение 2 часов. Добавляют метанол и неорганический материал отделяют фильтрованием. Метанол выпаривают, получая продукт в виде смеси цис- и трансизомеров. 1 Н ЯМР-спектр (основание, 3) 6,22 (, 1), 6,56 виниловых протонов цис-изомера 6,47 и 6,81 виниловых протонов трансизомера 6,09 и 7,12 (2, вместе 2 Н) 7,29-7,34 (, 2 Н), 7,36 и 7,49 (, вместе 2 Н), 7,69 и 8,02 (, вместе 2 Н),8,03 и 8,02 (, вместе 1), 8,26 и 8,12 (, вместе 1).Пример 9. 1-(1-(4-цианофенил)-3-(4-фторфенил)-1-пропенил-1,2,4-триазол) 1-1-(4-цианофенил)-3-(4-фторфенил)-2-гидроксипропил-1,2,4-триазол 1-1-(4-цианофенил)-3-(4-фторфенил)-2-гидроксипропил-1,2,4-триазол получают по способу Примера 2 с применением 1-(4-цианофенил)-1,2,4-триазола и 4-фторфенилацетальдегида в качестве исходных соединений. Диастереомеры продукта разделяют флэш-хроматографией (элюент смесь этилацетатметанол, 955). 1 Н ЯМР-спектр (-соль, МеОН-4) диастереомер 13) 1-1-(4-цианофенил)-3-(4-фторфенил)-1-пропенил-1,2,4-триазол 1-1-(4-цианофенил)-3-(4-фторфенил)-1-пропенил-1,2,4-триазол получают по способу Примера 3 из диастереомерас 1-1-(4-цианофенил)-3-(4-фторфенил)-2-гидроксипропил-1,2,4-триазола. Этим способом в основном получают изомер а. Продукт очищают флэш-хроматографией. 1 Н ЯМР-спектр (-соль изомера . -4) 3,47 (, 2), 6,97 (, 1), 7,04 (, 2), 7,26 (, 2), 7,43 (, 2), 7,75 (, 2), 8,86 (, 1), 9,71 (, 1). 1 ЯМР-спектр (-соль изомера , -4) 3,58 (, 2), 6,79 (, 1), 7,04 (, 2), 7,23 (, 2), 7,62 (, 2), 7,90 (, 2), 8,62 (, 1), 9,39 (. 1). Пример 10. 11-(4-цианофенил)-3-(4-фторфенил)-2-оксобутил-1,2,4-триазол 1-1-(4-цианофенил)-3-(4-фторфенил)-2-оксобутил-1,2,4-триазол получают способом, описанным в Примере 1, применяя 1-(4-цианобензил)-1,2,4-триазол (1, 7 г, 0,0092 моль), н- (0,0108 моль) и этил-3-(4 фторфенил)пропионат (2,3 г, 0,0117 моль), полученный из 4-фторкоричной кислоты этерификацией и гидрированием. Продукт очищают флэш-хроматографией с применением смеси хлористый метиленметанол(955) в качестве элюента. 1 Н ЯМР-спектр (основание СС 3) 2,65-2,95 (, 4 Н), 6,15 (, 1), 6,93 (, 2), 7,04 (, 2), 7,37 (, 2), 7,67 (, 2), 7,97(, 1),8,18(, ). Пример 11. 2-1-(4-цианофенил)-3-(4-фторфенил)пропилтетразиол и 1-1-(4-цианофенил)-3-(4-фторфенил)пропилтетразол(0,45 г 55 -ной суспензии в минеральном масле) добавляют в безводный ДМФ в атмосфере азота. Добавляют тетразол (1,1 г) и смесь осторожно нагревают в течение 20 мин. Смесь охлаждают до комнатной температуры и добавляют 1-хлор-1-(4-цианофенил)-3-(4-фторфенил)пропан (1,53 г). Реакционную смесь затем нагревают в течение 6 ч. Добавляют воду и продукты экстрагируют этилацетатом. После высушивания и выпаривания растворителя продукты очищают флэш-хроматографией. Элюированием, начиная с чистого хлористого метилена и с увеличением в нем содержания метанола, выделяют сначала 2-(1-(4 цианофенил)-3-(4-фторфенил)пропилтетразол, который имеет следующий 1 Н ЯМР-спектр. 1 Н ЯМР-спектр (основание СС 3) 2,47-5,62 (, 3), 2,88-3,01 (, 1 Н), 5,93 (, 1), 6,96-7,10 (, 4 Н), 7,51 (, 2), 7,67 (, 2), 8,57 (, 1). Дальнейшим элюированием выделяют 1-1-(4-цианофенил)-3-(4-фторфенил)пропилтетразол, который имеет следующий 1 Н ЯМР-спектр. 1 Н ЯМР-спектр (основание СС 3) 2,50-2,65 (, 3 Н), 2,86-2,93 (, 1), 5,54 (, 1), 6,98-7,26 (, 4 Н), 7,44 (, 2), 7,71 (, 2), 8,54 (, 1). Пример 12. 5-1-(4-цианофенил)-3-(4-фторфенил)пропенилтиазол а) 5-1-(4-цианофенил)-3-(4-фторфенил)гидроксипропилтиазол 5-бромтиазол (1,66 г, 10 ммоль) растворяют в диэтиловом эфире. В атмосфере азота при -60 С очень медленно добавляют н-бутиллитий (4,85 мл, 2,5 ). После перемешивания в течение 20 мин при 60 С добавляют при этой же температуре (4-цианофенил)-2-(4-фторфенил)этилкетон (25 г, 10 ммоль) в диэтиловом эфире и перемешивание продолжают в течение еще 2 часов. Реакционную смесь оставляют для нагревания до комнатной температуры и затем ее разлагают насыщенным раствором хлористого аммония. Слой диэтилового эфира отделяют и растворитель выпаривают. Добавляют воду и продукт экстрагируют этилацетатом. После высушивания и выпаривания растворителя остаток смешивают с этанолом и черный осадок отделяют фильтрованием. Этанол выпаривают и продукт очищают флэш-хроматографией (элюент смесь дихлорметанметанол, 461). 1 Н ЯМР-спектр (основание, СС 3) 2,33-2,40 (, 1), 2,52-2,67 (, 2 Н), 2,68-2,83 (, 1), 6,96 (, 2), 7,061 (, 2 Н), 7,65 (-, 4), 7,73) 5-1-(4-цианофенил)-3-(4-фторфенил)-1-пропенилтиазол 5-1-(4-цианофенил)-3-(4-фторфенил)-1-пропенилтиазол получают способом Примера 3) из 5-1-(4 цианофенил)-3-(4-фторфенил)-1-гидроксипропилтиазола. Продукт содержит в основном изомер а. Изомеры разделяют флэш-хроматографией (элюент смесь этилацетатметанол, 991). 1 Н ЯМР-спектр (основание СС 3) 14 4357 1 Таблица 2 Ингибирование человеческой ароматазы и дезмолазы испытываемыми соединениямисоединения Ингибирующий эффект финрозола (доза 0,001 мг/кг) на активность в ткани яичников крыс. Национальный центр интеллектуальной собственности. 220072, г. Минск, проспект Ф. Скорины, 66. 16
МПК / Метки
МПК: C07D 249/08, C07D 233/61, C07D 249/04, A61P 43/00, A61K 31/425, C07D 257/04, C07D 277/30, A61K 31/41
Метки: ингибирующие, селективно, ароматазу, способ, получения, основе, соединения, фармацевтическая, композиция
Код ссылки
<a href="https://by.patents.su/16-4357-soedineniya-selektivno-ingibiruyushhie-aromatazu-sposob-ih-polucheniya-farmacevticheskaya-kompoziciya-na-ih-osnove.html" rel="bookmark" title="База патентов Беларуси">Соединения, селективно ингибирующие ароматазу, способ их получения, фармацевтическая композиция на их основе</a>
Предыдущий патент: Производные эритромицина, способ их получения и фармацевтическая композиция на их основе
Следующий патент: Способы очистки 10-дезацетилбаккатина III и таксотера
Случайный патент: Установка для обработки кристаллов алмаза