Фармацевтические микросферические частицы вальпроевой кислоты для перорального введения
Текст
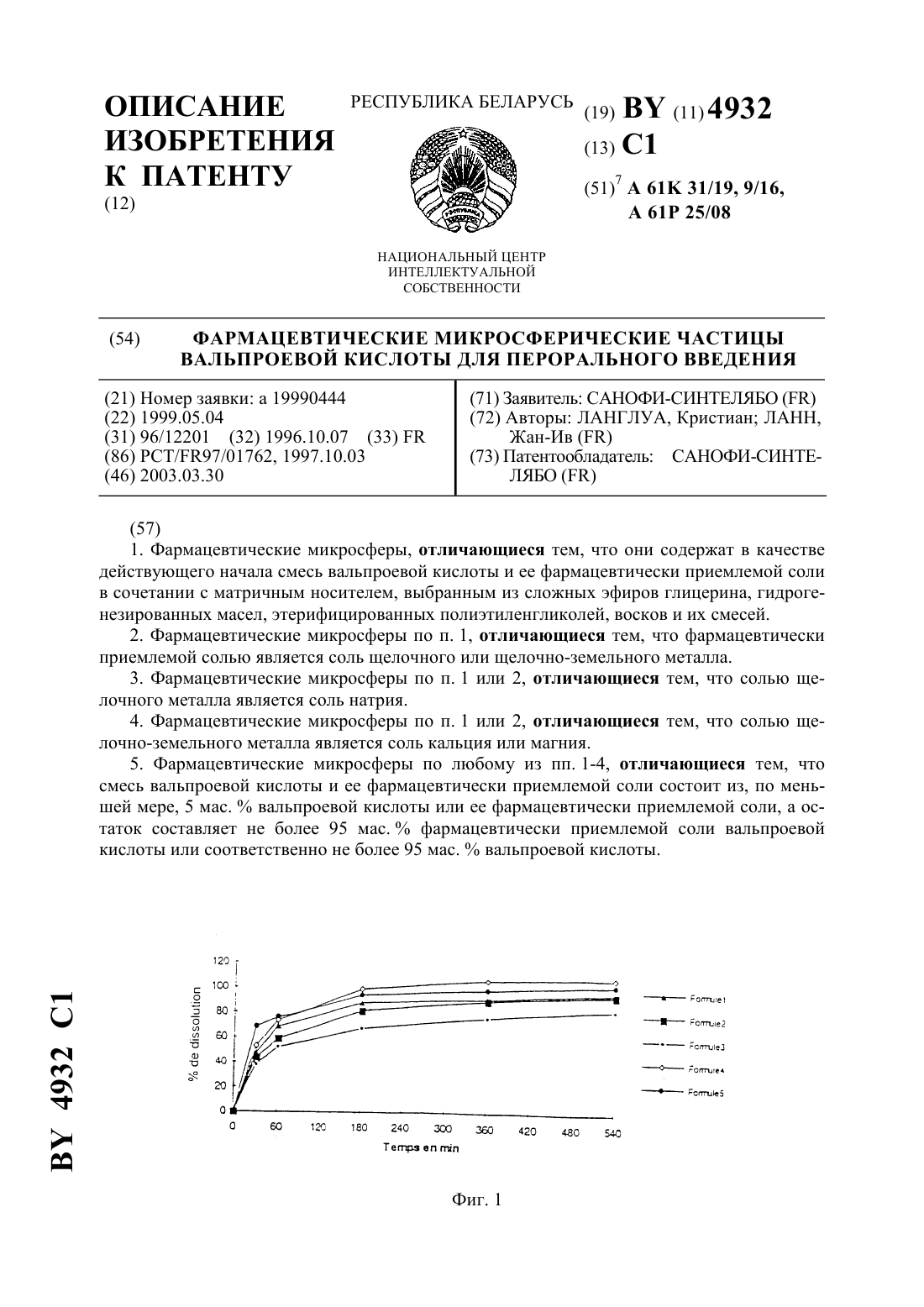
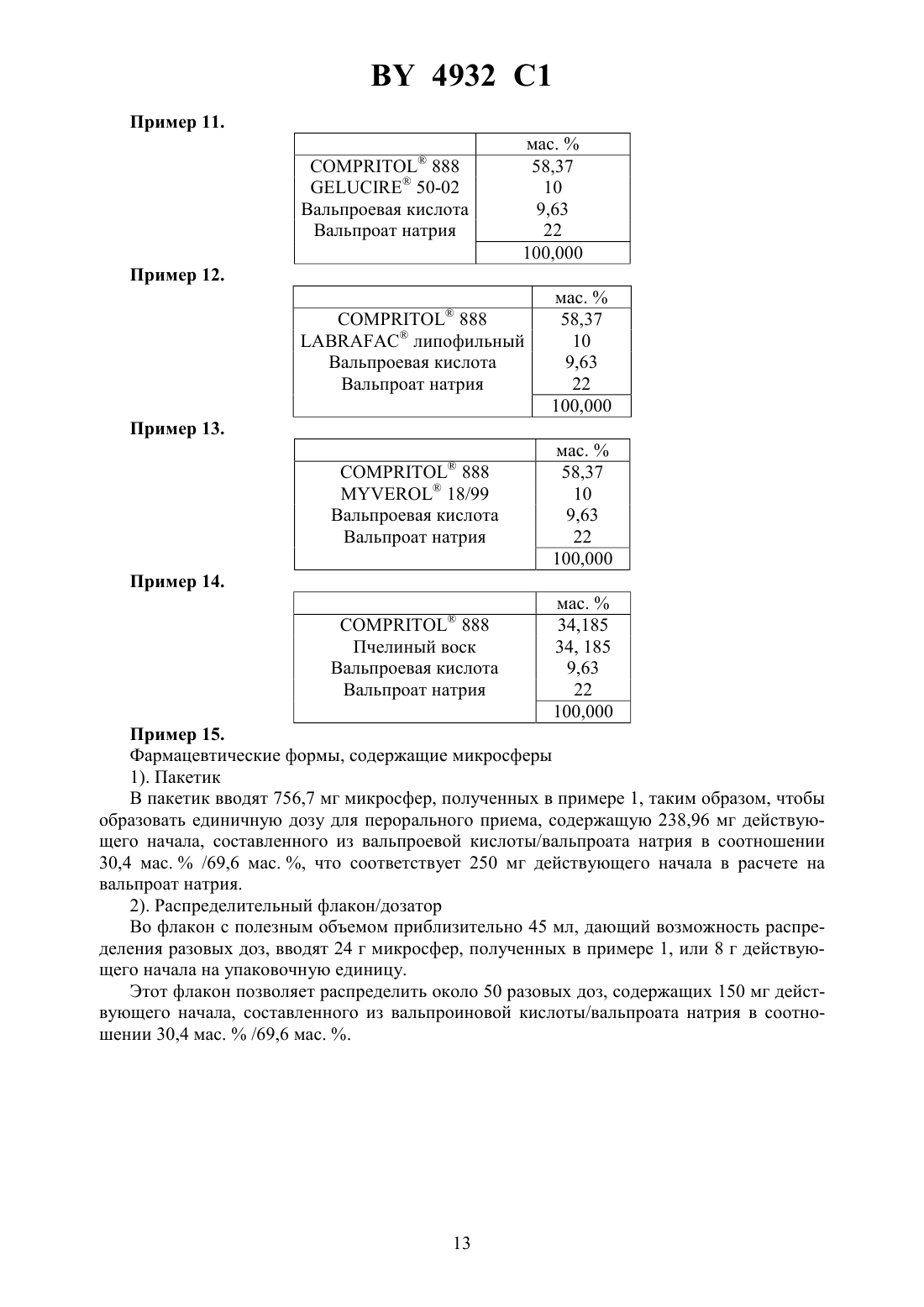
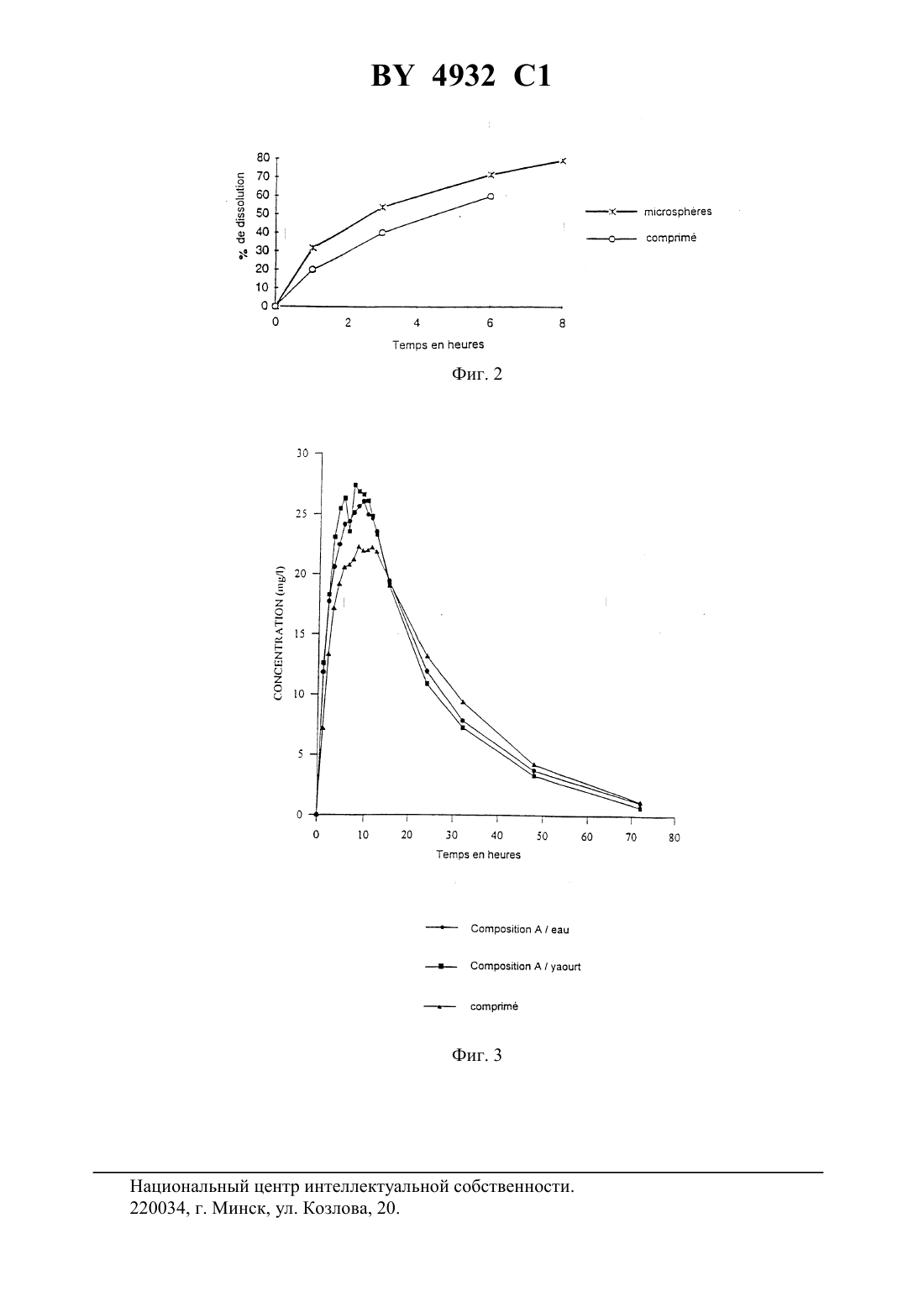
61 25/08 НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ФАРМАЦЕВТИЧЕСКИЕ МИКРОСФЕРИЧЕСКИЕ ЧАСТИЦЫ ВАЛЬПРОЕВОЙ КИСЛОТЫ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ(57) 1. Фармацевтические микросферы, отличающиеся тем, что они содержат в качестве действующего начала смесь вальпроевой кислоты и ее фармацевтически приемлемой соли в сочетании с матричным носителем, выбранным из сложных эфиров глицерина, гидрогенезированных масел, этерифицированных полиэтиленгликолей, восков и их смесей. 2. Фармацевтические микросферы по п. 1, отличающиеся тем, что фармацевтически приемлемой солью является соль щелочного или щелочно-земельного металла. 3. Фармацевтические микросферы по п. 1 или 2, отличающиеся тем, что солью щелочного металла является соль натрия. 4. Фармацевтические микросферы по п. 1 или 2, отличающиеся тем, что солью щелочно-земельного металла является соль кальция или магния. 5. Фармацевтические микросферы по любому из пп. 1-4, отличающиеся тем, что смесь вальпроевой кислоты и ее фармацевтически приемлемой соли состоит из, по меньшей мере, 5 мас.вальпроевой кислоты или ее фармацевтически приемлемой соли, а остаток составляет не более 95 мас.фармацевтически приемлемой соли вальпроевой кислоты или соответственно не более 95 мас.вальпроевой кислоты. 4932 1 6. Фармацевтические микросферы по любому из пп. 1-5, отличающиеся тем, что действующее начало образовано смесью 15-60 мас.вальпроевой кислоты и 40 - 85 мас.фармацевтически приемлемой соли этой кислоты. 7. Фармацевтические микросферы по любому из пп. 1-6, отличающиеся тем, что действующее начало образовано смесью 25-35 мас.вальпроевой кислоты и 65-75 мас.фармацевтически приемлемой соли этой кислоты. 8. Фармацевтические микросферы по любому из пп. 1-7, отличающиеся тем, что они содержат не более 35 мас.действующего начала. 9. Фармацевтические микросферы по любому из пп. 1-8, отличающиеся тем, что они содержат 30-35 мас.действующего начала. 10. Фармацевтические микросферы по любому из пп. 1-9, отличающиеся тем, что сложные эфиры глицерина представляют собой насыщенные или ненасыщенные глицериды жирной кислоты, содержащие до 80 атомов углерода, этерифицированные полиэтиленгликоли представляют собой насыщенные полигликолизированные глицериды. 11. Фармацевтические микросферы по п. 10, отличающиеся тем, что насыщенные полигликолизированные глицериды представляют собой смеси сложных моноэфиров, диэфиров и триэфиров глицерина и сложных моноэфиров и диэфиров полиэтиленгликоля. 12. Фармацевтические микросферы по любому из пп. 1-11, отличающиеся тем, что сложный эфир глицерина представляет собой глицерилтрибегенат, глицерилпальмитостеарат, глицерилмоностеарат, глицерилмоноолеат или каприлокаприновый глицерид,гидрогенизированное масло представляет собой гидрогенизированное касторовое масло,воск представляет собой натуральный пчелиный воск или синтетический пчелиный воск,или парафин. 13. Фармацевтические микросферы по любому из пп. 1-12, отличающиеся тем, что матричный носитель представляет собой натуральный пчелиный воск. 14. Фармацевтические микросферы по любому из пп. 1-13, отличающиеся тем, что температура плавления матричного носителя составляет 50-120 С. 15. Фармацевтические микросферы по п. 14, отличающиеся тем, что температура плавления матричного носителя составляет 70-90 С. 16. Фармацевтические микросферы по любому из пп. 1-15, отличающиеся тем, что они содержат 30-35 мас.действующего начала в сочетании с матричным носителем,представляющим собой пчелиный воск. 17. Фармацевтические микросферы по любому из пп. 1-9, отличающиеся тем, что матричный носитель выбирают из глицерилтрибегената, глицерилпальмитостеарата, гидрогенезированного касторового масла, глицерилмоностеарата, глицерилмоноолеата, глицерилтрикаприлокапрата, насыщенных полигликолизованных глицеридов, натурального пчелиного воска, синтетического пчелиного воска и парафина. 18. Фармацевтические микросферы по любому из пп. 1-9, отличающиеся тем, что матричный носитель состоит из глицерилтрибегената и парафина. 19. Способ получения фармацевтических микросфер по любому из пп. 1-18, заключающийся в том, что к расплаву матричного носителя добавляют вальпроевую кислоту и ее фармацевтически приемлемую соль, перемешивают полученную смесь до получения прозрачной жидкости, полученную смесь в форме прозрачной жидкости пропускают через насадку, подвергающуюся вибрации, с образованием на выходе из насадки капелек,которые под действием силы тяжести увлекаются в колонну, в которой в противотоке циркулирует холодный газ, и в нижней части колонны собирают полученные микросферы. 20. Фармацевтическая форма для перорального введения, отличающаяся тем, что она содержит микросферы по любому из пп. 1-18. 4932 1 21. Фармацевтическая форма по п. 20, отличающаяся тем, что она представлена в виде таблетки, капсулы, желатиновой капсулы или порошка, упакованного в пакетик или в распределительную систему, выдающую разовые дозы. 22. Фармацевтическая форма по п. 20 или 21, отличающаяся тем, что она содержит агенты, облегчающие истечение, смазывающие вещества, минеральные наполнители и/или подсластители.(56)5 188 838 , 1993.2 293 974 , 1976.2 682 677 , 1993. Настоящее изобретение касается новых фармацевтических микросферических частиц для перорального введения. В частности, изобретение относится к новым фармацевтическим микросферическим частицам для перорального введения, содержащим вальпроевую кислоту формулы и одну из ее фармацевтически приемлемых солей, в частности соль щелочного металла, такого как натрий или калий, щелочно-земельного металла, такого как кальций или магний. Вальпроат натрия представляет собой противоэпилептическое лекарство, широко выпускаемое в продажу в настоящее время в форме таблеток с дозировкой 500 мг на одноразовый прием. Эти таблетки снабжены защитной оболочкой для защиты тонкого кишечника или для программируемого выделения и по этой причине имеют относительно большой объем. Вследствие этого такие таблетки обычно доставляют неудобства при приеме, особенно детям или людям, испытывающим трудности с глотанием, например пожилым людям. Таким образом, для пациентов этого типа желательно располагать такими лекарственными формами, которые были бы лучше приспособлены к их состоянию или к их положению. Кроме того, вальпроат натрия имеет довольно неприятный горький вкус. Вследствие этого приходится принимать во внимание этот недостаток, когда речь идет о лекарственных формах, предназначенных для детей, например, таких как сироп или раствор для питья, и маскировать этот вкус с помощью различных приемов. Однако такие лекарственные формы, как сиропы не позволяют ребенку воспользоваться теми преимуществами, которые дают в некоторых случаях лекарственные формы,обладающие устойчивостью в желудочной среде и пролонгированным выделением активного ингредиента. С другой стороны, установление дозы активного ингредиента в соответствии с весом ребенка с учетом детской дозировки на кг массы тела представляет собой дополнительную сложность в педиатрии. Новая галеновая форма препарата, появившаяся несколько лет назад, позволяет удовлетворить некоторым из этих требований. Она имеет вид мелкой манной крупы, состоящей из микросфер, в которых активный ингредиент практически всегда покрыт изолирующей 4932 1 пленкой. Эту крупу высыпают на ложку с полутвердым продуктом питания, например пюре, компотом, йогуртом, и затем принимают в таком виде. Однако фармацевтическая форма, называемая микросферой, плохо удовлетворяет требованию пролонгированного выделения активного ингредиента. В самом деле при равной массе, чем меньше диаметр этих частиц, тем больше будет развитая поверхность этих сфер, и вследствие этого быстрее растворяются эти микросферы. Чтобы устранить этот недостаток, рекомендуется покрывать эти сферические частицы соответствующим покрытием, обеспечивающим возможность желаемого замедленного выделения. Нанесение такого покрытия на фармацевтические микросферические частицы, хотя и является промышленно осуществимым, однако оно является продолжительным, так как требует использования значительного количества осаждаемого полимера. Известны различные способы изготовления этих микросфер, иногда называемых гранулы, которые были применены к разным активным ингредиентам. Один из них, примененный к вальпроевой кислоте, был описан в, 21 (7), стр. 793-807 (1995). Согласно этому способу, смесь, состоящую из расплавленного белого пчелиного воска, вальпроевой кислоты и поверхностно-активного вещества, перемешивают в водной среде при рН 4,5, поддерживая смесь при температуре, выше температуры плавления воска. При охлаждении сферические частицы, полученные путем диспергирования, отверждаются с образованием микросфер. Однако средняя концентрация вальпроевой кислоты в этих микросферах не превышает 17 , причем в этих частицах еще содержится определенное количество используемого поверхностно-активного вещества, в частности, смесь этоксилированных или неэтоксилированных полисорбатов. Другой способ получения фармацевтических микросфер использует метод сталагмопуазии, обычно называемый приллинг - гранулирование отверждением капелек распыленных расплавленных солей. Согласно этому методу, описанному, в частности, в немецком патенте 2725924, расплавляют эксципиент, температура плавления которого ниже 120 С, в который добавляют при необходимости растворенный или диспергированный активный ингредиент, затем пропускают эту расплавленную дисперсию через вибрирующую насадку, вызывающую разрыв струи и образование сферических капелек, которые при падении охлаждаются с образованием микросфер. Этот способ был использован, например, для фармацевтических ингредиентов с неопределенной температурой кристаллизации и расплавленных в эксципиенте, как это описано в европейском патенте ЕР 438350. Эксципиентом может быть, например, жирный спирт, такой как стеариловый спирт,жирная кислота, такая как стеариновая кислота, сложный эфир глицерина, гидрогенизированное масло, соль жирной кислоты, многоатомный спирт, воск, полиоксиэтиленгликоль,этерифицированный полиэтиленоксид. Кроме того, стеариновая кислота приведена здесь в качестве эксципиента. Однако в этом способе говорится, что в случае только одного кетопрофена могут быть использованы жирные кислоты и их соли, сложные эфиры глицерина, гидрогенизированные масла, воски, этерифицированные полиэтиленоксиды. В методе сталагмопуазии были испытаны также и другие фармацевтические ингредиенты. Так, в документе 83, стр. 33-47 (1990) фирмысообщается об опытах по изготовлению микросфер, содержащих в качестве активного ингредиента теофиллин, с использованием в качестве матричного эксципиента совокупности таких веществ, как стеариновая кислота, белый воск или карнаубский воск, глицерилстеа 4 4932 1 рат (2155), с добавлением или без добавления насыщенного полигликолизированного глицерида ( 50-13) в зависимости от характеристик этих эксципиентов. Были отмечены при этом проблемы, связанные с однородностью, которые привели,согласно этой публикации, к отказу от вышеупомянутых смесей восков для создания микросфер на основе теофиллина. В рамках настоящего изобретения были предприняты попытки применить этот метод к вальпроату натрия. Однако первые опыты, осуществленные с использованием матрицы,содержащей стеариновое производное, показали наряду с другими проблемами, что кристаллизация вальпроата натрия в смеси, подвергающейся сталагмопуазии, и вязкость, не подходят для изготовления микросфер. Эти проблемы особенно проявились при использовании смеси стеариловый спирт/продукт 50-13/вольпроат натрия с массовым соотношением 68/2/30. С другой стороны, опыты с использованием вальпроата натрия и стеариновой кислоты в качестве эксципиента показали, что они несовместимы друг с другом, так как отмечается образование осадка при контактировании этих ингредиентов. Вследствие этого не представлялось возможным перенести на вальпроат натрия матричные эксципиенты, используемые в известном уровне техники для получения фармацевтических микросфер методом сталагмопуазии. В патентах 2293974, 19762682677, 1993 и особенно в патенте 5188838 А, 1993 предприняты попытки усовершенствовать известные методы, однако им присущи вышеперечисленные недостатки. Кроме того, проведенные в них опыты убедительно показывают, что не найден тип эксципиента, который можно было бы использовать в методе сталагмопуазии по отношению к любому используемому активному фармацевтическому ингредиенту. Поэтому решение задачи, заключающейся в разработке лекарственной формы вальпроата натрия, которую можно было бы одновременно легко использовать в педиатрии и в терапии взрослых пациентов, способную маскировать неприятный вкус этого активного ингредиента и имеющую предпочтительно профиль замедленного выделения активного ингредиента, представляется, несомненно, интересным. Заявитель удивительным образом обнаружил, что можно избежать изложенных выше недостатков, используя в качестве лекарственной формы микросферы, содержащие в качестве активного ингредиента вальпроат натрия или любую другую фармацевтически приемлемую соль вальпроевой кислоты и саму вальпроевую кислоту, связанную с соответствующим образом выбранным матричным носителем. В большинстве случаев эти микросферы проявляют себя приспособленными для пролонгированного выделения активного ингредиента без необходимости снабжать их с этой целью особой защитной оболочкой. Таким образом, первый объект изобретения касается фармацевтических микросфер,содержащих в качестве действующего начала смесь вальпроевой кислоты с одной из ее фармацевтически приемлемых солей, например с солью натрия, введенной в матричный носитель, выбранный из сложных эфиров глицерина, гидрогенизированных масел, этерифицированных полиэтиленгликолей, восков и их смесей. Другой объект изобретения касается способа получения микросфер, содержащих смесь вальпроевой кислоты и фармацевтически приемлемой соли этой кислоты, ассоциированную с матричным носителем. Наконец, изобретение относится к фармацевтической форме для перорального приема, содержащей микросферические частицы согласно изобретению.В настоящем описании, а также в формуле изобретения термин действующее начало означает смесь вальпроевой кислоты и фармацевтически приемлемой соли этой кислоты. 4932 1 Микросферы, согласно изобретению, могут быть получены методом сталагмопуазии,упомянутым выше, который заключается в том, что к расплаву матричного носителя добавляют вальпроевую кислоту и ее фармацевтически приемлемую соль для того, чтобы осуществить растворение этих активных ингредиентов в матрице, перемешивают полученную смесь до получения прозрачной жидкости,пропускают полученную смесь в форме прозрачной жидкости через насадку, подвергающуюся вибрации, в результате чего на выходе из насадки образуются капельки, которые под действием силы тяжести увлекаются в колонну, в которой в противотоке циркулирует холодный газ, обычно охлажденный воздух,собирают полученные микросферы в нижней части колонны. Если необходимо, можно снабдить эту колонну для сталагмопуазии псевдоожиженным слоем, который позволяет поддерживать в перманентном псевдоожиженном состоянии еще не полностью отвержденные микросферические частицы. Практически смесь, используемая в сталагмопуазии, может быть получена путем нагревания матричного носителя до температуры плавления, затем, когда масса полностью расплавится, добавляют вальпроевую кислоту, а затем фармацевтически приемлемую соль этой кислоты и поддерживают смесь при перемешивании до получения прозрачной жидкости. В качестве альтернативного варианта можно получить эту смесь, если добавлять отдельно фармацевтически приемлемую соль вальпроевой кислоты к самой вальпроевой кислоте и затем вводить смесь в расплав матричного носителя. Микросферы, согласно изобретению, содержат в качестве действующего начала смесь в любых пропорциях вальпроевой кислоты и одной из ее фармацевтически приемлемых солей. Этой солью обычно является соль щелочного металла, предпочтительно соль натрия,или соль щелочно-земельного металла, такая как соль кальция или магния. Предпочтительно, но не исключительно, в качестве действующего начала используют смеси, содержащие, по меньшей мере, 5 мас.либо вальпроевой кислоты, либо ее фармацевтически приемлемой соли, а остаток составляет не более 95 мас.фармацевтически приемлемой соли вальпроевой кислоты или соответственно не более 95 мас.вальпроевой кислоты. В частности, действующее начало представляет собой смеси 15-60 мас.вальпроевой кислоты и 40-85 мас.фармацевтически приемлемой соли этой кислоты. Смеси, содержащие 25-35 мас.вальпроевой кислоты и 65-75 мас.вышеупомянутой соли, представляют собой смеси, особенно предпочтительные для целей изобретения. Обычно вязкость композиции, образованной фармацевтическим ингредиентом и матричным эксципиентом, представляет собой ограничивающий фактор для осуществления метода сталагмопуазии, предназначенного для получения фармацевтических микросфер. В данном случае и по этой причине микросферы, согласно изобретению, содержат самое большее 35 мас.действующего начала, описанного выше, предпочтительно - от 30 до 35 мас. . В самом деле отмечают, что массовая концентрация действующего начала свыше 35 будет требовать более высокой температуры для того, чтобы поддержать достаточную вязкость матричной массы с целью получения микросфер. С другой стороны, концентрация действующего начала больше 35 вызывает трудности с его растворением в матричном носителе. Этот матричный носитель, который составлен из одного или нескольких эксципиентов класса сложных эфиров глицерина, гидрогенизированных масел, этерифицированных полиэтилен-гликолей или восков, выбирают таким образом, чтобы его температура плавления была заключена между 50 С и 120 С, обычно - между 70 С и 90 С. 4932 1 В этот матричный носитель не надо дополнительно вводить такие поверхностноактивные агенты, как этоксилированные или неэтоксилированные полисорбаты. Предпочтительно, выбирают эксципиенты, способные плавиться при температуре порядка 80 С, соответствующей, во-первых, температуре, которая позволяет растворить действующее начало в матричном носителе, а во-вторых, максимальной температуре, при которой хорошо сохраняются образующиеся микросферы. С другой стороны, слишком высокая температура будет требовать слишком большой высоты падения микросферических частиц для достижения полного отверждения, создавая риск вызвать разложение действующего начала. Принимая во внимание этот рекомендуемый интервал температур плавления, вышеупомянутые эксципиенты могут быть выбраны из глицеридов жирных кислот, насыщенных или ненасыщенных, в частности глицеридов, содержащих до 80 атомов углерода, таких как, например, глицерилтрибегенат, глицерилпальмитостеарат, глицерилмоностеарат, глицерилмоноолеат, каприлокаприновые глицериды, такие как глицерилтрикаприлокапрат насыщенных полигликолизированных глицеридов, таких как смеси сложных моноэфиров, диэфиров и триэфиров глицерина, и сложных моноэфиров и диэфиров полиэтиленгликоля гидрогенизированных масел, таких как гидрогенизированное касторовое масло воска, такого как натуральный пчелиный воск или синтетический пчелиный воск. В качестве примера, матричные эксципиенты, способные образовывать микросферические частицы, согласно изобретению, могут быть выбраны среди глицерилтрибегената, поставляемого в продажу под маркой 888 глицерилпальмитостеарата, поставляемого в продажу под маркойАТО 5-гидрогенизированного касторового масла, поставляемого в продажу под маркойглицерилмоностеарата, поставляемого в продажу под маркой 90/25 глицерилмоноолеата, поставляемого в продажу под маркой 18/99 глицерилтрикаприлокапрата, поставляемого в продажу под маркойлипофильный насыщенных полигликолизированных глицеридов, поставляемых в продажу под марками 50-02 или 2130 натурального пчелиного воска или синтетического пчелиного воска, поставляемого в продажу под маркойпарафина. Эксципиенты, используемые, согласно изобретению, выбирают, кроме того, с учетом их гидрофильной, липофильной (или гидрофобной) или амфифильной природы, и, соответственно, в зависимости от желаемой кинетики выделения действующего начала. В частности, и не ограничивая объема охраны изобретения, смеси эксципиентов типа или глицерилтрибегенат (СОМРТО 888)/поверхностно-активный агент 2130 или глицерилтрибегенат ( 888)/ глицерилмоноолеат 18/99 или синтетический пчелиный воск ( В/гидрогенизированное касторовое масло ( )/ глицерилмоностеарат ( 90/25) показали себя подходящими для немедленного освобождения действующего начала. Для иллюстрации проводят испытаниярастворения при рН 6,8 в течение 6 часов по методу, описанному в монографииЕвропейской Фармакопеи в главе Общие рецепты, том 5.4,стр. 1-9 (1995). С этой целью используют микросферы, содержащие 55-60 мас.продукта 888 или продуктаАТО 5, 30-35 мас.действующего начала (вальп 7 4932 1 роевая кислота/вальпроат натрия) и 10-15 мас.поверхностно-активного агента 2130 . Спустя 1 ч регистрируют 100 растворенного действующего начала в случае композиции, содержащей продуктАТО 5, и 85 для композиции, содержащей продукт 888. Точно также испытания на растворение, проведенные в тех же условиях с микросферами, содержащими 20-25 мас.продукта, 20-25 мас.продукта, 20-25 мас.продукта 90/25 и 30-35 мас.действующего начала (вальпроевая кислота/вальпроат натрия), показали растворение 100 действующего начала после 1 ч. Кроме того, аналогичное испытание, осуществленное с 55-60 мас.продукта 888, 30-35 мас.действующего начала (вальпроевая кислота/вальпроат натрия) и 10 мас.продукта 18/99, выявило равным образом профиль немедленного выделения. В результате этих испытаний можно заключить, что ни одна из испытанных и указанных выше в качестве примеров композиций не обладает замедленным профилем выделения действующего начала на протяжении 6 ч. Напротив, другие композиции микросфер, использующие продукт 888,как единственный матричный эксципиент, показали себя более подходящими к замедленному освобождению действующего начала. Добавление некоторых гидрофобных веществ, таких как гидрогенизированное касторовое масло ( ), пчелиный воск, парафин, продукт 50-02, липофильный продуктпозволяет, кроме того, усилить различное освобождение действующего начала. В качестве примера микросферические частицы, содержащие 6570 мас.продукта 888 и 30-35 мас.действующего начала (вальпроевая кислота/вальпроат натрия), при испытаниях растворения проявляют замедленный профиль растворения. Аналогичные результаты были зарегистрированы для микросферических частиц, содержащих 55-60 мас.продукта 888, 10-15 мас.продукта, пчелиный воск, парафин, продукт 50-02 или липофильный продукти 30-35 мас.действующего начала. В частности, испытаниям растворения при рН 6,8 в течение 9 ч по методу Европейской Фармакопеи(Раасорее), описанному выше, подвергали микросферические частицы следующих составов, а именно 888 Добавки Вальпроевая кислота Вальпроат натрия при этом добавки соответствовали продуктам,, парафин, 50-02 илипофильный. Полученные профили растворения представлены в приложении на фиг. 1, на которой а) кривая, обозначенная формула 1, показывает проценты растворения аниона вальпроата в зависимости от времени, начиная с вышеупомянутых микросфер, в которых добавкой является продуктб) кривая, обозначенная формула 2, показывает проценты, аналогичные кривой формула 1, когда добавкой является продуктв) кривая, обозначенная формула 3, показывает проценты, аналогичные кривой формула 1, когда добавкой является парафин 8 4932 1 г) кривая, обозначенная формула 4, показывает проценты, аналогичные кривой формула 1, когда добавкой является продукт 50-02 д) кривая, обозначенная формула 5, показывает проценты, аналогичные кривой формула 1, когда добавкой является продуктлипофильный. Полученные результаты указывают на замедленную кинетику выделения действующего начала. Можно сделать вывод, что композиции, содержащие парафин, гидрогенизированное касторовое масло ( ) и синтетический пчелиный воск (), являются наиболее интересными. Так как действующее начало, используемое в настоящем изобретении, состоит из гидрофобного компонента, а именно вальпроевой кислоты и гидрофильного компонента, то есть фармацевтически приемлемой соли этой кислоты, кажется, что наилучшими матричными эксципиентами должны были бы быть амфифильные вещества, чтобы обеспечить,за счет их гидрофобной части, замедленное выделение действующего начала и, за счет гидрофильной части, регулирование скорости высвобождения этого действующего начала из эксципиента. Однако неожиданно было обнаружено, что матричный эксципиент, образованный только из натурального пчелиного воска, типично гидрофобного жирного продукта, позволяет получать замедленный профиль высвобождения действующего начала, прекрасно совместимого с фармацевтическим составом замедленного действия. Кроме того, этот профиль оказался достаточно похожим на профиль высвобождения, регистрируемый с известными таблетками, содержащими в качестве активного ингредиента смесь вальпроевая кислота/вальпроат натрия. В частности, были проведены испытания растворения, а также фармакокинетические испытания, исходя из либо микросфер, сформированных из 68,37 г натурального пчелиного воска в качестве матричного носителя, и 31,63 г действующего начала, а именно, 9,63 г вальпроевой кислоты и 22 г вальпроата натрия, называемых ниже микросферы композиции А соответственно действующее начало соответствует смеси вальпроевая кислота/вальпроат натрия 30,45 мас. /69,55 мас.либо расслаиваемой таблетки с замедленным выделением, содержащей 478 мг смеси вальпроевая кислота/вальпроат натрия, а именно, 145 мг кислоты и 333 мг соли, при этом эта таблетка содержит, в частности, полимеры метакриловых кислот в качестве эксципиента. Активные ингредиенты этой поставляемой в продажу таблетки соответствуют, соответственно, смеси вальпроевая кислота/вальпроат натрия 30,33 мас. /69,67 мас.или 500 мг активного ингредиента, в расчете на вальпроат натрия.- Испытания на растворение. Эти испытания осуществляютпри рН 6,8 по методу, описанному выше. Полученные профили растворения представлены в приложении на фиг. 2, на которой а) кривая, обозначенная микросферы, показывает проценты растворения аниона вальпроата в зависимости от времени, исходя из вышеупомянутых микросфер композиции А б) кривая, обозначенная таблетка, показывает проценты растворения аниона вальпроата в зависимости от времени, исходя из вышеупомянутой таблетки с замедленным выделением. Полученные результаты ясно показывают, что профиль растворения микросфер композиции А близок и по форме подобен профилю растворения таблетки, так как только 10 -ное отклонение отличает их, начиная с первого часа, и это отклонение остается постоянным в течение, по меньшей мере, 5 ч.- Фармакокинетические испытания. Испытания проводят на трех группах из 24 здоровых пациентов, которым вводят микросферы композиции А в воде,9 4932 1 микросферы композиции А в йогурте,расслаиваемые таблетки с замедленным выделением, такие, как указаны выше, таким образом, что каждый пациент получает дозу активного ингредиента (вальпроевая кислота/вальпроат натрия), эквивалентную 500 мг в расчете на вальпроат натрия. У каждого пациента, начиная с момента приема препарата, каждый час регистрируют концентрацию аниона вальпроата в крови и, в частности, максимальную концентрацию(Смакс) в крови, время после приема, за которое достигается эта максимальная концентрация (Тмакс), и остаточную концентрацию в крови через 24 ч после приема. Полученные результаты представлены в приложении на фиг. 3, на которой а) кривая, обозначенная Композиция А/вода, показывает среднюю концентрацию в крови, полученную с микросферами композиции А в воде б) кривая, обозначенная Композиция А/йогурт, показывает среднюю концентрацию в крови, полученную с микросферами композиции А в йогурте в) кривая, обозначенная таблетка, показывает среднюю концентрацию в крови, полученную с таблеткой с замедленным выделением. Эти результаты показывают, что Смакс для микросфер композиции А слегка выше максимальной концентрации для расслаиваемой таблетки с замедленным выделением, а именно, приблизительно на 16 для микросфер композиции А в воде и приблизительно на 22 для микросфер в йогурте, в то время, как Тмакс оказалось слегка короче для микросферических частиц по сравнению с таблеткой. Наконец, результаты дисперсных анализов показывают, что нет значительного различия между площадями под кривыми . Другими словами, эти испытания позволяют заключить, что не существует заметного различия в биодоступности между микросферами композиции А и расслаиваемой таблеткой с замедленным выделением. Следовательно, микросферы, содержащие от 30 до 35 действующего начала в сочетании с матричным носителем, целиком состоящим из пчелиного воска, являются микросферами, представляющими существенный интерес. Точно также и микросферы этого типа, в которых действующее начало образовано из 2535 вальпроевой кислоты и 65-75 фармацевтически приемлемой соли этой кислоты, такой как вальпроат натрия, являются особенно предпочтительными для целей изобретения. В отличие от других способов получения сфероидов, метод сталагмопуазии позволяет получить гранулометрическое распределение, называемое монодисперсным, преимуществом которого является получение сферических частиц одинакового размера. Таким образом, при приеме медикамента, содержащего их, количество таких микросфер, принимаемых пациентом, будет постоянным. Фармацевтические микросферы, согласно изобретению, наделены тем преимуществом,что они имеют такую одинаковую сферическую форму и диаметр, заключенный между 250 мкм и 500 мкм, обычно - порядка 400 мкм. При необходимости, эти микросферы могут быть покрыты пленкообразующим агентом для того, чтобы образовать, например, пленку, устойчивую в желудке. Кроме того, они могут быть изготовлены в различных фармацевтических формах, в виде разовых доз или неразовых, подходящих для перорального приема. Такими фармацевтическими формами могут быть, например, таблетка, расслаиваемая или нерасслаиваемая капсула, желатиновая капсула, порошок, упакованный, например, в пакетик или в распределительную систему, выдающую разовые дозы, в частности, в распределительный флакон/дозатор или емкость, снабженную дозирующей ложкой регулируемого объема,например, для обеспечения соответствия доз весу пациента. При их формовании в вышеупомянутые микросферы можно вводить агенты, облегчающие истечение, а также смазывающие вещества, минеральные наполнители, такие как диоксиды кремния, тальк, оксид алюминия, или подсластители, такие как аспартам. 10 4932 1 Эти фармацевтические формы могут предпочтительно содержать в единице дозы введения от 50 до 500 мг действующего начала в форме микросфер, согласно изобретению, в частности, от 50 до 250 мг. Следующие примеры, не ограничивающие объема охраны изобретения, иллюстрируют изобретение Пример 1. Получение микросфер вальпроевая кислота/вальпроат натрия в пчелином воске Получают микросферы следующего состава Белый пчелиный воск Вальпроевая кислота Вальпроат натрия действуя следующим образом. В емкость с двойными стенками термостатируемого устройства для разогрева, настроенного на 95 С, вводят 68,424 г белого пчелиного воска и затем плавят его при температуре от 90 С до 93 С, контролируя полное плавление продукта. В расплавленном воске, поддерживаемом при 90 С, при медленном перемешивании диспергируют затем 9,576 г вальпроевой кислоты, затем 22,000 г вальпроата натрия и наблюдают за растворением двух ингредиентов, пока смесь не станет прозрачной (никакого появления кристаллов). Затем приступают к сталагмопуазии смеси при температуре 90 С через инжекторные форсунки диаметром 200 мкм, поддерживаемые при температуре от 87 С до 91 С, и под давлением 0,5 бар. При стробоскопическом контроле на частоте 25000 Гц регулируют частоту вибратора устройства (5,75103 Гц - 6,70-103 Гц) таким образом, чтобы индивидуализировать образующиеся капельки. Таким образом, в нижней части устройства собирают микросферы, затвердевшие в результате охлаждения во время их падения в воздухе (высота падения около 2,5 м), охлаждаемом противотоком холодного воздуха или ванной с жидким азотом. Эти микросферы имеют средний диаметр 400 мкм. Тем же самым образом, но, используя другие матричные эксципиенты, получают микросферы, исходя из следующих составов, которые после растворения действующего начала оказались совершенно прозрачными (никакого появления кристаллов) Пример 2. мас. 4932 1 Пример 4.888 2130 Вальпроевая кислота Вальпроат натрия АТО 5 2130 Вальпроевая кислота Вальпроат натрия 90-25 Вальпроевая кислота Вальпроат натрия 888 Вальпроевая кислота Вальпроат натрия 888 Вальпроевая кислота Вальпроат натрия Пример 9.888 Пчелиный воск Вальпроевая кислота Вальпроат натрия 888 Парафин Вальпроевая кислота Вальпроат натрия 4932 1 Пример 11.88850-02 Вальпроевая кислота Вальпроат натрия 888 липофильный Вальпроевая кислота Вальпроат натрия Пример 13.88818/99 Вальпроевая кислота Вальпроат натрия 888 Пчелиный воск Вальпроевая кислота Вальпроат натрия Пример 15. Фармацевтические формы, содержащие микросферы 1). Пакетик В пакетик вводят 756,7 мг микросфер, полученных в примере 1, таким образом, чтобы образовать единичную дозу для перорального приема, содержащую 238,96 мг действующего начала, составленного из вальпроевой кислоты/вальпроата натрия в соотношении 30,4 мас./69,6 мас. , что соответствует 250 мг действующего начала в расчете на вальпроат натрия. 2). Распределительный флакон/дозатор Во флакон с полезным объемом приблизительно 45 мл, дающий возможность распределения разовых доз, вводят 24 г микросфер, полученных в примере 1, или 8 г действующего начала на упаковочную единицу. Этот флакон позволяет распределить около 50 разовых доз, содержащих 150 мг действующего начала, составленного из вальпроиновой кислоты/вальпроата натрия в соотношении 30,4 мас./69,6 мас. . Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 14
МПК / Метки
МПК: A61K 31/19, A61P 25/08, A61K 9/16
Метки: введения, фармацевтические, перорального, кислоты, микросферические, вальпроевой, частицы
Код ссылки
<a href="https://by.patents.su/14-4932-farmacevticheskie-mikrosfericheskie-chasticy-valproevojj-kisloty-dlya-peroralnogo-vvedeniya.html" rel="bookmark" title="База патентов Беларуси">Фармацевтические микросферические частицы вальпроевой кислоты для перорального введения</a>
Предыдущий патент: Пневмосепаратор
Следующий патент: Электропечь для обжига заготовок керамических радиодеталей
Случайный патент: Шумозащитная стенка