Способ получения производного имидазола
Номер патента: 1372
Опубликовано: 16.09.1996
Авторы: Сусуму Окабе, Ютака Номура, Митсуо Масаки, Хитоси Матсукура, Томио Ямакава
Текст
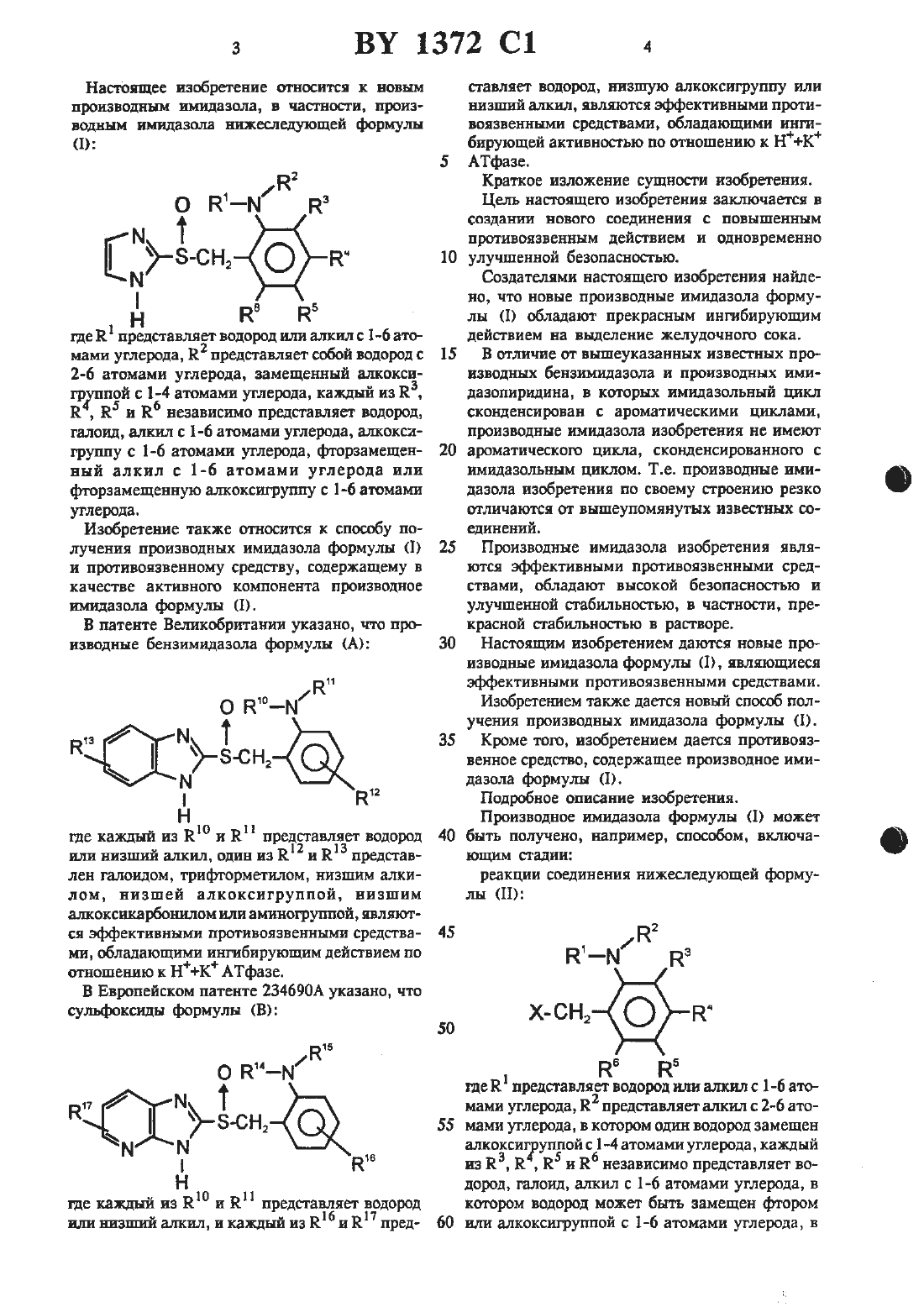
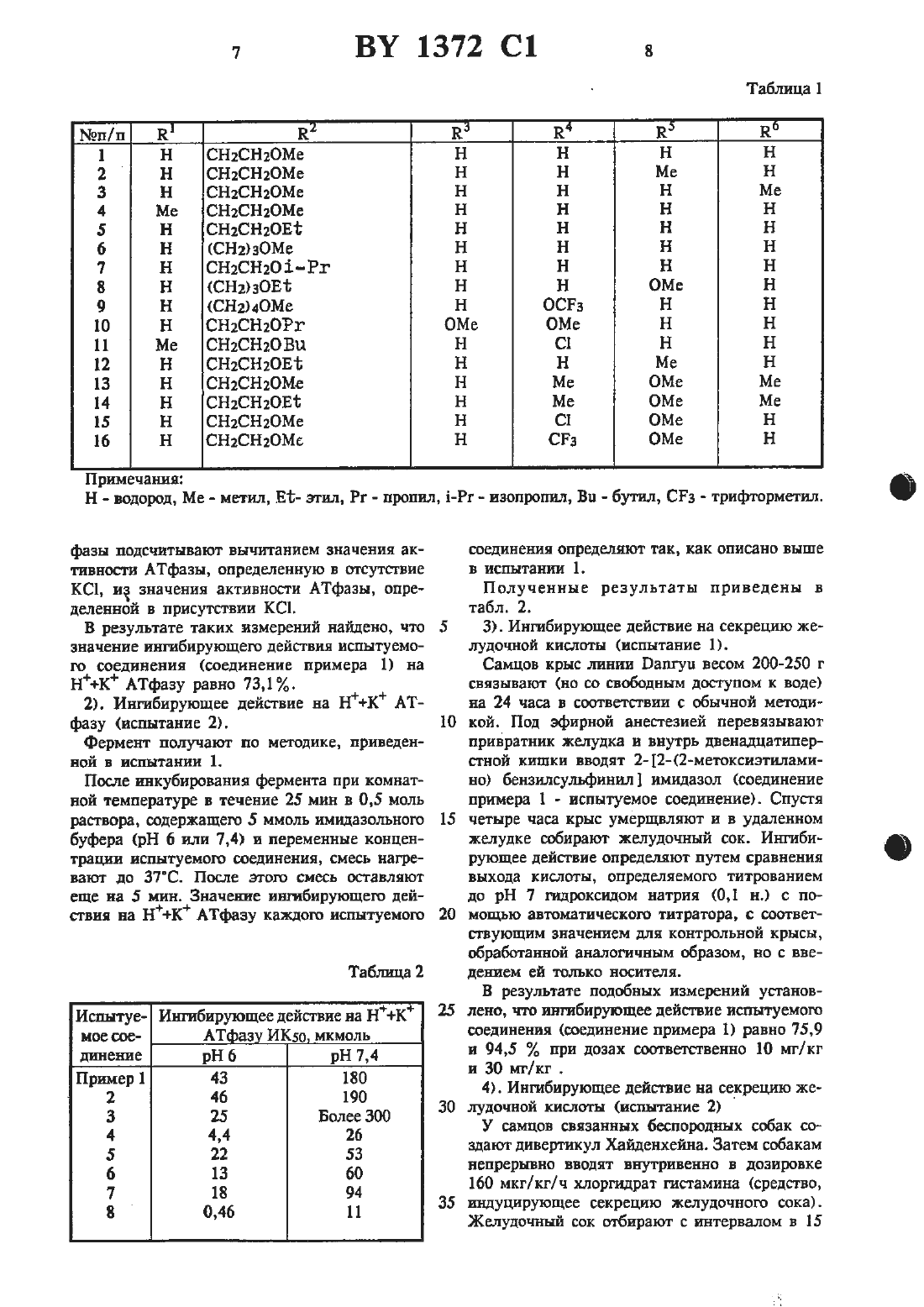
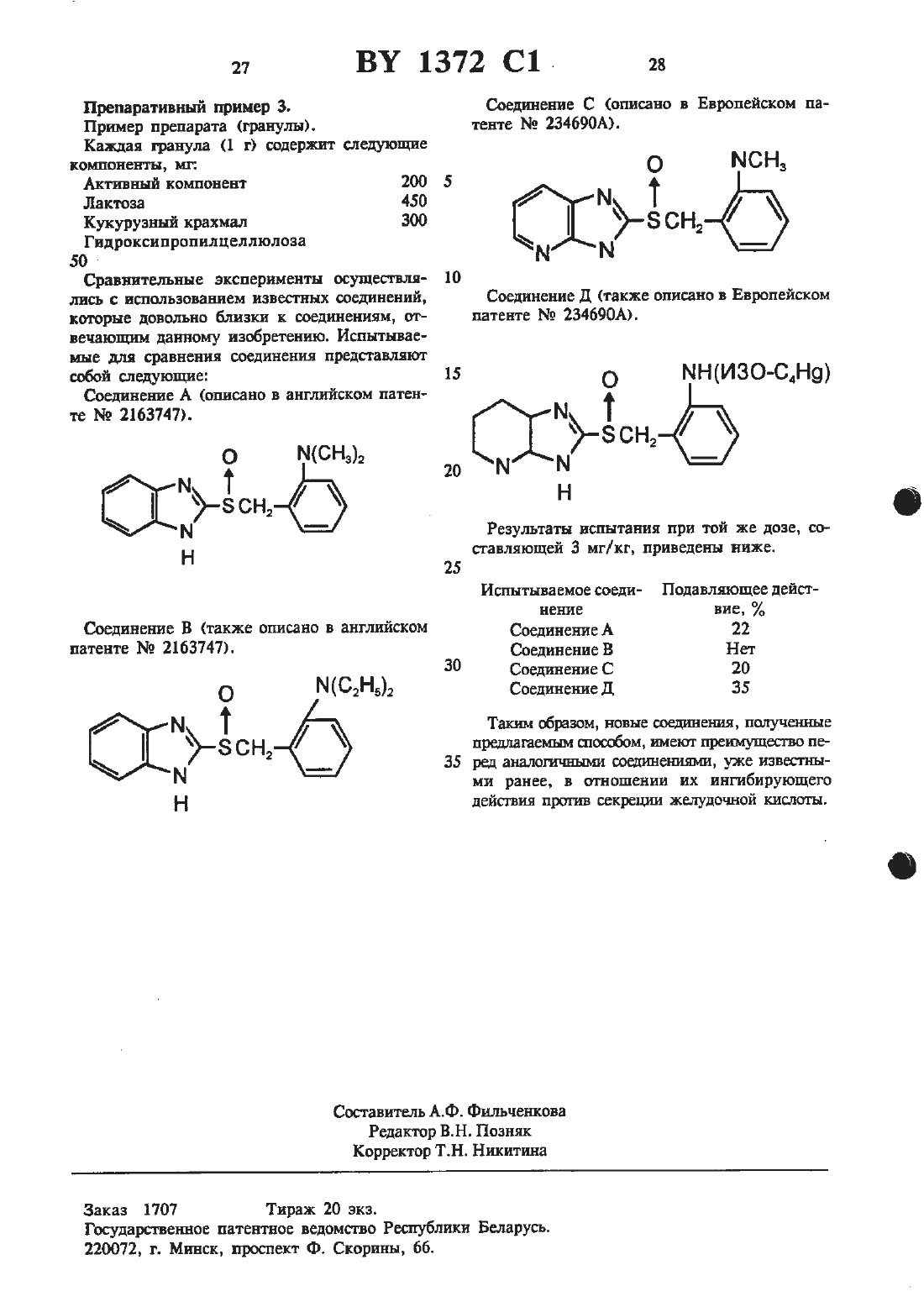
Настоящее изобретение относится к новым производным имидазола, в частности, производным имидазола нижеследующей формулыгде К представляет водород или алкил с 1-6 атомами углерода, 122 представляет собой водород с 15 2-6 атомами углерода, замощенный алкоксигруппой с 1-4 атомами углерода, каждый из 123, Е , 125 и 126 независимо предстамяет водород,галоид алкил с Е-б атомами углерода, алкоксигруппу с 1-6 атомаъш углерода, фторзамещен- 20 ный алкил с 1-6 атомами углерода или фторзамещенную алкоксигруппу с 1-6 атомами углерода.Изобретение также относится к способу попучения производных имидазола формулы (1) 25 и противоязвенному средству, содержащему в качестве активного компонента производноеимидазола формулы (1). В патенте Великобритании указано, что про изводные бензимидазола формулы (А) 30 Н о НЮ-м нчз М Т 35 з-сн,М к 12 Нгде каждый из Ею и К представляет водород 40 или низший алкил, один из Е и К представлен галоидом, трифторметилом, низшим алкилом, низшей алкоксигруппой низшим ашюксикарбонилом или аминогруппой, являются эффективными противоязвенными средства- 45 ми, обладающими ингибирующим действием по отоплению к НК АТфазе.где каждый из Ею Е представляет водород или визпшй алкил, и каждый из 1216 ИК пред- 60сгавляет водород, низшую алкокситруппу или низший алкил, являются эффективными противоязвенными средствами, обладающими ингибнрующей активностью по отношению к НК АТфазе.Краткое изложение сущности изобретения.Цель настоящего изобретения заключается в создании нового соединения с повышенным противоязвенным действием и одновременно улучшенной безопасностью.Создателями настоящего изобретения найдепо, что новые производные имидазола формулы (1) обладают прекрасным ингибирующим действием на выделение желудочного сока.В отличие от вышеуказанных известных производных бензимидазола и производных имидазопиридина, в которых имидазолъный цикл сконденсирован с ароматическими циклами,производные имидазола изобретения не имеют ароматического цикла, сконденсированною с имидазольным циклом. Т.е. производные имидазола изобретения по своему строению резко отличаются от вышеупомянутых известных ооединений.Производные имидазола изобретения являются эффективными противоязвенными средствами, обладают высокой безопасностью и улучшенной стабильностью, в частности, прекрасной стабильностью в растворе.Настоящим изобретением даются новые производные имидазола формулы (1), являющиеся эффективными противоязвенными средствами.изобретением также дается новый способ получения производных имидазола формулы (1).Кроме того, изобретением дается противоязвенное средство, содержащее производное имидазола формулы (1).Производное имидазола формулы (1) может быть получено, например, способом, включающим стадииреакции соединения нижеследующей формулы (П)КБ к) где Е представляет водород или алкил с 1-6 атомами углерода, В представляет али-сил с 2-6 атомами углерода, в котором один водород замещен алкоксиг уппой с 1-4 атомами углерода, каждый из Ка, Н , 35 и 126 независимо представляет водород, галоид, алкил с 1-6 атомами углерода, в котором водород может быть замещен фтором или алкоксигрутшой с 1-6 атомами углерода, вкоторой водород может быть замещен фтором, и Х представляет отходящую группу, такую, как галоид, тозилоксигруппа или мезилоксигруппа, с З-меркаптоимидазолом с получением производного имидааола формулы (111) иокисления производного имидазола формулыгде каждый из К, 122, 123, 114, Н 5 и 116 принимают значения, указанные для формулы (П).Вышеприведенная реакция между соединениями формулы (П) и Ъмеркаптоимидазолом может быть осуществлена в температурном интервале от комнатной температуры до температуры кипения инертного растворителя, такою как бензол, этанол или ацетон. Реакция может быть осуществлена в присутствии щелочного средства, такого, как ЫаОН, КОН, К 2 С 0 з, ЫаНСОэ и тризтиламин для связывания образующейся В РВЗКЦИИ КИСЛОТЫ.Методика окисления соединения формулы(111) с получением производного сульфинильною типа может быть самой обычной. К примеру, соединение формулы (111) может быть ОКИСЛСНО С ПОМОЩЬЮ ОКИСЛИТСЛЯ, ТЭКОПО как водная перекись водорода в присутствии иона металла (например, ванадия, молибдена или вольфрама), ортаъшчестсая перекись (например,м-хлорнадбензойная кислота или трет-бутилгидроперекись) или гипохлорит натрия. Реакпня может быть осуществлена в ш-тертном растворителе, таком, как хлороформ, дихлорметан,метанол шш этилацетат в температурном интервале от -З 0 С до 50 С, предпочтительно отВ описании примеры алкилов с 1-6 атомами углерода вкдпочают метил, этил, н-проштл, изопропил, н-бутил, наобутил, трет- бутил, н-пенПИЛ, РЕЗОПЕНТИЩ, НВОПЕНТИЛ, Н-ПЭКСУШ Н ИЗОПСКСИЛ. Примеры алкоксигрупп с 1-4 атомами углерода вкш-очают метоксш, ЗГОКСИ, н-пропокстъ, изопропокси-, н-бутокси-ц изобутокси- и трет-бутоксигруппу н циклопропокси. Примеры алкгшов с 2-6 атомами углерода включат этил,н-пропил, нзопропил, н-бутил, изобутил, третбутил, н-пентил, изопентил, неопентил, н-гексил и нзогексил. Что касается 122 (т.е. алкила с 2-6 атомами углерода, замешенного алкоксигруппой с 1-4 атомами углерода) в формулах(1), (11) и (Ш), то алкоксигруппа с 1-4 атомами углерода предпочтительно присоединена к концевому атому углерода (который не связан с атомом азота) алкила с 2-6 атомамиуглерода. Примеры алкокснгрупп с 1-6 атомами углерода включают метокси-, этокси, нпропоксиц иаопропоксть, н-бутоксиц изобутоксн-,трет- бутокси-, пентилокси- и гексилоксигруппу. Что касается фторзамещенных алкилов(каэкцый из Ка, 24, 115 и Кб), то в их числе фтораамещенный -метил, фторзамещенный изопропил, фгорзамещеныый н-бутил, фторзамещенный изобутил, фторзамещенный третбутил, фторзамещенный н-пентил,фторзамещеш-шй изопентил, фюрзамещетпцяй неопентил, фторзамещештьтй н-гексил итш фтораамещенный изогексил, и примеры фторзамещенной алкоксигруппы включаютфгорзамещенную алкоксшрушту, фторзамещенную этоксшрушту, фгторзамещенную н-пропок сигруппу, фторзамещенную иаопропоксигруппу, фторзамещенную трет-бутоксигруппу, фторзамещеттную пентилоксигруппу ишт фтораамещенную гексилоксигруппу. Атом галоида это фтор, хлор, бром шш йод.Примеры производных имндазола изобретения включают нижеследующие соединения.Представительные примеры производных имндазола формулы (1) включают соединения,для которых значения Е, 122, Ка, 124, 125 и 116 приведены в табл. 1.Фармакологическое действие испытано по отношению к представительному соединению формулы (1) изобретения. Ниже приведены результаты испытаний.1). ингибирующее действие на НК АТфаау (испытание 1).По методике Ропе и др. из слизистой желудка кролика выделяют клетки. Пузырек, содержащий НК АТфазу, получают центрифугированием клеток в Фиколле с непрерывным градиентом плотности, в соответствии с Сп 5 ассошапй и др. После инкубирования фермента при комнатной температуре в течение 15 минут в 0,5 мл раствора, содержащего 5 ммоль имидазольного буфера (рН 6) и 2 х 104 М 2-2- (2-метоксиэтиламино) бензилсульфинил имидааола (соединение примера 1- НСПНТУМОС СОСДИНСНИВ), СМЕСЬ нагревают ДО ЗТС. После этого смесь оставляют еще на 5 мин. К смеси добавляют 0,5 мл раствора,содержащего 4 ммоль хлорида магния, 80 ммоль нмидазольного буфера (рН 7,4), 20 ммоль хлорида калия и 4 ммоль АТФ. Полученную смесь оставляют реагировать на 15 мин при 37 С, после чего для прекращения реакции добавляют 1 мл 24 -ной трихлоруксусной кислоты. Внлелившийся неорганический фосфор определяют количественно по методике, предложенной Таиззку апо БЬот-г.Вышеприведенная методика повторена, но без добавления хлорида калия с целью определения активности АТФ в отсутствие хлорида калия. Целевую Кзависимую активность АТфазы подсчитывают вычитанием значения активности АТфазы, определенную в отсутствие КС 1, из значения активности АТфазщ определенной в присутствии КС 1.В резулътате таких измерений найдено, что значение ингибирующего действия испытуемого соединения (соединение примера 1) на НК АТфазу равно 73,1.2). ингибирующее действие на НК АТфазу (испытание 2).Фермент получат по методике, приведенной в испытании 1.После инкубирования фермента при комнатной температуре в течение 25 мин в 0,5 моль раствора, содержащего 5 ммоль имидазольного буфера (рН 6 или 7,4) в переменные концентрации испытуемого соединения, смесь нагревают до 37 С. После этого смесь оставляют еще на 5 мин. Значение ингибирующего дейсгвия на НК АТфазу каждою испытуемогоИспытуе- ингибирующее действие на НК мое оое- АТ аз ИК 5 о мкмольсоединения определят так, как описано выше в испытании 1.Полученные результаты приведены в табл. 2.З). ингибирующее действие на секрецию желудочной кислоты (испытание 1).Самцов крыс линии Папгуи весом 200-250 г связывают (но со свободным доступом к воде) на 24 часа в соответствии с обычной методикой. Под эфирной анестезией перевязывают привратник желудка и внутрь двенадцатиперстной кигпки вводят 2-2-(2-метоксизтиламино) бензилсульфинил имидазол (соединение примера 1 - испытуемое соединение). Спустя четыре часа крыс умерщвляют и в удаленном желудке собирают желудочный сок. Ингибирующее действие определяют путем сравнения выхода кислоты, определяемого титрованием до рН 7 гидроксидом натрия (0.1 н.) с помощью автоматического титратора, с соответствующим значением для контрольной крысы,обработанной аналогичным образом, но с введением ей только носителя.В результате подобных измерений установлено, что ингибирующее действие испытуемого соединения (соединение примера 1) равно 75,9 и 94,5 И, при дозах соответственно 10 мг/кг и 30 мт/кг .4). ингибирующее действие на секрецию желудочной кислоты (испытание 2)У самцов связанных беспородных собак создают дивертикул Хайденхейна. Затем собакам непрерывно вводят внутривенно в дозировке 160 мкг/ кг/ ч хлоргидрат гистамина (средство, индуцирующее секрецию желудочного сока). Желудочный сок отбирают с интервалом в 15мин с измерением его кшшчества и выхода кислоты с целью определения количества секретируемой кислоты (мЭкв/ 15 мин).Испытуемое соединение вводят собакам внутривенно через час после начала введения гистамина.ингибирующее действие определяют путем сравнения количества секретируемой кислоты между предлекарсгвенным значением (до применения лекарства) и послелекарствениым значением (спустя 30 мин после применения лекарства).Результаты при дозировке 3 мг/ кг приведены ниже.Испытуемоее соединение по примеруОКА-ВИЗЫ Согласно другому эксперименту, испытуемые соединения назначали орально за 2 часа до инициирования с применением гистамина и ингибирующее действие определяли путем сравнения количества секретируемой кислоты с соответствующим количеством для контрольной собаки, обработанной таким же образом,за исключением того, что вводят один лишь носитель.Результаты при дозе 10 мг/кг при-ведены ниже.Испытуемоее соедине- Подавляющее дейстние по примеру вис, 3 100 8 100Испытание на острую токсичность.Самцам крыс вида 513 с весом около 190 г орально вводили соединение примера 8. За крысами наблюдали затем в течение двух дней. МДЦ составляет 1000 мг/кг или более.Соединения формулы (1) настоящего изобретения могут быть введены либо перорально,либо парентерально. Препараты для перорального введения могут иметь вид. например, таблеток, капсул, порошков, гранул, сиропа и т.п. Препараты для парентерального введения могут иметь вид иньектируемых препаратов и т.п. В состав таких препаратов могут быть добавлены наполнители, диспергирующие добавки, связующие добавки, смазки, красители,разбавители и аналогичные обычно применяемые добавки. Наполнители могут включать декстрозу, лактозу и т.п. В качестве диспер 5гирующих добавок могут быть использованы крахмал, карбоксиметшщешполоза кальция и т.п. В качестве смазок могут быть использованы тальк, сгеарат магния и т.п. Связующей добавкой может шгужить гидроксшгрогшшдедиполоза,желатин, пшшвиннлгшрродшдон и т.п.Применяемая доза может составлять 1-50 мг/денъ в случае инъекцируемого препарата и 10-500 мг/день при пероральном введении (в обоих. случаях для взрослого человека). Доза может быть увеличена или уменьшена в зависимости от возраста пациента и дРУгих условий.Ниже приведены примеры настоящего изобретения.(1) Метиловый эфир Ъметоксиацетамидобенвойной кислоты.К раствору 3,02 г (20 ммоль ) метилового эфира антраниловой кислоты в 30 мл хлористого метилена добавляют 2,22 г (22 ммоль) триэтиламина и к полученному раствору при охлаждении льдом по каплям прибавляют раствор 2,39 г (22 ммоль) метоксиацетилхлорида. Полученную смесь перемешивают 1 ч. После добавления льда перемешиваемую соль подшелачивают добавлением 1 н. водного раствора гидроксида натрия и затем экстрагируют клороформом. органическую часть отделяют и последовательно промывают Зн. НС 1, 6 н. НС,водой и насыщенным водным раствором хлорида натрия. Промытую хлороформенную часть сушат над безводным сульфатом натрия.Растворитель удаляют при пониженном давле-.К суспензии 912 мг (24 ммоль) литийалюминийгидрица в 40 мл сухого тетрагидрофурана (ТГФ) при перемешивании и охлаждении льдом в течение 10 мин по каплям прибавляют 3,6 г (16,1 ммоль) метилового эфира 2-метоксиацетамидобензойной кислоты (получение см,стадию 1), после чего смесь перемешивают 1 ч. Затем- к реакционной смеси добавляют насыщенный водный раствор сульфата натрия. органическую часть отделяют и растворитель отгоняют при пониженном давлении. Очисткой осгатк-а колоночной хроматографией на силикагеле получают 1,2 г целевого соединения в виде бесцветного масла.
МПК / Метки
МПК: C07D 233/84, A61K 31/415
Метки: способ, производного, имидазола, получения
Код ссылки
<a href="https://by.patents.su/14-1372-sposob-polucheniya-proizvodnogo-imidazola.html" rel="bookmark" title="База патентов Беларуси">Способ получения производного имидазола</a>
Предыдущий патент: Калийное удобрение
Следующий патент: Огнеупорная бетонная масса
Случайный патент: Непрерывный лазерный излучатель