Физиологически активный конъюгат ПЭГ-(-IFN, способ его получения, фармацевтические композиции на его основе
Номер патента: 6445
Опубликовано: 30.09.2004
Текст
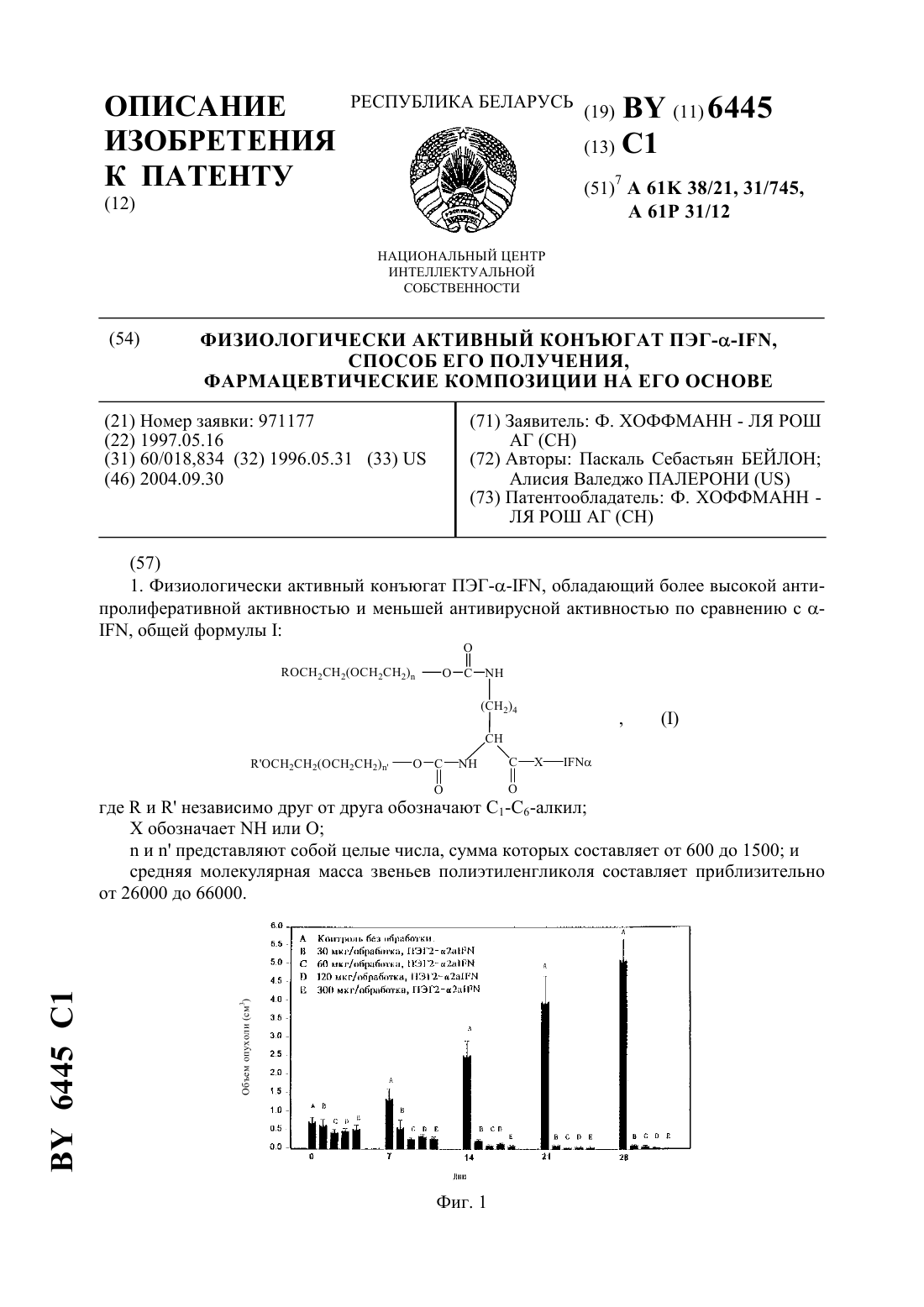
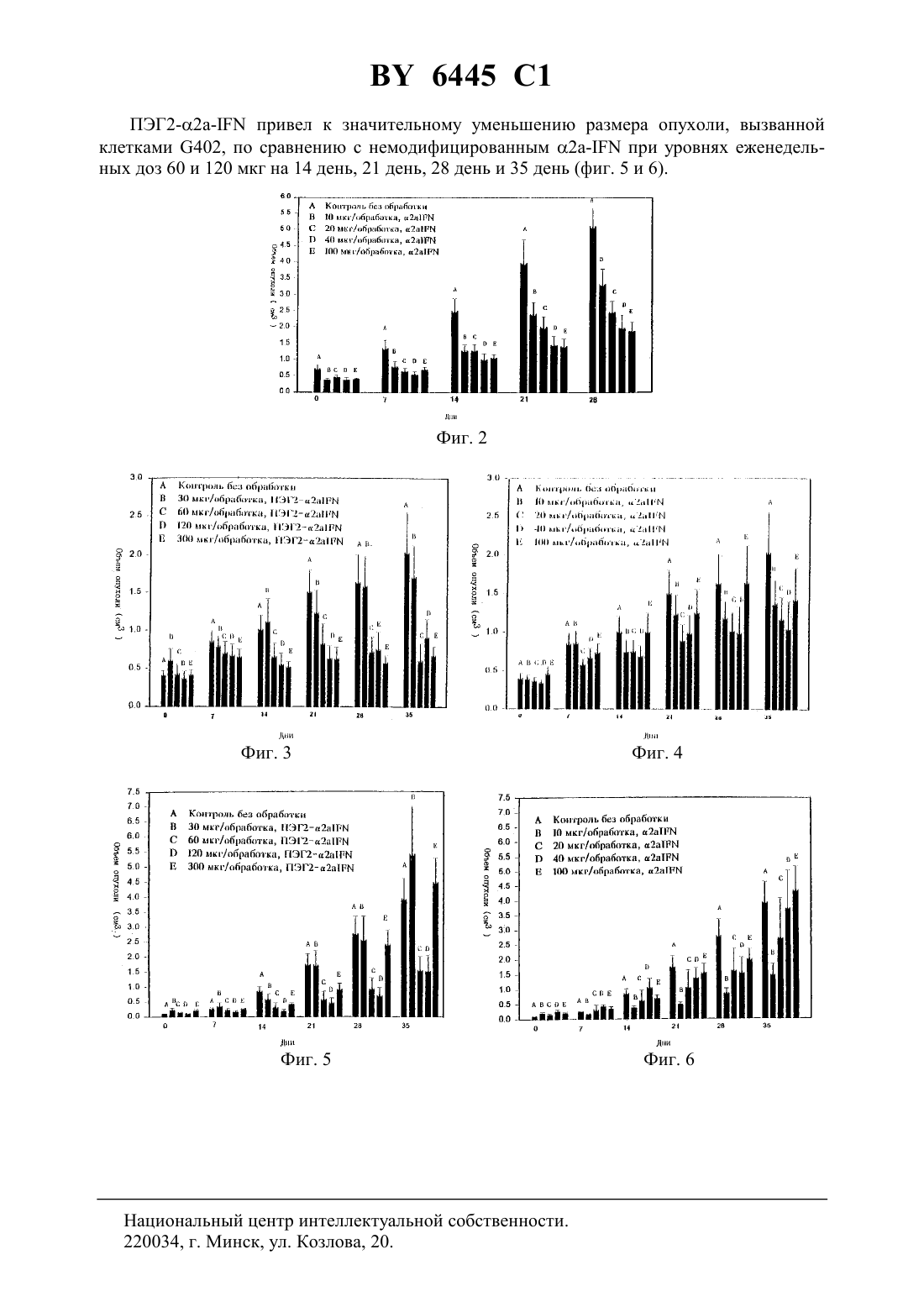
61 31/12 НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ФИЗИОЛОГИЧЕСКИ АКТИВНЫЙ КОНЪЮГАТ ПЭГ,СПОСОБ ЕГО ПОЛУЧЕНИЯ,ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ЕГО ОСНОВЕ(72) Авторы Паскаль Себастьян БЕЙЛОН Алисия Валеджо ПАЛЕРОНИ(73) Патентообладатель Ф. ХОФФМАНН ЛЯ РОШ АГ(57) 1. Физиологически активный конъюгат ПЭГ, обладающий более высокой антипролиферативной активностью и меньшей антивирусной активностью по сравнению с , общей формулы гдеинезависимо друг от друга обозначают 1-6-алкил Х обозначаетили Оипредставляют собой целые числа, сумма которых составляет от 600 до 1500 и средняя молекулярная масса звеньев полиэтиленгликоля составляет приблизительно от 26000 до 66000. 6445 1 2. Конъюгат по п. 1, отличающийся тем, что молекулярная масса звеньев полиэтиленгликоля составляет приблизительно от 35000 до 45000. 3. Конъюгат по п. 2, отличающийся тем, что молекулярная масса звеньев полиэтиленгликоля составляет приблизительно 40000. 4. Конъюгат по п. 1, отличающийся тем, чтоиобозначают метил. 5. Конъюгат по п. 1, отличающийся тем, чтообозначает . 6. Конъюгат по п. 1, отличающийся тем, что - представляет собой 2-. 7. Конъюгат по п. 1, отличающийся тем, что суммаисоставляет от 850 до 1000. 8. Конъюгат по п. 1, отличающийся тем, чтоиобозначают метилобозначает- представляет собой 2- и один или обаиравны 420. 9. Конъюгат по п. 1, отличающийся тем, чтоиобозначают метилобозначает- представляет собой 2- и один или обаиравны 520. 10. Способ получения конъюгата ПЭГ, обладающего большей антипролиферативной активностью и меньшей антивирусной активностью по сравнению с -, заключающийся в ковалентном связывании реагента общей формулы где , ,иимеют значения, определенные в п. 1 с -. 11. Фармацевтическая композиция для лечения и профилактики иммуномодуляторных нарушений, таких как заболевания, относящиеся к опухоли, или инфекционных болезней,содержащая терапевтически эффективное количество конъюгата ПЭГ по любому из пп. 1-9 и терапевтически инертный носитель. 12. Применение конъюгата ПЭГ по любому из пп. 1-9 для изготовления лекарственных средств для лечения и профилактики иммуномодуляторных нарушений, таких как заболевания, относящиеся к опухоли, или инфекционных болезней. 13. Конъюгат ПЭГ по любому из пп. 1-9, полученный способом по п. 11. 14. Конъюгат ПЭГ по любому из пп. 1-9 для изготовления лекарственных средств для лечения и профилактики иммуномодуляторных нарушений, таких как заболевания, относящиеся к опухоли, или инфекционных болезней. 6445 1 Интерферон, в частности, 2 а-интерферон, представляет собой фармацевтически активный протеин, который обладает антивирусной и антипролиферативной активностью. Например, интерферон применяют для лечения лейкемического ретикулеза и саркомы Капоши, и он также проявляет активность в отношении гепатита. Для улучшения стабильности и растворимости и уменьшения иммуногенности фармацевтически активные протеины, такие как интерферон, могут быть конъюгированы с полимером полиэтиленгликолем (ПЭГ). Биологическая доступность терапий с использованием протеинов часто ограничена их коротким периодом полураспада в плазме, что препятствует достижению их максимального лечебного действия. В последние годы было подтверждено, что ПЭГ-конъюгированные биологические молекулы обладают полезными лечебными свойствами ( и др., . .5, 343 (1990)и др.,9, 249 (1992) ,10, 91 (1993. Они обладают лучшей физической стабильностью и теплостойкостью, защищены (нечувствительны) от ферментативного разложения, имеют повышенную растворимость, более продолжительный период полураспада в кровотоке, пониженный клиренс и повышенную эффективность. Были опубликованы данные о том, что разветвленные ПЭГ-конъюгаты обладают более высоким значением рН и теплостойкостью и большей стабильностью по отношению к протеолитическому разложению по сравнению с линейными ПЭГ-конъюгатами( и др.,. 6, 62 (1995. Другими свойствами ПЭГилированных протеинов являются пониженная иммуногенность и антигенность, а также пониженная токсичность. Другим эффектом ПЭГилирования определенных протеинов может быть снижение активности, сопровождаемое увеличением активности. Это было обнаружено, в частности, на - (колониестимулирующий фактор гранулоцитов) (- и др.,17, 157-160 (1992), на -2 (интерлейкин-2)( и др., . . 5, 133 (1994 и на других. Было обнаружено, что в случае интерферона ПЭГилирование снижает антивирусную активность, но увеличивает антипролиферативную активность в отношении клеток опухоли человека. Однако новый ПЭГ-конъюгат интерферона по настоящему изобретению обладает неожиданными свойствами, заключающимися в том, что антипролиферативная активность ПЭГ-интерферона существенно выше не только таковой самого интерферона,но и других ПЭГ-конъюгатов интерферона. Хотя антипролиферативная активность конъюгата существенно увеличена по сравнению с активностью других ПЭГ-конъюгатов интерферона, однако в этом случае наблюдается аналогичное снижение антивирусной активности. Кроме того, ПЭГ-конъюгат -интерферона по настоящему изобретению не обладает иммуногенностью, в результате чего фактически при его введении не образуются антитела. В противоположность этому другие ПЭГ-конъюгаты -интерферона в определенной степени вызывают образование антител. Следовательно, предметом изобретения является новый класс ПЭГ-производных интерферона (-). Конъюгат по настоящему изобретению, как описано ниже, включает ПЭГ, имеющий разветвленное строение. Разветвленный ПЭГ обладает тем преимуществом, что он имеет возможность присоединять две молекулы линейного ПЭГ в одной точке, удваивая таким образом массу присоединенного ПЭГ и не увеличивая количества точек ПЭГилирования. По сравнению с немодифицированным - (т.е. - без присоединенного ПЭГ) конъюгат обладает увеличенным периодом полураспада в кровотоке и временем нахождения в плазме, уменьшенной иммуногенностью, пониженным клиренсом и увеличенной антипролиферативной активностью, что сопровождается пониженной антивирусной ак 3 6445 1 тивностью. Конъюгат по настоящему изобретению по сравнению с другими конъюгатами ПЭГ обладает существенно более высокой антипролиферативной активностью, не связанной пропорциональной зависимостью с усилением или снижением других характеристик, и фактически не обладает иммуногенностью. Физиологически активные виды конъюгата ПЭГ по настоящему изобретению имеют формулу Конъюгат по настоящему изобретению имеет такие же области применения, что и , например в качестве антипролиферативного средства. В частности ПЭГ-конъюгаты-интерферона по настоящему изобретению пригодны для лечения иммуномодуляторных нарушений, таких как заболевания, относящиеся к опухоли, например, лейкемический ретикулез, хронический миелолейкоз (ХМЛ) и саркома Капоши, и инфекционных болезней с помощью такого же способа, который применяют для лечения этих болезней интерфероном (в частности 2-). Однако конъюгат по настоящему изобретению обладает улучшенными свойствами, включающими лучшую стабильность, более высокую растворимость, увеличенный период полураспада в кровотоке и большее время нахождения в плазме. Кроме того, эти конъюгаты обладают антипролиферативной активностью,превосходящей таковую для -. Также было потверждено, что конъюгат проявляет неожиданное разделение антивирусного и антипролиферативного действия. Это свойство дает дополнительное преимущество в том случае, если необходимо усилить определенную активность конъюгата и в то же время уменьшить или устранить нежелательную активность. Например, если нежелательное побочное воздействие связано с антивирусной активностью, то устранение этой активности будет устранять это побочное воздействие,сохраняя при этом антипролиферативную активность. Таким образом, настоящее изобретение также включает фармацевтические композиции на основе соединений формулыили их солей и способы их получения. Фармацевтические композиции по настоящему изобретению, применяемые для лечения или предупреждения заболеваний, включают конъюгат интерферона общей формулыи терапевтически инертный нетоксичный и терапевтически приемлемый носитель. Предназначенные для применения фармацевтические композиции могут быть приготовлены и дозированы в соответствии с принятой медицинской практикой с учетом подлежащего лечению заболевания, состояния конкретного пациента, места доставки конъюгата протеина, способа введения и других факторов, известных специалистам в данной области техники. Конъюгат по настоящему изобретению представляет собой физиологически активный конъюгат ПЭГ, имеющий формулу гдеинезависимо друг от друга обозначают низший алкилобозначаетили О ( обозначает по крайней мере одну из функциональных групп в молекуле -, выбран 4 6445 1 ную из 2 или ОН)ипредставляют собой целые числа, сумма которых составляет от 600 до 1500 и средняя молекулярная масса звеньев полиэтиленгликоля в этом конъюгате составляет от приблизительно 26000 Да до приблизительно 66000 Да. Конъюгат формулыимеет разветвленное строение, в котором два фрагмента ПЭГ присоединены к протеину через простую связь. Числаивыбирают таким образом, чтобы образовавшийся конъюгат формулыобладал физиологической активностью -, причем эта активность может быть такой же, более высокой или представлять собой часть соответствующей активности немодифицированного -. Числаи(причемимогут быть одинаковыми или разными) обозначают количество звеньев этиленгликоля в ПЭГ. Одно звено ПЭГ, ОСН 2 СН 2, имеет молекулярную массу приблизительно 44 Да. Молекулярная масса конъюгата (за исключением молекулярной массы -) зависит от чисели . Суммаидля конъюгата формулысоставляет от 600 до 1500, что приводит к получению конъюгата, имеющего общую среднюю молекулярную массу звеньев ПЭГ от приблизительно 26000 до 66000 Да и предпочтительно от приблизительно 35000 до 45000 Да, в частности от приблизительно 39000 до 40000 Да, причем особенно предпочтительна молекулярная масса 40000 Да. Предпочтительная суммаисоставляет от приблизительно 800 до 1200, причем средняя сумма составляет от приблизительно 850 до 1000, а предпочтительной суммой является приблизительно 910. Каждое из чиселипо отдельности может быть равно 420 или 520, или оба могут быть равны 420 или 520, или оба могут быть равны 455. Предпочтительное отношениекможет составлять от приблизительно 0,5 до 1,5, причем наиболее предпочтительное отношение составляет от приблизительно 0,8 до приблизительно 1,2. Понятие приблизительно в отношении некоторого значения молекулярной массы означает, что она находится в статистически приемлемой области этого значения, определяемого стандартными аналитическими методами. Также предпочтительным является конъюгат формулы , в котором - представляет собой 2-, конъюгат, в которомиобозначают метил, конъюгат, в которомобозначает , и конъюгат, в которомикаждый или оба вместе равны либо 420, либо 520. Такой конъюгат, обладающий всеми вышеуказанными характеристиками, является особенно предпочтительным.имогут обозначать любой низший алкил, представляющий собой алкильную группу, имеющую от 1 до 6 атомов углерода, такой, как метил, этил, изопропил и т.д. Эта группа также включает разветвленные алкилы. Предпочтительным алкилом является метил. В двух группах ПЭГ формулыимогут быть одинаковыми или различными. Под - (-интерферон) и его разновидностями 2- понимают природный или рекомбинантный протеин, предпочтительно человеческий, получаемый из любого обычного источника, такого, как ткани, путем химического синтеза протеина из культуры клеток с использованием нативных и рекомбинантных клеток. Под объем настоящего изобретения подпадает любой протеин, обладающий активностью -, в том числе мутеины или модифицированные каким-либо другим образом протеины. Методика получения и выделения - из природных или рекомбинантых источников хорошо известна(, . . . 221, 1 (1983. Предпочтительным -, как указано выше, является 2-, получаемый известными способами (, . . 249, 36 (1983) Европейский патент 43980. Физиологически активный конъюгат формулыобладает активностью -, под которой понимают любую частичную или усиленную известную активность -, определяемую различными способами, известными в данной области техники. В частности конъюгаты по настоящему изобретению обладают активностью -, а именно, как установлено, антипролиферативным действием в отношении клеток опухоли и антивирусной активностью в отношении клеток, зараженных вирусом. Эти виды активности являются 5 6445 1 известными активностями, свойственными -. Такая активность конъюгата может быть определена способами, хорошо известными в данной области техники, например,описанными ниже способами (см. также уи др., . . 37, 755 (1981)и др., Са. . 42, 4948 (1982. Одним из предметов настоящего изобретения является конъюгат формулы , обладающий более высокой антипролиферативной активностью и меньшей антивирусной активностью по сравнению с немодифицированным -. Конъюгат формулыполучают путем ковалентного связывания - с ПЭГ, который может быть активирован замещением гидроксильной группы ПЭГ на связывающую группу с образованием реагента, представляющего собой производное ПЭГ в виде гидроксисукцинимидного эфира (в частности монометокси-ПЭГ) формулы . Реагент может быть получен традиционными методами ( и др., см. выше). Связывание происходит через амидную или эфирную связь. В предпочтительном конъюгате связывание происходит через амидную связь ( обозначает ). Одним из предметов настоящего изобретения является способ усиления антипролиферативной активности - при одновременном снижении антивирусной активности - путем связывания -, как описано выше, с реагентом формулыс получением конъюгата ПЭГ-.обозначает место присоединения на -, посредством которого ПЭГ-реагент формулыковалентно связывается с -. Реагенты присоединяются к первичным аминогруппам (ХН 2), например лизина, или к -концам -. Реагенты также могут быть присоединены к гидроксилу (ХНОН), например, серина. Реагент формулы(ПЭГ 2-), в котором в целом две цепи монометокси-ПЭГ (мПЭГ) связаны с лизином, каждая с - и -аминогруппами, через карбаматные (уретановые) связи и который содержит карбоксильную группу лизина, активированную до сукцинимидилового эфира, может быть получен обычными методами в соответствии с известными способами ( и др., см. выше), применимыми к реагенту, в которомобозначает низший алкил и с требуемым значением . Такой реагент поставляется, например, фирмой, . (Хантсвилл, шт. Алабама). Предпочтительная средняя молекулярная масса получаемого ПЭГ составляет приблизительно 20000 Да, что обеспечивает общую массу ПЭГ в ПЭГ 2- приблизительно 40000 Да (полимеры с другими молекулярными массами могут быть получены традиционными методами путем изменения значенияв исходных материалах для реагента формулы , представляющих собой спиртовой ПЭГ). Реагент формулыможет быть конъюгирован с - традиционными способами. В частности реагент формулысначала подвергают взаимодействию с одной или несколь 6 6445 1 кими первичными аминогруппами (например, с -концевыми группами или с боковыми цепями лизина) - (например, 2-) для образования амидной связи между - и полимерной основой ПЭГ. Реакция ПЭГилирования также может происходить между ПЭГ 2- и свободными (если они присутствуют) гидроксильными группами (например,серина) - с образованием сложноэфирной связи. Механизм реакции приведен выше. Условия реакции являются обычными для специалистов в данной области техники и более подробно приведены ниже. ПЭГ-реагент объединяют с - в среднещелочных условиях при низкой температуре и в условиях, пригодных для нуклеофильного замещения, что приводит к получению конъюгата формулы . Это также показано выше на схеме реакции. Присоединение реагентов к - может быть осуществлено традиционными методами. Могут быть использованы ПЭГ по настоящему изобретению с любыми выбранными молекулярными массами. Условия реакции могут быть выбраны таким образом, чтобы обеспечить получение конъюгата по изобретению с одним присоединенным реагентом. Конъюгат формулы , к которому присоединен один реагент формулы , отделяют от немодифицированного - и от конъюгатов, имеющих более одной присоединенной молекулы реагента, традиционными способами. Для разделения конъюгатов на основе различия в зарядах могут применяться методы очистки, такие как катионообменная хроматография, которая позволяет эффективно разделять конъюгаты на основе их различных молекулярных масс. Содержание фракций, получаемых в результате катионообменной хроматографии, может быть определено по молекулярной массе с использованием принятых способов, например, с помощью массспектроскопии, электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (ПААГ-ДСН) или других известных методов, применяемых для разделения молекулярных энантиомеров по молекулярной массе. Затем соответственно определяют фракцию, которая содержит конъюгат формулы , очищенный от немодифицированного и от конъюгатов, имеющих более одного присоединенного реагента. Кроме того, реагенты формулыпри кислотном гидролизе высвобождают по одной молекуле лизина на молекулу реагента, так что количество молекул лизина при гидролизе показывает количество групп ПЭГ, присоединенных к протеину, и таким образом может быть подтверждено количество молекул реагента, присоединенных к конъюгату. Ниже изобретение проиллюстрировано на примерах, которые не ограничивают его объем. В этих примерах использован 2-. Другие виды - также могут быть конъюгированы с ПЭГ способами, приведенными в примерах. Описание чертежей Фиг. 1 Противоопухолевая активность ПЭГ 2-2 а-, изученная на лишенных шерсти мышах, которым подкожно имплантировали почечные клетки человека линии А 498. Всем животным за 33 дня до начала эксперимента (день - 33) подкожно вводили имплантат, содержащий 2106 почечных клеток человека линии А 498. Обработку с помощью ПЭГ 2-2 а- начинали в день 0 эксперимента. Указанные количества (30, 60, 120 или 300 мкг) ПЭГ 2-2 а- вводили подкожно в противоположный относительно опухоли бок, 1 раз в неделю в течение 4-недельного периода. Фиг. 2 Противоопухолевая активность 2-, изученная на лишенных шерсти мышах, которым подкожно имплантировали почечные клетки человека линии А 498. Всем животным за 33 дня до начала эксперимента (день - 33) подкожно вводили имплантат, содержащий 2106 почечных клеток человека линии А 498. Обработку с помощью 2 начинали в день 0 эксперимента. Указанные количества (10, 20, 40 или 100 мкг) 2 вводили подкожно в противоположный относительно опухоли бок, 3 раза в неделю в течение 4-недельного периода. Фиг. 3 Противоопухолевая активность ПЭГ 2-2 а-, изученная на лишенных шерсти мышах, которым подкожно имплантировали почечные клетки человека линии . 7 6445 1 Всем животным за 25 дней до начала эксперимента (день - 25) подкожно вводили имплантат, содержащий 2106 почечных клеток человека линии . Обработку с помощью ПЭГ 2-2 а- начинали в день 0 эксперимента. Указанные количества (30, 60, 120 или 300 мкг) ПЭГ 2-2- вводили подкожно в противоположный относительно опухоли бок, 1 раз в неделю в течение 5-недельного периода. Фиг. 4 Противоопухолевая активность 2-, изученная на лишенных шерсти мышах, которым подкожно имплантировали почечные клетки человека линии . Всем животным за 25 дней до начала эксперимента (день - 25) подкожно вводили имплантат,содержащий 2106 почечных клеток человека линии . Обработку с помощью 2 начинали в день 0 эксперимента. Указанные количества (10, 20, 40 или 100 мкг) 2 вводили подкожно в противоположный относительно опухоли бок, 3 раза в неделю в течение 5-недельного периода. Фиг. 5 Противоопухолевая активность ПЭГ 2-2 а-, изученная на лишенных шерсти мышах, которым подкожно имплантировали почечные клетки человека линии 402. Всем животным за 45 дней до начала эксперимента (день - 45) подкожно вводили имплантат, содержащий 2106 почечных клеток человека линии 402. Обработку с помощью ПЭГ 2-2- начинали в день 0 эксперимента. Указанные количества (30, 60, 120 или 300 мкг) ПЭГ 2-2 а- вводили подкожно в противоположный относительно опухоли бок, 1 раз в неделю в течение 5-недельного периода. Фиг. 6 Противоопухолевая активность 2-, изученная на лишенных шерсти мышах, которым подкожно имплантировали почечные клетки человека линии 402. Всем животным за 45 дней до качала эксперимента (день - 45) подкожно вводили имплантат,содержащий 2106 почечных клеток человека линии 402. Обработку с помощью 2 начинали в день 0 эксперимента. Указанные количества (10, 20, 40 или 100 мкг) 2 вводили подкожно в противоположный относительно опухоли бок, 3 раза в неделю в течение 5-недельного периода. Пример 1. Получение конъюгата формулыМатериалы 2-Интерферон получали известными способами (, см. выше). Полиэтиленгликолевый (ПЭГ) реагент формулыбыл приобретен у фирмы, .(Хантсвилл, шт. Алабама). СмолаСМ 650 с размером частиц 25-40 мкм поставляется фирмой ЕМ(Гиббстаун, МА). Концентрированный (10 Х) забуференный фосфатом физиологический раствор (ЗФР), рН 7,3, был приобретен у фирмы(Уолкерсвилл, ). Наборы гелей для электрофореза в полиакриламидном геле в присутствии додецил-(лаурил)-сульфата натрия (ПААГ-ДСН) и приборы для электрофореза были приобретены у фирмы(Сан Диего, шт. Калифорния). Концентрированный красительдля окрашивания протеина ПЭГ-конъюгатов при электрофорезе в ПААГ-ДСН был приобретен у фирмы, . (Ньютон, МА). Набор для определения эндотоксина в тесте с использованием лизата амебоцитов (тест) был приобретен у фирмы, . (Вудс Хол, МА). Все другие применяемые реагенты были наиболее высокого доступного качества. Крысы с канюлями,имплантированными в яремную вену, и мыши линии -1 были приобретены у фирмы(Вилмингтон, МА). Методика эксперимента А. Маломасштабное получение конъюгата формулы 208 мг (5,2 мкмоля) реагента формулы(средняя молекулярная масса 40000 Да) добавляли к 50 мг (2,6 мкмоля) - в 10 мл 100 мМ боратного буфера, рН 8,0. Конечное молярное соотношение протеинреагент составляло 12. Реакционную смесь перемешивали при 4 С в течение 2 часов. Реакцию прекращали путем доведения рН до 4,5 с помощью ледяной уксусной кислоты. 8 6445 1 Реакционную смесь 50-кратно разбавляли водой, фильтровали через фильтр с размером пор 0,2 мкм и вносили в колонку типа , заполненную 100 мл (3,213 см) смолыСМ 650 при скорости потока 20 мл/мин. Колонку предварительно уравновешивали с помощью 10 мМ ацетата аммония, рН 4,5. Выходящий из колонки продукт анализировали с помощью УФ-абсорбции при 280 нм. Затем колонку промывали уравновешивающим буфером до тех пор, пока УФ-абсорбция не возвращалась к базовому уровню. Конъюгаты ПЭГ-, имеющие более одного присоединенного реагента формулы(олигомеры ПЭГ-), элюировали с помощью 40 мМ ацетата аммония, рН 4,5, а конъюгат формулыэлюировали с помощью 0,12 Мв 40 мМ аммоний-ацетатном буфере. Оставшийся на колонке немодифицированныйэлюировали с помощью 0,5 Мв таком же буфере. Колонку регенерировали, промывая 1,0 М , с последующей промывкой уравновешивающим буфером. Объединенные фракции конъюгатов формулыконцентрировали с использованием вакуумного фильтра для перемешанных клеток типа, снабженного мембраной типа 10, до концентрации приблизительно 1 мг/мл. Примененная для очистки катионообменная смола 650 эффективно адсорбировала ПЭГ и немодифицированный . Интенсивность адсорбции зависела от степени ПЭГилирования. Конъюгаты связывались менее сильно по сравнению с немодифицированным . Олигомеры ПЭГ- элюировали с помощью 40 мМ ацетата аммония, в то время как конъюгат формулыэлюировали с помощью 0,12 М . Немодифицированныйэлюировали с помощью 0,5 М . Все препараты содержали 5 ЭЕ (эндотоксиновых единиц) / мг эндотоксинов. Образовавшийся препарат содержал 99 конъюгата формулыи был лишен немодифицированного . Б. Крупномасштабное получение конъюгата формулы 6240 мг (156 мкмолей) реагента формулы(средняя молекулярная масса 40000 Да) растворяли при 4 С в 63 мл 1 мМ НС и быстро добавляли к 125 мл раствора, содержащего 1000 мг (52 мкмоля) интерферона в 50 мМ боратном буфере, рН 9,0. Конечное отношение протеин/реагент составляло 13, а конечная концентрация протеина в реакционной смеси была равна 5,3 мг/мл. Реакционную смесь перемешивали при 4 С в течение 2 часов. Реакцию прекращали путем доведения рН до 4,5 с помощью ледяной уксусной кислоты. Реакционную смесь 10-кратно разбавляли водой и наносили на колонку, заполненную 600 мл смолыСМ 650 (М) и предварительно уравновешенную 20 мМ натрий-ацетатным буфером, рН 4,5, при линейной скорости 1,3 см/мин. Колонку промывали уравовешивающим буфером, а затем 10 мМдля удаления избытка реагента, побочных продуктов реакции и олигомеров ПЭГ-. Конъюгат формулыэлюировали с помощью уравновешивающего буфера, содержащего 200 мМ . Немодифицированный интерферон, еще сохранившийся на колонке, удаляли, промывая 0,75 Мв уравновешивающем буфере. Конъюгат формулы , который элюировали при концентрации 0,3-0,5 мг/мл, затем концентрировали и для окончательного приготовления лекарственного средства фильтровали путем диализа в 20 мМ натрийацетатном буфере, рН 5,0, содержащем 150 мМ . Общий выход конъюгата формулысоставлял 40-45 . Очищенный ПЭГ- из препарата при крупномасшабном способе получения состоит более чем на 99 из конъюгата формулы . Средняя молекулярная масса конъюгата формулыиз этого примера составляет 62000 Да, включая молекулярную массу 2-, которая равна 19241 Да, и среднюю молекулярную массу реагента, которая находится в интервале между 40000 Да и 45000 Да, составляя приблизительно 43000 Да. Пример 2. Характеристика конъюгата формулыОпределение протеина Концентрации протеина определяли, используя значение А 280, равное 1, для раствора с концентрацией 2- 1 мг/мл. 9 6445 1 Анализ с использованием ПААГ-ДСН Конъюгат анализировали с помощью электрофореза в полиакриламидном геле (816 ) в присутствии додецил-(лаурил-)сульфата натрия в восстановительных условиях в соответствии с методами( 227, 680 (1970) ). ПААГ-ДСН-гели, содержащие ПЭГ-конъюгаты, окрашивали для определения протеина, используя краситель(фирма, .), в соответствии с инструкциями производителя. Определение уровней эндотоксина Уровни эндотоксина определяли, используя -тест в соответствии с инструкциями производителя. Все препараты содержали 5 ЭЕ/мг эндотоксинов. Пример 3. Биологические активностиконъюгата формулыАнтивирусная активность в бычьих почечных клетках Антивирусную активность 2- и конъюгата формулы , полученного по описанной в примере 1.А методике, определяли с помощью биологического анализа культуры клеток, используя бычьи почечные клетки линии - , зараженные вирусом везикулярного стоматита ( и др., см. выше). Показатели антивирусных активностей приведены в таблице 1 наряду с соответствующими остаточными активностями в процентах по отношению к исходному . Таблица 1 Показатели антивирусных активностей Образцы 2 Конъюгат формулы Антипролиферативная активностьна клетках опухоли человека Антипролиферативную активностьопределяли на человеческих клетках линии(лимфома Беркитта), как описано уи др. Человеческие клетки линииподдерживали в виде стационарных суспензионных культур в среде 1540, дополненной 10 -ной фетальной бычьей сывороткой и 2 мМ глутамином (, Гранд Исланд, шт. Нью-Йорк). Клетки подвергали скринингу и было обнаружено,что они лишены микоплазмы. Клетки (2104) добавляли в лунки планшетов для микротитрования (, ) с 100 мкл среды. Различные концентрациии конъюгата формулы , полученного по описанной в примере 1.А методике, добавляли в лунки объемом 100 мкл. Планшеты инкубировали при 37 С в 5 С 2 в течение 72 часов. За 16 часов до сбора клеток их обрабатывали 3 Н-тимидином (, Бостон, ) в дозе 0,25 мкКи/лунку. Клетки собирали на стеклянные фильтры и измеряли радиоактивность с использованием жидкостного сцинтилляционного счетчика. Результаты выражали в видеингибирования, вычисляемого по формулеингибирования(А-В) / А 100,где А обозначает количество импульсов в минуту в контрольной культуре (клетки, инкубированные в чистой среде) В обозначает количество импульсов в минуту в экспериментальной культуре. Опыты проводили в четырех повторностях, а стандартное отклонение во всех случаях составляло менее 20 от среднего значения. Эксперименты повторяли по крайней мере дважды, получая сопоставимые результаты. 6445 1 Антипролиферативные активности (50)и конъюгата формулыприведены в таблице 2. Данные показывают, что существует 28-кратное увеличение антипролиферативной активности конъюгата формулыпо сравнению с таковой у . Таблица 2 Антипролиферативная активностьв отношении клеток линиичеловека (лимфомы Беркитта) Образец 2 Конъюгат формулы Пример 4. Фармакокинетика Самок крыс линиисо средней массой тела 240-260 г, которым хирургическим путем имплантировали канюли в яремные вены, размещали каждую по отдельности, обеспечивая свободный доступ к пище и воде, и содержали при 12-часовом светотемновом цикле. Через 4-6 часов после введения канюли, находящиеся в яремных венах,заливали ЗФР. На следующий день после введения в канюли 0,15-0,2 мл ЗФР крысам инъецировали 2106 единиц - в 0,2-0,4 мл ЗФР, а затем вновь инъецировали 0,15-0,2 мл ЗФР, чтобы гарантированно обеспечить поступление всего количества лекарства в организм животного. Таким образом, каждое животное получало дозу 8106 единиц -/кг массы тела. Через 5, 15 и 30 минут, а также через 1, 3, 5, 12 и 24 часа после инъекциии конъюгата формулыотбирали образцы крови. После отбрасывания первой порции крови объемом 0,15-0,2 мл через яремную канюлю каждый раз отбирали аликвоту крови объемом 0,5 мл, используя новый шприц. При комнатной температуре образцы помещали в пробирки для отделения сыворотки. Сразу после того, как все образцы в рассматриваемый момент времени были собраны, пробирки центрифугировали при 14000 в течение 10 минут в центрифуге Эппендорфа с охлаждением. Отделенную сыворотку переносили в микроцентрифужные пробирки объемом 1,5 мл и замораживали при -80 С до проведения биологического анализа. Образцы сыворотки соответствующим образом разбавляли и для каждого момента времени определяли антивирусную активность, как описано ранее. Из графика зависимости активности от времени определяли окончательный период полураспада конъюгата формулыи -, эти данные приведены в таблице 3, в которой также указано время его нахождения в плазме. Таблица 3 Окончательные периоды полураспада (1/2) и среднее время нахождения в плазме Образец 2 Конъюгат формулы Окончательный период 1/2 определяли методом линейной регрессии в логарифмическом масштабе. Пример 5. Иммуногенность Нормальным мышам линии -1 (десять особей в группе) внутрибрюшинно инъецировали один раз в день пять раз в неделю различные препараты интерферона, содержащие 300000 единиц антивирусной активности. Некоторым мышам также инъецировали составную форму 2-, которая является более иммуногенной, чем мономерная фор 11 6445 1 ма. Образцы крови брали на 19 день после последней инъекции и анализировали сыворотку на наличие нейтрализующих антител. Как видно из таблицы 4, мыши, которым инъецировали 2-, вырабатывали нейтрализующие антитела, и эта реакция была сильно увеличена у мышей, которым инъецировали составные формы интерферона. У большинства животных, которым инъецировали конъюгат по настоящему изобретению, не было обнаружено антител. Таблица 4 Иммуногенность Обработка 2-. Составные формы 2 Конъюгат формулы Антитело (ИНЕ/мл) Среднее значение Диапазон 2400 217-8533 42667 8000-768000 0 0-1133 Пример 6. Противоопухолевая активностьПротивоопухолевую активностьконъюгата формулы(ПЭГ 2-2-) и немодифицированного 2- оценивали путем определения их способности уменьшать размер различных человеческих клеток опухоли, подкожно имплантированных мышам. Результаты показаны на фиг. 1-6. Методика Лишенным шерсти мышам (линии ), у которых отсутствовала вилочковая железа, подкожно вводили в заднюю часть левого бока имплантат, содержащий 2106 почечных клеток человека линии А 498 (фиг. 1 и 2), почечных клеток человека линии(фиг. 3 и 4) или почечных клеток человека линии 402 (фиг. 5 и 6). В течение 3-6 недель опухолям давали оформиться, как указано далее. Критерий размера, приемлемого для исследования, составлял от 0,05 до 0,5 см 3. Мышам вводили совокупные ежедневные дозы ПЭГ 2-2 а- или немодифицированного 2-, составляющие 30, 60,120 или 300 мкг. В случае ПЭГ 2-2 а- мышей обрабатывали один раз в неделю (в понедельник), используя по 30, 60, 120 или 300 мкг ПЭГ 2-2 а- на обработку. В случае немодифицированного 2 а- мышей обрабатывали три раза в неделю (в понедельник,среду и пятницу), используя по 10, 20, 40 или 100 мкг 2- на обработку. Продолжительность обработки составляла 4-5 недель в зависимости от интенсивности роста (агрессивности) опухоли. Объемы опухоли измеряли каждый понедельник до обработок. Результаты ПЭГ 2-2 а- привел к заметному уменьшению размера опухоли, вызванной клетками А 498, по сравнению с немодифицированным 2- при всех исследованных уровнях еженедельных доз на 7 день, 14 день, 21 день и 28 день после начала обработки (фиг. 1 и 2). Обработку продолжали в течение 4 недель. Через семь дней после прекращения обработки трех мышей в каждой группе умервщляли. У трех мышей, подвергавшихся обработке ПЭГ 2-2 а-, не обнаружили остатков опухоли. У мышей, подвергавшихся обработке немодифицированным 2-, масса опухоли, вызванной клетками А 498, составила 1,28 г, 0,62 г и 1,60 г соответственно у каждой из трех мышей. Масса опухоли, вызванной клетками А 498, составила 2,32 г, 2,37 г и 1,94 г у каждой из трех мышей в контроле. На 80 день после окончания четырехнедельного периода обработки наличие опухоли определяли пальпацией семи мышей. При пальпации у всех семи мышей не обнаружили наличия опухолевой ткани. ПЭГ 2-2 а- привел к значительному уменьшению размера опухоли, вызванной клетками , по сравнению с немодифицированным 2- при уровнях еженедельных доз 60, 120 и 300 мкг на 14 день, 21 день, 28 день и 35 день (фиг. 3 и 4). 12 6445 1 ПЭГ 2-2 а- привел к значительному уменьшению размера опухоли, вызванной клетками 402, по сравнению с немодифицированным 2- при уровнях еженедельных доз 60 и 120 мкг на 14 день, 21 день, 28 день и 35 день (фиг. 5 и 6). Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: A61K 31/745, A61K 38/21, A61P 31/12
Метки: основе, пэг-(-ifn, конъюгат, способ, композиции, фармацевтические, активный, получения, физиологически
Код ссылки
<a href="https://by.patents.su/13-6445-fiziologicheski-aktivnyjj-konyugat-peg-ifn-sposob-ego-polucheniya-farmacevticheskie-kompozicii-na-ego-osnove.html" rel="bookmark" title="База патентов Беларуси">Физиологически активный конъюгат ПЭГ-(-IFN, способ его получения, фармацевтические композиции на его основе</a>
Предыдущий патент: Олигонуклеотидный конъюгат, способ обнаружения структуры-мишени, способ неинвазивной диагностики заболеваний и диагностический набор
Следующий патент: Свариваемое испаряемое газоулавливающее устройство, имеющее высокий выход бария
Случайный патент: Приспособление для наващивания рамок