Пептид, связывающий иммуноглобулин Е
Номер патента: 11361
Опубликовано: 30.12.2008
Авторы: Янченко Владимир Вилиянинович, Мельник Ольга Викторовна, Осененко Елена Ивановна, Мартинович Вера Павловна, Янченко Лилия Кирилловна, Голубович Владимир Петрович, Янченко Андрей Вилиянинович, Новиков Павел Дмитриевич, Новиков Дмитрий Кузьмич
Текст
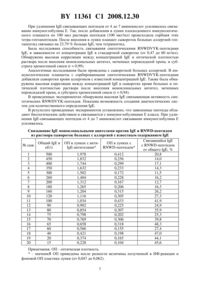
(51) МПК (2006) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ(71) Заявители Янченко Владимир Вилиянинович Новиков Павел Дмитриевич Новиков Дмитрий Кузьмич Мартинович Вера Павловна Голубович Владимир Петрович Мельник Ольга Викторовна Янченко Лилия Кирилловна Янченко Андрей Вилиянинович Осененко Елена Ивановна(72) Авторы Янченко Владимир Вилиянинович Новиков Павел Дмитриевич Новиков Дмитрий Кузьмич Мартинович Вера Павловна Голубович Владимир Петрович Мельник Ольга Викторовна Янченко Лилия Кирилловна Янченко Андрей Вилиянинович Осененко Елена Ивановна(73) Патентообладатели Янченко Владимир Вилиянинович Новиков Павел Дмитриевич Новиков Дмитрий Кузьмич Мартинович Вера Павловна Голубович Владимир Петрович Мельник Ольга Викторовна Янченко Лилия Кирилловна Янченко Андрей Вилиянинович Осененко Елена Ивановна(57) Пептид, выбранный из , ,и , имеющий последовательность аминокислотных остатков, соответствующую активному домену высокоаффинного рецепторадля иммуноглобулина Е, способный специфично связывать иммуноглобулин . Изобретение относится к медицине, в частности к аллергологии и иммунологии, и может быть использовано для диагностики, лечения и профилактики иммунопатологии. Иммуноглобулины Е- важные биологические молекулы-антитела, синтезируемые плазматическими клетками под влиянием аллергенов. Антителаучаствуют в развитии ряда аллергических заболеваний. Создание веществ, способных связывать ,позволяет проводить диагностику, лечение и профилактику -зависимых болезней. В настоящее время для связывания иммуноглобулина Е используют моноклональные или поликлональные антивидовые антитела 1-9. Учитывая рост числа аллергических заболеваний во всех развитых странах и отсутствие в Республике Беларусь патентованных технологий производства каких-либо моноклональных антител, целью изобретения является создание новых биологически активных пептидов, способных эффективно связывать . Нами был избран следующий подход для решения проблемы связывания . На поверхности тучных клеток и базофилов присутствуют высокоаффинные рецепторы для. Выявив и синтезировав фрагменты активного домена , можно получить пептиды, связывающие . Используя компьютерную программу Биоскан 9.0 ОДО НИКП Ресан, Витебск, Беларусь базу данных Национального центра биотехнологической информации США базу данных известных структур протеинов и нуклеиновых кислот Великобритании- файл 16 (авторы , , , , ), был произведен анализ С 3- и С 4-фрагмента иммуноглобулина Е (34-) и высокоаффинного рецептора иммуноглобулина Е . По результатам анализа был выбран пептидный фрагмент , принимающий участие в лиганд-рецепторном взаимодействии сучастком-(использовано однобуквенное международное обозначение аминокислот). Сравнительный анализ аминокислотной последовательностис 923 другими белками показал, что последовательность активной части(аминокислоты 111-117) уникальна и не встречалась в 923 проанализированных белках длиной от 54 до 4563 аминокислотных остатков. Учитывая эту особенность, можно получить 4 варианта пептидов, способных высокоспецифично связывать . Задачей данного изобретения является получение пептидов, входящих в активный домен высокоаффинного рецепторадля иммуноглобулина Е (последовательность 111117), которые способны высокоспецифично связывать-гептапептид. Прототипами предлагаемых нами пептидов были пентапептид ,являющийся активной частью тимопоэтина - гормона вилочковой железы 10-12, и моноклональные антитела против иммуноглобулина Е -13. Сопоставительный анализ предлагаемыхсвязывающих пептидов с прототипами показал, что заявляемыесвязывающие пептиды существенно отличаются от известных прототипов. Предлагаемыесвязывающие пептиды являются новыми, потому что их состав и структура неизвестны из существующего уровня техники. Возможность использования изобретения подтверждена приводимыми ниже сведениями, относящимися к составу, способу получения и результатам экспериментальной проверки. Пептиды получали с использованием классических методов пептидного синтеза. При получении тетрапептидаиспользовали тактику минимальной защиты боковых функциональных групп, при синтезе гексапептидабоковые функциональные группы блокировали водородолабильными защитами. Основным методом образования пептидной связи был выбран карбодиимидный, в качестве противорацемической добавки использовали 1-оксибензотриазол. Для блокирования -аминогрупп использовали трет.бутилоксикарбонильную защиту. Ее отщепление проводили обработкой пептидов 3,5-5,0 н раствором НС в этилацетате. Карбоксильные группы блокировали путем образования метиловых эфиров, для их удаления использовали щелочной гидролиз. Водородолабильные группы удаляли гидрированием пептида над катализатором - палладиевой чернью, в растворе уксусной кислоты. Чистота и структура созданных пептидов подтверждены методами масс-спектрометрии, аминокислотного анализа, ВЭЖХ, ТСХ. Масс-спектры целевых пептидов получили на масс-спектрометре РЕ 1 150 ( , США) с использованиемисточника ионов. Аналитическую ВЭЖХ созданных соединений провели на хроматографе фирмы(32,966 фотодиодный детектор, колонка 2015218 (2,1250 мм. Используемый градиент концентраций от 10 до 40 ацетонитрила в воде с добавлением 0,1. Скорость потока 1 мл/мин. 2 11361 1 2008.12.30 Хроматографические подвижности приведены в системах(Д) - хлороформ/метанол/20 -ный аммиак/уксусная кислота, 6045153. Удельное вращение определяли на спектрополяриметре -20 (, Япония). Температуры плавления определяли на приборе Кофлера (приведены без коррекции). Получение пептидов описано в следующих примерах. Получение -тетрапептида (дигидрохлорида аргинил-аспарагинил-триптофиласпарагиновой кислоты) а) Получение -трет.бутилоксикарбонил-триптофил-аспарагиновой кислоты диметилового эфира . К раствору 0,86 г (3,7 ммоль) гидрохлорида диметилового эфира аспарагиновой кислоты в 3,5 мл диметилформамида (ДМФ) прибавили 1,0 мл триэтиламина (7,0 ммоль). Реакционную смесь перемешивали в течение 20 мин и затем внесли 0,97 г (3,2 ммоль) трет.бутилоксикарбонил-триптофана. После охлаждения до 0 С в реакционный сосуд прибавили последовательно 0,46 г (3,4 ммоль) гидроксибензатриазола (НОВТ) и 0,78 г(3,8 ммоль) дициклогексилкарбодиимида (ДЦГК). Реакционную смесь перемешивали в течение 2 час при 0 С и 4 час при комнатной температуре. После окончания реакции осадок дициклогексилмочевины (ДЦГМ) отфильтровали, промыли на фильтре 1 мл ДМФ. В фильтрат добавили 10 мл этилацетата и полученный раствор промыли 9 -ным раствором лимонной кислоты, 5 -ным раствором 3, насыщенным раствором натрия хлорида, водой, сушили над 24. После сушки этилацетат упарили, а образовавшийся маслообразный остаток переосадили из эфира гексаном и сушили над Р 2 О 5. Получили 1,07 г(выход 76 ) соединения , 204,0 (С 1, МеОН) Температура плавления (Т.пл.) 5557 С 0,36 (Б), 0,97 (В). б) Получение -трет.бутилоксикарбонил-аспаргинил-триптофил-аспарагиновой кислоты диметилового эфира . К раствору 0,64 г (1,6 ммоль) -2 (получен обработкой соединенияНС в этилацетате) в 2,5 мл ДМФ прибавили 0,29 мл триэтиламина (2,1 ммоль). Реакционную смесь перемешивали в течение 20 мин и внесли 0,35 г (1,5 ммоль) трет.бутилоксикарбонил-аспарагина. После охлаждения до 0 С в реакционный сосуд прибавили последовательно 0,22 г (1,6 ммоль) НОВТ и 0,37 г (2,1 ммоль) ДЦГК. Время прохождения реакции - 6 час. Обработку синтеза проводили по методике, описанной для соединения . Выход соединения- 0,68 г (выход 81 ), Т. пл. 79-82 С 20 - 46,8 (С 1, МеОН)0,95 (В), 0,33 (Б). в) Получение -трет.бутилоксикарбонил-аргинил-аспаргинил-триптофил-аспарагиновой кислоты диметилового эфира . К раствору 0,39 г (0,8 ммоль) 2 (получен обработкой соединенияНС в этилацетате) в 2,0 мл ДМФ добавили 0,19 г (0,7 ммоль) трет.бутилоксикарбонил-аргинина и перемешивали полученный раствор в течение 30 мин. Охладив реакционную колбу до 0 С, в реакционный сосуд внесли последовательно 0,09 г(0,7 ммоль) НОВТ и 0,19 г (0,9 ммоль) ДЦГК. После окончания реакции осадок ДЦГМ отфильтровали, а к фильтрату добавили 10 мл безводного эфира. Полученное масло переосадили из метанола эфиром и сушили в эксикаторе над 25. Получили 0,43 г (выход 81 ) соединения , 20 - 28,0 (С 1, МеОН) Т. пл. 100-104 С 0,58 (А), 0,71 (В). г) Получение -трет.бутилоксикарбонил-аргинил-аспаргинил-триптофил-аспарагиновой кислоты . К раствору 0,36 г (0,5 ммоль) соединенияв 6,2 мл метанола добавили 0,6 мл 2 ни перемешивали полученный раствор в течение часа. После окончания гидролиза реакционную смесь нейтрализовали до рН 2-3 3,3 н раствором НС в уксусной кислоте,3 11361 1 2008.12.30 растворитель упарили в вакууме досуха, а к образовавшемуся остатку добавили 2,0 мл ДМФ. Нерастворившийся осадок натрия хлорида отфильтровали, к фильтрату прилили 6,0 мл безводного эфира. После переосаждения из метанола эфиром и сушки в эксикаторе над 25 получили 0,32 г (выход 89 ) соединения , 20 - 18,0 (С 1, МеОН)0,47 (Г), 0,27 (В). д) Получение тетрапептида 2 . К 0,30 г (0,4 ммоль) соединенияприбавили 2,1 мл 3,3 н раствора НС в уксусной кислоте. Реакционную смесь перемешивали около часа, затем растворитель упарили, а остаток дважды промыли эфиром, сушили в эксикаторе над . Получили 0,27 г (выход 96 ) соединенияТ. пл. 128-131 С 20 - 5 (С 1, Н 2 О)0,81 (Д), 0,20 (В). Масс-спектр/ 590,3 МН, 612,3 . По данным ВЭЖХ содержание целевого пептида - 92 . Получение -гептапептида (дигидрохлорида аргинил-аспарагинил-триптофил-аспарагил-валил-тирозил-лизина метилового эфира). а) Получение -трет.бутилоксикарбонил-тирозил-(-бензилоксикарбонил)лизина метилового эфира . К раствору 0,79 г (2,4 ммоль) гидрохлорида метилового эфира -бензилоксикарбонил-лизина 5 мл ДМФ прибавили 0,28 мл -метилморфолина (2,5 ммоль). Реакционную смесь перемешивали в течение 20 мин, затем прибавили 0,68 г (2,4 ммоль) трет.бутилоксикарбонил-тирозина. После охлаждения до 0 С в реакционный сосуд внесли последовательно 0,27 г (2,4 ммоль) НОВТ и 0,53 г (2,5 ммоль) ДЦГК. Реакционную смесь перемешивали в течение 2 час при 0 С и 5 час при комнатной температуре. После окончания реакции осадок ДЦГМ отфильтровали, промыли на фильтре 1 мл ДМФ. В фильтрат добавили 30 мл этилацетата и полученный раствор промыли 9 -ным раствором лимонной кислоты, 5 -ным раствором аНСО 3, водой, сушили над 24. После отгонки этилацетата образовавшийся маслообразный остаток переосадили из эфира гексаном и сушили над Р 2 О 5. Получили 1,07 г (80 ) , 20 - 7,0 (С 1, МеОН) Т. пл. 63-67 С 0,76 (Б), 0,77 (Д). б) Получение -трет.бутилоксикарбонил-валил-тирозил-(-бензилоксикарбонил)лизина метилового эфира . 0,51 г (1,5 ммоль) дициклогексиламмонийной соли трет.бутилоксикарбонил-валина и 0,74 г (1,5 ммоль) тирозил-(-бензилоксикарбонил)лизина метилового эфира гидрохлорида (получен обработкой соединенияНС в этилацетате) растворили в 5 мл ДМФ, затем раствор охладили до 0 С и прибавили последовательно 0,22 г (1,6 ммоль) НОВТ и 0,32 г (1,55 ммоль) ДЦГК. Реакционную смесь перемешивали 1 час при охлаждении и 6 час при комнатной температуре. Очистку и выделение защищенного трипептида ОМепроводили по методике, описанной для соединения . Выход(10 ммоль) аНСО 3 растворили в 2 мл 1 М(9) при интенсивном перемешивании, затем прилили раствор 0,94 г (2,0 ммоль) в 3 мл ДМФА. Реакционную смесь перемешивали около 40 мин, затем ее разбавили 7 мл 9 -ной лимонной кислоты и 15 мл этилацетата. Полученные слои разделили и обработали. Водный слой промыли два раза этилацетатом, этилацетатные слои объединили, промыли 9 -ной лимонной кислотой, затем водой до нейтральной реакции и сушили над 24. После сушки этилацетат упарили, остаток переосадили из эфира гексаном, переосаждение повторили дважды. После сушки получили 0,86 г (68 ) 201 (с 0,5, метанол)0,43 , 0,62 (Б). г) Получение -трет.бутилоксикарбонил-триптофил-(-бензил)аспарагил-валил-тирозил-(-бензилоксикарбонил)лизина метилового эфира . 4 11361 1 2008.12.30 0,51 г (1,0 ммоль) (получен обработкой соединенияНС в этилацетате) растворили в 5 мл ДМФ, прибавили 0,28 мл -метилморфолина (2,5 ммоль),все перемешивали в течение 20 мин, затем охладили до 0 С и прибавили последовательно 0,56 г (1,1 ммоль) , 0,16 г (1,2 ммоль) НОВТ и 0,23 г (1,1 ммоль) ДЦГК. Реакционную смесь перемешивали в течение 2 ч при 0 С и 12 ч при комнатной температуре. Очистку и выделение защищенного пентапептидапроводили по методике, описанной для соединения . Выход 0,60 г(57 ). Т. пл. 143-145 С 20 - 31,0 (С 1, МеОН)0,71 (В), 0,33 (Б). д) Получение -трет.бутилоксикарбонил-нитроаргинил-аспарагина . В 2,5 мл воды растворили 0,30 г (2,0 ммоль) аспарагина, прибавили 0,41 мл (3,0 ммоль) триэтиламина, раствор охладили до 5 С и объединили при перемешивании магнитной мешалкой с охлажденным до 5 С раствором 0,75 г (1,5 ммоль) пентафторфенилового эфира -трет.бутилоксикарбонил-нитроаргинина. Раствор перемешивали 0,5 ч при охлаждении и 1 ч при комнатной температуре, затем добавили 4 н раствор НС в этилацетате до рН 5-6 и упарили растворители в вакууме. К остатку - смеси кристаллов и масла - добавили 5 мл этилацетата, нерастворившиеся кристаллы отделили фильтрованием, к этилацетатному фильтрату прибавили 15 мл эфира, выпавший кристаллический осадок дипептидадля очистки переосадили из метанола эфиром и промыли хлороформом. После сушки в вакууме над Р 2 О 5 получили 0,40 г (61 ) -(2). Т. пл. 103-105 С 20 21,0 (С 1, МеОН)0,55 (В), 0,63 (Б). е) Получение -трет.бутилоксикарбонил-нитроаргинил-аспарагинил-триптофил-(бензил)аспарагил-валил-тирозил-(-бензилоксикарбонил)лизина метилового эфира . 0,290 г (0,30 ммоль) (получен обработкой соединенияНС в смеси этилацетата и уксусной кислоты) растворили в 4 мл ДМФ, прибавили 0,045 мл -метилморфолина (0,40 ммоль), все перемешивали в течение 20 мин,затем охладили до 0 С и прибавили последовательно 0,151 г (0,35 ммоль -(2)-ОН, 0,054 г (0,40 ммоль) НОВТ и 0,072 г (0,35 ммоль) ДЦГК. Реакционную смесь перемешивали в течение 2 ч при 0 С и 12 ч при комнатной температуре. Осадок ДЦГМ отделили фильтрованием, к фильтрату прибавили 15 мл эфира, выпавший осадок повторно переосадили из ДМФ эфиром, промыли на фильтре смесью метанол-этилацетат 11, этилацетатом. После сушки в вакууме над 2 О 5 получили 0,26 г (65 ) -(2). ж) Получение аргинил-аспарагинил-триптофил-аспарагил-валил-тирозил-лизина метилового эфира дигидрохлорида . 0,15 г (0,11 ммоль) защищенного гексапептидарастворили в 4 мл уксусной кислоты, к раствору прибавили 0,03 г катализатора - палладиевой черни и при перемешивании магнитной мешалкой через реакционную смесь пропускали ток водорода в течение 23 ч,контролируя полноту отщепления водородолабильных защитных групп методом ТСХ. После завершения гидрирования катализатор отделили фильтрованием, гексапептид перевели в осадок добавлением 12 мл эфира. Осадок растворили в 2 мл уксусной кислоты,к раствору прибавили 2 мл 4 н НС, все перемешивали в течение 50 мин, затем растворители упарили, кристаллический остаток промыли этилацетатом, смесью метанол-этилацетат 21. Очистку соединения проводили методом колоночной хроматографии на сефадексе-20, используя в качестве элюента смесь уксусная кислота - этанол 11. Фракции, содержащие чистый пептид, объединяли и упаривали. После сушки получили 0,76 (64 ) ОМе 2 НС. Т. пл. 161-164 С 20 - 17,0 (С 0,5, уксусная кислота)0,25 (В), 0,33 (Д). Масс-спектр/ 995,1 МН, 1017,1 . Оценивали биологическое действие пептидов. Проводили иммуноферментный анализ и определяли способность пептидов связывать -антитела. Исследовали влияние пептида на выброс ионов калия и миелопероксидазы из лейкоцитов под влиянием аллергена. Для исследования использовали растворы пептидов в концентрации от 100 пг/мл до 1 мг/мл. 5 11361 1 2008.12.30 Оценка связывания -пептида сДля определения способности -пептида связыватьнами была произведена сорбция -пептида в карбонат-бикарбонатном буфере с рН 9,6 на полистироловую планшету в пошаговых концентрациях 10 мкг/мл, 20 мкг/мл, 40 мкг/мл, 80 мкг/мл,160 мкг/мл, 320 мкг/мл, 640 мкг/мл, 1 мг/мл. В лунки микроплашета вносили по 0,1 мл-пептида в карбонат-бикарбонатном буфере с рН 9,6 и инкубировали в течение 1824 час при комнатной температуре. После инкубации микропланшет отмывали промывающим раствором (рН 7,2) с твином-20, чтобы удалить несвязавшийся -пептид. После этого в лунки микропланшета вносили по 200 мкл 0,1 бычьего альбумина и инкубировали 3 часа при 37 С для закрытия свободных зон полистирола и снижения неспецифического связывания. Затем микропланшет снова отмывали промывающим раствором с твином-20. Чтобы установить оптимальную сорбционную концентрацию -пептида, мы вносили по 0,1 мл пробы 5 сывороток больных аллергией, разведенных 15 с известной концентрацией , в лунки с разной сорбционной концентрацией -пептида и инкубировали 1 час при 37 С. После этого микропланшет 3 раза отмывали промывающим раствором и вносили по 0,1 мл антител против , меченных пероксидазой хрена, инкубировали 1 час при 37 С. После 3-кратной отмывки в лунки микропланшета вносили по 0,15 мл раствора тет-раметилбензидина с 22. Через 15 мин инкубации при комнатной температуре реакцию останавливали добавлением в лунки по 50 мкл 4 -ной серной кислоты и замеряли оптическую плотность на фотометре с длиной волны 450 нм. Для того чтобы выяснить, является ли связывание -пептида сполным или частичным, мы протестировали методом иммуноферментного анализа в парных постановках 20 проб сывороток с известной концентрациейна одной микропланшете, где в одном ряду был сорбирован -пептид в концентрации 160 мкг/мл, а в параллельном моноклональные антитела противв рабочей концентрации (5 мкг/мл) для системы определения общего . Пробы сывороток вносили в разведении 120. По оптической плотности и сорбционной концентрации -пептида нами были построены графики титрования и определена оптимальная сорбционная концентрация-пептида в этой экспериментальной иммуноферментной системе (фиг.).-пептида. Как видно на фиг. с сорбционной концентрации в 80 мкг/мл оптическая плотность практически не увеличивалась, что говорит о пороге насыщения сорбционной способности данной полистироловой планшеты в отношении -пептида. Следовательно, следующее разведение - 160 мкг/мл - можно считать оптимальным в этой экспериментальной иммуноферментной системе. Результаты связываниямоноклональными антителами и -пептидом представлены в таблице, из которой видно, что -пептид в данном эксперименте связывал от 11,5 до 48,3 от общего . Уровень общегои процента его связывания-пептидом коррелировали по обратной связи (-0,745, р 0,05). Можно считать доказанным факт связывания -пептидом . 6 11361 1 2008.12.30 При удлинении -связывающих пептидов от 4 до 7 аминокислот усиливалось связывание иммуноглобулина Е. Так, после добавления в лунки плоскодонного иммунологического планшета по 100 мкл раствора пептидов (100 мкг/мл) происходила сорбция этих тетра-гептапептидов. После внесения в лунки планшет сывороток больных аллергией гептапептид связывал на 23,79 больше , чем тетрапептид. Была исследована способность связывания синтетическими -пептидами, в зависимости от концентрациив стандартной сыворотке (от 0,47 до 60 нг/мл). Обнаружена высокая корреляция между концентрациейи оптической плотностью раствора после внесения моноклональных антител, меченных пероксидазой хрена, и субстрата хромогенной смеси (0,99). Аналогичные исследования были проведены с сывороткой больных аллергией. В иммунологические планшеты с сорбированными синтетическими -пептидами добавляли сыворотки крови аллергиков с известной концентрацией . Также была обнаружена высокая корреляция между концентрациейв сыворотке крови больных и оптической плотностью раствора после внесения моноклональных антител, меченных пероксидазой хрена, и субстрата хромогенной смеси (0,94). В проведенных экспериментах обнаружена высокаясвязывающая активность синтетических -пептидов. Показана возможность создания диагностических систем для количественного определения . В результате проведенных экспериментов установлено, что заявленные пептиды обладают биологическим действием и связываются с иммуноглобулинами Е класса. При удлинении -связывающих пептидов от 4 до 7 аминокислот связывание иммуноглобулина Е усиливалось. Связываниемоноклональными анителами противи -пептидом из раствора сывороток больных с аллергией с известным содержаниемСвязавшийсяОбщийв ОП в лунках с антиОП в лунках ссыв. с -пептидом кЕ/л-пептидом от общего ,1 500 1,978 0,412 20,8 2 450 1,832 0,256 14,0 3 400 1,744 0,299 17,1 4 350 1,632 0,233 14,3 5 300 1,502 0,172 11,5 6 260 1,404 0,228 16,2 7 200 1,312 0,167 12,7 8 180 1,265 0,206 16,3 9 160 1,204 0,315 26,2 10 120 1,116 0,305 27,3 11 100 1,034 0,433 41,9 12 90 0,902 0,225 24,9 13 80 0,854 0,307 35,9 14 75 0,798 0,202 25,3 15 70 0,769 0,306 39,8 16 65 0,658 0,318 48,3 17 60 0,566 0,155 27,4 18 40 0,421 0,198 47,0 19 20 0,374 0,165 44,1 20 15 0,228 0,104 45,6 Примечания. ОП - оптическая плотность.- значениЯ ОП приведены после разности величины полученной в ИФ-реакции и фоновой ОП пластика лунки (от 0,047 до 0,062). 7 11361 1 2008.12.30 У больных аллергической бронхиальной астмой с сенсибилизацией к грибковым аллергенам (12) предварительная инкубация лейковзвеси с -тетрапептидом (1 нг/мл) при 37 С в течение 30 мин оказывала десенсибилизирующее действие на лейкоциты, в то время как предварительная инкубация лейковзвеси с тетрапептидом в концентрации 100 пг/мл не оказывала такого влияния на лейкоциты. Как видно из описания экспериментов, предлагаемые пептиды обеспечивают достижение технического результата - связываюти обладают иммуномодулирующим эффектом. Практическое применение предлагаемых пептидов в медицине позволит удешевить иммунодиагностику и сделать доступным поликомпонентное аллергологическое обследование для всех слоев населения. Кроме этого, применение пептидов может быть полезно для профилактики и лечения -зависимых аллергопатологий. В настоящий момент разработан процесс получения -связывающих пептидов, проведены лабораторные исследования, которые подтверждают получение технического результата и биологического эффекта. Источники информации 1.,,..1995 107308-312. 2..-.,,.-25-.1997 1551835-1840. 3.Т.В.,,--.1997 100110-121. 4.,.,-- -.1997 1551828-1834. 5. Новиков Д.К., Сергеев Ю.В., Новикова В.И. Аллергические реакции на лекарства. Витебск, 1998. - 203 с. 6.., ,- .1999 341(26)1966-1973. 7..,.,, -,.2001 108184-190. 8..,.,.-.2001 18254-261. 9. Новиков П.Д., Новиков Д.К., Сергеев Ю.В. Диагностика лекарственной аллергии // Иммунопатология, аллергология, инфектология. - 2001. -1. - С. 51-64. 10.4369137. 11..,,,,.// . 197922 204(4399)1309-10. 12.,.,,5// . 198113(3)201-4. 13. 6267958. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 8
МПК / Метки
МПК: C07K 7/00
Метки: связывающий, иммуноглобулин, пептид
Код ссылки
<a href="https://by.patents.su/8-11361-peptid-svyazyvayushhijj-immunoglobulin-e.html" rel="bookmark" title="База патентов Беларуси">Пептид, связывающий иммуноглобулин Е</a>
Предыдущий патент: Статический преобразователь и способ преобразования кинетической энергии парамагнитного тела в электрическую энергию
Следующий патент: Способ получения 2-хлор-5-дихлорметилпиридина
Случайный патент: Электрохимический реактор