Аналоги тримера 2′, 5′-олигоадениловой кислоты, обладающие активностью против вирусов, поражающих картофель
Номер патента: 1565
Опубликовано: 30.03.1997
Авторы: Сентюрёва Светлана Леонидовна, Квасюк Евгений Иванович, Зинченко Анатолий Иванович, Ященко Нина Петровна, Михайлопуло Игорь Александрович, Коновалова Галина Ивановна, Ткаченко Ольга Васильевна, Барай Владимир Николаевич, Кулак Тамара Ивановна
Текст
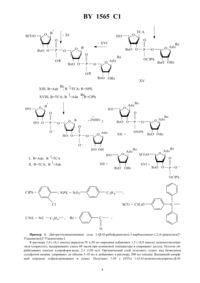
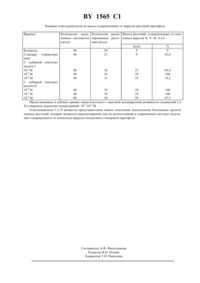
ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ(73) Патентообладатель Квасюк Евгений Иванович,Михайлопуло Игорь Александрович где один В или В 1 - , а другой - ТСА, обладающие активностью против вирусов, поражающих картофель.(56) 1. Борисенко С.И., Шмыгля В.А., Шустер Г. Эффективность оздоровления картофеля методом культуры апексов с помощью ингибиторов вирусов. // Доклады ВАСХНИЛ. - 1985.10. - С. 10-12. 2. Ткачук З.Ю., Артеменко В.С., Семерникова Л.И. Ингибирование вирусной инфекции 2, 5 - олигоаденилатом при регенерации мерисистем картофеля. // Биополимеры и клетка, 1993. Т.9.2. - С. 9-18 (прототип). 11 обладающим способностью ингибировать репликацию вирусов в растениях картофеля, в связи с чем данные растения могут найти применение в сельском хозяйстве в качестве экологически безопасных средств защиты растений, а также для получения оздоровленного от вирусов посадочного материала картофеля. Известно использование антивирусных препаратов природного и синтетического происхождения в оздоровлении картофеля от вирусов методом культуры верхушечной ткани 1. Суть способа заключается в том,что срезанные верхушки ростков картофеля, зараженные вирусами , ,и М, сначала стерилизуют в растворе диацида, затем отмывают водой и высаживают на питательную среду по Мурасиге-Скугу с добавкой ингибиторов вирусов. В качестве антивирусных препаратов (АВП) используют 1 спиртовой раствор новоиманина(5 мл/л) спиртовой раствор экстракта (110) зверобоя (20 мл/л) 2-тиоурацил (4 мг/л) 2,4 диоксогексагидроксотриазин (ДГТ) (100 мг/л) цианогуанидин (100 мг/л) и фенилаллил-тиомочевину (100 мг/л). Затем культивируют растения в пробирках 4-6 недель при освещенности 4 тыс.люкс и 16-часовом светопериоде. Из растений выделяют экспланты размером 0,3-0,5 мм и переносят их на такую же среду , содержащую АВП. Регенеранты размножают черенкованием, а регенерацию растений осуществляют при их периодическом пересаживании на свежую питательную среду в течение 3-4 месяцев. Степень зараженности растений определяют иммуноферментным методом. При использовании в качестве АВП 2-тиоурацила, новоиманина и экстрактов зверобоя было получено 100 растений, свободных от вируса , и 46 - от вирусов М и . При использовании ДГТ и циангуанидина получено 13-15,8 растений, свободных от комплекса вирусов , ,и М. Недостатком указанных антивирусных препаратов является низкая эффективность выхода растений,свободных от комплекса вирусов, которые присутствуют на растениях в различных соотношениях, что связано с различной специфичностью действия АВП по отношению к вирусам. Известен 2 аденилил(2-5)аденилил(2-5)аденозин формулы 1565 1 обладающий противовирусной активностью в отношении вирусов, поражающих картофель. Исследовано влияние аденилил(2-5)аденилил(2-5)-аденозина в концентрации 10-7-10-4 М на вирусы М, ,ипри регенерации растений картофеля из меристем. Из растущих почек растений вычленяли меристемы размером 0,3 мм и высаживали на питательную среду с добавкой тримера. Спустя три месяца полученные регенеранты величиной 10-15 мм черенковали и высаживали на свежую питательную среду без добавки олигоаденилата. Растения выращивали в течение 9 месяцев, осуществляя контроль за вирусами методом иммуноферментного анализа. Лучшие результаты были получены при использовании тримера в концентрации 10-5 М. При этом из высажденных меристем развивалось 17,91,9 нормальных растений, а доля свободных от вирусов растений составила 13,3 от высажденных меристем. Как видно из результатов, эффективность процесса оздоровления весьма низкая, сам процесс требует длительного времени и применения относительно высоких концентраций олигоаденилата. Задачей настоящго изобретения является получение новых 2, 5-олигоаденилатов, обладающих более высокой по сравнению с известными антивирусными препаратами активностью против вирусов, поражающих картофель. В соответствии с указанной задачей синтезированы соединенияи , добавление которых в питательную среду при регенерации растений картофеля из меристем приводит к получению оздоровленного от вирусов посадочного материала. Способ получения соединенийи(см . схему) заключается в монометокситритилировании 1-(-рибофуранозил)-3-карбоксамидо-1,2,4-триазола(виразола)3 селективном бензоилировании образовавшегося монометокситритильного производногофосфорилировании полученного при этом бензоатабис-триазолидом 2-хлорфенилфосфата в пиридине с последующим добавлением в реакционную среду 2-(4 нитро-фенил)этанола селективном удалении из полученных триэфирови 2-хлорфенильной защитной группы или цианэтильной группы, что приводит к образованию диэфираи , соответственно конденсации диэфирас селективно блокированным диаденозинмонофосфатом 4, а диэфира Х с трибензоиладенозином 4, что приводит к полностью блокированному тримеруи димеру ,соответственно детритилировании соединенияи конденсации образовавшегося селективно блокированного димерас диэфиром 5, приводящей к полностью блокированному тримеруисчерпывающем деблокировании соединенийии выделении целевых тримеровиионообменной хроматографией. Схема Пример 1. Ди(триэтиламмониевая) соль 1-(рибофуранозил)-3-карбоксамидо-1,2,4-триазолил(25)аденилил(2-5)аденозина . К раствору 1,0 г (4,1 ммоль) виразолав 50 мл пиридина добавляют 1,5 г (4,9 ммоль) монометокситритила хлористого, выдерживают смесь 48 часов при комнатной температуре и упаривают досуха. Остаток обрабатывают смесью хлороформ-вода, 21 (150 мл). Органический слой отделяют, сушат над безводным сульфатом натрия, упаривают до объема 5-10 мл и добавляют к раствору 200 мл гексана. Выпавший аморфный порошок отфильтровывают и сушат. Получают 1,95 г (92) 1-(5-О-монометокситритил 4 1565 1 рибофуранозил)-3-карбоксамидо-1,2,4-триазола . УФ спектр в метаноле, макс, нм ( ) 231 (4,27). К раствору 1,8 г (3,48 ммоль) соединенияв смеси 40 мл ацетонитрила, 6,3 мл (45,45 ммоль) триэтиламина и 32 мг (0,26 ммоль) диметиламинопиридина добавляют в течение 3 часов раствор 0,55 г (4,18 ммоль) бензоилцианида в 10 мл ацетонитрила. Реакционную смесь упаривают досуха, остаток хроматографируют на колонке с силикагелем (50 см 3). Продукты реакции элюируют смесью растворителей гексан-этилацетат, в градиенте концентрации этилацетата от 25 до 95 объемных . Фракции, содержащие бензоильное производное ,собирают, упаривают до объема 5-10 мл и высаждают в гексан. Получают в виде аморфного порошка 1,3 г(57) 1-(3-О-бензоил-5-О-монометокситритилрибофуранозил)-3-карбоксамидо-1,2,4-триазола . Уфспектр в метаноле макс, нм ( )231 (4,63). Смесь 0,16 г (2,38 ммоль) 1,2,4-триазола и 0,27 г (1,19 ммоль) 2 хлорфенилдихлорфосфата в 2,2 мл пиридина перемешивают 10 мин, охлаждают до 0 С и добавляют к реакционной смеси порциями раствор 0,5 г (0,81 ммоль) бензоатав 1,7 мл пиридина. Реакционную смесь перемешивают 3 ч, добавляют к ней 0,54 г (3,23 ммоль) 2-(4-нитрофенил)этанола и выдерживают при комнатной температуре 18 ч. Разбавляют реакционную смесь хлороформом (300 мл) и обрабатывают 0,05 М раствором триэтиламмонийбикарбоната (ТЕАБ) (2 х 100 мл). Органический слой отделяют, сушат безводным сульфатом натрия и упаривают досуха. Остаток хроматографируют на силикагеле (150 см 3). Продукты элюируют смесью растворителей хлороформ-метанол 501. Фракции, содержащие соединение , объединяют и упаривают до объема 5 мл и высаждают в 200 мл гексана. Получают в виде аморфного порошка 0,54 г (70) триэфира . Уф спектр в метаноле макс, нм ( ) 230 (4,61). Обрабатывают 0,35 г (0,36 ммоль) триэфирараствором 0,3 г (1,81 ммоль) 4-нитробензальдоксима в 12 мл смеси диоксан-триэтиламин-вода,111, в течение 1 ч, добавляют 20 мл пиридина и упаривают досуха. Остаток хроматографируют на силикагеле (60 см 3). Продукты элюируют смесью растворителей хлороформ-метанол-триэтиламин, 9541. Фракции, содержащие диэфир , собирают, упаривают досуха. Остаток растворяют в 3 мл хлороформа и высаждают в 100 мл гексана. Получают в виде аморфного порошка 0,24 г (70) 1-(3-О-бензоил-5-Омонометокситритилрибофуранозил)-3-карбоксамидо-1,2,4-триазол-2-2-(4-нитрофенил)этилфосфата(0,15 ммоль) диэфирав 1,7 мл пиридина добавляют 0,08 г (1,1 ммоль) тетразола и 0,17 г (0,56 ммоль) 2,4,6-триизопропилбензолсульфохлорида , перемешивают реакционную смесь при комнатной температуре 16 ч, добавляют 75 мл хлороформа и обрабатывают ее 0,05 М раствором ТЕАБ (2 х 20 мл). Органический слой отделяют, сушат безводным сульфатом натрия и упаривают досуха. Остаток хроматографируют на силикагеле (75 см 3). Продукты реакции элюируют смесью растворителей хлороформ-метанол в градиенте концентрации метанола от 0,1 до 2 объемных . Фракции, содержащие блокированный тример , объединяют, упаривают до объема 3 мл и высаждают в 100 мл гексана. Получают в виде аморфного порошка 0,19 г (61) соединения . Растворяют 190 мг (0,09 ммоль) соединенияв 7 мл 2 растворав смеси хлористый метилен-метанол, 73, спустя 10 мин раствор разбавляют хлороформом до 100 мл и экстрагируют 0,05 М раствором ТЕАБ (2 х 20 мл). Органический слой отделяют, сушат безводным сульфатом натрия и упаривают досуха. Остаток растворяют в 15 мл 0,5 М растворе 1,8-диазабицикло-5,4,0-ундецена-7 в пиридине и выдерживают раствор при комнатной температуре 16 ч. В реакционную смесь добавляют 7,5 мл 1 М раствора уксусной кислоты в пиридине и упаривают досуха. Остаток обрабатывают 40 мл насыщенного при 0 С раствора аммиака в метаноле в течение 18 ч и упаривают досуха. Остаток хроматографируют на ДЕАЕ-целлюлозе А-25 (НСО 3 -форма, 75 см 3). Продукты элюируют раствором ТЕАБ в градиенте концентрации от 0,05 до 0,2 М. Фракции, содержащие тример , собирают и лиофилизуют. Получают 52 мг (52) соединенияв виде ди(триэтиламмониевой) соли. УФ-спектр в воде, макс , нм ( ) 260 (4,43). 1 Н-ЯМРспектр в 2 О (внутренний стандарт -ОН), , мд 7,06 6,88 (2 Н) 6,75 и 6,65 синглеты протонов Н-5, Н-2,Н-8 4,84 д (1 Н, Н-1, 1,23,0 Гц) 4,73 д (1 Н, -, 1,22,0 Гц) 4,59 д (1 Н, Н-1, 1,23,0 Гц). Пример 2. Ди(триэтиламмониевая) соль аденилил(2-5)-1-(рибофуранозил)-3-карбоксамидо-1,2,4 триазолил(2-5)аденозина . Смесь 0,12 г (1,78 ммоль) 1,2,4-триазола и 0,2 г (0,89 ммоль) 2-хлор-фенилдихлорфосфата в 1,5 мл пиридина перемешивают 10 мин, охлаждают до 0 С и добавляют к реакционной смеси порциями раствор 0,37 г(0,60 ммоль) бензоатав 1,3 мл пиридина. Реакционную смесь перемешивают 2 ч, добавляют 0,16 г (2,4 ммоль) 2-цианэтанола и выдерживают при комнатной температуре 18 ч. Реакционную смесь разбавляют хлороформом (200 мл) и обрабатывают 0,05 М раствором Б (2 х 70 мл). Органический слой отделяют,сушат безводным сульфатом натрия и упаривают досуха. Остаток хроматографируют на силикагеле (100 см 3) и выделяют продукт, как описано в синтезе соединения . Получают в виде аморфного порошка 0,39 г(76) триэфира . УФ-спектр в метаноле, макс , нм ( )232 (4,63), 270 (4,18). Растворяют 0,39 г (0,45 ммоль) триэфирав 40 мл смеси пиридин-триэтиламин, 11, выдерживают 3 ч и упаривают досуха. Остаток хроматографируют на силикагеле (50 см 3) и выделяют продукты, как описано в синтезе соединения . Получают в виде аморфного порошка 0,29 г (72) 1-(3-О-бензоил-5-О-монометокситритилрибофуранозил)-3-карбоксамидо-1,2,4-триазол-2-(2-хлорфенил)фосфата Х. УФ-спектр в метаноле, макс , нм ( 1565 1 Конденсируют 0,27 г (0,3 ммоль) диэфираи 0,14 г (0,25 ммоль) трибензоиладенозинав 2,5 мл пиридина в присутствии 0,27 г (0,9 ммоль)и 0,13 г (1,8 ммоль) тетразола и выделяют образовавшийся димер . Получают в виде аморфного порошка 0,27 г (80) блокированного димера , как описано в интзе тримера , который детритилируют обработкой 10 мл 2 растворав смеси хлористый метилен-метанол, 73. Образовавшийся димерсо свободной 5-гидроксильной группой выделяют хроматографией на силикагеле (70 см 3), как описано при синтезе триэфира . Получают в виде аморфного порошка 0,2 г (90) димера Х, который конденсируют с 0,23 г (0,22 ммоль) диэфирав 3 мл пиридина в присутствии 0,2 г (0,66 ммоль)и 0,1 г (1,37 ммоль) тетразола. Образующийся полностью блокированный тримервыделяют, как описано при получении соединения . Получают в виде аморфного порошка 0,28 г (77 ) соединения . Детритилируют 0,27 г (0,13 ммоль) тримераобработкой 7 мл 2 растворав смеси хлористый метилен-метанол, 73, в течение 10 мин. Разбавляют раствор хлороформом (100 мл) и обрабатывают 0,05 раствором ТЕАБ (2 х 50 мл). Органический слой отделяют, сушат безводным сульфатом натрия и упаривают досуха. Добавляют к остатку 0,32 г (1,93 ммоль) 4-нитробензальдоксима в 18 мл смеси диоксантриэтиламин-вода, 111 , и выдерживают раствор при комнатной температуре 2 ч. К раствору добавляют 40 мл пиридина и упаривают смесь досуха. К остатку добавляют насыщенного при 0 С раствора аммиака в метаноле, выдерживают раствор при комнатной температуре 20 ч и упаривают досуха. Остаток хроматографи руют на ДЕАЕ- целлюлозе А-25 (НСО 3 -форма) (100 см 3), как описано при получении соединения . Получают в лиофилизованной форме 46 мг (31) тримерав виде ди(триэтиламмониевой) соли. УФ-спектр в метаноле, макс, нм ( ) 260 (4,42). 1 Н-ЯМР-спектр в 2 (внутренний стандарт -), , мд 7,06 6,98 6,90 (2 Н) и 6,71 синглеты протонов Н-5, Н-2, Н-8 4,87 д (1 Н, Н-1, 1,26,0 Гц) 4,77 д (1 Н, Н-, 1,2 5,0 Гц) 4,62 д (1 Н, Н-1, 1,22,0 Гц). Исследование биологической активности 1-(рибофуранозил)-3-карбоксамидо-1,2,4-триазолил(25)аденилил(2-5)аденозинаи аденилил(2-5)-1-(рибофуранозил)-3-карбоксамидо-1,2,4-триазолил(2-5)аденозинав виде ди(триэтиламмониевых) солей проводилось при получении оздоровленного от комплекса вирусов , , М,ипосадочного материала картофеля сорта Белорусский 3. Ингибирующее действие олигоаденилатовипроявлялось при добавлении их в питательную среду, используемую для оздоровления растений картофеля. Верхушки ростков из проростков клубней картофеля помещают в питательную среду по Мурасиге-Скугу в модификации НИИКХ 6 с добавкой олигоаденилатовив концентрации 10-8-106 М. В течение 3-4 недель выращивают растения до образования 5-7 междуузлий. Из верхушечных и пазушных почек полученных растений выделяют экспланты размером 1-1,5 мм и переносят их на свежую питательную среду с добавкой соединенийив той же концентрации. Приживаемость эксплантов в этом случае составляет 100 . Через 3-4 недели получают растения, свободные от комплекса вирусов и пригодные для последующго черенкования. Выход оздоровленных растений составляет 69-100. Контроль за наличием вирусов в регенерантах осуществляют методом электронной микроскопии и иммуноферментного анализа 7. Высокая эффективность получения свободных от вирусов растений обеспечивается антивирусными свойствами соединенийи , что позволяет вычленять экспланты большего размера, чем в традиционном способе оздоровления методом термотерапии. Использование больших по размеру эксплантов способствует их большей приживаемости. Метод оздоровления посадочного материала картофеля термотерапией в сочетании с культурой верхушечной меристемы заключается в том, что клубни картофеля выдерживают в термостабильных камерах при 35-37 С и влажности 65-70 в течение 1-2 месяцев. Затем из образовавшихся проростков вычленяют меристемы и высаживают их в пробирки с питательной средой на минеральной основе по Мурасиге-Скугу в модификации Научно-исследовательского института картофельного хозяйства. Растения выращивают в пробирках при 23 С, влажности 70 и освещенности 5-20 тыс.люкс при 16-часовом светопериоде в течение 11,5 месяцев. Проростки величиной 3-5 мм пересаживают на свежую питательную среду для ускорения роста. Полученные растения расчеренковывают по числу междуузлий и высаживают черенки в пробирки на такую же питательную среду. Осуществляют отбраковку зараженных вирусом растений, а безвирусные растения размножают черенкованием до необходимого количества. Полученные растения из пробирок пересаживают в почву теплиц для получения клубней картофеля. В контрольных экспериментах при использовании обычной питательной среды все полученные растения были заражены вирусами. При использовании метода термотепии выход оздоровленных от вирусов растений составлял 42,8. Сравнительные данные по получению различными методами оздоровленных от комплекса вирусов растений картофеля представлены в таблице. 1565 1 Влияние олигоаденилатов на выход оздоровленных от вирусов растений картофеля. Вариант Количество выде- Количество анали- Выход растений, оздоровленных от комленных эксплантов зированных расте- плекса вирусов , , ,и Контроль Стандарт пия) С добавкой олигоаденилата 10-840 36 25 69,4 10-740 39 39 100 10-640 31 23 74,2 С добавкой олигоаденилата 10-840 39 39 100 10-740 39 39 100 10-640 39 39 97,5 Представленные в таблице данные свидетельствуют о высокой антивирусной активности соединенийив широком диапазоне концентраций 10-8-10-6 М. Олигоаденилатыиявляются представителями нового поколения экологически безопасных средств защиты растений, которые являются перспективными для их использования в современных методах получения оздоровленного от комплекса вирусов посадочного материала картофеля.
МПК / Метки
МПК: A01N 57/16, C07H 19/20
Метки: активностью, обладающие, кислоты, аналоги, против, поражающих, 5'-олигоадениловой, тримера, картофель, вирусов
Код ссылки
<a href="https://by.patents.su/7-1565-analogi-trimera-2-5-oligoadenilovojj-kisloty-obladayushhie-aktivnostyu-protiv-virusov-porazhayushhih-kartofel.html" rel="bookmark" title="База патентов Беларуси">Аналоги тримера 2′, 5′-олигоадениловой кислоты, обладающие активностью против вирусов, поражающих картофель</a>
Предыдущий патент: Способ получения производных цитидина
Следующий патент: Способ получения заварного полуфабриката
Случайный патент: Строительный блок