Способ получения водорода
Номер патента: 12146
Опубликовано: 30.08.2009
Авторы: Вороник Надежда Ивановна, Земскова Лариса Михайловна, Давыдов Юрий Петрович, Кубрак Павел Борисович, Дроздович Валерий Брониславович
Текст
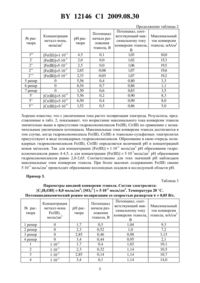
(51) МПК (2006) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ(71) Заявитель Государственное научное учреждение Объединенный институт энергетических и ядерных исследований - Сосны Национальной академии наук Беларуси(72) Авторы Давыдов Юрий Петрович Вороник Надежда Ивановна Земскова Лариса Михайловна Дроздович Валерий Брониславович Кубрак Павел Борисович(73) Патентообладатель Государственное научное учреждение Объединенный институт энергетических и ядерных исследований - Сосны Национальной академии наук Беларуси(56) ТОМИЛОВ А.П. и др. Электрохимия органических соединений. - Ленинград Химия, 1968. - . 319-327. ДРОЗДОВИЧ В.Б. и др. Труды Белорусского государственного технологического университета Серия . Химия и технология неорганических веществ, 2005. Вып. . - . 29-31.2003-328168 .11-229167 , 1999.1607369 1, 2005.2004/061161 2.63-219593 , 1988.(57) Способ получения водорода путем электролиза сернокислого водного раствора этанола, отличающийся тем, что электролиз проводят при рН 2,2-6,0 в растворе, содержащем этанол в концентрации 0,1-8,0 моль/дм 3, серную кислоту в концентрации 0,010,1 моль/дм 3 и в качестве катализатора растворимые полиядерные гидроксокомплексы железаили хрома , полученные путем введения соли железаили хромадо концентрации 510-4-510-3 моль/дм 3. 12146 1 2009.08.30 Изобретение относится к области электрохимической технологии, а именно электролитическому получению водорода. Изобретение может использоваться также для экологически чистого получения энергии посредством применения водородно-кислородной смеси в органической химии для окисления углеводородов, спиртов, кетонов и др. Наиболее распространенными и экономически доступными возобновляемыми источниками водорода являются простые алифатические спирты. В настоящее время повышенное внимание уделяется процессам электрохимической, каталитической конверсии метанола и этанола, использованию их в качестве топлива в топливных элементах, а так же как эффективные экологически безопасные добавки в моторное топливо 1-3. Экономическая доступность, экологическая безопасность этих возобновляемых источников водорода, в особенности этанола, как одного из основных продуктов гидролизных производств, являются основным аргументом для его использования в качестве анодного деполяризатора, а также эффективного топлива в современных электрохимических энергетических установках. Известен способ получения водорода путем электролиза водных растворов органических веществ 4. Электролитом является твердотельная полимерная мембрана, на противоположные поверхности которой нанесены катализаторы анодный - для электрохимического окисления органических соединений и катодный для выделения водорода. Недостатками этого метода являются сложность в нанесении катализаторов на твердотельные полимерные мембраны, ограниченный ресурс их работы, проведение электролиза при повышенных температурах, сложность аппаратурного оформления. Известен способ электролиза воды, состоящий в подводе электролита к активным и пассивным электродам, разложении воды на водород и кислород под действием электрического тока и отвода получившихся газов, где в качестве пассивных электродов используют порошок из материала электрода и/или катализатора, которые в процессе электролиза поддерживают во взвешенном состоянии любым известным способом 5. Недостатком этого способа является необходимость поддержания катализатора во взвешенном состоянии, что весьма усложняет аппаратурное оформление процесса, приводит к значительному увеличению напряжения электролиза в результате омических потерь. Наиболее близким к предлагаемому изобретению является способ получения водорода электроокислением низших спиртов 6. Недостатком этого способа является относительно медленное протекание органических реакций и сравнительно низкий выход водорода. Для преодоления этого недостатка в электролит добавляют катализаторы-переносчики зарядов, которые, обратимо восстанавливаясь (или окисляясь), окисляют (или восстанавливают) органические соединения в растворе. Задачей настоящего изобретения является создание способа получения водорода,обеспечивающего повышение эффективности процесса электролиза водных растворов органических веществ. Технический результат, получающийся при осуществлении предложенного изобретения, заключается в анодной деполяризации, снижении напряжения разложения этанола, увеличении токов конверсии этанола. Сущность предлагаемого изобретения заключается в том, что в способе получения водорода путем электролиза сернокислого водного раствора этанола, электролиз проводят при рН 2,2-6,0 в растворе, содержащем этанол в концентрации 0,1-8,0 моль/дм 3, серную кислоту в концентрации 0,01-0,1 моль/дм 3 и в качестве катализатора растворимые полиядерные гидроксокомплексы железаили хрома , полученные путем введения соли железаили хромадо концентрации 510-4-510-3 моль/дм 3. При этом на электродах происходят следующие реакции Анод С 2 Н 5 ОН 3 Н 2 О-12 е 2(СО 2)12 Н Катод 2 Н 2 е(Н 2) С 2 Н 5 ОН 3 Н 2 О 2(СО 2)6(Н 2) 2 12146 1 2009.08.30 Н-347,95 кДж/моль,-839,1 Дж/К, Е 0,085 В,где Н - тепловой эффект реакции- изменение энтропии Е - напряжение разложения. Термодинамическая оценка напряжения разложения этанола для стандартных условий в различных средах, в том числе до промежуточных продуктов (ацетальдегида, уксусной кислоты, этиленгликоля и др.), показывает, что для всех процессов,включая конечные продукты конверсии этанола в водных растворах, его величина не превышала 0,10,7 В. Это более чем в 2 раза ниже напряжения разложения воды на водород и кислород, которое равно 1,23 В. Экспериментально определенная величина напряжения разложения для этанольно-сульфатных электролитов на электродной паре нанопленочный платинатитановый электрод (НПТА) - анод, сталь Х 18 Н 9 Т - катод, по сравнению с расчетной,выше на 0,25-0,3 В. Таким образом, эффективность электрохимической конверсии этанола и использование его как анодного деполяризатора определяется кинетическими факторами. На чертеже представлена технологическая схема получения водорода. Технологическая схема получения водорода включает в себя диафрагменный электролизер 1, разделительные колонны 2 и 3, промыватели 4 и 5, регуляторы давления 6 и 7,осушитель 8, ресивер 9, центробежные насосы 10 и 11. Электрохимическую конверсию этанола с получением водорода проводят в электролизере 1 с плоскопараллельным расположением электродов, разделенных высокопроницаемой полипропиленовой диафрагмой, фиксированным межэлектродным расстоянием,равным одному сантиметру, снабженным устройством для отвода газов и циркуляции электролита. В качестве малоизнашиваемого анода используют электрод НПТА, содержащий в поверхностном слое 3-5 г/м 2 . В качестве катода используют стальную сетку марки Х 18 Н 9 Т с размерами ячейки 1,51,5 мм. В катодные и анодные камеры диафрагменного электролизера 1 по трубопроводам при помощи центробежных насосов 10 и 11 непрерывно поступает электролит. Отдельно из анодных и катодных камер газожидкостная смесь поступает на разделительные колонны 2 и 3, где происходит отделение газообразных продуктов от электролита, который далее возвращается в электролизер 1 при помощи центробежных насосов 10 и 11. Корректировка электролита по всем компонентам (этанол, вода, серная кислота, катализатор - растворимые полиядерные гидроксокомплексы поливалентных металл-ионов, например железаили хрома (, производится в разделительных колоннах 2 и 3. Получаемые в катодной камере электролизера водород и в анодной камере газообразные продукты после разделительных колонн 2 и 3 соответственно поступают в промыватели 4 и 5 с дистиллированной водой, где производится очистка их от остатков электролита. Из промывателей газы поступают в регуляторы давления 6 и 7. Водород из регулятора давления 6 поступает в осушитель 8 и через ресивер 9 или непосредственно из осушителя 8 подается потребителю. Ниже приведены основные показатели способа электролитического получения водорода в слабокислых этанольно-сульфатных электролитах с деполяризацией анодного процесса этанолом в присутствии растворимых полиядерных гидроксокомплексов поливалентных металл-ионовили С(Ш) в качестве катализаторов. Пример 1. Из данных, представленных в табл. 1, следует, что для этанольно-сульфатных электролитов-реперов с низким содержанием этанола потенциал начала анодной конверсии этанола снижается с увеличением рН. В присутствии в электролите гидроксокомплексов потенциал начала разложения этанола снижается на 0,1-0,2 В по сравнению с фоновым электролитом. Максимальный ток конверсии этанола в этом случае возрастает на 30-37 . 3 12146 1 2009.08.30 Таблица 1 Параметры анодной конверсии этанола. Состав электролита 250,1 моль/дм 3 42-510-2 моль/дм 3. Температура 20 С. Потенциодинамический режим поляризации со скоростью развертки 0,05 В/с. Концентрация рН рас- Потенциал Потенциал, соот- Максимальный металл-иона твора начала раз- ветствующий мак- ток конверсии-3 7 3,75 0,26 0,74 2,38 110 Пример 2. Результаты, представленные в табл. 2, показывают, что в этанольно-сульфатных электролитах с содержанием 253 моль/дм 3 потенциал начала анодной конверсии этанола снижается с увеличением рН. В присутствии в электролите гидроксокомплексов,потенциал начала анодной конверсии этанола снижается на 0,2-0,4 В. Эта закономерность в большей степени характерна для гидроксокомплексов . Потенциалы, соответствующие максимальным токам конверсии этанола, на 0,1-0,2 В выше в присутствии гидроксокомплексов , , чем для фоновых растворов. Это связано со значительным увеличением максимального тока конверсии этанола в 3-6 раз. Таблица 2 Параметры анодной конверсии этанола. Состав электролита 253,0 моль/дм 3 42-510-2 моль/дм 3. Температура 20 С. Потенциодинамический режим поляризации со скоростью развертки 0,05 В/с. Потенциал, соотПотенциал Концентрация ветствующий мак- Максимальныйрас рас- начала разметалл-иона,симальному току ток конверсии твора твора ложения моль/дм 3 конверсии этанола, этанола, мА/см 2 этанола, В В 1 репер 0 2,0 0,55 0,86 3,0 2 репер 0 2,56 0,5 0,84 3,4 3 репер 0 3,5 0,5 0,84 3,4 4 репер 0 4,5 0,44 0,90 3,5 Продолжение таблицы 2 Потенциал, соотПотенциал ветствующий мак- Максимальный начала разсимальному току ток конверсии ложения конверсии этанола, этанола, мА/см 2 этанола, В В 0,1 1,03 10,0 0,0 1,02 15,3 0,0 1,06 19,5 Хорошо известно, что с увеличением тока растет поляризация электрода. Результаты, представленные в табл. 2, показывают, что возрастание максимального тока конверсии этанола значительно выше в присутствии гидроксокомплексов ,по сравнению с незначительным увеличением потенциала. Максимальные токи конверсии этанола достигаются в том случае, когда гидроксокомплексы ,в этанольно-сульфатных электролитах присутствуют в виде полиядерных гидроксокомплексов. Образование в свою очередь полиядерных гидроксокомплексов ,определяется величиной рН и концентрацией ионов металлов. Так для концентрации 110-3 моль/дм 3 рН образования гидроксокомплексов равно 4-4,5, а для концентрации 510-3 моль/дм 3 рН образования гидроксокомплексов равно 2,0-2,65. Соответственно для этих значений рН наблюдаем максимальные токи конверсии этанола. При более высоких содержанияхсвыше 510-3 моль/дм 3 происходит образование коллоидных осадков в исследуемой области рН. Пример 3. Таблица 3 Параметры анодной конверсии этанола. Состав электролита 258,0 моль/дм 3 42-510-2 моль/дм 3. Температура 20 С. Потенциодинамический режим поляризации со скоростью развертки 0,05 В/с. Потенциал, соотКонцентрация Потенциал ветствующий мак- Максимальныйрасметалл-иона рН рас- начала разсимальному току ток конверсии твора 12146 1 2009.08.30 При повышении содержания этанола в электролите до 8 моль/дм 3 потенциал начала анодной конверсии этанола (табл. 3) практически не изменяется. Снижение потенциала начала анодного разложения этанола, как и в выше приведенных примерах, определяется величиной рН и присутствием гидроксокомплексов . Потенциал, соответствующий максимальному току конверсии этанола практически не изменяется с изменением рН в концентрированном этанольно-сульфатном электролите. Максимальный ток анодной конверсии этанола в присутствии гидроксокомплексовв 2-6 раз превышает величины токов для фоновых электролитов в области рН, соответствующей образованию полиядерных гидроксокомплексов . Влияние полиядерных гидроксокомплексов ,на интенсификацию процесса анодной конверсии этанола в указанной области рН, наиболее вероятно, обусловлено образованием поверхностных комплексов с переносом заряда (ПКПЗ). Образование ПКПЗ в таких средах обусловлено конкурирующей адсорбцией, переносом части заряда неподеленной пары электронов воды, этанола в свободную зону металлических анодов. Глубина этого процесса зависит от потенциала электрода. Необходимо отметить, что присутствие ПКПЗ в водных, водно-этанольных электролитах увеличивает их протонодонорную активность. Таким образом, предлагаемый способ электролитического получения водорода с использованием дешевых, растворенных в электролите катализаторов - полиядерных гидроксокомплексов поливалентных металл-ионов, обладающих высокой активностью,позволяет интенсифицировать процесс, снизить напряжение разложения этанола и поляризационные потери. Напряжение разложения этанола до С 2 на 0,3 В ниже в присутствии полиядерных гидроксокомплексов ,по сравнению с фоновым электролитом. Предложенный способ повышает эффективность процесса электролиза благодаря присутствию катализаторов в виде растворимых полиядерных гидроксокомплексов поливалентных металл-ионов и за счет деполяризации анодного процесса возобновляемым сырьем - этанолом. Источники информации 1. Патент Франции 2809420, МПК С 25 В 1/02, В 0119/08, 2001. 2. Патент США 6533919, МПК С 25 В 1/02, 2004. 3. Патент ЕПВ 1298089, МПК С 01 В 3/32, В 01 23/80, 2003. 4. Патент США 6368492, МПК С 25 В 1/02, 2002. 5. Заявка РФ 2001128256/15, МПК С 25 В 1/02, 2004. 6. ТОМИЛОВ А.П. и др. Электрохимия органических соединений. - Ленинград Химия, 1968. - С. 325 (прототип). Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 6
МПК / Метки
МПК: C25B 1/00
Метки: водорода, получения, способ
Код ссылки
<a href="https://by.patents.su/6-12146-sposob-polucheniya-vodoroda.html" rel="bookmark" title="База патентов Беларуси">Способ получения водорода</a>
Предыдущий патент: Ориентатор гибкой трубы
Следующий патент: Система калибров валков черновой группы клетей непрерывного сортопрокатного стана
Случайный патент: Матричный вычислитель