Способ определения стимулирующего или ингибирующего действия водного растительного экстракта на рост тест-штамма микроорганизма – дрожжевого или плесневого гриба
Номер патента: 14977
Опубликовано: 30.10.2011
Авторы: Мельникова Людмила Александровна, Дудчик Наталья Владимировна, Филонов Валерий Петрович, Лилишенцева Анна Николаевна, Колядич Елена Сергеевна, Иващенко Наталья Ивановна
Текст
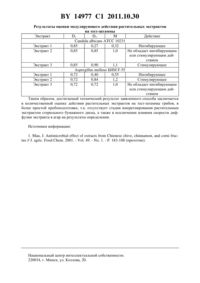
(51) МПК НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СПОСОБ ОПРЕДЕЛЕНИЯ СТИМУЛИРУЮЩЕГО ИЛИ ИНГИБИРУЮЩЕГО ДЕЙСТВИЯ ВОДНОГО РАСТИТЕЛЬНОГО ЭКСТРАКТА НА РОСТ ТЕСТ-ШТАММА МИКРООРГАНИЗМА ДРОЖЖЕВОГО ИЛИ ПЛЕСНЕВОГО ГРИБА(71) Заявитель Государственное учреждение Республиканский научнопрактический центр гигиены(72) Авторы Дудчик Наталья Владимировна Филонов Валерий Петрович Колядич Елена Сергеевна Мельникова Людмила Александровна Лилишенцева Анна Николаевна Иващенко Наталья Ивановна(73) Патентообладатель Государственное учреждение Республиканский научно-практический центр гигиены(57) Способ определения стимулирующего или ингибирующего действия водного растительного экстракта на рост тест-штамма микроорганизма - дрожжевого или плесневого гриба, заключающийся в том, что культивируют тест-штамм микроорганизма при температуре 20-28 С в жидкой питательной среде, в которую внесен растительный экстракт, а также в жидкой питательной среде, в которую внесен экстрагент - вода, каждые 4 часа измеряя оптическую плотность суспензий тест-штамма при длине волны 540 нм до достижения ее максимального значения, соответствующего наступлению стационарной фазы роста тест-штамма, после чего рассчитывают отношение М оптической плотности суспензии в стационарной фазе роста тест-штамма в питательной среде с растительным экстрактом к оптической плотности суспензии в стационарной фазе роста тест-штамма в питательной среде с экстрагентом, и при М равном единице судят о том, что растительный экстракт не оказывает стимулирующего или ингибирующего действия на рост тестштамма, при М больше единицы оказывает стимулирующее, а при М меньше единицы оказывает ингибирующее действие на рост тест-штамма, при этом в качестве питательной среды используют среду с 4,0-5,4, содержащую, г/л глюкоза 10,01,0 сахароза 10,01,0 натрий азотнокислый 3,00,5 калий фосфорнокислый однозамещенный 1,00,5 магний сернокислый семиводный 0,70,2 калий хлористый 0,50,2 железо сернокислое 0,020,005 Изобретение относится к разделу гигиены питания, санитарной микробиологии и фармакологии. Известен способ оценки антимикробной активности растительных экстрактовс использованием тест-культур бактерий, заключающийся в том, что в центр поверхности засеянного тест-штаммами микроорганизмов питательного агара располагают диски из стерильной фильтровальной бумаги, предварительно импрегнированные растительным экстрактом, растирают поверхность питательного агара стеклянным шпателем, а затем чашки с посевами микроорганизмов инкубируют в термостате. После инкубации с помощью кронциркуля измеряют диаметр зоны просветления и выражают в мм диаметр зоны ингибирования роста микроорганизмов. Однако способ-прототип обладает низкой воспроизводимостью и чувствительностью,в связи с чем требуется длительное, до 24 часов, время проведения испытаний и не дает возможность оценить стимулирующее воздействие растительных экстрактов на микроорганизмы. Общими признаками для заявляемого способа и прототипа является то, что осуществляют параллельное внесение растительных экстрактов в питательную среду, содержащую ранее определенную концентрацию тест-культуры дрожжевых или плесневых грибов, и проводят их совместное культивирование с последующей обработкой полученных данных. Задачей заявленного изобретения является повышение воспроизводимости и чувствительности способа. Поставленная задача достигается следующим образом. Предложен способ определения стимулирующего или ингибирующего действия водного растительного экстракта на рост тест-штамма микроорганизма - дрожжевого или плесневого гриба, при этом культивируют тест-штамм микроорганизма при температуре 20-28 С в жидкой питательной среде, в которую внесен растительный экстракт, а также в жидкой питательной среде, в которую внесен экстрагент - вода, каждые 4 часа измеряя оптическую плотность суспензий тест-штамма при длине волны 540 нм до достижения ее максимального значения, соответствующего наступлению стационарной фазы роста тест-штамма, после чего рассчитывают отношениеоптической плотности суспензии в стационарной фазе роста тест-штамма в питательной среде с растительным экстрактом к оптической плотности суспензии в стационарной фазе роста тест-штамма в питательной среде с экстрагентом, и приравном единице судят о том, что растительный экстракт не оказывает стимулирующего или ингибирующего действия на рост тест-штамма, прибольше единицы - оказывает стимулирующее, а применьше единицы - оказывает ингибирующее действие на рост тест-штамма, при этом в качестве питательной среды используют среду с 4,0-5,4, содержащую, г/л глюкоза 101,0 сахароза 101,0 натрий азотнокислый 30,5 калий фосфорнокислый однозамещенный 10,5 магний сернокислый семиводный 0,70,2 калий хлористый 0,50,2 железо сернокислое 0,020,005 пептон ферментативный 50,5 вода остальное. 14977 1 2011.10.30 Мы исходили из того, что рост микроорганизмов на питательной среде имеет, как правило, несколько фаз лаг-фазу, выраженную фазу быстрого роста культуры (логарифмическую фазу), фазу замедления роста, стационарную фазу и фазу отмирания. Стационарная фаза роста характеризуется максимальным накоплением биомассы культуры. Поэтому для оценки модулирующей активности водных экстрактов растений целесообразно выбрать стационарную фазу роста, а накопление биомассы оценивать по оптическим показателям в жидкой питательной среде. Для этой цели был оптимизирован состав среды культивирования. Питательный состав должен быть сбалансирован таким образом,чтобы обеспечить нормальное развитие тест-микроорганизма, но при этом не должен маскировать как ингибирующее, так и стимулирующее действие растительных экстрактов. Кроме того, среда должна быть прозрачна, бесцветна (или слегка окрашена). Согласно нашим исследованиям, такими свойствами обычно обладают синтетические или полусинтетические питательные среды. Такой прием позволяет повысить чувствительность и воспроизводимость способа за счет того, что осуществляется регистрация оптической плотности суспензии микроорганизма в стационарной фазе развития роста тест-штамма в питательной среде предложенного состава, содержащей и не содержащей испытуемого экстракта. Пример выполнения. Требуется определить действие экстрактов пряноароматических и лекарственных растений. В качестве бактериальных тест-штаммов используют 10231,полученный из Всероссийской коллекции промышленных микроорганизмов, иБИМ -55, полученный из Национальной коллекции непатогенных микроорганизмов (научая коллекция типовых и промышленно-ценных микроорганизмов) Института микробиологии НАН Беларуси. Используемые штаммы были типичными по культурально-морфологическим и биохимическим свойствам. Для приготовления рабочих культур производят отсев бактериальных тест-штаммов на косяки мясопептонного агара, содержащего 0,1 глюкозы и 0,2 дрожжевого экстракта, и инкубируют в термостате при (241) С в течение 18-24 ч. Смывы с косяков производят стерильным 0,85 -ным физиологическим раствором. Концентрацию клеток доводят до 105 КОЕ/см 3, используют оптический стандарт мутности на 10 ед. Состав среды культивирования, г/л глюкоза 101,0 сахароза 101,0 натрий азотнокислый - 30,5 калий фосфорнокислый однозамещенный - 10,5 магний сернокислый семиводный - 0,70,2 калий хлористый - 0,50,2 железо сернокислое - 0,020,005 пептон ферментативный - 50,5,4,0 - 5,4. В пробирки объемом 50 см 3 с 10 см 3 среды культивирования указанного состава вносят 3 объемныхсуспензии микроорганизмов с начальной концентрацией 105 КОЕ/см 3. Для оценки действия экстрактов в пробирки с питательной средой добавляют 5 объемныхводных экстрактов. Контролем служит питательная среда с внесенной суспензией микроорганизмов с равным объемом воды вместо экстракта. Культивируют при оптимальной для данных микроорганизмов температуре 20-28 С до достижения стационарной фазы роста. Во время проведения эксперимента проводят измерения оптической плотности культуры. Пробы отбирают в количестве 2 см 3 в начале опыта и через каждые 4 часа,соблюдая правила асептики. Рост микроорганизмов оценивают оптически по плотности клеточной культуры. Измерения проводят не менее чем в трех повторностях для каждого экстракта на спектрофотоколориметре при длине волны 540 нм, длина оптического пути составляет 1 см. Получены следующие результаты (таблица). 14977 1 2011.10.30 Результаты оценки модулирующего действия растительных экстрактов на тест-штаммы Экстракт 1 2 Действие 10231 Экстракт 1 0,85 0,27 0,32 Ингибирующее Экстракт 2 0,85 0,85 1,0 Не обладает ингибирующим или стимулирующим действием Экстракт 3 0,85 0,90 1,1 СтимулирующееБИМ -55 Экстракт 1 0,72 0,40 0,55 Ингибирующее Экстракт 2 0,72 0,84 1,2 Стимулирующее Экстракт 3 0,72 0,72 1,0 Не обладает ингибирующим или стимулирующим действием Таким образом, достигаемый технический результат заявленного способа заключается в количественной оценке действия растительных экстрактов на тест-штаммы грибов, в более простой пробоподготовке, т.к. отсутствует стадия импрегнирования растительным экстрактом стерильного бумажного диска, а также в исключении влияния скорости диффузии экстракта в агар на результаты определения. Источники информации 1. , ., ,// . .. 2001. - . 49. - о. 1. - . 183-188 (прототип). Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 4
МПК / Метки
МПК: C12Q 1/02
Метки: способ, стимулирующего, экстракта, растительного, ингибирующего, дрожжевого, действия, водного, определения, гриба, тест-штамма, или, рост, микроорганизма, плесневого
Код ссылки
<a href="https://by.patents.su/4-14977-sposob-opredeleniya-stimuliruyushhego-ili-ingibiruyushhego-dejjstviya-vodnogo-rastitelnogo-ekstrakta-na-rost-test-shtamma-mikroorganizma-drozhzhevogo-ili-plesnevogo-griba.html" rel="bookmark" title="База патентов Беларуси">Способ определения стимулирующего или ингибирующего действия водного растительного экстракта на рост тест-штамма микроорганизма – дрожжевого или плесневого гриба</a>
Предыдущий патент: Способ определения стимулирующего или ингибирующего действия растительного экстракта на рост тест-штамма бактерий семейства Enterococcaceae
Следующий патент: Защитный экран для термопары
Случайный патент: Подборщик-погрузчик плодов бахчевых культур