Способ интегрирования генов в определенные участки генома клеток млекопитающих посредством гомологичной рекомбинации и векторы для его выполнения
Номер патента: 7288
Опубликовано: 30.09.2005
Авторы: РЕФФ, Митчелл, И., МакЛЭХЛЕН, Карен, Ретта, БАРНЕТТ, Ричард, Спенс
Текст
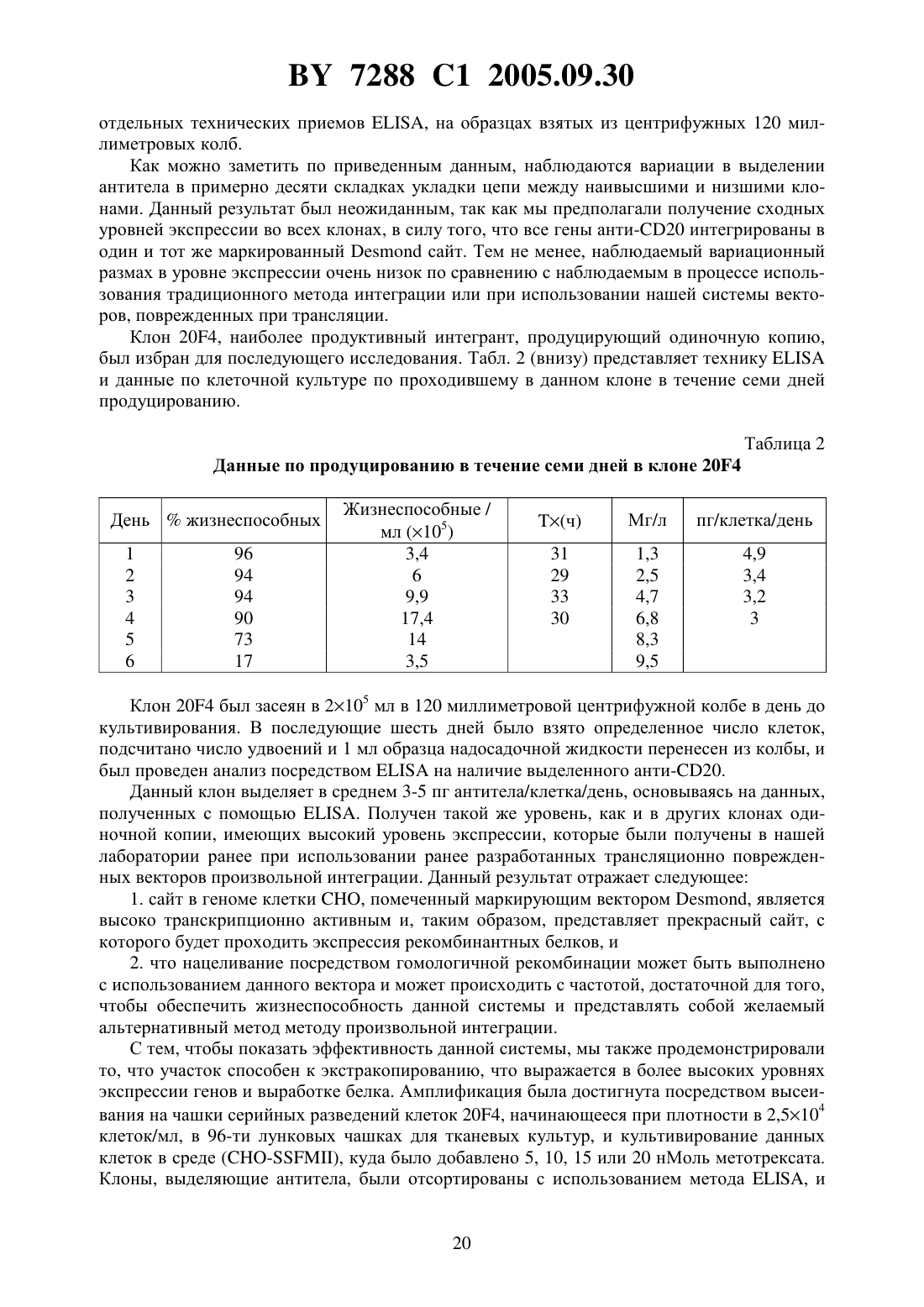
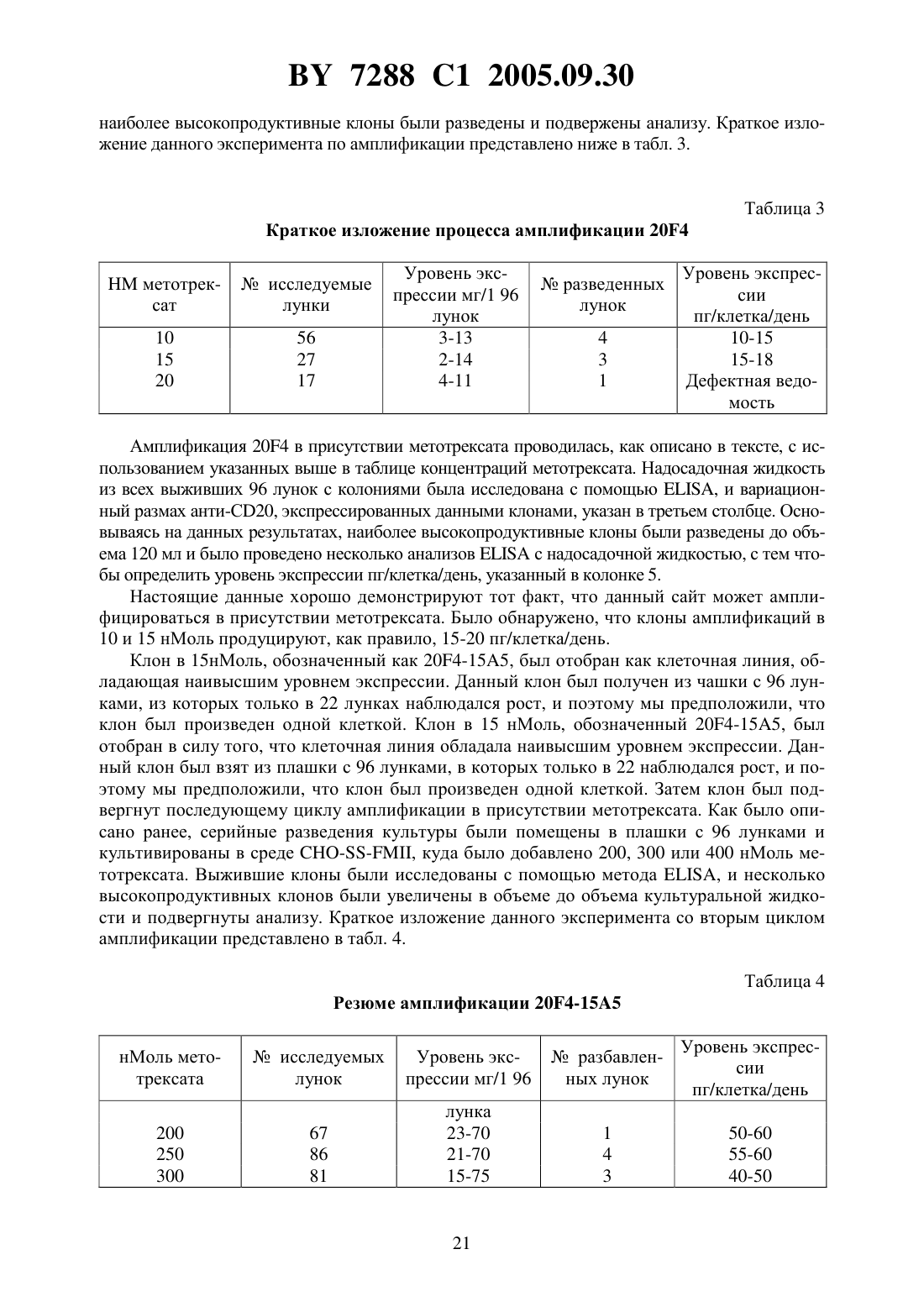
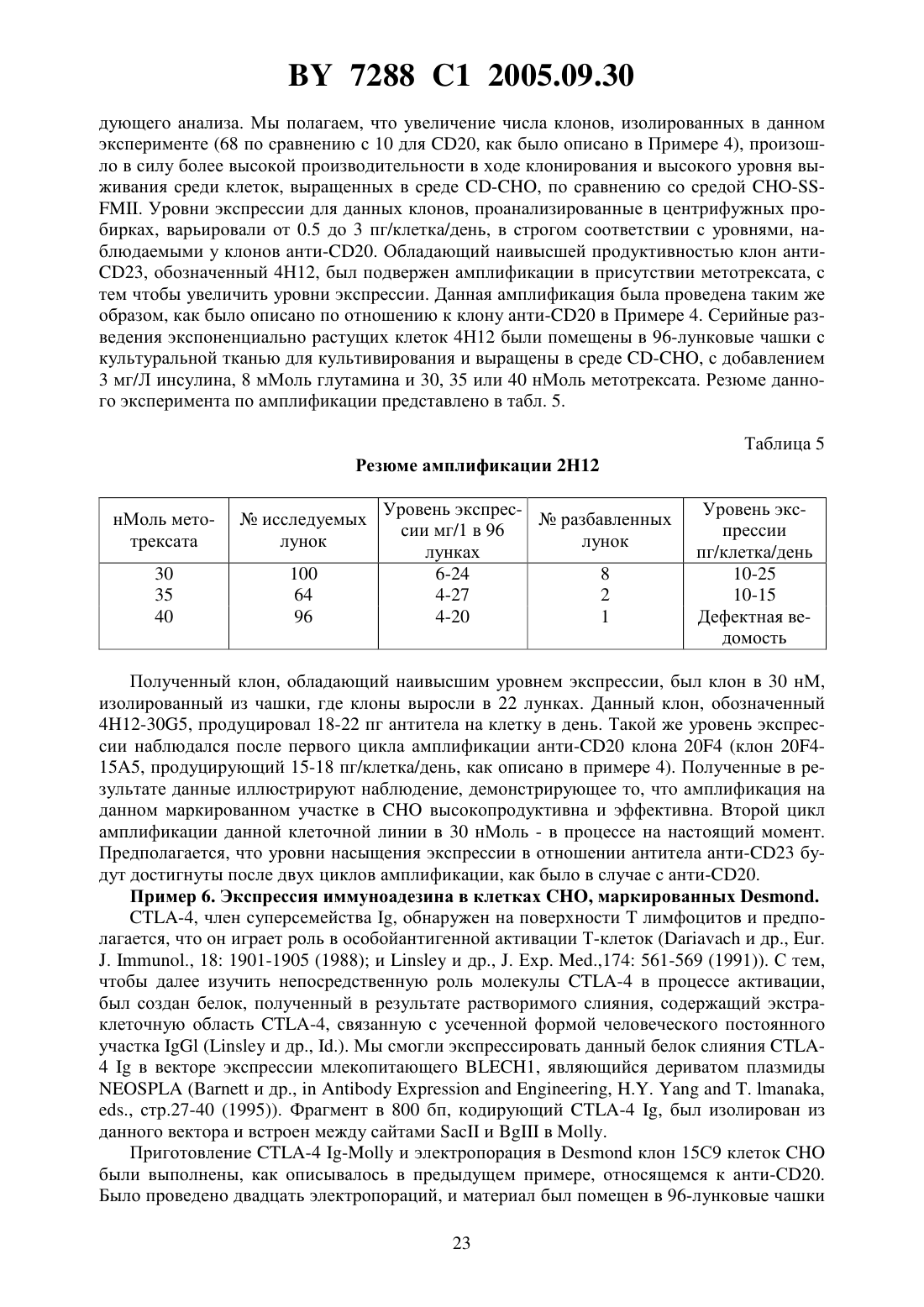
СПОСОБ ИНТЕГРИРОВАНИЯ ГЕНОВ В ОПРЕДЕЛЕННЫЕ УЧАСТКИ ГЕНОМА КЛЕТОК МЛЕКОПИТАЮЩИХ ПОСРЕДСТВОМ ГОМОЛОГИЧНОЙ РЕКОМБИНАЦИИ И ВЕКТОРЫ ДЛЯ ЕГО ВЫПОЛНЕНИЯ(71) Заявитель АЙДЕК Фармасьютикалс Корпорейшн(73) Патентообладатель АЙДЕК Фармасьютикалс Корпорейшн(57) 1. Способ вставки желаемой ДНК на целевой сайт генома в клетке млекопитающего,включающий следующие стадии трансфекцию или трансформацию клетки млекопитающего с помощью маркирующей плазмиды, содержащей следующие последовательности первый фрагмент ДНК, который содержит участок, являющийся гетерологичным геному клетки млекопитающего и который создает уникальный участок для проведения гомологичной рекомбинации после интеграции в геном клетки млекопитающего второй фрагмент ДНК, который содержит, по меньшей мере, один экзон гена, кодирующего белок первого избирательного маркера и третий фрагмент ДНК, который содержит участок, кодирующий белок второго избирательного маркера, отличающийся от белка первого избирательного маркера, и обеспечивает проведение отбора клеток млекопитающего, которые имеют указанную маркирующую плазмиду, интегрированную в геном клетки отбор клетки, содержащей маркирующую плазмиду, интегрированную в геном клетки, посредством тестирования на наличие экспрессии белка избирательного маркера,кодируемого указанным третьим фрагментом ДНК трансфекцию или трансформацию указанной клетки с помощью нацеливающей плазмиды, которая содержит, по меньшей мере, одну ДНК для вставки ее в геном указанной клетки и следующие последовательности четвертый фрагмент ДНК, который содержит участок, являющийся идентичным или в значительной степени гомологичным уникальному участку для проведения гомологичной рекомбинации в маркирующей плазмиде таким образом, что данный участок может рекомбинироваться с указанной ДНК маркирующей плазмиды посредством гомологичной рекомбинации пятый фрагмент ДНК, который содержит оставшийся экзон или оставшиеся экзоны гена, кодирующего белок первого избирательного маркера, которые не присутствуют в маркирующей плазмиде, где активный белок первого избирательного маркера продуцируется только в том случае, если, по меньшей мере, один экзон гена, кодирующего белок первого избирательного маркера, содержащийся в нацеливающей плазмиде, экспрессирован совместно с оставшимся экзоном или оставшимися экзонами гена, кодирующего белок первого избирательного маркера, содержащегося в маркирующей плазмиде и отбор клетки, содержащей нацеливающую плазмиду, интегрированную на уникальный участок для гомологичной рекомбинации, посредством тестирования на наличие экспрессии белка первого избирательного маркера. 2. Способ по п. 1, отличающийся тем, что, по меньшей мере, одна ДНК для вставки в геном указанной клетки, кодирует желаемый белок. 3. Способ по п. 2, отличающийся тем, что желаемый белок является белком млекопитающего. 4. Способ по п. 3, отличающийся тем, что белок является иммуноглобулином. 5. Способ по п. 1, отличающийся тем, что, по меньшей мере, одна ДНК для вставки в геном указанной клетки вставляется рядом с экзоном указанного первого избирательного маркера, содержащегося в нацеливающей плазмиде. 6. Способ по п. 1, отличающийся тем, что белок первого избирательного маркера выбирают из группы, включающей неомицинфосфотрансферазу, гистидинолдегидрогеназу, дигидрофолатредуктазу, гидромицинфосфотрансферазу, тимидинкиназу вируса простого герпеса, аденозиндеаминазу, глутаминсинтетазу и гипоксантингуанинфосфорибозилтрансферазу. 7. Способ по п. 6, отличающийся тем, что, по меньшей мере, один экзон гена, кодирующего белок первого избирательного маркера в маркирующей плазмиде, содержит участок гена неомицинфосфотрансферазы, и оставшиеся экзоны в нацеливающей плазмиде содержат оставшиеся участки указанного гена неомицинфосфотрансферазы. 8. Способ по п. 1, отличающийся тем, что включает определение уровней РНК второго избирательного маркера, содержащегося в указанном третьем фрагменте ДНК маркирующей плазмиды до интеграции целевого вектора. 9. Способ по п. 1, отличающийся тем, что белок второго избирательного маркера, который отличается от белка первого избирательного маркера, выбирают из группы, включающей неомицинфосфотрансферазу, гистидинолдегидрогеназу, дигидрофолатредуктазу,гидромицинфосфотрансферазу, тимидинкиназу вируса простого герпеса, аденозиндеаминазу, глутаминсинтетазу и гипоксантингуанинфосфорибозилтрансферазу. 2 7288 1 2005.09.30 10. Способ по п. 1, отличающийся тем, что маркирующая или нацеливающая плазмиды содержат ДНК, кодирующую белок третьего доминантного избирательного маркера,который отличается от белков первого и второго избирательных маркеров. 11. Способ по п. 10, отличающийся тем, что экспрессия ДНК, кодирующей указанный белок третьего доминанантного избирательного маркера, позволяет осуществить амплификацию указанной ДНК для вставки в геном указанной клетки. 12. Способ по п. 11, отличающийся тем, что белок третьего доминантного избирательного маркера является дигидрофолатредуктазой. 13. Способ по п. 1, отличающийся тем, что клетку млекопитающего выбирают из группы, включающей клетку яичника китайского хомячка (СНО), клетку миеломы, клетку почек детеныша хомячка, клетку , клетку , клеткуи клетку 3 Т 3. 14. Способ по п. 13, отличающийся тем, что клетка представляет собой клетку СНО. 15. Способ по п. 1, отличающийся тем, что маркирующая плазмида содержит редкую последовательность рестрикционной эндонуклеазы, встроенную в участок в первом фрагменте ДНК маркирующей плазмиды, что обеспечивает создание уникального участка для проведения гомологичной рекомбинации. 16. Способ по п. 1, отличающийся тем, что участок ДНК в первом фрагменте ДНК,который обеспечивает создание уникального участка для проведения гомологичной рекомбинации, состоит, по крайней мере, из 300 нуклеотидов. 17. Способ по п. 16, отличающийся тем, что размер участка ДНК в первом фрагменте ДНК, который обеспечивает создание уникального участка для проведения гомологичной рекомбинации, варьирует в пределах 300-20 тысяч нуклеотидов. 18. Способ по п. 17, отличающийся тем, что предпочтительная разница в размере участка ДНК в первом фрагменте ДНК, который обеспечивает создание уникального участка для проведения гомологичной рекомбинации, варьирует от 2 тысяч до 10 тысяч нуклеотидов. 19. Способ по п. 1, отличающийся тем, что ДНК, кодирующая белок первого избирательного маркера, разделена, по крайней мере, на три экзона. 20. Способ по п. 1, отличающийся тем, что участок ДНК в первом фрагменте ДНК,который обеспечивает создание уникального участка для проведения гомологичной рекомбинации, является ДНК бактерии, ДНК насекомого, ДНК вируса или искусственно созданной ДНК. 21. Способ по п. 20, отличающийся тем, что участок ДНК в первом фрагменте ДНК,который обеспечивает создание уникального участка для проведения гомологичной рекомбинации, не содержит функциональных генов. 22. Способ по п. 1, отличающийся тем, что маркирующая плазмида содержит последовательность нуклеотидов плазмиды , представленной на фиг. 7. 23. Способ по п. 1, отличающийся тем, что нацеливающая плазмида содержит последовательность нуклеотидов плазмиды , представленной на фиг. 8, и нацеливающая плазмида может иметь последовательности нуклеотидов, кодирующих полипептиды антител анти-20. 24. Способ по п. 1, отличающийся тем, что нацеливающая плазмида содержит последовательность нуклеотидов плазмиды , представленной на фиг. 10, и нацеливающая плазмида может иметь последовательности нуклеотидов, кодирующих полипептиды антител анти-23. 25. Система векторов для вставки желаемой ДНК на целевой сайт генома клетки млекопитающего, содержащая, по крайней мере, следующее первый фрагмент ДНК, который содержит участок ДНК, являющийся гетерологичным геному клетки млекопитающего, и который создает уникальный участок для осуще 3 7288 1 2005.09.30 ствления процесса гомологичной рекомбинации будучи интегрированным в геном клетки млекопитающего, второй фрагмент ДНК, который содержит, по меньшей мере, один экзон гена, кодирующего белок первого избирательного маркера и третий фрагмент ДНК, который содержит участок, кодирующий белок второго избирательного маркера, отличающаяся от белка первого избирательного маркера, и обеспечивает проведение отбора клеток млекопитающего, которые имеют указанную маркирующую плазмиду, интегрированную в геном клетки и нацеливающую плазмиду, которая содержит, по меньшей мере, одну ДНК для вставки в геном указанной клетки и следующие последовательности четвертый фрагмент ДНК, который содержит участок, являющийся идентичным или в значительной степени гомологичным уникальному участку для проведения гомологичной рекомбинации в маркирующей плазмиде таким образом, что данный участок ДНК может быть рекомбинирован с указанной ДНК маркирующей плазмиды посредством гомологичной рекомбинации пятый фрагмент ДНК, который содержит оставшийся экзон или оставшиеся экзоны гена, кодирующего белок первого избирательного маркера, которые не присутствуют в маркирующей плазмиде, где, по меньшей мере, один экзон гена, кодирующего белок первого избирательного маркера в маркирующей плазмиде, и оставшийся экзон или оставшиеся экзоны гена, кодирующего белок первого избирательного маркера в нацеливающей плазмиде, вместе кодируют активный белок первого избирательного маркера. 26. Система векторов по п. 25, отличающаяся тем, что, по меньшей мере, одна ДНК для вставки в геном указанной клетки кодирует желаемый белок. 27. Система векторов по п. 26, отличающаяся тем, что желаемый белок является белком млекопитающего. 28. Система векторов по п. 27, отличающаяся тем, что белок является иммуноглобулином. 29. Система векторов по п. 25, отличающаяся тем, что, по меньшей мере, одна ДНК для вставки в геном указанной клетки вставляется рядом с экзоном указанного первого избирательного маркера, содержащегося в нацеливающей плазмиде. 30. Система векторов по п. 25, отличающаяся тем, что белок первого избирательного маркера выбирают из группы, включающей неомицинфосфотрансферазу, гистидинолдегидрогеназу, дигидрофолатредуктазу, гидромицинфосфотрансферазу, тимидинкиназу вируса простого герпеса, аденозиндеаминазу, глутаминсинтетазу и гипоксантингуанинфосфорибозилтрансферазу. 31. Система векторов по п. 30, отличающаяся тем, что, по меньшей мере, один экзон гена, кодирующего белок первого избирательного маркера в маркирующей плазмиде, содержит участок гена неомицинфосфотрансферазы, а оставшиеся экзоны в нацеливающей плазмиде, содержат оставшиеся участки указанного гена неомицинфосфотрансферазы. 32. Система векторов по п. 25, отличающаяся тем, что белок второго избирательного маркера, который отличается от белка указанного первого избирательного маркера, выбирают из группы, включающей неомицинфосфотрансферазу, гистидинолдегидрогеназу, дигидрофолатредуктазу, гидромицинфосфотрансферазу, тимидинкиназу вируса простого герпеса, аденозиндеаминазу, глутаминсинтетазу и гипоксантингуанинфосфорибозилтрансферазу. 33. Система векторов по п. 25, отличающаяся тем, что маркирующая или нацеливающая плазмида содержит ДНК, кодирующую белок третьего доминантного избирательного маркера, который отличается от белков первого и второго избирательных маркеров. 34. Система векторов по п. 33, отличающаяся тем, что экспрессия ДНК, кодирующей белок третьего доминантного избирательного маркера, позволяет осуществить амплификацию указанной ДНК для вставки в геном указанной клетки. 7288 1 2005.09.30 35. Система векторов по п. 34, отличающаяся тем, что белок третьего доминантного избирательного маркера является дигидрофолатредуктазой. 36. Система векторов по п. 25, отличающаяся тем, что клетку млекопитающего выбирают из группы, включающей клетку яичника китайского хомячка (СНО), клетку миеломы, клетку почек детеныша хомячка, клетку , клетку , клеткуи клетку 33. 37. Система векторов по п. 36, отличающаяся тем, что клетка млекопитающего представляет собой клетку СНО. 38. Система векторов по п. 25, отличающаяся тем, что маркирующая плазмида содержит редкую последовательность рестрикционной эндонуклеазы, встроенной в участок ДНК в первом фрагменте ДНК маркирующей плазмиды, что обеспечивает создание уникального участка для проведения гомологичной рекомбинации. 39. Система векторов по п. 25, отличающаяся тем, что уникальный участок ДНК в первом фрагменте ДНК, который обеспечивает создание уникального участка для проведения гомологичной рекомбинации, составляет, по меньшей мере, 300 нуклеотидов. 40. Система векторов по п. 39, отличающаяся тем, что размер участка ДНК в первом фрагменте ДНК, который обеспечивает создание уникального участка для проведения гомологичной рекомбинации, варьирует в пределах 300-20 тысяч нуклеотидов. 41. Система векторов по п. 40, отличающаяся тем, что размер участка ДНК в первом фрагменте ДНК, который обеспечивает создание уникального участка для проведения гомологичной рекомбинации варьирует в пределах 2 тысяч - 10 тысяч нуклеотидов. 42. Система векторов по п. 25, отличающаяся тем, что ДНК, кодирующая белок первого избирательного маркера, разделена, по меньшей мере, на три экзона. 43. Система векторов по п. 25, отличающаяся тем, что участок ДНК в первом фрагменте ДНК, который обеспечивает создание уникального участка для проведения гомологичной рекомбинации, представляет собой ДНК бактерии, ДНК насекомого, ДНК вируса или искусственно созданную ДНК. 44. Система векторов по п. 43, отличающаяся тем, что участок ДНК в первом фрагменте ДНК, который обеспечивает создание уникального участка для проведения гомологичной рекомбинации, не содержит никаких функциональных генов. 45. Система векторов по п. 25, отличающаяся тем, что маркирующая плазмида содержит последовательность нуклеотидов плазмиды , представленной на фиг. 7. 46. Система векторов по п. 25, отличающаяся тем, что нацеливающая плазмида содержит последовательность нуклеотидов плазмиды , представленной на фиг. 8, и нацеливающая плазмида может иметь последовательности нуклеотидов, кодирующих полипептиды антител анти-20. 47. Система векторов по п. 25, отличающаяся тем, что нацеливающая плазмида содержит последовательность нуклеотидов плазмиды , представленной на фиг. 10, и нацеливающая плазмида может иметь последовательности нуклеотидов, кодирующих полипептиды антител анти-23. Настоящее изобретение относится к способу достижения интеграции желаемой экзогенной ДНК с особым участком внутри генома клетки млекопитающего. В частности,изобретение описывает новый метод идентификации транскрипционно активного желаемого целевого участка - горячей точки в геноме млекопитающего и вставки желаемой экзогенной ДНК на данный участок посредством гомологичной рекомбинации. Изобретение также предоставляет возможность для амплификации гена желаемой ДНК на данном участке посредством ко-интеграции амплифицированного избирательного маркера, например,(дигидрофолатредуктазы), в комбинации с экзогенной ДНК. Изобретение также описывает создание новых векторов, подходящих для выполнения вышесказанного 5 7288 1 2005.09.30 и, более того, обеспечивает создание клеточных линий млекопитающих, содержащих желаемую экзогенную ДНК, интегрированную в целевой участок. Технология экспрессии рекомбинантных белков в организмах прокариотах и эукариотах широко известна. Клетки млекопитающих имеют огромные преимущества перед клетками бактерий и дрожжей в отношении производства белка, что исходит из их способности правильно собирать, гликозилировать и, после осуществления трансляции, модифицировать рекомбинантные белки. После трансфекции в клетку-реципиент конструкции,полученные в результате рекомбинантной экспрессии, могут сохраняться в виде внехромосомных элементов или же могут быть интегрированными в геном клетки-реципиента. Генерация постоянно трансфектируемых клеточных линий млекопитающих обычно включает в себя последнее конструкция ДНК, кодирующая интересующий ген, а также ген, устойчивый к лекарственному препарату (доминантный избирательный маркер),представлены в клетке-реципиенте, и последующий рост в присутствии препарата позволяет отобрать среди клеток те, которые успешно интегрировали экзогенную ДНК. Во многих случаях интересующий ген связан с устойчивым к препарату избирательным маркером, который позднее может быть подвержен генной амплификации. Ген, кодирующий диоксифолатредуктазу , чаще всего используется в этих целях. Культивирование клеток в присутствии метотрексата, конкурентного ингибитора , приводит к повышению производствапосредством амплификации гена . После амплификации фланкирующих областей ДНК ко-амплификация гена, связанного св трансформированной клеточной линии, может привести к повышению производства белка, что таким образом отразится на высоком уровне экспрессии интересующего гена. Хотя данный подход и оказался успешным, существует ряд проблем в системе в силу произвольной природы интеграционного процесса. Эти проблемы существуют в силу того, что уровни экспрессии в большой степени подвержены влиянию локальной генетической среды в локусе гена, явление широко описанное в литературе и обычно называемое эффектом положения (например, у - и др., . . ., 10 1192-1198 (1990)и др., ., 7 1296-1299 (1987. В подавляющем большинстве у млекопитающих ДНК находится в транскрипционно неактивном состоянии, а произвольные способы интеграции не обеспечивают контроля за процессом транскрипции интегрированной ДНК. Следовательно, возможны широкие изменения в уровне экспрессии интегрированных генов, что зависит от участка интеграции. Например,интеграция экзогенной ДНК с неактивным или транскрипционно безмолвным участком генома вызовет низкую экспрессию или не вызовет ее вообще. В обратном случае, интеграция с транскрипционно активным участком приведет к высокому уровню экспрессии. Поэтому, когда целью работы является получение высокого уровня экспрессии гена, что обычно является желаемым результатом методов генной инженерии, чаще всего необходимо проверить большое число трансфектантов для того, чтобы найти такой высокопродуктивный клон. Кроме того, произвольная интеграция экзогенной ДНК в геном может в некоторых случаях разорвать связи между важными клеточными генами, что приведет к изменению фенотипа. Эти факторы могут определить культивирование высокоэкспрессивных устойчивых клеточных линий млекопитающих как сложный и трудоемкий процесс. Недавно нашей лабораторией был описан способ использования при экспрессии генов млекопитающих векторов ДНК, содержащих поврежденные в процессе трансляции доминантные избирательные маркеры (патент США 5648267). Данные векторы содержат поврежденный в процессе трансляции ген неомицинфосфотрансферазы (нео) в качестве доминантного избирательного маркера, искусственно созданного и содержащего интрон, в который встраивается ген , наряду с интересующим геном или генами. Было обнаружено, что использование таких векторов в качестве экспрессивных конструкций значительно снижает общее число создаваемых колоний, устойчивых к препарату, что таким образом облегчает процедуру отбора традицион 6 7288 1 2005.09.30 ных векторов экспрессии у млекопитающих. Более того, значительный процент полученных в результате использования данной системы клонов составляют клоны с высоким уровнем экспрессии. Данные результаты, очевидно, характерны для модификаций нового избирательного маркера. В силу повреждения неогена в процессе трансляции трансфектированные клетки не будут производить достаточное количество нео белка для того, чтобы выжить в процессе отбора, проводимого с помощью препарата, что таким образом отразится на снижении общего числа колоний, устойчивых к препарату. Кроме того, больший процент выживших клонов будет содержать вектор экспрессии, интегрированный с участком генома, обладающим высоким уровнем базальной транскрипции, что отразится на перепродуцировании нео и что, в свою очередь, позволит клеткам преодолеть препятствие,связанное с повреждением неогена. В то же время интересующие гены, связанные с нео,будут подвержены подобным повышенным уровням транскрипции. Это же преимущество также верно в результате искусственного создания интрона в нео выживание зависит от синтеза функционального неогена который, в свою очередь, зависит от правильного и эффективного сплайсирования нео интронов. Более того, данные критерии могут быть соблюдены в случае, если вектор ДНК интегрирован в участок, который уже обладал высокой транскрипционной активностью. После процесса интеграции вектора с транскрипционно активным участком амплификация гена производится с помощью отбора на наличие гена . С помощью данной системы стало возможным получение клонов с использованием низких уровней метотрексата (50 нМоль), содержащих небольшое количество (10) копий вектора, выделяющего высокий уровень белка (55 пг/клетка/день). Более того, данный результат может быть достигнут за относительно короткий промежуток времени. Однако амплификация не всегда проходит успешно. Некоторые транскрипционно активные участки не могут быть амплифицированы и, таким образом, нельзя предсказать частоту и величину амплификации на конкретном участке. В целом использование такого рода поврежденных в процессе трансляции векторов представляет собой значительное достижение на фоне других способов произвольной интеграции. Однако проблема отсутствия контроля за участком интеграции вызывает большую озабоченность. Один из подходов в решении проблемы произвольной интеграции представляет собой нацеливание гена, когда экзогенная ДНК направляется к определенному локусу в геномереципиенте. Экзогенная ДНК встраивается посредством гомологичной рекомбинации,происходящей между последовательностями ДНК в векторе экспрессии и соответствующей гомологичной последовательности в геноме. Однако, в то время как данный тип рекомбинации очень часто имеет место у дрожжей или других микроскопических грибов, у высших эукариотов такое явление чрезвычайно редко. В клетках млекопитающих частота гомологичных рекомбинаций в сравнении с негомологичными (произвольная интеграция) варьирует от 1/100 до 1/5000 (например, смотри , , 244 1288-1292 1989 и , . . ., 4 577-582, 1993). В одной из самых первых работ, описывающих гомологичную рекомбинацию в клетках млекопитающих, упоминается искусственная система, созданная в фибробластах мыши ( и др., , 44 419-428, 1986). Была создана клеточная линия, содержащая мутированный, нефункциональный вариант неогена, интегрированного в геном-реципиент, и впоследствии туда же была нацелена вторая нефункциональная копия нео, содержащая отличную от первой мутацию. Реконструкция функционального неогена может произойти только в случае использования гена в качестве мишени. Гомологические рекомбинанты были идентифицированы путем отбора клеток, устойчивых к 418, что было подтверждено анализом генома ДНК, изолированного от устойчивых клонов. В последнее время писалось об использовании гомологичной рекомбинации для замещения тяжелых и легких генов иммуноглобулина на эндогенных локусах в клетках, вы 7 7288 1 2005.09.30 деляющих антитела (патент США 5202238 и др., 1993). Однако данный подход не имеет широкого применения, так как он ограничивается продуцированием иммуноглобулинов в клетках, которые эндогенно производят экспрессию иммуноглобулинов, например, В-клетки и клетки - миеломы. Экспрессия также ограничивается одним уровнем генов-копий в силу того, что после гомологичной рекомбинации не происходит коамплификации. Способ далее усложняется тем фактом, что функциональный иммуноглобулин один для генов легкой цепи, за которыми следует другой для генов тяжелой цепи,должен продуцироваться в течение двух отдельных процессов интеграции. Еще одним примером такого типа системы является процесс, происходящий в клетках/0, где рекомбинантные иммуноглобулины экспрессированы посредством гомологичной рекомбинации в локус иммуноглобулина 2 ( и др., международная заявка /95/00014). Уровни экспрессии, полученные на данном участке, были чрезвычайно высоки - порядка 20 пг/клетка/день для одной копии интегранта. Однако, как было указано в предыдущем примере, экспрессия ограничена до данного уровня, так как амплифицирующий ген не ко-интегрирован в данной системе. Другими исследователями также было описано, что аберрантное гликозилирование рекомбинантных белков, экспрессированных в клетках /0 (например, смотрии др.,., 48 399-407, 1995), ограничивает применимость данного подхода. Рекомбинантная система - бактериофага Р 1 была недавно адаптирована и использована в качестве средства маркирования гена в клетках эукариотов. В частности, была описана особая интеграция экзогенной ДНК с участком генома Клеток Яичника Китайского Хомячкас использованиемрекомбиназы и сериисодержащих векторов ( и , . . . . , 89 7905-7909, 1992). Данная система привлекательна тем, что предусматривает репродуктивную экспрессию на одном и том же участке хромосомы. Однако не было сделано никаких попыток определить участок хромосомы, с которого экспрессия гена проходит оптимально, и, как в предыдущем примере,экспрессия ограничена одним уровнем копий в данной системе. Это усложняется также тем, что необходимо обеспечивать экспрессию функционального фермента рекомбиназы в клетке млекопитающего. Использование метода гомологичной рекомбинации между представленной последовательностью ДНК и ее эндогенным хромосомным локусом также должно являться полезным средством генетических манипуляций в клетках млекопитающих, а также в клетках дрожжей(смотри, например,и др., . ., 223 855-879, 1993) , , 244 1288-1292, 1989 и др., . .,194 281-301, 1991). На настоящее время большое число исследований маркирования гена у млекопитающих было направлено на разрыв гена (нокаут) или мутагенез особого участка в отобранных локусах гена-мишени в клетках эмбриона мыши . Создание данных моделей нокаута у мышей дало возможность ученым изучить особые структурно-функциональные результаты и изучить биологическую значимость большого числа генов мыши. Данная сфера исследования также имеет огромное значение в условиях применения возможной генной терапии. У(графство Кент, Великобритания) недавно были описаны намеренно нацеленные на транскрипционно активные участки в клеткахвекторы, не требующие амплификации генов ( и др., . . , 5 65-74 (1994. Однако,уровень секреции иммуноглобулина в данных клетках, не подвергавшихся амплификации,не превышает 20 пг/клетка/день, в то время как в амплифицированных клеткахмогут достигаться уровни в 100 пг/клетка/день. Хотелось бы разработать систему нацеливания генов, которая бы репродуктивно обусловливала интеграцию экзогенной ДНК с заранее определенным участком генома, обладающим транскрипционной активностью. Было бы также желательно, чтобы такого рода система нацеливания гена в последующем облегчала ко-амплификацию вставочной ДНК после процесса интеграции. Разработка такой системы позволит создать репродуктивный,8 7288 1 2005.09.30 высокий уровень экспрессии любого интересующего гена, клона в клетке млекопитающего. И, несомненно, вызовет значительный интерес у многих исследователей. Мы представляем новую систему экспрессии в клетках млекопитающих, основанную на гомологичной рекомбинации, имеющей место между двумя искусственными подложками, содержащимися в двух различных векторах. В частности, в данной системе используется комбинация двух новых векторов экспрессии у млекопитающих, названных нами как маркирующий вектор и нацеливающий вектор. Несомненно, что маркирующий вектор обеспечивает идентификацию и маркировку участка генома млекопитающего, обладающего транскрипционной активностью, т.е. участка с высоким уровнем экспрессии гена. Данный участок можно назвать горячей точкой генома. После интеграции маркирующего вектора рассматриваемая система экспрессии обеспечивает интеграцию другой ДНК с этим участком, т.е. нацеливающий вектор,посредством гомологичной рекомбинации, оказывается между последовательностями ДНК, общими для обоих векторов. Данная система имеет значительные преимущества перед другими системами гомологичной рекомбинации. В отличие от многих других гомологичных систем, имеющих место в клетках млекопитающего, данная система не имеет аналогов. Поэтому клетки, которые прошли только произвольную интеграцию вектора, не выживают в процессе отбора. Таким образом, любой интересующий ген, клонированный в намеченную плазмиду, имеет высокий уровень экспрессии на маркированной горячей точке. Соответственно, указанный метод генной экспрессии в значительной степени или полностью устраняет проблемы, присущие системам произвольной интеграции, детально описанные выше. Более того, данная система обеспечивает репродуктивную экспрессию и высокий уровень экспрессии любого рекомбинантного белка на одном и том же транскрипционно активном участке в геноме млекопитающего. К тому же, на амплификацию гена на данном конкретном транскрипционно активном участке можно воздействовать посредством включения доминантного избирательного амплифицированного маркера (например, ) как части маркирующего вектора. Таким образом, задачей изобретения является создание усовершенствованного метода нацеливания желаемой ДНК на особый участок в клетке млекопитающего. Более конкретно, задачей изобретения является обеспечение создания нового метода нацеливания желаемой ДНК на особый участок в клетке млекопитающего посредством гомологичной рекомбинации. Другой особой задачей изобретения является создание новых векторов для достижения интеграции желаемой ДНК с особым участком в клетке млекопитающего. Другой задачей изобретения является обеспечение новых клеточных линий млекопитающего, содержащих желаемую ДНК, интегрированную с заранее определенным участком, обеспечивающим высокий уровень экспрессии. Особой задачей изобретения является создание нового способа достижения интеграции желаемой ДНК с особым участком в клетке . Особой задачей изобретения является создание нового способа интеграции генов иммуноглобулина или других генов в клетки млекопитающих с заранее определенными участками хромосом, предусматривающих высокий уровень экспрессии. Другой особой задачей изобретения является создание новых векторов и комбинаций векторов, подходящих для интеграции генов иммуноглобулина в клетках млекопитающего с заранее определенными участками, что обеспечивает высокий уровень экспрессии. Другой задачей изобретения является создание клеточных линий млекопитающего,содержащих гены иммуноглобулина, интегрированные с заранее определенными участками, что обеспечивает высокий уровень экспрессии. Особой задачей изобретения является создание нового способа интеграции генов иммуноглобулина в клетки , что обеспечивает высокий уровень экспрессии, а также 7288 1 2005.09.30 создание новых векторов и комбинаций векторов, обеспечивающих такого рода интеграцию генов иммуноглобулина в клетках . В дополнение, особой задачей изобретения является создание новых клеточных линий, содержащих гены иммуноглобулина, интегрированные с заранее определенными участками (что обеспечивает высокую экспрессию), и амплификацию посредством отбора в присутствии метотрексата, для выделения большего количества функциональных иммуноглобулинов. Поставленные задачи решаются предлагаемым способом вставки желаемой ДНК на целевой сайт генома в клетке млекопитающего и системой векторов для его выполнения,Система векторов содержит маркирующую плазмиду и нацеливающую плазмиду. Маркирующая плазмида содержит следующие последовательности первый фрагмент ДНК, который содержит участок, являющийся гетерологичным геному клетки млекопитающего, и который создает уникальный участок для проведения гомологичной рекомбинации после интеграции в геном клетки млекопитающего второй фрагмент ДНК, который содержит, по меньшей мере, один экзон гена, кодирующего белок первого избирательного маркера и третий фрагмент ДНК, который содержит участок, кодирующий белок второго избирательного маркера, отличающийся от белка первого избирательного маркера, и обеспечивает проведение отбора клеток млекопитающего, которые имеют указанную маркирующую плазмиду, интегрированную в геном клетки. Нацеливающая плазмида содержит,по меньшей мере, одну ДНК для вставки в геном указанной клетки и следующие последовательности четвертый фрагмент ДНК, который содержит уникальный участок, являющийся идентичным или в значительной степени гомологичным уникальному участку для проведения гомологичной рекомбинации в маркирующей плазмиде таким образом, что данный участок ДНК может быть рекомбинирован с указанной ДНК маркирующей плазмиды посредством гомологичной рекомбинации пятый фрагмент ДНК, который содержит оставшийся экзон или оставшиеся экзоны гена, кодирующего белок первого избирательного маркера, которые не присутствуют в маркирующей плазмиде, где, по меньшей мере, один экзон гена, кодирующего белок первого избирательного маркера в маркирующей плазмиде, и оставшийся экзон или оставшиеся экзоны гена, кодирующего белок первого избирательного маркера в нацеливающей плазмиде, вместе кодируют активный белок первого избирательного маркера. Способ включает следующие стадии трансфекцию или трансформацию клетки млекопитающего с помощью маркирующей плазмиды отбор клетки, содержащей маркирующую плазмиду, интегрированную в геном клетки, посредством тестирования на наличие экспрессии белка избирательного маркера, кодируемого указанным третьим фрагментом ДНК трансфекцию или трансформацию указанной клетки с помощью нацеливающей плазмиды отбор клетки, содержащей нацеливающую плазмиду, интегрированную на уникальный участок для гомологичной рекомбинации, посредством тестирования на наличие экспрессии белка первого избирательного маркера. Изобретение поясняется графическими изображениями. Фиг. 1 отображает карту маркирующей плазмиды, в соответствии с изобретением называемой . Плазмида представлена в форме круга (1 А), а также в виде линии, используемой для трансфекции (1). Фиг. 2 (А) отображает карту нацеливающей плазмиды, называемой .представлена здесь в процессе кодирования генов иммуноглобулина анти-20, экспрессия которых описана в примере 1. 10 7288 1 2005.09.30 Фиг. 2 отображает линейную версиюпосле расщепления в присутствии ферментов рестрикции 1 и 1. Данная линейная форма использовалась для трансфекции. Фиг. 3 отображает возможное расположение между последовательностями , интегрированными в геном клеток , и последующей нацеливающей последовательности. Возможно также расположение , интегрированной впосле гомологичной рекомбинации. Фиг. 4 отображает Саузерн анализ единственной копии клонов . Приводятся следующие модели Строка 1 маркер размера ДНК Строка 2 клон 103 Строка 3 клон 1012 Строка 4 клон 15 С 9 Строка 5 клон 14 В 5 Строка 6 клон 9 В 2 Фиг. 5 отображает Нозерн анализ одной копии клонов . Приводятся следующие модели Панель А нозерн исследован зондамии , как указано на фигуре. Панель В дублирует нозерн, исследованный зондамии , как указано. Образцы РНК расположены на панелях А и В следующим образом Строка 1 клон 9 В 2, строка 2 клон 10 С 12, строка 3 клон 14 В 5, строка 4 15 С 9, строка 5 контрольная РНК из клеток, трансфектированная с плазмидой, содержащейи , строка 6 нетрансфектированная РНК клеток . Фиг. 6 отображает саузерн анализ клонов, получившихся в процессе гомологичной интеграциис . Приводятся следующие модели Строка 1 маркеры размера ДНК , строка 2 204, строка 3 59, строка 4 21 С 7, строка 5 242, строка 6 25 Е 1, строка 7 28 С 9, строка 8 299, строка 9 3911,строка 10 429, строка 11 5010, строка 12 плазмида ДНК , представленная линейно с(верхняя зона) и разорваннаяи 1 (нижняя зона), строка 13 нетрансфектированный . Фиг. с 7 А по 7 и с 7 Р по 7 Х содержат перечень последовательности нуклеотидов для. Фиг. с 8 А по 8 и с 8 Р по 8 Х содержат перечень последовательности нуклеотидов для содержащего анти-С 20 . Фиг. 9 отображает карту нацеливающей плазмиды , показанной здесь в процессе кодирования генов анти-С 23, экспрессия которых рассматривается в примере 5. Фиг. с 10 по 10 и с 10 Р по 10 содержат перечень последовательности нуклеотидов , содержащую гены анти-С 23, как показано в примере 5. Изобретение представляет новый метод интеграции желаемой ДНК с намеченным участком в геноме клетки млекопитающего посредством гомологичной рекомбинации. Изобретение также представляет новые векторы для достижения особой интеграции ДНК с намеченным участком генома в клетке млекопитающего. Более конкретно, предложенный метод клонирования обеспечивает интеграцию желаемой ДНК в клетку млекопитающего путем трансфекции такой клетки с маркирующей плазмидой, содержащей уникальную последовательность, являющуюся чужеродной для генома клетки млекопитающего и обеспечивающей подложку для гомологичной рекомбинации, за которой следует трансфекция с нацеливающей плазмидой, содержащей последовательность, обеспечивающую гомологичную рекомбинацию с уникальной последовательностью, содержащейся в маркирующей плазмиде, и далее содержащей желаемую ДНК, которая должна быть интегрирована в клетку млекопитающего. Закономерно то, что интегрированная ДНК будет кодировать интересующий белок, вырабатываемый в клетках млекопитающего, такой, как иммуноглобулин или другой гликопротеин. 11 7288 1 2005.09.30 Приводимая система гомологичной рекомбинации использует ген неомицинфосфотрансферазы в качестве избирательного маркера. Именно этот маркер использовался в следующих ранее описанных наблюдениях наглядно показанная способность нацеливать и восстанавливать мутированный неоген (упоминалось ранее) и наша разработка трансляционно поврежденных векторов экспрессии, в которой неогены были искусственно созданы в виде двух экзонов с интересующим геном, вставленным в находящийся рядом интрон нео экзоны верно сплайсированы и транслированы, продуцируют функциональный белок и таким образом обеспечивают созданную популяцию клеток с резистентностью к 418. Неоген разделен на три экзона. Третий экзон нео присутствует на маркирующей плазмиде и интегрируется в геном клеткиреципиента после интеграции маркирующей плазмиды в клетку млекопитающего. Экзоны 1 и 2 присутствуют в нацеливающей плазмиде и разделены вставленным интроном, в котором клонирован, по крайней мере, один интересующий ген. Гомологичная рекомбинация нацеливающего вектора с интегрированным маркирующим вектором выражается в верном сплайсировании всех трех экзонов неогена, и таким образом обеспечивается экспрессия функционального нео белка (как предусмотрено при отборе колоний, устойчивых к 418). До создания настоящей системы экспрессии мы экспериментально исследовали функциональность такой разделенной на три части нео конструкции в клетках млекопитающих. Результаты данного контрольного эксперимента показывают, что все три нео экзона были верно сплайсированы и таким образом предполагают осуществление предмета исследования. Однако, в то время как настоящее изобретение иллюстрируется использованием неогена, в частности, разделенного на три части неогена, общая методология должна быть действенна в отношении других доминантных избирательных маркеров. Как описывается более подробно ниже, настоящее изобретение предлагает многочисленные преимущества перед традиционными методами генной экспрессии, включая методы произвольной интеграции гена и нацеливание гена. В частности, настоящее изобретение представляет метод, репродуктивность которого позволяет производить интеграцию желаемой ДНК с особым участком на транскрипционно активном домене клетки млекопитающего. В силу того, что настоящий метод представляет искусственную область гомологии которая выступает в качестве уникальной подложки для гомологичной рекомбинации и вставки желаемой ДНК, действенность настоящего изобретения не требует того, чтобы клетка эндогенно содержала или экспрессировала конкретную ДНК. Таким образом, данный метод, в общем, применим в отношении всех клеток млекопитающих и может быть использован для экспрессии любого вида белка. Использование разделенного на три части избирательного маркера, например можно привести нео конструкцию, разделенную на три части, гарантирует, что все продуцированные колонии, устойчивые к 418, проистекают из явления гомологичной рекомбинации (при произвольной интеграции не будет продуцирован функциональный неоген и, соответственно, он не выживет в процессе селекции в присутствии 418). Таким образом,настоящее изобретение облегчает отбор для желаемой гомологичной процедуры. Более того, частота произвольных дополнительных интеграций в клетках, прошедших процесс гомологичной рекомбинации, оказывается низкой. Основываясь на упомянутом, очевидно, что значительным преимуществом изобретения является то, что оно позволяет в значительной степени снизить число колоний, требующих отбора, с целью идентификации высокопродуктивных клонов, т.е. клеточных линий, содержащих желаемые ДНК, вырабатывающие соответствующий белок в большом количестве. В среднем клоны, содержащие интегрированную желаемую ДНК, могут быть идентифицированы посредством отбора среди 5-20 колоний (по сравнению с несколькими тысячами, просматриваемыми при использовании стандартной техники произвольной ин 12 7288 1 2005.09.30 теграции, или несколькими сотнями при использовании ранее описанных векторов для вставки интронов). Кроме того, так как участок для интеграции был предварительно выбран и сравнен с транскрипционно активным доменом, все экзогенные ДНК, экспрессированные на данном участке, должны репродуцировать сравнительно высокие уровни интересующего белка. Более того, настоящее изобретение обладает преимуществами в том, что позволяет вставлять амплифицирующий ген при интеграции маркирующего вектора. Таким образом,когда желаемый ген нацеливается на данный участок посредством гомологичной рекомбинации, настоящее изобретение позволяет усиливать экспрессию гена путем амплификации гена. В связи с этим в литературе описывалось, что различные участки генома имеют различную способность к амплификации гена ( и др., . . ., 7 14151424 (1987. Следовательно, данная техника более выгодна, так как позволяет поместить желаемый ген на особый участок, являющийся как транскрипционно активным, так и легко амплифицируемым. Следовательно, этот способ должен в значительной степени снизить время, необходимое на изолирование такого рода высокопродуктивных участков. В частности, в то время как традиционные способы создания клеточных линий млекопитающих, обладающих высоким уровнем экспрессии, могут занять от 6 до 9 месяцев, настоящее изобретение позволяет изолировать такого рода клоны в среднем после 3-6 месяцев. Это происходит благодаря тому, что традиционно изолируемые клоны обычно должны проходить, по крайней мере, три этапа амплификации гена, устойчивого к препарату, с тем, чтобы были достигнуты удовлетворительные результаты в уровне экспрессии генов. Так как клоны, продуцированные в процессе гомологичной рекомбинации, генерируют на заранее избранном участке, являющемся участком с высоким уровнем экспрессии,для достижения удовлетворительного уровня продуцирования понадобится меньшее число циклов амплификации. Более того, данное изобретение позволяет осуществлять репродуктивный отбор высокопродуктивных клонов, в которых вектор интегрирован с низким числом копий, обычно одной копией. Это является преимуществом, так как повышает стабильность клонов и позволяет избежать других возможных неблагоприятных побочных эффектов, имеющих место при большом числе копий. Как описано ранее, в настоящей системе гомологичной рекомбинации используется комбинация маркирующей плазмиды и нацеливающей плазмиды, что описывается более подробно ниже. Маркирующая плазмида, используемая для маркировки и идентификации транскрипционно активного участка, содержит, по крайней мере, следующие последовательности участок ДНК, который является гетерологичным или единственным в своем роде для генома клетки млекопитающего, функционирующий в качестве источника гомологии,обеспечивающий процесс гомологичной рекомбинации (с ДНК, входящей во вторую нацеливающую плазмиду). Более подробно, уникальный участок ДНКв общем будет содержать ДНК бактерии, вируса, синтезированных дрожжей или другую ДНК, которая обычно не присутствует в геноме клетки млекопитающего и которая не имеет значительных гомологичных отличий или различий в последовательности нуклеотидов от ДНК, содержащейся в геноме клетки млекопитающего. По существу, данная последовательность должна значительно отличаться от последовательности в ДНК млекопитающего тем, что не будет проходить рекомбинацию с геномом клетки-реципиента посредствам гомологичной рекомбинации. Размер такой уникальной ДНК должен в общем составлять, по крайней мере, около 2-10 или более тысяч нуклеотидов, предпочтительнее около 10 тысяч нуклеотидов, как было отмечено различными исследователями при возрастании числа гомологичных участков увеличивается частота нацеленной рекомбинации (, , 2441288-1292 1989). Верхний предел размера уникальной ДНК, выступающей в качестве участка для гомологичной рекомбинации с последовательностью нуклеотидов во втором нацеливающем 13 7288 1 2005.09.30 векторе в большой степени обусловлен ограничителями потенциальной стабильности (в случае, если ДНК слишком велика, она не может быть легко интегрирована в хромосому,а также возникают трудности при работе с очень большой молекулой ДНК). ДНК, включающую фрагмент избирательного маркера ДНК, обычно, экзон доминантного избирательного маркера гена. Существенным признаком такой ДНК является то,что она не кодирует белок функционального избирательного маркера, если только он не экспрессирован в соединении с последовательностью нуклеотидов, входящей в нацеливающую плазмиду. Закономерно, что нацеливающая плазмида содержит остающиеся экзоны доминантного гена избирательного маркера (не входящие в нацеливающую плазмиду). Важно, что функциональный избирательный маркер может быть продуцирован в случае гомологичной рекомбинации (выражающейся в ассоциации и экспрессии данной последовательности маркера ДНКв совокупности с частью/частями фрагмента избирательного маркера ДНК, который(ые) содержатся в нацеливающей плазмиде). Можно отметить, что настоящее изобретение иллюстрирует использование гена неомицинфосфотрансферазы в качестве избирательного маркера, разделенного на два вектора. Однако другие избирательные маркеры также должны подходить, например ген Сальмонеллы гистидинолдегидрогеназы, ген гидромицинфосфотрансферазы, ген тимидинкиназы вируса простого герпеса, ген аденозиндеаминазы, ген глутаминсинтетазы и ген гипоксантингуанинфосфорибозилтрансферазы. ДНК, кодирующую белок функционального избирательного маркера, избирательный маркер которой отличается от избирательного маркера ДНК . Данный избирательный маркер обеспечивает успешный отбор клеток млекопитающих, в которых маркирующая плазмида успешно интегрируется в клеточную ДНК. Предпочтительнее, чтобы маркирующая плазмида содержала два такого рода доминантных избирательных маркера молекул ДНК, расположенных на противоположных сторонах вектора. Это благоприятно,так как обеспечивает отбор интегрируемых частей при помощи различных избирающих агентов и впоследствии обеспечивает отбор клеток, содержащих вектор полностью. Кроме того, один маркер может быть амплифицирующим, с тем чтобы облегчить, как описывалось ранее, амплификацию гена. Любой из доминантных избирательных маркеров, перечисленных в , может быть использован наряду с уже общеизвестными. Более того, выборочно, маркирующая плазмида может содержать редкий участок рестрикционной эндонуклеазы. Это является потенциально желаемым условием, так как может облегчить процесс дробления. В случае присутствия такого рода участка рестрикции он должен располагаться в близости от центра уникального участка, представляющего подложку для гомологичной рекомбинации. Предпочтительно, чтобы такая последовательность состояла из приблизительно 12 нуклеотидов. Как описывалось, введение двухнитевого разрыва ДНК посредством схожей методологии увеличило частоту процесса гомологичной рекомбинации. ( и др., . . ., 151968-1973, 1995). Однако наличие такого рода последовательности не обязательно. Нацеливающая плазмида будет содержать, по крайней мере, следующие последовательности(1) тот же уникальный участок ДНК, находящийся в маркирующей плазмиде, или участок, обладающий удовлетворительной гомологией или идентичной последовательностью, с помощью которой указанная ДНК способна объединиться посредством гомологичной рекомбинации с уникальным участкомв маркирующей плазмиде. Подходящие типы ДНК описаны ранее при описании уникального участка ДНК (1) в маркирующей плазмиде.(2) оставшиеся экзоны доминантного избирательного маркера, один из которых включен в качествев маркирующей плазмиде, описанной выше. Существенные особенности данного фрагмента ДНК в том, что его наличие отражается в белке функционального(избирательного) маркера только в случае, если нацеливающая плазмида интегрируется посредством гомологичной рекомбинации (там, где имеет место такого рода рекомбинация, выражающаяся в ассоциации данной ДНК с другим фрагментом избирательного мар 14 7288 1 2005.09.30 кера ДНК, содержащегося в маркирующей плазмиде) и впоследствии обеспечивает вставку желаемой экзогенной ДНК. Закономерно, что данная ДНК содержит оставшиеся экзоны избирательного маркера ДНК, разделенные интроном. Например, данная ДНК может содержать первые два экзона неогена, и маркирующая плазмида может содержать третий экзон (заднюю третью часть нео).(3) Нацеливающая плазмида также содержит желаемую ДНК, например, кодирующую желаемый полипептид, чаще всего вставленный во фрагмент ДНК избирательного маркера, содержащегося в плазмиде. Закономерно, что ДНК будет вставлена в интрон, стоящий между экзонами избирательного маркера ДНК. Данный факт обеспечивает то, что желаемая ДНК также интегрируется, в случае если гомологичная рекомбинация нацеливающей плазмиды и маркирующей плазмиды имеет место. Данный интрон может появиться естественным путем или быть искусственно встроенным во фрагмент доминантного избирательного маркера ДНК. Данная ДНК кодирует любой желаемый белок, который предпочтительно обладал бы фармацевтическими или другими желаемыми свойствами. Чаще всего ДНК кодирует белок клеток млекопитающих и, как описывается в данном примере, иммуноглобулин или иммуноадезин. Однако изобретение не ограничивается только продуцированием иммуноглобулинов. Как указывалось ранее, настоящий способ клонирования применим для любых клеток млекопитающих, так как в данном случае не требуется наличия особой последовательности или последовательностей в клетках млекопитающих. В общем, такого рода клетки млекопитающих будут содержать последовательности, обычно используемые для экспрессии белка, например клетки , клетки миеломы, клетки , клетки , клетки 2/0, клетки 3 Т 3 и . В приводимых далее примерах использовались клетки. Преимущества данных клеток состоят в наличии подходящей среды для выращивания, их способности хорошо расти, также они отличаются высокой плотностью культуры и способностью экспрессировать белки млекопитающих, такие как иммуноглобулин, в биологически активной форме. Более того, клеткибыли выбраны по большей части потому, что в прошлом исследователями использовались такого рода клетки для экспрессии иммуноглобулинов(используя поврежденный в процессе трансляции доминантный избирательный маркер,содержащий описанные ранее векторы). Таким образом, наша лаборатория имеет значительный опыт использования такого рода клеток для экспрессии. Однако, основываясь на последующих примерах, можно ожидать, что схожие результаты могут быть получены при использовании клеток других млекопитающих. В общем, трансформация или трансфекция клеток млекопитающих, согласно настоящему изобретению, будет зависеть от традиционных методов. С тем чтобы лучше пояснить суть изобретения, создание примерных векторов и их использование при продуцировании интегрантов описано в следующих ниже примерах. Пример 1. Создание и подготовка маркирующей и нацеливающей плазмиды векторов ДНК. Маркирующая плазмида, называемая здесь, была собрана из следующих элементов ДНК Ген мурина дигидрофолатредуктазы , встроенный в транскрипционную кассету, содержащую промотер 5 бета глобина мыши для участка начала , и для кодона рестрикции бычий гормон роста, сигнал поли адениляции 3. Транскрипционная кассетабыла изолирована от ТСАЕ 6, вектора экспрессии ранее созданного в данной лаборатории ( и др., 1992, , 10 1455-1460). Ген -галактозидазы . , который возможно приобрести, полученный ув качестве контрольного вектора галактозидазы, каталогЕ 1081. Содержащий кассету промотер и усиливающие элементы из Цитомегавируса и вируса 40. Кассета была генерирована посредствамс использованием деривата вектора экспрессии ТСАЕ 8 ( и др. , , 83 435-445 (1994. Кассета для усилителей была вставлена в последовательность палочкового вируса, которая была первоначально модифицирована посредством вставки множественного (или сложного) участка клонирования. Ген . тифимуриумгистидинолдегидрогеназы . Данный ген изначально был взят у ( и др., , 1847-59 (1982 и был впоследствии внедрен в транскрипционную кассету, содержащую в гене основной промотер 5 бета глобина мыши, и признак 3 полиаденилирования гена 40. Элементы ДНК, описанные в пунктах (а)-, были собраны в каркас молекулы деривата плазмида , для продуцирования соседнего фрагмента секвенирования ДНК, состоящего из 7.7 тысяч нуклеотидов, называемого на приложенных фигурах гомология. В этом смысле гомология относится к последовательности нуклеотидов ДНК, не являющихся частью генома млекопитающего и используемых для обеспечения процесса гомологичной рекомбинации между трансфектированными плазмидами, находящимися в этой же гомологии последовательностей молекулы ДНК. Ген неомицинфосфотрансферазы из числа молекул фермента 5 ( и , ., 32 469-518 (1978. Полный неоген был субклонирован вК(Каталог стратагенов 212205.является товарным знаком) с целью облегчить генетические манипуляции. Синтетический линкер был затем встроен в уникальный участок 1, расположенный поперек кодонов аминокислот 51 и 52 неогена. Данный линкер закодировал необходимые элементы ДНК для создания искусственного сайта-донора,расположенного между интроном и акцепторным участком в неогене, таким образом создавая два отдельных экзона, описываемых как нео экзон 1 и 2. Нео экзон 1 кодирует первые 51 аминокислоты нео, в то время как экзон 2 кодирует оставшиеся 203 аминокислоты,а также конечный кодон участка клонирования белка 1, созданного внутри интрона. Нео экзон 2 далее разделен на участки, продуцирующие нео экзоны 2 и 3. Это было достигнуто следующим образом множество праймеровбыли созданы для амплификации участка ДНК, кодирующего нео экзон 1, интрон и первые 111 2/3 аминокислот экзона 2. Использование праймера 3 выразилось во введении нового участка сплайсирования непосредственно сразу же после второго нуклеотида кодона для аминокислоты 111 в экзоне 2, для чего был создан новый небольшой экзон 2. Фрагмент ДНК, кодирующий теперь изначальный экзон 1, интрон и новый экзон 2, был субклонирован и размножен в векторе, созданном в . Оставшаяся часть исходного экзона 2 была использована в качестве матрицы для второго цикла амплификации , в результате которого был создан экзон 3. Праймер 5 предоставил новый акцепторный сайт для нового цикла амплификации, находящийся на стороне 5 новосозданного экзона 3, т.е. расположенный перед последним нуклеотидом кодона аминокислоты 111. Созданные 3 экзона нео закодировали следующую информацию экзон 1 - первые 51 аминокислоты нео экзон 2 - последующие 111 2/3 аминокислоты, а экзон 3 конечные 91 1/3 аминокислоты, а также трансляционный терминирующий кодон неогена. Нео экзон 3 был внедрен наряду с указанными выше элементами ДНК в маркирующую плазмиду . Нео экзоны 1 и 2 были внедрены в нацеливающую плазмиду. Участок клонирования 1, созданный в интроне между экзонами 1 и 2, использовался на последующих стадиях клонирования для внедрения интересующих генов в нацеливающую плазмиду. 7288 1 2005.09.30 Вторая нацеливающая плазмидатакже была генерирована. Данная плазмида почти идентична плазмиде(некоторые сайты рестрикции в векторах были изменены), не считая того, что изначальные геныи , содержащиеся в , были инактивированы. Данные изменения были внесены в силу того, что клеточная линияне культивировалась больше в присутствии гистидинола, поэтому не было необходимости включать вторую копию гена . Кроме того, генбыл инактивирован,с тем чтобы убедиться в том, что только ген , а именно присутствующий на участке,отмеченном , может быть амплифицирован в любую клеточную линию.была производена изпутем следующих модификацийИскусственный линкер был встроен в центр участка, кодирующего . Данный линкер создал терминирующий кодон и переместил оставшиеся части кодирующегоучастка за пределы каркаса, таким образом лишая ген функциональности., не имеющего промотера и инициирующего кодона гена. Фигура 1 отображает расположение данных элементов ДНК в маркирующей плазмиде. Фигура 2 отображает расположение данных элементов в первой нацеливающей плазмиде. Фигура 3 иллюстрирует возможное расположение различных элементов ДНК в геноме клетокпосле нацеливания и интеграции ДНКв помеченныеклетки . Фигура 9 отображает нацеливающую плазмиду. Создание маркирующей и нацеливающей плазмид из перечисленных элементов ДНК было выполнено с помощью следующих общепринятых техник клонирования (см. например,,, .и др., 1987,и, и др., ., 1987,). с плазмиды были разведены и сохранялись в .(Стратагены, каталог 200236). Большое число препаратов плазмид было приготовлено с использованием Очистительной Системы ДНКв соответствии с указаниями производителя. Пример 2. Создание маркированной клеточной линии . 1. Клеточная Культура и Процедуры Трансфекции, Применяемые к Продуцированной Клеточной Линии . ДНК маркирующей плазмиды была придана линейная форма с помощью продолжающегося всю ночь сжигания при температуре 37 С в присутствии 11071. Имеющий линейную структуру вектор был осажден этанолом и ресуспендирован в стерильном ТЕ до концентрации в 1 мг/моль. Линейный вектор был встроен вклетокклетки 44 ( и др., .. ., 12555-566, 1986) посредством электропорации. Экспоненциально растущие клетки были собраны центрифугированием, промыты в сильно охлажденном(буферный раствор сахарозы - 272 мМоль сахарозы, 7 мМоль фосфата натрия, рН 7.4, 1 мМоль хлорида магния), затем ресуспендированы в растворе сахарозы до концентрации 107 клеток/мл. После 15-ти минутной инкубации на льду 0.4 мл клеточного раствора было смешано с 40 г линейной ДНК в имеющейся кювете для электропорации. Клетки раздражались током с помощьюэлектрического манипулятора клеток (Сан Диего, штат Калифорния), установленного на 230 вольт, емкостное сопротивление в 400 микрофарад, сопротивление в 13 Ом. Обработанные током клетки затем были перемешаны с 20 мл предварительно подогретой питательной среды для выращивания клеток(, /, каталог 31033-012) и разложены в 96-ти луночные чашки для культивации. Через 48 ч после электропорации в чашки была залита селективная среда (в случае трансфекции сселективной средой выступает -, без гипоксантина или тимидина, в которую было добавлено 2 мМоль гистидинола ( каталогН 6647. Чашки оставались в селективной среде около 30 дней или до тех пор, пока некоторые из расположенных в лунках клетки не вырастали. Данные клетки 17 7288 1 2005.09.30 были затем перемещены из 96-ти луночных чашек в 120 миллиметровые центрифужные колбы, где они сохранялись в селективной среде постоянно. Пример 3. Характеристика маркированных клеточных линий . Саузерн анализ. ДНК генома была изолирована от всех стабильно растущих маркированныхклеток . ДНК была изолирована с использованием набора ДНКв соответствии с инструкциями изготовителя. ДНК генома затем была подвержена сжиганию в течение ночи с помощьюпри температуре в 37 С и подвержена саузерн анализу с использованием генерированного с помощьюзонда, помеченного дигоксигенином,что является специфичным для гена . Гибридизация и промывание были произведены с помощью прибора для гибридизации(каталог 1603 558) набора для промывки(каталог 1585 762), в соответствии с инструкциями изготовителя. Было определено, что образцы ДНК, содержащие только одну зону, гибридизирующиеся на зонде , представлены клонами, выделившимися из одной клетки, интегрированной в одиночную копию плазмиды. Данные клоны были сохранены для последующего анализа. Из 45 изолированных клеточных линий, устойчивых к , только 5 были представлены интегрантами одиночной копии. Фигура 6 изображает Саузерн блот, содержащий все 5 данных клонов единичной копии . Наименования клонов приведены в сносках к фигуре. Нозерн Анализ Целая молекула РНК была изолирована от единичной копии клоновс использованием реагента(/ каталог 15596-026. является товарным знаком) в соответствии с инструкцией производителя. Был проведен анализ 10-20 г РНК из каждого клона на наличие дублетов формальдегидных гелей. Полученные блоты были зондированы с помощьюгенерированных зондов ДНК, помеченных дигоксигенином на наличиесвязи,связи исвязи.представляет из себя трехфункциональный белок, участвующий в биосинтезе уридина ( и др., . .., 254, 17 8679-8689 (1979, и экспрессирован одинаково во всех клеточных типах. В данном случае он используется для внутреннего контроля с целью облегчить подсчет нагрузки РНК. Гибридизация и промывка были проведены с использованием указанных выше реагентов. Результаты нозерн анализа показаны на фигуре 5. Одиночная копия клонадемонстрирует высокие уровниив клоне 15 С 9, показанном на проходе 4 обеих панелях фигуры. Данный клон был обозначен как маркированная клеточная линия и использовался в будущих экспериментах по процессу нацеливания в клетках , примеры чего содержатся в следующих частях. Пример 4. Экспрессия антитела анти-С 20 в клетках , маркированных. С 2 В 8, гибридное антитело, распознающее антиген 20, располагающийся на поверхности В-клеток, было клонировано и экспрессировано ранее в нашей лаборатории.( и др., , 83434-45, 1994). Фрагмент ДНК в 4.1 т.п.н., включающий в себя легкие и тяжелые гены цепи С 2 В 8 наряду с необходимыми регуляторными элементами (эукариотными промотерами и сигналами полиаденилирования), был встроен в вызванный обработкой интрон, созданный между экзонами 1 и 2 неогена, входящего клонирующего вектора, являющегося дериватом . Этот созданный фрагмент ДНК в 5 т.п.н. (содержащий нео экзон 1, С 2 В 8 и нео экзон 2) был вырезан и использован при создании нацеливающей плазмиды . Другие элементы ДНК, использованные при создании , идентичны тем, что использовались при конструировании маркирующей плазмиды , идентифицированной ранее. Полная картапредставлена на фиг. 2. Нацеливающему векторубыла придана линейная структура до трансфекции посредством сжигания в присутствии Кр 1 и 1, осажденных и ресуспендированных этанолом в стерильном ТЕ до концентрации в 1.5 мг/мл. Как и описывалось, плазмида ли 18 7288 1 2005.09.30 нейной формы была введена в экспоненциально растущие клетки, маркированные , однако в каждом процессе электропорации использовалась ДНК в 80 г. Спустя 48 ч после электропорации, в 96-ти луночные чашки была добавлена селективная среда клетки -, с добавлением 400 г/мл генетицина (418, /, каталог 10131-019). Чашки с элективной средой сохранялись до 30 дней или до тех пор, пока в одной из лунок не начнется рост клеток. Предполагалось, что такой рост клеток является результатом экспансии клонов в одиночной клетке, устойчивой к 418. Надосадочная жидкость из всех устойчивых к 418 лунок была проверена на репродукцию С 2 В 8 посредством стандартного метода(ферментный иммуносорбентный тест), и все продуцирующие клоны были в конечном итоге разведены до 120 мл в центрифужных колбах и проанализированы. Характеристика Целевых Клеток, Выделяющих Антитела. В ходе данного эксперимента было проведено 50 электропораций с нацеливающей плазмидой , материал каждой из которых был помещен в 96-ти лунковые чашки. Было получено и разведено в 120 мл 10 жизнеспособных клонов, выделяющих антитела анти-20. Геномные ДНК были изолированы от всех клонов, и были проведены саузерн анализы, с тем чтобы определить - представляют ли клоны одиночные случаи гомологичной рекомбинации или в тех же самых клетках произошел процесс произвольной дополнительной интеграции. При изоляции ДНК и саузерн гибридизации использовались методы, описанные в предыдущих разделах. Геномная ДНК расщеплялась в присутствиии зондировалась с помощьюмаркированным дигоксигенином зондом в сегменте участка, содержащего константу тяжелой цепи 20. Результаты данного саузерн анализа представлены на фигуре 6. Как можно увидеть на фигуре, 8 из 10 клонов демонстрируют одиночный участок, гибридизированный на зонд 20, что обозначает одиночный случай гомологичной рекомбинации, прошедшей в данных клетках. Два из десяти клонов, 242 и 28 С 9, демонстрируют наличие дополнительных зон, что указывает на то,что где-то в геноме имела место произвольная интеграция. Мы изучили уровни экспрессии антитела анти-20 во всех десяти клонах, полученные в результате данные представлены в табл. 1. Таблица 1 Уровень экспрессии гомологичных интегрантов, выделяющих анти-20 Клон Данные клоны содержат дополнительные произвольно интегрированные клоны анти 20. Таким образом, уровень экспрессии данных клонов отражает показатели гомологичных и произвольных сайтов. Уровень экспрессии указывается в пикограммах на клетку в день (пг/клетка/день), выделяемый отдельными клонами, и представленные показатели получены при помощи трех 7288 1 2005.09.30 отдельных технических приемов , на образцах взятых из центрифужных 120 миллиметровых колб. Как можно заметить по приведенным данным, наблюдаются вариации в выделении антитела в примерно десяти складках укладки цепи между наивысшими и низшими клонами. Данный результат был неожиданным, так как мы предполагали получение сходных уровней экспрессии во всех клонах, в силу того, что все гены анти-20 интегрированы в один и тот же маркированныйсайт. Тем не менее, наблюдаемый вариационный размах в уровне экспрессии очень низок по сравнению с наблюдаемым в процессе использования традиционного метода интеграции или при использовании нашей системы векторов, поврежденных при трансляции. Клон 204, наиболее продуктивный интегрант, продуцирующий одиночную копию,был избран для последующего исследования. Табл. 2 (внизу) представляет техникуи данные по клеточной культуре по проходившему в данном клоне в течение семи дней продуцированию. Таблица 2 Данные по продуцированию в течение семи дней в клоне 204 Деньжизнеспособных 1 2 3 4 5 6 Клон 204 был засеян в 2105 мл в 120 миллиметровой центрифужной колбе в день до культивирования. В последующие шесть дней было взято определенное число клеток,подсчитано число удвоений и 1 мл образца надосадочной жидкости перенесен из колбы, и был проведен анализ посредствомна наличие выделенного анти-20. Данный клон выделяет в среднем 3-5 пг антитела/клетка/день, основываясь на данных,полученных с помощью . Получен такой же уровень, как и в других клонах одиночной копии, имеющих высокий уровень экспрессии, которые были получены в нашей лаборатории ранее при использовании ранее разработанных трансляционно поврежденных векторов произвольной интеграции. Данный результат отражает следующее 1. сайт в геноме клетки , помеченный маркирующим вектором , является высоко транскрипционно активным и, таким образом, представляет прекрасный сайт, с которого будет проходить экспрессия рекомбинантных белков, и 2. что нацеливание посредством гомологичной рекомбинации может быть выполнено с использованием данного вектора и может происходить с частотой, достаточной для того,чтобы обеспечить жизнеспособность данной системы и представлять собой желаемый альтернативный метод методу произвольной интеграции. С тем, чтобы показать эффективность данной системы, мы также продемонстрировали то, что участок способен к экстракопированию, что выражается в более высоких уровнях экспрессии генов и выработке белка. Амплификация была достигнута посредством высеивания на чашки серийных разведений клеток 204, начинающееся при плотности в 2,5104 клеток/мл, в 96-ти лунковых чашках для тканевых культур, и культивирование данных клеток в среде (-), куда было добавлено 5, 10, 15 или 20 нМоль метотрексата. Клоны, выделяющие антитела, были отсортированы с использованием метода , и 7288 1 2005.09.30 наиболее высокопродуктивные клоны были разведены и подвержены анализу. Краткое изложение данного эксперимента по амплификации представлено ниже в табл. 3. Таблица 3 Краткое изложение процесса амплификации 204 метотрексат Амплификация 204 в присутствии метотрексата проводилась, как описано в тексте, с использованием указанных выше в таблице концентраций метотрексата. Надосадочная жидкость из всех выживших 96 лунок с колониями была исследована с помощью , и вариационный размах анти-С 20, экспрессированных данными клонами, указан в третьем столбце. Основываясь на данных результатах, наиболее высокопродуктивные клоны были разведены до объема 120 мл и было проведено несколько анализовс надосадочной жидкостью, с тем чтобы определить уровень экспрессии пг/клетка/день, указанный в колонке 5. Настоящие данные хорошо демонстрируют тот факт, что данный сайт может амплифицироваться в присутствии метотрексата. Было обнаружено, что клоны амплификаций в 10 и 15 нМоль продуцируют, как правило, 15-20 пг/клетка/день. Клон в 15 нМоль, обозначенный как 204-155, был отобран как клеточная линия, обладающая наивысшим уровнем экспрессии. Данный клон был получен из чашки с 96 лунками, из которых только в 22 лунках наблюдался рост, и поэтому мы предположили, что клон был произведен одной клеткой. Клон в 15 нМоль, обозначенный 204-155, был отобран в силу того, что клеточная линия обладала наивысшим уровнем экспрессии. Данный клон был взят из плашки с 96 лунками, в которых только в 22 наблюдался рост, и поэтому мы предположили, что клон был произведен одной клеткой. Затем клон был подвергнут последующему циклу амплификации в присутствии метотрексата. Как было описано ранее, серийные разведения культуры были помещены в плашки с 96 лунками и культивированы в среде , куда было добавлено 200, 300 или 400 нМоль метотрексата. Выжившие клоны были исследованы с помощью метода , и несколько высокопродуктивных клонов были увеличены в объеме до объема культуральной жидкости и подвергнуты анализу. Краткое изложение данного эксперимента со вторым циклом амплификации представлено в табл. 4. Таблица 4 Резюме амплификации 204-155 нМоль метотрексата 7288 1 2005.09.30 Амплификация 204-155 в присутствии метотрексата была произведена и проанализирована, как описано в тексте. Лунки, обладающие наивысшим уровнем продуцирования,номера которых указаны в столбце 4, были увеличены в объеме до 120 мл. Зарегистрированный уровень экспрессии клеточных линий, произошедших из данных лунок, указан в пг/клетка/день в столбце 5. Наиболее высокопродуктивный клон получен из 250 нМоль амплификации в присутствии метотрексата. Клон в 150 нМоль, 204-15 А 5-250 А 6, получен в чашке с 96 лунками,в которой росли только лунки, и поэтому рассматривается как производный от одной клетки. Если рассматривать данные из таблицы 3 и 4, то можно заметить строгую тенденцию того, что вполне достаточно двух циклов амплификации в присутствии метотрексата,для того чтобы достичь уровня экспрессии в 60 пг/клетка/день, что достигает максимума возможности выделения иммуноглобулина в клетках млекопитающих (, , .. ., 4573-576, 1993). Тот факт, что данный уровень выделения может быть достигнут после двух циклов амплификации, повышает полезность данной системы гомологичной рекомбинации. Обычно методы произвольной интеграции требуют более чем два цикла амплификации для достижения данного уровня экспрессии, и результаты амплификации менее определенны. Таким образом, система гомологичной рекомбинации предлагает более эффективный и требующий меньше времени метод получения высоких уровней экспрессии генов в клетках млекопитающих. Пример 5. Экспрессия чужеродного для человека антитела 23 в клетках ,маркированных . 23 представляет собой малоподобный рецептор , который является промежуточным звеном при связываниис лимфоцитами В и(, , , , ,366 421-428, 1993). Чужеродное для человека анти-С 23 моноклональное антитело 5 Е 8 является человеческим -1 моноклональным антителом, недавно клонированным и подверженным экспрессии в нашей лаборатории. Данное антитело описано в патенте США 6011138. Гены тяжелой и легкой цепей 5 Е 8 были клонированы в вектор экспрессии млекопитающего 51, являющийся производным вектора( и др.,, . , ., . 27-40, 1995), и затем в гены были введены две модификации. Нами наблюдался более высокий уровень выработки легких цепей иммуноглобулина по сравнению с тяжелыми цепями в других экспрессированных конструкциях, полученных в лаборатории ( и др., 1997, неопубликованные наблюдения). В попытке компенсировать данный дефицит мы изменили ген тяжелой цепи 5 Е 8 путем добавления более сильного элемента промотера/усилителя непосредственно против последовательности сайта инициации. Впоследствии фрагмент ДНК в 2.9 т.п.н.,содержащий гены модифицированных легких и тяжелых цепей 5 Е 8, был изолирован от вектора 51 и встроен в нацеливающий вектор . Подготовка , содержащего 5 Е 8, и его электропорация в клетки 159 проходила таким же образом,как это было описано в предыдущей части. Одно изменение в описанном ранее протоколе касалось типа используемой среды для культивации. Клетки , маркированные , были культивированы в среде , не содержащей белка (-, каталог 21206), в которую было добавлено 3 мг/л рекомбинантного инсулина (3 мг/мл исходного раствора, -, каталог 22057) и 8 мМоль -глутамина (200 мМоль исходного раствора, -, каталог 25030-081). Далее, трансфектированные клетки были отобраны в указанной среде, куда было добавлено 400 г/мл генетицина. В ходе данного эксперимента было проведено 20 электропораций, и материал распределен в 96-лунковых чашках с культуральной тканью для культивации. Клетки выросли и выделили анти-С 23 в 68 лунках, все полученные клоны рассматривались как клоны, полученные из одной клетки 418. Двенадцать из данных лунок были разбавлены в 120 миллиметровых пробирках для проведения после 22 7288 1 2005.09.30 дующего анализа. Мы полагаем, что увеличение числа клонов, изолированных в данном эксперименте (68 по сравнению с 10 для 20, как было описано в Примере 4), произошло в силу более высокой производительности в ходе клонирования и высокого уровня выживания среди клеток, выращенных в среде -, по сравнению со средой -. Уровни экспрессии для данных клонов, проанализированные в центрифужных пробирках, варьировали от 0.5 до 3 пг/клетка/день, в строгом соответствии с уровнями, наблюдаемыми у клонов анти-20. Обладающий наивысшей продуктивностью клон анти 23, обозначенный 4 Н 12, был подвержен амплификации в присутствии метотрексата, с тем чтобы увеличить уровни экспрессии. Данная амплификация была проведена таким же образом, как было описано по отношению к клону анти-20 в Примере 4. Серийные разведения экспоненциально растущих клеток 4 Н 12 были помещены в 96-лунковые чашки с культуральной тканью для культивирования и выращены в среде -, с добавлением 3 мг/Л инсулина, 8 мМоль глутамина и 30, 35 или 40 нМоль метотрексата. Резюме данного эксперимента по амплификации представлено в табл. 5. Таблица 5 Резюме амплификации 2 Н 12 нМоль метотрексата Уровень экспрес разбавленных сии мг/1 в 96 лунок лунках 6-24 8 4-27 2 4-20 1 Полученный клон, обладающий наивысшим уровнем экспрессии, был клон в 30 нМ,изолированный из чашки, где клоны выросли в 22 лунках. Данный клон, обозначенный 412-305, продуцировал 18-22 пг антитела на клетку в день. Такой же уровень экспрессии наблюдался после первого цикла амплификации анти-20 клона 204 (клон 204155, продуцирующий 15-18 пг/клетка/день, как описано в примере 4). Полученные в результате данные иллюстрируют наблюдение, демонстрирующее то, что амплификация на данном маркированном участке ввысокопродуктивна и эффективна. Второй цикл амплификации данной клеточной линии в 30 нМоль - в процессе на настоящий момент. Предполагается, что уровни насыщения экспрессии в отношении антитела анти-23 будут достигнуты после двух циклов амплификации, как было в случае с анти-20. Пример 6. Экспрессия иммуноадезина в клетках , маркированных .-4, член суперсемейства , обнаружен на поверхностилимфоцитов и предполагается, что он играет роль в особойантигенной активации Т-клеток ( и др., .. ., 18 1901-1905 (1988) ии др., . Ехр. .,174 561-569 (1991. С тем,чтобы далее изучить непосредственную роль молекулы -4 в процессе активации,был создан белок, полученный в результате растворимого слияния, содержащий экстраклеточную область -4, связанную с усеченной формой человеческого постоянного участка( и др., .). Мы смогли экспрессировать данный белок слияния 4 в векторе экспрессии млекопитающего 1, являющийся дериватом плазмиды( и др.,, . ,., стр.27-40 (1995. Фрагмент в 800 бп, кодирующий -4 , был изолирован из данного вектора и встроен между сайтамиив . Приготовление -4 - и электропорация вклон 15 С 9 клетокбыли выполнены, как описывалось в предыдущем примере, относящемся к анти-С 20. Было проведено двадцать электропораций, и материал был помещен в 96-лунковые чашки 23 7288 1 2005.09.30 для культивирования, как было описано ранее. Восемнадцать лунок, экспрессирующих-4, было изолировано из 96 луночных чашек и разбавлено в 120 миллиметровых колбах. Были проведены саузерн анализы геномной ДНК, изолированной от каждого из данных клонов, с тем чтобы определить, сколько гомологичных клонов содержит дополнительные произвольные интегранты. Геномная ДНК была расщеплена си исследована с помощью зонда с генерированными отмеченным дигоксигенином на наличие человеческого постоянного участка 1. Результаты данного анализа показали, что 85 клонов -4 являются только гомологичными интегрантами оставшиеся 15 содержат один дополнительный произвольный интегрант. Данный результат подтверждает открытия в процессе экспрессии анти-С 20, описанные ранее, где 80 клонов являлись одиночными гомологичными интегрантами. Таким образом, мы можем сделать заключение о том, что данная система экспрессии повышает продуктивность одиночных целевых гомологичных интегрантов в 80 всех продуцированных клонов. Уровни экспрессии для гомологичных клонов -4- варьируют от 8 до 12 пг/клетка/день. Данный результат выше описанного в отношении клонов антител антиС 20 и анти-С 23, указанных ранее. Однако мы ранее наблюдали, что экспрессия данной молекулы при использовании системы векторов вставки интрона достигает значительно высоких уровней, чем были получены для иммуноглобулинов. На настоящий момент мы не в состоянии представить объяснения данному наблюдению. Пример 7. Нацеливание анти-С 20 на альтернативную маркированнуюклеточную линию . Как мы описали в предыдущей части, мы получили 5 одиночных копий маркированныхклеточных линий(смотри фиг. 4 и 5). С тем, чтобы продемонстрировать, что успех нашей стратегии нацеливания не в силу того, что клон 159 обладает каким-то уникальным свойством и присущим только данному клону, мы ввели анти-С 20 вклон 9 В 2 (строка 6 на фиг. 4, строка 1 на фиг. 5). Приготовление ДНКи электропорация в 92 прошли таким же образом,как описано в предыдущем примере, относящемся к анти-С 20. Нами был получен один гомологичный интегрант в результате данного эксперимента. Данный клон был разбавлен в 120 мл колбе, где им было продуцировано в среднем 1.2 пг анти-С 20/клетка/день. Данный уровень экспрессии значительно ниже, чем тот, что наблюдался при интеграциив 159. Однако такой результат предполагался, так как мы основывались на нозерн анализе клонов . Как показано на фигуре 5, уровнив клоне 9 В 2 значительно ниже, чем в клоне 15 С 9, что указывает на то, что сайт данного клона не является транскрипционно активным по сравнению с 15 С 9. Таким образом, данный эксперимент не только демонстрирует репродуктивную способность системы - предположительно, что любой маркированныйучасток может быть достигнут с помощью он также подтверждает данные, полученные в результате нозерн анализа, что сайт в 159 является наиболее транскрипционно активным участком. Из всего вышесказанного, следует принять во внимание, что хотя здесь были описаны с целью иллюстрации особые способы применения изобретения, в него могут быть внесены различные модификации без отвлечения от сути описываемого способа. Соответственно, изобретение не ограничено формулой изобретения.
МПК / Метки
МПК: C12N 15/12, C12N 15/13, C12N 15/85, C12N 15/87, C12N 5/10, C12N 15/90, C12N 15/62
Метки: генома, рекомбинации, определенные, интегрирования, векторы, участки, генов, посредством, выполнения, способ, клеток, гомологичной, млекопитающих
Код ссылки
<a href="https://by.patents.su/30-7288-sposob-integrirovaniya-genov-v-opredelennye-uchastki-genoma-kletok-mlekopitayushhih-posredstvom-gomologichnojj-rekombinacii-i-vektory-dlya-ego-vypolneniya.html" rel="bookmark" title="База патентов Беларуси">Способ интегрирования генов в определенные участки генома клеток млекопитающих посредством гомологичной рекомбинации и векторы для его выполнения</a>
Предыдущий патент: Применение прамипексола для лечения синдрома усталых ног
Следующий патент: Фармацевтическая композиция для перорального применения производного N-пиперидин-3-пиразолкарбоксамида, его солей и их сольватов
Случайный патент: Композиционный абразивостойкий материал