Фармацевтическая композиция с ноотропным действием
Номер патента: 14067
Опубликовано: 28.02.2011
Авторы: Максимова Лейла Вагиф кызы, Романовский Дмитрий Иосифович, Кравченко Елена Валериевна
Текст
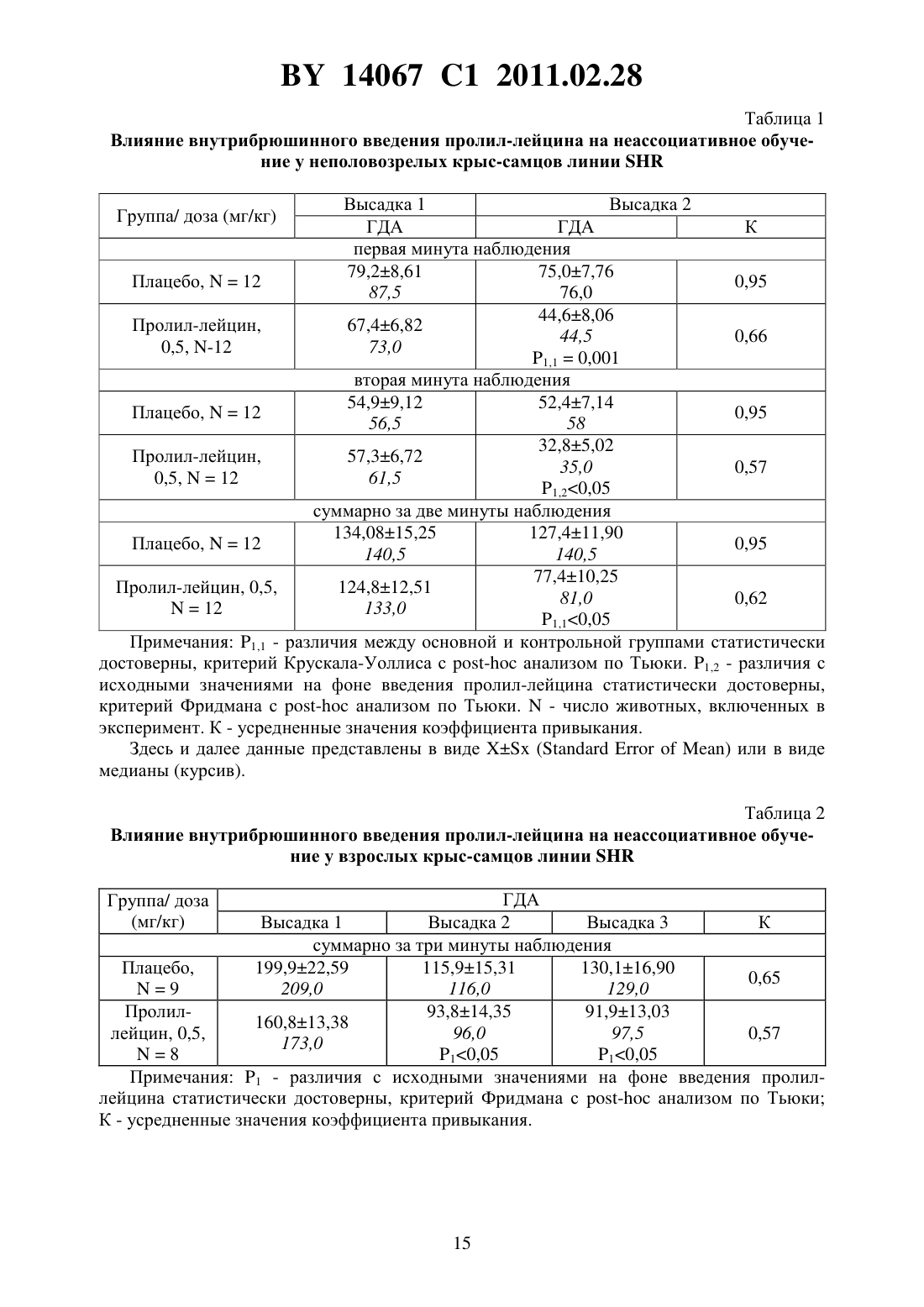
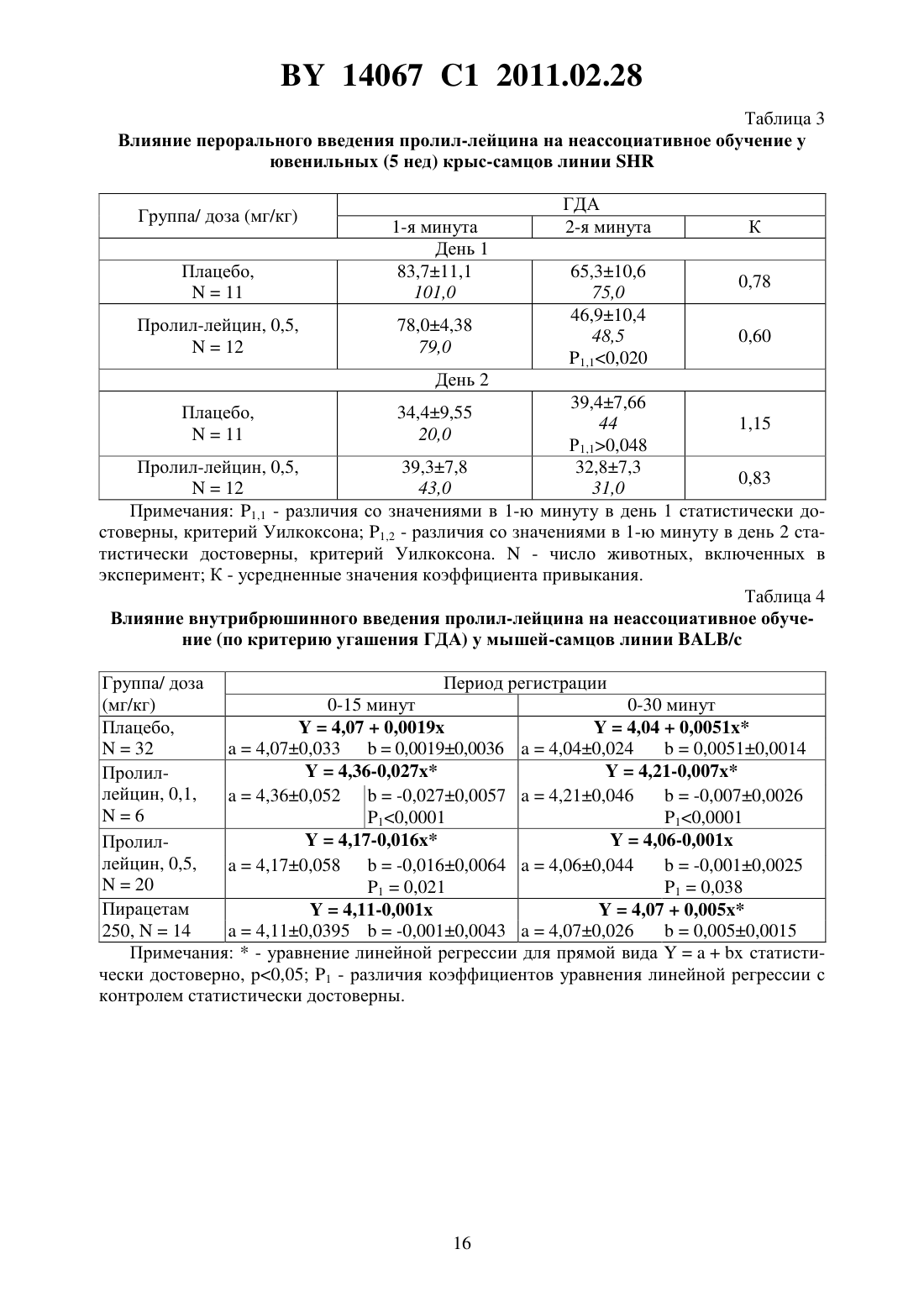
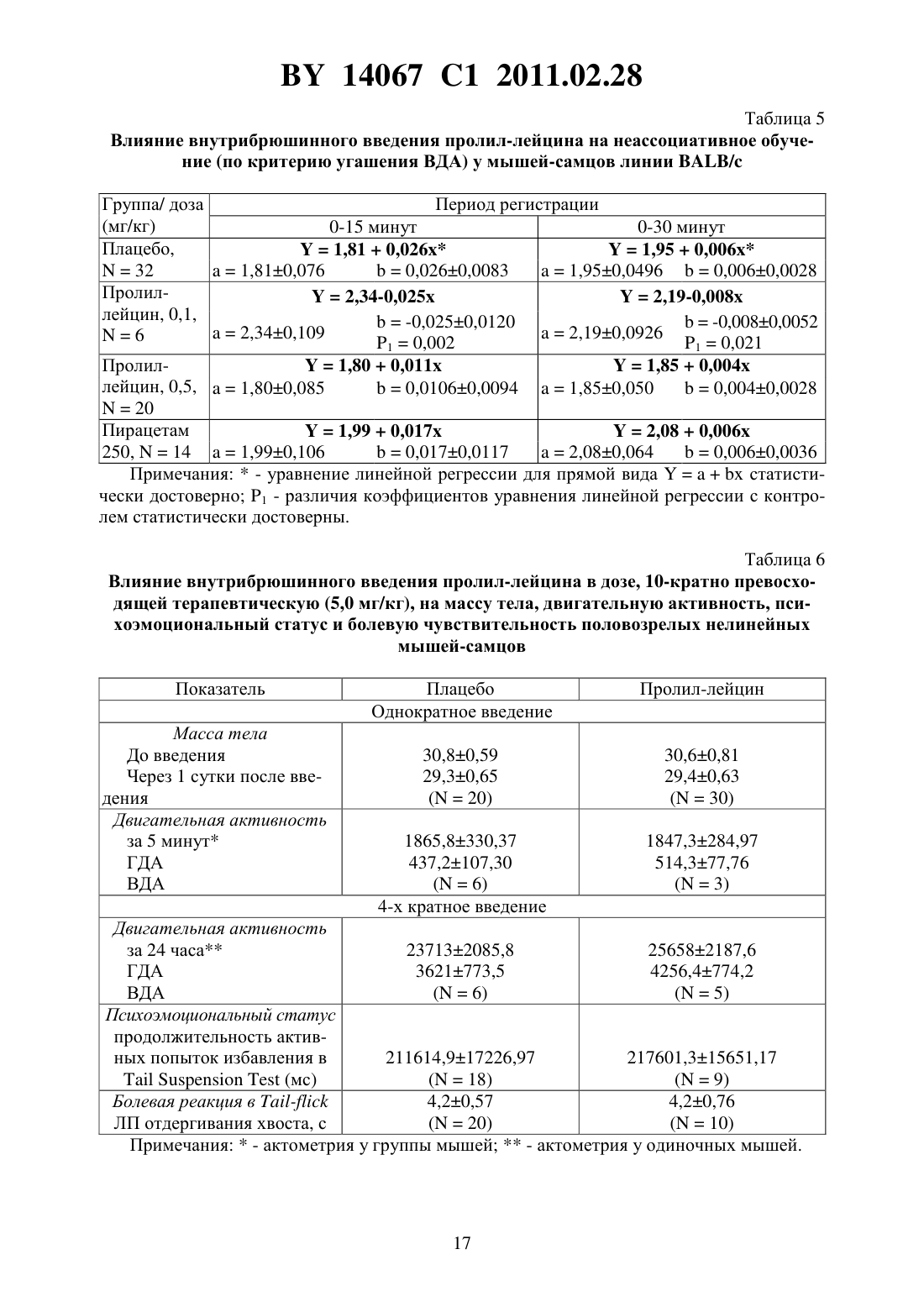
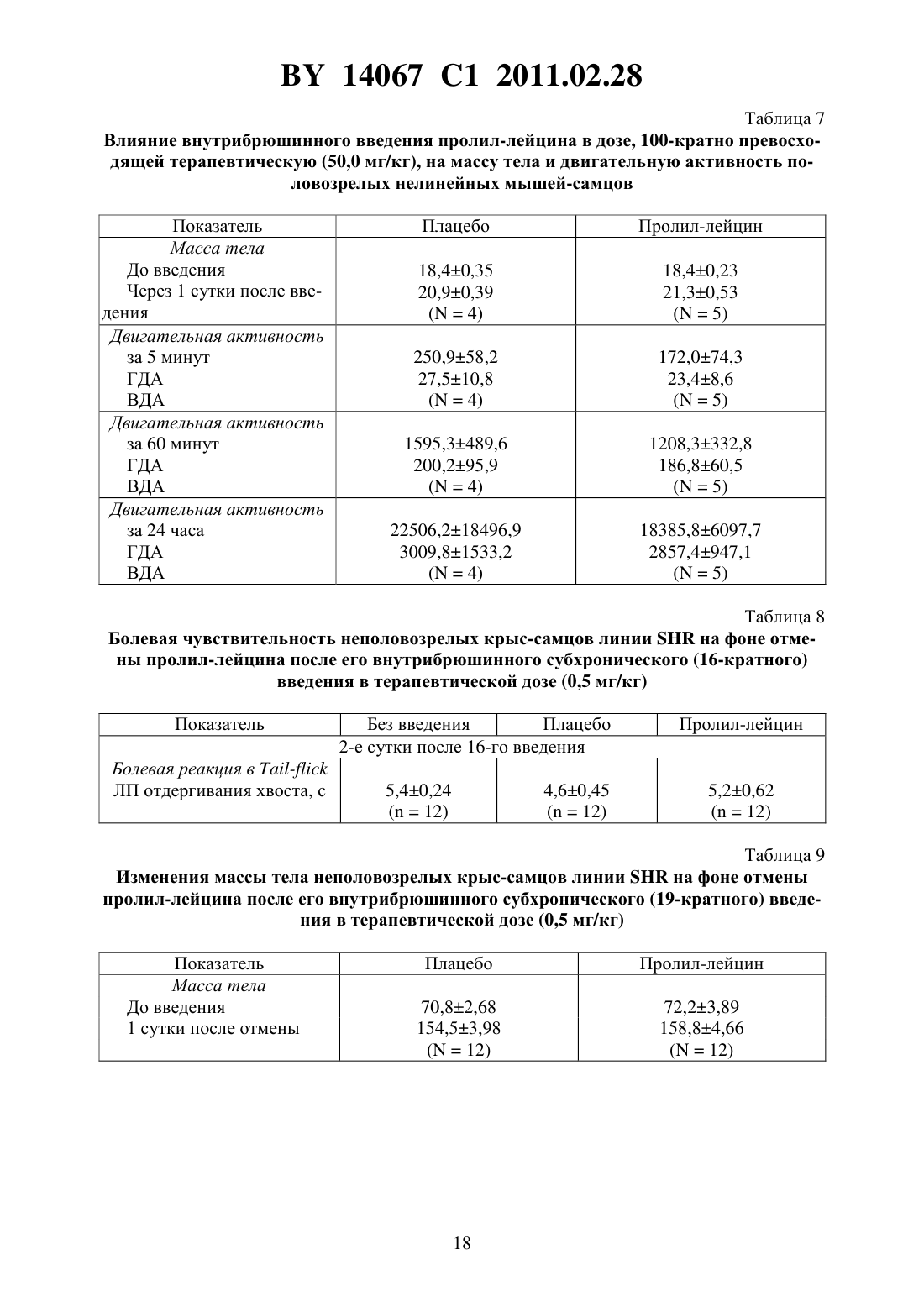
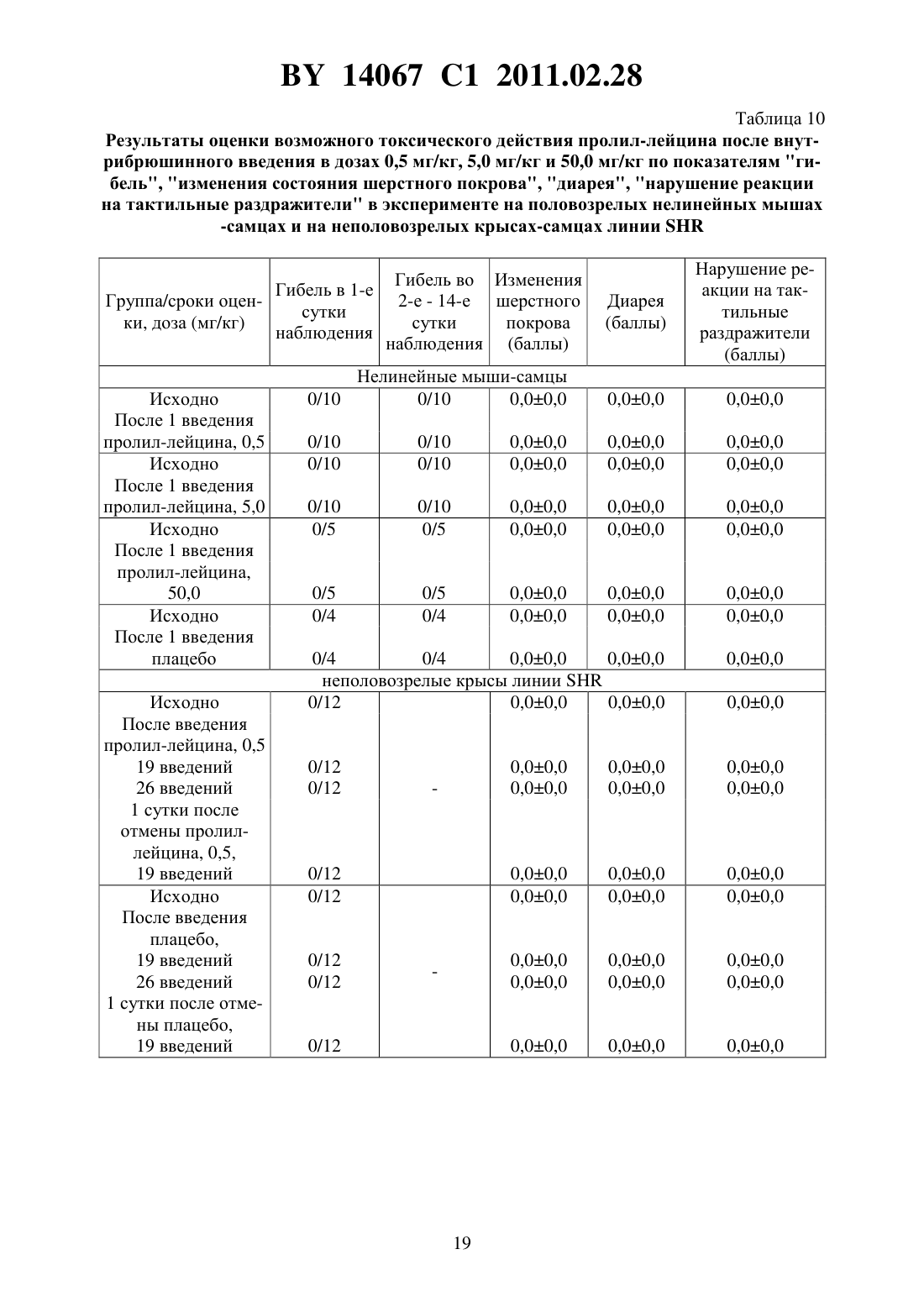
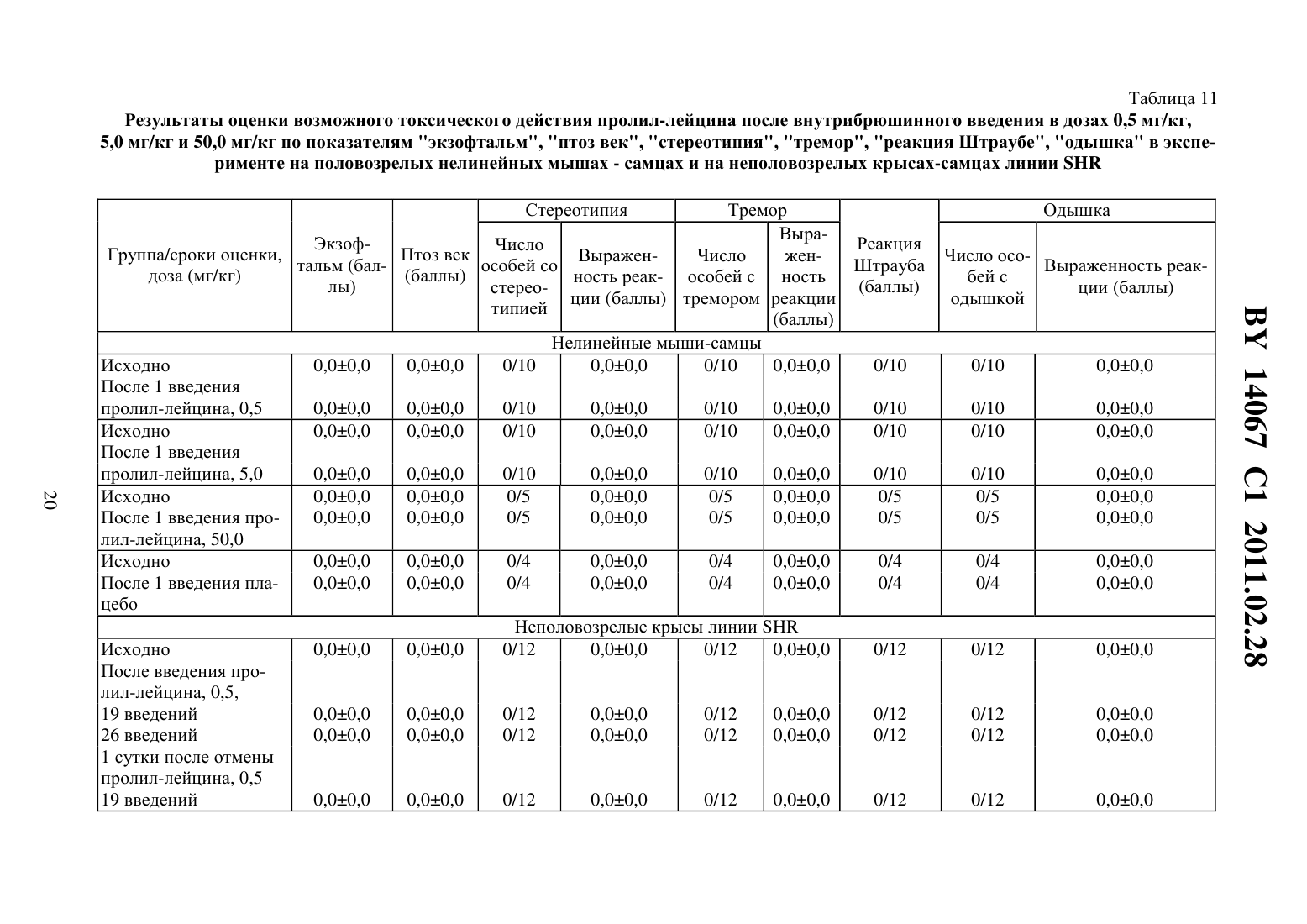
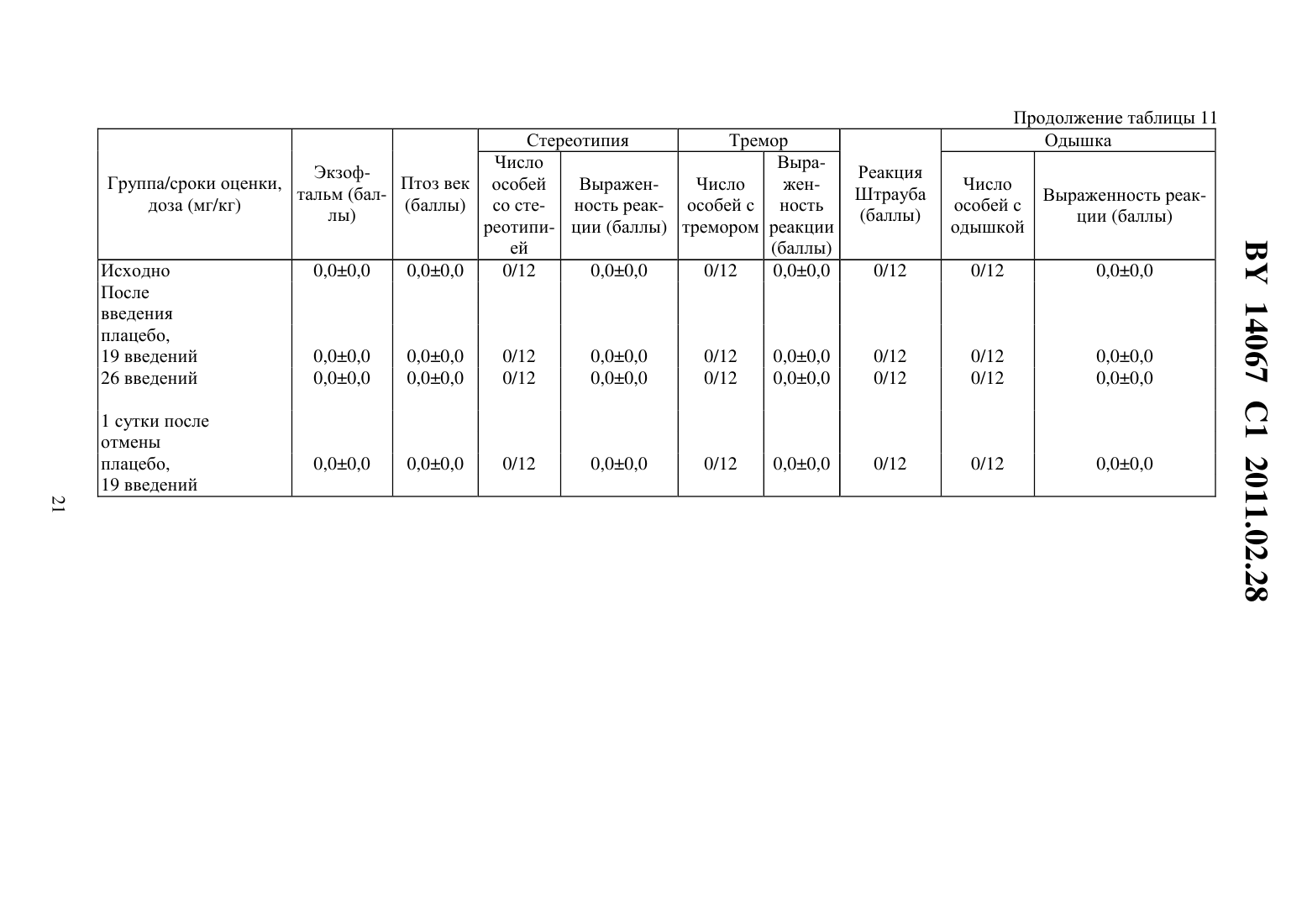
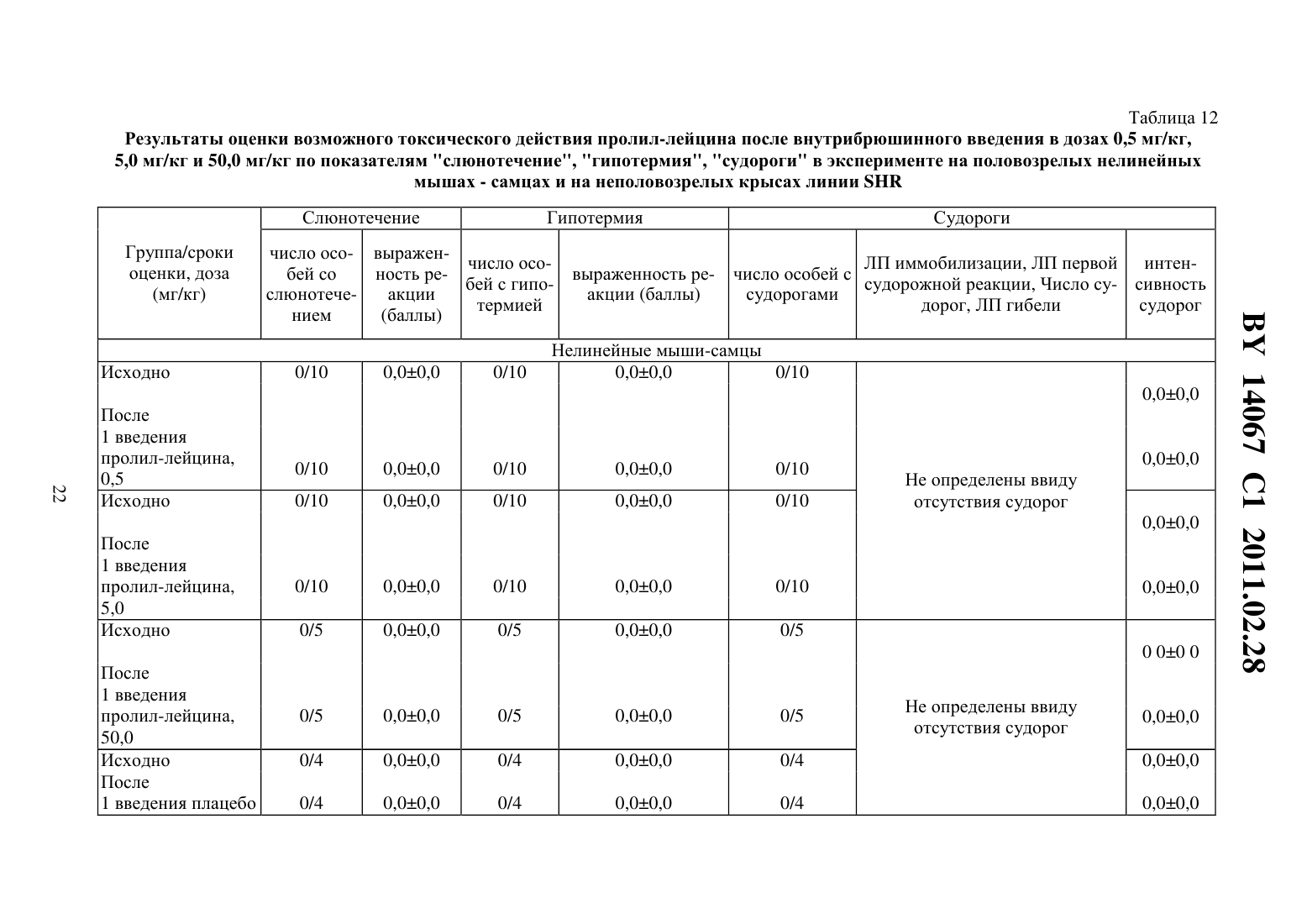
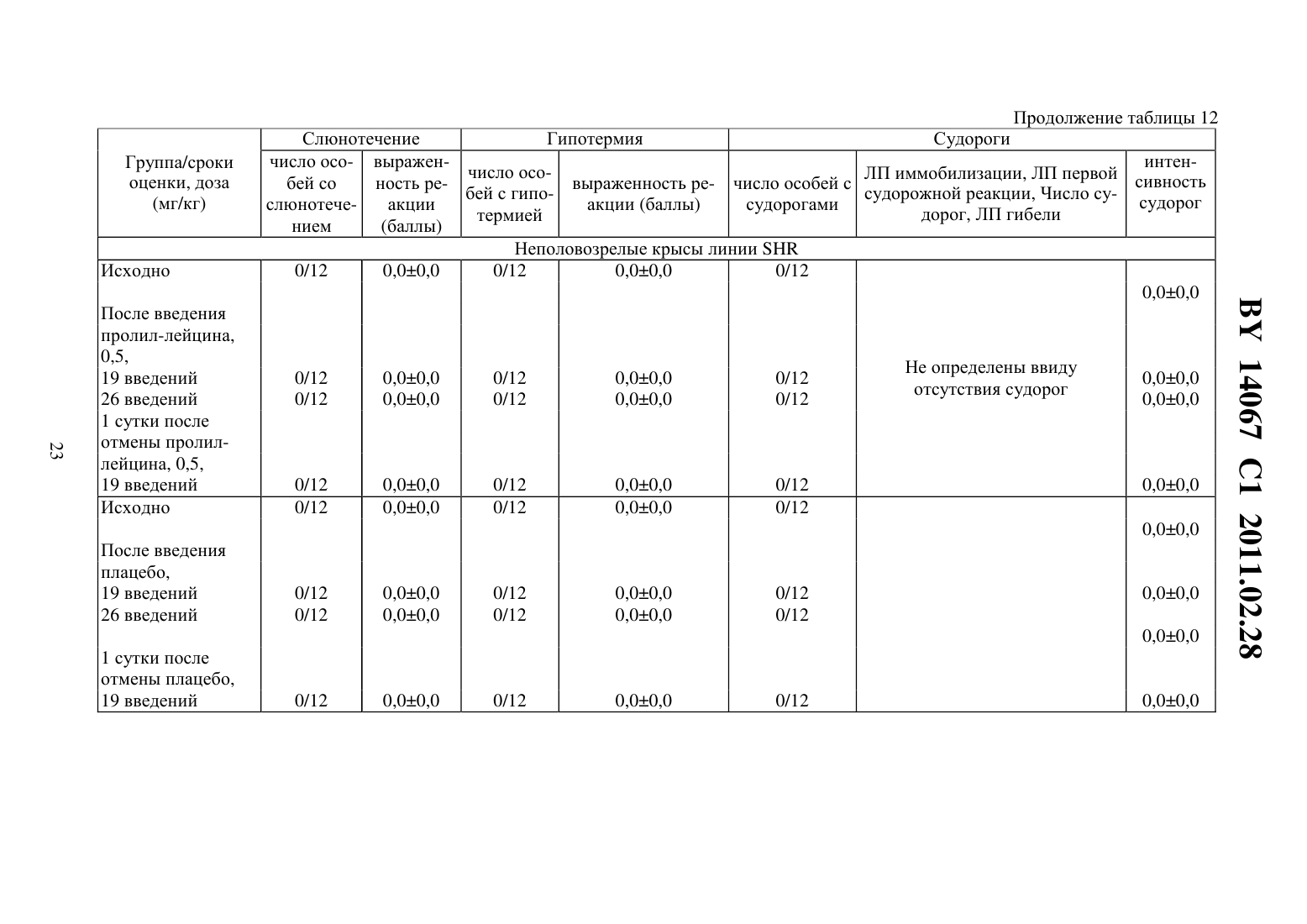
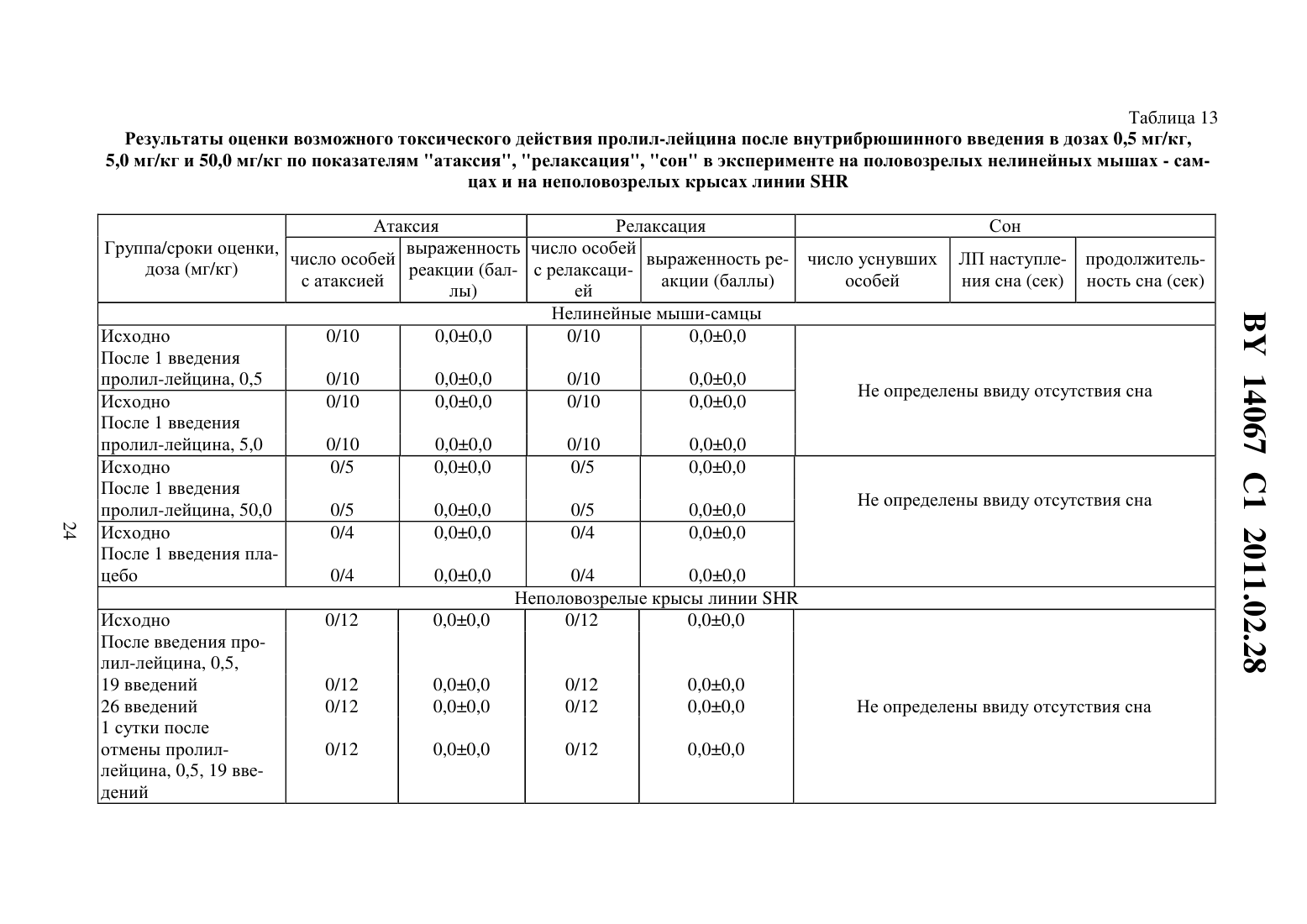
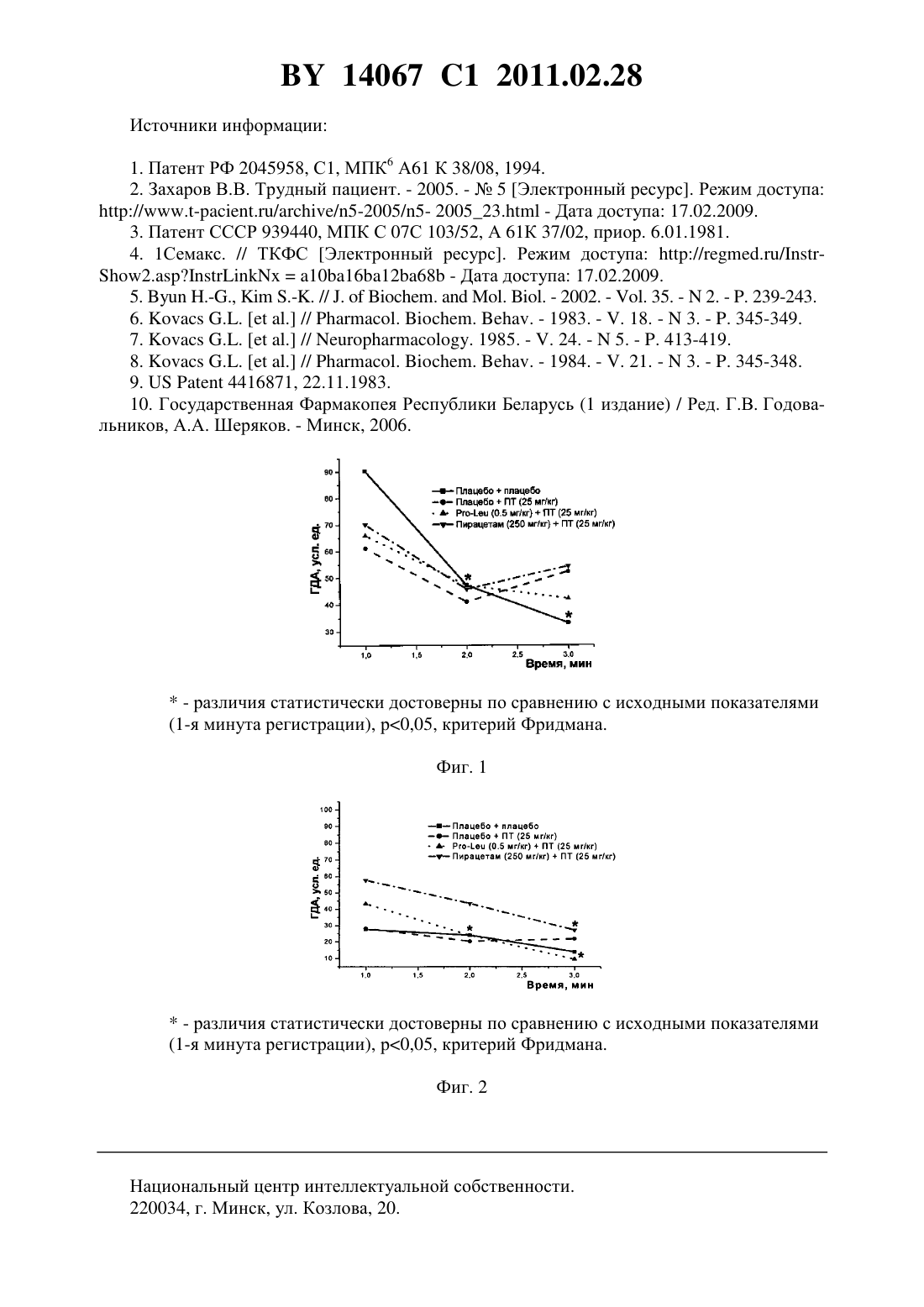
(51) МПК (2009) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ(71) Заявитель Государственное учреждение Научно-производственный центр Институт фармакологии и биохимии Национальной академии наук Беларуси(72) Авторы Романовский Дмитрий Иосифович Кравченко Елена Валериевна Максимова Лейла Вагиф кызы(73) Патентообладатель Государственное учреждение Научно-производственный центр Институт фармакологии и биохимии Национальной академии наук Беларуси(57) 1. Фармацевтическая композиция с ноотропным действием, содержащая пролиллейцин в эффективном количестве и фармацевтически приемлемые вспомогательные вещества. 2. Фармацевтическая композиция по п. 1, отличающаяся тем, что предназначена для приема внутрь и выполнена в форме таблетки, капсулы, гранул или порошка. 3. Фармацевтическая композиция по п. 1, отличающаяся тем, что предназначена для парентерального введения и выполнена в форме раствора, лиофилизированного порошка или стерильной сухой рассыпки. 4. Фармацевтическая композиция по п. 1, отличающаяся тем, что выполнена в форме таблетки и имеет следующий состав, г пролил-лейцин 0,0001-1,0 целлюлоза микрокристаллическая 0,015-0,450 лактоза 0,010-0,300 крахмал кукурузный 0,010-0,450 аэросил 0,001-0,010 поливинилпирролидон 0,004-0,020 магния стеарат 0,0005-0,0030. 5. Фармацевтическая композиция по п. 1, отличающаяся тем, что выполнена в форме твердой желатиновой капсулы, содержащей гранулы следующего состава, г пролил-лейцин 0,0001-1,0 14067 1 2011.02.28 целлюлоза микрокристаллическая 0,015-0,450 лактоза 0,010-0,300 крахмал кукурузный 0,010-0,450 аэросил 0,001-0,010 поливинилпирролидон 0,004-0,020 магния стеарат 0,0005-0,0030. 6. Фармацевтическая композиция по п. 1, отличающаяся тем, что выполнена в форме порошка для приема внутрь и имеет следующий состав, г пролил-лейцин 0,0001-1,0 лактоза 0,010-0,300. 7. Фармацевтическая композиция по п. 1, отличающаяся тем, что выполнена в форме раствора для инъекций и имеет следующий состав пролил-лейцин, г 0,0001-1,0-маннит, г 0,005-50,0 вода для инъекций, мл до 1-1000. 8. Фармацевтическая композиция по п. 1, отличающаяся тем, что выполнена в форме лиофилизированного порошка для инъекций и имеет следующий состав, г пролил-лейцин 0,0001-1,0-маннит 0,005-50,0. 9. Фармацевтическая композиция по п. 1, отличающаяся тем, что выполнена в форме стерильной сухой рассыпки и имеет следующий состав, г пролил-лейцин 0,0001-1,0-маннит 0,005-50,0. Изобретение относится к области медицины (фармакологии, психиатрии) и фармацевтической промышленности, и может быть использовано для повышения умственных способностей, профилактики и терапии нарушений высших психических функций у человека. В настоящее время широкое применение получили ноотропные средства, которые активизируют интегративные функции мозга, стимулируют обучение, память и умственную деятельность, повышают устойчивость мозга к повреждающим факторам. В англоязычной литературе для обозначения ноотропов нередко используется терминусилитель когнитивных функций. Пирацетам - наиболее известный представитель ноотропных препаратов, применяется на протяжении нескольких десятилетий. Вместе с тем, клинический эффект проявляется при назначении этого лекарственного средства в сравнительно высоких дозах терапевтическое действие отмечается через 2-3 недели, продолжительность курса лечения до 6 месяцев. При применении пирацетама возможно возникновение ряда побочных эффектов диспепсия, обострение коронарной недостаточности. Препарат противопоказан при выраженной почечной недостаточности 1. Церебролизин - комплекс пептидов и аминокислот, полученных из головного мозга свиньи. Препарат обладает достоверным клиническим эффектом, может использоваться для лечения когнитивных нарушений 2. Вместе с тем не удалось установить активное начало церебролизина. Действие церебролизина при когнитивных нарушениях является неспецифическим. Актовегин, представляющий собой высокоочищенный депротеинизированный гемодиализат, который получают методом ультрафильтрации из крови телят, предложен для лечения когнитивных нарушений 2. Для актовегина, как и для церебролизина, не установлено активное начало, эффект в отношении высших психических функций является неспецифическим. 2 14067 1 2011.02.28 Известно лекарственное средство семакс, которое, как и заявляемая композиция, обладает ноотропными свойствами, улучшает когнитивные функции 1. Активное вещество семакса является синтетическим аналогом фрагмента адренокортикотропного гормона(АКТГ) (4-10) с аминокислотной последовательностью метионин-глутамин-гистидинфенилаланин-пролил-глицин-пролин . Семакс, как и заявляемое соединение, относится к пролинсодержащим олигопептидам, предложен в качестве стимулятора памяти пролонгированного действия 3, являющегося основой ноотропного средства и фармацевтической композиции ноотропного действия 1 - прототип. Как для прототипа, так и для заявляемой композиции охарактеризованы количественные и качественные характеристики олигопептида, входящего в состав лекарственного средства. Как семакс, так и заявляемое соединение малотоксичны, хорошо переносятся при одно- и многократном использовании. Вместе с тем, семакс противопоказан к применению при расстройствах, сопровождаемых тревогой 4. Заявляемое соединение улучшает память и не оказывает какого-либо отрицательного влияния на общее состояние у мышей / (см. ниже пример 5), для которых характерен патологически высокий уровень тревожности. Семакс противопоказан при наличии судорог в анамнезе пациента 4. Для пролил-лейцина показано ноотропное действие и отсутствие побочных эффектов в экспериментах на мышах /,предрасположенных к развитию судорожного синдрома, а также в опытах на крысах с патологией, вызванной введением вещества, вызывающего судороги пентилентетразола (см. ниже примеры 4 и 5). Семакс не применяется внутрь и в виде инъекций. Существует принципиальная сложность его использования в клинической практике, связанная с интраназальным способом введения, не обеспечивающим точности дозирования (например,вследствие вытекания раствора из носовых ходов после закапывания), возникают неудобства при применении на работе, в путешествии и т.п., возможны выраженные индивидуальные колебания в скорости и полноте всасывания препарата, особенно при таких состояниях, как острый и хронический насморк, носовое кровотечение, возрастной атрофический ринит (особенно часто развивающийся у пожилых пациентов, в т.ч. на фоне приема лекарственных препаратов, влияющих на тонус сосудистого русла). Очевидны трудности точного применения семакса пациентами, имеющими когнитивные нарушения неточное введение пипетки с препаратом в носовые ходы, нарушение предписанной дозировки при подсчете числа капель. Заявляемая композиция эффективна при введении внутрь или в виде инъекций, что обеспечит точность и удобство дозирования лекарственного средства (см. примеры 1-5). Кроме того, заявляемое соединение, относящееся к классу ингибиторов ангиотензинпревращающего фермента 5, может обеспечить дополнительное лечебное действие, например снижение артериального давления, у больных с нарушениями высших психических функций на фоне артериальной гипертензии(АГ). Для семакса такой вид активности не описан. Задачей настоящего изобретения является выявление нового, полезного, ранее неописанного ноотропного действия у дипептида пролил-лейцина, а также направленная разработка лекарственного препарата с ноотропным действием на основе этого дипептида и разрешенных к медицинскому применению вспомогательных веществ. Настоящее изобретение направлено на выявление новых, ранее неизвестных у пролиллейцина ноотропных свойств и разработку фармацевтической композиции, включающей пролил-лейцин и вспомогательные вещества для приготовления готовой лекарственной формы, описанные в фармакопеях и разрешенные к медицинскому применению. Такая композиция может использоваться в качестве ноотропного лекарственного средства для повышения умственных способностей, профилактики и лечения нарушений памяти и способности к обучению, интеллектуальных расстройств, в т.ч. когнитивных нарушений при деменции легкой и умеренной степени выраженности. Пролил-лейцин (формула ,3, молекулярная формула - 11203) имеет молекулярную массу 228,29, регистрационный номер соединения по- 52899-07-7. Ряд фармакологических свойств пролил-лейцина, применяемого до настоящего времени в качестве химического реактива, описан в научной литературе. Известны данные,подтверждающие у заявляемого соединения свойства ингибитора ангиотензинпревращающего фермента (ИАПФ) 5. Соединения этого класса широко используются для лечения АГ. Опубликованы результаты изучения механизмов нейротропного действия заявляемого соединения 6-8, однако не даны рекомендации по его использованию. Замещенный пептид -карбобензокси-пролиллейцин предложен как средство для ингибирования развития толерантности и зависимости от морфина, однако не выявлено его влияние на память 9. Ноотропные свойства пролил-лейцина, как и содержащие его фармацевтические композиции с ноотропным действием не описаны. Поставленная задача решается тем, что в направленных психофармакологических экспериментах по стандартным методикам выявлено ноотропное действие пролиллейцина, разработана фармацевтическая композиция, включающая этот высокоактивный дипептид и разрешенные к медицинскому применению вспомогательные вещества. Техническим результатом, достигаемым при реализации изобретения, является обнаружение свойств стимулятора памяти и обучаемости у известного дипептида, выявление возможности его использования в низких дозах в качестве ноотропного средства и получение лекарственной формы, характеризующейся низкой токсичностью, обеспечивающей точность дозирования и удобство применения. Фармацевтическая композиция содержит в качестве основного действующего вещества пролил-лейцин в диапазоне доз 0,0005-1,0 г (предпочтительно - 0,0025-0,05 г). Предпочтительно, чтобы обе аминокислоты дипептида являлись -формами. Предпочтительно введение пролил-лейцина в виде пероральной или инъекционной лекарственной формы,поскольку при этих способах введения обеспечивается наибольшая точность дозирования активного вещества. К числу пероральных лекарственных форм, содержащих пролиллейцин, могут относиться таблетки, капсулы (в т.ч. мягкие и твердые), порошки и гранулы для орального применения. Инъекционной лекарственной формой, содержащей пролиллейцин, может быть раствор для инъекций (инфузий), или лиофилизированный порошок для приготовления раствора для инъекций (инфузий), или стерильная сухая рассыпка для приготовления раствора для инъекций (инфузий). При этом фармацевтическая композиция может содержать одно или несколько разрешенных к медицинскому применению вспомогательных веществ (целевых добавок), способных улучшить фармацевтические характеристики заявляемой композиции. К числу предпочтительных вспомогательных веществ относятся целлюлоза микрокристаллическая, лактоза (наиболее предпочтительно в виде моногидрата), крахмал, аэросил, поливинилпирролидон, магния стеарат, -маннит. В отличие от семакса, заявляемая композиция может применяться в виде лекарственной формы для приема внутрь или в виде инъекций, не противопоказана при повышенной тревожности, склонности к судорожным реакциям. От церебролизина, актовегина заявляемая композиция отличается тем, что может быть применена в виде лекарственных форм для приема внутрь, что обеспечивает удобство применения и точность дозирования. Заявляемая композиция отличается от семакса, пирацетама, церебролизина, актовегина тем,что она обладает свойствами ингибитора АПФ (это может обеспечить дополнительный антигипертензивный и другие лечебные эффекты, присущие этому классу лекарственных 4 14067 1 2011.02.28 средств). Заявляемая композиция отличается от семакса, пирацетама, церебролизина, актовегина наличием статистически значимого ноотропного эффекта при моделируемых в эксперименте когнитивных нарушениях на фоне АГ (см. примеры 1-3), тогда как для прототипа и препаратов сравнения такой эффект не показан. От церебролизина и актовегина заявляемая композиция отличается установленным действующим веществом (пролиллейцин), что обеспечивает точность дозирования, контроль параметров качества. Действующее вещество заявляемой композиции отличается от пирацетама высокой активностью (уровень эффективных доз в 2500 раз ниже) и возможностью применения при почечной недостаточности. Пример 1 Изучали эффективность пролил-лейцина (здесь и далее использована субстанция производства фирмы -, США, 1130-1) при инъекционном введении в условиях моделирования когнитивных расстройств на фоне АГ у неполовозрелых крыс-самцов линии в возрасте 5-6 недель (моделирование когнитивных расстройств у детей и подростков с гипертензией). Одной из элементарных форм обучения является габитуация (привыкание). Привыкание является примером неассоциативного обучения и состоит не в приобретении новых поведенческих реакций, а в их подавлении, поэтому его называют также негативным обучением. Одним из проявлений привыкания является ослабление во времени (угашение) исследовательско-ориентировочной реакции на новую обстановку вследствие ее оценки как биологически незначимой. Неполовозрелых крыс-самцов линииосновной и контрольной групп помещали в камеры актометра(Италия) поодиночке дважды с перерывом 3 суток между 1-й и 2-й высадками. Показатели двигательной активности регистрировали в 1-ю и 2-ю минуты наблюдения. Животным основной группы вводили пролил-лейцин в дозе 0,5 мг/кг внутрибрюшинно 5-кратно (1 инъекция в сутки, в т.ч. последние 2 введения за 30 минут до 1-й и 2-й высадок соответственно). Крысам контрольной группы применяли плацебо(здесь и далее -дистиллированная вода) при использовании того же режима введения. У животных без генетически обусловленных нарушений привыкание к окружающей обстановке проявляется постепенным снижением двигательной активности в горизонтальной плоскости (горизонтальная двигательная активность, ГДА). При 2-й и последующих высадках животные помнят, что уже находились в камере и совершают меньше движений при повторном обследовании установки (долговременная память габитуации). Это проявляется уменьшением ГДА и снижением коэффициента привыкания (К), определяемого здесь и далее по формуле ДА,(1) ДА 1 где ДА 1 - ГДА животных при 1-й высадке ДА - тот же показатель при каждой последующей высадке- порядковый номер высадки. Чем меньше абсолютное значение коэффициента К, тем глубже процесс привыкания (лучше неассоциативное обучение). Генетически обусловленный когнитивный дефицит у неполовозрелых крыс-самцов линиипроявляется ухудшением памяти, и при 2-й высадке активность этих животных как в 1-ю минуту, так и во 2-ю минуту, а также за 2 минуты наблюдения практически не изменяется по сравнению с теми же показателями при первом обследовании камеры(табл. 1). Средние значения коэффициента угашения К близки к 1,0 (0,95 - в 1-ю, 2-ю минуту, и за 2 минуты наблюдения), что подтверждает нарушение процессов привыкания(табл. 1). Напротив, при введении пролил-лейцина уже в 1-ю минуту наблюдения при 2-й высадке имеется отчетливая тенденция к снижению двигательной активности в сравнении с 1-й высадкой. Во 2-ю минуту регистрации при повторном помещении в камеру актометра активность неполовозрелых крыс-самцов линииосновной группы была статистиче 5 14067 1 2011.02.28 ски значимо ниже, чем при первом обследовании камеры в те же сроки. Значения К на фоне введения пролил-лейцина 0,66 - в 1-ю минуту, 0,57 - во 2-ю минуту и 0,62 - за 2 минуты наблюдения (табл. 1). В связи с развитием привыкания у крыс основной группы ГДА статистически достоверно ниже, чем в контроле, за 1-ю минуту и суммарно за 2 минуты наблюдения (табл. 1). Это говорит о существенном улучшении неассоциативного обучения под действием пролил-лейцина. Указанная активность проявляется в условиях инъекционного введения у неполовозрелых линейных спонтанно гипертензивных крыс с нарушениями когнитивной сферы, что не описано для семакса. Пример 2 Изучали эффективность пролил-лейцина при инъекционном введении в условиях моделирования когнитивных расстройств, деменции легкой выраженности на фоне АГ у взрослых крыс-самцов линиив возрасте 6 месяцев. Использование взрослых животных этой линии рекомендовано для моделирования когнитивных нарушений (особенно связанных с гипертензией и нарушениями со стороны холинергической нейротрансмиттерной системы). В возрасте 6 месяцев у крысотмечаются гипертензивные повреждения мозга, напоминающие сосудистую деменцию. Крыс-самцов линииосновной и контрольной групп помещали в камеры актометра(Италия) поодиночке трижды с перерывом 3 суток между 1-й и 2-й высадками 2-ю и 3-ю высадки осуществляли на протяжении двух последовательных дней. Регистрировали показатели ГДА за 3 минуты наблюдения. Животным основной группы вводили пролил-лейцин в дозе 0,5 мг/кг внутрибрюшинно 6-кратно (1 инъекция в сутки, в т.ч. последние 3 введения - за 30 минут до 1-й, 2-й и 3-й высадок соответственно). Крысам контрольной группы применяли плацебо при использовании того же режима введения. Генетически обусловленные нарушения памяти у взрослых крыс-самцовконтрольной группы проявляется в отсутствии статистически достоверного снижения двигательной активности в камере актометра от 1-й к 3-й высадке за 3 минуты наблюдения(табл. 2). При введении пролил-лейцина двигательная активность животных за 3 минуты регистрации как при 2-й, так и при 3-й высадках статистически значимо уменьшается по сравнению с исходным уровнем ГДА (табл. 2). Это свидетельствует о существенном облегчении неассоциативного обучения на фоне инъекционного введения пролил-лейцина у 6-месячных линейных спонтанно гипертензивных крыс с нарушениями когнитивной сферы, гипертензивными повреждениями мозга (модель сосудистой деменции), что не описано для семакса. Пример 3 Изучали эффективность пролил-лейцина при пероральном введении в условиях моделирования когнитивных расстройств на фоне АГ у неполовозрелых крыс-самцов линиив возрасте 5 недель. Неполовозрелых крысосновной и контрольной групп помещали в камеры актометра(Италия) поодиночке дважды с перерывом 3 суток между 1-й и 2-й высадками. Показатели ГДА регистрировали в 1-ю и 2-ю минуты наблюдения. Животным основной группы вводили пролил-лейцин в дозе 0,5 мг/кг перорально 5-кратно (1 введение в сутки, в т.ч. последние 2 введения за 30 минут до 1-й и 2-й высадок соответственно). Крысам контрольной группы применяли плацебо при использовании того же режима введения. Известно, что запоминание окружающей обстановки при однократном помещении животного в новую среду обитания проявляется постепенным снижением двигательной активности (краткосрочная память внутрисессионная габитуация). У ювенильных крыссамцов линииконтрольной группы снижение подвижности в камере актометра от 1-й ко 2-й минуте в день 1 наблюдения не является статистически достоверным (табл. 3). При пероральном применении пролил-лейцина ГДА животных от 1-й ко 2-й минуте статистически значимо уменьшается ГДА (табл. 3). Это свидетельствует о существенном облегче 6 14067 1 2011.02.28 нии неассоциативного обучения под действием пролил-лейцина. Во 2-й день нарушения неассоциативного обучения в контрольной группе проявляются статистически достоверным возрастанием ГДА от 1-й ко 2-й минуте наблюдения. У животных, получавших перорально пролил-лейцин, такой поломки нет. Указанная ноотропная активность заявляемого соединения у ювенильных спонтанно гипертензивных крыспроявляется при пероральном (обеспечивающем большее удобство и точность дозирования, чем интраназальное) введении, что является его преимуществом по отношению к прототипу (семакс). Пример 4 Изучали эффективность пролил-лейцина при инъекционном введении половозрелым аутбредным крысам-самцам(в возрасте 3 месяцев). Моделировали когнитивные расстройства путем введения пентилентетразола, блокирующего ионофор ГАМКАрецептора, способного вызывать судороги, повышение уровня тревожности и амнезию у крыс. Крыспомещали в камеры актометра(Италия) поодиночке дважды с перерывом 3 суток между 1-й и 2-й высадками. Показатели двигательной активности регистрировали в 1-ю, 2-ю и 3-ю минуты наблюдения. Степень нарушения запоминания животными обстановки в камере оценивали следующим образом. Чем выше уровень двигательной активности в каждую последующую минуту пребывания в актометре по отношению к 1-й минуте (в 1-ю или 2-ю высадки), тем хуже краткосрочная память. Чем больше подвижность крысы в 1-ю минуту при повторном нахождении в актометре по отношению к соответствующему промежутку времени при первом помещении в камеру, тем хуже долгосрочная память животного. Крысам группы 1 (контрольная группа) применяли плацебо внутрибрюшинно 5 кратно (1 введение в сутки, в т.ч. последние 2 введения за 30 минут до 1-й и 2-й высадок соответственно) и подкожно 1-кратно за 30 минут до 1-й высадки. Крысам группы 2 (активный контроль, моделирование поломки) применяли плацебо внутрибрюшинно 5 кратно (1 введение в сутки, в т.ч. последние 2 введения за 30 минут до 1-й и 2-й высадок соответственно), пентилентетразол - в дозе 25,0 мг/кг, подкожно 1-кратно за 30 минут до 1-й высадки. Животным группы 3 (основная группа 1) вводили пролил-лейцин в дозе 0,5 мг/кг внутрибрюшинно 5-кратно (1 введение в сутки, в т.ч. последние 2 введения за 30 минут до 1-й и 2-й высадок соответственно), пентилентетразол - в дозе 25,0 мг/кг, подкожно 1-кратно за 30 минут до 1-й высадки. Животным группы 4 (основная группа 2) вводили пирацетам в дозе 250 мг/кг внутрибрюшинно 5-кратно (1 введение в сутки, в т.ч. последние 2 введения за 30 минут до 1-й и 2-й высадок соответственно), пентилентетразол в дозе 25,0 мг/кг, подкожно 1-кратно за 30 минут до 1-й высадки. Полученные в эксперименте данные представлены на фиг. 1, фиг. 2. На фиг. 1 показано влияние внутрибрюшинного введения пролил-лейцина на неассоциативное обучение у половозрелых крыс-самцов ,нарушенное пентилентетразолом (ПТ), при первой высадке в камеру актометра, на фиг. 2 - влияние внутрибрюшинного введения пролиллейцина на неассоциативное обучение у половозрелых крыс-самцов , нарушенное пентилентетразолом, при второй высадке. У крыс контрольной группы (группа 1) как при 1-й, так и при 2-й высадках, ГДА во 2-ю и 3-ю минуты регистрации достоверно снижалась относительно исходных значений в этот же день наблюдения (0,05, критерий Фридмана с - анализом по НьюменуКейлсу) (рисунок 1). У животных групп 2-4 статистически значимого угашения локомоторной активности в указанные сроки не отмечалось. При повторном помещении в камеру актометра у животных, которым вводили пентилентетразол и пролил-лейцин, отмечена нормализация поведения - достоверное угашение ГДА во 2-ю и 3-ю минуты актометрии(0,05, критерий Фридмана с - анализом по Ньюмену-Кейлсу), а у крыс, которым вводили пентилентетразол и пирацетам, - только в 3-ю минуту (0,05, критерий Фридма 7 14067 1 2011.02.28 на с - анализом по Ньюмену-Кейлсу) (фиг. 1). Таким образом, пролил-лейцин эффективно предотвращает отрицательное влияние модельного анксиогена/конвульсогена на краткосрочную память, превосходя по эффективности пирацетам. Подвижность животных контрольной группы в 1-ю минуту повторного нахождения в актометре статистически значимо ниже соответствующего показателя при первом помещении в экспериментальную установку (0,018, критерий Уилкоксона). На фоне введения пентилентетразола достоверного межсессионного снижения уровня ГДА не происходит, что свидетельствует о нарушении долговременной памяти. В случае введения пентилентетразола на фоне пролил-лейцина или пирацетама угашение локомоции, отражающее улучшение долговременной памяти, является статистически значимым (0,048,критерий Уилкоксона). Таким образом, пролил-лейцин в условиях инъекционного введения оказывает облегчающее влияние как на краткосрочную, так и на долговременную память у крысс нарушением ГАМК-ергической нейротрансмиссии, вызванным введением анксиогена/хемоконвульсанта пентилентетразола. Для прототипа (семакс) описано облегчающее влияние только на долговременную (но не на краткосрочную) память габитуации 1, что указывает на преимущества заявляемого соединения в отношении прототипа. Для семакса отсутствуют данные, подтверждающие улучшение когнитивных функций в поведенческом эксперименте у животных с моделируемой патологией ГАМК-ергической системы. Преимуществом заявляемого соединения перед прототипом является и то, что семакс противопоказан к применению при повышенной тревожности и судорогах в анамнезе, тогда как пролил-лейцин в условиях описанного в этом примере моделирования подобных состояний улучшает состояние животных. Пример 5 Изучали эффективность пролил-лейцина при инъекционном введении в условиях моделирования когнитивных расстройств на фоне такого фактора риска развития АГ, как длительные психоэмоциональные нагрузки. Эксперименты проводили на 2-х месячных мышах линии /, неустойчивых к действию психоэмоционального стресса, характеризующихся генетически обусловленным патологически высоким уровнем тревожности и повышенной склонностью к развитию судорожных реакций. У мышей линии / отмечаются нарушения как краткосрочной, так и долговременной памяти при угашении исследовательско-ориентировочной реакции. Мышам основной группы 1 и основной группы 2 вводили пролил-лейцин в дозах 0,1 мг/кг и 0,5 мг/кг соответственно внутрибрюшинно, однократно (за 30 минут до высадки в камеру актометра), животным основной группы 3 применяли пирацетам в дозе 250 мг/кг с использованием того же режима введения. Мышам контрольной группы применяли плацебо по той же схеме. Запись актограмм ГДА и вертикальной двигательной активности (ВДА) осуществляли в многоканальном актометре(Италия) в условиях однократной высадки. Наблюдение за животными вели на протяжении 30 минут (продолжительность единичного интервала регистрации - 1 мин). Инбредных мышей-самцов / помещали в камеры актометра поодиночке. Процесс привыкания описывали с помощью уравнений линейной регрессии для построения прямойиспользовали натуральные логарифмы значений ГДА и ВДА. При этом коэффициентхарактеризует исходный уровень ГДА или ВДА (чем выше , тем выше начальная активность), а коэффициентотражает выраженность привыкания (чем ниже значения , тем более выражено неассоциативное обучение). Оценку статистической значимости результатов при сравнении коэффициентов уравнений линейной регрессии проводили с использованиемкритерия Стьюдента. Нарушения краткосрочной памяти у мышей / проявляются отсутствием статистически значимого угашения исследователько-ориентировочной реакции как за 15 минут, так и за 30 минут наблюдения. Напротив, с течением времени отмечается возрастание 8 14067 1 2011.02.28 ГДА (табл. 4) и ВДА (табл. 5), о чем свидетельствуют положительные значения коэффициента . Применение пирацетама несколько снижает значения показателя , однако изменения статистически незначимы и проявляются лишь в первые 15 минут наблюдения. Введение заявляемого соединения в обеих испытуемых дозах приводит к достоверному улучшению обучения, проявляющемуся постепенным снижением локомоции (отрицательные значения коэффициента , статистически отличающиеся от таковых в контроле как при 15-минутном, так и при 30-минутном наблюдении) - табл. 4. Аналогичное статистически достоверное снижение числа вертикализаций отмечено у животных, получавших пролил-лейцин (0,1 мг/кг), при 15-минутной и 30-минутной актометрии (табл. 5). Таким образом, пролил-лейцин в условиях инъекционного введения оказывает облегчающее влияние на когнитивные функции (краткосрочную память габитуации) у мышей/ с патологически высоким уровнем тревожности. При этом эффективность пролил-лейцина выше, чем у стандартного ноотропа пирацетама. Для прототипа (семакс) описано облегчающее влияние только на долговременную (но не на краткосрочную) память габитуации 1, что указывает на преимущества заявляемого соединения в отношении прототипа. Приведенные в этом примере данные указывают на предотвращение пролил-лейцином когнитивных нарушений на фоне продолжительного психоэмоционального стресса, что не описано для семакса. Преимуществом заявляемого соединения перед прототипом является и то, что семакс противопоказан к применению при повышенной тревожности и судорогах в анамнезе, тогда как пролил-лейцин улучшает состояние мышей / с соответствующими генетически обусловленными нарушениями. Пример 6 Было изучено влияние пролил-лейцина на поведение белых половозрелых нелинейных мышей-самцов и их двигательную активность, а также его острая токсичность. Животным основных групп вводили дипептид внутрибрюшинно в терапевтической дозе(0,5 мг/кг) и в дозах, 10-кратно (5,0 мг/кг) и 100-кратно (50,0 мг/кг) превышающих терапевтическую. Мышам контрольных групп применяли плацебо. Накануне введения пролил-лейцина или плацебо проводилась оценка исходного состояния нервной системы животных с использованием батареи тестов оценки нейротропной активности. Число погибших животных после однократной внутрибрюшинной инъекции плацебо или пролил-лейцина в дозах 0,5 мг/кг и 5,0 мг/кг регистрировали на протяжении 1 суток, после однократного внутрибрюшинного введения плацебо или пролил-лейцина в дозе 50,0 мг/кг - в течение 14 суток. Визуальную и инструментальную оценку поведенческих реакций осуществляли в сроки до 24 часов после введения тестируемых образцов. Отмечали отсутствие/наличие изменений внешнего вида и шерстного покрова животных, а также диареи, нарушения реакции на тактильные раздражители,одышки, слюнотечения, гипотермии. Определяли число мышей, у которых введение пролил-лейцина вызывало один из указанных характерных симптомов, а также отмечали выраженность этих симптомов в баллах по 4-х балльной шкале 0 баллов - отсутствие реакции, 1 - слабо выраженная реакция, 2 - отчетливая, умеренно выраженная реакция, 3 сильно выраженная реакция. Проводили регистрацию отсутствия/наличия экзофтальма,птоза век, стереотипии (упорное повторение какого-либо сложного, но бессмысленного действия, которое каждый раз выполняется тем же самым способом, что и раньше), тремора и судорог у экспериментальных животных. При наличии судорог указывали, имеют место судороги клонические, тонические или клонико-тонические определяли время иммобилизации, латентный период наступления первой клонико-тонической судороги, количество приступов, время гибели. Интенсивность судорожного припадка оценивали по 5 ти балльной системе 0 баллов - отсутствие судорожных реакций, 1 - вздрагивания головы или отдельных мышц тела, 2 - отдельные повторные клонические вздрагивания всего тела,3 - клонико-тонические судороги умеренной выраженности 4 - клонико-тонические судороги с падением животного на бок 5 - серийные клонико-тонические судороги и смерть. 9 14067 1 2011.02.28 Регистрировали отсутствие/наличие реакции Штрауба (ригидность хвоста у мышей, хвост запрокинут за спину и изогнут в виде буквы ). Оценивали наличие/отсутствие атаксии у экспериментальных животных регистрировали расстройства координации движений(непроизвольные движения, неуверенная шатающаяся походка, затруднения при ходьбе). Отмечали отсутствие/наличие релаксации и сна на фоне введения образца при возникновении бокового положения у мышей отмечали латентное время наступления и его продолжительность (время восстановления рефлекса переворачивания у животных), число животных, у которых вещество в исследуемой дозе вызывает характерный симптом (сон). Кроме того, до введения и спустя 1 сутки после острого введения пролил-лейцина(5,0 мг/кг и 50,0 мг/кг) или плацебо определяли массу тела мышей. Регистрировали в актометре(Италия) число движений, совершаемых животными в горизонтальной и вертикальной плоскостях - ГДА и ВДА мышей. Исследования проводили через 30 минут после однократного внутрибрюшинного введения плацебо или пролил-лейцина в дозе 5,0 мг/кг. Возможное влияние пролил-лейцина в вышеуказанных условиях на зоосоциальные взаимодействия оценивали, учитывая данные о двигательной активности мышей, помещаемых группой (по 10 животных одновременно) на 5 минут в камеры аппарата. В актометре отечественного производства определяли показатели ГДА и ВДА на фоне внутрибрюшинного введения плацебо или дипептида при высадке поодиночке на 24 часа(после 4-кратного введения в дозе 5,0 мг/кг) и при помещении поодиночке в камеру на 5 минут, 60 минут и 24 часа (после 1-кратного введения в дозе 50,0 мг/кг). Эффекты 4-кратного (1 инъекция в сутки) внутрибрюшинного введения плацебо или пролил-лейцина в дозе 5,0 мг/кг в отношении психоэмоционального статуса животных изучали в тесте. Этот тест основан на оценке поведения животных в неизбегаемой ситуации. Снижение активности и увеличение времени неподвижности по сравнению с контролем указывает на повышенную склонность к депрессии. Наблюдение за животными продолжали на протяжении 6 минут. В качестве базисного критерия, характеризующего психофизиологический статус животных, использовали показатель суммарная продолжительность активных попыток избавления. Регистрировали отсутствие/наличие анальгезии после 4-кратного (1 инъекция в сутки) внутрибрюшинного введения плацебо или пролил-лейцина в дозе 5,0 мг/кг. Болевую чувствительность оценивали в тесте отдергивания хвоста при нанесении теплового стимула(-) с использованием соответствующей аппаратуры фирмы , США. Животное не жестко фиксировали в прозрачном цилиндре так, чтобы хвост находился снаружи между сфокусированным лучом яркого света и фотодатчиком. Измеряли время до отдергивания хвоста, используя автоматическую оценку латентного периода (ЛП) отдергивания. Увеличение ЛП отдергивания хвоста является свидетельством уменьшения болевой чувствительности. Установлено, что разовое введение пролил-лейцина в дозе, 10-кратно превосходящей терапевтическую, не вызывает гибели белых нелинейных мышей-самцов, не нарушает общего состояния и не ведет к изменению массы тела, не отражается на показателях двигательной активности за 5 минут, не влияет на поведенческие реакции при зоосоциальных взаимодействиях (в условиях групповой актометрии) (табл. 6, 10-13). Подострое 4 кратное введение дипептида в той же дозе не приводит к гибели животных, не влияет на ГДА и ВДА за 24 часа, не вызывает депрессивно-подобных реакций ви не изменяет порога болевой чувствительности у мышей в тесте - (табл. 6, 10-13). Однократное внутрибрюшинное введение пролил-лейцина в дозе, 100-кратно превосходящей терапевтическую дозу, не вызывает гибели животных, не влияет на массу тела, не приводит к существенному изменению двигательной активности за 5 минут, 60 минут и за 24 часа, не влечет за собой патологических изменений в общем состоянии мышей (табл. 7,10-13). Статистически достоверных различий между группами сравнения ни по одному из 10 14067 1 2011.02.28 названных критериев не обнаружено, что свидетельствует о хорошей переносимости пролиллейцина, вводимого в дозах, 10-кратно и 100-кратно превосходящих терапевтическую. Из приведенных экспериментальных данных следует, что системное применение пролил-лейцина в дозе, 100-кратно превышающей терапевтическую дозу, не вызывает гибели и проявлений токсического действия у лабораторных мышей. Пример 7 Изучено влияние субхронического внутрибрюшинного введения пролил-лейцина (19 и 26 инъекций, 1 инъекция в сутки, 5-7 дней в неделю) в терапевтической дозе (0,5 мг/кг) на поведение неполовозрелых крыс-самцов линии(основная группа). Животным контрольной группы применяли плацебо. Оценка потенциального токсического действия дипептида проведена в батарее тестов согласно вышеприведенным критериям оценки на протяжении 1 суток после применения (пример 6). Установлено, что субхроническое внутрибрюшинное введение пролил-лейцина не вызывает ухудшения общего состояния и гибели животных (табл. 10-13). Пример 8 Возможность возникновения абстинентного синдрома на фоне пролил-лейцина оценивали в условиях острой отмены после его субхронического введения неполовозрелым крысам-самцам линиив терапевтической дозе (0,5 мг/кг, 16 и 19 инъекций, 1 инъекция в сутки, 5-7 дней в неделю) - основная группа. Животным контрольной группы применяли в те же сроки плацебо. Общепринятым тестом, позволяющим оценить возникновение абстинентного синдрома, является реакция вздрагивания. Крысамосновной и контрольной групп спустя 1 сутки после 19-го введения пролил-лейцина или плацебо предъявляли 5 громких звуковых стимулов с интервалом 18 с в момент, когда животные всеми 4-мя лапами стояли на полу. Параметры звука частота - 10 кГц, интенсивность 110 децибел, длительность звукового стимула - 200 мс, время нарастания импульса - 50 мс. Реакцию оценивали в баллах 0 баллов - видимое отсутствие реакции, 1- замирание, 2-вздрагивание, 3 - прыжок. Усиление реакции вздрагивания является компонентом синдрома отмены, который наиболее выражен в первые - вторые сутки после прекращения введения испытуемого вещества. Показано, что отмена пролил-лейцина не вызывает усиления указанной реакции. Средние значения оценки этого критерия статистически значимо не отличаются в группах сравнения, при этом в основной группе она даже ниже, чем в контроле (1,60,14 баллов и 1,730,12 баллов соответственно). Ни у одной из 12-ти крыс основной группы и 12-ти особей контрольной группы не отмечено реакции, оцениваемой 3-мя баллами. Другим общепринятым тестом, с помощью которого определяют возможность развития абстинентного синдрома после отмены тестируемого вещества, является тест . Латентный период отдергивания хвоста (см. пример 6) у неполовозрелых крыссамцов линииопределяли спустя 2 суток после 16-го введения плацебо или пролиллейцина (0,5 мг/кг, 1 инъекция в сутки, 5-7 дней в неделю). Абстинентный синдром,наиболее выраженный в первые-вторые сутки лишения применявшегося вещества, характеризуется резко выраженным увеличением болевой чувствительности, которая, как правило, превышает таковую у интактных животных. Отмена пролил-лейцина после 16 кратного введения не приводит к снижению латентного периода отдергивания хвоста, что свидетельствует об отсутствии абстиненции (табл. 8). У неполовозрелых крыс-самцов линииисходно и спустя 1 сутки после 19-го введения пролил-лейцина (0,5 мг/кг, 1 инъекция в сутки, 5-7 дней в неделю) или плацебо определяли массу тела. Средние значения прироста массы тела в основной группе составили 86,6 г, в контрольной группе - 83,7 г. Статистически достоверных различий между группами ни на одном из этапов эксперимента не обнаружено, что свидетельствует о хорошей переносимости введения и отмены пролил-лейцина. Таким образом, пролил-лейцин не вызывает абстинентного синдрома. 11 14067 1 2011.02.28 Пример 9 Пероральная лекарственная форма в виде таблеток пролил-лейцин 0,025 г лактоза 0,160 г микрокристаллическая целлюлоза 0,070 г крахмал кукурузный 0,030 г поливинилпирролидон 0,010 г аэросил 0,0023 г магния стеарат 0,0027 г. Таблетки, содержащие пролил-лейцин, могут быть получены из композиций данного изобретения любым подходящим способом получения таблеток. Лекарственную форму в виде таблеток предпочтительно получать путем влажного гранулирования, что в последнем случае включает операции просеивание и смешивание порошков, увлажнение порошков раствором связывающих веществ и их перемешивание, гранулирование влажной массы, сушка влажных гранул, обработка сухих гранул, таблетирование, фасовка и упаковка. Берут 0,025 г пролил-лейцина, 0,160 г лактозы, 0,040 г микрокристаллической целлюлозы, 0,030 г кукурузного крахмала, просеивают, загружают в чистый сухой смеситель,перемешивают 10-15 минут и увлажняют при перемешивании 10 раствором ранее просеянного поливинилпирролидона (0,010 г). Наиболее предпочтительным является использование лактозы в виде моногидрата. Увлаженную смесь гранулируют, влажные гранулы раскладывают на лотки слоем 1,5-2 см и сушат (в печи или предпочтительно в сушилке с псевдоожиженным слоем) при температуре 603 С в течение 10-12 часов, периодически помешивая, до остаточной влажности 3,00,5 . 0,030 г микрокристаллической целлюлозы, 0,0023 г аэросила и 0,0027 г магния стеарата просеивают, добавляют к сухому грануляту и перемешивают в течение 10-15 мин. Прессуют полученную смесь для получения таблеток (например, с использованием пресса для формования таблеток). Каждая таблетка весит 300 мг и содержит 25 мг пролил-лейцина. Пример 10 Пероральная лекарственная форма в виде капсул пролил-лейцин 0,010 г лактоза 0,060 г микрокристаллическая целлюлоза 0,030 г крахмал кукурузный 0,010 г поливинилпирролидон 0,004 г аэросил 0,001 г магния стеарат 0,001 г. Капсулы, содержащие пролил-лейцин, могут быть получены из композиций данного изобретения любым подходящим способом. Для лекарственной формы в виде твердых желатиновых капсул используют гранулят, получаемый аналогично способу, описанному в примере 9. Полученный гранулят (0,116 г) с содержанием 10 мг пролил-лейцина капсулируют в твердые желатиновые капсулы. Пример 11 Пероральная лекарственная форма в виде порошка для приема внутрь пролил-лейцин 0,015 г лактоза 0,070 г. Проводят измельчение исходных материалов, разделяют частицы порошка по размерам, смешивают 0,015 г пролил-лейцина и 0,070 г лактозы, проводят фасовку. Пример 12 Инъекционная лекарственная форма в виде раствора для инфузий пролил-лейцин 0,03 г 12-маннит 5,0 г вода для инъекций до 100 мл. Проводят подготовку помещения, оборудования, очистку воздуха, водоподготовку подготовку флаконов или пластиковых пакетов к наполнению. Подготавливают, взвешивают и растворяют в воде для инъекций 0,03 г пролил-лейцина и 5,0 г маннита. Полученный раствор фильтруют, проводят розлив во флаконы или пластиковые пакеты,укупоривают или запаивают, стерилизуют. Пример 13 Инъекционная лекарственная форма в виде раствора для инъекций пролил-лейцин 0,005 г-маннит 0,05 г вода для инъекций до 5 мл. Проводят подготовку помещения, оборудования, очистку воздуха, водоподготовку моют и стерилизуют ампулы. Подготавливают, взвешивают и растворяют в воде для инъекций 0,005 г пролил-лейцина и 0,05 г маннита. Полученный раствор фильтруют, ампулируют, стерилизуют. Пример 14 Сублимационно высушенная инъекционная лекарственная форма (для приготовления раствора для инъекций) пролил-лейцин 0,005 г-маннит 0,08 г. Порошок лиофилизированный для приготовления раствора для инъекций готовят следующим образом. Проводят подготовку помещения, оборудования, очистку воздуха. Получают воду для инъекций, проводят мойку и стерилизацию ампул или флаконов. Подготавливают, взвешивают и растворяют в воде для инъекций (проводя стерильную фильтрацию) 0,005 г пролил-лейцина и 0,08 г маннита. Наполняют ампулы или флаконы полученным раствором, замораживают, проводят сублимацию. Осуществляют запайку ампул или укупорку флаконов с готовой продукцией. Раствор для инъекций готовят непосредственно перед применением с использованием стерильного растворителя, прилагаемого в упаковке (5 мл воды для инъекций). Пример 16 Сублимационно высушенная инъекционная лекарственная форма (для приготовления раствора для инфузий) пролил-лейцин 0,03 г-маннит 5,0 г. Порошок лиофилизированный для приготовления раствора для инфузий получают следующим образом. Проводят подготовку помещения, оборудования, очистку воздуха. Получают воду для инъекций, проводят мойку и стерилизацию флаконов. Подготавливают, взвешивают и растворяют в воде для инъекций (проводя стерильную фильтрацию) 0,003 г пролил-лейцина и 5,0 г маннита. Наполняют ампулы или флаконы полученным раствором, замораживают, проводят сублимацию. Осуществляют запайку ампул или укупорку флаконов с готовой продукцией. Раствор для инфузий готовят непосредственно перед применением с использованием стерильного растворителя, прилагаемого в упаковке(100 мл воды для инъекций). Пример 17 Инъекционная лекарственная форма в виде порошка (сухая стерильная рассыпка) для приготовления раствора для инъекций пролил-лейцин 0,005 г-маннит 0,05 г. Порошок для приготовления раствора для инъекций (стерильная рассыпка) получают следующим образом. Проводят подготовку помещения, оборудования, очистку возду 13 14067 1 2011.02.28 ха подготовку флаконов к наполнению. Подготавливают, взвешивают и помещают во флаконы (с соблюдением требований стерильности) 0,005 г пролил-лейцина и 0,05 г маннита, укупоривают флаконы с готовой продукцией. Раствор для инъекций готовят непосредственно перед применением с использованием стерильного растворителя, прилагаемого в упаковке (5 мл воды для инъекций). Пример 18 Инъекционная лекарственная форма в виде порошка (сухая стерильная рассыпка) для приготовления раствора для инъекций пролил-лейцин 0,03 г-маннит 5,0 г. Порошок для приготовления раствора для инфузий (стерильная рассыпка) получают следующим образом. Проводят подготовку помещения, оборудования, очистку воздуха мойку и стерилизацию флаконов. Подготавливают, взвешивают и помещают во флаконы(с соблюдением требований стерильности) 0,03 г пролил-лейцина и 5,0 г маннита. Помещают во флаконы пролил-лейцин и маннит с соблюдением требований стерильности,укупоривают флаконы с готовой продукцией. Раствор для инфузий готовят непосредственно перед применением с использованием стерильного растворителя, прилагаемого в упаковке (100 мл воды для инъекций). Все описанные в Примерах 9-18 лекарственные формы должны удовлетворять требованиям Государственной Фармакопеи Республики Беларусь 10. Понятно, что в примерах описаны наиболее применяемые на практике варианты фармацевтических композиций,однако заявляемый дипептид в дозировках 0,0001-1,0 г может быть включен и в другие фармацевтические композиции (не ограничиваясь приведенными примерами), описанные в Государственной Фармакопее Республики Беларусь 10. Показаниями для применения фармацевтической композиции, содержащей пролиллейцин, являются профилактика и лечение нарушений памяти и способности к обучению,интеллектуальных расстройств, протекающих на фоне АГ или без таковой, развивающихся на фоне тревожных и панических состояний, шизофрении, депрессии, старения, черепно-мозговой травмы, интоксикаций, стрессорных воздействий, гипогликемии, ишемии,дыхательной гипоксии, умственной отсталости. Пролил-лейцин может назначаться как взрослым, так и детям, подросткам. Лекарственные формы, содержащие пролил-лейцин,применяют 1-3 раза в сутки в течение 1-3 недель, при необходимости до 1-6 месяцев. Основываясь на имеющихся данных, для лечения вышеназванных расстройств могут применяться и другие пролилдипептиды, содержащие в своей структуре остаток природной аминокислоты пролина совместно с остатком второй аминокислоты. Учитывая, что дипептиды на основе -производных аминокислот обладают биологической активностью,в том числе улучшают неассоциативное обучение, возможно применение для лечения фармацевтической композиции, содержащей в качестве основного вещества пролилдипептиды, состоящие из остатка пролина и второй аминокислоты как в форме -, так и- стереоизомеров. Способ лечения такой композицией, ее состав и способы получения могут быть аналогичны таковым для композиции, содержащей пролил-лейцин и разрешенные к медицинскому применению вспомогательные вещества. 14067 1 2011.02.28 Таблица 1 Влияние внутрибрюшинного введения пролил-лейцина на неассоциативное обучение у неполовозрелых крыс-самцов линииВысадка 1 Высадка 2 ГДА ГДА К первая минута наблюдения 79,28,61 75,07,76 Плацебо,12 0,95 87,5 76,0 44,68,06 Пролил-лейцин,67,46,82 44,5 0,66 0,5, -12 73,0 1,10,001 вторая минута наблюдения 54,99,12 52,47,14 Плацебо,12 0,95 56,5 58 32,85,02 Пролил-лейцин,57,36,72 35,0 0,57 0,5,12 61,5 1,20,05 суммарно за две минуты наблюдения 134,0815,25 127,411,90 Плацебо,12 0,95 140,5 140,5 77,410,25 Пролил-лейцин, 0,5,124,812,51 81,0 0,6212 133,0 1,10,05 Примечания 1,1 - различия между основной и контрольной группами статистически достоверны, критерий Крускала-Уоллиса с - анализом по Тьюки. 1,2 - различия с исходными значениями на фоне введения пролил-лейцина статистически достоверны,критерий Фридмана с - анализом по Тьюки.- число животных, включенных в эксперимент. К - усредненные значения коэффициента привыкания. Здесь и далее данные представлены в виде или в виде медианы (курсив). Группа/ доза (мг/кг) Таблица 2 Влияние внутрибрюшинного введения пролил-лейцина на неассоциативное обучение у взрослых крыс-самцов линииГДА Высадка 1 Высадка 2 Высадка 3 К суммарно за три минуты наблюдения Плацебо,199,922,59 115,915,31 130,116,90 0,65 9 209,0 116,0 129,0 Пролил 93,814,35 91,913,03 160,813,38 лейцин, 0,5,96,0 97,5 0,57 173,0 8 10,05 10,05 Примечания 1 - различия с исходными значениями на фоне введения пролиллейцина статистически достоверны, критерий Фридмана с - анализом по Тьюки К - усредненные значения коэффициента привыкания. Группа/ доза 14067 1 2011.02.28 Таблица 3 Влияние перорального введения пролил-лейцина на неассоциативное обучение у ювенильных (5 нед) крыс-самцов линииГруппа/ доза (мг/кг) Плацебо,11 День 2 39,47,66 44 1,15 Р 1,10,048 Пролил-лейцин, 0,5,39,37,8 32,87,3 0,8312 43,0 31,0 Примечания 1,1 - различия со значениями в 1-ю минуту в день 1 статистически достоверны, критерий Уилкоксона 1,2 - различия со значениями в 1-ю минуту в день 2 статистически достоверны, критерий Уилкоксона.- число животных, включенных в эксперимент К - усредненные значения коэффициента привыкания. Таблица 4 Влияние внутрибрюшинного введения пролил-лейцина на неассоциативное обучение (по критерию угашения ГДА) у мышей-самцов линии / Плацебо,11(мг/кг) 0-15 минут 0-30 минут Плацебо,4,070,00194,040,0051324,070,0330,00190,00364,040,0240,00510,00144,36-0,0274,21-0,007 Пролиллейцин, 0,1,4,360,052-0,0270,00574,210,046-0,0070,0026 6 10,0001 10,00014,17-0,0164,06-0,001 Пролиллейцин, 0,5,4,170,058-0,0160,00644,060,044-0,0010,002520 10,021 10,038 Пирацетам 4,11-0,0014,070,005 250,144,110,0395-0,0010,00434,070,0260,0050,0015 Примечания- уравнение линейной регрессии для прямой видастатистически достоверно, 0,05 1 - различия коэффициентов уравнения линейной регрессии с контролем статистически достоверны. 14067 1 2011.02.28 Таблица 5 Влияние внутрибрюшинного введения пролил-лейцина на неассоциативное обучение (по критерию угашения ВДА) у мышей-самцов линии / Группа/ доза Период регистрации Пролил 1,800,0111,850,004 лейцин, 0,5,1,800,0850,01060,00941,850,0500,0040,002820 Пирацетам 1,990,0172,080,006 250,141,990,1060,0170,01172,080,0640,0060,0036 Примечания- уравнение линейной регрессии для прямой видастатистически достоверно 1 - различия коэффициентов уравнения линейной регрессии с контролем статистически достоверны. Таблица 6 Влияние внутрибрюшинного введения пролил-лейцина в дозе, 10-кратно превосходящей терапевтическую (5,0 мг/кг), на массу тела, двигательную активность, психоэмоциональный статус и болевую чувствительность половозрелых нелинейных мышей-самцов Показатель Масса тела До введения Через 1 сутки после введения Двигательная активность за 5 минут ГДА ВДА Двигательная активность за 24 часа 237132085,8 256582187,6 ГДА 3621773,5 4256,4774,2 ВДА(5) Психоэмоциональный статус продолжительность активных попыток избавления в 211614,917226,97 217601,315651,17(мс) 14067 1 2011.02.28 Таблица 7 Влияние внутрибрюшинного введения пролил-лейцина в дозе, 100-кратно превосходящей терапевтическую (50,0 мг/кг), на массу тела и двигательную активность половозрелых нелинейных мышей-самцов Показатель Масса тела До введения Через 1 сутки после введения Двигательная активность за 5 минут ГДА ВДА Двигательная активность за 60 минут ГДА ВДА Двигательная активность за 24 часа ГДА ВДА Таблица 8 Болевая чувствительность неполовозрелых крыс-самцов линиина фоне отмены пролил-лейцина после его внутрибрюшинного субхронического (16-кратного) введения в терапевтической дозе (0,5 мг/кг) Показатель Болевая реакция в ЛП отдергивания хвоста, с Без введения Плацебо 2-е сутки после 16-го введения 5,40,24 Таблица 9 Изменения массы тела неполовозрелых крыс-самцов линиина фоне отмены пролил-лейцина после его внутрибрюшинного субхронического (19-кратного) введения в терапевтической дозе (0,5 мг/кг) Показатель Масса тела До введения 1 сутки после отмены 14067 1 2011.02.28 Таблица 10 Результаты оценки возможного токсического действия пролил-лейцина после внутрибрюшинного введения в дозах 0,5 мг/кг, 5,0 мг/кг и 50,0 мг/кг по показателям гибель, изменения состояния шерстного покрова, диарея, нарушение реакции на тактильные раздражители в эксперименте на половозрелых нелинейных мышах Нарушение реакции на тактильные раздражители 0/4 0/4 0,00,0 0,00,0 неполовозрелые крысы линии 0/12 0,00,0 0,00,0 Гибель в 1-е Группа/сроки оценсутки ки, доза (мг/кг) наблюдения Исходно После 1 введения пролил-лейцина, 0,5 Исходно После 1 введения пролил-лейцина, 5,0 Исходно После 1 введения пролил-лейцина,50,0 Исходно После 1 введения плацебо Исходно После введения пролил-лейцина, 0,5 19 введений 26 введений 1 сутки после отмены пролиллейцина, 0,5,19 введений Исходно После введения плацебо,19 введений 26 введений 1 сутки после отмены плацебо,19 введений Гибель во Изменения 2-е - 14-е шерстного сутки покрова наблюдения (баллы) Таблица 11 Результаты оценки возможного токсического действия пролил-лейцина после внутрибрюшинного введения в дозах 0,5 мг/кг,5,0 мг/кг и 50,0 мг/кг по показателям экзофтальм, птоз век, стереотипия, тремор, реакция Штраубе, одышка в эксперименте на половозрелых нелинейных мышах - самцах и на неполовозрелых крысах-самцах линииСтереотипия Одышка Число осоВыраженность реакбей с ции (баллы) одышкой Тремор ВыраЭкзофРеакция Число Группа/сроки оценки,Птоз век ВыраженЧисло жентальм (балШтрауба особей со доза (мг/кг)(баллы) Нелинейные мыши-самцы Исходно 0,00,0 0,00,0 0/10 0,00,0 0/10 0,00,0 0/10 После 1 введения пролил-лейцина, 0,5 0,00,0 0,00,0 0/10 0,00,0 0/10 0,00,0 0/10 Исходно 0,00,0 0,00,0 0/10 0,00,0 0/10 0,00,0 0/10 После 1 введения пролил-лейцина, 5,0 0,00,0 0,00,0 0/10 0,00,0 0/10 0,00,0 0/10 Исходно 0,00,0 0,00,0 0/5 0,00,0 0/5 0,00,0 0/5 После 1 введения про 0,00,0 0,00,0 0/5 0,00,0 0/5 0,00,0 0/5 лил-лейцина, 50,0 Исходно 0,00,0 0,00,0 0/4 0,00,0 0/4 0,00,0 0/4 После 1 введения пла 0,00,0 0,00,0 0/4 0,00,0 0/4 0,00,0 0/4 цебо Неполовозрелые крысы линииИсходно 0,00,0 0,00,0 0/12 0,00,0 0/12 0,00,0 0/12 После введения пролил-лейцина, 0,5,19 введений 0,00,0 0,00,0 0/12 0,00,0 0/12 0,00,0 0/12 26 введений 0,00,0 0,00,0 0/12 0,00,0 0/12 0,00,0 0/12 1 сутки после отмены пролил-лейцина, 0,5 19 введений 0,00,0 0,00,0 0/12 0,00,0 0/12 0,00,0 0/12 1 сутки после отмены плацебо,19 введений Число Выраженность реакособей с ции (баллы) одышкой Стереотипия Тремор Число ВыраЭкзофГруппа/сроки оценки,Птоз век особей ВыраженЧисло жентальм (балдоза (мг/кг) Таблица 12 Результаты оценки возможного токсического действия пролил-лейцина после внутрибрюшинного введения в дозах 0,5 мг/кг,5,0 мг/кг и 50,0 мг/кг по показателям слюнотечение, гипотермия, судороги в эксперименте на половозрелых нелинейных мышах - самцах и на неполовозрелых крысах линииСлюнотечение Группа/сроки оценки, доза число осо- выраженчисло осоЛП иммобилизации, ЛП первой интенбей со ность ревыраженность ре- число особей с бей с гипосудорожной реакции, Число су- сивность слюнотечеакции акции (баллы) судорогами термией дорог, ЛП гибели судорог нием 0,00,0 Не определены ввиду отсутствия судорог 0,00,0 Не определены ввиду отсутствия судорог Не определены ввиду отсутствия судорог 1 сутки после отмены плацебо,19 введений После введения пролил-лейцина,0,5,19 введений 26 введений 1 сутки после отмены пролиллейцина, 0,5,19 введений Исходно Слюнотечение Гипотермия Судороги интенчисло осо- выраженчисло осоЛП иммобилизации, ЛП первой сивность бей со ность ревыраженность ре- число особей с бей с гипосудорожной реакции, Число су- судорог акции (баллы) судорогами слюнотечеакции дорог, ЛП гибели термией нием(баллы) Неполовозрелые крысы линии 0/12 0,00,0 0/12 0,00,0 0/12 0,00,0 Таблица 13 Результаты оценки возможного токсического действия пролил-лейцина после внутрибрюшинного введения в дозах 0,5 мг/кг,5,0 мг/кг и 50,0 мг/кг по показателям атаксия, релаксация, сон в эксперименте на половозрелых нелинейных мышах - самцах и на неполовозрелых крысах линии Атаксия Релаксация Сон Группа/сроки оценки,выраженность число особей число особей выраженность ре- число уснувших ЛП наступле- продолжительдоза (мг/кг) реакции (бал- с релаксацис атаксией акции (баллы) особей ния сна (сек) ность сна (сек) лы) ей Нелинейные мыши-самцы Исходно 0/10 0,00,0 0/10 0,00,0 После 1 введения пролил-лейцина, 0,5 0/10 0,00,0 0/10 0,00,0 Не определены ввиду отсутствия сна Исходно 0/10 0,00,0 0/10 0,00,0 После 1 введения пролил-лейцина, 5,0 0/10 0,00,0 0/10 0,00,0 Исходно 0/5 0,00,0 0/5 0,00,0 После 1 введения Не определены ввиду отсутствия сна пролил-лейцина, 50,0 0/5 0,00,0 0/5 0,00,0 Исходно 0/4 0,00,0 0/4 0,00,0 После 1 введения плацебо 0/4 0,00,0 0/4 0,00,0 Неполовозрелые крысы линииИсходно 0/12 0,00,0 0/12 0,00,0 После введения пролил-лейцина, 0,5,19 введений 0/12 0,00,0 0/12 0,00,0 26 введений 0/12 0,00,0 0/12 0,00,0 Не определены ввиду отсутствия сна 1 сутки после отмены пролил 0/12 0,00,0 0/12 0,00,0 лейцина, 0,5, 19 введений Продолжение таблицы 13 Атаксия Релаксация Сон Группа/сроки оценки,выраженность число особей продолжительчисло особей выраженность ре- число уснувших ЛП наступления доза (мг/кг) реакции (бал- с релаксациность сна (сек) с атаксией акции (баллы) особей сна (сек) лы) ей Исходно 0/12 0,00,0 0/12 0,00,0 После введения плацебо,19 введений 0/12 0,00,0 0/12 0,00,0 Не определены ввиду отсутствия сна 26 введений 0/12 0,00,0 0/12 0,00,0 1 сутки после отмены плацебо,19 введений 0/12 0,00,0 0/12 0,00,0//.-.//5-2005/5- 200523. - Дата доступа 17.02.2009. 3. Патент СССР 939440, МПК С 07 С 103/52, А 61 К 37/02, приор. 6.01.1981. 4. 1 Семакс. // ТКФС Электронный ресурс. Режим доступа //./2.10161268 - Дата доступа 17.02.2009. 5..-.,.-. // ... . - 2002. - . 35. -2. - . 239-243. 6.. // . . . - 1983. - . 18. -3. - . 345-349. 7.. // . 1985. - . 24. -5. - . 413-419. 8.. // . . . - 1984. - . 21. -3. - . 345-348. 9.4416871, 22.11.1983. 10. Государственная Фармакопея Республики Беларусь (1 издание) / Ред. Г.В. Годовальников, А.А. Шеряков. - Минск, 2006.- различия статистически достоверны по сравнению с исходными показателями- различия статистически достоверны по сравнению с исходными показателями Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: A61P 25/00, A61K 38/05
Метки: ноотропным, фармацевтическая, композиция, действием
Код ссылки
<a href="https://by.patents.su/26-14067-farmacevticheskaya-kompoziciya-s-nootropnym-dejjstviem.html" rel="bookmark" title="База патентов Беларуси">Фармацевтическая композиция с ноотропным действием</a>
Предыдущий патент: Способ лечения острого деструктивного панкреатита
Следующий патент: Способ получения катализатора окислительных реакций на основе кобальтита лантана
Случайный патент: Телескопический расширитель лазерного пучка типа Галилея