Фармацевтическая композиция для парентерального введения, содержащая пептиды, способ ее получения и применения
Номер патента: 13285
Опубликовано: 30.06.2010
Авторы: БАУЭР, Хорст, САРЛИКИОТИС, Вернер, ДАММ, Микаэль
Текст
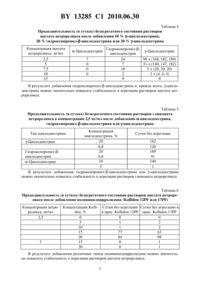
(51) МПК (2009) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ, СОДЕРЖАЩАЯ ПЕПТИДЫ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ(57) 1. Фармацевтическая композиция для парентерального введения, содержащая в качестве активного агента имеющий тенденцию к агрегации антагониств форме соли уксусной, глюконовой, глюкуроновой, молочной, лимонной, аскорбиновой, бензойной или фосфорной кислоты в растворе в концентрации от 0,5 до 15,0 мг/мл, и дополнительно одну из упомянутых кислот в свободной форме. 2. Фармацевтическая композиция по п. 1, отличающаяся тем, что она растворима в воде. 3. Фармацевтическая композиция по п. 1, отличающаяся тем, что она растворима в физиологически приемлемом масле, предпочтительно в нейтральном масле. 4. Фармацевтическая композиция по любому из пп. 1-3, отличающаяся тем, что антагониствыбран из цетрореликса, тевереликса, антида, А-75998, ганиреликса и -антагониста. 5. Фармацевтическая композиция по п. 4, отличающаяся тем, что содержит в качестве антагонистацетрореликс в форме ацетата и в качестве кислоты в свободной форме - глюконовую кислоту. 6. Фармацевтическая композиция для парентерального введения, содержащая в качестве активного агента имеющий тенденцию к агрегации антагониств форме соли уксусной, глюконовой, глюкуроновой, молочной, лимонной, аскорбиновой, бензойной или фосфорной кислоты в растворе в концентрации от 0,5 до 15,0 мг/мл, одну из упомянутых кислот в свободной форме, необязательно добавку и, по меньшей мере, одно вспомогательное вещество, выбранное из класса кислот, поверхностно-активных веществ,полимеров, липидов или сахаров. 7. Фармацевтическая композиция по п. 6, отличающаяся тем, что антагониствыбран из цетрореликса, тевереликса, антида, А-75998, ганиреликса и антагониста. 8. Фармацевтическая композиция по п. 7, отличающаяся тем, что содержит в качестве антагонистацетрореликс в форме ацетата и в качестве кислоты в свободной форме - глюконовую кислоту. 13285 1 2010.06.30 9. Фармацевтическая композиция по п. 7, отличающаяся тем, что содержит в качестве вспомогательного вещества глюконовую, глюкуроновую, галактуроновую, глюкаровую, лимонную, аскорбиновую кислоту или аминокислоту. 10. Фармацевтическая композиция по п. 7, отличающаяся тем, что содержит в качестве поверхностно-активного вещества полиэтиленгликоль-12-(гидрокси)стеарат, полиоксиэтиленрицинолеат, полисорбат, полиоксамер, фосфолипид или лецитин или содержит в качестве добавки консервант бензалькония хлорид или ацетат фенилртути. 11. Фармацевтическая композиция по п. 7, отличающаяся тем, что содержит в качестве полимера альбумин, полиэтиленгликоль, производное целлюлозы или крахмала или поливинилпирролидон. 12. Фармацевтическая композиция по п. 7, отличающаяся тем, что содержит в качестве сахара циклодекстрин или его производное или полиол. 13. Фармацевтическая композиция по п. 7, отличающаяся тем, что содержит в качестве вспомогательного вещества хаотропный агент, в частности мочевину. 14. Фармацевтическая композиция по любому из пп. 6-13, отличающаяся тем, что содержит антагониств форме ацетата, глюконата, глюкуроната, лактата, цитрата,аскорбата, бензоата или фосфата, в качестве вспомогательного вещества, замедляющего скорость высвобождения активного вещества, полимер, предпочтительно сополимер молочной и гликолевой кислот, и, при необходимости, другие вспомогательные вещества. 15. Способ получения фармацевтической композиции по п. 1 или 6, заключающийся в том, что к фармацевтически эффективному количеству антагонистав форме его соли уксусной, глюкуроновой, глюконовой, молочной, лимонной, аскорбиновой, бензойной или фосфорной кислоты добавляют кислоту, выбранную из уксусной, глюкуроновой,глюконовой, молочной, лимонной и аскорбиновой кислоты в свободной форме, полученную смесь растворяют в воде для инъекций, при необходимости смешивают с, по меньшей мере, одним вспомогательным веществом, указанным в любом из пп. 9-13,стерилизуют, разливают в емкости для инъекций и лиофилизуют. 16. Способ получения фармацевтической композиции по п. 7, заключающийся в том,что к фармацевтически эффективному количеству антагонистав форме его соли уксусной, глюкуроновой, глюконовой, молочной, лимонной, аскорбиновой, бензойной или фосфорной кислоты добавляют кислоту, выбранную из уксусной, глюкуроновой, глюконовой, молочной, лимонной и аскорбиновой кислоты в свободной форме, полученную смесь вводят в микрочастицы из сополимера молочной и гликолевой кислот, замедляющие высвобождение активного вещества, и суспендируют эти микрочастицы в физиологически приемлемой среде для инъекций. 17. Применение фармацевтической композиции по любому из пп. 4, 7, 14 для парентерального введения при лечении доброкачественного или злокачественного заболевания,зависимого от половых гормонов. 18. Применение фармацевтической композиции по любому из пп. 4, 7, 14 для парентерального введения при лечении доброкачественного или злокачественного заболевания,зависимого от половых гормонов, преимущественно доброкачественной гиперплазии предстательной железы, карциномы предстательной железы, преждевременного полового развития, гирсутизма, гиперплазии эндометрия, карциномы эндометрия, оплодотворения, контрацепции, предменструального синдрома, миоматоза матки, рака груди, окклюзии маточной трубы, рака яичников или карциномы матки. Настоящее изобретение относится к новым галеновым формам для парентерального введения пептидов, имеющих тенденцию к агрегации, прежде всего, аналоговили антагонистови агонистов , а также к способам их получения и применения. В документе ЕР 0299402 использованы фармацевтически активные декапептиды, такие как -030, -075 (цетрореликс) и -088 в форме их фармацевтически приемле 2 13285 1 2010.06.30 мых, не токсичных кислотно-аддитивных солей, таких как гидрохлориды, гидробромиды,сульфаты, фосфаты, фумараты, глюконаты, таннаты, малеаты, ацетаты, цитраты, бензоаты, сукцинаты, альгинаты, памоаты, аскорбаты и тартраты и т.д. Кроме того, в 06321800-А описан лиофилизированный пептидный или белковый препарат, содержащий глюконаты в качестве стабилизаторов. В одном примере описан раствор, содержащий 2,5 глюконата магния, при этом в качестве активного вещества среди прочих используют вазопрессин,и инсулин. Из литературных данных (среди прочих, см. статьи,, .(1991) стр. 16-22) известно, что олигопептиды и, прежде всего, включающие концевую функцию амида кислоты имеют тенденцию к гелеобразованию. В документе ЕР 0611572 описан способ получения лиофилизата из пептида, содержащего 3-15 аминокислотных остатков, причем препарат получают растворением 100-10000 массовых частей пептида в уксусной кислоте и смешиванием с носителем, таким как маннит, с последующей лиофилизацией, чтобы получить после стерильной фильтрации лиофилизированный пептид и исключить гелеобразование. В документе 19542873 описаны фармацевтические формы для введения сложного состава в форме микрочастиц, причем используют тройной блок-сополимер , в котором А означает блок-полимер из молочной и гликолевой кислот, а В означает полимер с цепью полиэтиленгликоля, в смеси с наполнителем из группы сывороточных белков,полиаминокислот, циклодекстринов, производных циклодекстринов, сахаридов, аминосахаров, аминокислот, ПАВ или карбоновых кислот, а также их смесей. Описанные микрочастицы должны также непрерывно высвобождать полипептид после включения незначительного количества или чувствительной к агрегации полипептидной массы в течение продолжительного периода времени. В документе 141996 описано получение лекарственных форм природного ,которые устойчивы в течение продолжительного периода времени и соответствуют требованиям для препарата, используемого для парентерального введения. При этом основной задачей является повышение срока действия таких препаратов (см. стр. 2, строки 19-23). Фильтруемость растворов не упоминается. В связи с этим для повышения срока действия добавляют также буферные вещества (а также уксусную кислоту), чтобы установить величинув диапазоне 3,5-6,5. Не решена проблема получения стерильных лиофилизированных препаратов из образующихся солей пептидов. В документе ЕР 0175506 водный раствор пептида обрабатывают 1 н. уксусной кислотой и затем его лиофилизируют, чтобы получить ацетат пептида. Таким образом, предметом данной заявки является синтез соли пептида. Однако показано, что получение стерильных растворов ацетатов известных пептидов(например, антагонистов ), имеющих тенденцию к агрегации, для парентерального введения путем фильтрации вполне возможно при высоких концентрациях, но возможно образование агрегатов после растворения лиофилизата непосредственно перед инъекцией. Образование агрегатов приводит к зависимому от концентрации снижению биодоступности, начиная с концентрации пептида 0,5 мг/мл. Упомянутая проблема относится не только к растворам для инъекций, которые получают для быстрого высвобождения активного вещества, но также наблюдается при использовании препаратов для введения с замедленным высвобождением активного вещества. Таким образом, включенные в матрицу пептиды, которые должны регулировать скорость высвобождения активного вещества, могут приводить к нежелательному снижению скорости высвобождения активного вещества по причине тенденции пептида к агрегации. В данном случае снижается также биодоступность. С учетом того факта, что предпочтительной формой применения фармацевтически активных пептидов, таких как агонисты и антагонисты , например антареликс и цетроре 3 13285 1 2010.06.30 ликс, является парентеральная лекарственная форма, существует необходимость получения стабильных инъекционных препаратов с приемлемой биодоступностью, которые легко поддаются обработке, стерилизации и переработке (в готовую лекарственную форму). Это относится, прежде всего, к инъекционным препаратам в форме реконструированных лиофилизированных образцов, полученных из растворимых солей пептидов, и к микрочастицам, микрокапсулам или имплантатам. Указанные факты имеют особое значение с точки зрения общеизвестной, все более развивающейся, многосторонней области применения антагонистов . Особый интерес представляет широкий выбор парентеральных, стабильных пептидных растворов, прежде всего, для подкожной инъекции, с учетом быстро расширяющейся области показаний указанного класса веществ. Задачей изобретения является разработка фармацевтических форм введения, подходящих для парентерального применения и содержащих имеющие тенденцию к агрегации пептиды в растворимой или диспергированной форме. Предметом изобретения является фармацевтическая композиция для парентерального введения, содержащая в качестве активного агента имеющий тенденцию к агрегации антагониств форме соли уксусной, глюконовой, глюкуроновой, молочной, лимонной,аскорбиновой, бензойной или фосфорной кислоты в растворе в концентрации от 0,5 до 15,0 мг/мл и дополнительно одну из упомянутых кислот в свободной форме. Фармацевтическая композиция может быть в виде раствора в воде либо в физиологически приемлемом масле, предпочтительно в нейтральном масле. В предпочтительном воплощении изобретения антагониствыбран из цетрореликса, тевереликса, антида, А-75998, ганиреликса и антагониста. Наиболее предпочтительно, когда в качестве антагониста- цетрореликс в форме ацетата, а в качестве кислоты в свободной форме - глюконовая кислота. Согласно другому варианту воплощения настоящего изобретения фармацевтическая композиция для парентерального введения содержит в качестве активного агента имеющий тенденцию к агрегации антагониств форме соли уксусной, глюконовой, глюкуроновой, молочной, лимонной, аскорбиновой, бензойной или фосфорной кислоты в растворе в концентрации от 0,5 до 15,0 мг/мл, одну из упомянутых кислот в свободной форме, необязательно добавку и, по меньшей мере, одно вспомогательное вещество, выбранное из класса кислот, поверхностно-активных веществ, полимеров, липидов или сахаров. В этом варианте также предпочтительно, когда антагониствыбран из цетрореликса, тевереликса, антида, А-75998, ганиреликса и антагониста, а наиболее предпочтительно, когда в качестве антагониста- цетрореликс в форме ацетата и в качестве кислоты в свободной форме - глюконовая кислота. В этом варианте выполнения изобретения фармацевтическая композиция предпочтительно содержит в качестве вспомогательного вещества глюконовую, глюкуроновую, галактуроновую, глюкаровую, лимонную, аскорбиновую кислоту или аминокислоту в качестве поверхностно-активного вещества полиэтиленгликоль-12-(гидрокси)стеарат , полиоксиэтиленрицинолеат , полисорбат, полиоксамер, фосфолипид или лецитин или содержит в качестве добавки консервант бензалькония хлорид или ацетат фенилртути в качестве полимера альбумин, полиэтиленгликоль, производное целлюлозы или крахмала или поливинилпирролидон в качестве сахара циклодекстрин или его производное или полиол. Наиболее предпочтительно, в качестве вспомогательного вещества содержит хаотропный агент, в частности мочевину. Одним из предпочтительных вариантов выполнения изобретения является фармацевтическая композиция, которая содержит антагониств форме ацетата, глюконата,глюкуроната, лактата, цитрата, аскорбата, бензоата или фосфата, в качестве вспомогательного вещества, замедляющего скорость высвобождения активного вещества, полимер,предпочтительно сополимер молочной и гликолевой кислот, и, при необходимости, другие вспомогательные вещества. 4 13285 1 2010.06.30 Объектом изобретения является также способ получения фармацевтической композиции по изобретению, заключающийся в том, что к фармацевтически эффективному количеству антагонистав форме его соли уксусной, глюкуроновой, глюконовой, молочной,лимонной, аскорбиновой, бензойной или фосфорной кислоты добавляют кислоту, выбранную из уксусной, глюкуроновой, глюконовой, молочной, лимонной и аскорбиновой кислоты в свободной форме, полученную смесь растворяют в воде для инъекций, при необходимости смешивают с, по меньшей мере, одним вспомогательным веществом, стерилизуют, разливают в емкости для инъекций и лиофилизуют. Объектом изобретения является также способ получения фармацевтической композиции по изобретению, заключающийся в том, что к фармацевтически эффективному количеству антагонистав форме его соли уксусной, глюкуроновой, глюконовой, молочной,лимонной, аскорбиновой, бензойной или фосфорной кислоты добавляют кислоту, выбранную из уксусной, глюкуроновой, глюконовой, молочной, лимонной и аскорбиновой кислоты в свободной форме, полученную смесь вводят в микрочастицы из сополимера молочной и гликолевой кислот, замедляющие высвобождение активного вещества, и суспендируют эти микрочастицы в физиологически приемлемой среде для инъекций. Объектами изобретения являются также применение фармацевтической композиции по изобретению для парентерального введения при лечении доброкачественного или злокачественного заболевания, зависимого от половых гормонов, а также применение при лечении преимущественно доброкачественной гиперплазии предстательной железы, карциномы предстательной железы, преждевременного полового развития, гирсутизма, гиперплазии эндометрия, карциномы эндометрия, оплодотворения, контрацепции,предменструального синдрома, миоматоза матки, рака груди, окклюзии маточной трубы,рака яичников или карциномы матки. Фармацевтические формы для введения могут также присутствовать в растворимой или диспергированной форме в физиологически приемлемом масле, предпочтительно в триглицеридах со средней длиной цепи (нейтральное масло, ) или в касторовом масле, кунжутном масле, хлопковом масле, кукурузном масле, арахисовом масле, оливковом масле или в смеси указанных масел. Таким образом, становится возможным подавить агрегацию пептида и тем самым удовлетворить требованиям для препарата с удовлетворительной биодоступностью, расширить арсенал лекарственных средств с использованием эффективной галеновой технологии. Кроме того, неожиданно было показано, что при добавлении глюконовой, глюкуроновой, лимонной, молочной или аскорбиновой кислот значительно увеличивается стабильность различных солей цетрореликса. Таким образом, согласно настоящему изобретению является возможным получение и переработка стерилизованных фильтрованием стабильных препаратов без осложнений. Область применения составов по настоящему изобретению включает, прежде всего,профилактику и лечение всех состояний и заболеваний, зависимых от аналогов , то есть от агонистови антагонистов , и связанных с половыми гормонами. Для составов по настоящему изобретению в качестве антагонистовиспользуют также антагонистысогласно патентам 5942493 и 19911771.3. Пример 1 Исследование агрегации растворов различных солей цетрореликса в присутствии или отсутствии добавок вспомогательных веществ проводят с помощью поляризационного микроскопа. Агрегированные растворы пептидов характеризуются в поляризационном световом микроскопе характерной крестообразной поляризационной картиной, которая аналогична жидкокристаллическим структурам. Не содержащие агрегатов растворы пептидов не проявляют таких эффектов. 5 13285 1 2010.06.30 Таблица 1 Влияние добавки глюконовой кислоты на агрегатные свойства растворов ацетата цетрореликса Концентрация ацетата цетрореликса, мг/мл 2,5 2,5 2,5 2,5 Содержание глюконовой кислоты в среде для реконструкции,0 0,0071 0,071 0,71 Таким образом, добавка глюконовой кислоты позволяет увеличить стабильность растворов ацетата цетрореликса, при этом агрегация замедляется или предотвращается. Дальнейшие исследования сфокусированы на глюконате цетрореликса в присутствии или в отсутствии глюконовой кислоты. Основные данные приведены в табл. 2. Таблица 2 Агрегатные свойства различных растворов, содержащих в качестве основного компонента глюконат цетрореликса Добавка глюконовой кислоты Концентрация цетрореликса, мг/мл 2,5 5 5 7,5 7,5 Глюконат цетрореликса обладает преимуществом по сравнению с ацетатом. Добавка глюконовой кислоты позволяет повысить срок действия растворов глюконата цетрореликса. Кроме того, исследуют стабилизирующее влияние глюконовой кислоты на растворы ацетата цетрореликса, а также на агрегатные свойства другой соли, глюкуроната цетрореликса. Результаты приведены в табл. 3. Таблица 3 Агрегатные свойства растворов ацетата и глюкуроната цетрореликса с различной концентрацией в присутствии или отсутствии добавки глюкуроновой кислоты Добавка глюкуроновой кислоты Концентрация цетроФорма соли реликса, мг/мл Ацетат 2,5 Ацетат 5 Глюкуронат 2,5 Глюкуронат 5 Да Сутки без агрегации 21 0 30 30 Сутки без агрегации 0 При замене ацетатной соли на глюкуронат можно наблюдать значительное увеличение устойчивости к агрегации растворов цетрореликса, сходной с глюконатной солью. В результате добавления глюкуроновой кислоты к растворам глюкуроната цетрореликса можно наблюдать еще большее увеличение стабильности к агрегации указанных растворов. 6 13285 1 2010.06.30 Таблица 4 Продолжительность (в сутках) безагрегатного состояния растворов ацетата цетрореликса после добавления 10-циклодекстрина,20 гидроксипропилциклодекстрина или 20-циклодекстрина В результате добавления гидроксипропилциклодекстрина и, прежде всего, -циклодекстрина можно значительно повысить стабильность к агрегации растворов ацетата цетрореликса. Таблица 5 Продолжительность (в сутках) безагрегатного состояния растворов глюконата цетрореликса в концентрации 2,5 мг/мл после добавления -циклодекстрина,гидроксипропилциклодекстрина или -циклодекстрина Концентрация Сутки без агрегации циклодекстрина,20 182-Циклодекстрин 5 1 В результате добавления гидроксипропилциклодекстрина или -циклодекстрина можно значительно повысить стабильность к агрегации растворов глюконата цетрореликса. Тип циклодекстрина Таблица 6 Продолжительность (в сутках) безагрегатного состояния растворов ацетата цетрореликса после добавления поливинилпирролидона ( 12 или 17) Концентрация цетро- Концентрация - Сутки без агрегации Сутки без агрегации в реликса, мг/мл,в прис.12 прис.17 2,5 0 0 0 5 1 2 10 1 2 15 77 63 20 84 98 5 15 0 1 20 0 1 В результате добавления различных типов поливинилпирролидона можно значительно повысить стабильность к агрегации растворов ацетата цетрореликса. 7 13285 1 2010.06.30 Таблица 7 Агрегатные свойства растворов ацетата цетрореликса после добавления различных вспомогательных веществ, определенные по данным поляризационной микроскопии и виду оптической картины (внешний вид) Концентрация Концентрация Вспомогательное Агрегация (данвспомогательного цетрореликса,Внешний вид вещество ные микроскопии) вещества,мг/мл Прозрачный 15 5,00 2,5 да, через 14 сут раствор Прозрачный 112 сут 10,00 2,5 раствор без агрегации Прозрачный 112 сут 20,00 2,5 раствор без агрегации Прозрачный 5,00 2,5 да, через 10 сут раствор Прозрачный 112 сут 10,00 2,5 раствор без агрегации Прозрачный,20,00 5 да, через 1 сут вязкий-Глютаминовая Прозрачный 0,80 2,5 да, через 2 сут кислота раствор,3,8 Глюкаровая Прозрачный 12 сут 2,50 2,5 кислота раствор,2,5 без агрегации Галактуроновая Прозрачный 12 сут 2,50 2,5 кислота раствор,2,6 без агрегации Пример 2 Основной компонент - цетрореликс - растворяют в 30 уксусной кислоте при концентрации 10 мг/мл и разбавляют водным раствором добавки в 3 уксусной кислоты до конечной концентрации пептида 1 мг/мл. Затем этот раствор стерилизуют и лиофилизируют (по 5 мг во флаконе). После реконструкции этих лиофилизированных препаратов в растворах (2,5 мг/мл цетрореликса) исследуют образование агрегатов и свойства высвобождения активного вещества следующими методами поляризационная микроскопия (пол. мик.) сутки без агрегации (сут б/агр.) фильтруемость (фил-сть) врастворы цетрореликса получают стандартным способом и фильтруют через фильтр с размером пор 0,22 мкм или 0,45 мкм с использованием центрифугирования. Концентрацию цетрореликса в фильтрате определяют с помощью ВЭЖХ вв расчете на исходную концентрацию перед фильтрованием (фильтруемость в ) высвобождениеиз краткосрочной формы (высвобождение в растворе Рингера, ВРР)высвобождения через 1 и 6 ч. Характеристики высвобожденияопределяют проточным методом с использованием раствора Рингера в качестве среды при 37 С. Концентрацию определяют методом ВЭЖХ. Образцы цетрореликса, соответствующие 10 мг основания цетрореликса, помещают в проточную ячейку, смешивают с 4 мл воды и перемешивают в течение 10 мин. После добавления к образцу 6 мл раствора Рингера при перемешивании через ячейку равномерно прокачивают поток раствора Рингера со скоростью 0,5 мл/мин испытания на крысах остаточное содержание цетрореликса в мышцах вот введенной дозы определяют через 168 ч после внутримышечного введения (в/м). 8 13285 1 2010.06.30 В табл. 8 а приведены составы полученных лиофилизированных препаратов ацетата цетрореликса и соответствующие данные испытаний с использованием полученных растворов ацетата цетрореликса с концентрацией 2,5 мг/мл. Н/о - не определено. Таблица 8 а Лиофилизир. препарат ацетата цетрореликса (5 мг) Вспом. вещество Только маннит (контроль) На основании приведенных примеров представляется очевидным, что при использовании многочисленных испытанных вспомогательных веществ из различных групп соединений(ПАВ, кислоты, аминокислоты, полимеры, сахара, многоатомные спирты, циклодекстрины, консерваторы) в отдельности или в смеси можно получить стабилизирующий эффект(поляризационная микроскопия, фильтруемость, высвобождение) и. Такая сниженная тенденция к агрегации и улучшенное высвобождение активного вещества приводят к улучшенной биодоступности пептидных активных веществ и к снижению остаточного содержания в мышцах, как показано в экспериментах на крысах. Другие данные испытанийиразличных солей цетрореликса в присутствии или отсутствии стабилизирующих вспомогательных веществ приведены в следующей табл. 8 б. 9(реконструированная в воде) Вспомогательное вещество Ацетат Ацетат Ацетат Ацетат с глюконовой к-той, реконстр. Ацетат 12 Ацетат 17 Ацетатбензалькония хлорид Ацетатфосфолипид Ацетат-циклодекстрин(190) Ацетат с глюконовой к-той, реконстр. Глюконат Глюконат Глюконат с глюконовой ктой, реконстр. Цитрат Лактат Эмбонат Пример 3 Содержащие цетрореликс составы, которые характеризуются более слабой/более медленной способностью к агрегации (улучшенная фильтруемость/поляризационная микроскопия) и более высокой скоростью высвобожденияв растворе Рингера, отличаются незначительным остаточным содержанием цетрореликса в мышцах крыс через 168 ч. Следует ожидать, что такие составы будут обладать более высокой биодоступностью. Некоторые данные, полученные в экспериментах на мышцах крыс, приведены в табл. 8 а и 8 б. В табл. 9 приведены результаты дальнейших экспериментов на мышцах крыс, в которых наряду с остаточным содержанием в мышцах определяют содержание (часть) цетро 10 13285 1 2010.06.30 реликса в плазме. На основании этих данных также отчетливо проявляется стабилизирующее действие исследованных вспомогательных веществ. Кроме того, при замене ацетатов на другие соли цетрореликса достигается увеличение биодоступности и при этом снижается остаточное содержание в мышцах, определенное в экспериментах на крысах. Таблица 9 Вещество (цетрореликс) Ацетаталанинглюконовая кислота Ацетаттриптофанглюконовая кислота Ацетатциклодекстрин(110), аланин, глюконовая кислота Ацетатглюконовая кислота Ацетатлимонная кислота Ацетат Ацетат вАцетатбензалькония хлорид Ацетат 20 циклодекстрин Ацетат 20 Ацетатглюкуроновая кислота Ацетатглюконовая кислота Ацетат 20 циклодекстрин Ацетат Ацетат вАцетат 0,025 бензалькон. Ацетатглюкуроновая кислота Ацетатглюконовая кислота Глюконат Глюконат в манните Глюконат в манните Глюконат вГлюконат в глюконовой кислоте Глюконат в глюконовой кислоте 13285 1 2010.06.30 Продолжение табл. 9 Вещество (цетрореликс) Глюконат в глюконовой кислоте Глюкуронат Глюкуронат Лактат Лактат Цитратлиоф./а Цитрат вОснование Основание вБензоат в манните Бензоат вФосфат Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 12
МПК / Метки
МПК: A61K 47/12, A61K 9/08, A61K 38/08
Метки: способ, парентерального, фармацевтическая, введения, композиция, применения, содержащая, пептиды, получения
Код ссылки
<a href="https://by.patents.su/12-13285-farmacevticheskaya-kompoziciya-dlya-parenteralnogo-vvedeniya-soderzhashhaya-peptidy-sposob-ee-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Беларуси">Фармацевтическая композиция для парентерального введения, содержащая пептиды, способ ее получения и применения</a>
Предыдущий патент: Устройство ультразвуковой сварки полимерных материалов
Следующий патент: Способ защиты насаждений сосны от объедания лосем
Случайный патент: Покрытие модульное сборно-разборное