Пептид, способный нейтрализовать или модулировать образование антител к миелиновому основному белку, фармацевтическая композиция и способ лечения рассеянного склероза у человека
Текст
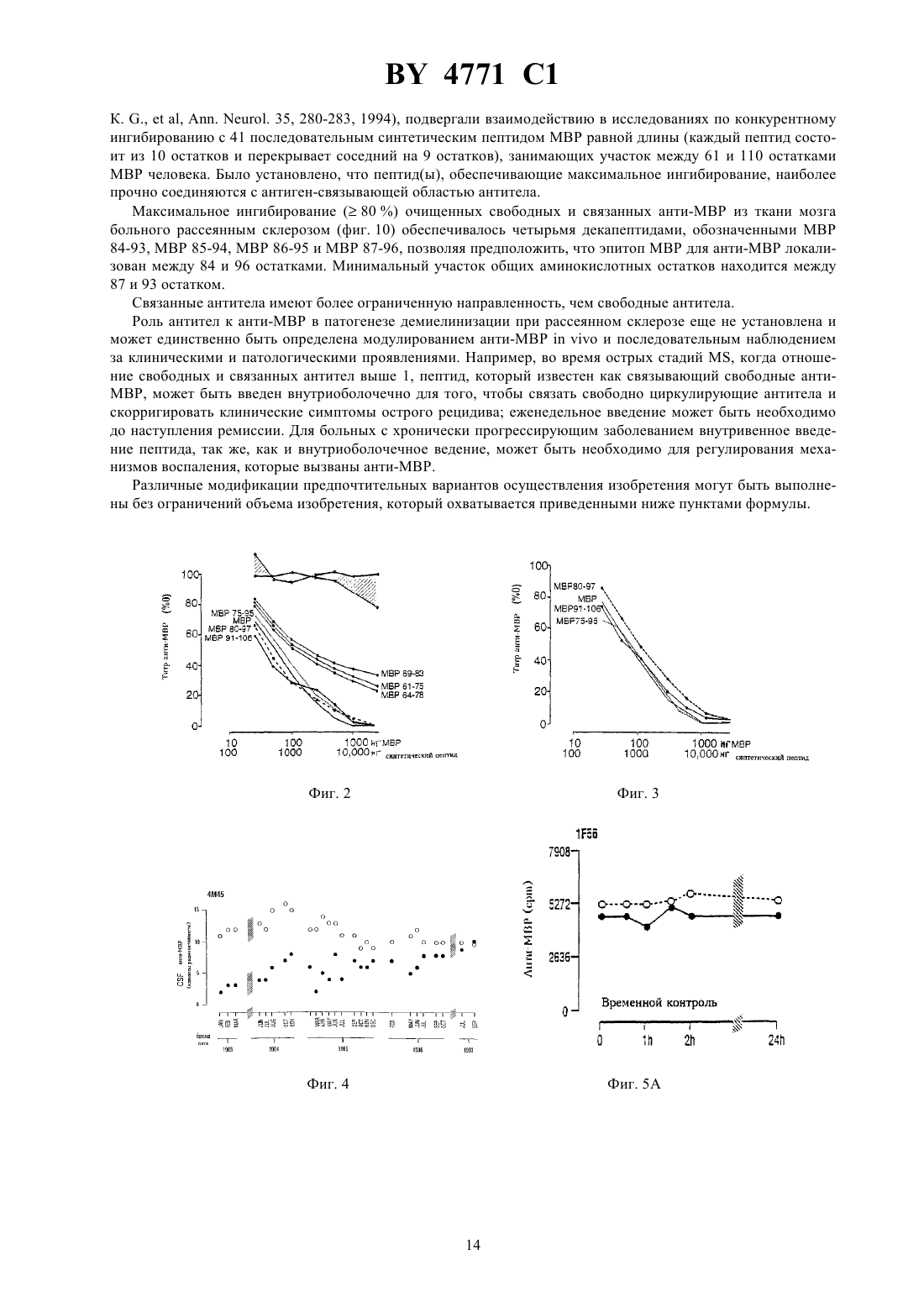
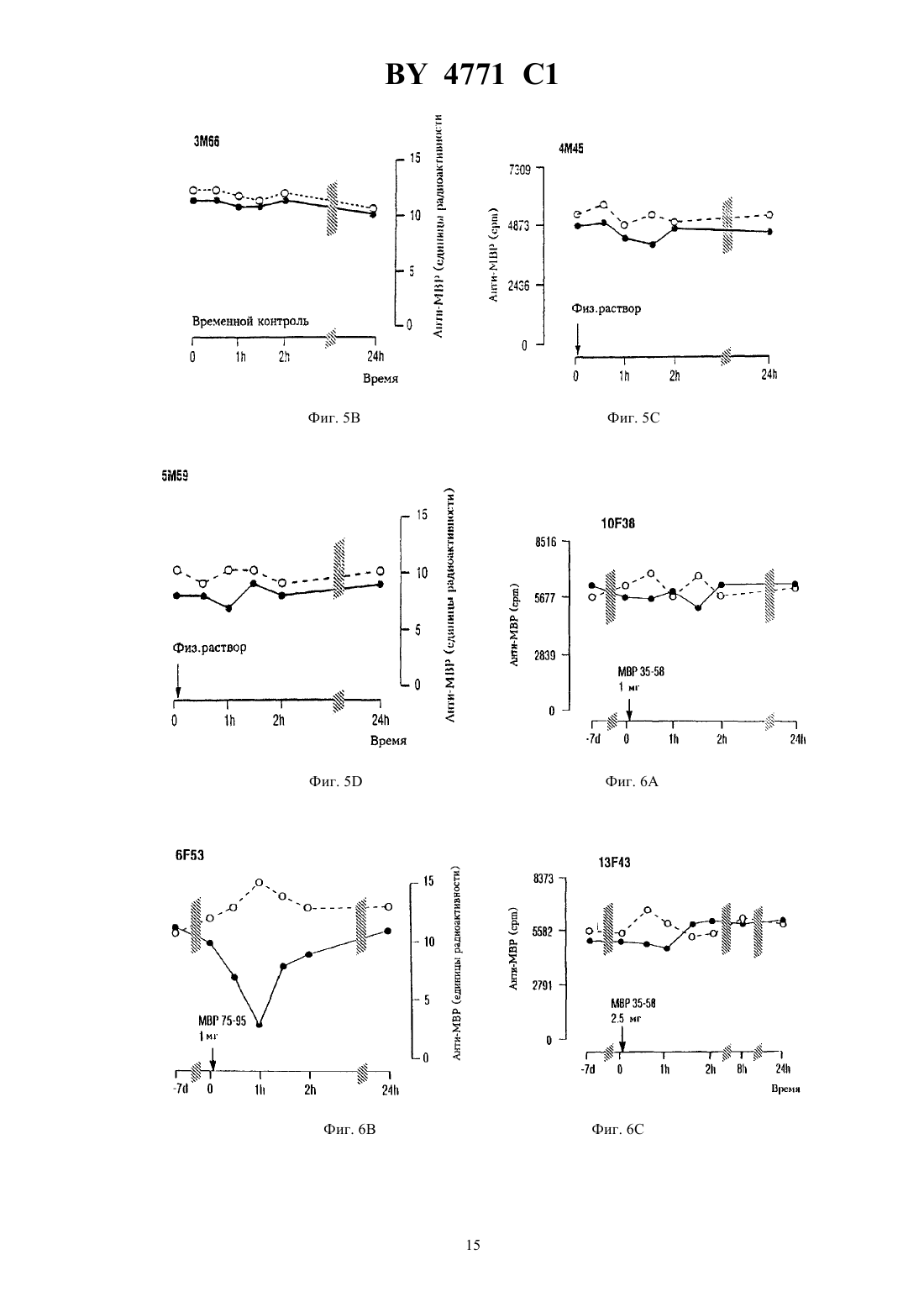
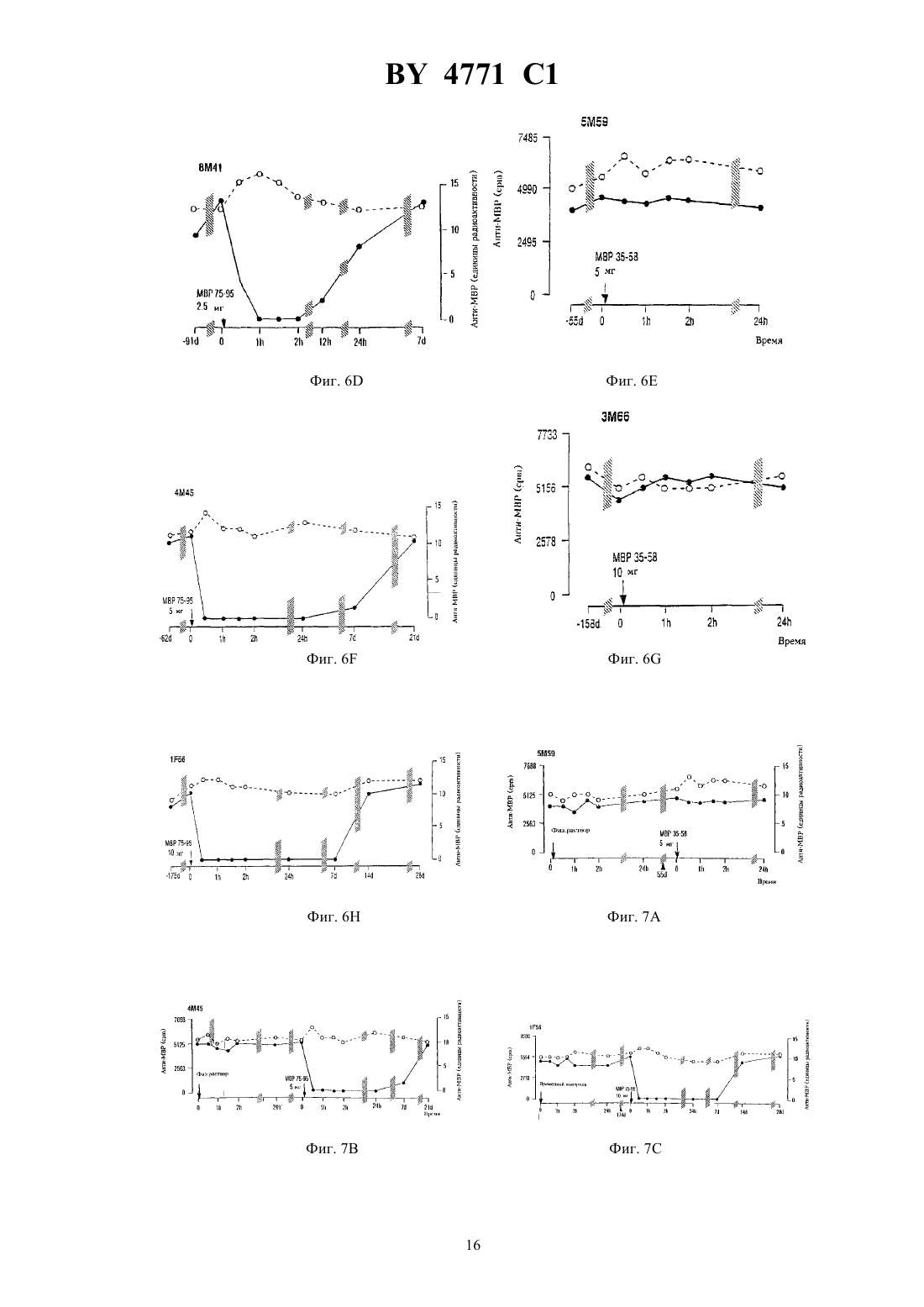
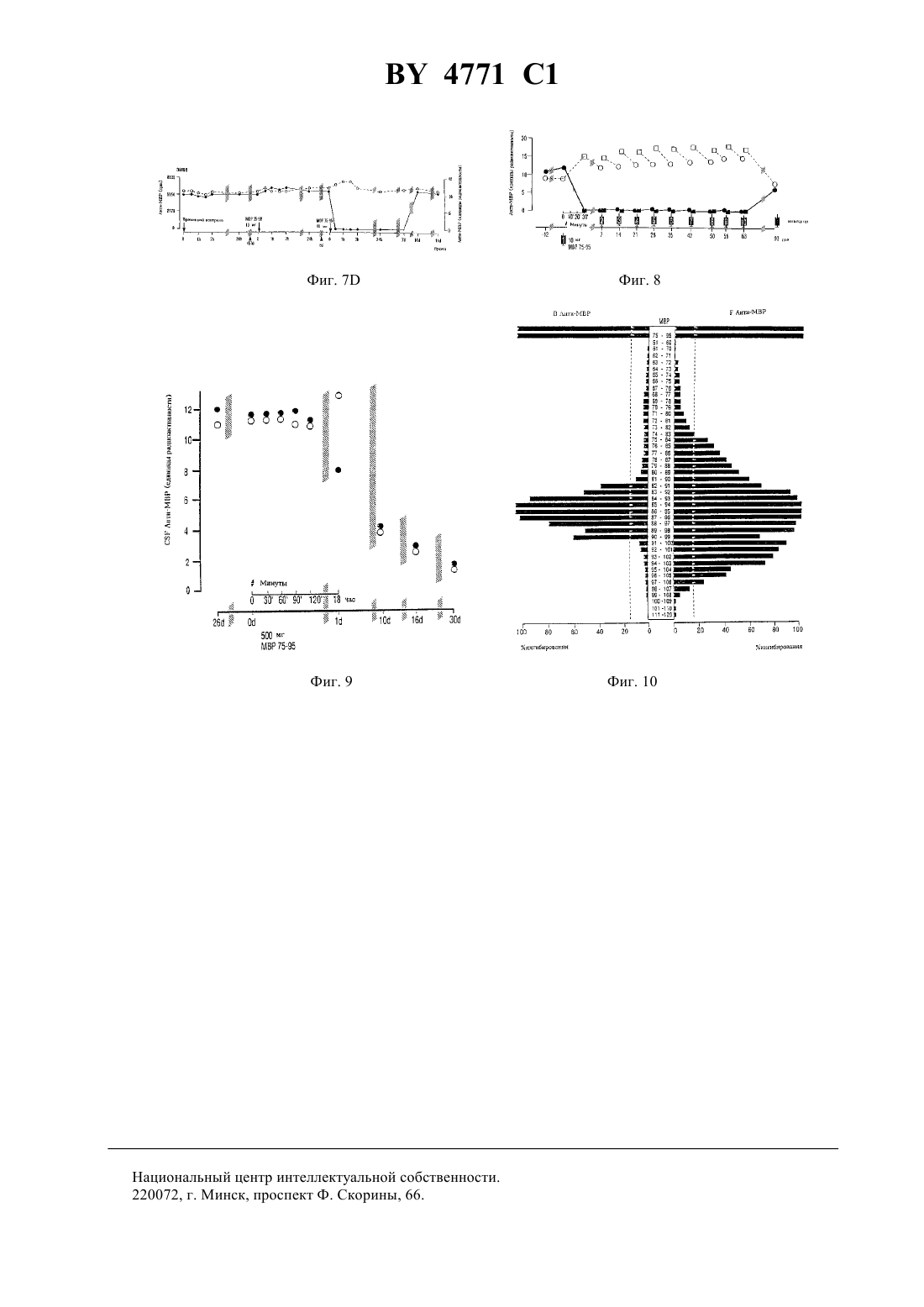
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ПЕПТИД, СПОСОБНЫЙ НЕЙТРАЛИЗОВАТЬ ИЛИ МОДУЛИРОВАТЬ ОБРАЗОВАНИЕ АНТИТЕЛ К МИЕЛИНОВОМУ ОСНОВНОМУ БЕЛКУ,ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА У ЧЕЛОВЕКА(71) Заявитель ЗЕ ГОВЕРНЕРС ОФ ЗЕ ЮНИВЕРСИТИ ОФ АЛБЕРТА(72) Авторы УОРРЕН Кенет Ж., КАЦ Ингрид(73) Патентообладатель ЗЕ ГОВЕРНЕРС ОФ ЗЕ ЮНИВЕРСИТИ ОФ АЛБЕРТА(57) 1. Пептид, способный нейтрализовать или модулировать образование антител к миелиновому основному белку, имеющий формулу-,,,,водород и гидрокси при условии, что 1 и 2 одновременно не являются водородом или гидрокси, при этом данный пептид содержит замещения, добавления или делеции,или его соли. 2. Пептид по п. 1, отличающийся тем, что когда 1 представляет собой , 2 является водородом или гидрокси,когда 1, 2-,когда 1-, 2,когда 1 водород или гидрокси, 2,когда 1, 2 и когда 1, 2. 3. Фармацевтическая композиция активная против рассеянного склероза, включающая пептид или его соли, способные нейтрализовать или модулировать образование антител к миелиновому основному белку, и фармацевтически приемлемый носитель, при этом указанный пептид имеет формулу 12,1 гдевыбран из группы, включающей-,,,,водород и гидрокси при условии, что 1 и 2 одновременно не являются водородом или гидрокси, при этом данный пептид содержит замещения, добавления или делеции. 4. Фармацевтическая композиция по п. 3, отличающаяся тем, что когда 1 представляет собой , 2 является водородом или гидрокси,когда 1, 2-,когда 1-, 2,когда 1 водород или гидрокси, 2,когда 1, 2 и когда 1, 2. 5. Способ лечения рассеянного склероза, заключающийся во введении пациенту пептида или его соли,отличающийся тем, что указанный пептид имеет формулу 12,1 гдевыбран из группы, включающей-,,,,водород и гидрокси при условии, что 1 и 2 одновременно не являются водородом или гидрокси, при этом данный пептид содержит замещения, добавления или делеции. 6. Способ по п. 5, отличающийся тем, что когда 1 представляет собой , 2 является водородом или гидрокси,когда 1, 2-,когда 1-, 2,когда 1 водород или гидрокси, 2,когда 1, 2 и когда 1, 2. 7. Способ по п. 5, отличающийся тем, что пептид вводят внутривенно, с помощью поясничной пункции,орально или комбинацией данных методов. 8. Способ по п. 5, отличающийся тем, что пептид вводят внутривенно в дозе от 1 мг/кг массы тела до 10 мг/кг массы тела однократно или последовательно несколько раз в случае необходимости. Данное изобретение касается некоторых полипептидов и их использования для иммунорегуляции антител к миелиновому основному белку человека. Изобретение также относится к новым фармацевтическим композициям, содержащим указанные полипептиды, и к способу использования этих пептидов для лечения рассеянного склероза. Рассеянный склерозэто многоочаговое демиелинизирующее заболевание центральной нервной системы (ЦНС) человека, связанное с воспалением. Повышенный синтезв пределах гематоэнцефалического барьера (-) является признаком рассеянного склероза (, . . .. 10279 304, 1970 , .., . . . . . 37397-401, 1977 , . .. В.,2876-83, 1978 , . ., . ., . . , . . ., 1.17475-480, 1985). Выработкав пределах ВВВ в основном повышается у пациентов с клинически определенным заболеванием - рассеянным склерозом (, . ., , .,. ... . 15266272, 1965), как в случае активной, так и скрытой формы заболевания. Специфичность большинстваЦНС неизвестна. Тогда как небольшая их часть обладает антивирусной активностью или выступает во взаимодействие с антигенами мозга, нуклеиновыми кислотами, эритроцитами или антигенами гладкой мускулатуры,другие неспецифическиемогут быть задействованы в поликлональной активации В-клеток (, ..,, В.,2876-83, 1978). В течение последнего десятилетия наблюдается значительный интерес к изучению антител, специфичных к миелиновым белкам. Вслед за обнаружением циркулирующих иммунных комплексов, содержащих миелиновый основный белок (МВР) в качестве антигенного компонента (, М. К. , , , К. .,, . .. 10239-243, 1983), были выявлены повышенные титры антител к МВР (-) в спино-мозговой жидкостибольных с активной формой рассеянного склероза(, К. .,, .,20920-25, 1986). Клиническая картина рассеянного склероза характеризуется фазами активного заболевания, такими как острые рецидивы или хроническое течение, и фазами клинической ремиссии. Для активной формы рассеянного склероза характерны повышенные уровни внутриоболочечных антиМВР (, К. .,, .,20920-25, 1986,, .,, . .,.. 1321-24, 1986). Эти антитела обнаруживаются преимущественно в свободнойформе во время острых рецидивов и преимущественно в связной (В) форме - когда болезнь незаметно прогрессирует (, К..,, .,20920-25, 1986). Во время острых рецидивов титры анти-МВР в спиномозговой жидкостисоответствуют активному развитию заболевания (, К. .,, 1., А 21183-187, 1987). Уровни анти-МВР также повышаются у больных с первыми приступами оптического 4771 1 неврита и у большинства больных с начальными стадиями рассеянного склероза(, К. ., ,1.,, С.,23297-299, 1988 , . .,, .,. 91143-151, 1989). Продолжительные исследования кинетики уровней антител к МВР ву пациентов, находящихся в стадии выздоровления после острого рецидива, показали постепенное падение титров анти-МВР в свободнойформе с соответствующим пропорциональным повышением (В)-фракций, т.е. анти-МВР в связанной форме (, К. .,, ., .. 91143-151, 1989 , . .,, ., .. 88185-194, 1988). В стадии ремиссии анти-МВР вмогут не обнаруживаться, что позволяет предположить, что нейтрализация анти-МВР связана с неактивной стадией заболевания(, . .,,., .. 88185-194, 1988). Наоборот, хронически прогрессирующий рассеянный склероз , характеризующийся постоянным увеличением выработки анти-МВР в течение продолжительного периода времени, связан с ингибированием нейтрализации анти-МВР (, К. .,, ., .. 88185-194, 1988). Недавно в -фракции, полученной избольных , были идентифицированы антитела к основному миелиновому белку, в том числе анти-МВР, антитела, нейтрализующие анти-МВР, и антитела, ингибирующие нейтрализацию анти-МВР (, К. .,, ., .. 9619-27, 1990). Предыдущие исследования авторов изобретения с учетом сведений о В- клеточных аутоантителах показывает, что существует по крайней мере две отличающиеся друг от друга формы рассеянного склероза первая - когда у большинства больных вырабатываются аутоантитела к миелиновому основному белку (анти-МВР), и вторая - когда у меньшего числа больных вырабатываются антитела к белку протеолипидной природы (анти-) (, К. .,.,35280-289, 1994). При той форме заболевания, для которой характерно наличие анти-МВР, острые рецидивы сопровождаются увеличением соотношения свободныхи связанных (В) анти-МВР, тогда как хронически прогрессирующая фаза характеризуется более низким соотношением / анти-МВР, а больные на стадии ремиссии редко имеют слегка повышенные титры анти-МВР (, К. .,, ., .. 88185-194, 1989). Было показано, что часть пролиферирующих Т-клеток у больных рассеянным склерозом направлена к МВР (., , 718-721, 1990) и что Т-клетки человека могут узнавать множественные эпитопы на молекуле (., .23, 55-66, 1989). МВР, по-видимому, также способом к активации некоторых Т-клеток без вовлечения антиген-презентирующих клеток (, . . . 17,1635-1640, 1987). Похоже, что небольшие пептиды МВР могут распознаваться Т-клетками без внутриклеточного процессирования просто за счет их способности связывать антигены основного комплекса гистосовместимости классана поверхности презентирующих клеток. Поскольку экспериментальный аллергический энцефаломиелит (ЕАЕ), признанный моделью рассеянного склерозана животных, может быть индуцирован введением чувствительным грызунам как МВР, так ив сочетании с полным адьювантом Фрейнда, процесс демиелинизации при рассеянном склерозе, возможно, имеет аутоиммунный механизм(, . В.., . ., 130, 1024-1024, 1983 , . .., .. 79, 173-188, 1987). Принимая во внимание сведения о В-клеточных аутоантителах, эпитоп МВР, на который нацелено заболевание, локализован вблизи от трипролиловой последовательности (остатки - 99-100-101-) на участке между 80-м и 100-м остатком (, К. .,,35280-289, 1994). Этот В-клеточный эпитоп частично перекрывает иммунодоминантный эпитоп Т-клеток, активных в отношении МВР, которые обнаружены в участках мозга, пораженных рассеянным склерозом(, . ., , 362,68-70,1993). Предыдущие исследования показали, что анти-МВР нейтрализуются МВР. Однако предварительные попытки лечения рассеянного склерозавнутримышечным или подкожным введением гетерологичных МВР не привели к успеху (, В., , . ., , ., .,2910-15, 1973, . ., , ., ,21627- 31, 1977, . ., .,, . ., , . . ., . ., .. ,, 1982621-630). Проблема использования нативного МВР имеет две стороны. Белок получают из образцов мозга человека и потому существует потенциальная опасность, что в нем присутствуют латентные нейровирусы. Кроме того, несмотря на то, что, как правило, МВР не является иммуногенным, при введении лицам с нарушенной иммунной системой МВР может проявлять себя как антиген и вызывать выработку антител к МВР. Соответственно, настоящее изобретение направлено на решение вопросамогут ли анти-МВР, выделенные из спиномозговой жидкостибольных рассеянным склерозомв стадии острого рецидива нейтрализоваться определенными пептидами МВР человека (-). Для этой цели синтетические пептиды,соответствующие полной длине -, использовали для определения возможной эпитопной области на , которая нейтрализует анти-МВР, полученные от указанных больных. Следовательно, выбранные пептиды, которые нейтрализуют анти-МВР, могут использоваться для лечения рассеянного склерозаболее эффективно, чем МВР полной длины. Эти пептиды получены искусственным путем и потому не несут потенциальной угрозы, связанной с нейровирусами. Кроме того, в связи с малым размером эти пептиды не проявляют себя в качестве иммуногенов. Следовательно, использование указанных пептидов как средства 4 4771 1 лечения рассеянного склероза поможет решить проблемы, возникающие при использовании нативного белка. Кроме того, пептиды, полученные согласно настоящему изобретению, исследуют для определения эффективности их связывания или модуляции выработки анти-МВР рассеянного склероза. В соответствии с изобретением заявлены пептиды, последовательность которых в основном гомологична части аминокислотной последовательности миелинового основного белка человека. Эти пептиды способны нейтрализовать или модулировать выработку анти-МВР. В соответствии с настоящим изобретением заявляются пептиды формулы 12 и их соли, где - аминокислотные остатки 87-9301 и 1 и 2 независимо выбраны из группы, включающей водород, гидрокси, остаток аминокислоты и остаток полипептида, причем 1 и 2 не являются водородом или гидроксилом одновременно. Пептид может содержать замещения, делеции или добавления, причем его функция нейтрализации или модулирования выработки анти-МВР сохраняется. Примеры указанных пептидов. МВР 75-95 (аминокислотные остатки 75-951)64-78 (аминокислотные остатки 64-781)61-75 (аминокислотные остатки 61-751)69-83 (аминокислотные остатки 69-831)80-97 (аминокислотные остатки 80-971)91-106 (аминокислотные остатки 91-1061)84-93 (аминокислотные остатки 84-931). Далее, согласно настоящему изобретению, заявлена фармацевтическая композиция, содержащая в качестве активного ингредиента пептид из числа описанных выше, индивидуально или в композиции, смеси с фармацевтически приемлемым носителем. Кроме того, в соответствии с настоящим изобретением заявляется способ лечения рассеянного склероза,предусматривающий введение эффективного количества пептида из описанных выше, как индивидуально,так и в сочетании для эффективной нейтрализации или модулирования выработки антител к МВР человека. Изобретение поясняется чертежами. Фиг. 1 - показывает локализацию восемнадцати синтетических пептидов по отношению к интактной молекуле МВР человека. Пептиды представлены в виде вертикальных полос и размещены после соответствующего им участка на молекуле МВР. Шкала показывает аминокислотные остатки на молекуле МВР человека. Фиг. 2 показывает кривые ингибирования антител к МВР, очищенных и полученных от 10 различных больных рассеянным склерозом, при введении МВР человека и МВР-пептидов. Фиг. 3 показывает нейтрализацию анти-МВР, полученных от одного больного рассеяннымМВР человека и пептидами МВР 80-97, МВР 91-106 и МВР 75-95. Фиг. 4 - длительный мониторинг титров анти-МВР в спинномозговой жидкости у пациента с хроническим рассеянным склерозомуровни(свободных) и В (связанных) анти-МВР были стабильно повышенными при исследовании 26 проб в течение 11-летнего периода с 1983 по 1993 г.счет в минутуо бразцае диницы Радиоактив ностиобщее- о - связанные (В) анти-МВР, определенные после кислотного гидролиза иммунных комплексов в спинномозговой жидкости . - свободныеанти-МВР. Фиг. 5 - контрольные больные уровни анти-МВРв 2 временных контролях (156, Фиг. 5 А и ЗМ 66,Фиг. 5 В) и 2 двух временных контролях при использовании физиологического раствора. У всех четверых больных уровень - и (В)-анти-МВР остается устойчиво повышенным по отношению к базовому уровню,5 4771 1 когдаотбиралась для анализа каждые 30 мин в течение первых двух часов, так же, как и 24 часами позже. Обозначения такие же, как на фиг. 4. Фиг. 6 - сравнительные исследования пептидов от разных больных уровни анти-МВР в спинномозговой жидкости в группе из четырех больных (1038, Фиг. 6 а 1343, Фиг. 6 С 5 М 59, Фиг. 6 и ЗМ 66, Фиг. 6),получивших увеличенные количества (1, 2.5, 5 и 10 мг соответственно) несвязанного контрольного синтетического пептида МВР-35-58 и в группе из четырех других больных (653, Фиг. 6 В 8 М 41, Фиг. 6 и 4 М 45,Фиг. 6 и 156, Фиг. 6 Н), которые получали повышенные количества (1, 2.5, 5 и 10 мг соответственно) анти-МВР, связывающих синтетический пептид МВР 75-95.- анти-МВР были связаны в дозозависимом соотношении пептидом МВР 75-95, и они не вступали во взаимодействие с пептидом МВР 35-58. Связанные анти-МВР оставались фактически нереакционноспособным. Фиг. 7 - сравнительные исследования пептидов от разных больных когда больныеподвергались временному контролю (156, Фиг. 7 С и ЗМ 66, Фиг. 7) или временному контролю при использовании физиологического раствора (5 М 59, Фиг. 7 А и 4 М 45, Фиг. 7 В), а также, когда они получали несвязанный контрольный пептид МВР 35-58 (5 М 59 и ЗМ 66), уровни их -анти-МВР и (В)-анти-МВР оставались постоянно неизмененными. Напротив, когда те же больные 4 М 45, 156 и ЗМ 66 позже получили 5-10 мг анти-МВР, связанных с пептидом МВР 75-95, их -анти-МВР переставали обнаруживаться в течение периода до 7 дней и возвращались на уровень базовой линии между 10 и 21 днем. Фиг. 8 - повторяемые внутрикожные инъекции синтетического пептида больной с хронически прогрессирующимполучал 10 еженедельных инъекций 10 мг МВР 75-95, вводимых непосредственно в спинномозговую жидкость титрыи (В)-анти-МВР измерялись до (обозначенные кружками) и спустя 30 мин после инъекции (обозначенные квадратами). Свободные -анти-МВР (заштрихованные квадраты и кружки) становились неопределяемыми в течение 10 недель, несмотря на то, что уровень связанных (В)-антител оставался существенно неизмененным (незаштрихованные квадраты и кружки). Фиг. 9. Внутривенное введение синтетического пептида уровни анти-МВР в спинномозговой жидкости соответствуют одной внутривенной инъекции 500 мг МВР 75-95 уровни связанных (В)- и свободных анти-МВР существенно снижаются при исследованиях спустя 10, 16 и 30 дней после инъекции. Обозначения- такие же, как на Фиг. 4. Фиг. 10. Дальнейшее изучение МВР эпитопа для анти-МВРс использованием группы из 41 декапептида, которые перекрывают участки между 61 и 110 остатками. Описание полосы обозначают процент ингибирования 100 - единицы радиоактивности МВР и пептид МВР 75-95 были использованы в качестве позитивного контроля и обеспечили 100 ингибирование как свободных -, так и связанных (В)-антител пептиды МВР 51-60 и МВР 111-120 были использованы в качестве негативного контроля и привели к незначительному ингибированию (0-10 ) связанных (В)- и свободных -анти-МВР декапептиды МВР 84-93, МВР 85-94, МВР 86-95 и МВР 87-96, которые обеспечили максимальное ингибирование (90-100 ) как свободных -, так и свободных (В)-антител, тесно ассоциируются с МВР эпитопом пунктирная линия 95 -ный достоверный интервал исследования по ингибированию. Детальное описание изобретения. Настоящее изобретение касается пептидов, аминокислотная последовательность которых практически гомологична части аминокислотной последовательности миелинового основного белка человека. Термин практически гомологична означает, что небольшие различия между аминокислотной последовательностью миелинового основного белка человека и пептидами могут существовать при условии, что пептиды с небольшими различиями в аминокислотной последовательности способны функционировать в соответствии с изначально присущим назначением, т.е. способны нейтрализовать или модулировать выработку антител к миелиновому основному белку человека (анти-МВР). Проведенные в настоящем изобретении разъяснения делают очевидным для специалистов в данной области тот факт, что эмпирически небольшие вариации в аминокислотной последовательности указанных пептидов могут быть произведены без ущерба для их функции. В соответствии с настоящим изобретением на основе исследований по конкурентному ингибированию при использовании набора из 41 декапептида было установлено, что МВР эпитоп для анти-МВРлокализован на участке между аминокислотой 82 и аминокислотой 98 (более 40 ингибирования связанных антиМВР и более 60 ингибировния свободных анти-МВР). С учетом самого высокого уровня ингибирования МВР эпитоп анти-МВР вероятно находится между аминокислотой 84 и аминокислотой 96. Наименьший общий участок эффективных декапептидов располагается между 87 и 93 аминокислотами. Таким образом, в соответствии с настоящим изобретением пептиды могут описываться следующей формулой 1 - 2, 6 4771 1 включающей и их соли, где остатки аминокислот 87-931 и где 1 и 2 - независимо друг от друга выбраны из группы, включающей водород, гидрокси, остаток аминокислоты и остаток полипептида при условии, что 1 и 2 не являются водородом или гидроксилом одновременно. Участок аминокислотной последовательности, соответствующий семи аминокислотам, занимающим положение 87-93, вероятно, не слишком велик, чтобы эффективно связывать анти-МВР. Поэтому 1 и 2 не могут одновременно быть водородами или гидроксилами. Когда 1 или 2 - аминокислота, то она может быть выбрана из природных аминокислотили 2 не ограничены аминокислотами, расположенными в положенииипо отношению к 187 и 93 в миелиновом основном белке человека, как показано в 1. Могут использоваться различные модификации, включая замещения, добавления и делеции в последовательностях, расположенных в положенияхиотношению к 1 и 2. Кроме того, такие же модификации, включая замещения, добавления и делеции, могут быть произведены и в последовательности , при условии, что полученные таким образом пептиды сохраняют предназначенную им функцию, т.е. нейтрализуют или модулируют выработку антител к миелиновому основному белку человека. Термин остаток пептида или полипептидный остаток обозначает полипептид, состоящий из двух,трех и более аминокислотных остатков, включая белки и их фрагменты. Как сказано выше, когда , или 2 полипептидный остаток, 1 и 2 не ограничиваются пептидами, расположенными в положенииипо отношению к 187 и 93 миелинового основного белка человека. Может быть использован любой остаток полипептида. 1 и/или 2 могут быть повторами последовательности или ее модификациями, включая замещения, дополнения или делеции. Таким образом, пептид может содержать многочисленные повторы сайта связывания анти-МВР (эпитопа). Соединения, заявленные согласно настоящему изобретению, могут быть получены в соответствии с общепринятыми и хорошо известными методами синтеза полипептидов. Под термином пептид подразумевают пептиды, полученные из природных миелиновых основных белков человека в результате контролируемого гидролиза, осуществляемого до образования пептидов, относящихся к данному изобретению. Указанное понятие также включает и пептиды, полученные с помощью технологии рекомбинантных ДНК. С учетом известной последовательности заявленных пептидов в объем настоящего изобретения включено также установление соответствующей последовательности ДНК, кодирующей заявленную аминокислотную последовательность. Соответствующая последовательность ДНК может быть получена общепринятыми хорошо известными методами синтеза ДНК последовательностей. Полученные таким образом последовательности ДНК могут быть клонированы в соответствующих клонирующих векторах и использованы для трансформации подходящей клетки-хозяина с целью получения рекомбинантного пептида. Все изложенные выше подходы являются общепринятыми и хорошо известными для специалистов в данной области. Пептиды, заявленные согласно настоящему изобретению, в основном гомологичны по своей аминокислотной последовательности части аминокислотной последовательности миелинового основного белка человека. Понятие часть аминокислотной последовательности означает, что последовательность может быть любой длины при условии, что она достаточно длинна для того, чтобы нейтрализовать или модулировать выработку антител к МВР, но имеет не такую длину, которая приводит к известным ранее проблемам, когда пептиды используютсядля лечения рассеянного склероза. В одном примере настоящего изобретения описаны пептиды, включающие от 10 до 25 аминокислотных остатков. Если заявленные пептиды используются как часть белков слияния, общий размер пептида может быть гораздо больше. В соответствии с одним вариантом осуществления изобретения было установлено, что заявленные пептиды, соответствующие в значительной мере аминокислотной последовательности человеческого МВР, эффективны в отношении нейтрализации и модулирования выработки анти-МВР. Эти пептиды соответствуют аминокислотной последовательности человеческого МВР в интервале от 61 до 106 аминокислотного остатка. В одном примере эти пептиды соответствуют участку 75-106 аминокислотной последовательности человеческого МВР, когда пептиды используются для нейтрализации свободных анти-МВР. В последующем примере эти пептиды соответствуют участку 82-99 аминокислотной последовательности человеческого МВР, когда пептиды используются для нейтрализации и модулирования выработки связанных анти-МВР. Поэтому выбираются пептиды, состоящие из 10-25 аминокислотных остатков, из сплошной аминокислотной последовательности в пределах последовательности, показанной ниже (аминокислотные остатки 01), при условии, что указанная последовательность может нейтрализовать или модулировать выработку антител к миелиновому основному белку человека. Аминокислотные остатки 61-1061 61 Ту 106. Ниже приведены примеры пептидов, выбранных из группы, включающей 7 4771 1 МР 61-75 (аминокислотные остатки 61-751)64-78 (аминокислотные остатки 64-781)69-83 (аминокислотные остатки 69-831)75-95 (аминокислотные остатки 75-951)80-97 (аминокислотные остатки 80-971)91-106 (аминокислотные остатки 91-1061). Один аспект настоящего изобретения касается пептидов, представленных формулой 1 2 и их солей, где 1 и 2 независимо друг от друга выбраны из группы,включающей водород, гидрокиси, остаток аминокислоты и остаток полипептида при условии, что 1 2 не являются одновременно водородом или гидроксилом. Пептид может содержать замещения, добавления или делеции при условии сохранения пептидом своего свойства нейтрализовать или модулировать выработку антител к МР человека. Ниже приведены примеры пептидов, выбранные из группы, включающей МР 84-93 (аминокислотные остатки 84-931). Возможная роль анти-МВР в патогенезе рассеянного склероза продолжает исследоваться. О повышенных титрах анти-МВР у больных активной формой рассеянного склероза впервые сообщили. (,. ., , С. .,, . .,37206-209, 1980), которые использовали твердофазный радиоиммунологический анализ с МВР морской свинки. Пациенты с острым рецидивом заболевания, как правило, имели повышенное содержание анти-МВР, в основном, в свободной форме, тогда как некоторые больные в стадии клинической ремиссии могли иметь необнаруживаемые уровни анти-МВР. Во время переходного периода от острой дозы к ремиссии титры свободных анти-МВР прогрессивно снижались за период от нескольких недель до нескольких месяцев, в то время как уровень связанных антител был сравним с первоначальным. У других больных на стадии ремиссии можно было наблюдать низкие титры свободных и связанных анти-МВР, обычно с соотношением / меньше 1. Это позволяет предположить, что антитела (антитело), нейтрализующие анти-МВР, связываются с анти-МВР. Иногда больные, которые точно соответствовали критериям клинически определяемого рассеянного склероза, или больные с нейропатологически выявленным рассеянным склерозом имели неопределяемый уровень анти-МВР в период активной стадии заболевания. Возможно, такие пациенты имеют антитела к другим миелиновым белкам. Отсутствие схемы выработки специфических антител не уменьшает потенциальной возможной роли анти-МВР в механизме демиелинизации у большинства больных рассеянным склерозом. Недавно различные антитела к МВР были обнаружены во фракции , выделенной из спинномозговой жидкости больных рассеянным склерозом (, К. ., .,9619-27, 1990). Первичные антитела к МВР как в свободной, так и в связанной форме оказались связанными с активной фазой заболевания/1 у пациентов с острой формой и 1 - у пациентов с хронически прогрессирующей формой рассеянного склероза (, К. ., .,20920-25, 1986 , .,, . .1321-24, 1986, . ., .,21183-187, 1987). Вторичные антитела, которые нейтрализуют анти-МВР, появляются, когда заболевание переходит в неактивную форму. Третичные антитела, которые ингибируют нейтрализацию анти-МВР, обнаруживаются, когда заболевание становится хронически прогрессирующим и переходит в неактивную форму. Тот факт, что каскад антител к МВР ассоциирован с фазами , позволяет предположить, что образование таких антител, возможно, играет важную роль в развитии данного заболевания. Несмотря на то, что анти-МВР могут быть определены вбольных с активной формой рассеянного склероза , их главная роль в патогенезе демиелинизации остается неподтвержденной. Участие анти-МВР в механизме развития рассеянного склерозалучше всего может быть установлено их нейтрализацией, возможно, при введении заявленных пептидов и мониторингом клинического течения заболевания. Если анти-МВР являются только первичными антителами, связанными с демиелинизацией при рассеянном склерозе , вероятно, возможно блокировать димие 8 4771 1 линизацию внутриоболочечным, и/или внутривенным, и/или оральным введением заявленных МВР пептидов, которые нейтрализовали бы анти-МВР и обеспечивали бы толерантность к. Другие миелиновые белки человека, возможно, также участвуют в димиелинизации при рассеянном склерозеи, в соответствии с этим, в объем настоящего изобретения включено использование пептидов, в значительной мере гомологичных по аминокислотной последовательности части аминокислотной последовательности указанных других миелиновых белков, для того, чтобы нейтрализовать соответствующие антитела. Несмотря на то,что предыдущие попытки лечения рассеянного склерозавнутримышечным или подкожным введением гетерологичного МВР не оказались в полной мере успешными (, В., , . ., , ., ., .2910-15, 1973 , . ., , ., .21627-31, 1977, . ..,, . ., , . . ., . ., ..,, 1982621-630), внутриоболочечное и/или внутривенное введение МВР пептидов, которые нейтрализуют или модулируют выработку анти-МВР, в соответствии с изобретением, продемонстрировало более успешные результаты. Модельюна животных служит экспериментальный аллергический энцефаломиелит (ЕАЕ), представляющий собой опосредованное Т-клетками демиелинизирующее заболевание. Симптомы ЕАЕ могут быть скорригированы введением мышам синтетических пептидов МВР (, ., , 258, 1491-1494,1992). Более того, введение высоких доз МВР делегировало аутореактивные Т-клетки и аннулировало клинические и патологические симптомы ЕАЕ у мышей (, . .., , 263, 1139-1143, 1994). Даже оральное введение МВР модулировало течение ЕАЕ за счет индукции периферической толерантности(, ., , 265, 1237-1240, 1394). Недавно на основании сдвоенных пробных экспериментов было высказано предположение, что толерантность может быть индуцирована у больныхоральным введением миелиновых антигенов (, . ..259, 1321-1324, 1993). Комбинация миелиновых антигенов и синтетических пептидов указанных антигенов, введенная оральным, и/или внутривенным, и/или внутриоболочечным путем, возможно, необходима для модулирования Т-клеток, В-клеток и макрофагов,участвующих в деструкции миелина у больных рассеянным склерозом . Соответственно, изобретение также касается фармацевтической композиции, содержащей в качестве активного ингредиента пептид, описанный выше, отдельно или в композиции, в смеси с фармацевтически приемлемым носителем. Примеры фармацевтически пригодных носителей хорошо известны и включают, например, физиологический раствор. Пептиды, заявленные в настоящем изобретении, могут назначаться людям для лечения или модулирования . Терапевтическая доза для внутривенного и/или орального введения при леченииможет составлять от примерно 1.0 мг на 1 кг веса тела до примерно 10.0 мг на 1 кг веса тела. Если введение осуществляется внутриоболочечно, доза может составлять от около 1 до около 10 мг. В одном из примеров изобретения пептид применяется либо внутривенно, либо внутриоболочечно или сочетанием данных методов. Если требуется, пептиды могут назначаться как однократной дозой, так и последовательно в виде нескольких доз. В то время как в описании изобретения детально и подробно изложены предпочтительные варианты его осуществления, нижеследующие примеры иллюстрируют, но не ограничивают изобретение. Пример 1. Нейтрализация антител к МВР человека. Фиг. 1 показывает локализацию 18 пептидов человеческого МВР, используемых в этом опыте, по отношению к молекуле интактного МВР. Нативный МВР был выделен из ткани мозга, не пораженного рассеянным склерозом, О. Е., ,., , . , 2139-165, 1972) и далее очищен гель-фильтрацией. Конечные антигенные препараты были проверены на чистоту электрофорезом в полиакриламидном геле. В дальнейших исследованиях использовались только те препараты, которые перемещались соответственно молекулярному весу 18.5 кД. Очищенный МВР был использован в антиген-специфичной аффинной хроматографии, в опытах по нейтрализации и в твердофазном радиоиммуноисследовании при использовании анти-МВР. Восемнадцать пептидов, перекрывающих МВР человека и содержащих от 8 до 25 аминокислотных остатков, были синтезированы -методом, как было описано ранее (, . ., , , , ...19305-315, 1988). Чистота пептидов проверялась обратнофазовой жидкостной хроматографией высокого давления на колонке С 18 и при градиенте вода/ацетонитрил (0.1 ТА). Аминокислотный анализ пептидов был также осуществлен с помощью стандартных приемов. Многие пептиды, использованные в этом опыте, содержали остаток неприродного цистеина, т.к. они были синтезированы, чтобы функционировать в качестве иммуногенов. Маловероятно, чтобы это повлияло на сделанные выводы. Спинномозговая жидкость была получена в течение недели от момента появления начальных симптомов у 35 больных с острыми рецидивами , и уровниопределялись нефелометрически. Для этого опыта отбирались образцыс первоначально абсолютно высокими уровнями( 80 г/л) и повышенными титрами анти-МВР (/ отношение 1,0). Все больные имели клинически определенное заболевание. 4771 1 был выделен из концентрированной спинномозговой жидкости больных с острым рассеянным склерозом на протеин А-сефарозе (тм) аффинной хроматографией, как описано ранее (, К. .,, . .9619-27, 1990). Чистота каждого препаратапроверялась электрофорезом в полиакриламидном геле и изоэлектрическим фокусированием. Когда повышенные уровни анти-МВР из очищенногобыли абсорбированы МВР до нулевого значения, полученные после абсорбции супернатанты содержали остаточные количества . Очищенный МВР связывали с активированнойсефарозой 4 Вв соответствии с инструкцией производителя. Очищенныйизот 35 больных с острой формой рассеянного склерозаиспользовался как исходный материал для выделения несвязанных анти-МВР с помощью аффинной хроматографии на МВР-сефарозе (, К. .,, . ./0390-96, 1991). Очищенные образцы анти-МВР сравнивались с исходным источникомс помощью электрофореза в полиакриламидном геле. Когда очищенные анти-МВР были абсорбированы до нулевого значения с помощью МВР, полученные после абсорбции супернатанты не содержали остаточных . Постоянные количества анти-МВР (с целью расширения шкалы 15 единиц связывания радиоактивности приняты за 100 ) инкубировали с повышенными количествами человеческого МВР (0-10000 нг) или отдельными пептидами МВР (0-10000 нг) в жидкофазном исследовании и после 1,5 часов инкубации содержание (уровень) свободных анти-МВР определялось во всех смесях. Анти-МВР, выведенные отдельно от 7 больных , или объединенную фракцию анти-МВР от 10 различных больных использовали в экспериментах по нейтрализации. Гистон тимуса теленка и альбумин сыворотки человека использовались как негативные антигенные контроли (пределы 10-1000 нг). Одно моноклональное антитело к пептиду МВР 64-78 (клон 26) и поликлональная антисыворотка кролика к пептиду МВР 1-8 ( 155) использовались как позитивные контроли на антитела (, ., , ., ,. 7309-317, 1985 , ., , ..,2291300, 1991). Другое моноклональное антитело мыши к эпитопу 45-50 (клон 16) использовалось как негативный контроль на антитела. Уровни анти-МВР определяли твердофазным радиоиммуноисследованием при использовании МВР человека (, К. ., .20920-25, 1986 , . ., .21183187, 1987 , . ., , .91143-151, 1989). Содержание свободных анти-МВР измеряли во всех фракциях, полученных при аффинной хроматографии, и во всех реакционных смесях, используемых для нейтрализации. Все индивидуальные пробы исследовали четыре раза с использованием одного и того же йодинированного материала для того, чтобы минимизировать вариабельность результатов между опытами. Очищенные анти-МВР были полностью нейтрализованы МВР и пептидами МВР 80-97, МВР 91-106 и МВР 75-95 и были частично нейтрализованы пептидами МВР 64-78, МВР 69-83 и МВР 61-75 (Табл. 1 и фиг. 2). Оставшиеся 12 пептидов не нейтрализовали очищенные анти-МВР, и их кинетические кривые показывают спад в пределах заштрихованной области, см. фиг. 2. Гистон тимуса теленка и альбумин сыворотки человека не реагировали с очищенными анти-МВР даже при концентрациях выше 1000 нг. Клон 26 ингибировался только пептидом МВР 64-78.155 ингибировался только пептидом МВР 1-8. Клон 16 не реагировал ни с МВР, ни с другими пептидами (для чистоты изображения, данные контроля не приведены). Контрольные образцы показывают обоснованность подхода в отношении нейтрализации, так как каждое контрольное антитело было абсолютно нейтрализовано выбранным пептидом и никакими другими. Это показывает, что специфичность взаимодействия имеет место даже при высоких концентрациях пептидов(10 000 нг). Анти-МВР, полученные от 7 разных больных, были полностью нейтрализованы МВР человека и пептидами МВР 80-97, МВР 91-106 и МВР 75-95 (см. фиг. 3 как иллюстрацию). Поскольку полученное от отдельных пациентов количество антител было ограничено, анти-МВР не подвергали реакции с остальными 15 пептидами. Как указано выше, анти-МВР были нейтрализованы пептидами, соответствующими промежутку между 61 - 106 аминокислотными остатками. Пептиды, которые не нейтрализовали анти-МВР, охватывают аминоконцевой (примерно от 1 до 63 остатков) и карбоксиконцевой (примерно от 117 до 162 остатка) участки МВР человека. По-видимому, пептиды от различных не перекрывающихся участков МВР нейтрализуют одни и те же антитела. Это может объясняться тем, что антитела узнают прерывистый эпитоп, содержащий аминогруппы различных участков. Подобный факт ранее наблюдался. (, ., , . . . ..,241359-1364, 1987), который показал, что крысиное моноклональное антитело имеет основной эпитоп в последовательности МВР 112-121 и в то время сильную перекрестную реактивность с другим эпитопом 39-91. Это более вероятно, чем возможность того, что антитело имеет перекрестную реактивность по отношению к двум совершенно различным последовательностям, которые не образуют прерывистого эпитопа (, ., , Е. С., , Е. С.,. ., .44637-650, 1985). Данные по нейтрализации могут быть объяснены способностью пептидов, соответствующих различным участкам МВР, частично занимать связывающую область антитела, взаимодействуя с 10 4771 1 различными аминокислотами в боковых цепях. Это объяснение подтверждается тем наблюдением, что пептиды, обеспечивающие полное ингибирование (МВР 80-97, МВР 91-106 и МВР 75-95), приблизительно в 100 раз менее эффективны в молярном отношении, чем интактный МВР. Исходя из вышеизложенной гипотезы, это могло быть обусловлено тем, что каждый пептидный клон не способен достичь энергии связывания с действительным эпитопом МВР. Пример 2. Нейтрализация или модулирование образования антител к МВР человека,Подбор больных и контрольные исследования Больные, которых подобрали для данного исследовательского проекта, наблюдались в клинике по уходу и исследованию больных рассеянным склерозом Университета Альберты, Эдмонтон, Канада. Пациенты были продиагностированы как больные рассеянным склерозом по критерию Шумахера (1965) с подтверждением диагноза методом получения изображения мозга с помощью магнитного резонанса и/или иммунохимическими профилями спинномозговой жидкости . Для того чтобы проиллюстрировать, что при хронически прогрессирующем рассеянном склерозеуровень анти-МВР устойчиво повышен в течение продолжительных периодов времени, от месяцев до нескольких лет, у больных повторно брали пункциипоясничного отдела с контролем свободных и связанных анти-МВР. У больных с хронически прогрессирующим заболеваниемуровень аутоантител остается устойчиво повышенным в течение 11 лет и спонтанного спада уровня анти-МВР не происходит (фиг. 14 как иллюстрирующий пример). Для того чтобы определить, что изначально повышенные уровни анти-МВР в спинномозговой жидкости оставались относительно постоянными в течение 24 часов, у двух больных (156 и ЗМ 66) брали образцыкаждые 30 мин в течение 2 часов так же, как 24 часами позже, с контролированием свободной и связанной форм анти-МВР (фиг. 5 А и 5 В соответственно). Больные 156 и ЗМ 66 служили в качестве временных контролей. Уровни свободных и связанных анти-МВР оставались неизменно повышенными при исследованияхкаждые 30 мин в течение 2-х часов так же, как и спустя 24 часа. Кроме того, подобным образом был определен эффект введения 5 см 3 физиологического раствора в спинномозговую жидкость двум другим больным (4 М 45 и 5 М 59) (фиг. 5 С и 5 Д соответственно). Эти больные служили в качестве временных контролен с физиологическим раствором. При введении 5 см 3 физиологического раствора внутриоболочечно уровнии В анти-МВР оставались повышенными по сравнению с базовым уровнем, когда образцыисследовались, как описано выше, подтверждая таким образом, что эффект разведения на титры анти-МВР был незначительным. Уровни анти-МВР определяли твердофазным радиоиммунологическим анализом с МВР человека, адсорбированным в лунках панели для микротитрования Иммунлон. Лунки покрывали 100 мкл МВР в концентрации 10 мкг/мл (1 мкг/лунку) и инкубировали в течение ночи при 37 С. После нанесенияи трехкратного отмывания водой панели выдерживались при комнатной температуре. Образцы (100 мкл)или экстракта ткани, растворенные в 0,010 г /л (0,01 Мбуфер, 0,05 Твин 20), инкубировали в МВРпокрытых ячейках в течение 1-2 часов при комнатной температуре. После пяти отмываний буфером (0,01 М, 0,05 Твин 20) ячейки инкубировали с антителами козы к - кролика (0,01 М , 0,05 Твин 20, 0,5) в течение 1 часа при комнатной температуре и затем отмывали, как описано выше. Наконец,добавляли меченый 125-протеин А (или 125-протеин ) и инкубировали в течение 1 часа при комнатной температуре. Когда в качестве метки использовали 125-протеин ,в буфере для исследований и для процедуры истощения заменяли на овальбумин. После трехкратного завершающего отмывания водой лунки обсчитывали индивидуально. Результаты, выраженные в единицах радиоактивности, представляли следующим образом(счет образца - счет контроля) - (общий счет радиоактивности - счет контроля). Все образцы исследовали в 10 повторах, и время счета составляло 10 мин для того, чтобы зарегистрировать 10000 единиц радиоактивности в каждом положительном образце. Перед исследованием все образцыи/или образцы ткани разводили до конечной концентрации 0,010 г/л. Свободныеанти-МВР определяли непосредственно вили тканевом экстракте, тогда как уровни связанных антител определяли после кислотного гидролиза иммунных комплексов. Неспецифичное связывание наблюдалось для каждого образца в непокрытых лунках. С целью локализации эпитопа синтетические пептиды сначала подвергали взаимодействию с очищенными антителами в жидкофазном конкурентном исследовании, после чего анти-МВР определяли радиоиммунологическим анализом во всех конечных смесях. Результаты анализов конкурентного связывания и радиоиммуноанализа выражали какингибирования синтетического пептида, определенный как 100 единиц радиоактивности. Пробы исследовались в 10 повторах и обсчитывались в течение 10 мин на 1275 -счетчике. Объединенные выделенные из ткани анти-МВР использовались в 5 предварительно приготовленных разведениях в качестве позитивных контролей. , собранная от больных с не неврологическими заболеваниями, служила негативным контролем. Воспроизводимость исследований составляла от 3 до 5 , а разброс данных менее 7 . Определение постоянной повышенных уровней анти-МВР вв контрольных экспериментах составило следующую стадию исследования. Контрольный слепой эксперимент фазы 1 с дублированным пептидом-внутриоболочечная инъекция 11 4771 1 Проводят фазу 1 эксперимента по определению действия синтетического пептида МВР 75-95 на титрыи В анти-МВР в спинномозговой жидкости. После утверждения в Научном Совете по этике Университета Альберты проект был осуществлен при участии больных с клинически установленным диагнозом рассеянного склероза(,. ., 122, 552-568, 1965), тяжелобольных инвалидов с сильно прогрессирующим заболеванием. Четырнадцать больных согласились добровольно участвовать в этом исследовании 8 больных были отобраны по начальному титруанти-МВР в(около 8 единиц радиоактивности) (Табл. 2) для получения одной внутриоболочечной инъекции либо пептидов МВР 75-95, которые связывают анти-МВР, либо не связывающего контрольного пептида МВР 35-58 (, 1993 ). Эксперимент проводили методом двойного слепого варианта, когда ни исследователи, ни испытуемые не знали природы вводимого вещества. Все пептиды были закодированы семью наугад выбранными однозначными номерами посторонним врачом. Парные пептиды, растворенные в 5 см 3 физиологического раствора и введенные впутем поясничной пункции, использовались в возрастающих дозах (1, 2,5,5 и 10 мг).исследовалась до инъекции (базовая линия), с 30 минутными интервалами в течение 2 часов после инъекции, 24 часами позже и затем с предельным интервалом в течение 3-4 недель до тех пор, пока уровни анти-МВР не вернулись к базовому (исходному). Подсчет клеток, общий белок, глюкоза, уровнии альбумина были определены во всех образцах . Уровни свободных и связанных анти-МВР определяли радиоиммуноанализом, как описано выше. Табл. 2 Клинические данные и уровни анти-МВР ву 14 больных с хронически прогрессирующим рассеянным склерозом , давших согласие участвовать в фазе 1 научного исследования, предусматривающего внутриоболочечную однократную инъекцию синтетических пептидов МВР. Поскольку был необходим исходно высокий уровень свободныханти-МВР ( 8 единиц радиоактивности) для того, чтобы получить значительное постинъекционное изменение, для исследования было отобрано только 8 из 14 больных. Все пептиды, используемые в данных исследованиях, синтезировались под кодом продукт хорошего качествана основе(9-метоксикарбонил) метода. (. , ). Чистоту пептидов контролировали жидкостной обратнофазовой хроматографией на колонке С 18 при водноацетонитрильном градиенте, содержащем 0,1 ТХУ. Масе-спектроскопия и аминокислотный анализ выполнялся на основе стандартных методик. Перед введением все пептиды тестировались на пирогенность(Ванкуверский Генеральный госпиталь, Ванкувер, Канада), стерильность (местная лаборатория Общественного Здравоохранения Северной Альберты, Эдмонтон, Канада) и острую токсичность (Служба Лаборатория медицинских исследований Университета Альберты, Канада). Было показано, что они пригодны для введения людям. Соответствующие количества закодированных синтетических пептидов растворяли в 5 см 3 стерильного физиологического раствора (0,9, инъекция , апирогенный,, ,) фильтровали 2 раза через стерилизующую мембрану с размером пор 0,22 мкм (-,., ,, ) и вводили в спинномозговую жидкостьпутем поясничной инъекции. Сравнительные (между пациентами) исследования пептидов Больные 633, 8 М 41, 4 М 45 и 156 получали синтетический пептид МВР 75-95, способный связывать анти-МВР, а пациенты 1036, 1343, 5 М 59 и 3 М 66 получали контрольный несвязывающий синтетический пептид МВР 35-58 в возрастающих дозах 1, 2,5, 5 и 10 мг соответственно (фиг. 6). У больного 653(фиг. 6 В), который получил 1 мг МВР 75-95, наблюдалось 75 уменьшение свободных анти-МВР с немедленным возвращением их к исходному уровню у больного 8 М 41 (фиг. 6), который получил 2,5 мг МВР 7595, наблюдалось полное связывание-нейтрализация свободных анти-МВР, а затем их уровень вернулся к исходному через 24 часа у больного 4 М 45 (фиг. 6), которому ввели 5 мг МВР 75-95, произошло резкое и полное связывание-нейтрализация свободных анти-МВР, что продолжалось в течение 7 дней с возвратом к исходному уровню, как было установлено, спустя 21 день у больного 156 (фиг. 6 Н), которому ввели 10 мг МВР 75-95, также произошло полное связывание-нейтрализация свободных анти-МВР, что продолжалось в течение 7 дней и затем уровень антител вернулся к исходным значениям, как было установлено, в период с 14 по 28 день. Уровни связанных анти-МВР несущественно изменялись при однократном внутриоболочечном введении МВР 75-95. У больных 1038, 1343, 5 М 59 и 3 М 66, которым было введено соответственно 1,2,5, 5 и 10 мг контрольного несвязывающего пептида МВР 35-58, уровни свободных и связанных антител воставались измененными по отношению к исходному в течение 24 часов эксперимента (фиг. 6 А, 6 С, 6 Е и 6 соответственно). Традиционные -параметры воспаления при , такие как счет клеток, абсолютные уровни общего белка,и альбумина, олигоклональное связывание, индекси синтезв ,оставались неизменяемыми до и после введения пептида. Сравнительные исследования пептидов при введении одному пациенту Эти исследования проводились для того, чтобы минимизировать вариабельность результатов полученных исследований нескольких больных. У больного 5 М 59, которому вводили либо физиологический раствор(временный контроль), либо 5 мг несвязывающего пептида МВР 35-58, уровни свободных анти-МВР оставались повышенными относительно исходного уровня во время обоих экспериментов (фиг. 7 А). Больному 4 М 45 первоначально вводили физиологический раствор (временный контроль), а двумя месяцами позже ему 12 4771 1 ввели 5 мг МВР 75-95. Уровни свободных больных анти-МВР оставались устойчиво повышенными во всех образцах, собранных во время контрольного эксперимента, и стали необнаруживаемыми после введения МВР 75-95 (фиг. 7 В). Подобные результаты были получены и у больной 156, которая имела устойчиво повышенные уровни свободных антител в течение контрольного эксперимента, а после введения 10 мг МВР 75-95 ее свободные анти-МВР стали необнаруживаемыми, (фиг. 7 С). Полное исследование было проведено с больным 3 М 66. У него уровни свободных анти-МВР были устойчиво повышенными в течение контрольного эксперимента или при введении 10 мг МВР 35-58 однако, когда были введены 10 мг МВР 75-95, свободные анти-МВР были полностью нейтрализованы и не обнаруживались в течение 7 дней (фиг. 7). Повторное введение синтетического пептида МВР 75-95 После установления того, что пептид МВР 75-95 нейтрализует свободные анти-МВРза период,больший чем 7 суток, было принято решение о повторном введении 10 мг МВР 75-95 в спинномозговую жидкость еженедельно в течение 10 недель. Этот эксперимент был проведен с участием трех больных с прогрессирующим рассеянным склерозом , которые не участвовали в эксперименте по однократному введению пептидов и дали согласие на это исследование. Свободные и связанные анти-МВР определялись за 12 недели до первого введения, до и после 30 мин после каждой инъекции и вновь спустя 1 и 2 месяца после последней инъекции. Счет клеток, общий белок, глюкозу,и альбумин определяли во всех образцах ,полученных перед каждой из 10 инъекций. Перед первой и после последней инъекции отбирали кровь и анализировали содержание электролитов, креатинина, ферментов сердца и печени и гематологические показатели. Когда больные хронически прогрессирующей формой рассеянного склерозаполучали повторные внутриоболочечные инъекции 10 мг МВР 75-95 с недельным интервалом (в течение периода до 10 недель),первоначально высокий уровень свободных анти-МВР мог становиться необнаруживаемым, пока вводился пептид когда пептид прекращали вводить, уровень свободных анти-МВР возвращался на исходный в течение 1-2 месяцев (фиг. 8). Титры связанных антител оставались устойчиво повышенными на протяжении всего эксперимента. Больные, которые участвовали в этих исследованиях и которые получали либо однократные инъекции синтетических пептидов, либо повторяемые еженедельно инъекции, имели хронически прогрессирующий рассеянный склероз с повышенной степенью неврологических повреждений. Ни один из этих больных не сообщил об ухудшении неврологических симптомов или об обострениях болезни , последовавших в результате внутриоболочечного введения пептидов, и клеточная реакция вне развивалась. Больные, получавшие повторные введения МВР 75-95 контролировались на развитие возможных соматических осложнений, включая изменения электролитов, также и дисфункцию сердца, печени,почек и гематологические изменения, и никаких нежелательных осложнений не было выявлено. Внутривенное ведение МВР 75-95 После установления того факта, что внутриоболочечное введение пептида МВР 75-95 приводит к связыванию свободных анти-МВР без изменения уровня связанных антител, было решено определить влияние внутривенного введения того же пептида на титры всвободных и связанных анти-МВР 500 мг МВР 7595 растворяли в 100 см 3 физиологического раствора и вводили внутривенно спустя 30 мин больному 8 М 41 при постоянном контроле анти-МВР вкаждые 30 мин в течение первых двух часов, 18 часов спустя и 10, 16 и 30 дней спустя. Кровь отбирали перед инъекцией, а также через 16 и 30 дней и анализировали на содержание электролитов, креатинина, сердечных и печеночных ферментов и гематологические показатели. В спинномозговой жидкости определяли количество клеток, общий белок, глюкозу, содержаниеи альбумина. Как показано на фиг. 8, внутривенное введение 500 мг МВР 75-95 не дает никаких изменений в уровнях титров связанных и свободных анти-МВР вна протяжении первых двух часов 30 -ное падение уровня свободных анти-МВР внаблюдалось через 18 часов. Когдаповторно подвергалась анализу через 10, 16 и 30 дней, уровни свободных и связанных анти-МВР опускались ниже исходного с 11 единиц радиоактивности до 4, 2 и 1 радиоактивных единиц соответственно. При повторных наблюдениях у пациентов с внутриоболочечными инъекциями МВР часто наблюдалась устойчивость повышенных уровней связанных антител, тогда как свободные анти-МВР были необнаруживаемыми после внутриоболочечной инъекции МВР 75-95. Это свидетельствует о том, что воспалительный процесс, вызванный аутоантителами к МВР, остается активным во время и после внутриоболочечного введения МВР 75-95. Для подтверждения этого наблюдения МВР 75-95 был введен внутривенно пациенту, который предварительно получил внутриоболочечную инъекцию пептида. После внутривенного введения уровни и свободных, и связанных антител взначительно снижались при наблюдении в течение месяца. Снижение как свободных, так и связанных антителпосле внутривенного введения МВР 75-95 означает,что имеет место снижающая регуляция аутоиммунного воспалительного процесса, ответственного за синтез анти-МВР. МВР эцитоп для анти-МВР при . Для определения локализации МВР эпитопа для анти-МВР присвободные и связанные анти-МВР,очищенные аффинной хроматографией изи ткани мозга больных рассеянным склерозом( 13 4771 1 К. .,, . . 35, 280-283, 1994), подвергали взаимодействию в исследованиях по конкурентному ингибированию с 41 последовательным синтетическим пептидом МВР равной длины (каждый пептид состоит из 10 остатков и перекрывает соседний на 9 остатков), занимающих участок между 61 и 110 остатками МВР человека. Было установлено, что пептид(ы), обеспечивающие максимальное ингибирование, наиболее прочно соединяются с антиген-связывающей областью антитела. Максимальное ингибирование ( 80 ) очищенных свободных и связанных анти-МВР из ткани мозга больного рассеянным склерозом (фиг. 10) обеспечивалось четырьмя декапептидами, обозначенными МВР 84-93, МВР 85-94, МВР 86-95 и МВР 87-96, позволяя предположить, что эпитоп МВР для анти-МВР локализован между 84 и 96 остатками. Минимальный участок общих аминокислотных остатков находится между 87 и 93 остатком. Связанные антитела имеют более ограниченную направленность, чем свободные антитела. Роль антител к анти-МВР в патогенезе демиелинизации при рассеянном склерозе еще не установлена и может единственно быть определена модулированием анти-МВРи последовательным наблюдением за клиническими и патологическими проявлениями. Например, во время острых стадий , когда отношение свободных и связанных антител выше 1, пептид, который известен как связывающий свободные антиМВР, может быть введен внутриоболочечно для того, чтобы связать свободно циркулирующие антитела и скорригировать клинические симптомы острого рецидива еженедельное введение может быть необходимо до наступления ремиссии. Для больных с хронически прогрессирующим заболеванием внутривенное введение пептида, так же, как и внутриоболочечное ведение, может быть необходимо для регулирования механизмов воспаления, которые вызваны анти-МВР. Различные модификации предпочтительных вариантов осуществления изобретения могут быть выполнены без ограничений объема изобретения, который охватывается приведенными ниже пунктами формулы. Национальный центр интеллектуальной собственности. 220072, г. Минск, проспект Ф. Скорины, 66. 17
МПК / Метки
МПК: C08K 7/08, A61K 38/10, A61K 38/08, C07K 14/435, A61P 25/28, C07K 7/06, A61K 38/17
Метки: антител, склероза, нейтрализовать, миелиновому, человека, белку, модулировать, способ, основному, лечения, образование, фармацевтическая, композиция, пептид, или, рассеянного, способный
Код ссылки
<a href="https://by.patents.su/17-4771-peptid-sposobnyjj-nejjtralizovat-ili-modulirovat-obrazovanie-antitel-k-mielinovomu-osnovnomu-belku-farmacevticheskaya-kompoziciya-i-sposob-lecheniya-rasseyannogo-skleroza-u-chelove.html" rel="bookmark" title="База патентов Беларуси">Пептид, способный нейтрализовать или модулировать образование антител к миелиновому основному белку, фармацевтическая композиция и способ лечения рассеянного склероза у человека</a>
Предыдущий патент: Способ получения волокнистой пульпы поли-пара-фенилентерефталамида и поливинилпирролидона и поли-пара-фенилентерефталамидная пульпа, полученная указанным способом
Следующий патент: Держатель компакт-диска (варианты)
Случайный патент: Диспергатор