Фармацевтическая композиция для перорального применения производного N-пиперидин-3-пиразолкарбоксамида, его солей и их сольватов
Номер патента: 7200
Опубликовано: 30.09.2005
Авторы: АБРАМОВИЧИ, Бернар, ГРОМЕНИЛ, Жан-Клод, КОНДАМИН, Кристиан
Текст
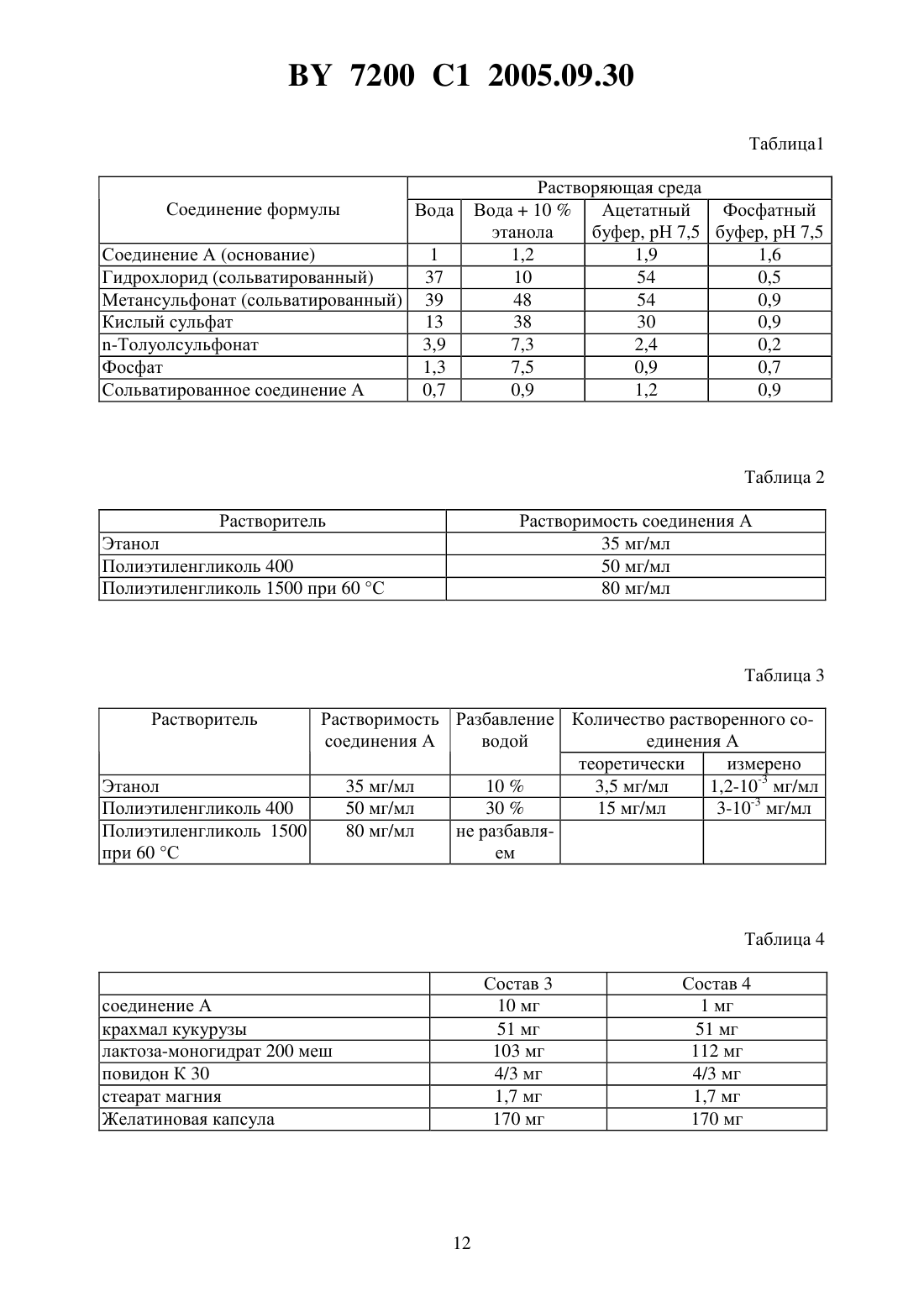
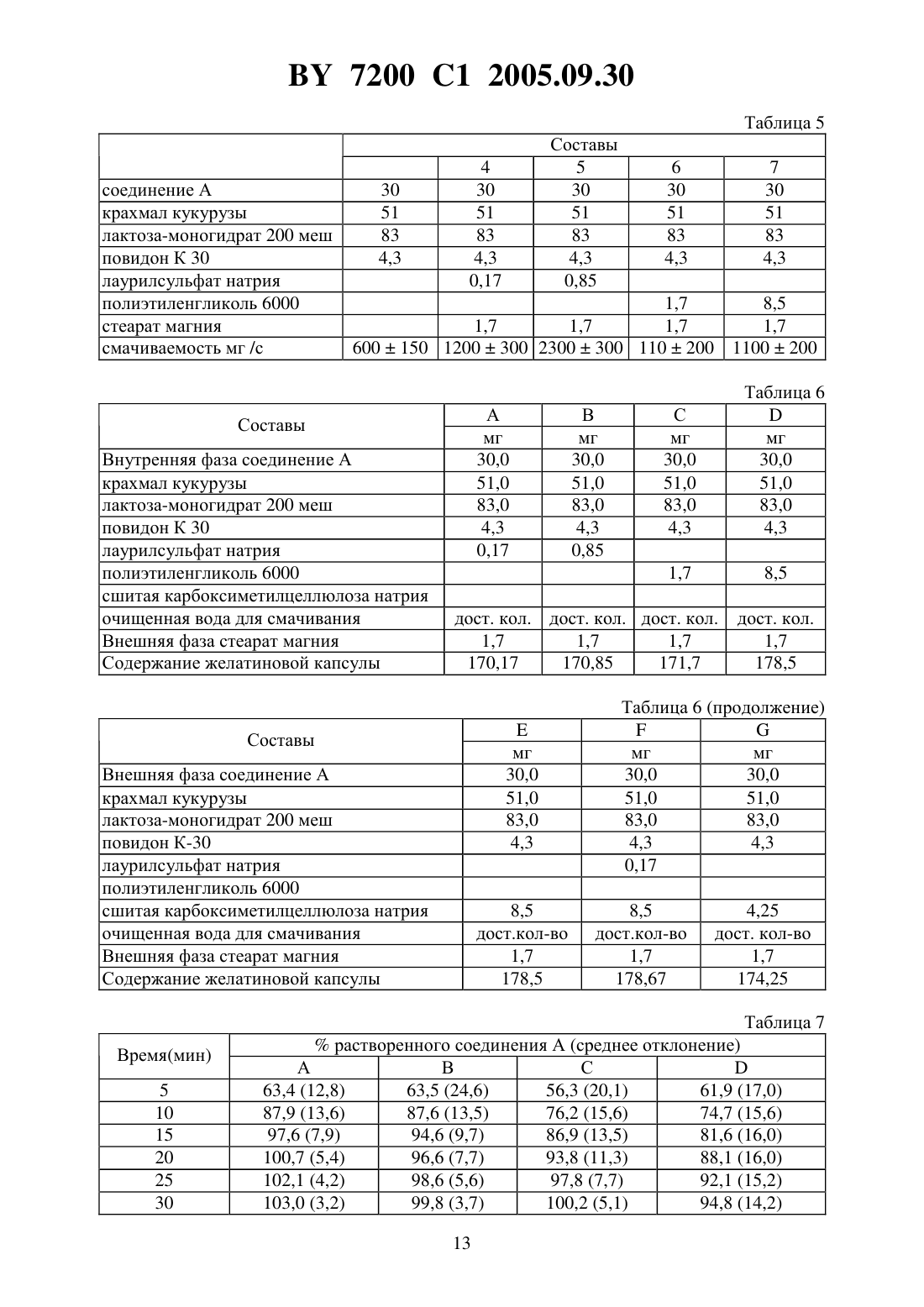
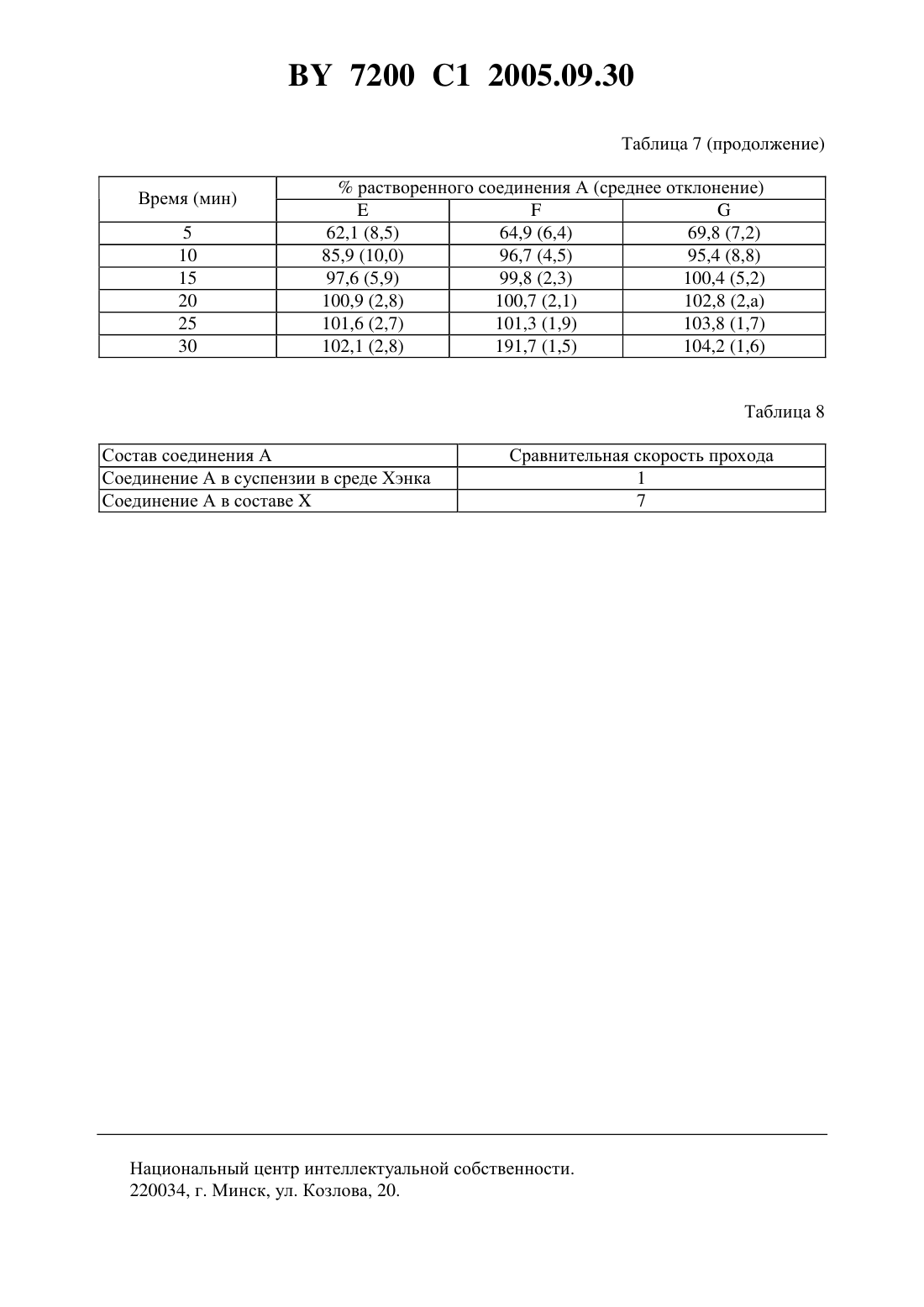
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ ПРОИЗВОДНОГО -ПИПЕРИДИН-3 ПИРАЗОЛКАРБОКСАМИДА, ЕГО СОЛЕЙ И ИХ СОЛЬВАТОВ(57) 1. Фармацевтическая композиция для перорального применения, содержащая в качестве активного начала -пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилпиразол-3 карбоксамид формулы, его фармацевтически приемлемую соль или сольват в микронизированной форме в количестве 0,5-20,0 мас. , 0,05-0,5 мас.С 8-С 12-алкилсульфата натрия, 2,5-10,0 мас.агента дезагрегации и фармацевтические эксципиенты, полученная методом влажного гранулирования. 2. Фармацевтическая композиция по п. 1, отличающаяся тем, что содержит 0,520,0 мас.-пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилпиразол-3-карбоксамида в микронизированной форме, 0,05-0,5 мас.лаурилсульфата натрия и 2,5-10,0 мас.сшитой -карбоксиметилцеллюлозы. 3. Фармацевтическая композиция по п. 1, отличающаяся тем, что содержит 0,520,0 мас.-пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилпиразол-3-карбоксамида в микронизированной форме, 0,1 мас.лаурилсульфата натрия, 5,0 мас.сшитой 7200 1 2005.09.30 карбоксиметилцеллюлозы, 1,0-10,0 мас.связующего, 0,2-5,0 мас.смазочного агента и разбавитель в количестве до 100 . 4. Фармацевтическая композиция по любому из пп. 1-3, отличающаяся тем, что получена методом влажного гранулирования, при котором С 8-С 12-алкилсульфат натрия добавляют к очищенной воде. 5. Фармацевтическая композиция по любому из пп. 1-4, отличающаяся тем, что выполнена в виде желатиновых капсул, таблеток, пакетиков или порошков. 6. Фармацевтическая композиция по п. 1, отличающаяся тем, что выполнена в виде желатиновой капсулы и имеет следующий состав, мас.внутренняя фаза-пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4 метилпиразол-3-карбоксамид в микронизированной форме 0,59 крахмал кукурузный 30,0 лактоза-моногидрат 200 меш 60,78 повидон К-30 2,53 сшитая -карбоксиметилцеллюлоза 5,0 лаурилсульфат натрия 0,1 внешняя фаза стеарат магния 1,0. 7. Фармацевтическая композиция по п. 1, отличающаяся тем, что выполнена в виде желатиновой капсулы и имеет следующий состав, мас.внутренняя фаза-пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-45,88 метилпиразол-3-карбоксамид в микронизированной форме крахмал кукурузный 30,0 лактоза-моногидрат 200 меш 55,49 повидон К-30 2,53 сшитая -карбоксиметилцеллюлоза 5,0 лаурилсульфат натрия 0,1 внешняя фаза стеарат магния 1,0. 8. Фармацевтическая композиция по п. 1, отличающаяся тем, что выполнена в виде желатиновой капсулы и имеет следующий состав, мас.внутренняя фаза-пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-417,64 метилпиразол-3-карбоксамид в микронизированной форме крахмал кукурузный 30,0 лактоза-моногидрат 200 меш 43,73 повидон К-30 2,53 сшитая -карбоксиметилцеллюлоза 5,0 лаурилсульфат натрия 0,1 внешняя фаза стеарат магния 1,0. 9. Способ получения фармацевтической композиции по любому из пп. 1-5, заключающийся в том, что а) при комнатной температуре смешивают активное начало, агент дезагрегации и С 8 С 12-алкилсульфат натрия с разбавителем, связующим и, при необходимости, с красителем б) смесь смачивают очищенной водой в) полученную влажную массу высушивают и сортируют по размеру зерен. 10. Способ получения фармацевтической композиции по любому из пп. 1-5, заключающийся в том, что 2 7200 1 2005.09.30 а) при комнатной температуре смешивают активное начало и агент дезагрегации с разбавителем, связующим и, при необходимости, с красителем б) смесь смачивают очищенной водой с добавлением С 8-С 12-алкилсульфата натрия в) полученную влажную массу высушивают и сортируют по размеру зерен г) к полученным высушенным и отсортированным по размеру зернам добавляют смазывающее вещество и, при необходимости, антиадгезивный агент, вещество, способствующее растеканию, краситель и/или вкусовое вещество. Настоящее изобретение относится к фармацевтической композиции для перорального применения амида -пиперидин-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилпиразол-3 карбоновой кислоты формулы, ее фармацевтически приемлемых солей и их сольватов, называемых далее соединениями формулы . Соединения формулыи способ их получения описаны в европейской патентной заявке 656 354. Амид -пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилпиразол-3-карбоновой кислоты, известный также под кодовым названием 141716 и в последующем описании называемый соединением А, является особенно предпочтительным для фармацевтических композиций настоящего изобретения. О фармакологических свойствах соединений формулы , которые являются избирательными антагонистами рецепторов центральных каннабиноидов , сообщалось, в частности, в публикации - ..,, 1994, 240-244. Для введения таких соединений оральным путем необходимо, чтобы они обладали хорошей всасываемостью, что предполагает одновременно хорошую растворимость в водной среде и высокую способность проходить через кишечную мембрану ( . и,,., 1989, 2. - Р. 113-130). Для оценки эпителиальной проницаемости соединений используют клеточную линию Сасо-2, которая обладает особенностью дифференцироватьсяс образованием эпителиального монослоя (, 1991/8(4), 105-330). На этой модели проницаемость соединения А, растворенного в диметилсульфоксиде (ДМСО), является высокой, что показывает его хорошую способность всасываться в кишечнике из раствора. С другой стороны, гидрофобный характер соединений формулыявляется четко выраженным. Так, констатируется, что соединение А не смачивается водой, кроме того, это соединение и его соли практически не растворимы в воде ни при каких значениях рН. Эти соединения растворимы в спиртах и гликолях и, более конкретно, в полиэтиленгликолях (ПЭГ). Однако, когда растворы, приготовленные с использованием спирта или гликоля, разбавляют в водной среде, соединение формулыпо причине своего гидрофобного характера выпадает в осадок. 7200 1 2005.09.30 Соединения формулыи в частности соединение А являются слабыми электростатиками. Они поддаются микронному распылению с высоким выходом (около 85 ), которое позволяет получать частицы размером приблизительно 1 мкм. Аналитический контроль, произведенный после этой микронизации, показывает отсутствие изменений в кристаллической форме. При изучении смачиваемости отмечали, что скорость проникновения воды в слой порошка, приготовленного путем влажного гранулирования, гораздо выше скорости проникновения воды, измеряемой на слое порошка, полученного путем сухого смешения. Изучение эффекта введения смачивающих агентов показало, что алкилсульфаты натрия при низкой концентрации существенно повышают смачиваемость. Далее было обнаружено, что присутствие в композиции агента дезагрегации, такого,как сшитая карбоксиметилцеллюлоза натрия, позволяет улучшить кинетику растворения. Было неожиданным образом обнаружено, что при совместном присутствии в одном и том же составе алкилсульфата натрия и агента дезагрегации быстро достигается полное растворение этого состава с хорошей воспроизводимостью получаемых результатов. Под влажным гранулированием предполагается фармацевтическая операция, которая позволяет с помощью грануляционной жидкости уплотнить смесь порошков, содержащих активное начало, причем эта смесь является внутренней фазой композиции, после чего полученную влажную массу сушат и сортируют по размеру и затем к ней добавляют ингредиенты, образующие внешнюю фазу композиции. Согласно настоящему изобретению, под алкилсульфатом натрия понимают 8-С 12 алкилсульфат натрия, например октилсульфат натрия или, предпочтительно, лаурилсульфат натрия. Согласно настоящему изобретению, под агентом дезагрегации понимают целлюлозу или ее производные, такие как карбоксиметилцеллюлоза натрия, сшитая карбоксиметилцеллюлоза натрия, поливинилпирролидон, предварительно желатинированный крахмал и карбоксиметилкрахмал натрия, из которых предпочтительным агентом дезагрегации является сшитая карбоксиметилцеллюлоза натрия. Фармацевтические эксципиенты, пригодные для фармацевтической композиции настоящего изобретения, включают, в частности, разбавитель, связующее и смазочный агент. Могут быть также добавлены агент растекания, антиадгезивный агент и, возможно,краситель и/или отдушка. Применяемый в композиции настоящего изобретения разбавитель может представлять собой одно или несколько соединений, способных загущать активное начало до получения желаемой массы. Предпочтительными разбавителями являются неорганические фосфаты, такие как фосфаты кальция сахара, такие как водная или обезвоженная лактоза и маннит а также целлюлоза или ее производные, такие, например, как микрокристаллическая целлюлоза, крахмал, крахмал кукурузы или предварительно желатинизированный крахмал. Особое предпочтение отдается лактозе-моногидрату, манниту, микрокристаллической целлюлозе и крахмалу кукурузы, используемым индивидуально или в смеси, например, смесь лактозы-моногидрата и крахмала кукурузы. Применяемое в композиции настоящего изобретения связующее может представлять собой одно или несколько соединений, способных загущать соединение формулы , переводя его в более крупные и более плотные частицы, обладающие лучшей растекаемостью. Предпочтительными связующими являются альгиновая кислота и альгинат натрия целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза,гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза или метилцеллюлоза желатина полимеры акриловой кислоты поливинилпирролидон, например, повидон -30 особенно предпочтителен повидон К-30. Содержание связующего в фармацевтической композиции изобретения составляет от 1 до 10 мас. Применяемый в композиции настоящего изобретения смазочный агент может представлять собой одно или несколько соединений, способных избежать проблем, связанных 4 7200 1 2005.09.30 с приготовлением сухих форм, таких, например, как проблемы липкости и/или слипания,возникающие в машинах в процессе компримирования или заполнения. Предпочтительными смазочными агентами являются жирные кислоты или производные жирных кислот,такие как стеарат кальция, глицерилмоностеарат, глицерилпальмитостеарат, стеарат магния, лаурилсульфат натрия, стеарилфумарат натрия, стеарат цинка или стеариновая кислота гидрированные растительные масла, например гидрированное касторовое масло полиалкиленгликоли, в частности полиэтиленгликоль бензоат натрия или тальк. Согласно настоящему изобретению, предпочтение отдается стеарату магния. Антиадгезивный агент, который может присутствовать в композиции, согласно изобретению, представляет собой одно или несколько соединений, способных уменьшить липкость состава, например, понизить адгезию к металлическим поверхностям. Предпочтительными антиадгезивными агентами являются соединения, содержащие кремний, например,диоксид кремния или тальк. Антиадгезивный агент может присутствовать в фармацевтической композиции изобретения в количествах от 0 до 5 мас. . Агент растекания, который может присутствовать в композиции настоящего изобретения, представляет собой одно или несколько соединений, способных облегчить растекание приготовленного состава. Предпочтительными агентами растекания являются соединения, содержащие кремний, например, безводный коллоидный диоксид кремния или осажденный диоксид кремния. Агент растекания может присутствовать в фармацевтической композиции изобретения в количествах от 0 до 15 мас. . Согласно настоящему изобретению предлагается фармацевтическая композиция для перорального применения, содержащая в качестве активного начала -пиперидино-5-(4 хлорфенил)-1-(2,4-дихлорфенил)-4-метилпиразол-3-карбоксамид формулы, его фармацевтически приемлемую соль или сольват в микронизированной форме в количестве 0,5-20,0 мас , 0,05-0,5 масС 8-С 12-алкилсульфата натрия, 2,5-10,0 масагента дезагрегации и фармацевтические эксципиенты, полученная методом влажного гранулирования. В предпочтительном варианте фармацевтическая композиция содержит 0,5-20,0 мас.пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилпиразол-3-карбоксамида в микронизированной форме, 0,05-0,5 мас.лаурилсульфата натрия и 2,5-10,0 мас.сшитой карбоксиметилцеллюлозы. Более предпочтительно фармацевтическая композиция содержит 0,5-20,0 мас.мас. 7200 1 2005.09.30 В предпочтительном варианте фармацевтическую композицию получают методом влажного гранулирования, при котором С 8-С 12-алкилсульфат натрия добавляют к очищенной воде. Фармацевтическая композиция может быть выполнена в виде желатиновых капсул,таблеток, пакетиков или порошков. В одном из вариантов фармацевтическая композиция выполнена в виде желатиновой капсулы и имеет следующий состав, мас.Внутренняя фаза-пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4 метилпиразол-3-карбоксамид в микронизированной форме 0,59 крахмал кукурузный 30,0 лактоза-моногидрат 200 меш 60,78 повидон К-30 2,53 сшитая -карбоксиметилцеллюлоза 5,0 лаурилсульфат натрия 0,1. Внешняя фаза стеарат магния 1,0. В другом варианте фармацевтическая композиция выполнена в виде желатиновой капсулы и имеет следующий состав, мас.Внутренняя фаза-пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4 метилпиразол-3-карбоксамид в микронизированной форме 5,88 крахмал кукурузный 30,0 лактоза-моногидрат 200 меш 55,49 повидон К-30 2,53 сшитая -карбоксиметилцеллюлоза 5,0 лаурилсульфат натрия 0,1. Внешняя фаза стеарат магния 1,0. В третьем варианте фармацевтическая композиция выполнена в виде желатиновой капсулы и имеет следующий состав, масВнутренняя фаза-пиперидино-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4 метилпиразол-3-карбоксамид в микронизированной форме 17,64 крахмал кукурузный 30,0 лактоза-моногидрат 200 меш 43,73 повидон К-30 2,53 сшитая -карбоксиметилцеллюлоза 5,0 лаурилсульфат натрия 0,1. Внешняя фаза стеарат магния 1,0. Предметом изобретения является также способ получения фармацевтической композиции по изобретению, заключающийся в том, что а) при комнатной температуре смешивают активное начало, агент дезагрегации и С 8 С 12-алкилсульфат натрия с разбавителем, связующим и, при необходимости, с красителем б) смесь смачивают очищенной водой в) полученную влажную массу высушивают и сортируют по размеру зерен. В предпочтительном варианте способ получения фармацевтической композиции по изобретению заключается в том, что 6 7200 1 2005.09.30 а) при комнатной температуре смешивают активное начало и агент дезагрегации с разбавителем, связующим и, при необходимости, с красителем б) смесь смачивают очищенной водой с добавлением 8-12-алкилсульфата натрия в) полученную влажную массу высушивают и сортируют по размеру зерен г) к полученным высушенным и отсортированным по размеру зернам добавляют смазывающее вещество и, при необходимости, антиадгезивный агент, вещество, способствующее растеканию, краситель и/или вкусовое вещество. Характеристики и преимущества композиций изобретения будут выявлены в приведенном ниже описании на данных в качестве примеров композициях. ИСПЫТАНИЯ. 1. Изучение растворимости соединений формулы . Растворимости соединений формулыизмерены в различных водных средах. Количественно измеряется мгновенная растворимость при комнатной температуре. Результаты, выраженные в г/мл, сведены в табл. 1. Измерена также растворимость соединения А в различных растворителях (табл. 2) и после разбавления водой полученных растворов (табл. 3). 2. Изучение смачиваемости. Смачиваемость соединения А была изучена в различных составах с использованием методики ..,., 1984,32(346), 284-289. 2.1. Влияние метода гранулирования. Сравнивали состав (состав 1), полученный простым смешиванием, с составом (составом 2), полученным методом влажного гранулирования. Состав 1 соединение А модифицированный крахмал кукурузы экстратонкие кристаллы лактозы-моногидрата безводный коллоидный диоксид кремния стеарат магния желатиновая капсула Состав 2 соединение А 30 мг модифицированный крахмал кукурузы 51 мг лактоза-моногидрат 200 меш 83 мг повидон К-30 4,3 мг стеарат магния 1,7 мг желатиновая капсула 170 мг. Смачиваемость, измеренная по методике -, составляет 22 мг 2/с для состава 1 и 110 мг 2/с для состава 2. Таким образом, метод влажного гранулирования увеличивает смачиваемость в 5 раз. 7200 1 2005.09.30 2.2. Влияние содержания активного начала. В качестве сравнения готовят методом влажного гранулирования составы, в которых содержание активного начала составляет, соответственно, 10 мг (состав 3) и 1 мг (состав 4) (табл. 4). Для состава 3 смачиваемость составляет 500 мг 2/с. Для состава 4 смачиваемость составляет 1000 мг 2/с. Таким образом, смачиваемость обратно пропорциональна количеству активного начала, содержащегося в составе. Это подтверждает гидрофобный характер соединения А. 2.3. Влияние эксципиентов. Методом влажного гранулирования было приготовлено несколько составов и сравнивались с контрольным составом, также приготовленным методом влажного гранулирования (табл. 5). Только лаурилсульфат натрия в концентрации 0,5 увеличивает смачиваемость существенным образом. Измерения смачиваемости не пригодны для изучения влияния такого дезинтегрирующего агента, как сшитая карбоксиметилцеллюлоза натрия. 3. Изучение растворимости в желудочной среде. Изучена кинетика растворения различных составов в желудочной среде при 37 С в течение 30 мин с использованием фосфат-цитратного буфера, рН 3. Когда 40 мг соединения А без добавок помещают в 1 л растворяющей среды, не наблюдается никакого растворения. Для обеспечения растворения испытуемых составов к среде добавляли в качестве поверхностно-активного агента 0,2 лаурилсульфата натрия. Для каждого состава производилось по 6 опытов, в процессе которых каждые 5 мин измеряли количество соединения А, растворенного в среде. Табл. 7 дает средние значения процента растворения соединения А и относительные средние отклонения этих значений для разных составов, приведенных в табл. 6 Для составови , которые, соответственно, содержат 1 и 5 полиэтиленгликоля 6000, делается вывод, что максимальное растворение достигается только через 30 мин. Для составов А и В, которые, соответственно, содержат 0,1 и 0,5 лаурилсульфата натрия, делается вывод, что максимальное значение достигается, соответственно, через 20 и 30 мин. Кроме того, результаты, полученные для каждого из составов А, В, С или , характеризуются разбросом. Результаты, полученные с составами ,и , показывают преимущество присутствия сшитой карбоксиметилцеллюлозы натрия, которая благоприятствует растворению. С составамии , содержащими, соответственно, 5 и 2,5 сшитой карбоксиметилцеллюлозы натрия, наблюдается 100 -ное растворение соединения А, соответственно,через 20 и 15 мин, причем относительный разброс результатов наблюдается в течение первых 15 мин. Состав , содержащий одновременно 0,1 лаурилсульфата натрия и 5 сшитой карбоксиметилцеллюлозы натрия, дает лучшие результаты. Так, уже через 15 мин растворяется все количество соединения А, причем расхождения между результатами в разных опытах очень малы (между 15 и 30-й мин расхождения составляют от 2,3 до 1,5). 7200 1 2005.09.30 5. Оценка трансэпителиальной проницаемости соединения А в кишечнике. На микропористых фильтрах из поликарбоната с коллагеновым покрытием высеивают клетки Сасо-2. Образующийся при этом на фильтре клеточный монослой позволяет отделить верхнюю часть (имитирующую кишечный проход) от базальной части (имитирующей кровоток). С верхней стороны помещают композицию, содержащую изучаемое соединение, и оценивают прохождение этого соединения, диспергированного или солюбилизированного в среде Хэнка, через клеточный барьер, измеряя кинетику появления этого соединения на базальной стороне. Эта водная среда, имеющая рН 6,5, содержит в г/л 8,00,4 2 0,19 2 0,1 4 0,1 24 0,09 24 0,06 3 0,35 глюкоза 1 и феноловый красный 0,01. После этого определяют коэффициент проницаемостив см/с, который характеризует скорость прохождения молекулы через мембрану, а именно(/)(1/),где / обозначает зависимость количества испытуемого соединения, прошедшего через клеточный монослой, от времени(моль/с) А обозначает поверхность монослоя в см 2 и Со - начальная концентрация испытуемого соединения в моль/л. 3.1. Коэффициент проницаемости соединения А, введенного в среду Хэнка в растворе ДМСО 9610-7 см/с Проницаемость соединения А, измеренного таким образом в растворе (в ДМСО), указывает на характеристику, присущую этому соединению. Полученный результат указывает на очень высокую способность растворенного соединения А осуществлять трансэпителиальный проход. 3.2. Сравнительная скорость трансэпителиального прохода соединения А в кишечнике. Измеряют скорость прохода соединения А в составеи сравнивают со скоростью прохода соединения А в суспензии (табл. 8). Составсоединение А модифицированный крахмал кукурузы лактоза-моногидрат 200 меш повидон К 30 лаурилсульфат натрия сшитая карбоксиметилцеллюлоза натрия стеарат магния желатиновая капсула Пример 1. Желатиновая капсула 1 мг. Желатиновая капсула, приготовленная методом влажного гранулирования, имеет следующий состав Внутренняя фаза соединение А микронного размера крахмал кукурузы лактоза-моногидрат 200 меш повидон К-30 7200 1 2005.09.30 сшитая карбоксиметилцеллюлоза натрия 8,5 мг Гранулирование лаурилсульфат натрия 0,17 мг очищенная вода достаточное количество. Внешняя фаза стеарат магния 1,7 мг На одну белую непрозрачную желатиновую капсулу размера 3 всего 170 мг. Пример 2. Желатиновая капсула 10 мг. Желатиновая капсула, приготовленная методом влажного гранулирования, имеет следующий состав Внутренняя фаза соединение А микронного размера крахмал кукурузы лактоза-моногидрат 200 меш повидон К-30 сшитая карбоксиметилцеллюлоза натрия Гранулирование лаурилсульфат натрия очищенная вода Внешняя фаза стеарат магния на одну белую непрозрачную желатиновую капсулу размера 3 всего Пример 3. Желатиновая капсула 30 мг. Желатиновая капсула, приготовленная методом влажного гранулирования, имеет следующий состав Внутренняя фаза соединение А микронного размера 30 мг крахмал кукурузы 51 мг лактоза-моногидрат 200 меш 74,33 мг повидон К-30 4,3 мг сшитая карбоксиметилцеллюлоза натрия 8,5 мг. Гранулирование лаурилсульфат натрия 0,17 мг очищенная вода достаточное количество. Внешняя фаза стеарат магния 1,7 мг. На одну белую непрозрачную желатиновую капсулу размера 3 всего 170 мг. Пример 4. Желатиновая капсула 30 мг. Желатиновая капсула, приготовленная методом влажного гранулирования, имеет следующий состав Внутренняя фаза соединение А микронного размера крахмал кукурузы лактоза-моногидрат 200 меш 7200 1 2005.09.30 повидон К-30 4,3 мг сшитая карбоксиметилцеллюлоза натрия 8,5 мг. Гранулирование лаурилсульфат натрия 0,85 мг очищенная вода достаточное количество. Внешняя фаза стеарат магния 1,7 мг. На одну белую непрозрачную желатиновую капсулу размера 3, всего 170 мг. Пример 5. Таблетка 1 мг. Внутренняя фаза соединение А микронного размера крахмал кукурузы лактоза-моногидрат 200 меш гидроксипропилметилцеллюлоза 6 сР натриевая сшитая карбоксиметилцеллюлоза Гранулирование лаурилсульфат натрия очищенная вода Внешняя фаза стеарат магния на одну таблетку всего Пример 6. Таблетка 10 мг. Внутренняя фаза соединение А микронного размера крахмал кукурузы лактоза-моногидрат 200 меш гидроксипропилметилцеллюлоза 6 сР карбоксиметилкрахмал натрия лаурилсульфат натрия Гранулирование очищенная вода Внешняя фаза стеарат магния На одну таблетку всего Пример 7. Таблетка 30 мг. Внутренняя фаза соединение А микронного размера крахмал кукурузы лактоза-моногидрат 200 меш повидон К-30 сшитая карбоксиметилцеллюлоза натрия лаурилсульфат натрия Гранулирование очищенная вода Внешняя фаза стеарат магния На одну таблетку всего-Толуолсульфонат Фосфат Сольватированное соединение А Растворяющая среда Вода 10 Ацетатный Фосфатный этанола буфер, рН 7,5 буфер, рН 7,5 1,2 1,9 1,6 10 54 0,5 48 54 0,9 38 30 0,9 7,3 2,4 0,2 7,5 0,9 0,7 0,9 1,2 0,9 Растворимость Разбавление Количество растворенного сосоединения А водой единения А теоретически измерено Этанол 35 мг/мл 103,5 мг/мл 1,2-10-3 мг/мл Полиэтиленгликоль 400 50 мг/мл 3015 мг/мл 3-10-3 мг/мл Полиэтиленгликоль 1500 80 мг/мл не разбавляпри 60 С ем соединение А крахмал кукурузы лактоза-моногидрат 200 меш повидон К 30 стеарат магния Желатиновая капсула соединение А крахмал кукурузы лактоза-моногидрат 200 меш повидон К 30 лаурилсульфат натрия полиэтиленгликоль 6000 стеарат магния смачиваемость мг /с Составы Внутренняя фаза соединение А крахмал кукурузы лактоза-моногидрат 200 меш повидон К 30 лаурилсульфат натрия полиэтиленгликоль 6000 сшитая карбоксиметилцеллюлоза натрия очищенная вода для смачивания Внешняя фаза стеарат магния Содержание желатиновой капсулы Составы Внешняя фаза соединение А крахмал кукурузы лактоза-моногидрат 200 меш повидон К-30 лаурилсульфат натрия полиэтиленгликоль 6000 сшитая карбоксиметилцеллюлоза натрия очищенная вода для смачивания Внешняя фаза стеарат магния Содержание желатиновой капсулы Состав соединения А Соединение А в суспензии в среде Хэнка Соединение А в составе Сравнительная скорость прохода 1 7 Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 14
МПК / Метки
МПК: A61K 31/4155, A61K 31/4453, A61K 9/14, A61P 43/00, A61K 9/20, A61K 31/454, A61K 9/48
Метки: применения, солей, композиция, сольватов, перорального, производного, n-пиперидин-3-пиразолкарбоксамида, фармацевтическая
Код ссылки
<a href="https://by.patents.su/14-7200-farmacevticheskaya-kompoziciya-dlya-peroralnogo-primeneniya-proizvodnogo-n-piperidin-3-pirazolkarboksamida-ego-solejj-i-ih-solvatov.html" rel="bookmark" title="База патентов Беларуси">Фармацевтическая композиция для перорального применения производного N-пиперидин-3-пиразолкарбоксамида, его солей и их сольватов</a>
Предыдущий патент: Способ интегрирования генов в определенные участки генома клеток млекопитающих посредством гомологичной рекомбинации и векторы для его выполнения
Следующий патент: Устройство для перемешивания и растворения твердых гранул в жидкости, в особенности для производства фосфорно-азотных удобрений
Случайный патент: Упрочняющее покрытие