Способ получения производных таксана
Текст
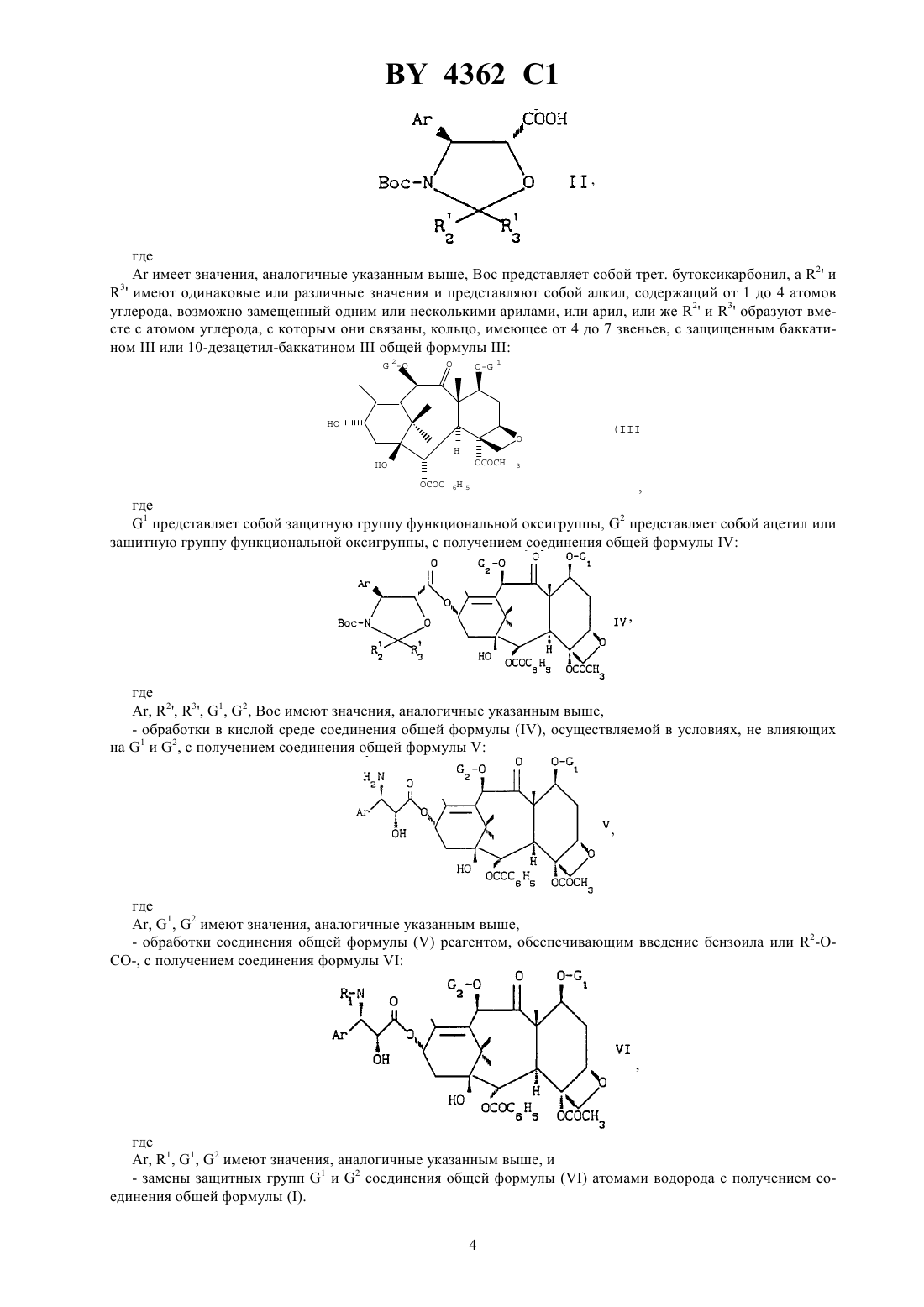
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТАКСАНА(57) 1. Способ получения производных таксана общей формулы,где -атом водорода или ацетил, 1-бензоил или трет-бутоксикарбонил, -фенил, путем этерификации производного защищенного баккатинаили 10-дезацетилбаккатинаобщей формулы 6 5,где 1- защитная группа функциональной гидроксигруппы, 2-ацетил или защитная группа функциональной гидроксигруппы, производным оксазолидина, отличающийся тем, что в качестве производного оксазолидина используют кислоту общей формулы,гдеиимеют указанные значения, 3 - атом водорода, 1-4-алкоксигруппа, фенил или метоксифенил, или производное этой кислоты с получением соединения общей формулы 1,4362 1 где , 1, 3, 1 и 2 имеют указанные значения, затем снимают защиту боковой цепи и, при необходимости, функциональных гидроксигрупп, защищенных группами 1 и 2, получая соединение общей формулы,гдеи 1 имеют указанные значения, 1-атом водорода или защитная группа функциональной гидроксигруппы, 2 атом водорода, ацетил или защитная группа функциональной гидроксигруппы, с последующей, при необходимости,заменой защитных групп 1 и 2 на атомы водорода. 2. Способ по п. 1, отличающийся тем, что защитные группы 1 и 2 представляют собой 2,2,2 трихлорэтоксикарбонил или 1 - триэтилсилил, если 2 - ацетил. 3. Способ по любому из пп. 1-2, отличающийся тем, что этерификацию осуществляют в присутствии агента конденсации и агента активации в органическом растворителе при температуре от -10 до 90 о. 4. Способ по п. 3, отличающийся тем, что в качестве агента конденсации используют карбодиимиды или реакционноспособные карбонаты, а в качестве агента активации-аминопиридины. 5. Способ по п. 4, отличающийся тем, что в качестве агента конденсации используют дициклогексилкарбодиимид или 2-дипиридилкарбонат, а в качестве агента активации-4-диметиламинопиридин или 4 пирролидинопиридин. 6. Способ по п. 3, отличающийся тем, что в качестве растворителя используют простые эфиры, кетоны,сложные эфиры, нитрилы, алифатические углеводороды, галогенсодержащие алифатические углеводороды или ароматические углеводороды. 7. Способ по п. 6, отличающийся тем, что в качестве растворителя используют ароматические углеводороды. 8. Способ по любому из пп. 1-2, отличающийся тем, что в качестве производного кислоты используют ангидрид общей формулы,где ,иимеют значения, указанные в п. 1, при этом этерификацию осуществляют в присутствии агента активации в органическом растворителе при температуре 0-90 о. 9. Способ по п. 8, отличающийся тем, что в качестве агента активации используют аминопиридины. 10. Способ по п. 9, отличающийся тем, что в качестве агента активации используют 4 диметиламинопиридин или 4-пирролидинопиридин. 11. Способ по п. 8, отличающийся тем, что в качестве растворителя используют простые эфиры, кетоны,сложные эфиры, нитрилы, алифатические углеводороды, галогенсодержащие алифатические углеводороды или ароматические углеводороды. 12. Способ по любому из пп. 1-2, отличающийся тем, что в качестве производного кислоты используют активированную кислоту общей формулы 3,где ,иимеют значения, указанные в п. 1, -атом галогена или радикал ацилокси или арилокси, возможно приготовленную, при этом этерификацию осуществляют в присутствии основания в органическом растворителе при температуре 10-80 С. 13. Способ по п. 12, отличающийся тем, что в качестве основания используют азотсодержащее органическое основание. 14. Способ по п. 13, отличающийся тем, что в качестве азотсодержащего органического основания используют третичные алифатические амины, пиридин или аминопиридин. 1 4362 1 15. Способ по п. 12, отличающийся тем, что в качестве растворителя используют простые эфиры, кетоны, сложные эфиры, нитрилы, алифатические углеводороды, галогенсодержащие алифатические углеводороды или ароматические углеводороды. 16. Способ по п. 15, отличающийся тем, что в качестве растворителя используют ароматические углеводороды. 17. Способ по любому из пп. 1-2, отличающийся тем, что снимают защиту боковой цепи и функциональных гидроксигрупп, защищенных группами 1-триэтилсилил и 2-ацетил, в присутствии минеральной или органической кислоты или их смесей в среде органического растворителя при температуре от -10 до 60 С. 18. Способ по п. 17, отличающийся тем, что в качестве минеральной кислоты используют соляную или серную кислоту, а в качестве органической кислоты используют уксусную кислоту, метансульфокислоту,трифторметансульфокислоту или п-толуолсульфокислоту. 19. Способ по п. 17, отличающийся тем, что в качестве растворителя используют спирты, простые эфиры, сложные эфиры, нитрилы, алифатические углеводороды, галогенсодержащие алифатические углеводороды или ароматические углеводороды. 20. Кислота общей формулы,где ,иимеют значения, указанные в п. 1, или ее соли, сложные эфиры, ангидрид или галогенид. 21. Соединение общей формулы 1(56)92/09589 1.0253738 1, 1988. Настоящее изобретение касается нового способа получения производных таксана общей формулы,гдепредставляет собой атом водорода или ацетил, а 1 представляет собой бензоил или остаток 2,где 2 представляет собой линейный или разветвленный алкил, содержащий от 1 до 8 атомов углерода,представляет собой фенил, обладающий противолейкемическими и противоопухолевыми свойствами. Особый интерес представляют соединения общей формулы , в которойпредставляет собой атом водорода или ацетил, 1 представляет собой бензоил или трет.бутоксикарбониламино остаток, апредставляет собой фенил. Соединения общей формулы , где 1 представляет собой бензоил, соответствуют таксолу и 10 дезацетил-таксолу, а соединения общей формулы , где 1 представляет собой трет.бутоксикарбонил, соответствуют соединениям, описанным в европейском патенте 0253738. В соответствии со способом, описанным в международной заявке 92/09589, производные общей формулымогут быть получены путем конденсации производного оксазолидина обшей формулы, гдеимеет значения, аналогичные указанным выше, Вос представляет собой трет. бутоксикарбонил, а 2 и 3 имеют одинаковые или различные значения и представляют собой алкил, содержащий от 1 до 4 атомов углерода, возможно замещенный одним или несколькими арилами, или арил, или же 2 и 3 образуют вместе с атомом углерода, с которым они связаны, кольцо, имеющее от 4 до 7 звеньев, с защищенным баккатиномили 10-дезацетил-баккатиномобщей формулы 2,где 1 представляет собой защитную группу функциональной оксигруппы, 2 представляет собой ацетил или защитную группу функциональной оксигруппы, с получением соединения общей формулы, 2, 3, 1, 2, Вос имеют значения, аналогичные указанным выше,- обработки в кислой среде соединения общей формулы , осуществляемой в условиях, не влияющих на 1 и 2, с получением соединения общей формулы, 1, 2 имеют значения, аналогичные указанным выше,- обработки соединения общей формулыреагентом, обеспечивающим введение бензоила или 2, с получением соединения формулы- замены защитных групп 1 и 2 соединения общей формулыатомами водорода с получением соединения общей формулы . 4 4362 1 Согласно изобретению, способ получения соединений общей формулызаключается в том, что производное защищенного баккатинаили 10-дезацетил-баккатинаобщей формулы 2,где 1 представляет собой защитную группу функциональной оксигруппы, а 2 представляет собой ацетил или защитную группу функциональной оксигруппы, подвергают этерификации действием кислоты общей формулы,где 1 представляет бензоил или остаток 2, где 2 представляет собой линейный или разветвленный алкил, содержащий от 1 до 8 атомов углерода,представляет собой фенил, 3 представляет собой атом водорода, 1-4 алкоксигруппу или фенил, возможно замещенный одним или двумя заместителями, выбранными из 1-6-алкила или 1-6 алкоксигруппы, или производного этой кислоты с получением соединения общей формулы 2, 1, 3, 1 и 2 имеют значения, указанные выше, деблокируют боковое звено и, возможно, функциональные оксигруппы, защищенные заместителями 1 и 2 с получением соединения формулы,гдеи 1 имеют значения, указанные выше, 1 представляет собой атом водорода или защитную группу функциональной оксигруппы, а 2 представляет собой атом водорода или ацетил, или защитную группу функциональной оксигруппы, у которого защитные группы 1 и, возможно, 2 заменены, возможно, на атомы водорода для получения соединения формулы . Согласно настоящему изобретению, этерификацию соединения общей формулыосуществляют с помощью кислоты общей формулы , которая может иметь форму ангидрида, галогенида или смешанного ангидрида. Предпочтительно использовать кислоту общей формулыили ее активированные производные, в формуле которых 3 представляет собой атом водорода или алкоксирадикал, содержащий от 1 до 4 атомов углерода, или фенил, возможно замещенный одним или несколькими электродонорными радикалами, выбранными, в частности, из группы алкоксирадикалов, содержащих от 1 до 4 атомов углерода. Этерификация с помощью кислоты общей формулыможет быть осуществлена в присутствии агента конденсации, например карбодиимида, такого, как дициклогексилкарбодиимид, или реакционноспособного карбоната, каким является 2-дипиридилкарбонат, и агента активации, такого, как аминопиридин, например 4362 1 4-диметиламинопиридин или 4-пирролидинопиридин. Названную этерификацию осуществляют в органическом растворителе, выбранном среди таких простых эфиров, как тетрагидрофуран, диизопропиловый эфир,метил-трет.бутиловый эфир или диоксан, среди таких кетонов, как метилизобутилкетон, таких сложных эфиров, как этилацетат, изопропилацетат или -бутилацетат, таких нитрилов, как ацетонитрил, таких алифатических углеводородов, как пентан, гексан или гептан, таких галогенсодержащих алифатических углеводородов, как дихлорметан или 1,2-дихлорэтан, или таких ароматических углеводородов, как бензол, толуол,ксилолы, этилбензол, изопропилбензол или хлорбензол, при температуре, составляющей от -10 до 90 С. Особо предпочтительно осуществлять этерификацию в ароматическом растворителе при температуре, близкой 20 С. Этерификация может быть также осуществлена при использовании кислоты общей формулыв форме ангидрида формулы, 1 и 3 имеют значения, аналогичные указанным выше, в присутствии агента активации, например аминопиридина, а именно 4-диметиламинопиридина или 4-пирролидинопиридина, в органическом растворителе,выбранном среди таких простых эфиров, как тетрагидрофуран, диизопропиловый эфир, метилтрет.бутиловый эфир или диоксан, таких кетонов, как метил-изобутилкетон, таких сложных эфиров, как этилацетат, изопропилацетат или -бутилацетат, таких нитрилов, как ацетонитрил, таких алифатических углеводородов, как пентан, гексан или гептан, таких галогенсодержащих алифатических углеводородов, как дихлорметан или 1,2-дихлорэтан, или таких ароматических углеводородов, как бензол, толуол, ксилолы,этилбензол, изопропилбензол или хлорбензол, при температуре, составляющей от 0 до 90 С. Этерификация может быть также осуществлена при использовании кислоты общей формулыв форме галогенида или смешанного ангидрида общей формулы, 1 и 3 имеют значения, аналогичные указанным выше, апредставляет собой атом галогена или радикал ацилокси или ароилокси, возможно полученный, в присутствии основания, которым преимущественно является азотсодержащее органическое основание, такое, как трет.алифатический амин, например триэтиламин, пиридин, аминопиридина такого, как 4-диметиламинопиридин или 4-пирролидинопиридин, в инертном органическом растворителе, выбранном среди таких простых эфиров, как тетрагидрофуран, диизопропиловый эфир, метил-трет. бутиловый эфир или диоксан, среди кетонов, среди таких сложных эфиров,как этилацетат, изопропилацетат или -бутилацетат, среди таких нитрилов, как ацетонитрил, таких алифатических углеводородов, как пентан, гексан или гептан, таких галогенсодержащих алифатических углеводородов, как дихлорметан или 1,2-дихлорэтан, и таких ароматических углеводородов, как бензол, толуол, ксилолы, этилбензол, изопропилбензол или хлорбензол, при температуре, составляющей от 10 до 80 С, а предпочтительно 20 С. Предпочтительно использовать активированное производное общей формулы , в которойпредставляет собой атом галогена или радикал ацилокси, содержащий от 1 до 5 атомов углерода, или ароилокси,арильная часть которого представляет собой фенил, возможно замещенный от 1 до 5 атомами или радикалами, имеющими одинаковое или различное значение, выбранными среди атомов галогена (хлор, бром) и радикалов нитро, метил или метокси. Деблокирование боковой цепи может быть осуществлено в присутствии минеральной кислоты (соляной кислоты, серной кислоты) или органической кислоты (уксусной кислоты, метансульфокислоты, трифторметансульфокислоты, пара-толуолсульфокислоты), используемой в единственном числе или в смеси, и проводится в органическом растворителе, выбранном среди спиртов (метанол, этанол, пропанол, изопропанол),6(этилацетат, изопропилацетат, -бутилацетат), алифатических углеводородов (пентан, гексан, гептан), галогенсодержащих алифатических углеводородов (дихлорметан, 1,2-дихлорметан), ароматических углеводородов (бензол, толуол, ксилолы) и нитрилов (ацетонитрил), при температуре, составляющей от -10 до 60 С, а предпочтительно от 15 до 30 С. Минеральная или органическая кислота может быть использована в каталитическом количестве или стехиометрическом количестве или в избытке. Деблокирование может быть также осуществлено в условиях окисления при использовании, например,нитрата аммония и церия , взятых в смеси ацетонитрил-вода или 2,3-дихлор-5,6-дициано-1,4-бензохинон в воде. Деблокирование может быть также осуществлено в условиях восстановления, например, путем гидрогенолиза, в присутствии катализатора. Защитные группы 1 и 2 представляют собой предпочтительно 2,2,2-трихлорэтоксикарбонил, 2-(2 трихлорметилпропокси)-карбонил или радикалы триалкилсилил, диалкил-арилсилил, алкилдиарилсилил или триарилсилил, алкильная часть которых содержит от 1 до 4 атомов углерода, а арильная часть представляет собой предпочтительно фенилы. Замена защитных групп 1 и, возможно, 2, представляющих собой силилсодержащий радикал, на атомы водорода может быть осуществлена одновременно с деблокированием боковой цепи. Замена защитных групп 1 и, возможно, 2, представляющих собой 2,2,2-трихлорэтоксикарбонил или 2(2-трихлор-метилпропокси)-карбонил, осуществляется с помощью цинка, возможно, ассоциированного с медью, в присутствии уксусной кислоты при температуре, составляющей от 20 до 60 С, или с помощью минеральной или органической кислоты (такой, как соляная кислота или уксусная кислота), взятой в растворе с алифатическим спиртом, содержащим от 1 до 3 атомов углерода, или в таком сложном алифатическом эфире, как этилацетат, изопропилацетат или -бутилацетат, в присутствии цинка, возможно, ассоциированного с медью. Эта замена может быть также осуществлена путем электролитического восстановления. Кислота общей формулыможет быть получена путем омыления в основной среде сложного эфира общей формулы, 1 и 3 имеют значения, аналогичные указанным выше, а 4 представляет собой алкил, содержащий от 1 до 4 атомов углерода, возможно замещенный фенилом. В основном, омыление осуществляют с помощью такого минерального основания, как гидроокись щелочного металла (лития, калия, натрия), карбоната или бикарбоната щелочного металла (бикарбоната натрия,карбоната или бикарбоната калия) в среде водно-спиртовой, такой, как смесь метанол-вода, при температуре, составляющей от 10 до 40 С, а предпочтительно близкой 20 С. Сложный эфир общей формулыможет быть получен путем взаимодействия альдегида общей формулы 3-,где 3 имеет значение, аналогичное указанному выше, взятого в форме диалкилацеталя или енолалкильного эфира или ортоформиата общей формулы(3)3,где 3 имеет значение, аналогичное указанному выше, на производное фенилизосерина общей формулы, 1 и 4 имеют значения, аналогичные указанным выше, предпочтительно взятого в форме 2, 3,осуществляемого в инертном органическом растворителе в присутствии сильной минеральной кислоты, например серной, или сильной органической кислоты, например паратолуолсульфокислоты, возможно в форме соли пиридиния, при температуре, составляющей от 0 С до температуры кипения реакционной смеси. Наиболее подходящими растворителями являются ароматические углеводороды. Производное фенилизосерина общей формулыможет быть получено путем ацилирования производного фенилизосерина общей формулы,гдеи 4 имеют значения, аналогичные указанным выше. Ацилирование осуществляют, воздействуя бензоилхлоридом или реакционноспособным производным общей формулы 2,где 2 имеет значение, аналогичное указанному выше, апредставляет собой атом галогена (фтор, хлор) или остаток 2 или - 2,используя органический растворитель, например такой алифатический сложный эфир, как этилацетат,или такой галогенсодержащий алифатический углеводород, как дихлорметан, в присутствии минерального или органического основания, например бикарбоната натрия. В основном реакцию проводят при температуре от 0 до 50 С, а предпочтительно близкой к 20 С. Соединение общей формулыможет быть получено в условиях, описанных в международной заявке 92/09589. Изобретение относится также к кислотам общей формулы,где 1 представляет собой бензоил или остаток 2, где 2 представляет собой линейный или разветвленный алкил, содержащий от 1 до 8 атомов углерода,представляет собой фенил, 3 представляет собой атом водорода, 1-4 алкоксигруппу или фенил, возможно замещенный одним или двумя заместителями,выбранными из 1-6 алкила или 1-6 - алкоксигруппы, имеющим форму сложного эфира, ангидрида, смешанного ангидрида или галогенида, в качестве исходного продукта для получения соединений общей формулы . Изобретение относится также к соединениям формулы, где 1,и 3 имеют указанные выше значения, а 1 представляет собой защитную группу функциональной оксигруппы, а 2 представляет собой ацетил или защитную группу функциональной оксигруппы в качестве промежуточного продукта при получении соединения общей формулы . Способ, предлагаемый в настоящем изобретении, особо пригоден при получении соединении общей формулы , в которойпредставляет собой атом водорода или ацетил, а 1 представляет собой бензоил или трет.бутоксикарбонил,представляет собой фенил. 8 4362 1 Нижеследующие примеры иллюстрируют настоящее изобретение. Пример 1. Раствор 10,0 г метил-3-трет.бутоксикарбониламино-2-окси-3-фенил-пропионата-(2,3) и 0,25 г паратолуолсульфоната пиридиния в 200 см 3 толуола подвергают дегидратации путем дистилляции 20 см 3 растворителя. В течение 5 мин в реакционную смесь, нагретую до температуры кипения, вводят 6,34 см 3 параметоксибензальдегида диметилацеталя. Во время введения названного соединения дистиллируют 50 см 3 растворителя, а затем еще 100 см 3. После охлаждения до температуры, приблизительно равной 20 С, в течение 10 мин прибавляют 80 см 3 циклогексана. Полученную смесь охлаждают до температуры 0-5 С. Полученную пульпу подвергают фильтрованию на фритированном стекле, образованный осадок промывают 40 см 3 циклогексана, затем сушат при пониженном давлении и температуре, близкой к 20 С. Таким образом получают(выход 74 ) 10,39 г 3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(2,4,5), имеющего следующие характеристики инфракрасный спектр (таблетки с ) характеристические полосы поглощения 3100-3000, 2980, 2960,2930, 2910, 2840, 1740, 1700, 1614, 1514, 1460, 1435, 1390, 1370, 1245, 1175, 1165, 816, 760, 700 см-1 спектр ядерно-магнитного резонанса протона (400 МГц 3 температура 323 К, химический сдвигвконстанты сочетанияв Гц) 1,11 (, 9) 3,60 (, 3) 3,82 (, 3) 4,58 (,5, 1) 5,42 ( широкий,5,1) 6,38 ( широкий, 1) 6,92 (,7,5, 2) 7,30 (, 7). К раствору 3,0 г соединения, полученного ранее, взятого в 27 см 3 метанола, прибавляют 14 см 3 отводного раствора, содержащего 0,31 г моногидратированного гидроксида лития. В течение 2 ч осуществляют перемешивание при температуре, близкой 20 С. Метанол удаляют путем дистилляции при пониженном давлении, после чего прибавляют 40 см 3 дихлорметана. В режиме интенсивного перемешивания реакционную смесь подкисляют путем присоединения 1 -ной соляной кислоты до 1. После отстаивания водную фазу дважды экстрагируют 40 см 3 дихлорметана. Объединенные органические фазы сушат на сульфате натрия. После фильтрования и выпаривания растворителя получают (при выходе 94,5 ) 2,88 г 3 трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоновой-(2,4,5) кислоты,имеющей следующие характеристики инфракрасный спектр (таблетки с ) характеристические полосы поглощения 3325-2675, 2980, 2955,2935, 2845, 1755, 1700, 1615, 1590, 1515, 1460, 1250, 1175, 1030, 835, 765 и 705 см-1 спектр ядерно-магнитного резонанса протона (250 МГц 3 химический сдвигвконстанты сочетанияв Гц) 1,08 (, 9) 3,82 (, 3) 4,61 (,5,1), 5,42 ( широкий,5,1), 6,38 ( широкий,1), 6,92 (,7,5, 2) 7,30-7,45 (, 7). Пример 2. К перемешиваемому раствору 1,0 г 3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3 оксазолидин-5-карбоновой-(2,4,5) кислоты, 1,34 г 4-ацетокси-2-бензоилокси-5, -20-эпокси-1,13 диокси-9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксена и 0,061 г 4-диметиламинопиридина в 7,6 см 3 безводного толуола прибавляют при температуре 0 С 0,52 г дициклогексилкарбодиимида. В течение 2 ч осуществляют перемешивание при температуре 20 С. Дициклогексилкарбамид отделяют путем фильтрования и промывают толуолом. Собранные органические фазы промывают 0,1 -ным раствором соляной кислоты, насыщенным раствором гидрогенокарбоната натрия, после чего сушат на сульфате натрия. После фильтрования и концентрирования насухо при пониженном давлении получают 2,09 г сырого 3 трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата-(2,4,5)4-ацетокси 2-бензоилокси-5, 20-эпокси-1-окси-9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен 13-ила, имеющего следующие характеристики инфракрасный спектр (3) характеристические полосы поглощения 3575, 1765, 1740, 1725, 1710,1615, 1515, 1455, 1250, 1175, 980, 710 и 700 см-1 спектр ядерно-магнитного резонанса протона (400 МГц, 3 температура 323 К, химический сдвигвконстанты сочетанияв Гц) 1,09 (, 9), 1,18 (, 3) 1,27 (, 3) 1,67 (, 3) 1,72 (, 1) 1,82 (, 3) 1,90 (, 3) 2,02 (, 1) 2,13 (,15 и 9,1 ) 2,25 (,15 и 9,1) 2,60 (, 1) 3,83 (,7,1), 3,83 (, 3) 4,12 (,8,1 Н) 4,26 (,8,1) 4,60 (,5,1) 4,61 (,12,1) 4,78 ( огран.,11, 2) 4,90 ( шир.,10,1) 4,90 (,12,1) 5,45 (. шир.,5,1) 5,50 (,11 и 7,1 ) 5,66 (,7,1) 6,12 (,9,1) 6,18 (, 1) 6,39 ( шир.) 6,94 (,7,5, 2) 7,42 (,7,5, 2) 7,35 и 7,50 (, 5). 7,49 (,5,2) 7,63 (,7,5, 1) 8,03 (,7,5, 2). К раствору 0,161 г соединения, полученного выше, в 2,1 см 3 этилацетата прибавляют 9 л 37 -ного водного раствора соляной кислоты (р/р). В течение 3 ч осуществляют перемешивание при температуре, близкой 20 С. Количественный анализ, осуществленный путем жидкостной хроматографии высокой результативности, показал, что выход 3-трет.бутоксикарбонила амино-3-фенил-2-окси-пропионата (2,3) 4-ацетокси-2 бензоилокси 5, -20-эпокси-1-окси-9 оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен-13 ила составляет 95 . 4362 1 3-трет.бутоксикарбониламино-3-фенил-2-окси-пропионат-(2,3)-ацетокси-2-бензоилокси-5, 20-эпокси-1-окси-9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен-13-ила превращают в 3 трет.бутоксикарбониламино-3-фенил-2-окси-пропионат-(2,3) 4-ацетокси-2-бензоилокси-5, 20-эпокси-9-оксо 1,7, 10-триокси-11-таксен-13-ила(иди Таксотер) в условиях, описанных в патенте 0253738. Пример 3. Раствор 2,43 г метил-3-трет.бутоксикарбониламино-2-окси-3-фенил-пропионата-(2,3) и 0,059 г паратолуолсульфоната пиридиния в 60 см 3 толуола подвергают дегидратации путем дистиллирования 5 см 3 растворителя. Затем к реакционной смеси, нагретой до температуры кипения, прибавляют в течение 15 мин раствор 1,7 г 3,4-диметоксибензальдегиддиметилацеталя в 14 см 3 толуола. В процессе прибавления названного соединения дистиллируют 15 см 3 толуола, а затем еще 25 см 3. После охлаждения при температуре, близкой к 20 С, при перемешивании прибавляют 40 см 3 воды. После отстаивания органическую фазу сушат на сульфате магния. После фильтрования и концентрирования насухо остаток растворяют в 8 см 3 диизопропилового эфира. Кристаллизующийся продукт отделяют путем фильтрования, промывают в диизопропиловом эфире,после чего сушат при пониженном давлении. Таким образом получают (при выходе 50 ) 1,7 г 3-трет. бутоксикарбониламино-2-(3,4-диметоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидин-(2,4,5),имеющего следующие характеристики инфракрасный спектр (таблетки из смеси с ) характеристические полосы поглощения 3085, 3065,3030, 2975, 2935, 2840, 1740, 1700, 1600, 1520, 1495, 1455, 1425, 1265, 1175, 1025, 800, 755, 700 см-1 спектр ядерно-магнитного резонанса протона (300 МГц 6 химический сдвигвконстанты сочетанияв Гц) 1,00 (, 9) 3,58 (, 3) 3,80 (, 3) 3,83 (, 3) 4,68 (,4,1) 5,31 (, 1) 6,34 (, 1) 6,957,10 (, 3) 7,35-7,50 (, 5). К раствору 1,63 г таким образом полученного сложного эфира, взятого в 25 см 3 метанола и 7 см 3 дистиллированной воды, прибавляют 0,24 г 86 -ного гидроксида калия. В течение 40 мин перемешивают при температуре, близкой к 20 С. После удаления метанола путем дистилляции при пониженном давлении и подкисления среды до 3-4 с помощью 1-ной соляной кислоты образованный осадок отделяют фильтрованием. Осадок после фильтрования промывают водой, затем сушат. Таким образом получают (при выходе 92 ) 1,45 г 3-трет.бутоксикарбонил-2-(3,4-диметоксифенил)-4-фенил-1,3-оксазолидин-5-карбоновой (2,4,5) кислоты, чистота которой составляет 95 , а характеристики которой следующие инфракрасный спектр (таблетки в смеси с ) характеристики полосы поглощения 3225, 3030, 3005,2975, 2930, 2840, 1740, 1710, 1610, 1600, 1515, 1465, 1455, 1260, 1175, 1020, 760, 700 см-1 спектр ядерно-магнитного резонанса протона (250 МГц 6 химический сдвигвконстанты сочетанияв Гц) 1,00 (, 9), 3,78 (, 3) 3,81 (, 3) 4,55 (,4,1) 5,23 (, 1) 6,29 (, 1) 6,907,10 (, 3) 7,30-7,50 (, 5). Пример 4. К перемешиваемой суспензии 0,155 г 3-трет.бутоксикарбонил-2-(3,4-диметоксифенил-4-фенил-1,3 оксазолидин-5-карбоновой-(2,4,5) кислоты и 0,24 г 4-ацетокси-2-бензоилокси-5, 20-эпокси-1,13 диокси-9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен в 2,25 см 3 безводного толуола прибавляют в один прием при температуре 0 С 0,076 г дициклогексилкарбодиимида и 0,0075 г 4 диметиламинопиридина. Осуществляют перемешивание в течение 1 ч при температуре 0 С. Образовавшийся дициклогексилкарбамид отделяют фильтрованием. Осадок после фильтрования промывают толуолом. Объединенные толуолсодержащие фазы последовательно промывают водным насыщенным раствором бикарбоната натрия, затем водой. После высушивания и концентрирования насухо при пониженном давлении получают (при выходе количественном) 0,435 г 3-трет.бутоксикарбонил-(3,4-диметоксифенил)-4-фенил-1,3 оксазолидин-5-карбоксилат-(2,4,5) 4-ацетокси-2-бензоилокси-5, 20-эпокси-1-окси-9-оксо-бис-(2,2,2 трихлорэтокси)-7, 10-карбонилокси-11-таксен-13-ила, характеристики которого следующие инфракрасный спектр (3) характеристические полосы поглощения 3580, 3550-3375, 3090, 3070, 3030,1765, 1740, 1730, 1715, 1605, 1520, 1500, 1465, 1455, 1265, 1250, 1180, 1035, 985, 710 и 695 см-1 спектр ядерно-магнитного резонанса протона (400 МГц 3 температура 323 К химический сдвигвконстанты сочетанияв Гц) 1,10 (, 9 Н) 1,17 (, 3 Н) 1,25 (, 3 Н) 1,66 (, 3 Н) 1,70 (, 1 Н) 1,82 (, 3 Н) 1,90 (, 3 Н) 2,02 (, 1) 2,13 (,15 и 9, 1), 2,24 (,15 и 9,1) 2,60 (, 1) 3,83 (,7,1), 3,89 (, 3) 3,93 (, 3) 4,12 (,8,1), 4,26 (,8,1), 4,60 (,4,5, 1) 4,60 (,12,1), 4,78 ( огран., 2) 4,89 ( шир.,10, 1), 4,90 (,12, 1) 5,46 (, шир.,4,5, 1) 5,50 (,11 и 7,1 ) 5,66 (,7,1) 6,13 (,9,1), 6,15 (, 1), 6,39 (, 1) 6,90 (,7,5, 1), 7,03 (,1, 1), 7,07 (,7,5 и 1, 1), 7,35 и 7,50 (, 5) 7,48 (,7,5, 2) 7,62 (,7,5, 1) 8,03 (,7,5, 2). К раствору 0,223 г сложного эфира, полученного выше, в 2,5 см 3 метанола прибавляют 12 л метансульфокислоты. Смесь перемешивают в течение 2 ч 30 мин при температуре, близкой 20 С. Количественный анализ, осуществленный путем жидкостной хроматографии высокой результативности, показывает, что вы 10 4362 1 ход 3-трет.бутоксикарбониламино-3-фенил-2-окси-пропионата-(2,3) 4-ацетокси-2-бензоилокси-5, 20-эпокси 1-окси-9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен-13-ила составляет 88 . Пример 5. Раствор 0,497 г метил-3-трет.бутоксикарбониламино-2-окси-3-фенил-пропионата-(2,3), 0,021 г паратолуолсульфоната пиридиния и 0,295 г 2,4-диметоксибензальдегида в 20 см 3 безводного толуола нагревают при рефлюксе в течение 24 ч. Воду, образовавшуюся в процессе реакции, удаляют с помощью насадки ДинаСтарка. После охлаждения при температуре, близкой к 20 С, раствор промывают в водном 37 -ном растворе гидрогеносульфита натрия (вес/вес), затем в водном насыщенном растворе бикарбоната натрия. После концентрирования органической фазы при пониженном давлении получают (при выходе 80 ) 0,700 г 3 трет. бутоксикарбонил-2-(2,4-диметоксифенил-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(4,5) в виде смеси диастереоизомеров А и В квазиэквимолекулярной, имеющей следующие характеристики инфракрасный спектр (4) характеристические полосы поглощения 3095, 3070, 3035, 2980, 2955, 2935,2840, 1760, 1645, 1710, 1615, 1590, 1510, 1465, 1455, 1435, 1210, 1160, 1040, 835 и 700 см-1 спектр ядерно-магнитного резонанса протона (250 МГц,6 химический сдвигвконстанты сочетанияв Гц) 1,00 (, С(С 3 ) 3 для В) 1,22 (, С(С 3 )3 для А) 3,55 (, - 3 - или -3 для В) 3,87 и 3,85(, - 3 или,3 для А и В) 4,64 (,4,5, -5 для В) 5,01 (,2,5, -5 для А) 5,21 (,2,5, - 4 для А) 5,26 (,4,5 - 4 для В) 6,46 (,7,5 и 1,5, -65 в 2( -5 ) для А) 6,52 (, - 2 для А) 6,50-6,65 (, - 2 и 65 в 2( -5 и -3 ) В-65 в 2( -3 ) для А) 7,00 (,7,5, -65 в 2( -6 ) для В) 7,30-7,53 (, 5, -65 в 4( - 2 - -6 ) для А и В). К раствору 0,700 г сложного эфира, полученного выше, взятого в смеси 9 см 3 метанола и 3 см 3 дистиллированной воды, прибавляют 0,073 г моногидратного гидроксида лития. В течение 3 ч 30 мин смесь перемешивают при температуре, равной приблизительно 20 С. Метанол удаляют путем дистилляции при пониженном давлении. Водную фазу промывают толуолом, затем подкисляют до 3-4 путем введения водного 1 ного раствора соляной кислоты. Полученный осадок отделяют фильтрованием, а остаток после фильтрования обильно промывают водой до нейтральности, после чего сушат при пониженном давлении. Таким образом получают (при выходе 74 ) 0,450 г 3-трет.бутокси-карбонил-2-(2,4-диметилфенил)-4-фенил-1,3 оксазолидин-5-карбоновой (4,5) кислоты в виде смеси диастереоизомерных форм А и В квазиэквимолекулярной, имеющей следующие характеристики инфракрасный спектр (в таблетках с ) характеристические полосы поглощения 3300-2700, 27002250, 3070, 3030, 3005, 2975, 2940, 2840, 1710, 1615, 1590, 1510, 1460, 1210, 1160, 1035, 835 и 700 см-1 спектр ядерно-магнитного резонанса протона (200 МГц 6 температура 393 К химический сдвигвконстанты сочетанияв Гц, смесь 2 диастериоизомеров в соотношении 55/45) 1,00 (, С(С 3 ) 3 для В) 1,25 (, С(С 3 ) 3 для А) 3,75 и 3,85 (, 6, -3 для А и В) 4,43 (,5, -5 для В) 4,77 (,2, -5 для А) 5,21 (,2, - 4 для А) 5,21 (,2, - 4 для В) 6,42 (,7,5 и 1,5, 65 в 2( -5 ) для А) 6,49 (, - 2 для 6,45-6,60 (, - 2 и 65 в 2( -5 и -3 ) для 65 в 2( -3 ) для ) 7,02 (,7,5, -65 в 2( -6 ) для ) 7,15 (,7,5, -65 в 2( -6 ) для ) 7,25-7,50(, 5, -65 в 4( - 2 и -6 ) дляи ). Пример 6. К перемешиваемой суспензии 1,671 г 3-трет.бутоксикарбонил-2-(2,4-диметоксифенил)-4-фенил-1,3 оксазолидин-5-карбоновой-(4,5) кислоты и 1,003 г 4-ацетокси-2-бензоилокси-5, 20-эпокси-1,13-диокси 9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10, -карбонилокси-11-таксена в 8 см 3 безводного толуола прибавляют в один прием при температуре 0 С 0,656 г дициклогексилкарбодиимида и 0,0287 г 4-диметиламинопиридина. В течение 10 мин осуществляют перемешивание при температуре 0 С, а затем при температуре, близкой к 20 С, в течение 5 ч. Образовавшийся дициклогексилкарбамид отделяют фильтрованием и промывают в толуоле. Собранные толуолсодержащие фазы промывают водным насыщенным раствором бикарбоната натрия, а затем водой. После высушивания, фильтрования и концентрирования насухо при пониженном давлении получают 1,623 г 3-трет.бутоксикарбонил-2-(2,4-диметоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата-(4,5) 4-ацетокси-2-бензоилокси-5, 20-эпокси-1-окси-9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен-13-ила неочищенного в виде диастереоизомерной смеси, которую разделяют на изомеры с помощью жидкостной хроматографии на силикагеле, используя в качестве элюента смесь этилацетатциклогексан (75-25 по объему). Один из двух диастереоизомеров имеет следующие характеристики спектр ядерно-магнитного резонанса протона (400 МГц, 3 химический сдвигвконстанты сочетанияв Гц) 1,20 (, 3) 1,25 (, 9) 1,30 (, 3) 1,76 (, 1) 1,85 (, 3) 2,00 (, 3) 2,05 (, 1) 2,17 (, 3) 2,26 (,15 и 9, 1) 2,34 (,15 и 9, 1) 2,60 (, 1) 3,82 (, 3) 3,92 (, 3) 3,95 (,7,1) 11(,12, 1) 5,36 (,2, 1) 5,63 (,11 и 7, 1) 5,70 (,7, 1) 6,28 (, 1) 6,34 (,9, 1) 6,43 (,7,5 и 1,5, 1) 6,51 (,1,5, 1) 6,69 (, 1) 7,16 (,7,5, 1) 7,35-7,50 (, 3), 7,48 (,7,5, 2), 7,67 (,7,5, 2), 7,63 (,7,5, 1) 8,04 (,7,5, 2). Другой диастереоизомер имеет следующие характеристики инфракрасный спектр (4) характеристические полосы поглощения 3580, 3550-3300, 3070, 3030, 1760,1740, 1710, 1610, 1590, 1510, 1455, 1435, 1260, 1250, 1210, 1180, 1035, 985, 710 и 700 см-1 спектр ядерно-магнитного резонанса протона (400 МГц 3 химический сдвигвконстанты сочетанияв Гц) 1,10 (, 9 -( 3 ) 3 ) 11,16 (3, 3 - 3 16 или 17) 1,24 (, 3 - 3 16 или 17) 1,53 (, 3 - 3 19) 1,66 (, 1 - 1) 1,82 (, 3 - 3 18) 2,00 (, 3 - 3 ) 2,00 (, 1 - -62,12 (,15 и 9, 1 -14 ) 2,24 (,15 и 9, 1 - -14 ) 2,60 (, 1-6 ) 3,82 (,7, 1 -3 ) 3,82 (, 3 - 3 ) 3,90 (, 3 - 3 ), 4,12 (,8,1 - - 2 ) 4,26 (,8, 1- 24,55( -6 ) 7,30 - 7,50 , 5 -65 в 4( - 2 - -6 ) 7,48 ,7,5, 2 -65( -3 и -5 ) 7,63 ,7,5,1 65( - 4 ) 8,03 ,7,5, 2 -65 ( - 2 и -6 ). К раствору 1,623 г неочищенного сложного эфира, полученного выше, в 20 см 3 метанола прибавляют 80 л метансульфокислоты. В течение 4 ч при температуре, близкой 20 С, смесь перемешивают. Количественный анализ, осуществленный путем жидкостной хроматографии высокой результативности, показал, что выход 3-трет.бутоксикарбониламино-3-фенил-2-окси-пропионата-(2,3) 4-ацетокси-2-бензоилокси-5, 20-эпокси 9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен-13-ила составляет 88 . Пример 7. Раствор 10,0 г метил-3-трет.бутоксикарбониламино-2-окси-3-фенил-пропионата-(2,3), 1,0 г паратолуолсульфоната пиридиния и 5,7 см 3 бензальдегиддиметилацеталя в 250 см 3 безводного толуола нагревают с обратным холодильником. Перегоняют 200 см 3 растворителя за 2 ч. Раствор охлаждают до температуры,близкой 20 С, и промывают 50 см 3 воды. После отстаивания, высушивания и концентрирования насухо органической фазы полученный остаток растворяют в 14 см 3 диизопропилового эфира. Полученную пульпу фильтруют, промывают и отжимают. Таким образом получают (при выходе 65 ) 8,4 г 3 трет.бутоксикарбониламино-2,4-дифенил-5-метоксикарбонил-1,3-оксазолидин-(2,4,5) в виде одного диастереоизомера, имеющего следующие характеристики инфракрасный спектр (таблетировано в смеси с ) характеристические полосы поглощения 3250,3095, 3070, 3030, 2975, 1710, 1500, 1460, 1165, 760 и 700 см-1 спектр ядерно-магнитного резонанса протона (300 МГц 6 химический сдвигвконстанты сочетанияв Гц) 0,95 (, 9) 4,26 (, 1) 5,10 (, 1) 6,20 (, 1), 7,25-7,55 (, 5). К раствору 7,07 г сложного эфира, полученного выше, в 88 см 3 метанола и 22 см 3 воды прибавляют 1,26 г гидроксида калия 86 -ного. Осуществляют перемешивание в течение ночи при температуре, близкой к 25 С. Метанол удаляют путем перегонки при пониженном давлении. Затем подкисляют добавлением 1 ной соляной кислоты до 2. Образованный осадок отделяют фильтрованием, обильно затем промывают водой до нейтральной реакции, после чего сушат при пониженном давлении. Таким образом получают (при выходе количественном) 7,0 г 3-трет.бутоксикарбонил-2,4-дифенил-1,3-оксазолидин-5-карбоновой(2,4,5) кислоты в виде единственного диастереоизомера, имеющего следующие характеристики инфракрасный спектр (таблетировано в смеси с ) основные характеристические полосы поглощения 3080, 3050, 3030, 3005, 2975, 1760, 1695, 1600, 1585, 1490, 1460, 1435, 1175, 760 и 700 см-1. спектр ядерно-магнитного резонанса протона (200 МГц 6 химический сдвигв , константы сочетанияв Гц) 0,98 (, 9) 3,38 (, 3) 4,71 (,4,1) 5,30 ( широкий,4, 1) 6,38 (, 1) 7,25-7,55 (, 5). Пример 8. К перемешиваемой суспензии 1,25 г 3-трет.бутоксикарбонил-2,4-дифенил-1,3-оксазолидин-5-карбоновой(2,4,5) кислоты и 1,08 г 4-ацетокси-2-бензоилокси-5, 20-эпокси-1,13-диокси-9-оксо-бис-(2,2,2 трихлорэтокси)-7, 10, -карбонилокси-11-таксена в 12 см 3 безводного толуола прибавляют 0,70 г дициклогексилкарбодиимида и 0,030 г 4-диметиламинопиридина. Смесь перемешивают в течение 24 ч при температуре, близкой к 20 С. Образовавшийся дициклогексилкарбамид отделяют фильтрованием, после чего промывают толуолом. Собранные органические фазы промывают водным насыщенным раствором бикарбоната 12 4362 1 натрия. После высушивания и концентрирования насухо при пониженном давлении получают 2,27 г неочищенного соединения, которое очищают путем жидкостной хроматографии на силикагеле, используя в качестве элюента смесь гексан-этилацетат (1/1 по объему). Таким образом получают (при выходе 75 ) 1,05 г 3 трет.бутокси-2,4-дифенил-1,3-оксазолидин-5-карбоксилата-(2,4,5) 4-ацетокси-2-бензоилокси-5, 20 эпокси-1-окси-9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен-13-или в виде единственного диастереоизомера, имеющего следующие характеристики инфракрасный спектр (таблетирование с ) основные характеристические полосы поглощения 3250,3095, 3070, 3030, 2975, 1710, 1500, 1460, 1165, 760 и 700 см-1 спектр ядерно-магнитного резонанса протона (400 МГц, 3 химический сдвигвконстанты сочетанияв Гц) 1,05 (, 9), 1,15 (, 3) 1,25 (, 3), 1,63 (, 3), 1,73 (, 1), 1,80 (, 3) 1,87 (, 3) 2,01 (, 1), 2,08 (,15 и 9, 1) 2,23 (,15 и 9, 1) 2,58 (, 1) 3,81 (,7, 1) 4,10 (,8,1), 4,26 (,8, 1) 4,60 (,12, 1), 4,61 (,4, 1), 4,78 (,11, 2), 4,87 ( шир.,10, 1),4,90 (,12, 1). 5,46 (, 1), 5,50 (,11 и 7, 1), 5,63 (,7, 1), 6,13 (, 1), 6,13 (, 1), 6,43(, 1), 7,35-7,50 (, 10), 7,48 (,7,5, 2), 7,62 (,7,5, 1), 8,03 (,7,5, 2). К раствору 41 мг сложного эфира, полученного выше, в 0,4 см 3 метанола прибавляют 2,6 л метансульфокислоты. Перемешивают в течение 48 ч при температуре, близкой к 20 С. Количественный анализ, осуществленный с помощью жидкостной хроматографии высокой результативности, показывает, что получен 3 трет.бутоксикарбониламино-3-фенил-2-окси-пропионата-(2,3) 4-ацетокси-2-бензоилокси-5, 20-эпокси 1-окси-9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен-13-ила при выходе 50 . Пример 9. Раствор 10,0 г метил-3-трет.бутоксикарбониламино-2-окси-3-фенил-пропионата-(2,3), 0,334 г паратолуол-сульфоната пиридиния и 3,75 см 3 триметилортоформиата в 70 см 3 толуола нагревают при рефлюксе. Перегоняют 4 см 3 растворителя. После охлаждения при температуре, близкой к 20 С, и фильтрования полученный фильтрат концентрируют насухо при пониженном давлении. Остаток растворяют в 50 см 3 гексана. Полученную пульпу фильтруют, промывают и отжимают. Таким образом получают (при выходе 40 ) 4,6 г 3-трет.бутоксикарбонил-2-метокси-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(4,5) в форме смеси диастереоизомеров, имеющих следующие характеристики инфракрасный спектр (22) характеристические полосы поглощения 2380, 2955, 2935, 2840, 1760,1745, 1710, 1495, 1460, 1440, 1175, 1080 и 1065 см-1 спектр ядерно-магнитного резонанса протона (300 МГц,6 температура 393 К, химический сдвигвконстанты сочетанияв Гц) на смеси 65/35 диастереоизомеров 1,22 (, 3) 1,32 (, 3), 3,34 (,3), 3,43 (, 3), 3,75 (, 3), 4,55 (,3, 1), 4,68 (,8, 1) 4,98 (,8,1), 5,17 (,3, 1) 6,10(, 1), 6,13 (, 1), 7,20-7,50 (, 5). К раствору 11 27 г соединения, полученного выше, в 85 см 3 метанола и 28 см 3 воды прибавляют 16,1 г моногидратного гидроксида лития. В течение 30 мин осуществляют перемешивание при температуре, близкой к 20 С. Метанол удаляют путем перегонки при пониженном давлении, после чего прибавляют 145 см 3 воды и 245 см 3 этилацетата. Двухфазную смесь охлаждают при температуре 0 С при перемешивании, затем подкисляют 1 -ной соляной кислотой до 5. Водную фазу отделяют путем отстаивания смеси и двухкратного экстрагирования 75 см 3 этилацетата. Органические фазы собирают и сушат на сульфате натрия. После фильтрования и концентрирования при пониженном давлении при температуре 25 С до объема в 50 см 3 к полученному таким образом раствору прибавляют при температуре 0 С 9,80 г 4-ацетокси-2 бензоилокси-5, 20-эпокси-1,13-диокси-9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксена, 4,29 г дициклогексилкарбодиимида и 0,25 г 4-диметиламинопиридина. Полученную смесь перемешивают в точение 15 мин при 0 С, а затем в течение 3 ч при температуре, близкой к 20 С. Образовавшийся дициклогексилкарбамид отделяют путем фильтрования и последующего промывания в этилацетате. Собранные органические фазы промывают водным насыщенным раствором бикарбоната натрия. После высушивания и концентрирования насухо при пониженном давлении получают 14,75 г 3-трет. бутокси-карбонил-2-метокси 4-фенил-1,3-оксазолидин-5-карбоксилата-(4,5) 4-ацетокси-2-бензоилокси-5, 20-эпокси-1-окси-9-оксобис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен-13-ила в виде диастереоизомерной смеси, характеристики которой следующие инфракрасный спектр (22) характеристические полосы поглощения 1760, 1725-1710, 1600, 1450,1245, 1175, 1060, 985 и 815 см-1 спектр ядерно-магнитного резонанса протона (400 МГц, 3 температура 323 К, химический сдвигв , константы сочетанияв Гц) 1,23 (, 3), 1,32 (, 3), 1,35 (, 9), 1,88 (, 3), 1,91 (, 3), 2,08 (, 3), 2,08 (, 1), 2,26 ( двойн.,15 и 9, 1), 2,65 (, ), 3,65 (, 3), 3,92 (,7, 1), 4,18 (,8, 1), 4,31 (,8, 1), 4,64 4362 1 К перемешиваемому раствору 0,617 г сложного эфира, полученного выше, в 7,6 см 3 этилацетата прибавляют 47 л 37 -ной соляной кислоты (в/в). Перемешивают в течение 20 ч при температуре, близкой к 20 С. Анализ, осуществленный методом жидкостной хроматографии высокой результативности, показал,что получен 3-трет.бутоксикарбониламино-3-фенил-2-окси-пропионат-(2,3) 4-ацетокси-2-бензоилокси 5, 20-эпокси-1-окси-9-оксо-бис-(2,2,2-трихлорэтокси)-7, 10-карбонилокси-11-таксен-13-ил с выходом 53 . Пример 10. Раствор 4,01 г метил-3-бензоиламино-2-окси-3-фенил-пропионата-(2,3) и 0,01 г паратолуолсульфоната пиридиния в 70 см 3 толуола дегидратируют путем перегонки 30 см 3 раствора. Прибавляют 30 см 3 толуола и перегоняют 20 см 3 растворителя. После охлаждения прибавляют раствор 2,57 г параметоксибензальдегиддиметилацеталя в 6 см 3 толуола. Затем прибавляют 20 см 3 толуола, после чего смесь нагревают при температуре, близкой к 100 С, в течение 40 мин перегоняя 60 см 3 растворителя. После охлаждения мутный раствор фильтруют через хлопок, после чего концентрируют насухо. Таким образом получают 6,13 г желтоватого масла, которое перемешивают в течение 12 ч с 30 см 3 циклогексана. После фильтрования на фриттированном стекле и промывания осадка дважды 10 см 3 циклогексана получают (при выходе 91 ) 5,09 г 3-бензоил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(2,4,5). К раствору 4,80 г соединения, полученного выше, в 120 см 3 метанола прибавляют 25 см 3 водного раствора, содержащего 834 мг 86 -ного гидроксида калия. Перемешивают в течение 1 ч при температуре, близкой к 20 С. Метанол удаляют путем дистилляции при пониженном давлении, после чего прибавляют 25 см 3 воды и 50 см 3 изопропилового эфира. Водную фазу отделяют путем отстаивания, после чего дважды промывают 25 см 3 изопропилового эфира. Водную фазу подкисляют, добавив концентрированную соляную кислоту, до 1, после чего прибавляют 50 см 3 дихлорметана. После отстаивания водную фазу промывают 25 см 3 дихлорметана. Собранные органические фазы промывают 25 см 3 воды, затем сушат на сульфате натрия. После фильтрования и концентрирования насухо получают (при выходе 97 ) 4,49 г 3-бензоил 2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоновой-(2,4,5) кислоты. Пример 11. К раствору 0,137 г 85 -ного 4,10-диацетокси-2 -бензоилокси-5, 20-эпокси-1,13-диокси-9-оксо-7 триэтил-силилокси-11-таксена и 0,0521 г дициклогексилкарбодиимида в 1 см 3 толуола прибавляют раствор 0,1023 г 3-бензоил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоновой-(2,4,5) кислоты и 5,2 мг 4-диметиламинопиридина в 3 см 3 толуола. Перемешивают в течение 2 ч 15 мин при температуре, близкой к 20 С. Дициклогексилкарбамид отделяют фильтрованием. К фильтрату прибавляют 20 см 3 насыщенного раствора бикарбоната натрия. После отстаивания водную фазу трижды экстрагируют 30 см 3 дихлорметана. Собранные органические фазы сушат на сульфате натрия. После фильтрования и концентрирования получают 0,2108 г соединение, которое очищают путем хроматографии на 7 г двуокиси кремния,помещенной в колонку высотой 30 см и имеющей диаметр 1,5 см, используя в качестве элюента смесь циклогексан-этилацетат (70-30 по объему). Таким образом получают (при выходе 70,54 ) 127,4 мг 3-бензоил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата-(2,4,5) 4,10 диацетокси-2-бензоилокси-5,20-эпокси-1-окси-9-оксо-7-триэтилсилилокси-11-таксен-13-ила,структура которого подтверждена спектром ядерно-магнитного резонанса протона, имеющего чистоту, близкую 95 . К раствору 40 мг соединения, полученного выше, в 2 см 3 этанола прибавляют 40 л этанолового 0,9 ного раствора соляной кислоты. Перемешивают в течение 6 ч при температуре, близкой к 20 С. Количественный анализ, осуществленный с помощью жидкостной хроматографии высокой результативности, показал, что выход 3-бензоил-3-фенил-пропионата-(2,3) 4, 10-диацетокси-2-бензоилокси-5, 20-эпокси 1,7-диокси-9-оксо-11 таксен-13-ила (или таксол) составляет 51,4 . Национальный центр интеллектуальной собственности. 220072, г. Минск, проспект Ф. Скорины, 66. 14
МПК / Метки
МПК: C07D 413/12, C07D 263/06, C07D 305/14
Метки: производных, способ, таксана, получения
Код ссылки
<a href="https://by.patents.su/14-4362-sposob-polucheniya-proizvodnyh-taksana.html" rel="bookmark" title="База патентов Беларуси">Способ получения производных таксана</a>
Предыдущий патент: Способ получения упакованного в пакеты потребительского молока с определенным содержанием жира
Следующий патент: Способ повышения приживляемости эмбрионов у коров
Случайный патент: Комплект упаковки для пищевых продуктов