Ингибитор активности IL-6
Номер патента: 4867
Опубликовано: 30.12.2002
Текст
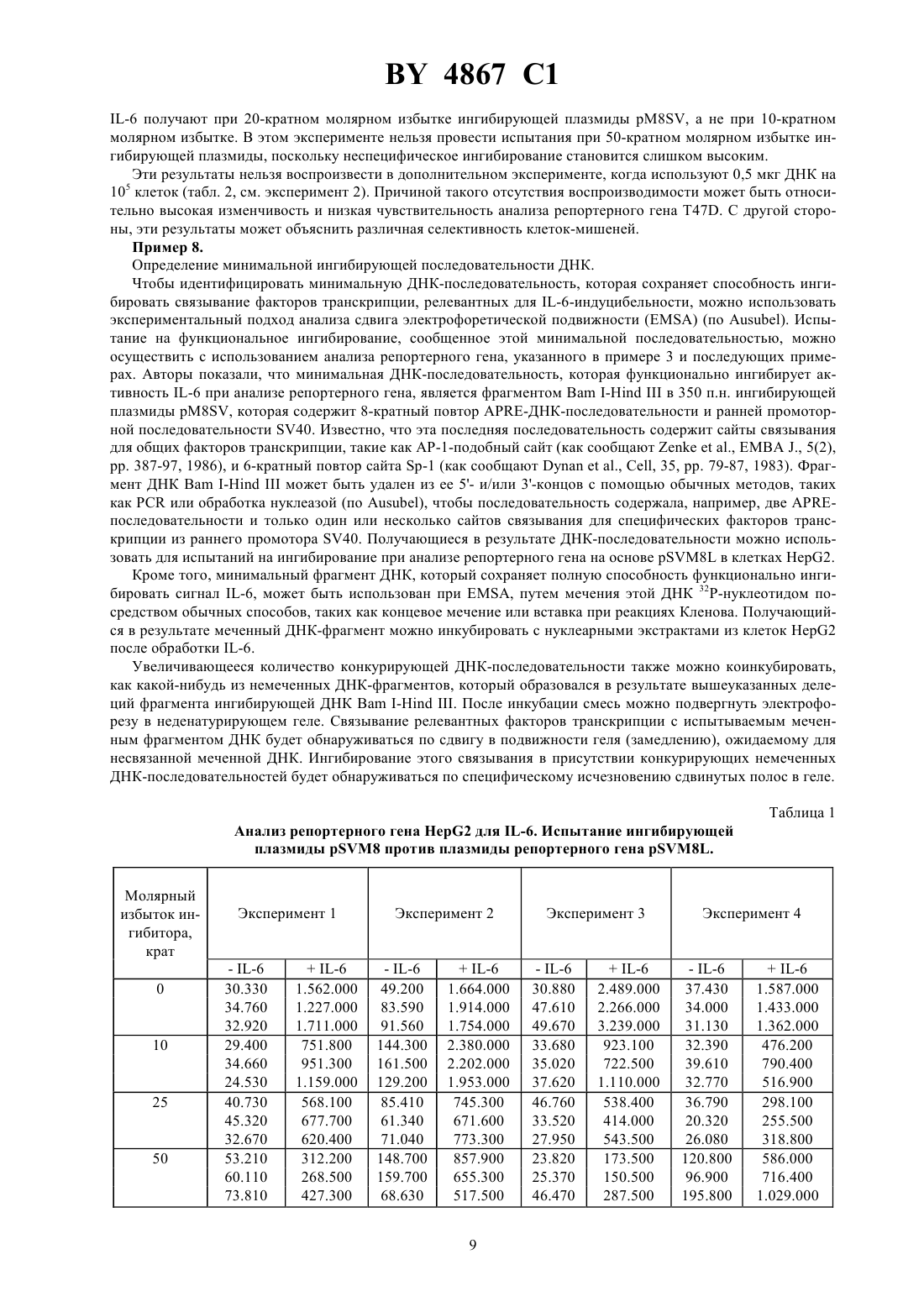
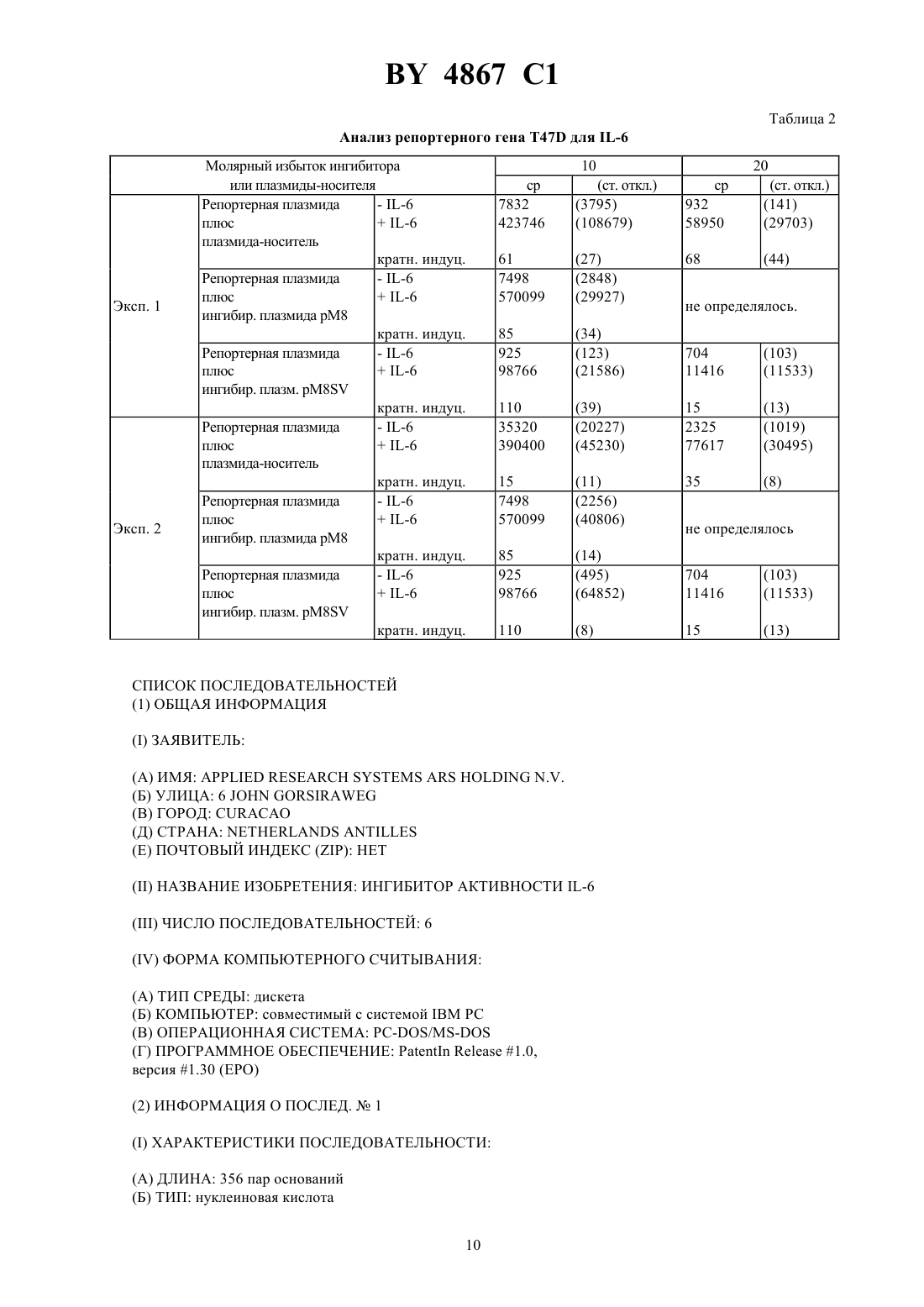
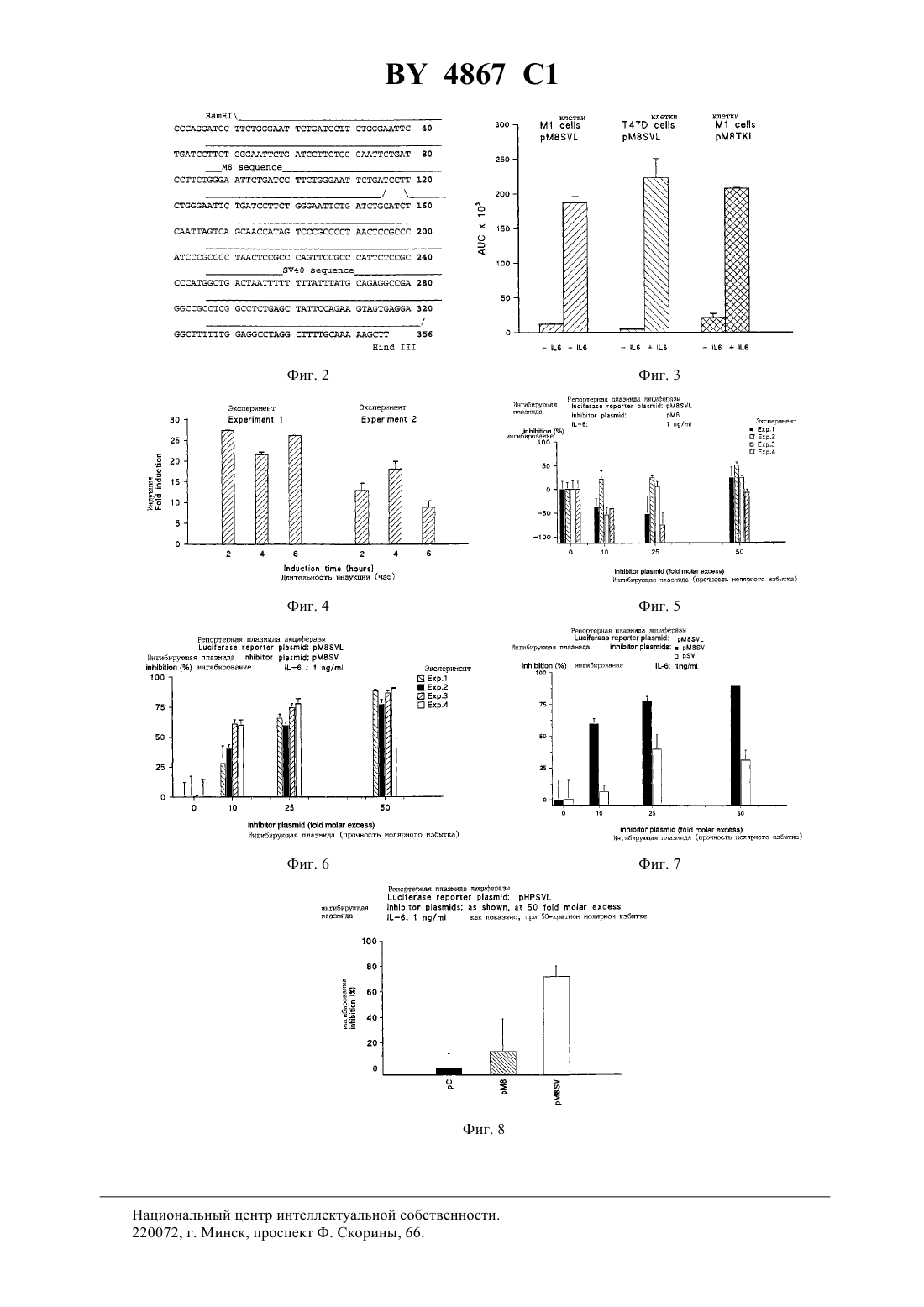
(71) Заявитель Апплайд Резеч Системз АРС Холдинг Н. В. (/)(73) Патентообладатель Апплайд Резеч Системз АРС Холдинг Н. В. (/)) по меньшей мере, одну нуклеотидную последовательность, составляющую сайт связывания фактора транскрипции иной, чем -элемент. Фиг. 1 2. Нуклеотидная последовательность по п. 1, отличающаяся тем, что последовательностьявляется нуклеотидной последовательностью . 4867 1 3. Нуклеотидная последовательность по п. 1, отличающаяся тем, что последовательностьвыбирают из группы, состоящей из блока ТАТА и сайтов связывания для факторов транскрипции -1, -2, -1,-1, -кВ, -1, -2 и . 4. Нуклеотидная последовательность по любому из п.п. 1-3, отличающаяся тем, что -элемент повторяется, по меньшей мере, 2 раза. 5. Нуклеотидная последовательность по п. 4, отличающаяся тем, что -элемент повторяется 3-10 раз. 6. Нуклеотидная последовательность по п. 5, отличающаяся тем, что -элемент повторяется 8 раз. 7. Нуклеотидная последовательность по любому из п.п. 1-6, отличающаяся тем, что последовательность содержит, по меньшей мере, два различных -элемента. 8. Нуклеотидная последовательность по любому из п.п. 1-7, отличающаяся тем, что последовательность содержит, по меньшей мере, две различные олигонуклеотидные последовательности, составляющие сайт связывания фактора транскрипции. 9. Нуклеотидная последовательность по п. 8, отличающаяся тем, что последовательностьявляется ранним промотором 40. 10. Нуклеотидная последовательность по п. 1, отличающаяся тем, что представлена в виде 1. 11. Нуклеотидная последовательность по любому из п.п. 1-10, предназначенная для использования в терапии для ингибирования активности -6. 12. Плазмидный вектор, содержащий нуклеотидную последовательность по любому из п.п. 1-10. 13. Фармацевтическая композиция, ингибирующая активность -6, содержащая эффективное количество нуклеотидной последовательности по любому из п.п. 1-10 вместе с одним или несколькими фармацевтически приемлемыми носителями и/или эксципиентами. 14. Фармацевтическая композиция, ингибирующая активность -6, содержащая эффективное количество плазмидного вектора по п. 12 вместе с одним или несколькими фармацевтически приемлемыми носителями и/или эксципиентами. Область техники, к которой относится изобретение. Настоящее изобретение относится к нуклеотидной последовательности, которая способна ингибировать активность -6, ее применению в терапии, а также к содержащим ее фармацевтическим композициям. Предпосылки создания изобретения.-6 является белком, принадлежащим к группе цитокинов, которые призваны играть ключевую роль в иммунной реакции организма и стимуляции гематопоэз. Действительно, обнаружено много биологических функций -6 в гематологической и лимфатической системах, в печени и других мишенных органах и тканях. Некоторые из этих функций являются благоприятными, в то время как другие относятся к патологическим состояниям. К числу последних относится, как обнаружено, то, что -6 является фактором роста для клеток множественной миеломы показано, что антитела против -6 временно блокируют пролиферацию миеломных клеток у пациента с лейкемией (см., например,., , 78, (5), . 1198-1204, 1991, и., . , 22, . 2819-24, 1992). Найдена взаимосвязь оцененных уровней -6 с аутоиммунными и воспалительными заболеваниями, такими как ревматоидный артрит, гломерулонефрит, псориаз и болезнь Кастлемена (см., например,., . ., 71, . 664-71, 1993). Также показано, что -6 играет явную роль в остеопорозе и гиперкальциемии (см., например,.,., 13, (5), . 1189-96, и.,., 53, . 73740, . 1993). Поэтому разработка ингибиторов активности -6 была предметом активных исследований. Для этих целей были выбраны различные подходы, в том числе, применение антител против -6 130 или р 80 (как сообщают., см. выше) применение растворимого 130 или применение мутеинов для -6, или рецептора -6. Так как такие подходы могут ассоциироваться со специфическими нежелательными эффектами при клиническом применении (как сообщают., см. выше), может быть полезным выдвижение других стратегий ингибирования активности -6. Поэтому Заявитель провел исследования при другом подходе к ингибированию активности -6, а именно путем блокирования внутриклеточных белков, опосредующих сигнал -6. 4867 1 Трансдукция сигнала -6 в отвечающих клетках тщательно исследована.. ( , 81,. 2313-6, 1984) первыми предположили, что существуют отвечающие элементы ДНК, специфические для-6, фланкирующие фибриногенные гены крысы. Позднее. (. . ., 17, (3), 1121-37, 1989) показали отвечающий элемент с коровой последовательностью, идентичной последовательности генов крысиного фибриногена , который отвечает на -6 в гене крысиного 2-макроглобулина. Отвечающие элементы ДНК с последовательностями, родственными вышеупомянутым последовательностям, также определены в генах, кодирующих человеческий С-реактивный белок(см..,. . ., 7, . 199-212, 1990), человеческий гаптоглобин (см..,. 6, (7), . 190512, 1987), и в других генах, кодирующих добавочные белки острой фазы, индуцированные -6 (см.., . ., 265, . 621-36, 1990), что приводит к определению коровой консенсусной последовательностиили , гдепредставляет А или Т, ипредставляет А или .. (. . ., 12, (5), . 2282-94, 1992) показали, что многие родственные коровые последовательности, подобные коровой последовательности, упомянутой выше, могут присутствовать в регуляторных областях генов дикого типа, отвечающих -6, и что эта множественность ведет к амплификации ответа, что анализируется функционально с помощью анализа репортерного гена.. (. . ., 13, (1), . 276-88, 1993) недавно предложили расширенную версию коровой консенсусной последовательности как элемента реакции острой фазы , активного в клетках гепатомы, которую можно представить формулой , гдепредставляет С или А, К представляет Т или ,представляет С или Т. Показано (., . . ., 14, (3), . 1657-68, 1994), что такие -подобные последовательности связывают белковый фактор транскрипции с молекулярной массой порядка 90 кД, названный АРЕ, который недавно клонирован (см.., , 77, . 63-71, 1994). На практике связывание активированногос -последовательностями приводило бы к активации -6-индуцибельных генов(содержащих такие -последовательности) в отвечающих на -6 клетках. Вследствие этого -элемент можно использовать в качестве энхансера гена-мишени в отвечающих на -6 клетках следующим образом в отвечающих на -6 клетках обработка -6 индуцирует синтез белков, которые связываются с -элементом, и такое связывание активирует экспрессию гена-мишени.. (сообщение на 12-ой Европейской конференции по иммунологии, Барселона, 14-17 июня 1994) показали, что 8-кратный повтор ДНК-последовательности(8) отвечает за 50-100 кратную индукцию с помощью -6 репортерного гена в клетках гепатомы человека 2. В случае таких отдельных транскрипционных факторов действительно выявлены двухцепочечные олигонуклеотиды. Краткое изложение сущности изобретения. Основным предметом настоящего изобретения является нуклеотидная последовательность, способная ингибировать активность -6, которая включает) по меньшей мере одну нуклеотидную последовательность, которая является -элементом общей формулы , гдепредставляет Т или , или может также отсутствовать,представляет Т или также может отсутствовать, М представляет С или ,представляет С или Т, и К представляет Т или ,в сочетании с) по меньшей мере одной нуклеотидной последовательностью, составляющей сайт связывания транскрипционного фактора иной, чем -элемент, такой, как сайты, присутствующие в промоторных областях. Примерами нуклеотидных последовательностей последнего типа являются блок ТАТА и сайты связывания факторов транскрипции, таких как АР-1 (см..,, 89, . 157-61, 1992), -2,-1 (м.., . . ., 21 (15), . 3405-11), -1 (м.., , 89, . 203-9, 1990),(м.., , 250, . 997-1000, 1990), -1, -2 и факторов транскрипции . В предпочтительном варианте осуществления настоящего изобретения как -элемент , так и/или нуклеотидная последовательностьприведенной выше общей формулы повторяются по меньшей мере 2 раза, предпочтительнее - от 3 до 10 раз, еще предпочтительнее - 8 раз. В другом предпочтительном варианте осуществления настоящего изобретения элементсодержит по меньшей мере два различных -элемента, и/или нуклеотидная последовательностьсодержит по меньшей мере две различные олигонуклеотидные последовательности, составляющие сайт связывания фактора транскрипции иной, чем -элемент. Нуклеотидная последовательностьявляется, предпочтительно, ранним промотором 40.-элементсодержит, например, нуклеотидную последовательность . На фиг. 2 приводится нуклеотидная последовательность, которая входит в объем изобретения, в соответствии с предпочтительными вариантами его осуществления. Такая последовательность также обозначается,как послед.1, и составляет предмет настоящего изобретения. Другим предметом настоящего изобретения является плазмидный вектор, содержащий нуклеотидную последовательность настоящего изобретения. 3 4867 1 Дополнительным аспектом настоящего изобретения является применение нуклеотидной последовательности настоящего изобретения в качестве терапевтического средства для ингибирования действия -6 в условиях, когда -6 играет патологическую роль. Настоящее изобретение также относится к фармацевтическим композициям, содержащим нуклеотидную последовательность или плазмидный вектор по настоящему изобретению. Такие композиции могут быть составлены для перорального, ректального, внутривенного или местного применения. Составы настоящего изобретения могут включать использование любого сочетания переноса вирусноопосредованного гена, липосомной композиции, опосредованной рецептором доставки ДНК и/или гантельных структур активной нуклеотидной ингибирующей последовательности по настоящему изобретению. Ингибирующее действие нуклеотидной последовательности настоящего изобретения определяют с помощью анализа репортерного гена. Анализ репортерного гена настоящего изобретения основан на способности -элемента функционировать в качестве энхансера любого гена в отвечающих на -6 клетках (как сообщалось выше). В этом случае -элемент используют как энхансер репортерного гена-мишени (которым является, например, ген люциферазы) в отвечающих на -6 клетках (которыми являются, например, гепатоциты, такие как 2). Затем клетки обрабатывают -6 если достаточное количество продуцированных -белков захватывается избытком нуклеотидной последовательности настоящего изобретения, ген-мишень не будет активироваться. В соответствии с этим анализом строят ингибирующие плазмиды, которые содержат нуклеотидную последовательность настоящего изобретения. Пример такой плазмиды дается на фиг. 1 вместе со стратегией ее построения. Также подразумевается, что эта и другие плазмиды, содержащие нуклеотидную последовательность настоящего изобретения, составляют другой вариант осуществления настоящего изобретения. В дальнейшем настоящее изобретение будет описываться с помощью примеров, которые не следует рассматривать как ограничивающие настоящее изобретение в какой-либо степени. В примерах будут даваться ссылки на чертежи, описанные здесь далее. Краткое описание чертежей. Фиг. 1. Построение плазмиды 8. 8 переваривают си, и липкие концы трансформируют в тупые концы посредством реакции Кленова. Получающийся в результате фрагмент ДНК в 3,2 т.п.н. очищают с помощью электрофореза в агарозном геле, и затем его аутолигируют. Затем генерируют плазмиду 8, содержащую последовательность М 8 (170 п.н.) и последовательность от раннего промотора вируса 40 (190 п.н.), но не имеющую гена люциферазы. Фиг. 2. Последовательность фрагмента-ингибирующей ДНК плазмиды 8. Непрерывная линия над верхней частью приведенной нуклеотидной последовательности представляет последовательность М 8. Четкая непрерывная линия над нижней частью нуклеотидной последовательности представляет промоторную последовательность 40. Также указаны сайты рестрикциии. Фиг. 3. Анализ репортерного гена в клетках 47 и . Испытание различных плазмид, содержащих М 8. Приведенные величины светового излучения являются средними значениями двукратного определения чос за период 30 секунд (площадь под кривой, ППК) из трансфектированных клеток. Каждый прямоугольник представляет среднее трех трансфекцийст.откл. Фиг. 4. Зависимость от времени люциферазной индуцибельности трансфектированных клеток 2 после обработки -6. Плазмиду 8 используют в качестве позитивной плазмиды репортерного гена. Каждый прямоугольник представляет среднее из двух трансфекцийст.откл На чертеже показаны результаты двух экспериментов. Фиг. 5. Анализ репортерного гена 2 для -6. Испытания рМ 8 как ингибирующей плазмиды против 8 как плазмиды репортерного гена. Каждый прямоугольник представляет среднее из трех трансфекцийст.откл На чертеже показаны результаты четырех экспериментов. Фиг. 6. Анализ репортерного гена 2 для -6. Испытания 8 как ингибирующей плазмиды против 8 как плазмиды репортерного гена. Каждый прямоугольник представляет среднее из трех трансфекцийст.откл Результаты выражаются в видеингибирования по отношению к клеткам 2, трансфектированным плазмидой-носителем рС без ингибирующей плазмиды. Фиг. 7. Анализ репортерного гена 2 для -6. Испытанияи 8 как ингибирующих плазмид против 8 как плазмиды репортерного гена. Каждый прямоугольник представляет среднее из трех трансфекцийст.откл Результаты выражаются в видеинигибирования по отношению к клеткам 2,трансфектированным плазмидой-носителем рС без ингибирующей плазмиды. Фиг. 8. Испытания ингибирования активности -6 инигибирующими плазмидами рМ 8 и 8 при анализе репортерного гена 2 на основе люциферазного гена под контролем индуцибельных регуляторных последовательностей -6 из промотора гена человеческого гаптоглобина. Каждый прямоугольник представляет среднее из трех трансфекцийст.откл Результаты выражаются в видеинигибирования по отношению к клеткам 2, трансфектированным плазмидой-носителем рС без ингибирующей плазмиды. 4 4867 1 Трансфекцию осуществляют 0,1 мкг репортерной плазмидной ДНК и указанным молярным избытком ингибирующей плазмиды. Общее количество трансфектированной ДНК поддерживают постоянным с помощью плазмиды-носителя. Трнасфектированные клетки обрабатывают в течение 18 часов 1 нг/мл -6. Подробное описание изобретения. Пример 1. Построение плазмид. Отвечающую на -6 плазмиду репортерного гена люциферазы конструируют, получая, сначала, путем химического синтеза двухцепочечный олигонуклеотид с 38 п.н. с невырезанным сайтом ВаНна его 5 тупом конце и формируя выступ нижней цепочки в 4 нуклеотида, совместимых с сайтамии ВаНна 3 конце. Этот синтетический олигонуклеотид называют М 2, и он содержит две идентичные последовательности из промоторной области гена крысиного 2-макроглобулина. Последовательность олигонуклеотида (верхняя цепочка, 5-3) имеет вид (послед.2). Этот олигонуклеотид клонируют в сайтах-плазмиды 2- (от), где экспрессия люциферазного репортерного гена производится ранним промотором вируса 40,формируя, таким образом, после аутолигирования, плазмиду 2. Синтетический олигонуклеотид также лигируют, через его 5 тупой конец, с сайтомтой же плазмиды 2-, и получающийся в результате линейный продукт лигирования затем разрезают. Получающийся в результате линейный вектор используют в качестве реципиента для клонирования следующих фрагментов ДНК 1) фрагмента-с 238 п.н. из плазмиды 2, с образованием, таким образом, после аутолигирования, плазмиды 4 2) фрагмента-с 280 п.н. из 4, с образованием, таким образом, после аутолигирования, плазмиды 6 и 3) фрагмента ВаН -с 322 п.н. из 6, с образованием, таким образом, после аутолигирования, плазмиды 8. Плазмиду 8 конструируют путем переваривания 8 си путем конвертирования липких концов в тупые концы с помощью реакции вставки с ферментом Кленова. После переваривания ВаНполучающийся в результате фрагмент ДНК М 8 в 163 п.н. лигируют с синтетическим адаптором- с 16 п.н. и клонируют во фрагменте ДНК в 5,6 т.п.н., получающемся при перевариваниивектора 2- (от). Плазмида -2 идентична вышеупомянутой плазмиде 2-, за исключением отсутствия промоторной последовательности 40 в 2-. Адаптор с 16 п.н. содержит сайт множественного клонирования, и его получают путем химического синтеза со следующей последовательностью верхняя цепочка 53 (послед.3) нижняя цепочка 53 (послед. 4). Плазмида, получающаяся из вышеуказанной конструкции, представляет собой 8, и она имеет последовательность ДНК М 8 без промотора, вставленную в сайт множественного клонирования, в обратном направлении люциферазного гена. Плазмиду люциферазного репортерного гена 8 получают путем разрезания плазмиды - (описанной в.,., 7(5), . 1411-9, 1988)и. Получающийся в результате фрагмент в 181 п.н., содержащий ТК-промоторную последовательность гена тимидинкиназы вируса ,лигируют с фрагментом-с 5,8 т.п.н. вектора 8 между последовательностями М 8 и ДНК люциферазы. Плазмиду люциферазного репортерного генаконструируют сначала путем -амплификации 841 п.н. из промоторной области гена гаптоглобина из человеческой геномной ДНК. Конец 3 амплифицированногофрагмента соответствует позиции 36 от начала транскрипции гена человеческого гаптоглобина(как сообщается в., . . ., 260(11), . 6698-709, 1985). Этот -продукт получают с верхней и нижней затравками, содержащими, соответственно, сайты рестрикциии. ДНКзатравки, синтезированные для геномной амплификации промоторной области гаптоглобина, имеют следующую последовательность верхняя затравка 53 (послед.5) нижняя затравка 53 (послед.6). Полученный таким образом -фрагмент вставляют в сайтыиуказанной выше плазмиды люциферазного репортерного гена 2-, в обратном направлении раннего промотора 40. Получающаяся в результате плазмида представляет собой . Чтобы сконструировать ингибирующую плазмиду рМ 8, вышеуказанную плазмиду 8 переваривают си, и полученные таким образом липкие концы исправляют в тупые концы с помощью реакции Кленова. Получающийся в результате фрагмент в 3,1 т.п.н., не имеющий последовательности гена люциферазы, очищают с помощью электрофореза в агарозном геле, затем его аутолигируют, и генерируют ингибирующую плазмиду рМ 8. Ингибирующую плазмиду 8 получают так, как показано на фиг. 1. Переваривают 8 си, и липкие концы трансформируют в тупые концы с помощью реакции Кленова. Получающийся в результате фрагмент ДНК в 3,2 т.п.н. очищают с помощью электрофореза в агарозном геле, затем его аутоли 5 4867 1 гируют. Генерируют, таким образом, плазмиду 8, содержащую последовательность М 8 (170 п.н.) и последовательность из раннего промотора вируса 40 (190 п.н.), но не имеющую люциферазного гена. Ингибирующую плазмидуконструируют посредством вырезания фрагмента- , содержащего люциферазный ген, из указанной выше плазмиды 2-. Получающийся в результате фрагмент в 3,1 т.п.н. подвергают реакции вставки с ферментом Кленова, очищают с помощью электрофореза в агарозном геле, и затем его аутолигируют, получая, таким образом, плазмиду , которая содержит промотор 40,но не имеет люциферазного гена. Плазмиду-носитель рС получают путем разрезания указанной выше плазмиды 2- ферментами рестрикциии. Получающийся в результате фрагмент в 2,9 т.п.н. подвергают реакции вставки с ферментом Кленова, очищают с помощью электрофореза в агарозном геле, и затем его аутолигируют, получая,таким образом, плазмиду рС. Все описанные выше плазмидные конструкции используют для трансформации штамма Е.обычными способами ( ..,.,). Плазмидную ДНК экстрагируют из трансформированных клонов с помощью минипрепаративного метода щелочного лизиса (по , цит. выше). Плазмидную ДНК проверяют с помощью рестрикционного анализа и электрофореза в агарозном геле. Отбирают клоны с предполагаемой картиной. Чтобы получить очищенные плазмидные препараты для применения при трансфекции клеток млекопитающих, получают 300 мл культур отобранных трансформантов Е.-. Затем плазмиды очищают с помощью ионообменных миниколонок 500 с наконечникомв соответствии с инструкциями изготовителя. Пример 2. Клеточные линии и условия культивирования. Клетки гепатомы человека 2 культивируют в минимальной поддерживающей средес добавлением 10, 5 мМ -глутамина, 20 мМ , 100 Е/мл пенициллина/стрептомицина. Клетки рака молочной железы человека 47 (АТСС) культивируют в модифицированной по способу Дульбекко среде Иглас добавлением 10, 5 мМ -глутамина, 20 мМ , 100 Е/мл пенициллина/стрептомицина. Клетки миелоидного лейкоза мышикультивируют вс добавлением 10, 5 мМ -глутамина, 20 мМ , 100 Е/мл пенициллина/стрептомицина. Культивирование вышеуказанных клеточных линий осуществляют в присутствии или в отсутствии соответствующий дозы -6(производный СНО-6 от), как описано ниже. Пример 3. Промежуточная трансфекция и анализы люциферазы и -галактозидазы. Промежуточную трансфекцию клеток гепатомы человека 2 и клеток рака молочной железы человека 47 осуществляют с использованием преципитации ДНК фосфатом кальция в буфере , по стандартным процедурам ( ..,.,). Промежуточную трансфекцию клеток миелоидного лейкоза мышиосуществляют с использованием -декстрана обычными процедурами (по , цит.выше). Чтобы обнаружить активность люциферазы и -галактозидазы, клетки экстрагируютпутем инкубации в течение 15 мин при комнатной температуре с 1 мл/106 клеток буфере для экстракции (25 мМ трисфосфата, рН 7,8, 2 мМ , 2 мМ ЭДТК, 10 глицерина, 1 тритона Х-100). В случае люциферазной активности непосредственно анализируют 20 мкл клеточного экстракта со 100 мкл буфера для анализа люциферазы (20 мМ трицина, 1,07 мМ (МС 3)4 М(О)25 Н 2, 2,67 мМ 4, 0,1 мМ ЭДТК, 33,3 мМ ,0,27 мМ кофермента А, 0,47 мМ люциферина, 0,53 мМ АТФ). В случае активности -галактозидазы 10 мкл клеточного экстракта инкубируют в течение 1 ч при 37 С со 100 мкл субстрата(от ). Считывание данных си люциферазы осуществляют с помощью люменметра 953,причем излучаемая мощность представляет число отсчетов за секунды (чос), взятое за период 30 с в случае люциферазы и за период 15 с в случае -галактозидазы. Показано, что репортерная плазмида 8 предоставляет -6-отвечаемость после промежуточной трансфекции клеток 2, повышая экспрессию люциферазной активности в 50-100 раз (., сообщение на 12-ой европейской конференции по иммунологии, Барселона, 14-17 июня 1994). Эту плазмиду также испытывают в клетках рака молочной железы человека 47 и в клетках миелоидного лейкоза мыши . Клеткитрансфектируют 0,5 мкг ДНК на 106 клеток с использованием декстрана, в то время как для кальцийфосфатной трансфекции клеток 47 используют 2,5 мкг ДНК на 105 клеток. Только весьма ограниченные признаки разделяются этими двумя клеточными линиями, кроме их обычной реакции на человеческий -6. Результаты (фиг. 3) показывают, что молекула ДНК М 8 в плазмиде 8 существенно активна в обеих клеточных линиях после обработки -6. Как показывает фиг. 3, значительная реакция на -6 также наблюдается в клеткахс плазмидой репортерного гена 8, где молекула М 8 фланкирована тимидинкиназным промотором, который отличается от промотора 40, присутствующего в 8. 6 4867 1 Зависимость от времени люциферазной индуцибельности трансфектированных клеток 2 проверяют после обработки -6 (1 нг/мл). Плазмиду 8 используют в качестве позитивной плазмиды репортерного гена (при 0,2 мкг/105 клеток). Клетки трансфектируют в течение ночи, расщепляют и затем подвергают обработке -6. Результаты приводятся на фиг. 4, и они показывают, что почти полного ответа на -6 можно достичь спустя только два часа после обработки -6. Пример 4. Испытание ингибирующей плазмиды рМ 8. Ингибирование активности -6 молекулами ДНК М 8 измеряют после котрансфекции в клетки 2 ) плазмиды репортерного гена 8, отвечающей на -6, и ) молекулы М 8, вставленной в ингибирующую плазмиду М 8. Эта последняя плазмида выступает в роли хозяина последовательности М 8, но она не обладает способностью предоставлять отвечаемость на -6. Клетки 2 трансфектируют 2,5 мкг/105 клеток отвечающей на -6 репортерной плазмиды 8 (содержащей М 8 и ген люциферазы) и 10- или 50 кратным молярным избытком рМ 8, в присутствии различных доз -6. Общее количество ДНК на трансфекцию поддерживают постоянным, используя плазмиду-носитель рС, которая идентична рМ 8, за исключением отсутствия в первой плазмиде специфического фрагмента ДНК М 8 длиной в 165 п.н. Как видно из фиг. 5, ингибирующая плазмида не показывает существенного и воспроизводимого специфического ингибирования активности -6 в четырех экспериментах, даже при 50-кратном молярном избытке ингибирующей плазмиды рМ 8. В этих экспериментах отвечающую на -6 плазмиду репортерного гена используют при дозе 0,1 мкг/105 клеток, в то время как постоянное количество общей ДНК, используемой при трансфекции, составляет 5 мкг/105 клеток. Субоптимальная доза -6, использованная в этих экспериментах, составляет 1 нг/мл. Как показывает фиг. 5, изменчивость при этих условиях эксперимента приемлема, исходя из факта, что различные трансфекции сами по себе являются неизбежным источником изменчивости. Пример 5. Испытание инигибирующей плазмиды 8. Результаты, приведенные на фиг. 5, являются несколько неожиданными, поскольку активная ингибирующая ДНК-последовательность М 8 ингибирующей плазмиды рМ 8 идентична активной последовательности плазмиды репортерного гена 8. Поэтому после котрансфекции следовало бы ожидать конкуренции между двумя идентичными М 8 последовательностями, присутствующими в различных плазмидах,приводящей к ингибированию активности -6 при анализе репортерного гена. Кроме того, описанные выше результаты нельзя объяснить с помощью присутствия избытка активированного -6-специфического фактора (факторов) транскрипции, которые недостаточно нейтрализованы молекулами ингибирующей ДНК М 8, так как данные получают в присутствии ограниченного количества -6. Кроме того, опубликованные данные о подобных экспериментах с сайтами связывания ДНК для известных факторов транскрипции (26-30) не совместимы с результатами, приведенными на фиг. 5. Другим объяснением результатов, показанных на фиг. 5, может быть то, что отличающиеся от М 8 последовательности в плазмиде репортерного гена могут вносить вклад в -6-специфическую сигнальную трансдукцию. Эти последовательности должны отсутствовать в ингибирующей последовательности рМ 8, но они должны присутствовать в позитивной плазмиде репортерного гена 8 (например, последовательности раннего генного промотора 40, которые могут связывать общие факторы транскрипции). Ингибирующая плазмида рМ 8 поэтому может быть неэффективной при конкуренции с плазмидой репортерного гена 8. Чтобы проверить эту гипотезу, конструируют ингибирующую плазмиду (8), содержащую в качестве ингибирующих -6 ДНК-последовательностей как последовательность М 8, так и промоторную последовательность 40 (см. фиг. 1). Эту ингибирующую плазмиду проверяют при анализе репортерного гена -6 с клетками 2. Осуществляют четыре независимых эксперимента, при двукратном повторении трансфекции на эксперимент. Трансфекцию осуществляют 0,1 мкг репортерной плазмидной ДНК и молярным избытком инигибирующей плазмиды, как показано на фиг. 6. Общее количество трансфектированной ДНК поддерживают постоянным с помощью плазмиды-носителя. Трансфектированные клетки обрабатывают в течение 18 часов 1 нг/мл -6. Результаты, приведенные на фиг. 6, показывают четкое зависимое от дозы ингибирование активности 6 ингибирующей плазмидой 8. Необработанные данные для фиг. 6 приводятся в табл. 1. При каждом эксперименте осуществляют три повторных трансфекции на дозу ингибирующей плазмиды. Для каждого эксперимента величины в случае индуцирования и без индуцирования, приведенные в отдельной колонке,приводят к одной и той же трансфекции. Данные значения светового излучения представляют чос за период в 30 секунд. Как можно видеть из табл. 1, наблюдается некоторое непостоянство в этих экспериментах, особенно, при более низких дозах ингибирующей плазмиды, но обычно коэф.вариации повторных трансфекций твердо составляет ниж 20 . Чтобы исключить предположение, что ингибирование активности -6, обеспеченное ингибирующей плазмидой 8, происходит исключительно благодаря ДНК-последовательности промотора 40, а не 7 4867 1 сочетанию последовательностей М 8 и 40, конструируют дополнительную ингибирующую плазмиду, и испытывают ее при анализе репортерного гена. Эта плазмида содержит в качестве инигибитора активности-6 только ДНК-последовательность 40, без последовательности М 8, а также люциферазного гена. Трансфекцию осуществляют 0,1 мкг репортерной плазмидной ДНК и молярным избытком ингибирующей плазмиды, как показано на фиг. 7. Общее количество трансфектированной ДНК поддерживают постоянным с помощью плазмиды-носителя. Трансфектированные клетки обрабатывают в течение 18 ч 1 нг/мл-6. Результаты, приведенные на фиг. 7, показывают, что эта ингибирующая плазмидадемонстрирует только частичное ингибирование активности -6, которое никогда не превышает 40 и не зависит от дозы. Это позволяет сделать вывод, что одной ДНК-последовательности 40 недостаточно для эффективного ингибирования активности -6. С другой стороны, содержащая люциферазу репортерная плазмида 2 содержит промоторную последовательность 40, но не содержит последовательность М 8, давая, таким образом, в результате, основной уровень экспрессии люциферазы, более не индуцируемый -6. В этой плазмиде основной уровень экспрессии люциферазы не ингибируется ингибирующей плазмидой 8, показывая, таким образом, что факторы транскрипции, которые специфически связываются только промоторной областью 40 2-, не удаляются эффективно ингибирующей плазмидой 8. В действительности,в присутствии последней ингибирующей плазмиды активность люциферазы из репортерной плазмиды 2 даже выше, чем в отсутствие указанной инигибирующей плазмиды (не показано). Пример 6. Игибирование 8 активности -6, предоставленной плазмидой репортерного гена . Авторы затем пожелали проверить ингибирующую плазмиду 8 при дополнительном анализе репортерного гена для -6, когда последовательность ДНК-мишени, опосредующей сигнал -6 в плазмиде репортерного гена, не вполне соответствует ингибирующей последовательности М 8. Поэтому клетки 2 трансфектируют плазмидой , которая содержит 841 пару оснований из промоторной последовательности гена человеческого гаптоглобина, фланкированную промотором 40 и люциферазным геном. В этой плазмиде присутствует один сайт АРЕ из гаптоглобиновой промоторной последовательности (согласно., . . ., 260 (11), . 6698-709,10, 1985). Авторы предварительно показали, что эта плазмида отвечает на -6 6-8-кратным увеличением экспрессии люциферазы (., сообщение на 12-ой Европейской конференции по иммунологии, Барселона, 14-17 июня 1994). Результаты одного из экспериментов при трехкратном повторе трансфекции приводятся на фиг. 8. После котрансфекции плазмиды репортерного генас 50-кратным молярным избытком плазмиды-носителя индуцибельность за счет -6 дает, в результате, экспрессию люциферазы в 4 раза выше основного уровня. Напротив, котрансфекция с 50-кратным молярным избытком ингибирующей плазмиды 8 полностью разрушает индуцибельность за счет -6. Следовательно, ингибирующая плазмида 8 способна ингибировать активность -6 также тогда, когда испытывают отвечающую на -6 плазмиду репортерного гена,отличающуюся от 8 (например, репортерную плазмиду ). Пример 7. Испытание ингибирующей плазмиды 8 в клетках 47. Ингибирующую плазмиду рМ 8 также испытывают при анализе репортерного гена 8, используя клетки рака молочной железы человека 47, где трансдукция сигнала -6 может быть иной, чем в клетках гепатомы. Как упоминалось ранее, анализ репортерного гена -6 с плазмидой репортерного гена 8 работает в этой клеточной линии, хотя он не оптимизирован. Так как чувствительность анализа с клетками 47 иногда ниже, трансфекцию осуществляют с 1 мкг позитивной плазмиды репортерного гена на 105 клеток, что является относительно высоким уровнем плазмидной ДНК. Поэтому в этом эксперименте наблюдают неспецифическое ингибирование в присутствии избытка плазмиды-носителя или инигибирующей плазмиды, приводящее, в результате, к более высокой изменчивости -6-специфического ингибирования. Результаты приводятся в табл. 2. Показаны средние (ср) и стандартные отклонения (ст.откл.) трехкратно повторенной трансфекции в двух экспериментах. Средние величины кратной индукции вычисляют из необработанных значений каждой трансфекции. В экспериментах 1 и 2 используют 1 и 0,5 мкг плазмиды репортерного гена, соответственно, на 105 трансфектированных клеток. В этих экспериментах осуществляют отдельную трансфекцию плазмиды-носителя и ингибируюшей плазмиды, причем обе плазмиды используют при указанном молярном избытке по отношению к репортерной плазмиде. После трансфекции клетки индуцируют в течение 18 ч 1 нг/мл -6. Приведенные величины светового излучения являются чос за период в 30 с. Специфическое ингибирование -6 в этих экспериментах оценивают путем сравнения индукции, полученной в присутствии избытка ингибируюшей плазмиды, и индукции,полученной в присутствии соответствующей дозы плазмиды-носителя. Кроме того, из-за неспецифического ингибирования основной уровень экспрессии люциферазы приближается к количественному пределу анализа. Результаты, приведенные в табл. 2 (см. эксперимент 1), показывают, что после трансфекции, повторенной трижды, релевантное специфическое ингибирование активности 8-6 получают при 20-кратном молярном избытке ингибирующей плазмиды 8, а не при 10-кратном молярном избытке. В этом эксперименте нельзя провести испытания при 50-кратном молярном избытке ингибирующей плазмиды, поскольку неспецифическое ингибирование становится слишком высоким. Эти результаты нельзя воспроизвести в дополнительном эксперименте, когда используют 0,5 мкг ДНК на 105 клеток (табл. 2, см. эксперимент 2). Причиной такого отсутствия воспроизводимости может быть относительно высокая изменчивость и низкая чувствительность анализа репортерного гена 47. С другой стороны, эти результаты может объяснить различная селективность клеток-мишеней. Пример 8. Определение минимальной ингибирующей последовательности ДНК. Чтобы идентифицировать минимальную ДНК-последовательность, которая сохраняет способность ингибировать связывание факторов транскрипции, релевантных для -6-индуцибельности, можно использовать экспериментальный подход анализа сдвига электрофоретической подвижности(по ). Испытание на функциональное ингибирование, сообщенное этой минимальной последовательностью, можно осуществить с использованием анализа репортерного гена, указанного в примере 3 и последующих примерах. Авторы показали, что минимальная ДНК-последовательность, которая функционально ингибирует активность -6 при анализе репортерного гена, является фрагментом-в 350 п.н. ингибирующей плазмиды 8, которая содержит 8-кратный повтор -ДНК-последовательности и ранней промоторной последовательности 40. Известно, что эта последняя последовательность содержит сайты связывания для общих факторов транскрипции, такие как АР-1-подобный сайт (как сообщают.,., 5(2),. 387-97, 1986), и 6-кратный повтор сайта -1 (как сообщают., , 35, . 79-87, 1983). Фрагмент ДНК-может быть удален из ее 5- и/или 3-концов с помощью обычных методов, таких какили обработка нуклеазой (по ), чтобы последовательность содержала, например, две последовательности и только один или несколько сайтов связывания для специфических факторов транскрипции из раннего промотора 40. Получающиеся в результате ДНК-последовательности можно использовать для испытаний на ингибирование при анализе репортерного гена на основе 8 в клетках 2. Кроме того, минимальный фрагмент ДНК, который сохраняет полную способность функционально ингибировать сигнал -6, может быть использован при , путем мечения этой ДНК 32 Р-нуклеотидом посредством обычных способов, таких как концевое мечение или вставка при реакциях Кленова. Получающийся в результате меченный ДНК-фрагмент можно инкубировать с нуклеарными экстрактами из клеток 2 после обработки -6. Увеличивающееся количество конкурирующей ДНК-последовательности также можно коинкубировать,как какой-нибудь из немеченных ДНК-фрагментов, который образовался в результате вышеуказанных делеций фрагмента ингибирующей ДНК- . После инкубации смесь можно подвергнуть электрофорезу в неденатурирующем геле. Связывание релевантных факторов транскрипции с испытываемым меченным фрагментом ДНК будет обнаруживаться по сдвигу в подвижности геля (замедлению), ожидаемому для несвязанной меченной ДНК. Ингибирование этого связывания в присутствии конкурирующих немеченных ДНК-последовательностей будет обнаруживаться по специфическому исчезновению сдвинутых полос в геле. Таблица 1 Анализ репортерного гена 2 для -6. Испытание ингибирующей плазмиды 8 против плазмиды репортерного гена 8. Молярный избыток ингибитора,крат 0 4867 1 Таблица 2 Анализ репортерного гена 47 для -6 Молярный избыток ингибитора или плазмиды-носителя Репортерная плазмида НАЗВАНИЕ ИЗОБРЕТЕНИЯ ИНГИБИТОР АКТИВНОСТИ -6(Б) ТИП нуклеиновая кислота 10 Национальный центр интеллектуальной собственности. 220072, г. Минск, проспект Ф. Скорины, 66. 13
МПК / Метки
МПК: C12N 15/11, A61P 37/00, C12N 15/63, A61K 48/00, A61P 35/00
Метки: ингибитор, активности
Код ссылки
<a href="https://by.patents.su/13-4867-ingibitor-aktivnosti-il-6.html" rel="bookmark" title="База патентов Беларуси">Ингибитор активности IL-6</a>
Предыдущий патент: Способ определения неисправностей в электрической сетии 6-10 кВ и устройство для его осуществления
Следующий патент: Передача
Случайный патент: Электростатическое зажимное устройство