Поливалентная инактивированная вирус-вакцина против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота
Номер патента: 10697
Опубликовано: 30.06.2008
Авторы: Капуцкий Федор Николаевич, Бойчук Сергей Викторович, Красочко Ирина Александровна, Машеро Владимир Александрович, Кабась Степан Степанович, Зубец Олег Владимирович, Герт Евгений Владимирович, Иванова Ирина Павловна, Торгашов Вадим Иванович, Красочко Петр Альбинович, Жих Глафира Иосифовна, Ковалев Николай Андреевич
Текст
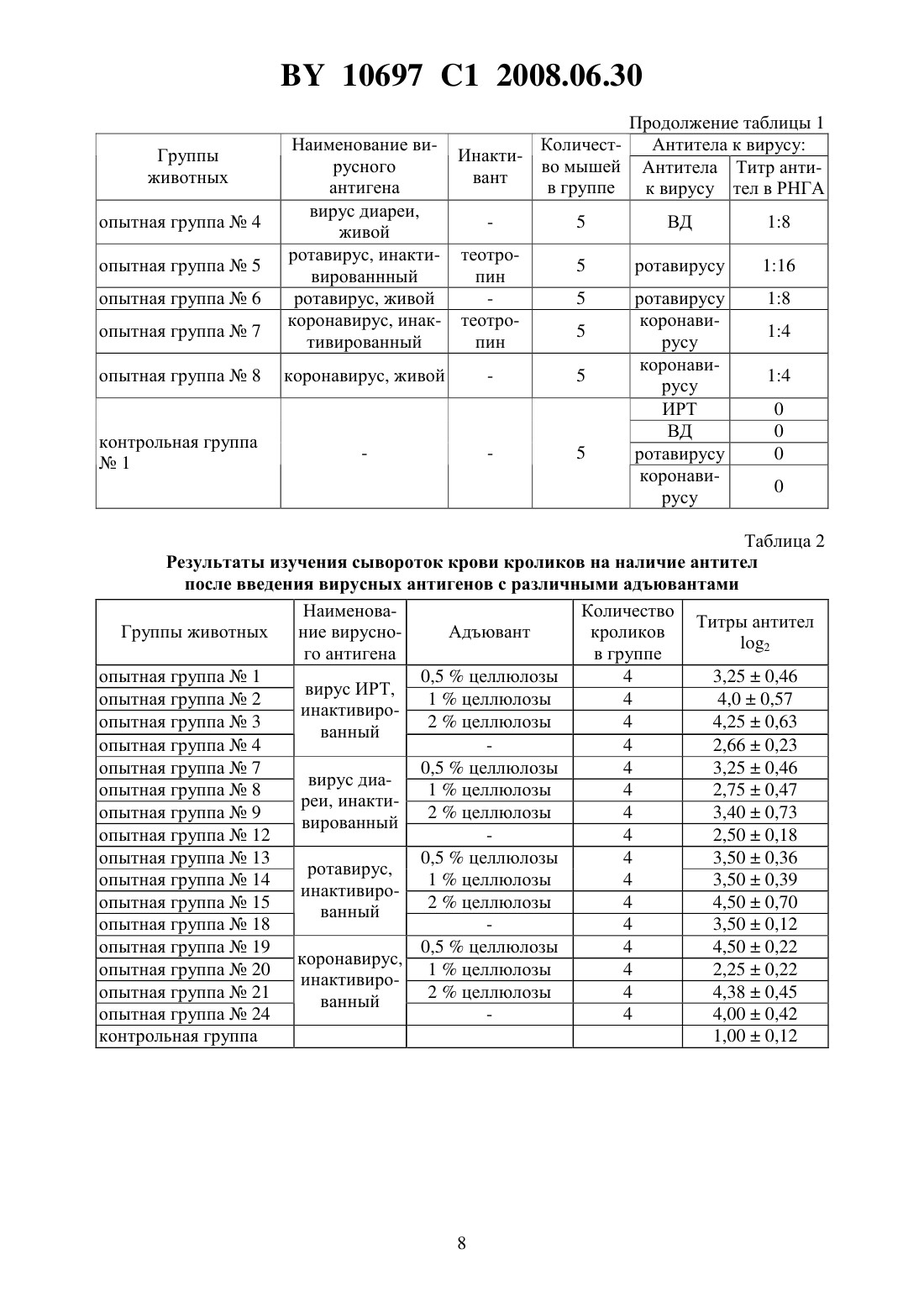
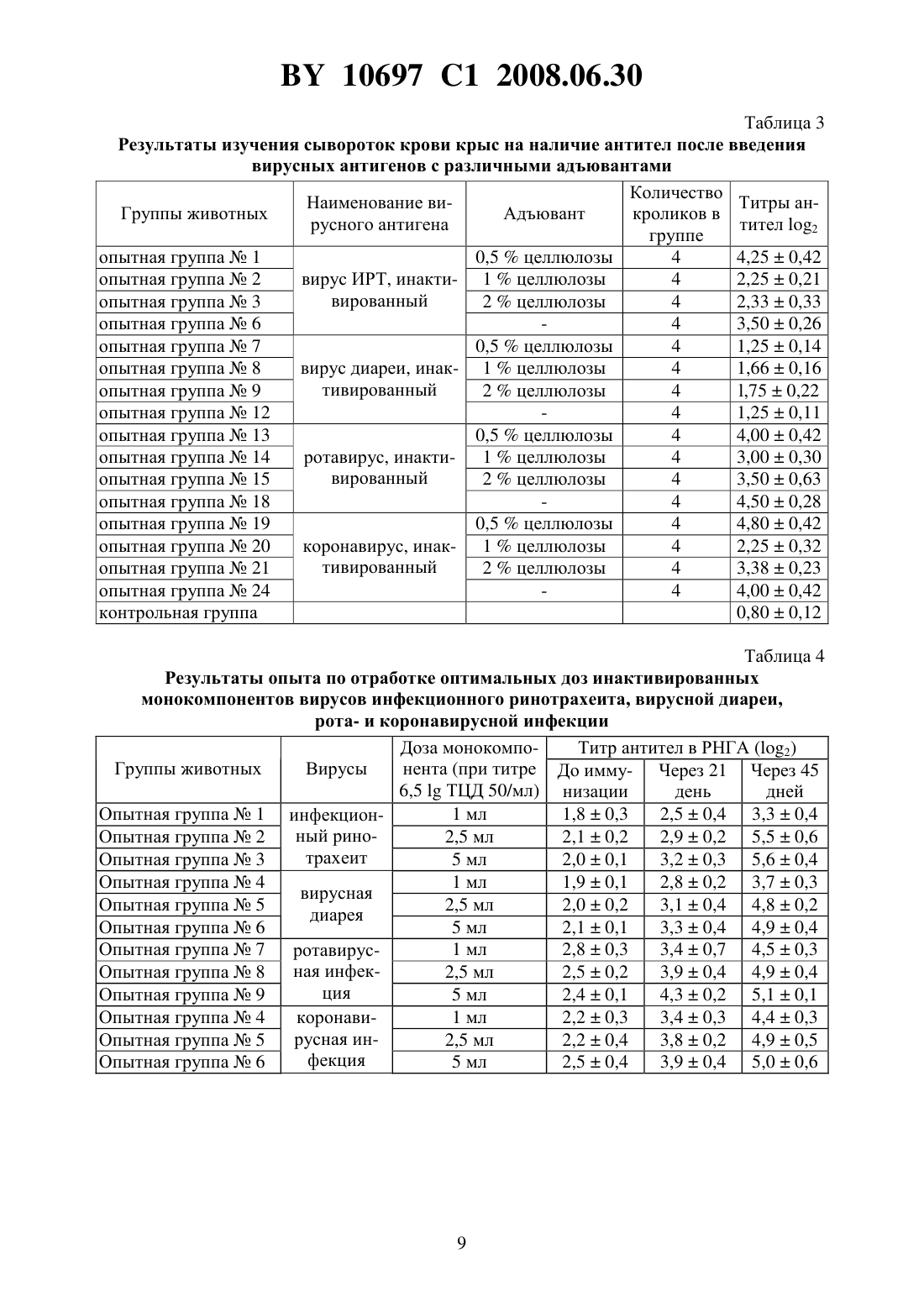
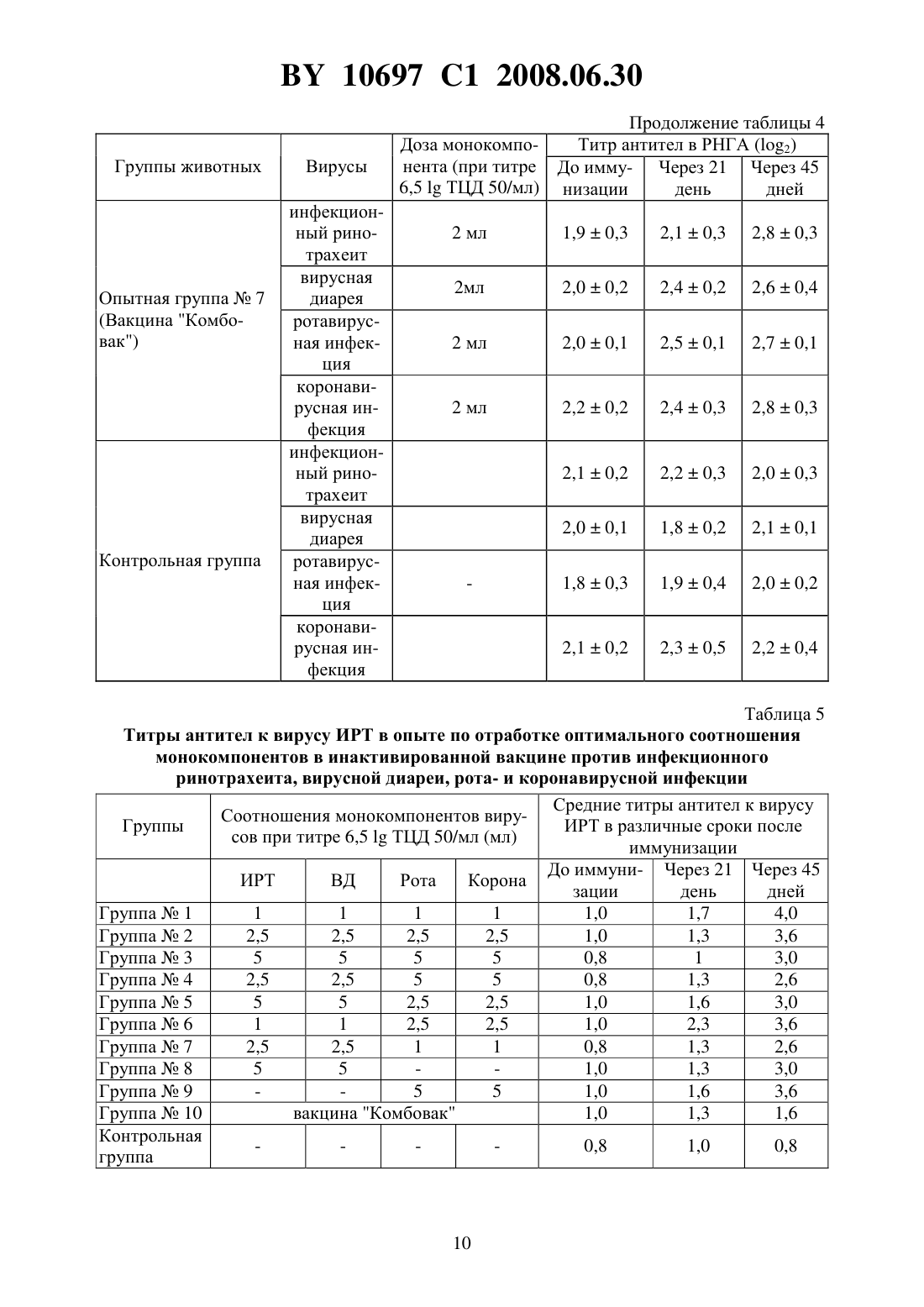
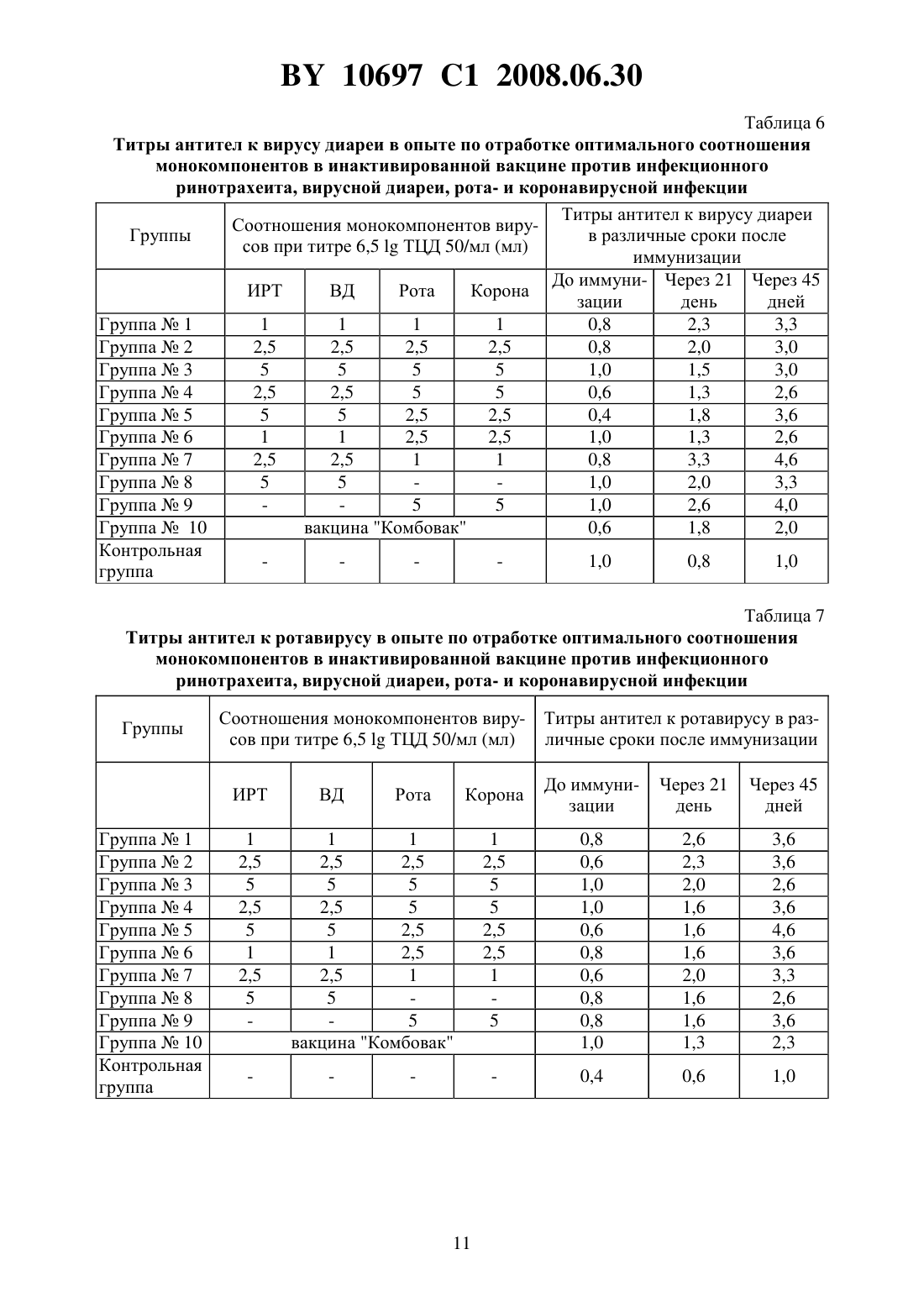
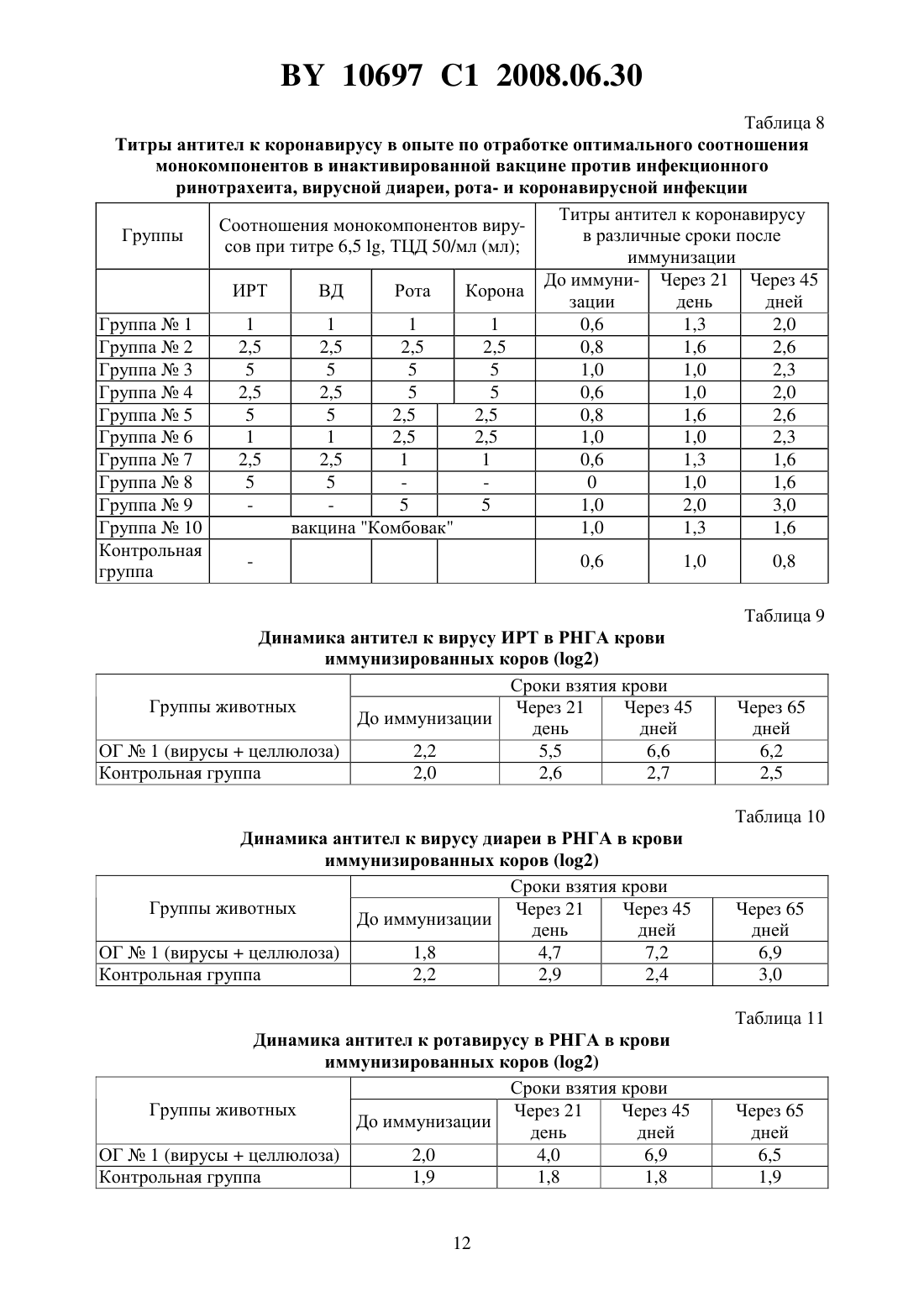
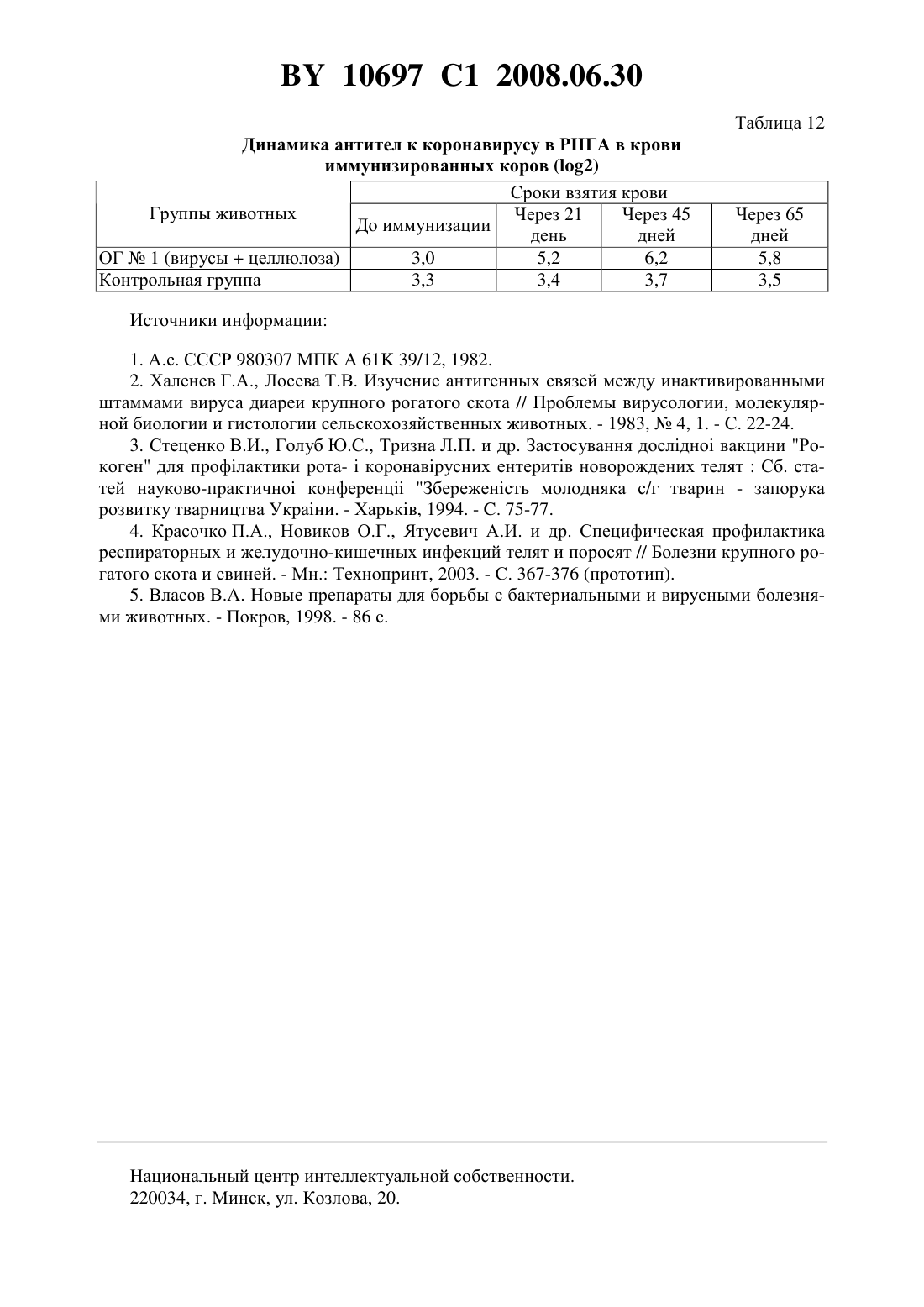
(51) МПК (2006) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ПОЛИВАЛЕНТНАЯ ИНАКТИВИРОВАННАЯ ВИРУС-ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА,ВИРУСНОЙ ДИАРЕИ, РОТА- И КОРОНАВИРУСНОЙ ИНФЕКЦИЙ КРУПНОГО РОГАТОГО СКОТА(71) Заявитель Республиканское научноисследовательское дочернее унитарное предприятие Институт экспериментальной ветеринарии имени С.Н. Вышелесского(72) Авторы Красочко Петр Альбинович Красочко Ирина Александровна Кабась Степан Степанович Жих Глафира Иосифовна Иванова Ирина Павловна Ковалев Николай Андреевич Машеро Владимир Александрович Бойчук Сергей Викторович Капуцкий Федор Николаевич Герт Евгений Владимирович Торгашов Вадим Иванович Зубец Олег Владимирович(73) Патентообладатель Республиканское научно-исследовательское дочернее унитарное предприятие Институт экспериментальной ветеринарии имени С.Н. Вышелесского(56) Красочко П.А. и др. Вакцины и иммунизация. Шестой международный форум по глобальной вакцинологии. Мн., 2003. - С. 39. Красочко П.А. и др. Международная научно-практическая конференция Современные вопросы патологии сельскохозяйственных животных. - Мн.,2003. - С. 157-159. Красочко П.А. и др. Международная научно-практическая конференция Современные вопросы патологии сельскохозяйственных животных. - Мн.,2003. - . 160-163.(57) Поливалентная инактивированная вирус-вакцина против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота, содержащая инактивированные 0,2 теотропином вируссодержащие жидкости штаммовКМИЭВ-6 с инфекционным титром 6,5 ТЦД 50/мл,КМИЭВ-7 с инфекционным титром 6,5 ТЦД 50/мл,КМИЭВ-3 с инфекционным титром 6,5 ТЦД 50/мл иКМИЭВ-1 с инфекционным титром 6,5 ТЦД 50/мл, взятые в соотношении 1111, и активированную целлюлозу в конечной концентрации 2 . Изобретение относится к ветеринарной вирусологии, в частности к области получения вакцин и может быть использовано в профилактике вирусных респираторных инфекций телят. Известны инактивированные моновалентные вакцины против инфекционного ринотрахеита 1, вирусной диареи 2 и двухвалентная вакцина против рота- и коронавирусной инфекций Рокоген 3 крупного рогатого скота, которые изготовлены из эпизоотических 10697 1 2008.06.30 штаммов вируса ИРТ - 4016, ВД - Орегон 24 , ротавируса - 238 и коронавируса ВС-1. Недостатками вышеуказанных вакцин является то, что для получения напряженного иммунитета против 4-х инфекций необходимо использовать 2-3 вакцины, применение которых для животных осуществляется в разные сроки, что затрудняет работу специалистов. Кроме того, в технологии изготовления вакцины используются эпизоотические штаммы вирусов, которые при неполной инактивации после применения чувствительным животным могут вызвать вспышку заболевания. Наиболее близкой к заявляемой является шестивалентная ин активированная вакцина против инфекционного ринотрахеита, вирусной диареи, парагриппа-3, респираторносинцитиальной, рот- и коронавирусной инфекций крупного рогатого скота, рекомендуемая для иммунизации стельных коров Комбовак 4. Однако основным недостатком данной вакцины является то, что при введении животным возникает большая антигенная нагрузка на организм. Кроме того, в состав инактивированной вакцины входят монокомпоненты вирусов парагриппа-3 и респираторносинцитиальной инфекций, которые не играют роли в возникновении вирусных энтеритов молодняка крупного рогатого скота. Для повышения иммуногенности вакцин используются адъюванты - гидроокись алюминия или алюмокалиевые квасцы 3. Однако эти препараты реактогенны, на месте инъекции образуется воспалительная гранулема, которая с одной стороны способствует медленному рассасыванию антигена, а с другой - ухудшает качество продукции из-за браковки места иньекции, а также из-за осложнения и образования на месте введения вакцины с адъювантов абсцессов. Задачей настоящего изобретения является разработка поливалентной инактивированной вирус-вакцины против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота. Поставленная задача достигается тем, что поливалентная инактивированная вирусвакцина против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота, содержащая инактивированные 0,2 теотропином вируссодержащие жидкости штаммовКМИЭВ-6 с инфекционным титром 6,5 ТЦД 50/мл,-штамм КМИЭВ-7 с инфекционным титром 6,5 ТЦД 50/мл,КМИЭВ-3 с инфекционным титром 6,5 ТЦД 50/мл иКМИЭВ-1 с инфекционным титром 6,5 ТЦД 50/мл, взятые в соотношении 1111, и активированную целлюлозу в конечной концентрации 2 . Пример 1. Для изготовления поливалентной инактивированной вирус-вакцины против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота используются аттенуированные штаммы вирусов инфекционного ринотрахеита КМИЭВ-6, вирусной диареи КМИЭВ 7, коронавируса КМИЭВ-1, ротавируса - КМИЭВ-3. Штамм вируса инфекционного ринотрахеита крупного рогатого скота получен Белорусским НИИЭВ им. С.Н. Вышелесского в 1991 г., адаптирован к новой клеточной системе перевиваемых клеток ПТ или МДБК, культивируемых на новых ростовой и поддерживающей средах - гемогидролизате. Штамму присвоен номер КМИЭВ-6. Штамм получен т теленка, больного бронхопневмонией путем выделения на первичной культуре клеток почки эмбриона коровы (ПЭК). Штамм хранится в музее культур микроорганизмов РНИУП ИЭВ им. С.Н. Вышелесского НАНБ. Штамм имеет следующие свойства. Культурально-морфологические свойства ДНК-содержащий вирус, вирионы диаметром 106-108 нм, чувствителен к действию эфира, хлороформа, трипсина. Устойчив к ко 2 10697 1 2008.06.30 лебаниям среды с величинойот 3,0 до 9,0. ЦПД наступает через 24-48 ч после инокуляции и характеризуется округлением клеток зернистостью, разрушением монослоя. Антигенная активность вирус вызывает образование антител у телят и кроликов при парентеральном введении. Безвредность непатогенен для телят и лабораторных животных. Штамм вируса инфекционного ринотрахеита крупного рогатого скота хранится в замороженном состоянии при температуре - 20 С и ниже или в лиофилизированном 4 С. Поддерживается методом субкультивирования на перевиваемой линии МДБК, П или первичной культуре клеток ПЭК. Для культивирования вируса используется питательная среда с 5 -ми гемогидролизата с добавлением 2 сыворотки крови крупного рогатого скота. Штамм вируса диареи крупною рогатого скота получен Белорусским НИИЭВ им. С.Н. Вышелесского в 1991 г., адаптирован к новой клеточной системе перевиваемых клеток ПТ или МДБК, культивируемых на новых ростовой и поддерживающей средах - гемогидролизате. Штамму присвоен номер КМИЭВ-7. Штамм получен от теленка, больного пневмоэнтеритами путем выделения на первичной культуре клеток почки эмбриона коровы (ПЭК). Штамм хранится в музее культур микроорганизмов РНИУП ИЭВ им. С.Н. Вышелесского НАНБ. Штамм имеет следующие свойства. Культурально-морфологические свойства РНК-содержащий вирус, вирионы диаметром 30-50 нм, чувствителен к действию эфира, хлороформа, колебаниям среды с величинойот 3,0 до 9,0. Наиболее устойчив при 7,4. ЦПД наступает через 24-48 ч после инокуляции и характеризуется округлением клеток зернистостью, разрушением монослоя. Антигенная активность вирус вызывает образование антител у телят и кроликов при парентеральном введении. Безвредность непатогенен для телят и лабораторных животных. Штамм вируса диареи крупного рогатого скота хранится в замороженном состоянии при температуре - 20 С и ниже или в лиофилизированном 4 С. Поддерживается методом субкультивирования на перевиваемой линии МДБК, ПТ или первичной культуре клеток ПЭК. Для культивирования вируса используется питательная среда с 5 гемогидролизата. Штамм коронавируса крупного рогатого скота получен Белорусским ПИИЭВ им. С.Н. Вышелесского в 1991 г., адаптирован к новой клеточной системе перевиваемых клеток ПТ или МДБК, культивируемых на новых ростовой и поддерживающей средах - гемогидролизате. Штамму присвоен номер КМИЭВ-1. Штамм получен от теленка, больного энтеритом путем выделения на первичной культуре клеток почки эмбриона коровы (ПЭК). Штамм хранится в музее культур микроорганизмов РНИУП ИЭВ им. С.Н. Вышелесского НАНБ. Штамм имеет следующие свойства. Культурально-морфологические свойства РНК-содержащий вирус, вирионы диаметром 100-140 нм, чувствителен к действию эфира, хлороформа, колебаниям среды с величинойот 3,0 до 9,0. На поверхности имеет выступы. Наиболее устойчив при 6,8-7,5. ЦПД наступает через 48-72 ч после инокуляции. Титр вируса - 6,5 ТЦД 50/мл. Антигенная активность вирус вызывает образование вируснейтрализующих антител у телят и кроликов при парентеральном введении. Безвредность непатогенен для телят и лабораторных животных. Штамм коронавируса крупного рогатого скота хранится в замороженном состоянии при температуре - 20 С и ниже или в лиофилизированном -4 С. Поддерживается методом субкультивирования на перевиваемой линии МДБК, ПТ или первичной культуре кле 3 10697 1 2008.06.30 ток ПЭК. Для культивирования вируса используется питательная среда с 5 гемогидролизата. Штамм ротавируса крупного рогатого скота получен Белорусским НИИЭВ им. С.Н. Вышелесского в 1984 г., адаптирован к новой клеточной системе перевиваемых клеток ПТ или МДБК, культивируемых на новых ростовой и поддерживающей средах - гемогидролизате. Штамму присвоен номер КМИЭВ-3. Штамм получен от теленка, больного энтеритом путем выделения на первичной культуре клеток почки эмбриона коровы (ПЭК). Штамм хранится в музее культур микроорганизмов РНИУП ИЭВ им. С.Н. Вышелесского НАНБ. Штамм имеет следующие свойства. Культурально-морфологические свойства РНК-содержащий вирус, вирионы диаметром 66 нм, чувствителен к действию эфира, хлороформа, колебаниям среды с величинойот 3,0 до 9,0. На поверхности имеет выступы. Наиболее устойчив при 6,8-7,5. ЦПД наступает через 48-72 ч после инокуляции. Тит вируса - 6,5 ТЦД 50/мл. Антигенная активность вирус вызывает образование вируснейтрализующих антител у телят и кроликов при парентеральном введении. Безвредность непатогенен для телят и лабораторных животных. Штамм ротавируса крупного рогатого скота хранится в замороженном состоянии при температуре - 20 С и ниже или в лиофилизированном -4 С. Поддерживается методом субкультивирования на перевиваемой линии МДБК, ПТ или первичной культуре клеток ПЭК. Для культивирования вируса используется питательная среда с 5 гемогидролизата. В качестве инактиванта вирусов используется теотропин. Теотропин-1,8,3,6-диэндометилен-1,3,6,8-тетраазациклодекан, представляет собой порошок белого или желтоватобелого цвета, кисловатого вкуса, без запаха, хорошо растворим в воде, спирте, хлороформе, не растворим в эфире, не летуч. Водные растворы стойкие, при комнатной температуре (18-20 С) сохраняют свое действие в течение 4-х месяцев. Теотропин обладает широким спектром вирусоцидного и бактерицидного действия в отношении грамотрицательных, грамположительных бактерий, включая споровые формы и микоплазмы. Инактивационная активность теотропина обусловлена его способностью проникать в бактериальные клетки и вирусы, взаимодействовать с аминогруппами пуриновых и пиримидиновых оснований нуклеиновых кислот, блокируя их матричную - генетическую функцию. По уровню острой токсичности для теплокровных животных теотропин относится к малотоксичным соединениям ( класс опасности по ГТ 12.1.007-76). Препарат не обладает кумулятивным и кожно-резорбтивными свойствами. В качестве адьюванта используется суспензия окисленной микрокристаллической целлюлозы, представляющей собой тонкодисперсный белый порошок с содержанием карбоксильных групп 3,0-4,0 , карбонильных групп 1,5-1,7 , альдегидных групп 0,1-0,2 ,связанного нитроэфирного азота 0,2 , зольностью 0,2 , растворимостью в 0,1 растворе щелочи до 100 , растворимостью в воде при 20 С до 10 , температурой начала разложения от 165 С. Пример 2. Накопление вируссодержащей жидкости вирусов инфекционного ринотрахеита, вирусной диареи и коронавируса крупного рогатого скота проводят на культуре перевиваемых клеток МДБК, выращенной на питательной среде - 5 гемогидролизате с добавлением 10 сыворотки крови крупного рогатого скота. Заражение клеточного монослоя производят путем внесения расплодки маточной культуры вирусов не более 15 пассажа. При этом вирусы инфекционного ринотрахеита, диареи и коронавирус крупного рогатого скота культивируют отдельно. После 1,5-2-х часового контакта вносят под 4 10697 1 2008.06.30 держивающую среду - 5 гемогидролизат. ЦПД вирусов проявляется через 24-48 ч. После поражения свыше 75 клеток на матрасах с зараженным монослоем их подвергают замораживанию с последующим титрованием. Ротавирус крупного рогатого скота накапливают на культуре клеток почки свиньи - СПЭВ по вышеописанной методике. Пример 3. Инактивация вакцинных штаммов - компонентов инактивированной поливалентной вакцины против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота проведена с использованием инактиванта теотропина в различных концентрациях. Для отработки режимов инактивации вирусов использованы различные разведения препаратов (от 0,1 до 0,5 ) путем их добавления в заранее оттитрованную вируссодержащую жидкость. После контакта вирусов с инактивантами в течение 24, 48, 72, 96 и 120 ч была проверена полнота инактивации вирусов на культуре клеток. Для работы использованы следующие вирусы с инфекционной активностью вирус инфекционного ринотрахеита (штамм КМИЭВ-6) при титре 6,5 ТЦД 50/мл, вирус диареи(штамм КМИЭВ-7) при титре 6,5 ТЦД 50/мл, ротавирус (штамм КМИЭВ-3) при титре 6,5 ТЦД 50/мл, коронавирус (штамм КМИЭВ-1) при титре 6,5 ТЦД 50/мл. При изучении влияния теотропина на культуры клеток МДБК и СПЭВ установлено,что добавление на монослой теотропина в концентрации свыше 0,2 ведет к дегенерации монослоя культуры клеток. При инактивации вируса инфекционного ринотрахеита с использованием теотропина оптимальной оказалась его 0,15 концентрация в течение 24 ч, вируса диареи - 0,1 концентрация в течение 24 ч, ротавируса - 0,2 концентрация в течение 48 ч, коронавируса - 0,1 концентрация в течение 24 ч. Пример 4. Для изучения антигенной активности инактивированных и неинактивированных штаммов - компонентов поливалентной вакцины исследования проводились на лабораторных животных - белых мышах. При этом было сформировано 10 групп белых мышей по 5 голов в группе. Каждой опытной группе мышей вводились вирусы в соответствии со схемой опыта. После проверки каждого из вирусных антигенов через 21 день после их введения мыши были тотально обескровлены и в сыворотках крови был проверен титр противовирусных антител в РНГА. В табл. 1 представлены результаты изучения титров противовирусных антител у мышей при отработке оптимального метода инактивации вирусов. Полученные результаты исследований показали, что после введения инактивированных теотропином вирусов у животных титр противовирусных антител не снижается по сравнению с животными, получавшими те же дозы неинактивированных вирусов. Пример 5. Для изучения иммунного ответа у лабораторных животных на введение им инактивированных вакцинных штаммов с различными адъювантами исследования был использован адъювант - суспензия мелкокристаллической активированной целлюлозы. Целлюлоза была использована в количестве 0,5 1 и 2 от количества антигена. Для проведения исследований было использовано 25 групп кроликов, 25 групп белых крыс по 4 головы в группе. У кроликов и крыс была взята кровь до введения вирусных антигенов с адъюантами и через 21 день после введения. В сыворотках крови будет проверен титр противовирусных антител в РНГА. После внутримышечного введения животным смеси инактивированного вируса и различных адъювантов получены следующие результаты (табл. 2 и 3). На основании проведенных результатов изучения гуморального иммунитета после введения кроликам и крысам инактивированных вирусов инфекционного ринотрахеита, 5 10697 1 2008.06.30 вирусной диареи, рота- и коронавирусов крупного рогатого установлено, что наиболее оптимальным адъювантом является 1 и 2 суспензия целлюлозы. Пример 6. Для отработки оптимальных доз монокомпонентов вирусов инфекцинного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекции, используемых для конструирования инактивированной поливалентной вакцины исследования проведены на коровах. На ферме крупного рогатого скота было сформировано 13 групп животных по 10 голов в группе. Опытным животным каждый монокомпонент (инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусы) поливалентной вакцины вводился по 1, 2,5 и 5,0 мл при инфекционном титре каждого монокомпонента 6,5 ТЦД 50/мл двукратно с интервалом в 21 день. В качестве контроля использовалась вакцина Комбовак производства НПО Нарвак. За коровами проводили наблюдение на протяжении опыта. Для исследования поствакцинального иммунитета брали кровь до иммунизации, через 21 и 45 дней после иммунизации. В крови у коров изучался титр противовирусных антител в РНГА. В результате исследований установлено, что у опытных животных после введения монокомпонентов вакцины отмечался выраженный биосинтез противовирусных антител. Результаты проведенных исследований представлены в табл. 4. Представленные данные показывают, что оптимальной дозой монокомпонентов при инфекционном титре 6,5 ТЦД 50/мл является 2,5-5 мл на корову. Это дает максимальное возрастание титров антител после введения монокомпонентов вакцины. Для отработки оптимального соотношения монокомпонентов вирусов инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекции для конструирования инактивированной поливалентной вакцины исследования проведены на коровах. За основу были взяты монокомпоненты с инфекционным титром 6,5 ТЦД 50/мл. Для этого было сформировано 11 групп животных по 10 голов в группе. Коровам 1-й опытной группы вводили по 4 мл инактивированных монокомнонентов вирусов в следующих соотношениях вирус ИРТ - 1 мл, вирус диареи - 1 мл, ротавирус - 1 мл, коронавирус - 1 мл коровам 2-й опытной группы по 10 мл (соответственно по 2,5 мл каждого монокомпонента), коровам 3-й группы - по 20 мл (соответственно по 5 мл) коровам 4-й группы - по 15 мл (ИРТ и ВД по 5 мл, рота- и коронавирусов - по 2,5 мл) 5-й группы - по 15 мл (ИРТ и ВД по 2,5 мл, рота- и коронавирусов - по 5 мл) 6-й группы - 7 мл (ИРТ и ВД по 1 мл, рота- и коронавирусов - по 2,5 мл) 7-й группы - 7 мл (ИРТ и ВД по 2,5 мл, рота- и коронавирусов по 1 мл) 8-й группы по 10 мл (ИРТ и ВД по 5 мл) 9-й группы - по 10 мл (рота- и коронавирусов - по 5 мл) 10-й группы - по 2 мл вакцины Комбовак (производство НПО Нарвак) и 11-я группа-контроль. Опытным животным вводили различные соотношения монокомпонентов образца поливалентной вакцины двукратно с интервалом в 21 день. За животными было проведено наблюдение в течение всего опыта. У коров была взята кровь до иммунизации и через 21 день после иммунизации. В результате наблюдений за коровами после обработки различными дозами и соотношениями монокомпонентов образца поливалентной вакцины изменений в клиническом состоянии животных не установлено. Аппетит сохранен, продуктивность коров не снизилась. На месте введения компонентов болезненности и воспалительной реакции не было установлено. В табл. 5-8 представлены результаты опыта по отработке оптимального соотношения монокомпонентов в инактивированной вакцине против инфекционного ринотрахеита,вирусной диареи, рота- и коронавирусной инфекции. Из представленных в таблицах данных видно, что при введении коровам монокомпонентов с инфекционным титром 6,5 ТЦД 50/мл в дозе 2,5-5 мл в различных комбинациях отмечается максимальная выработка антител ко всем изучаемым вирусам. 10697 1 2008.06.30 Пример 7. Иммунизация стельных коров поливалентной инактивированной вирус-вакцины против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота сопровождается перестройкой иммунной системы организма животных. Для этого были проведены исследования по изучению биосинтеза противовирусных антител у иммунизированных коров. В опыт было взято 20 коров, которых разделили на 2 группы по 10 голов в группе. Коров опытной группы 1 обработали экспериментальным образцом поливалентной вакцины (инактивант - 0,2 раствор теотропина, адъювант - 2 суспензия целлюлозы) внутримышечно в области крупа в дозе 10 мл на голову двукратно с интервалом 21 день. Контрольным коровам вводилось по 10 мл стерильного изотонического раствора натрия хлорида. За обработанными животными было проведено клиническое наблюдение в течение 65 дней. Для контроля биосинтеза противовирусных антител от опытных и контрольных животных была взята кровь до иммунизации, через 21, 45 и 65 дней. В табл. 9-12 представлены результаты изучения динамики антител к вирусам ИРТ, ВД,рота- и коронавирусам у иммунизированных коров. Из представленных данных видно, что иммунизация коров вакцинами с различными адъювантами ведет к активизации выработки противовирусных антител. Через 45 дней после иммунизации отмечается увеличение титров антител ко всем возбудителям на 2,53,5 2, что свидетельствует об активном биосинтезе антител у иммунизированных коров. У контрольных животных отмечаются незначительные колебания уровня антител. Пример 8. Для испытания эффективности поливалентной инактивированной вакцины против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота исследования проводились на стельных коровах. Для проведения исследований было отобрано 75 стельных коров, из которых сформировано 2 группы. Коров опытной группы 1 в количестве 40 голов иммунизировали двукратно инактивированной вакциной против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота в дозе 10 мл внутримышечно с интервалом в 21 день. Коров вакцинировали за 2 месяца до отела. Коровы контрольной группы в количестве 30 голов не были вакцинированы. Показателем эффективности вакцины служило снижение заболеваемости новорожденных телят пневмоэнтеритами. Обработка коров вакциной показала, что это безвредный и нереактогенный биологический препарат. У коров опытной и контрольной групп абортов и мертворожденных телят не было отмечено. При наблюдении за новорожденными телятами были получены следующие результаты. От коров опытной группы было получено 40 телят, от контрольной группы 30 телят. В группе телят, полученных т иммунизированных коров заболело энтеритами 2 головы (5,0 ), тогда как в группе телят от неиммунизированных коров заболело 16 голов (53,3 ). Таблица 1 Результаты изучения титров противовирусных антител у мышей при отработке оптимального метода инактивации вирусов Антитела к вирусу КоличестНаименование ви- ИнактиГруппы животных во мышей Антитела Титр антирусного антигена вант в группе к вирусу тел в РНГА вирус ИРТ, инакти- теотроопытная группа 1 5 ИРТ 132 вированный пин опытная группа 2 вирус И, живой 5 ИРТ 18 вирус диареи, инак- теотроопытная группа 3 5 ВД 18 тивированный пин 7 10697 1 2008.06.30 Группы животных опытная группа 4 опытная группа 5 опытная группа 6 опытная группа 7 опытная группа 8 контрольная группа 1 Наименование вирусного антигена вирус диареи,живой ротавирус, инактивированнный ротавирус, живой коронавирус, инактивированный Продолжение таблицы 1 Антитела к вирусу КоличестИнактиво мышей Антитела Титр антивант в группе к вирусу тел в РНГА теотропин теотропин ротавирусу коронавирусу коронавирусу ИРТ ВД ротавирусу коронавирусу Таблица 2 Результаты изучения сывороток крови кроликов на наличие антител после введения вирусных антигенов с различными адъювантами НаименоваКоличество Титры антител Группы животных ние вирусноАдъювант кроликов 2 го антигена в группе опытная группа 1 0,5 целлюлозы 4 3,250,46 вирус ИРТ,опытная группа 2 1 целлюлозы 4 4,00,57 инактивироопытная группа 3 2 целлюлозы 4 4,250,63 ванный опытная группа 4 4 2,660,23 опытная группа 7 0,5 целлюлозы 4 3,250,46 вирус диаопытная группа 8 1 целлюлозы 4 2,750,47 реи, инактиопытная группа 9 2 целлюлозы 4 3,400,73 вированный опытная группа 12 4 2,500,18 опытная группа 13 0,5 целлюлозы 4 3,500,36 ротавирус,опытная группа 14 1 целлюлозы 4 3,500,39 инактивироопытная группа 15 2 целлюлозы 4 4,500,70 ванный опытная группа 18 4 3,500,12 опытная группа 19 0,5 целлюлозы 4 4,500,22 коронавирус,опытная группа 20 1 целлюлозы 4 2,250,22 инактивироопытная группа 21 2 целлюлозы 4 4,380,45 ванный опытная группа 24 4 4,000,42 контрольная группа 1,000,12 10697 1 2008.06.30 Таблица 3 Результаты изучения сывороток крови крыс на наличие антител после введения вирусных антигенов с различными адъювантами Количество Наименование виТитры анГруппы животных Адъювант кроликов в русного антигена тител 2 группе опытная группа 1 0,5 целлюлозы 4 4,250,42 опытная группа 2 вирус ИРТ, инакти- 1 целлюлозы 4 2,250,21 вированный опытная группа 3 2 целлюлозы 4 2,330,33 опытная группа 6 4 3,500,26 опытная группа 7 0,5 целлюлозы 4 1,250,14 вирус диареи, инак- 1 целлюлозы опытная группа 8 4 1,660,16 тивированный опытная группа 9 2 целлюлозы 4,750,22 опытная группа 12 4 1,250,11 опытная группа 13 0,5 целлюлозы 4 4,000,42 опытная группа 14 ротавирус, инакти- 1 целлюлозы 4 3,000,30 вированный опытная группа 15 2 целлюлозы 4 3,500,63 опытная группа 18 4 4,500,28 опытная группа 19 0,5 целлюлозы 4 4,800,42 опытная группа 20 коронавирус, инак- 1 целлюлозы 4 2,250,32 тивированный опытная группа 21 2 целлюлозы 4 3,380,23 опытная группа 24 4 4,000,42 контрольная группа 0,800,12 Таблица 4 Результаты опыта по отработке оптимальных доз инактивированных монокомпонентов вирусов инфекционного ринотрахеита, вирусной диареи,рота- и коронавирусной инфекции Доза монокомпоТитр антител в РНГА (2) Группы животных Вирусы нента (при титре До имму- Через 21 Через 45 6,5 ТЦД 50/мл) низации день дней Опытная группа 1 инфекцион 1 мл 1,80,3 2,50,4 3,30,4 ный риноОпытная группа 2 2,5 мл 2,10,2 2,90,2 5,50,6 трахеит Опытная группа 3 5 мл 2,00,1 3,20,3 5,60,4 Опытная группа 4 1 мл 1,90,1 2,80,2 3,70,3 вирусная Опытная группа 5 2,5 мл 2,00,2 3,10,4 4,80,2 диарея Опытная группа 6 5 мл 2,10,1 3,30,4 4,90,4 Опытная группа 7 1 мл 2,80,3 3,40,7 4,50,3 ротавирусная инфекОпытная группа 8 2,5 мл 2,50,2 3,90,4 4,90,4 ция Опытная группа 9 5 мл 2,40,1 4,30,2 5,10,1 Опытная группа 4 1 мл 2,20,3 3,40,3 4,40,3 коронавирусная инОпытная группа 5 2,5 мл 2,20,4 3,80,2 4,90,5 фекция Опытная группа 6 5 мл 2,50,4 3,90,4 5,00,6 Вирусы инфекционный ринотрахеит вирусная диарея ротавирусная инфекция коронавирусная инфекция инфекционный ринотрахеит вирусная диарея ротавирусная инфекция коронавирусная инфекция Продолжение таблицы 4 Доза монокомпоТитр антител в РНГА (2) нента (при титре До имму- Через 21 Через 45 6,5 ТЦД 50/мл) низации день дней 2 мл Таблица 5 Титры антител к вирусу ИРТ в опыте по отработке оптимального соотношения монокомпонентов в инактивированной вакцине против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекции Средние титры антител к вирусу Соотношения монокомпонентов вируГруппы ИРТ в различные сроки после сов при титре 6,5 ТЦД 50/мл (мл) иммунизации До иммуни- Через 21 Через 45 ИРТ ВД Рота Корона зации день дней Группа 1 1 1 1 1 1,0 1,7 4,0 Группа 2 2,5 2,5 2,5 2,5 1,0 1,3 3,6 Группа 3 5 5 5 5 0,8 1 3,0 Группа 4 2,5 2,5 5 5 0,8 1,3 2,6 Группа 5 5 5 2,5 2,5 1,0 1,6 3,0 Группа 6 1 1 2,5 2,5 1,0 2,3 3,6 Группа 7 2,5 2,5 1 1 0,8 1,3 2,6 Группа 8 5 5 1,0 1,3 3,0 Группа 9 5 5 1,0 1,6 3,6 Группа 10 вакцина Комбовак 1,0 1,3 1,6 Контрольная 0,8 1,0 0,8 группа 10697 1 2008.06.30 Таблица 6 Титры антител к вирусу диареи в опыте по отработке оптимального соотношения монокомпонентов в инактивированной вакцине против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекции Титры антител к вирусу диареи Соотношения монокомпонентов вируГруппы в различные сроки после сов при титре 6,5 ТЦД 50/мл (мл) иммунизации До иммуни- Через 21 Через 45 ИРТ ВД Рота Корона зации день дней Группа 1 1 1 1 1 0,8 2,3 3,3 Группа 2 2,5 2,5 2,5 2,5 0,8 2,0 3,0 Группа 3 5 5 5 5 1,0 1,5 3,0 Группа 4 2,5 2,5 5 5 0,6 1,3 2,6 Группа 5 5 5 2,5 2,5 0,4 1,8 3,6 Группа 6 1 1 2,5 2,5 1,0 1,3 2,6 Группа 7 2,5 2,5 1 1 0,8 3,3 4,6 Группа 8 5 5 1,0 2,0 3,3 Группа 9 5 5 1,0 2,6 4,0 Группа 10 вакцина Комбовак 0,6 1,8 2,0 Контрольная 1,0 0,8 1,0 группа Таблица 7 Титры антител к ротавирусу в опыте по отработке оптимального соотношения монокомпонентов в инактивированной вакцине против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекции Группы Соотношения монокомпонентов виру- Титры антител к ротавирусу в разсов при титре 6,5 ТЦД 50/мл (мл) личные сроки после иммунизации ИРТ 10697 1 2008.06.30 Таблица 8 Титры антител к коронавирусу в опыте по отработке оптимального соотношения монокомпонентов в инактивированной вакцине против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекции Титры антител к коронавирусу Соотношения монокомпонентов вируГруппы в различные сроки после сов при титре 6,5 , ТЦД 50/мл (мл) иммунизации До иммуни- Через 21 Через 45 ИРТ ВД Рота Корона зации день дней Группа 1 1 1 1 1 0,6 1,3 2,0 Группа 2 2,5 2,5 2,5 2,5 0,8 1,6 2,6 Группа 3 5 5 5 5 1,0 1,0 2,3 Группа 4 2,5 2,5 5 5 0,6 1,0 2,0 Группа 5 5 5 2,5 2,5 0,8 1,6 2,6 Группа 6 1 1 2,5 2,5 1,0 1,0 2,3 Группа 7 2,5 2,5 1 1 0,6 1,3 1,6 Группа 8 5 5 0 1,0 1,6 Группа 9 5 5 1,0 2,0 3,0 Группа 10 вакцина Комбовак 1,0 1,3 1,6 Контрольная 0,6 1,0 0,8 группа Таблица 9 Динамика антител к вирусу ИРТ в РНГА крови иммунизированных коров (2) Сроки взятия крови Группы животных Через 21 Через 45 До иммунизации день дней ОГ 1 (вирусыцеллюлоза) 2,2 5,5 6,6 Контрольная группа 2,0 2,6 2,7 Динамика антител к вирусу диареи в РНГА в крови иммунизированных коров (2) Сроки взятия крови Группы животных Через 21 Через 45 До иммунизации день дней ОГ 1 (вирусыцеллюлоза) 1,8 4,7 7,2 Контрольная группа 2,2 2,9 2,4 Динамика антител к ротавирусу в РНГА в крови иммунизированных коров (2) Сроки взятия крови Группы животных Через 21 Через 45 До иммунизации день дней ОГ 1 (вирусыцеллюлоза) 2,0 4,0 6,9 Контрольная группа 1,9 1,8 1,8 10697 1 2008.06.30 Таблица 12 Динамика антител к коронавирусу в РНГА в крови иммунизированных коров (2) Сроки взятия крови Группы животных Через 21 Через 45 До иммунизации день дней ОГ 1 (вирусыцеллюлоза) 3,0 5,2 6,2 Контрольная группа 3,3 3,4 3,7 Источники информации 1. А.с. СССР 980307 МПК А 61 39/12, 1982. 2. Халенев Г.А., Лосева Т.В. Изучение антигенных связей между инактивированными штаммами вируса диареи крупного рогатого скота // Проблемы вирусологии, молекулярной биологии и гистологии сельскохозяйственных животных. - 1983,4, 1. - С. 22-24. 3. Стеценко В.И., Голуб Ю.С., Тризна Л.П. и др. Застосування дослдно вакцини Рокоген для профлактики рота-коронаврусних ентеритв новорождених телятСб. статей науково-практично конференц Збереженсть молодняка с/г тварин - запорука розвитку тварництва Украни. - Харькв, 1994. - . 75-77. 4. Красочко П.А., Новиков О.Г., Ятусевич А.И. и др. Специфическая профилактика респираторных и желудочно-кишечных инфекций телят и поросят // Болезни крупного рогатого скота и свиней. - Мн. Технопринт, 2003. - С. 367-376 (прототип). 5. Власов В.А. Новые препараты для борьбы с бактериальными и вирусными болезнями животных. - Покров, 1998. - 86 с. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 13
МПК / Метки
МПК: A61K 39/295
Метки: против, рота, инфекционного, вирусной, коронавирусной, поливалентная, рогатого, инфекций, крупного, ринотрахеита, вирус-вакцина, инактивированная, диареи, скота
Код ссылки
<a href="https://by.patents.su/13-10697-polivalentnaya-inaktivirovannaya-virus-vakcina-protiv-infekcionnogo-rinotraheita-virusnojj-diarei-rota-i-koronavirusnojj-infekcijj-krupnogo-rogatogo-skota.html" rel="bookmark" title="База патентов Беларуси">Поливалентная инактивированная вирус-вакцина против инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота</a>
Следующий патент: Способ литья заготовки
Случайный патент: Сумматор унитарных кодов по модулю семь