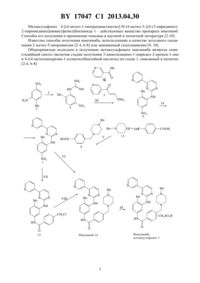
Способ получения метансульфоната 4-[(4-метил-1-пиперазинил)метил]-N-[4-метил-3-{[4-(3-пиридинил)-2-пиримидинил]амино}фенил]бензамида
Номер патента: 17047
Опубликовано: 30.04.2013
Авторы: Игнатович Жанна Владимировна, Фарина Александр Васильевич, Гусак Клавдия Николаевна, Королева Елена Вадимовна, Агабеков Владимир Енокович, Ермолинская Анастасия Леонидовна, Кадуцкий Алексей Петрович, Калиниченко Елена Николаевна, Бей Максим Петрович, Гапанович Владимир Николаевич
Текст
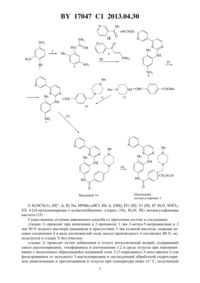
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СПОСОБ ПОЛУЧЕНИЯ МЕТАНСУЛЬФОНАТА 4-(4-МЕТИЛ-1 ПИПЕРАЗИНИЛ)МЕТИЛ 4-МЕТИЛ-3-4-(3-ПИРИДИНИЛ)-2 ПИРИМИДИНИЛАМИНОФЕНИЛБЕНЗАМИДА(71) Заявители Государственное научное учреждение Институт химии новых материалов Национальной академии наук Беларуси Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(72) Авторы Королева Елена Вадимовна Гапанович Владимир Николаевич Агабеков Владимир Енокович Игнатович Жанна Владимировна Гусак Клавдия Николаевна Ермолинская Анастасия Леонидовна Бей Максим Петрович Кадуцкий Алексей Петрович Калиниченко Елена Николаевна Фарина Александр Васильевич(73) Патентообладатели Государственное научное учреждение Институт химии новых материалов Национальной академии наук Беларуси Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(57) Способ получения метансульфоната 4-(4-метил-1-пиперазинил)метил 4-метил-34-(3-пиридинил)-2-пиримидиниламинофенилбензамида 1 17047 1 2013.04.30 1) 2-метил-5-нитроанилин подвергают взаимодействию с цианамидом при кипячении в 2-пропаноле в присутствии соляной кислоты, полученный гидрохлорид 2-метил-5 нитрофенилгуанидина путем добавления азотной кислоты переводят в 2-метил-5 нитрофенилгуанидин нитрат 2) в толуол, содержащий металлический натрий, при перемешивании добавляют смесь 3-ацетилпиридина и этилформиата в среде толуола, промежуточно образующуюся натриевую соль 3-(3-пиридинил)-3-онпропен-2-ола отфильтровывают и обрабатывают в толуоле гидрохлоридом диметиламина и триэтиламином при температуре ниже 5 С с образованием 3-диметиламино-1-(3-пиридинил)-2-пропен-1-она 3) осуществляют конденсацию 3-диметиламино-1-(3-пиридинил)-2-пропен-1-она и 2 метил-5-нитрофенилгуанидин нитрата путем кипячения с водным гидроксидом натрия в диметилформамиде, полученный -(2-метил-5-нитрофенил)-4-(3-пиридинил)пиримидин 2-амин осаждают 2-пропанолом 4) проводят восстановление путем прибавления к 1 экв -(2-метил-5-нитрофенил)-4(3-пиридинил)пиримидин-2-амина в смеси метанола и тетрагидрофурана, взятых в соотношении 31, 1 экв скелетного -Ренея и 10 экв 80 -ного гидразин гидрата и перемешивания реакционной смеси при 45-50 С в течение 4-8 ч с образованием -(2-метил-5 аминофенил)-4-(3-пиридинил)пиримидин-2-амина 5) смесь 1 экв 1-метилпиперазина и 1,01 экв метилового эфира 4-формилбензойной кислоты при 5-20 С восстанавливают триацетоксиборогидридом натрия, полученным предварительно путем обработки тетрагидробората натрия уксусной кислотой при 0-5 С,полученный метиловый эфир 4-4-метилпиперазин-1-ил)метил)бензойной кислоты подвергают кислотному гидролизу, выделяют дигидрохлорид 4-4-метилпиперазин-1 ил)метил)бензойной кислоты и обрабатывают его тионил хлоридом в толуоле при 30 С в течение 5 ч с получением дигидрохлорида 4-4-метилпиперазин-1-ил)метил)бензоилхлорида 6) -(2-метил-5-аминофенил)-4-(3-пиридинил)пиримидин-2-амин обрабатывают триэтиламином и дигидрохлоридом 4-4-метилпиперазин-1-ил)метил)бензоилхлорида в тетрагидрофуране при 45-50 С до полной конверсии в 4(4-метил-1-пиперазинил)метил-4-метил-3-4-(3-пиридинил)-2-пиримидиниламинофенилбензамид 7) в раствор 4(4-метил-1-пиперазинил)метил 4-метил-3-4-(3-пиридинил)-2 пиримидиниламинофенилбензамида в сухом этаноле постепенно добавляют метансульфокислоту, смесь кипятят в течение 1 ч, фильтруют при 60 С, фильтрат упаривают, остаток растворяют в смеси этанола и воды при их соотношении 101, выдерживают при комнатной температуре 12 ч, затем высушивают в вакууме при 60 С до постоянного веса. Предлагаемое изобретение относится к усовершенствованному способу получения действующего вещества противолейкозного лекарственного препарата иматиниб. Иматиниб является специфическим ингибитором тирозинкиназы -, блокирующим патогенетические механизмы неконтролируемого опухолевого роста, и представляет новое направление специфической лекарственной терапии в лечении хронического миелолейкоза. Иматиниб превосходит по эффективности все когда-либо применявшиеся средства для лекарственной терапии хронического миелолейкоза (ХМЛ), являясь в настоящее время противоопухолевым терапевтическим средством первой линии в лечении ХМЛ 1. Первоначально открытый как ингибитортирозинкиназы, иматиниб оказался эффективным блокаторомтирозинкиназы по крайней мере еще двух видов рецепторов ( -), что обусловило эффективность его применения при стромальных опухолях желудочно-кишечного тракта, при раке предстательной железы и высокодифференцированной глиоме. 17047 1 2013.04.30 Метансульфонат 4-(4-метил-1-пиперазинил)метил 4-метил-3-4-(3-пиридинил)2-пиримидиниламинофенилбензамида 1 - действующее вещество препарата иматиниб. Способы его получения и применение описаны в научной и патентной литературе 2-10. Известны способы получения иматиниба, использующие в качестве исходного соединения 2-метил-5-нитроанилин 2-4, 6-8 или замещенный галогенанилин 9, 10. Общепринятым подходом к получению метансульфоната иматиниба является семистадийный синтез (включая стадии получения 3-диметиламино-1-пиридил-2-пропен-1-она и 4-4-метилпиперазин-1-ил)метил)бензойной кислоты) по схеме 1, описанный в патентах 2-4, 6-8) 2(3), ,) 2 ) ,))) 4-(4-метилпиперазин-1-ил)метилбензоил хлорид (10) ) 4-хлорметилбензоилхлорид (11), ) 1-метилпиперазин (13) ) метансульфоновая кислота (15). Синтез включает получение 1-(2-метил-5-нитрофенил)гуанидина нитрата 4 реакцией 2-метил-5-нитроанилина 2 с цианамидом 3 (стадия 1). 1-(2-Метил-5-нитрофенил)гуанидин нитрат 4 вводят в конденсацию с 3-диметиламино-1-пиридил-2-пропен-1-оном 5 с получением -(2-метил-5-нитрофенил)-4-(3-пиридинил)пиримидин-2-амина 6 (стадия 3) нитро-пиримидин 6 восстанавливают в 6-метил(4-(3-пиридинил)пиримидинил-2 фенилен 1,3-диамин 7 (стадия 4). Далее аминопиримидин 7 ацилируют хлорангидридом 10 4-4 метилпиперазин-1-ил)метил)-бензойной кислоты 8 в присутствии основания, получая иматиниб основание 14 (стадия 6) 2, 6. Вариантом схемы является двухстадийный путь от аминопиримидина 7 к иматинибу основанию 14 путем ацилирования амина 7 4 хлорметилбензоилхлоридом 11 (стадия 7) полученный 4-хлорметил 4-метил-3-(4 пиридин-3-ил)пиримидин-2-иламино фенил бензамид 12 реагирует с 1-метилпиперазином 13 (стадия 8) 3-5. Этот путь позволяет отказаться от использования 4-4 метилпиперазин-1-ил)метил)бензойной кислоты, известные способы получения которой многостадийны и/или не обеспечивают хорошего выхода целевого продукта. Обработка иматиниба основания 14 метансульфоновой кислотой 15 (стадия 9) дает метансульфонат иматиниба 1 - действующее вещество лекарственного препарата. Дополнительно к указанным промежуточным соединениям 4, 6, 7, 12, 14 данный подход (схема) включает получение диметиламино-1-пиридил-2-пропен-1-она 5 (стадия 2) и 4-4-метилпиперазин-1 ил)метил)бензойной кислоты (стадия 5). Известен способ получения действующего вещества иматиниба по указанной схеме,включающий получение 1-(2-метил-5-нитрофенил)-гуанидина нитрата 4 (стадия 1) реакцией 2-метил-5-нитроанилина 2 с цианамидом 3 в присутствии соляной кислоты и конверсией образующейся хлористоводородной соли в азотнокислую соль обработкой азотной кислотой независимо получают 3-диметиламино-1-пиридил-2-пропен-1-он 5 (стадия 2) при взаимодействии 3-ацетилпиридина с избытком диметилацеталя диметилформамида при нагревании с отгонкой образующегося в реакции метанола и сырой продукт без очистки вводят в конденсацию с 2-метил-5-нитрофенилгуанидина нитратом 4 с получением -(2-метил-5-нитрофенил)-4-(пиридин-3-ил)пиримидин-2-амина 6 с выходом 73 в расчете на 3-ацетилпиридин (стадия 3) нитропиримидин 6 восстанавливают в -(2-метил 5-аминофенил)-4-(пиридин-3-ил)пиримидин-2-амин 7 с 3-4 мольным избытком 40-80 водного раствора гидразин гидрата в присутствии скелетного никеля Ренея (стадия 4), выход продукта 80 аминопиримидин 7 конденсируют с 4-хлор-метилбензоилхлоридом(стадия 7) в нейтральном органическом растворителе (ТГФ, диоксан, диметилсульфоксид) в присутствии основания полученный 4-хлорметил 4-метил-3-(4-пиридин-3 ил)пиримидин-2-иламинофенилбензамид 12 вводят в реакцию с избытком 1-метилпиперазина 13 (стадия 8), получая после обработки реакционной смеси водой осадок иматиниба основания 14, который известными методами переводят в соль с метансульфоновой кислотой (стадия 9) 4. Суммарный выход иматиниба основания 14 составляет 45 в сравнении с 15 в других патентах. Недостатком данного способа получения является энергозатратная и нетехнологичная с использованием дорогостоящего диметилацеталя диметилформамида методика синтеза 3-диметиламино-1-(3-пиридинил)-2-пропен-1-она, который получается с невысоким выходом и требует очистки от исходного 3-ацетилпиридина. Этот же процесс описан в патенте 3, но в отличие от предыдущего способа по патенту 4 в стадии получения гуанидина используют только азотную кислоту и восстановление нитропиримидина 6 проводят хлоридом олова. Известен способ получения действующего вещества иматиниба по указанной схеме 8, включающий получение 1-(2-метил-5-нитрофенил)-гуанидина нитрата 4 (стадия 1) ре 4 17047 1 2013.04.30 акцией 2-метил-5-нитроанилина 2 с цианамидом 3 в присутствии азотной кислоты в нбутаноле 3-диметиламино-1-пиридил-2-пропен-1-он 5 (стадия 2) получают при взаимодействии 3-ацетилпиридина с избытком диметилацеталя диметилформамида его конденсацию с 1-(2-метил-5-нитрофенил)гуанидина нитратом 4 проводят в н-бутаноле с получением -(2-метил-5-нитрофенил)-4-(пиридин-3-ил)пиримидин-2-амина 6 (стадия 3) нитропиримидин 6 восстанавливают в 6-метил(4-(пиридин-3)пиримидинил-2 фенилен 1,3-диамин 7 хлоридом олова (стадия 4) далее аминопиримидин 7 конденсируют с 4 хлорметил-бензоилхлоридом (стадия 7) полученный 4-хлорметил 4-метил-3-(4 пиридин-3-ил)пиримидин-2-иламинофенилбензамид 12 вводят в реакцию с 1 метилпиперазином 13 (стадия 8), получая иматиниб 14, который известными методами переводят в соль с метансульфоновой кислотой (стадия 9). Известен способ получения иматиниба по указанной схеме 6, в котором 3 диметиламино-1-(3-пиридинил)-2-пропен-1-он (стадия 2) получают из 3-ацетилпиридина нагреванием с диметилацеталем диметилформамида, для восстановления нитропиримидина 6 (стадия 4) проводят его обработку хлоридом олова в соляной кислоте при 50-60 С,выход 65-70 получение бензамида 14 (стадия 6) проводят в нейтральном растворителе диметилформамиде при 70 С реакцией ацилирования хлорангидридом 10 4-4 метилпиперазин-1-ил)метил)бензойной кислоты 8 без акцептора хлористого водорода, получая трихлоргидрат иматиниба, который превращают в иматиниб основание 14 обработкой водным аммиаком с выходом целевого продукта 65-70 метансульфонат получают обработкой метансульфоновой кислотой при кипячении в 2-пропаноле. Описываемый способ обладает рядом недостатков, которые затрудняют его использование в промышленном производстве. Так, восстановление нитропиримидина 6 с использованием хлорида олова не обеспечивает достаточной чистоты целевого продукта, в силу чего проводят дополнительную операцию по очистке, 4-4-метилпиперазин-1 ил)метил)бензойную кислоту перед амидированием превращают в хлорангидрид. Стадию амидирования (стадия 6) проводят без акцептора хлористого водорода, получая трихлоргидрат, для превращения которого в целевой в иматиниб 14 требуется дополнительная технологическая операция выделения иматиниба основания из хлористоводородной соли обработкой водным аммиаком с выходом целевого продукта 65-70 . Известен способ получения иматиниба основания по указанной схеме 7, где ключевая стадия амидирования выполняется с использованием дициклогексилкарбодиимида,обеспечивающего экологически безопасный процесс, хороший выход и необходимую чистоту иматиниба 14. Остальные стадии схемы в патенте 7 не раскрыты. Наиболее близким по технической сущности к предлагаемому изобретению является способ, описанный в патенте 2. В первой стадии синтеза из 2-метил-5-нитроанилина в реакции с цианамидом и 65 азотной кислотой получают 1-(2-метил-5 нитрофенил)гуанидин нитрат 4 (стадия 1), который нагревают в 2-пропаноле (стадия 2) в присутствии гидроксида натрия с 3-диметиламино-1-(3-пиридинил)-2-пропен-1-оном 5,полученным из 3-ацетилпиридина и этилформиата в присутствии метилата натрия (стадия 3). Полученный -(2-метил-5-нитрофенил)-4-(пиридин-3-ил)пиримидин-2-амин 6 восстанавливают в аминопиримидин 7 путем каталитического гидрирования на / (стадия 4). Из -(2-метил-5-аминофенил)-4-(пиридин-3-ил)пиримидин-2-амина 7 и хлоран-гидрида 10 4-4-метилпиперазин-1-ил)метил)бензойной кислоты 8 в пиридине получают 4-(4 метил-1-пиперазинилметил 4-метил-3-4-(3-пиридинил)-2-пиримидиниламинофенилбензамид 14 (стадия 6), который затем обрабатывают метансульфоновой кислотой(стадия 9), получая мезилат иматиниба 1, действующее вещество иматиниба. Однако в этом способе отдельные стадии синтеза трудны для осуществления в промышленном масштабе. Так, проведение восстановления соединения 6 в соединение 7 проводится путем каталитического гидрирования на /, требует специальной аппаратуры,использования водорода и больших объемов растворителя выход соединения 7 при этом 5 17047 1 2013.04.30 составляет 40-45 . Получение кислоты 8 в патенте не раскрыто. Из описания изобретения можно сделать вывод, что кислоту 8 получают с выходом 35 с использованием патента этой же фирмы 9 путем каталитического восстановления водородом под давлением при высокой температуре, что также трудноосуществимо в промышленном масштабе. Получение 3-диметиламино-1-(3-пиридинил)-2-пропен-1-она из 3-ацетилпиридина и этилформиата в присутствии этилата натрия проводится через дополнительную стадию получения мелкодисперсной суспензии натрия в толуоле, к тому же 3 диметиламино-1-(3-пиридинил)-2-пропен-1-он загрязнен ацетилпиридином, вследствие чего нуждается в многократной очистке, выход 3-диметиламино-1-пиридил-2-пропен-1 она не превышает 50 . Реакция амидирования проводится при длительном перемешивании в пиридине, использование которого в качестве акцептора хлористого водорода является одной из причин загрязненности конечного продукта, в том числе и следами пиридина. Целевой продукт 14 очищается от побочных веществ хроматографией на силикагеле, трудоемкой и затратной, нетехнологичной для масштабных синтезов операцией,снижающей выход целевого продукта. Кроме того, чистота получаемых продуктов, в том числе и целевого, также недостаточно высокое, о чем свидетельствует разность температур плавления образцов в 4-5 С. Общий выход конечного продукта по данному способу не указан, но при воспроизведении не превышал 154. Задача предлагаемого изобретения - усовершенствовать способ получения мезилата иматиниба, повысить технологичность всей схемы, сделать его наиболее пригодным для промышленного применения, использовать более безопасные, нетоксичные и доступные растворители и реагенты, минимизировать неутилизируемые побочные продукты реакций и получать целевой продукт с более высоким выходом и чистотой, без применения энергоемких стадий синтеза. При осуществлении изобретения указанный технический результат достигается путем семистадийного синтеза, включающего 1) взаимодействие 2-метил-5-нитроанилина с цианамидом в присутствии соляной кислоты с образованием производного гуанидина 4 2) синтез 3-диметиламино-1-пиридил-2-пропен-1-она 5 путем конденсации этилформиата и 3-ацетилпиридина в толуоле в присутствии натрия с образованием натриевой соли 3-(3 пиридинил-)-3-он-пропен-2-ола, фильтрование ее от исходного 3-ацетилпиридина и обработку суспензии натриевой соли 3-(3-пиридинил)-3-он-пропен-2-ола и гидрохлорида диметиламина в толуоле триэтиламином с образованием 3-диметиламино-1-пиридил-2 пропен-1-она 5 3) конденсацию производного гуанидина 4 в присутствии основания в диметилформамиде с полученным в стадии 2) 3-диметиламино-1-пиридил-2-пропен-1 оном 5 4) восстановление полученного -(2-метил-5-нитрофенил)-4-(пиридин-3 ил)пиримидин-2-амина 6 в -(2-метил-5-аминофенил)-4-(пиридин-3-ил)пиримидин-2 амин 7 гидразин гидратом в присутствии скелетного никеля Ренея 5) синтез дигидрохлорида 4-4-метилпиперазин)метил)бензойной кислоты 8 путем восстановления смеси метилового эфира 4-формилбензойной кислоты и 1-метилпиперазина триацетоксиборгидридом натрия, получаемым смешением при 0-5 С уксусной кислоты и тетрагидробората натрия непосредственно перед добавлением амина и эфира, с последующим гидролизом соляной кислотой полученного метилового эфира 4-4 метилпиперазин)метил)-бензойной кислоты до кислоты 8 и обработки последней тионил хлоридом с получением дигидрохлорида 4-4-метилпиперазин)метил)бензоилхлорида 10 6) ацилирование полученным в стадии 5) дигидрохлоридом 4-4-метилпиперазин)метил)бензоил хлоридом 10 полученного в стадии 4) -(2-метил-5-аминофенил)-4-(3-пиридинил)пиримидин-2-амина 7 в тетрагидрофуране в присутствии триэтиламина с образованием 4-(4-метил-1-пиперазинилметил 4-метил-3-4-(3-пиридинил)-2-пиримидиниламинофенилбензамида 14 7) обработку полученного бензамида метансульфоновой кислотой в среде 1-4-алканола, схема 2) 4-(4-метилпиперазин-1-ил)метипбензоил хлорид (10), 3 ) метансульфоновая кислота (15) Существенные отличия заявляемого способа от прототипа состоят в следующем стадию 1) проводят при кипячении в 2-пропаноле 1 экв 2-метил-5-нитроанилина и 2 экв 50 водного раствора цианамида в присутствии 5 экв соляной кислоты, осаждая целевое соединение 4 в виде азотнокислой соли, выход производного 4 составляет 80 используется в стадии 3) без очистки стадию 2) проводят путем добавления в толуол металлический натрий, содержащий смеси ацетилпиридина, этилформиата в соотношении 12 в среде толуола при перемешивании с выделением образующейся натриевой соли 3-(3-пиридинил)-3-оксо-пропен-2-ола фильтрованием от исходного 3-ацетилпиридина и последующей обработкой гидрохлоридом диметиламина и триэтиламином в толуоле при температуре ниже 5 С полученный 7 17047 1 2013.04.30 3-диметиламино-1-(3-пиридинил)-2-пропен-1-он является хроматографически чистым с выходом 84 и без очистки используется в стадии 3 стадию 3) проводят путем конденсации полученного в стадии 1) гуанидина с 3 диметиламино-1-(3-пиридинил)-2-пропен-1-оном в присутствии водного гидроксида натрия в среде диметилформамида и осаждением продукта 2-пропанолом с выходом 95 стадию 4) проводят путем восстановления при 45-50 С в течение 4-8 ч 1 экв -(2-метил 5-нитрофенил)-4-(3-пиридинил)пиримидин-2-амина, полученного в стадии 3), в смеси метанол ТГФ (31) скелетным -Ренея и 10 экв 80 гидразин гидрата, выход продукта 70 стадию 5) проводят путем восстановления при 05 С смеси 1 экв 1-метилпиперазина и 1,01 экв метилового эфира 4-формилбензойной кислоты триацетоксиборогидридом натрия, приготовленным из тетрагидробората натрия и уксусной кислоты, и последующим гидролизом полученного метилового эфира 4-4-метилпиперазин-1-ил)метил)бензойной кислоты путем кипячения с разбавленной соляной кислотой в течение 2 ч, выделением дигидрохлорида 4-4-метилпиперазин-1-ил)метил)-бензойной кислоты хроматографически чистого с выходом 92 и последующей обработкой его тионил хлоридом в толуоле при 30 С в течение 5 ч. стадию 6) проводят путем обработки -(2-метил-5-аминофенил)-4-(3-пиридинил)пиримидин-2-амина 7, полученного в стадии 4, при 45-50 С в растворе тетрагидрофурана 2 экв триэтиламина и 1,3 экв дигидрохлорида 4-(4-метилпиперазин-1-ил)метил)бензоилхлорида,полученного в стадии 5) до полной конверсии в бензамид, и выделением продукта из водного раствора экстракцией хлороформом, выход чистого продукта 55 стадию 7) проводят постепенным добавлением 1 экв метансульфокислоты к суспензии бензамида в сухом этаноле, кипячением смеси в течение 1 ч, фильтрованием, упариванием фильтрата, растворением в смеси этанолвода (101), выдерживанием при комнатной температуре 12 ч и высушиванием в вакууме при 60 С до постоянного веса. Отличительными признаками предлагаемого способа являются получение гуанидина в виде солянокислой соли, что позволяет существенно сократить энергозатраты и время протекания реакции новый препаративный вариант реакции конденсации (стадия 2) ацетилпиридина и этилформиата с использованием натрия металлического в качестве конденсирующего агента, что уменьшает энергозатраты, время синтеза, позволяет получать хроматографически чистый продукт использование нового метода синтеза 4-4-метилпиперазин-1-ил)метил)бензойной кислоты, в котором последовательность реакций восстановительного аминирования и гидролиза полученного эфира обеспечивает препаративный выход продукта (92 ) в две синтетические стадии без выделения и очистки промежуточного эфира целевой кислоты (8) все стадии синтеза проводят при обычном давлении ни в одной из стадий не требуется обеспечение инертной атмосферы промежуточные продукты используются в последующих стадиях синтеза без дополнительной очистки, при необходимости проводится очистка путем перекристаллизации с применением обычных органических растворителей. Изобретение иллюстрируется следующим примером. 2-Метил-5-нитрофенилгуанидин нитрат (4). К перемешиваемому раствору 15 г(0,1 моль) 2-метил-5-нитроанилина 2 в 75 мл 2-пропанола добавили 0,2 моль 50 водного раствора цианамида, смесь нагрели до кипения и прибавили по каплям 0,25 моль (2,5 экв) концентрированной соляной кислоты, нагревали в течение 2 ч, после чего добавили еще 0,25 моль (2,5 экв) концентрированной соляной кислоты и кипятили реакционную смесь в течение 4 ч, охладили до 60 С и медленно прикапали 0,11 моль (1,1 экв) 653. Выпавший после охлаждения реакционной смеси до комнатной температуры осадок 2-метил 5-нитрофенилгуанидин нитрата отфильтровали, промыли 2-пропанолом 350 мл. Выход 80 , кристаллы белого цвета, т. пл. 203-206 С. ИК-спектр (, см-1, ) 3490, 3370, 3150,1690, 1515, 1340. Спектр ЯМР 1, -6 (, м.д.) 1,30 с (3, 3), 3,34 с (1, ) 6,57 8 17047 1 2013.04.30 ш.с. (3, 2, ), 6,78 д (1,8,5 Гц), 7,24 д (1,2,5 Гц), 7,30 дд (1,8.5 2,5 Гц). Спектр ЯМР 13, -6 (, м.д.) 155,87, 146,16, 143,50, 134,30, 132,00, 122,57, 122,30,17,40. Масс-спектр, / (отн)194 (100 ), - 179 (78 ), -2 147 (43 ),1 195 (10 ), 106, 94, 77. Найдено,27,54 81042. Вычислено,28,95. 3-Диметиламино-1-(3-пиридинил)-2-пропен-1-он (5). К 7,0 г (0,3 моль) нарезанного тонкими пластинками натрия в 110 мл толуола при перемешивании и охлаждении до 5 С прибавили по каплям смесь 30,0 мл (0.27 моль) 3-ацетилпиридина и 32 мл (0,4 моль) этилформиата в 70 мл толуола, после чего реакционную смесь перемешивали в течение 2 ч и оставляли на ночь. Образовавшийся осадок отфильтровали, промыли толуолом,вновь поместили в реакционную колбу, прилили 200 мл сухого толуола, при охлаждении до 5 С добавили 32,4 г (0,4 моль) гидрохлорида диметиламина и 20,0 г (0,3 моль) триэтиламина. Смесь перемешивали в течение 5-6 ч, фильтровали, фильтрат упаривали до половины объема, в остаток добавили охлажденный петролейный эфир и оставили продукт кристаллизоваться при 0-5 С. Кристаллы отфильтровывали, промыли холодным петролейным эфиром, высушили, получили 39,4 г (83 ) 3-диметиламино-1-(3 пиридинил)-2-пропен-1-она с чистотой 97 по данным ТСХ. Т. пл. 80-82 С. ИК-спектр(0,1 моля) 3-диметиламино-1-(3-пиридинил)-2-пропен-1-она (5) в минимальном количестве диметилформамида прибавляют 0,1 моля 2-метил-5-нитрофенилгуанидина нитрата 19,4 г (4) и 1,2 моль гидроксида натрия, растворенного в минимальном количестве воды,кипятят реакционую смесь в течение 4-5 ч, охлаждают, добавляют 2-пропанол и оставляют продукт кристаллизоваться. Осадок отфильтровывают, промывают 380 мл 2 пропанолом. Выход 95 , т. пл. 198-200 С. (т. пл. 195-198 С 2) т. пл. 198-202 С 5). Спектр ЯМР 1, -6 (, м.д.) 2,44 с (3, 3), 7,53 д (1,8,4 Гц), 7,57 ддд (1,8,0 4,8 0,8 Гц), 7,.60 д (1,5,2 Гц), 7,91 дд (1,2,4 8,4 Гц), 8,49 ддд (1,8,0 2,4 1,6 Гц), 8,63 д (1,5,2 Гц), 8,72 дд (1,4,8 1,6 Гц), 8,81 д (1,2,3 Гц), 9,26 уш. с. (1, ), 9,33 дд (1,2,3 0,8 Гц). Спектр ЯМР 13, -6 (, м.д.) 161,52, 160,22, 159,62, 151,55, 148,07, 145,74, 138,80, 138,70, 134,22, 131,79, 131,16, 123,80,117,87, 117,42, 108,81, 18,28. ИК-спектр (, см-1, ) 3432, 3256, 1602, 1585, 1557, 1534,1347. Масс-спектр, / (отн)307 (100 ), -3 292 (85 ), -2 260 (75 ). Найдено,20,58. 161352. Вычислено,22,79.(0,03 моль) -(2-метил-5-нитрофенил)-4-(3-пиридинил)пиримидин-2-амина (6) в 20 мл смеси метанол - ТГФ 31 прибавляют 0,02 моль скелетного никеля Ренея. Затем при охлаждении до 0 С, осторожно добавляют 0,15 моль 80 гидразин гидрата в 5 мл метанола. Реакционную смесь перемешивают при 45-50 С 2 ч, прибавляют еще 0,15 моль 80 гидразин гидрата в 5 мл метанола и перемешивают при 45-50 С еще 2 ч, охлаждают до комнатной температуры, фильтруют через бумажный фильтр, упаривают. Остаток растворяют в этилацетате при 55-60 С, добавляют 3 г активированного угля, кипятят 0,5 ч, фильтруют через целит, целит промывают этилацетатом. Этилацетатные смывы промывают водой,сушат безв. сульфатом натрия, упаривают на 2/3 объема и осаждают продукт (7) петролейным эфиром. Выход 70 , кристаллы желтого цвета, т. пл. 122-124 С (т. пл. 134 С 5). Спектр ЯМР 1, 3 (, м. д.) 2,25 с (3, 3), 3,68 с (2, 2), 6,42 дд (1,7,9 1,8 Гц), 7,00 д (1,8,0 Гц), 7,03 уш. с (1, ), 7,14 д (1,5,1 Гц), 7,42 дд(0,27 моля) тетрагидробората натрия в 160 мл тетрагидрофурана при охлаждении прибавляют 48 мл (0,84 моль) уксусной кислоты, поддерживая температуру не выше 5 С. Перемешивают смесь 30 мин, добавляют 9 г (0,09 моль) 1-метилпиперазина в 20 мл тетрагидрофурана и 15,5 г (0,095 моль) метилового эфира 4-формилбензойной кислоты в 80 мл тетрагидрофурана, перемешивают смесь при охлаждении в бане со льдом 1,5 и 22 ч при комнатной температуре. Реакционную смесь упаривают в вакууме, остаток разбавляют 100 мл воды и нейтрализуют насыщенным водным раствором карбоната натрия. Экстрагируют метиловый эфир 4-4-метилпиперазин-1-ил)метил)бензойной кислоты хлороформом, экстракт промывают водой, сушат и упаривают. К полученному бесцветному маслу добавляют 20 мл воды, 40 мл концентрированной соляной кислоты, нагревают до кипения, разбавляют 40 мл горячей воды и кипятят 2 ч. Затем горячий раствор в течение 30 мин обрабатывают 0,75 г активированного угля и фильтруют, фильтрат упаривают. В остаток добавляют 250 мл сухого бензола и суспензию кипятят с ловушкой ДинаСтарка до полного отделения воды. Смесь фильтруют не охлаждая, кристаллический осадок промывают бензолом и высушивают при 75-80 С, получая 25,09 г (92 ) дигидрохлорида 4-4-метилпиперазин-1-ил)метил)бензойной кислоты (8), кристаллы белого цвета, т. пл. 240 С (с разлож.). Спектр ЯМР 1, 2, , м. д. (, Гц 3,07 (3, с), 3,72 (8,шс), 4,58 (2, с), 7,65 (2, д,8,0 Гц) 8.06 (2, д,8,0 Гц). Спектр ЯМР 13, 2, ,м. д. 169,81, 132,87, 131,90, 131,69, 130,66, 59,99, 50,40, 48,56, 43,08. ИК-спектр (, см-1,таблетка ) 3430, 2890, 2400-2650, 1720, 1460, 1248. Масс-спектр, / -2 235. 4-(4-метилпиперазин-1-ил)метилбензоил хлорид (10). К раствору 0,03 моль дигидрохлорида 4-4-метилпиперазин-1-ил)метил)-бензойной кислоты 8 в толуоле прибавляют 0,035 моль тионил хлорида, перемешивают при 30 С в течение 5 ч, упаривают растворитель в вакууме и промывают полученный осадок этилацетатом 320 мл. Выход 92 , кристаллы белого цвета, т. пл. 300 С (разл.). ИК-спектр (, см-1, пленка) 3480, 2970, 2454(3), 1784, 1680. 4-(4-метил-1-пиперазинил)метил-4-метил-3-4-(3-пириди-нил-)-2-пиримидиниламинофенилбензамид (14). К раствору 0,01 моль -(2-метил-5-аминофенил)-4-(3 пиридинил)пиримидин-2-амина 7 в 20 мл ТГФ прибавляют 2.8 мл (0.02 моль) триэтиламина, выдерживают при 45-50 С в течение 1 ч, затем добавляют 0.013 моль хлорангидрида 10. Перемешивают при 45-50 С в течение 8-16 ч, упаривают растворитель, добавляют 30 мл воды, подкисляют 10 доравного 2, экстрагируют этилацетатом 340 мл, экстракт отбрасывают. Водный остаток обрабатывают 20 доравного 9, экстрагируют хлороформом 320 мл, экстракт сушат 24, упаривают в вакууме. Полученный осадок бензамида перекристаллизовывают из смеси хлороформ - гексан. Выход 55 , кристаллы бежевого цвета, т. пл. 205-208 С (лит. т. пл. 211-213 С 2). Спектр ЯМР 1, 3 (,м. д.) 9,2 (1, д,1.2 Гц) 8,65 (1, дд,4.0 1,2 Гц) 8,54(1, д,1,7 Гц,) 8,54 (1, д,1,7 Гц,) 8,47 (1, м) 8,19 (1, с) 7,81(2, д, -8,1 Гц) 7,39 (2, д,8,1 Гц) 7,38 (1,м) 7,29 (1, дд,8,2, 1,6 Гц) 7,16 1, д,8,2 Гц) 7,13 (1, д,5,3 Гц) 7,12 (1, с) 3,53 (2, с) 2,92 (4, шс) 2,46 (4, шс) 2,28 (3, с) 2,30 (3, с) Спектр ЯМР 13, 3(6, м. д.) 165,58, 162,22. 161,64, 159,54, 151,43, 148,65, 138,21, 137,74, 135,76, 134,94, 131,51,130,28, 128,51, 127,58, 128,17, 124,07, 117,60, 117,28, 107,84, 18,25. ИК-спектр (, см-1, пленка) 3500-3430, 1660, 1580, 1530, 1460. Масс-спектр, / (отн) 56,01 (99 ), 117,98 (94 ),146,01 (65 ), -(2)4-3 394,9 (53 ), 450,0 (39 ), 301,9 (11 ), 275,9 (32 ),188,0 (26 ),493,0 (20 ), 367,0 (5 ). Метансульфонат 4-(4-метил-1-пиперазинил)метил 4-мет-ил-3-4-(3-пиридинил)2-пиримидиниламинофенилбензамида (1). К суспензии 0.04 моль бензамида 14 в 200 мл сухого этанола прикапывают 0.04 моль метансульфоновой кислоты в 70 мл этанола, реак 10 17047 1 2013.04.30 ционную смесь нагревают до кипения 1 ч и, не охлаждая, фильтруют. Фильтрат упаривают досуха, растворяют при нагревании в 500 мл этанола, прибавляют 50 мл воды, выдерживают при комнатной температуре 12 ч и затем сушат в вакууме при 60 С до постоянного веса ( в течение 4 ч). Выход 98 , негигроскопичный порошок желтого цвета, т.пл. 122-138 С (лит. т. пл. 122-138 С 11). Спектр ЯМР 1, -6 (, м. д.) 2,48 с(1, 14,1 Гц), 9,00 с (1), 9,27 с (1), 10,19 с (1). Спектр ЯМР 13, 2 (, м.д.) 165,24,162,35, 160,24, 158,66, 151,06, 148,13, 142,01, 137,40, 136,33, 134,64, 133,60, 132,34, 130,42,128,96, 126,77, 124,05, 123,43, 115,21, 113,08, 107,96, 62,14, 54,63, 52,60, 45,53, 17,36. ИКспектр (, см-1, ) 3500-3410, 3030, 1680, 1580, 1525, 1450, 1335, 1290, 1210, 1150. Использование предлагаемого способа получения метансульфоната 4-(4-метил-1 пиперазинил)метил 4-метил-3-4-(3-пиридинил)-2-пири-мидиниламинофенилбензамида обеспечивает по сравнению с существующим способом следующие преимущества 1. Предлагаемый способ синтеза является более технологичным и обеспечивает повышение выхода целевого продукта. 2. В предлагаемом способе исключается энергоемкая стадия синтеза 3-диметиламино 1-(3-пиридинил)-2-пропен-1-она с применением операции получения высокодисперсной суспензии натрия. 3. Предлагаемый новый метод синтеза 4-4-метилпиперазин-1-ил)метил)бензойной кислоты путем восстановительного аминирования в присутствии триацетоксиборгидрида натрия обеспечивает высокий выход продукта. 4. Все стадии синтеза проводят при обычном давлении, используют доступные растворители ни в одной из стадий синтеза не требуется обеспечение инертной атмосферы на всех стадиях обеспечиваются препаративные выходы цевых продуктов синтеза. 5. Очистка всех промежуточных продуктов проводится, как правило, путем отмывания примесей от исходного соединения или путем кристаллизации с применением обычных органических растворителей. 6. Получаемые промежуточные продукты используются в последующей стадии без специальной или дополнительной очистки. Источники информации 1..,,,//. - 2005. - . 7. . 117-123. 2.0564409 1, МПК 07 239/92. 1994. 3.2004/099186, МПК 07 401/14, 2004. 4. /2006/071130, МПК 07 401/04,07 401/00, 2009. 5..,.,.,.,.,. // . . . - 2005. . 48. - . 249-255. 6.2004/074502, МПК 07 239/92, 2005. 7.2009/060463, МПК 07 401/0407 401/00, 2010. 8.2004/108699, МПК 07 401/04, 2005. 9.2003/066613, МПК 07 295/00,07 241/04, 2006 10.2010/014022, МПК 07 233/65,61 31/506, 2009. 11.2006/054314, МПК 07 401/0461 31/505, 2009. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 11
МПК / Метки
МПК: C07D 401/04, C07D 401/14
Метки: 4-[(4-метил-1-пиперазинил)метил]-n-[4-метил-3-{[4-(3-пиридинил)-2-пиримидинил]амино}фенил]бензамида, получения, способ, метансульфоната
Код ссылки
<a href="https://by.patents.su/11-17047-sposob-polucheniya-metansulfonata-4-4-metil-1-piperazinilmetil-n-4-metil-3-4-3-piridinil-2-pirimidinilaminofenilbenzamida.html" rel="bookmark" title="База патентов Беларуси">Способ получения метансульфоната 4-[(4-метил-1-пиперазинил)метил]-N-[4-метил-3-{[4-(3-пиридинил)-2-пиримидинил]амино}фенил]бензамида</a>
Предыдущий патент: Способ селекции радиолокационных целей
Следующий патент: Способ магнитного контроля твердости движущегося ферромагнитного изделия
Случайный патент: Средство для снижения уровня гомоцистеина при гипергомоцистеинемии