Замещенные 5,6-дигидро-1,4,2-диоксазины, используемые в синтезе новых фунгицидов
Номер патента: 8312
Опубликовано: 30.08.2006
Авторы: ХАЙНЕМАНН Ульрих, АССМАНН, Лутц, ТИМАНН Ральф, ХЭНССЛЕР Герд, КУНТ, Дитмар, КРЮГЕР Бернд-Виланд, ГАЙЕР, Херберт, ШТЕТТЕР, Ёрг, ГЕРДЕС, Петер, ЗАЙТЦ, Томас, ДУТЦМАНН Штефан, ФИЛИПП, Ульрих, ДЕНЕ, Хайнц-Вильхельм
Текст
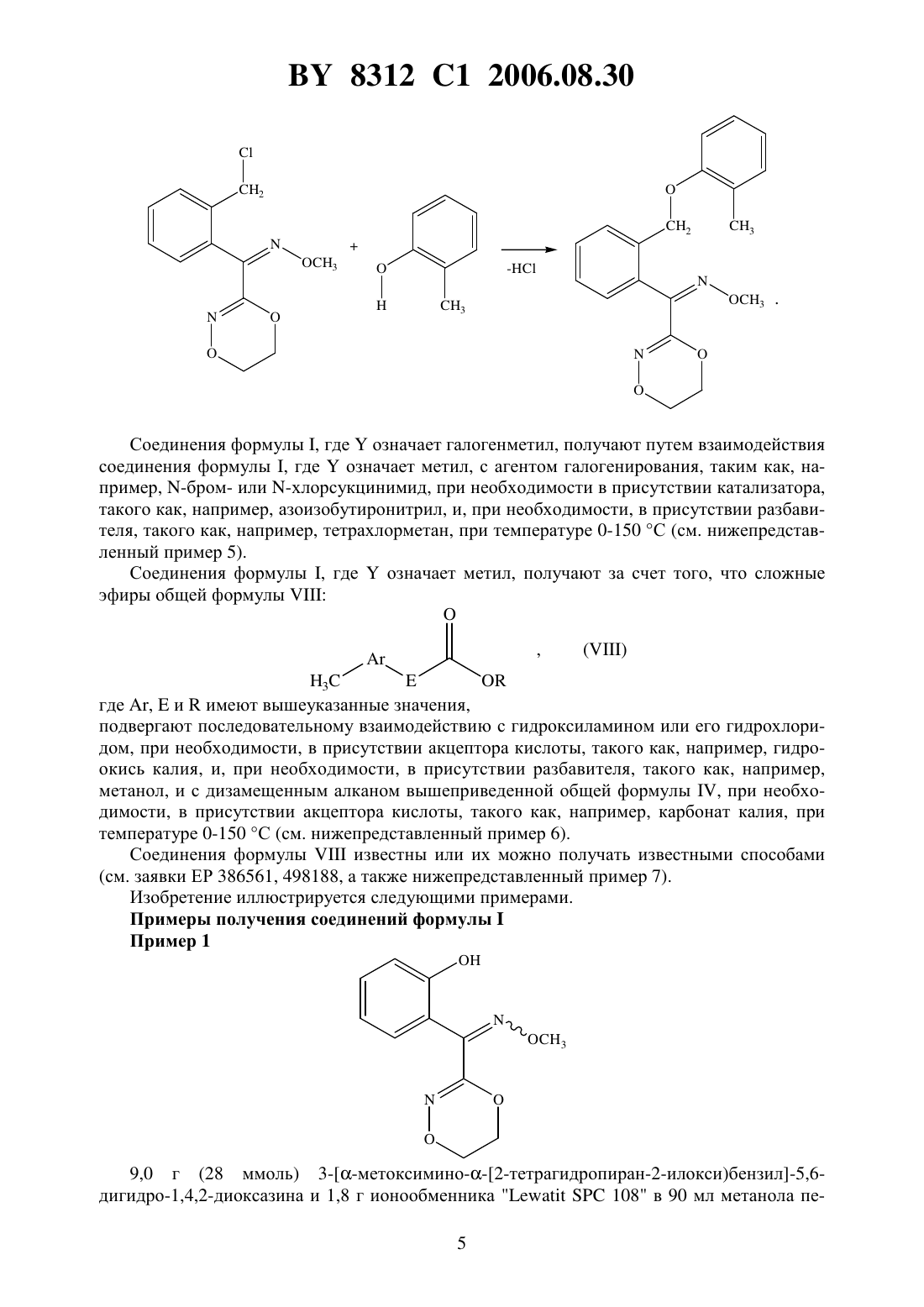
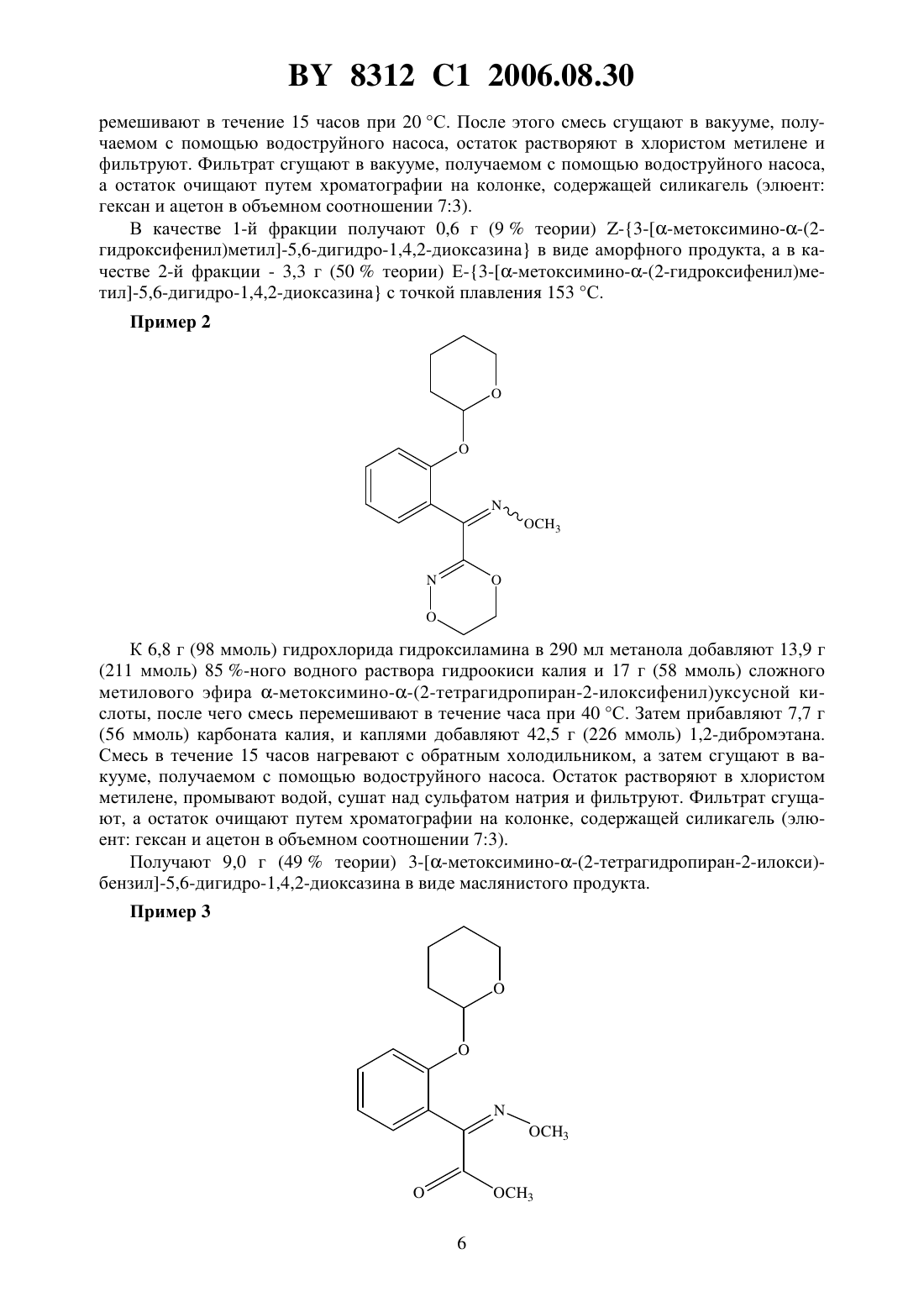
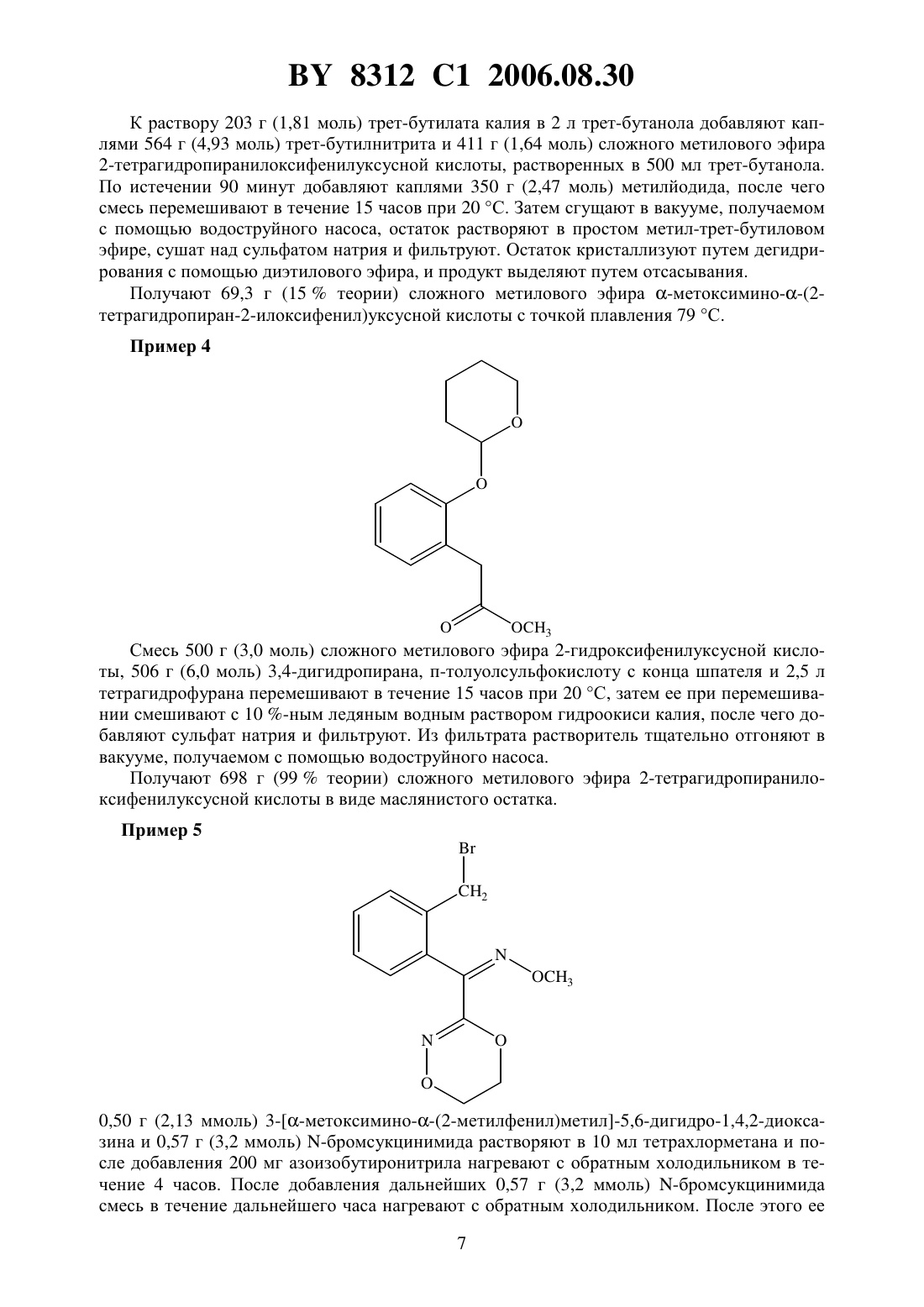
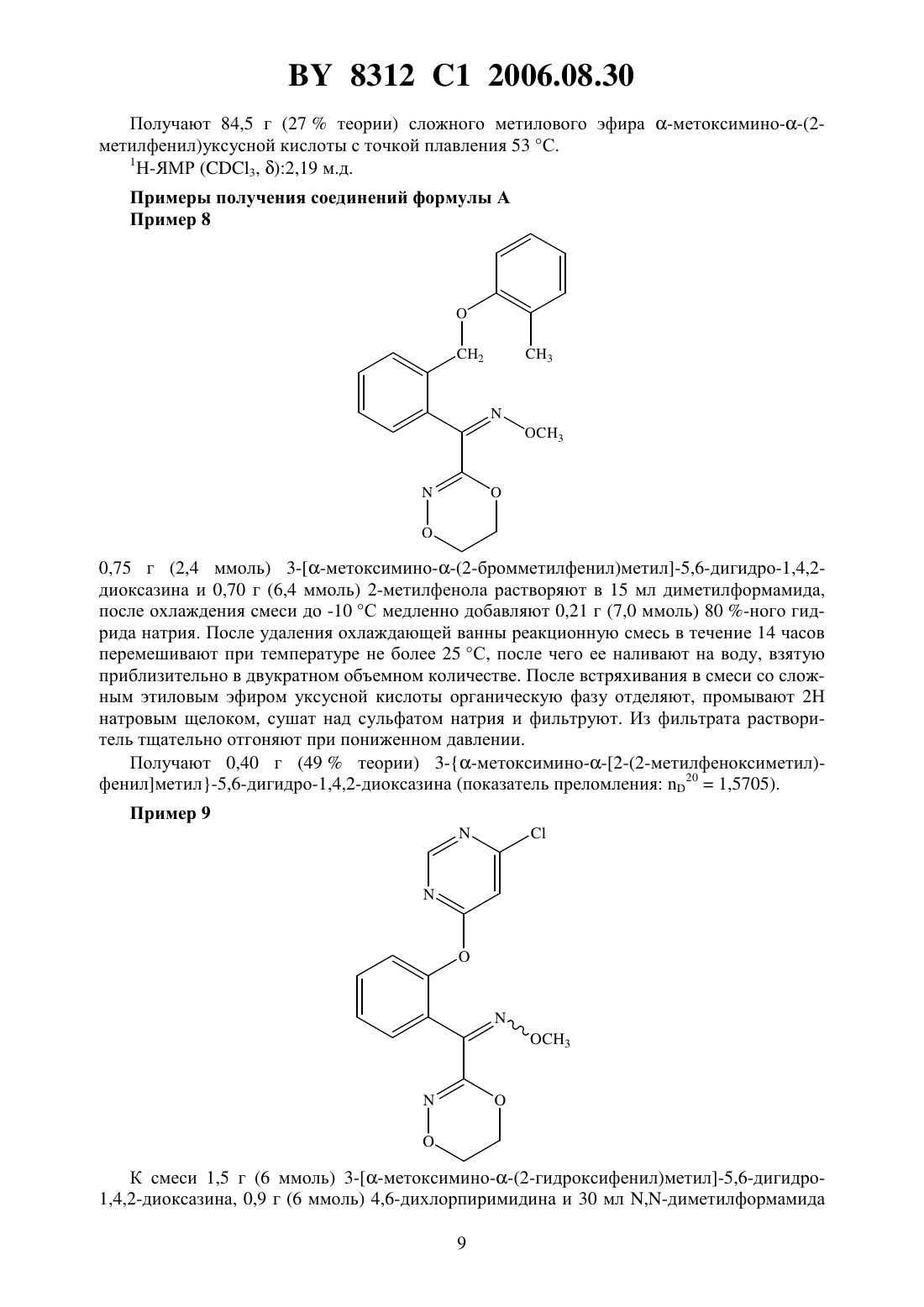
(73) Патентообладатель Байер Акциенгезельшафт где А - диметилен (этан-1,2-диил), незамещенный или замещенный метилом- орто-фенилен, незамещенный или замещенный фтором, тиофендиил или пиридиндиил Е - группа формулы Изобретение относится к новым замещенным 5,6-дигидро-1,4,2-диоксазинам, которые используются в синтезе новых замещенных азадиоксациклоалкенов, обладающих фунгицидным действием. 8312 1 2006.08.30 Известно, что определенные замещенные 5,6-дигидро-1,4,2-диоксазины обладают фунгицидными свойствами (см. заявку 01221371, упомянутую в .112,реферат 98566 патент 02001484, упомянут в .113, реферат 6381 у). Однако эти соединения не приобрели особенного значения. Теперь были найдены новые замещенные азадиоксациклоалкены общей формулы А где А - диметилен (этан-1,2-диил), незамещенный или замещенный метилом, - орто-фенилен, незамещенный или замещенный фтором, тиофендиил или пиридиндиил,Е - группа формулы- кислород, группы -О-СН 2- или -СН 2-О-, - фенил, пиримидинил или тиадиазолил, незамещенные или одно- или двукратно замещенные заместителями, выбранными из группы, включающей метил, этил, н- или изопропил, н-, изо-, втор- или трет-бутил, метокси, этокси, трифторметил, фтор, хлор, бром,метилтио, этилтио, 3, бензилокси, дифторметилтио, трифторметилтио, пиридинил, тиенил, пиридинилтио, пиридинилокси, фенокси, бензилтио, фенил, замещенный метилом или хлором тиенил, замещенный хлором бензилтио, фенил, незамещенный или замещенный 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей метил, этил, метокси, этокси, дифторметил, трифторметил, фтор, хлор и бром, фенокси, незамещенный или замещенный 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей фтор, хлор, бром, циано, метил,этил, дифторметил и трифторметил, и фенилтио, однократно замещенный хлором или бромом. Для получения соединений общей формулы А можно использовать новые замещенные 5,6-дигидро-1,4,2-диоксазины общей формулы где А,и Е имеют вышеуказанное значение, означает гидрокси, тетрагидропиранилокси, метил или галогенметил. Следовательно, объектом настоящего изобретения являются замещенные 5,6-дигидро 1,4,2-диоксазины общей формулы где А - диметилен (этан-1,2-диил), незамещенный или замещенный метилом, - орто-фенилен, незамещенный или замещенный фтором, тиофендиил или пиридиндиил, 2- гидрокси, тетрагидропиранилокси, метил или галогенметил,используемые в синтезе замещенных азадиоксациклоалкенов общей формулы А, обладающих фунгицидным действием. Для получения соединений формулы А, гдеозначает кислород или группу -СН 2-О-,а , , Е иимеют вышеуказанное значение, используют соединения формулы , гдегидрокси, которые подвергают взаимодействию с соединениями общей формулы-(2), гдеиимеют вышеуказанное значение иозначает число 0 или 1,при необходимости, в присутствии органического или неорганического основания в качестве акцептора кислоты и, при необходимости, в присутствии воды или ее смеси с органическим растворителем в качестве разбавителя, при температуре от -20 до 200 С, предпочтительно при температуре 0-150 С. В случае, если в качестве исходных веществ используют, например, 3 метоксимино(2-гидроксифенил)метил-5,6-дигидро-1,4,2-диоксазин и бензилхлорид, то получение соединения формулы А протекает по следующей реакционной схеме Соединения формулы , гдеозначает гидроксил, получают путем взаимодействия соединения формулы , гдеозначает тетрагидропиранилокси, с кислотой, такой как, например, соляная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, или с кислым ионообменником, при необходимости в присутствии разбавителя, такого как, например, вода, метанол, этанол или сложный этиловый эфир уксусной кислоты, при температуре 0-100 С (см. нижепредставленный пример 1). Соединения формулы , гдеозначает тетрагидропиранилокси, получают за счет того, что сложные эфиры общей формулы 8312 1 2006.08.30 гдеи Е имеют вышеуказанные значения,означает алкил,подвергают взаимодействию с гидроксиламином или его гидрохлоридом, при необходимости в присутствии акцептора кислоты, такого как, например, гидроокись калия, и, при необходимости, в присутствии разбавителей, таких как, например, метанол и вода, и образовавшийся при этом промежуточный продукт ин ситу подвергают взаимодействию с дигалогеналканами общей формулыХ-А-Х , где А имеет вышеуказанное значение, аозначает галоген, алкилсульфонилокси или арилсульфонилокси, при необходимости в присутствии акцептора кислоты, такого как,например, карбонат калия, при температуре 0-100 С (см. нижепредставленный пример 2). Соединения формулыполучают за счет того, что сложные эфиры тетрагидропиранилоксифенилуксусной кислоты общей формулы гдеиимеют вышеуказанные значения,подвергают дериватизации обычными методами (см. нижепредставленный пример 3). Сложные эфиры тетрагидропиранилоксифенилуксусной кислоты общей формулыполучают за счет того, что сложные эфиры гидроксифенилуксусной кислоты общей формулы гдеиимеют вышеуказанные значения,подвергают взаимодействию с дигидропираном, при необходимости в присутствии катализатора, такого как, например, п-толуолсульфоновая кислота, и, при необходимости,в присутствии разбавителя, такого как, например, тетрагидрофуран, при температуре 0-100 С (см. нижепредставленный пример 4). Соединения формулыпредставляют собой известные химикаты органических синтезов. Для получения соединений формулы А, гдеозначает группу -О-СН 2-, а , ,иимеют вышеуказанное значение, используют соединения общей формулы , гдеозначает галогенметил, которые подвергают взаимодействию с соединениями общей формулы- , гдеимеет вышеуказанное значение,при необходимости, в присутствии акцептора кислоты и, при необходимости, в присутствии разбавителя. В случае, если в качестве исходных веществ используют, например, 3 метоксимино(2-хлорметилфенил)метил-5,6-дигидро-1,4,2-диоксазин и 2-метилфенол, то получение соединения формулы (А) протекает по следующей реакционной схеме Соединения формулы , гдеозначает галогенметил, получают путем взаимодействия соединения формулы , гдеозначает метил, с агентом галогенирования, таким как, например, -бром- или -хлорсукцинимид, при необходимости в присутствии катализатора,такого как, например, азоизобутиронитрил, и, при необходимости, в присутствии разбавителя, такого как, например, тетрахлорметан, при температуре 0-150 С (см. нижепредставленный пример 5). Соединения формулы , гдеозначает метил, получают за счет того, что сложные эфиры общей формулы где ,иимеют вышеуказанные значения,подвергают последовательному взаимодействию с гидроксиламином или его гидрохлоридом, при необходимости, в присутствии акцептора кислоты, такого как, например, гидроокись калия, и, при необходимости, в присутствии разбавителя, такого как, например,метанол, и с дизамещенным алканом вышеприведенной общей формулы , при необходимости, в присутствии акцептора кислоты, такого как, например, карбонат калия, при температуре 0-150 С (см. нижепредставленный пример 6). Соединения формулыизвестны или их можно получать известными способами(см. заявки ЕР 386561, 498188, а также нижепредставленный пример 7). Изобретение иллюстрируется следующими примерами. Примеры получения соединений формулыПример 1 9,0 г (28 ммоль) 3 метоксимино 2-тетрагидропиран-2-илокси)бензил-5,6 дигидро-1,4,2-диоксазина и 1,8 г ионообменника 108 в 90 мл метанола пе 5 8312 1 2006.08.30 ремешивают в течение 15 часов при 20 С. После этого смесь сгущают в вакууме, получаемом с помощью водоструйного насоса, остаток растворяют в хлористом метилене и фильтруют. Фильтрат сгущают в вакууме, получаемом с помощью водоструйного насоса,а остаток очищают путем хроматографии на колонке, содержащей силикагель (элюент гексан и ацетон в объемном соотношении 73). В качестве 1-й фракции получают 0,6 г (9 теории) -3 метоксимино(2 гидроксифенил)метил-5,6-дигидро-1,4,2-диоксазина в виде аморфного продукта, а в качестве 2-й фракции - 3,3 г (50 теории) Е-3 метоксимино(2-гидроксифенил)метил-5,6-дигидро-1,4,2-диоксазина с точкой плавления 153 С. Пример 2 К 6,8 г (98 ммоль) гидрохлорида гидроксиламина в 290 мл метанола добавляют 13,9 г(211 ммоль) 85 -ного водного раствора гидроокиси калия и 17 г (58 ммоль) сложного метилового эфира -метоксимино(2-тетрагидропиран-2-илоксифенил)уксусной кислоты, после чего смесь перемешивают в течение часа при 40 С. Затем прибавляют 7,7 г(56 ммоль) карбоната калия, и каплями добавляют 42,5 г (226 ммоль) 1,2-дибромэтана. Смесь в течение 15 часов нагревают с обратным холодильником, а затем сгущают в вакууме, получаемом с помощью водоструйного насоса. Остаток растворяют в хлористом метилене, промывают водой, сушат над сульфатом натрия и фильтруют. Фильтрат сгущают, а остаток очищают путем хроматографии на колонке, содержащей силикагель (элюент гексан и ацетон в объемном соотношении 73). Получают 9,0 г (49 теории) 3 метоксимино(2-тетрагидропиран-2-илокси)бензил-5,6-дигидро-1,4,2-диоксазина в виде маслянистого продукта. Пример 3 8312 1 2006.08.30 К раствору 203 г (1,81 моль) трет-бутилата калия в 2 л трет-бутанола добавляют каплями 564 г (4,93 моль) трет-бутилнитрита и 411 г (1,64 моль) сложного метилового эфира 2-тетрагидропиранилоксифенилуксусной кислоты, растворенных в 500 мл трет-бутанола. По истечении 90 минут добавляют каплями 350 г (2,47 моль) метилйодида, после чего смесь перемешивают в течение 15 часов при 20 С. Затем сгущают в вакууме, получаемом с помощью водоструйного насоса, остаток растворяют в простом метил-трет-бутиловом эфире, сушат над сульфатом натрия и фильтруют. Остаток кристаллизуют путем дегидрирования с помощью диэтилового эфира, и продукт выделяют путем отсасывания. Получают 69,3 г (15 теории) сложного метилового эфира -метоксимино(2 тетрагидропиран-2-илоксифенил)уксусной кислоты с точкой плавления 79 С. Пример 4 Смесь 500 г (3,0 моль) сложного метилового эфира 2-гидроксифенилуксусной кислоты, 506 г (6,0 моль) 3,4-дигидропирана, п-толуолсульфокислоту с конца шпателя и 2,5 л тетрагидрофурана перемешивают в течение 15 часов при 20 С, затем ее при перемешивании смешивают с 10 -ным ледяным водным раствором гидроокиси калия, после чего добавляют сульфат натрия и фильтруют. Из фильтрата растворитель тщательно отгоняют в вакууме, получаемом с помощью водоструйного насоса. Получают 698 г (99 теории) сложного метилового эфира 2-тетрагидропиранилоксифенилуксусной кислоты в виде маслянистого остатка. Пример 5 0,50 г (2,13 ммоль) 3 метоксимино(2-метилфенил)метил-5,6-дигидро-1,4,2-диоксазина и 0,57 г (3,2 ммоль) -бромсукцинимида растворяют в 10 мл тетрахлорметана и после добавления 200 мг азоизобутиронитрила нагревают с обратным холодильником в течение 4 часов. После добавления дальнейших 0,57 г (3,2 ммоль) -бромсукцинимида смесь в течение дальнейшего часа нагревают с обратным холодильником. После этого ее 7 8312 1 2006.08.30 охлаждают и фильтруют, фильтрат сгущают, а осадок подвергают хроматографии на силикагеле (элюент толуол и ацетон в соотношении 101). Получают 20 мг (30 теории) 3 метоксимино(2-бромметилфенил)метил-5,6 дигидро-1,4,2-диоксазина. 1 Н-ЯМР (3, )4,4 м.д. Пример 6 3 К 19,6 г (0,283 моль) гидрохлорида гидроксиламина в 150 мл метанола добавляют медленно раствор 36,9 (0,565 моль) 86 -ного раствора гидроокиси калия в 150 мл метанола. Затем добавляют порциями 30 г (0,145 моль) сложного метилового эфира -метоксимино-(2-метилфенил)уксусной кислоты. Смесь перемешивают в течение 3 часов при 50 С. После этого при 20 добавляют 20 г (0,145 моль) карбоната калия и 122 г (0,65 моль) 1,2-дибромэтана. Реакционную смесь перемешивают в течение 17 часов при 65 С. После охлаждения отсасывают, фильтрат сгущают, а осадок подвергают хроматографии на силикагеле (элюент толуол и ацетон в соотношении 151). Получают 15,2 г (45 теории) 3 метоксимино(2-метилфенил)метил-5,6-дигидро-1,4,2-диоксазина. 1 Н-ЯМР (3, )2,2 м.д. Пример 7 3 3 187,5 г (1,673 моль) трет-бутилата калия растворяют в 1875 мл трет-бутанола. К этому раствору добавляют раствор 471,5 г (4,57 моль) трет-бутилнитрита и 250 г (1,525 моль) сложного метилового эфира 2-метилфенилуксусной кислоты в 500 мл трет-бутанола таким образом, что внутренняя температура не превышает 50 С. Смесь перемешивают в течение 90 минут при 20-30 С. После этого добавляют каплями 326,5 г (2,3 моль) метилйодида. Реакционную смесь перемешивают в течение 14 часов при 20 С. Затем растворитель отгоняют в вакууме, получаемом с помощью водоструйного насоса, остаток подают в 2 л воды и три раза экстрагируют сложным этиловым эфиром уксусной кислоты. Объединенные органические фазы сушат над сульфатом натрия и фильтруют. Фильтрат сгущают, осадок растворяют в 250 мл изопропанола и при кипячении смешивают с водой до помутнения. После охлаждения до 0 С и перемешивания в течение 60 минут выкристаллизовавшийся продукт выделяют путем отсасывания. 8312 1 2006.08.30 Получают 84,5 г (27 теории) сложного метилового эфира -метоксимино(2 метилфенил)уксусной кислоты с точкой плавления 53 С. 1 Н-ЯМР (3, )2,19 м.д. Примеры получения соединений формулы А Пример 8 0,75 г (2,4 ммоль) 3 метоксимино(2-бромметилфенил)метил-5,6-дигидро-1,4,2 диоксазина и 0,70 г (6,4 ммоль) 2-метилфенола растворяют в 15 мл диметилформамида,после охлаждения смеси до -10 С медленно добавляют 0,21 г (7,0 ммоль) 80 -ного гидрида натрия. После удаления охлаждающей ванны реакционную смесь в течение 14 часов перемешивают при температуре не более 25 С, после чего ее наливают на воду, взятую приблизительно в двукратном объемном количестве. После встряхивания в смеси со сложным этиловым эфиром уксусной кислоты органическую фазу отделяют, промывают 2 Н натровым щелоком, сушат над сульфатом натрия и фильтруют. Из фильтрата растворитель тщательно отгоняют при пониженном давлении. Получают 0,40 г (49 теории) 3 метоксимино 2-(2-метилфеноксиметил)фенилметил-5,6-дигидро-1,4,2-диоксазина (показатель преломления 201,5705). Пример 9 8312 1 2006.08.30 добавляют на ледяной бане 0,3 г (6 ммоль) 60 -ной суспензии гидрида натрия в беленом масле. После удаления ледяной бани реакционную смесь в течение 15 часов перемешивают при 20 С. После этого сгущают в вакууме, создаваемом при помощи масляного насоса, остаток растворяют в сложном этиловом эфире уксусной кислоты, промывают водой,сушат над сульфатом натрия и фильтруют. Из фильтрата растворитель тщательно отгоняют в вакууме, получаемом с помощью водоструйного насоса. Получают 1,9 г (86 теории) 3 метоксимино 2-(6-хлорпиримидин-4-илокси)фенилметил-5,6-дигидро-1,4,2-диоксазина в качестве маслянистого остатка. Пример 10 Смесь 0,5 г (2 ммоль) 3 метоксимино(2-гидроксифенил)метил-5,6-дигидро 1,4,2-диоксазина, 0,3 г (2,2 ммоль) 2-метилбензилхлорида, 0,4 г (2,5 ммоль) карбоната калия и 10 мл ацетонитрила нагревают с обратным холодильником в течение 15 часов. Затем сгущают, остаток растворяют в хлористом метилене, промывают водой, сушат над сульфатом натрия и фильтруют. Из фильтрата растворитель тщательно отгоняют в вакууме,получаемом с помощью водоструйного насоса. Получают 0,4 г (59 теории) 3 метоксимино 2-(2-метилбензилокси)фенилметил-5,6-дигидро-1,4,2-диоксазина с точкой плавления 142 С. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 10
МПК / Метки
МПК: C07D 273/01, C07D 413/14, C07D 413/12
Метки: используемые, 5,6-дигидро-1,4,2-диоксазины, новых, синтезе, замещенные, фунгицидов
Код ссылки
<a href="https://by.patents.su/10-8312-zameshhennye-56-digidro-142-dioksaziny-ispolzuemye-v-sinteze-novyh-fungicidov.html" rel="bookmark" title="База патентов Беларуси">Замещенные 5,6-дигидро-1,4,2-диоксазины, используемые в синтезе новых фунгицидов</a>
Предыдущий патент: Гидроксиалкоксиамиды, используемые в синтезе новых фунгицидов
Следующий патент: Натриевая или L-аргининовая соли нитроэфира окисленного крахмала, проявляющие сосудорасширяющие и кардиотропные свойства, и способ их получения
Случайный патент: Способ неразрушающего контроля и устройство для его осуществления