Способ получения препарата для лечения субклинического мастита у коров
Номер патента: 18391
Опубликовано: 30.08.2014
Авторы: Гусев Анатолий Алексеевич, Ломако Юрий Васильевич, Курочкин Денис Васильевич, Ивашкевич Олег Петрович, Новикова Оксана Николаевна, Иванов Василий Егорович
Текст
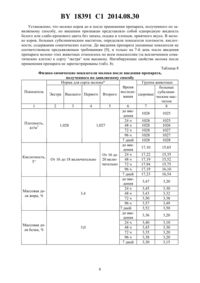
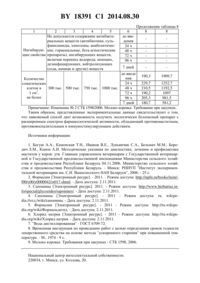
(51) МПК НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ЛЕЧЕНИЯ СУБКЛИНИЧЕСКОГО МАСТИТА У КОРОВ(71) Заявитель Республиканское научно-исследовательское дочернее унитарное предприятие Институт экспериментальной ветеринарии им. С.Н.Вышелесского(72) Авторы Гусев Анатолий Алексеевич Новикова Оксана Николаевна Ломако Юрий Васильевич Ивашкевич Олег Петрович Иванов Василий Егорович Курочкин Денис Васильевич(73) Патентообладатель Республиканское научно-исследовательское дочернее унитарное предприятие Институт экспериментальной ветеринарии им. С.Н.Вышелесского(57) Способ получения препарата для лечения субклинического мастита у коров, при котором в водный раствор хлорида натрия добавляют тритерпеновые сапонины, полученный раствор стерилизуют при 100 С в течение 5-7 мин, охлаждают до 30-35 С, добавляют формальдегид в виде 37-40 -ного раствора, доводятдо значения 5,0-7,0, затем раствор перемешивают при температуре 10-40 С при скорости мешалки 100-150 об/мин в течение 10-20 мин до получения раствора однородного цвета со следующим соотношением компонентов, мас.натрия хлорид 0,80-0,85 тритерпеновые сапонины 0,03-0,05 формальдегид 0,10-0,25 дистиллированная вода остальное. Изобретение относится к области ветеринарии, может быть использовано в качестве иммуностимулирующего препарата для лечения коров, больных субклиническим маститом. Известен способ получения иммуностимулирующего препарата, описанный в заявке на изобретение Иммуностимулирующий препарат, который заключается в смешивании активного начала - формальдегида - с физиологическим раствором натрия хлорида на основе дистиллированной воды, причем в качестве активного начала он содержит формальдегид - 0,07-0,24 , а в качестве целевых добавок содержит натрия хлорид - 0,9-0,95 дистиллированную воду - остальное до 100 . Препарат используют в качестве стимуля 18391 1 2014.08.30 тора естественной резистентности, восстанавливающего иммунный статус организма и обеспечивающего иммунологическую перестройку в отношении опухолевых клеток, возбудителей инфекционных заболеваний, антигенов и гаптенов при заболеваниях не выясненной этиологии 1. Недостатком этого способа является получение иммуностимулирующего препарата со сравнительно низкой фармакологической активностью. Задачей заявляемого изобретения является разработка способа, позволяющего получить экологически безопасный препарат с расширенным спектром фармакологической активности, обладающий противомаститным, противовоспалительным и иммуностимулирующим действием. Поставленная задача достигается тем, что препарат для лечения субклинического мастита у коров получают путем добавления тритерпеновых сапонинов в водный раствор хлорида натрия, затем полученный раствор стерилизуют при 100 С в течение 5-7 мин,охлаждают до 30-35 С, добавляют формальдегид в виде 37-40 -ного раствора, доводятдо значения 5,0-7,0, затем раствор перемешивают при температуре 10-40 С при скорости мешалки 100-150 об/мин в течение 10-20 мин до получения раствора однородного цвета со следующим соотношением компонентов, мас.натрия хлорид 0,80-0,85 тритерпеновые сапонины 0,03-0,05 формальдегид 0,10-0,25 дистиллированная вода остальное. Кроме того, поставленная задача достигается за счет того, что заявляемый препарат дополнительно содержит тритерпеновые сапонины, которые при взаимодействии с холестерином клетки формируют поры в двойных слоях мембраны клетки, в результате чего повышается биологическая доступность молекул формальдегида, которые при проникновении в клетку модулируют внутриклеточные процессы метаболизма 2, т.е. наблюдается новое свойство заявляемого препарата в результате синергитического эффекта. Кроме того, поставленная задача достигается за счет того, что формальдегид в заявляемых мас.индуцирует замедление обменных процессов в клетке и тем самым блокирует патологические процессы в органе. Обратимость блокирования формальдегидом жизнедеятельности в биологическом объекте доказана на органном, клеточном и молекулярном уровнях 2. Кроме того, поставленная задача достигается за счет применения отработанных мас.соотношений заявляемых компонентов, которое выражается в снижении эффективности применения заявляемого препарата при уменьшении заявленных соотношений мас. , а при увеличении заявленных соотношений мас.появляется отрицательный эффект в виде гемолитического эффекта - разрушение эритроцитов (табл. 1, 3-6). Таблица 1 Изучение гематологических показателей у поросят при курсовом введении препарата, полученного по заявляемому способу Доза препаГруппа рата,Эритроциты,Гемоглобин, Тромбоци- ЛейкоциГематокрит животных мл/10 кг 1012/л ммоль/л ты,109/л ты, 109/л массы тела Препарат 1,0 4,30,8 0,250,03 8,31,б 367,869,4 11,22,5 Препарат 2,0 3,60,6 0,200,05 7,60,9 355,873,1 12,93,1 Препарат 3,0 3,240,4 0,190,03 6,41,2 327,884,5 10,22,7 Контроль без обра 4,50,5 0,290,04 8,51,5 322,853,2 12,83,2 ботки Примечание- при 0,05,- при 0,01. 2 18391 1 2014.08.30 Тритерпеновые сапонины - высокомолекулярные сложные органические соединения гликозидного характера - растворяются в воде с образованием коллоидных растворов,уменьшают величину поверхностного натяжения и, подобно мылу, образуют пену, способствуют повышению проникающей способности клеточных мембранах 3, 4. Кроме того, для тритерпеновых сапонинов характерно адаптогенное, антиоксидантное, противовоспалительное, противоопухолевое действие 4. Формальдегид - первый представитель класса альдегидов . Представляет собой бесцветный газ с резким запахом, мол. массой 30,03, плотность его при 20 С равна 0,815,температура плавления 92 С температура кипения 19,2 С. Хорошо растворим в воде,спирте. В чистом виде легко полимеризуется, образуя параформальдегид, и используется в качестве биологического модулятора обменных процессов в клетке 2, 5. Натрия хлорид - кубические кристаллы или белый кристаллический порошок соленого вкуса, без запаха. Растворим в воде (13). Используется в качестве образующего компонента для физиологического раствора 6. Дистиллированная вода - 2 - бесцветная прозрачная жидкость без запаха и вкуса,используется в качестве растворителя 7. Пример 1. Приготовление препарата по заявляемому способу. Диапазон концентраций активнодействующих веществ в формуле препарата определяет его фармакологическую активность. Препарат готовят исходя из заявленных в формуле компонентов в мас. . Берут 0,03 г, что соответствует 0,03 мас. , тритерпеновых сапонинов, добавляют к 98,5 мл 0,80-0,85 раствор натрия хлорида и стерилизуют при 100 С в течение 5-7 мин. Раствор охлаждают до 30-35 С и в стерильный раствор добавляют 37-40 раствор формальдегида до получения 0,10-0,25 раствора формальдегида. Доводятраствора до значения 5,0-7,0. Раствор перемешивают в течение 10-20 мин при температуре 10-40 С при скорости мешалки-шейкера 100-150 об/мин до получения раствора однородного цвета. Кроме того, доведение концентрациираствора до значения 5,0-7,0 с перемешиванием в течение 10-20 мин при температуре 10-40 С при скорости мешалки-шейкера 100-150 об/мин до получения раствора однородного цвета позволяет получить однородную композицию со стабильными качественными и количественными характеристиками. Стабильность физико-химических свойств иммуностимулирующего препарата изучали с использованием метода ускоренного старения путем повышения температуры хранения препарата на 15 С 8. Результаты изучения стабильности заявляемого препарата представлены в табл. 2. Таблица 2 Результаты изучения органолептических, физико-химических и биологических показателей препарата в зависимости от показателя концентрации водородных ионов раствора Показатель концентрации водородных ионов , единиНаименование показателя Характеристика и норма цы 4,0 5,0-7,0 8,0 1. Внешний вид, цвет, за- Прозрачная бесцветная или пах, наличие осадка и ме- светло-соломенного цвета,ханических примесей опалесцирующая жидкость без не соотосадка и без запаха, при не соотвстряхивании которой наблюсоответ- ветствуветствует дается пенообразование. Доствует ет осадок осадок пускается наличие механических примесей в 3 от общего количества флаконов в партии 3 18391 1 2014.08.30 Наименование показателя 2. Стерильность 3. Массовая доля тритерпеновых сапонинов,4. Подлинность содержания тритерпеновых сапонинов 5. Подлинность содержания формальдегида 6. Массовая доля формальдегида,7. Безвредность Характеристика и норма Должен выдерживать испытание 0,03-0,05 Продолжение таблицы 2 Показатель концентрации водородных ионов , единицы 4,0 5,0-7,0 8,0 стерилен стерилен стерилен 0,030 Должен выдерживать испыта- выдержи- выдержи- выдерние вает вает живает Должен выдерживать испыта- выдержи- выдержи- выдерние вает вает живает 0,10-0,25 Препарат не должен вызывать гибель и признаки заболеваний у клинически здоровых белых мышей при его однократном введении под кожу в объеме 0,30 см 3 Пример 2. Применение препарата, полученного по заявляемому способу, для лечения коров,больных субклиническим маститом. Для установления лечебного действия препарата при субклиническом мастите была проведена диагностика лактирующих коров на наличие субклинического мастита, по результатам которой были сформированы 3 группы коров. Препарат, приготовленный согласно примеру 1, вводят коровам внутримышечно по следующей схеме первая группа животных - в объеме 3,0 мл трехкратно с интервалом 24 ч, вторая группа - в объеме 5,0 мл трехкратно с интервалом 24 ч (табл. 3). При необходимости курс применения препарата повторяют через 7-10 суток согласно аналогичной схеме. Животным контрольной группы вводили, согласно наставлению, базовый препарат мастилекс, который наиболее широко используется в ветеринарной практике для лечения коров с этой патологией. Таблица 3 Перевод объемных единиц препарата (мл) в весовые единицы (г) Количество активнодействующих веществ, г Объем препарата, мл Тритерпеновые сапонины Формальдегид 3,0 9,010-4 30,010-4 5,0 15,010-4 60,010-4 Эффективность мероприятий определяли спустя 5-7 суток после введения препаратов с помощью диагностикума Беломастин (10 раствор разводили дистиллированной водой в соотношении 13, затем в углубление пластинки МКП-1 вносили по 1,0 см 3 испытуемого молока, после чего добавляли по 1,0 см 3 рабочего раствора диагностикума и перемешивали путем горизонтального вращения). Результат реакции учитывали в первые 10-20 с- - (отрицательная реакция) жидкая смесь остается однородной- (сомнительная реакция) в смеси образуются слизистые нити- (положительная реакция) смесь приобретает консистенцию слизистой массы или желеобразного сгустка. 4 18391 1 2014.08.30 Полученные результаты по изучению эффективности применения заявляемого препарата с целью лечения коров, больных субклиническим маститом, представлены в табл. 4. Таблица 4 Лечебная эффективность препарата, полученного по заявляемому способу,при субклиническом мастите у коров В том числе выздоровело Количество После первого После второго курГруппа Всего больных коров курса са голов 1. Опытная 51 34 66,6 21 41,2 13 25,4 2. Опытная 41 29 70,7 12 29,2 17 41,5 Контрольная 12 9 75,0 9 75,0 При изучении неспецифических гуморальных и клеточных факторов иммунитета было выявлено, что заявляемый препарат повышал бактерицидную и лизоцимную активность сыворотки крови коров, стимулировал фагоцитарную активность гранулоцитов. Таблица 5 Влияние препарата, полученного по заявляемому способу, на бактерицидную активность сыворотки крови коров с субклиническим маститом Бактерицидная активность сыворотки крови,8-е сутки после пер- 10-е сутки после втоГруппа коров До начала лечения вого курсового вве- рого курсового введения препаратов дения препаратов 1. Опытная 33,55,0 37,85,3 40,55,2 2. Опытная 26,55,0 29,84,2 44,56,8 Контрольная 35,99,2 36,66,5 34,64,1 Примечание- при 0,01. Таблица 6 Влияние препарата, полученного по заявляемому способу, на лизоцимную активность сыворотки крови коров с субклиническим маститом Лизоцимная активность сыворотки крови,8-е сутки после пер- 10-е сутки после втоГруппа коров До начала лечения вого курсового введе- рого курсового введения препаратов ния препаратов 1. Опытная 1,910,2 2,230,5 2,10,4 2. Опытная 1,900,2 2,130,2 2,80,3 Контрольная 1,950,1 2,00,2 2,170,4 Примечание- при 0,01. Таблица 7 Влияние препарата, полученного по заявляемому способу, на фагоцитарную активность гранулоцитов крови коров с субклиническим маститом Группа коров Фагоцитарный показатель,8-е сутки после пер- 10-е сутки после До начала введения вого курсового вве- второго курсового препарата дения препарата введения препарата 1. Опытная 65,65,7 78,35,2 81,63,3 2. Опытная 65,65,7 79,34,2 82,65,3 Контрольная 69,36,3 73,13,5 75,55,3 Примечание- при 0,01. 5 18391 1 2014.08.30 Установлено, что молоко коров до и после применения препарата, полученного по заявляемому способу, по внешним признакам представляло собой однородную жидкость белого или слабо-кремового цвета без запаха, осадка и хлопьев, приятного вкуса. В молоке коров, больных субклиническим маститом, определяли показатели плотности, кислотности, содержания соматических клеток. До введения препарата указанные показатели не соответствовали предъявляемым требованиям 9, и только на 7-й день после введения препарата молоко этих животных относилось по всем показателям (за исключением соматических клеток) к сорту экстра или высшему. Ингибирующие свойства молока после применения препарата не зарегистрированы (табл. 8). Таблица 8 Физико-химические показатели молока после введения препарата,полученного по заявляемому способу Норма для сорта молока Группа животных Время больные Показатель исследосубклиниЭкстра Высшего Первого Второго здоровые вания ческим маститом 1 2 3 4 5 6 7 8 до вве 1028 1025 дения 24 ч 1028 1025 Плотность,1,028 1,027 48 ч 1028 1026 кг/м 3 72 ч 1028 1027 96 ч 1028 1027 7 дней 1028 1028 до вве 17,10 15,65 дения 24 ч 17,22 15,35 От 16 до Кислотность,От 16 до 18 включительно 20 вклю 48 ч 17,19 15,52 Т чительно 72 ч 17,94 15,75 96 ч 17,19 16,10 7 дней 17,23 16,54 до вве 3,47 3,20 дения 24 ч 3,45 3,30 Массовая до 3,4 48 ч 3,43 3,32 ля жира,72 ч 3,50 3,38 96 ч 3,57 3,49 7 дней 3,52 3,50 до вве 3,36 3,20 дения 24 ч 3,40 3,10 Массовая до 3,0 48 ч 3,45 3,30 ля белка,72 ч 3,35 3,20 96 ч 3,38 3,20 7 дней 3,30 3,15 2 3 4 5 Не допускается содержание антибактериальных веществ (антибиотики, сульфаниламиды, хинолоны, анаболитичесИнгибирую- кие, гормональные, бета-агностические щие свойства препараты), ингибирующих веществ,включая перекись водорода, моющих,дезинфицирующих, нейтролизующих до введе 190,3 1909,7 ния Количество 24 ч 229,7 1252,7 соматических клеток в 300 тыс. 500 тыс. 750 тыс. 1000 тыс. 48 ч 210,5 1192,5 1 см 3,72 ч 190,2 1097 не более 96 ч 205,3 981,5 7 дней 180,7 581,2 Примечание Изменение 2 СТБ 1598/2006. Молоко коровье. Требование при закупках. Таким образом, представленные экспериментальные данные свидетельствуют о том,что заявляемый способ дает возможность получить экологически безопасный препарат с расширенным спектром фармакологической активности, обладающий противомаститным,противовоспалительным и иммуностимулирующим действием. Источники информации 1. Богуш А.А., Каменская Т.Н., Иванов В.Е., Лукьянчик С.А., Бельмач М.М., Бородич Л.М., Конон А.И. Методические указания по диагностике, лечению и профилактике маститов у коров утв. Главным управлением ветеринарии с Государственной ветеринарной и Государственной продовольственной инспекциями Министерства сельского хозяйства и продовольствия Республики Беларусь 04.11.2006. Министерство сельского хозяйства и продовольствия Республики Беларусь. - Минск РНИУП Институт экспериментальной ветеринарии им. С.Н. Вышелесского НАН Беларуси, 2006. - 25 с. 2. Формалин Электронный ресурс. - 2011. - Режим доступа //.///00/00/0000042/017 - Дата доступа 2.11.2011. 3. Сапонины Электронный ресурс. 2011. - Режим доступа //////. - Дата доступа 2.11.2011. 4. Сапонины Электронный ресурс. - 2011 - Режим доступа . .//отд.//сапонины. - Дата доступа 2.11.2011. 5. Формалин Электронный ресурс. - 2011 - Режим доступа ////Формальдегид. - Дата доступа 2.11.2011. 6. Хлорид натрия Электронный ресурс. - 2011 - Режим доступа ////Хлорид натрия. - Дата доступа 2.11.2011. 7. Вода дистиллированная - ГОСТ 6709-72. 8. Временная инструкция по проведению работ с целью определения сроков годности лекарственного средства на основе метода ускоренного старения при повышенной температуре. - М., 1974 - 9 с. 9. Молоко коровье. Требования при закупках - СТБ 1598, 2006. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 7
МПК / Метки
МПК: A61K 31/702, A61P 29/00, A61K 9/08, A61P 37/04, A61K 31/115
Метки: препарата, получения, мастита, способ, коров, лечения, субклинического
Код ссылки
<a href="https://by.patents.su/7-18391-sposob-polucheniya-preparata-dlya-lecheniya-subklinicheskogo-mastita-u-korov.html" rel="bookmark" title="База патентов Беларуси">Способ получения препарата для лечения субклинического мастита у коров</a>