Способ определения концентрации альфа1-кислого гликопротеина в плазме крови
Номер патента: 7744
Опубликовано: 28.02.2006
Авторы: Конев Сергей Васильевич, Гаврилов Виктор Борисович, Михайлов Алексей Сергеевич
Текст
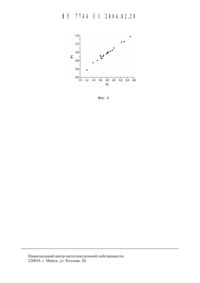
Изобретение относится К клинической биохимии, а именно К биохимическому анализу крови, и может быть использовано в медицинской диагностике для оценки воспалительного синдрома при инфекционных, онкологических и травматических заболеваниях.Альфа 1-кисль 1 й гликопротеин (АГП) относится к белкам острой фазы, участвующим в неспецифической защите организма при развитии различных патологических процессов(инфекция, травма, рак, токсикоз и др.). В норме содержание АГП в плазме крови составляет 0,4-1,3 г/л, при патологии его концентрации возрастает в 2-4 раза до 3,5 г/л. При этом по степени повышения концентрации АГП оценивают выраженность воспалительного процесса. Таким образом, метод определения АГП в плазме крови должен обеспечить измерение его концентрации в диапазоне 0,4-3,5 г/л.Обычно содержание АГП измеряют с помощью метода радиальной иммунодиффузии,недостатками которого являются большая трудоемкость и дороговизна реагентов 1.Другой принцип измерения концентрации АГП основан на регистрации флуоресценции сольватохромных катионных красителей, которые обладают свойствами селективного связывания с этим белком и многократного усиления интенсивности флуоресценции в белок-связанном состоянии. Известен способ определения АГП (аналог изобретения), по которому плазму инкубируют с 3 раствором сульфосалициловой кислоты (ССК) для осаждения всех белков плазмы, кроме АГП 2. Затем супернатант, содержащий АГП, разбавляют в фосфатном буфере и к пробе добавляют 90 мкМ флуоресцентного зонда Аурамина О (АО). Содержание АГП оценивают по интенсивности флуоресценции АО в пробе в режиме возбуждения/испускания флуоресценции Ех/Еш 470/550 нм. Для калибровки результатов используют стандартные растворы АГ П в буфере. Однако последующие исследования вь 1 явили, что взаимодействие АГП с АО характеризуется слабой селективностью по сравнению с альбумином плазмы и очень низким квантовым выходом флуоресценции (О 0,1). По первой причине обязательной является операция осаждения альбумина до проведения анализа с АО, а вторая причина приводит к значительному снижению чувствительности метода.Прототипом предлагаемого изобретения является способ определения содержания АГП по флуоресценции катионного зонда хинальдинового красного (ХК) З. По этому методу 100 мкл плазмы добавляют к 5,9 мл 0,15 М фосфатного буфера (рН 7,4), отбирают из пробы 3 мл в измерительную кювету 11 см и добавляют 100 мкл раствора ХК в метаноле до конечной концентрации зонда 48 мкМ. Затем измеряют интенсивность флуоресценции пробы в режиме Ех/Еш 496/590 нм. Для построения калибровочной кривой используют искусственную плазму с различным содержанием АГП, что обусловлено измерением флуоресценции зонда в цельной плазме. В состав искусственной плазмы входят альбумин, иммуноглобулин 6 и стероидный гормон андростандион, которые существенно влияют на интенсивность флуоресценции ХК в нативной плазме. По сравнению с другими зондами ХК обладает наиболее высокой специфичностью связывания с АГП и большим квантовым вь 1 ходом (О 0,7) в комплексе с этим белком. К недостаткам указанного метода можно отнести сложность приготовления искусственной плазмы. Эта операция может быть исключена при использовании осаждения альбумина и других мешающих белков с помощью ССК, как в методе 2. Другими недостатками, выявленными в результате наших исследований, является недостаточно высокая чувствительность метода и высокий расход красителя.Задача, на решение которой направлено предлагаемое изобретение, заключается в увеличении чувствительности метода и снижении расхода реагентов.Отличительной сущностью предлагаемого способа определения содержания АГП путем его выделения из плазмы с помощью осаждения других белков ССК и измерения концентрации АГ П по интенсивности флуоресценции зонда ХК является проведение реакции супернатанта плазмы с зондом в боратном буфере с рН 9,0, и концентрации зонда 15-20 мкМ ХК.По сравнению с прототипом предлагаемый способ в 1,8 раза увеличивает чувствительность измерения АГП и в 2,4-3,2 раза снижает расход красителя.Отличительная сущность предлагаемого способа заключается в изменении рН, концентраций плазмы и зонда ХК в инкубационной среде, что обеспечивает повышение чувствительности способа и снижение расхода реагентов.Существенность предлагаемых условий для определения концентрации АГП в плазме крови подтверждается следующими исследованиями и примерами. Исследования проводили на АГП, выделенном из плазмы крови путем осаждения остальных белков плазмы с помощью ССК и последующего осаждения АГП из супернатанта ацетоном. Исходный раствор ХК готовили в диметилформамиде (ДМФА). Интенсивность флуоресценции измеряли на флуориметре оЬ 1 п Ууоп (Франция). Максимумы возбуждения/испускания флуоресценции ХК в растворе АГП составляли Ех/Еш 525/625 нм.1 . Оптимизация рН среды инкубации.Установлено, что в кислой среде при рН 3,0 зонд ХК практически не флуоресцирует, с повышением рН 3,0 интенсивность флуоресценции зонда возрастает и выходит на плато при рН 5,0 (фиг. 1). Известно, что в этой области рН происходит переход красителя из протонированной кислой формы в депротонированную щелочную форму ВН 21 ЭН Н д.Следовательно, флуоресцентными свойствами обладает только депротонированная форма ХК. В присутствии белка АГ П рост флуоресценции ХК происходит в том же диапазоне рН с 3,0 до 5,0, что объясняется рН-зависимым образованием флуоресцирующей формы красителя. Кроме того, в растворе с белком интенсивность флуоресценции ХК проходит через резко выраженный максимум при рН 9,0, который отсутствует в чистом растворе красителя и обусловлен рН-зависимой структурной перестройкой белка. Таким образом, измерение флуоресценции ХК при рН 9,0 вместо рН 7,4, как в способе-прототипе, позволяет в 1,5 раза повысить чувствительность определения концентрации АГ П.2 Оптимизация концентрации зонда ХК.Зависимость интенсивности флуоресценции при увеличении концентрации ХК в растворе с АГП проходила через максимум при концентрации зонда 15 мкМ (фиг. 2). Дальнейшее повышение концентрации ХК приводило к падению интенсивности флуоресценции, которое обусловлено концентрационным тушением флуоресценции или эффектом внутреннего фильтра. Таким образом, оптимальная концентрация ХК в предлагаемом способе в 2,4-3,2 раза ниже, чем в способе прототипе.На фиг. 3 представлена зависимость интенсивности флуоресценции при оптимальном значении рН 9,0 и концентрации ХК 15 мкМ от концентрации АГП в конечной пробе. С учетом первой операции выделения АГП, включающей осаждение других белков плазмы 3 ССК, и последующего разведения супернатанта в состав конечной пробы была включена 0,3 ССК. Начальный диапазон линейного роста флуоресценции ХК соответствовал концентрациям АГП 5-40 мг/л. При дальнейшем повышении концентрации АГП в пробе рост флуоресценции замедлялся и концентрационная зависимость флуоресценции становилась более пологой. Исходя из полученных данных, предел обнаружения концентрации АГП в конечной пробе составлял 5 мг/л. С учетом нижней границы концентраций АГП в плазме крови общее разбавление плазмы должно быть не более 40. При таком разбавлении плазмы верхняя граница линейного диапазона измеряемых концентраций АГП составляет 4040 мг/л 1,6 г/л, то есть чуть превышает верхний уровень нормы. Чтобы наблюдаемые при патологии более высокие концентрации АГП 1,4-3,5 г/л попали в диапазон линейного роста флуоресценции, разбавление плазмы крови необходимо увеличить до 100 раз. В этом случае линейный рост флуоресценции будет соответствовать следующему диапазону исходных концентраций АГП в плазме крови 0,5-4,0 г/л.Таким образом, при измерении концентрации АГП первоначально, особенно при обследовании больных, необходимо использовать конечное разведение плазмы в 100 раз. Однако, если измеряемая концентрация АГП составляет менее 0,5 г/л, желательно повторить измерение при меньшем разведении плазмы - в 40 раз.Предлагаемый способ осуществляют следующим образом К 0,1 мл плазмы крови в пластиковой пробирке на 1,5 мл добавляют 0,1 мл 6 ССК, инкубируют 5-10 мин, центрифугируют 10 мин при 3-5 ть 1 с. об/мин, отбирают 20-100 мкл супернатанта, добавляют к нему 1,0 мл 0,2 М боратного буфера, рН 9,0 и 20 мкл 750 мкМ ХК в ДМФА, интенсивно перемешивают и измеряют интенсивность флуоресценции (131) в режиме возбуждения/испускания флуоресценции 525/625 нм в пластиковой кювете для флуориметрии. В контрольной пробе измеряют интенсивность флуоресценции (130) после добавления 20 мкл ХК к 1,0 мл боратного буфера. Содержание АГП оценивают по разности сигналов флуоресценции 132 131 - 130. При построении калибровочного графика к 1,0 мл боратного буфера вместо супернатанта добавляют 20 мкл стандартного раствора АГП в 0,3 ССК с концентрацией 0,5, 1,0 и 2,0 мг/л и затем 20 мкл раствора ХК.Пример 1 . Определение концентрации АГП в плазме крови больного с воспалительнь 1 м синдромом.В пластиковую пробирку на 1,5 мл добавляют 0,1 мл плазмь 1 крови больного инфильтративнь 1 м туберкулезом легких и 0,1 мл 6 ССК, инкубируют 5-10 мин, центрифугируют 10 мин при 3 ть 1 с. об/мин на центрифуге ОПН-8, отбирают 20 мкл супернатанта в другую пластиковую пробирку, добавляют к нему 1,0 мл 0,2 М боратного буфера, рН 9,0 и 20 мкл 750 мкМ ХК в ДМФА, интенсивно перемешивают и измеряют интенсивность флуоресценции(131 170) в режиме возбуждения/испускания флуоресценции 525/625 нм в 2 мм пластиковой кювете для флуориметрии. В контрольной пробе измеряют интенсивность флуоресценции(130 20) после добавления 20 мкл ХК к 1,0 мл боратного буфера. Содержание АГП оценивают по разности сигналов флуоресценции 132 131 - 130 170 - 20 150. При построении калибровочного графика к 1,0 мл боратного буфера вместо супернатанта добавляют 20 мкл стандартного раствора АГ П в 0,06 ССК с концентрацией 0,5, 1,0 и 2,0 мг/л и затем 20 мкл раствора ХК. Для стандартного раствора АГ П Сст 1 мг/л показатель 132 СТ - 130. Таким образом, концентрация АГП в измеряемой пробе составила Сизм - Сст Р 2/132 ст 1 150/130 1,15 мг/л. С учетом двукратного разведения плазмь 1 на стадии осаждения белков ССК исходная концентрация АГП в плазме крови равна Сисх 2 Сизм 2 х 1,15 2,3 мг/л.Пример 2 . Определение концентрации АГП в плазме крови здорового донора.После получения супернатанта описаннь 1 м вь 1 ше способом в пластиковую пробирку добавляют 100 мкл супернатанта, 1,0 мл 0,2 М боратного буфера, рН 9,0 и 20 мкл 1 мМ ХК в ДМФА, интенсивно перемешивают и измеряют интенсивность флуоресценции(131 65). В контрольной пробе измеряют 130 24. Затем рассчить 1 вают 132 131 - 130 65 24 41. Для калибровки 100 мкл стандартного раствора АГП с Сст 0,5 мг/л добавляют к 1 мл боратного буфера и также вносят 20 мкл раствора ХК. При этом 132 ст 53. Аналогичнь 1 м образом вь 1 числяют Сизм Сст 132/132 ст 0,5 41/53 0,39 мг/л и Сисх 2 х Сизм 2 0,39 0,78 мг/л. Так как концентрация АГП у этого донора вь 1 ше 0,5 мг/л, ее можно бь 1 ло измерить и при большем разбавлении плазмь 1, как в примере 1.Сопоставление предлагаемого способа со способом-прототипом показало следующие преимущества 1. Увеличение чувствительности определения АГП в 1,8 раза.Для сравнительного анализа чувствительности двух методов определения АГП с их помощью бь 1 ло проведено обследование плазмь 1 25 больнь 1 х туберкулезом с вь 1 раженнь 1 м воспалительнь 1 м синдромом. В качестве способа-прототипа использовали предварительное осаждение других белков плазмь 1 по способу 2 и измерение концентрации в супернатанте по флуоресценции ХК по методу 3. Фактически первь 1 й этап анализа по предлагаемому способу и способу-прототипу бь 1 л идентичен, а различия возникали на стадии взаимодействия АГП с зондом ХК. Между результатами измерения концентрации АГП двумя методами бь 1 ла вь 1 явлена сильная корреляция с коэффициентом корреляции К 0,98, при этом сигнал флуоресценции, полученнь 1 й при проведении анализа по предлагаемому способу, в среднем бь 1 л в 1,83 раза вь 1 ше сигнала флуоресценции (фиг. 4). Сле ВУ 7744 С 1 200611218довательно, чувствительность предлагаемого способа в 1,8 раза выше чувствительности способа-прототипа. 2. Снижение расхода красителя в 2,4-3,2 раза.В способе-прототипе конечная концентрация ХК в пробе составляет 48 МКМ, тогда как в предлагаемом способе эта концентрация находится в Диапазоне 15-20 МКМ, или в 2,4-3,2 раза ниже.Разработанный способ может быть использован в медицинской диагностике для оценки реакции острой фазы у больных с воспалительным синдромом при тяжелых инфекционных и онкологических заболеваниях, травмах, отравлениях и хирургических операциях.Фиг. 1. рН-зависимость флуоресценции 10 мкМ хинальдинового красного (ХК) в растворе 100 мкг/мл альфа 1-кислого гликопротеина -АГП (2, 131), буферном растворе (1, 130) и их разности 132 131 - 130 (3). В диапазоне рН 3-7 использован 0,2 М фосфатный буфер,а в диапазоне рН 7 -11 - 0,2 М боратный буфер. Интенсивность флуоресценции измеряли в режиме возбуждения/испускания флуоресценции Ех/Еш 525/625 нм.Фиг. 2. Зависимость флуоресценции от концентрации ХК в 0,1 М боратном буфере рН 9,0 без (1, 130) и в присутствии 100 мкг/мл АГП (2, 131). Кривая (3) показывает разность 132 131-130.Фиг. 3. Зависимость флуоресценции 15 мкМ ХК в 0,1 М боратном буфере рН 9,0 и 0,06 сульфосалициловой кислоте от концентрации АГП.Фиг. 4. Сопоставление сигналов флуоресценции ХК при определении содержанияАГП в плазме больных туберкулезом легких по способу-прототипу (131) предлагаемому способу (132).
МПК / Метки
МПК: G01N 33/84, G01N 33/52
Метки: плазме, способ, гликопротеина, концентрации, крови, определения, альфа1-кислого
Код ссылки
<a href="https://by.patents.su/6-7744-sposob-opredeleniya-koncentracii-alfa1-kislogo-glikoproteina-v-plazme-krovi.html" rel="bookmark" title="База патентов Беларуси">Способ определения концентрации альфа1-кислого гликопротеина в плазме крови</a>
Предыдущий патент: Устройство и способ для изготовления напольных панелей
Следующий патент: Скреперный агрегат
Случайный патент: Способ вызывания эрекции полового члена у самца животного, способ лечения эректильной дисфункции у самца животного и фармацевтическая композиция.