Адгезивный пластырь для трансдермального введения гранизетрона
Текст
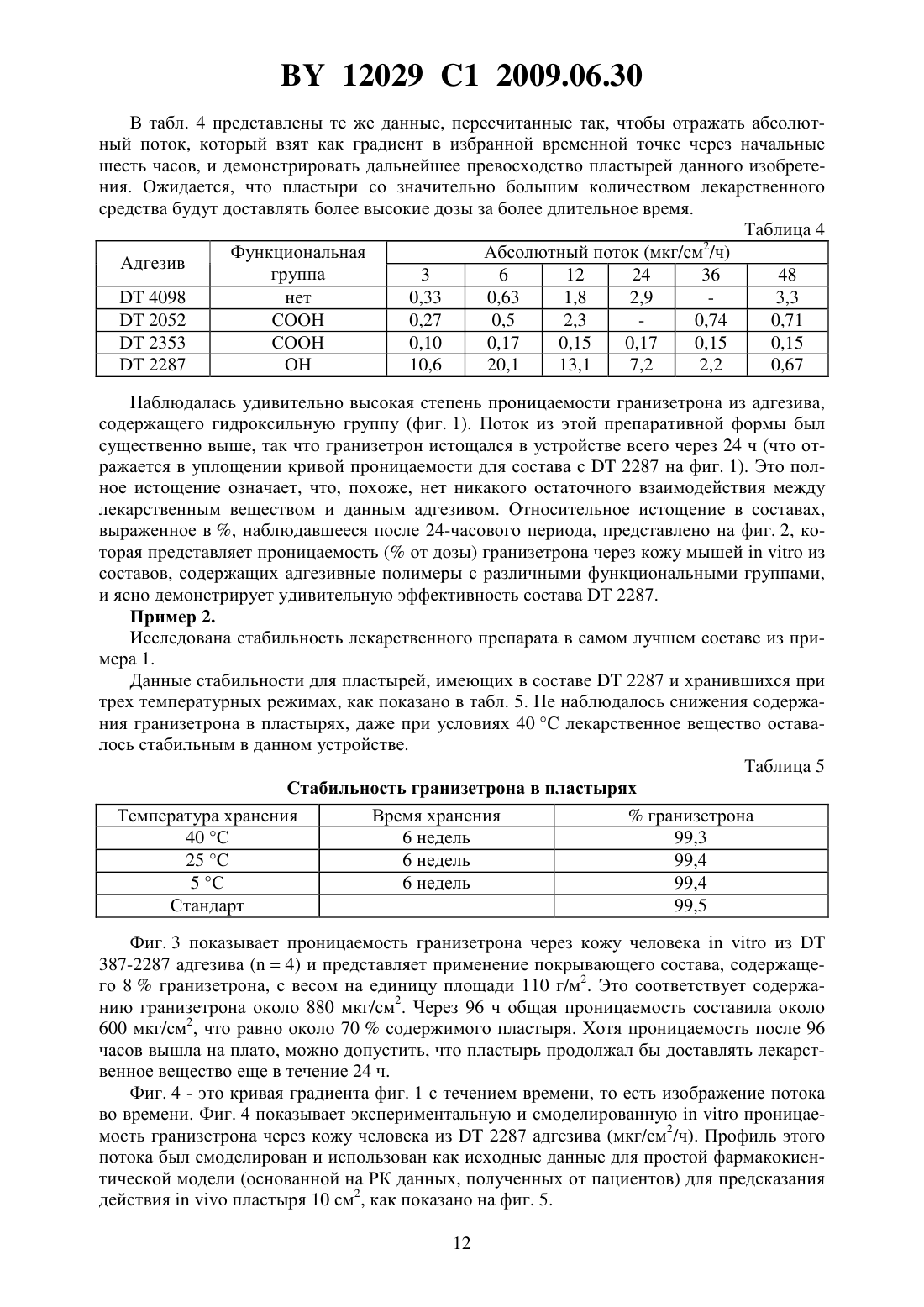
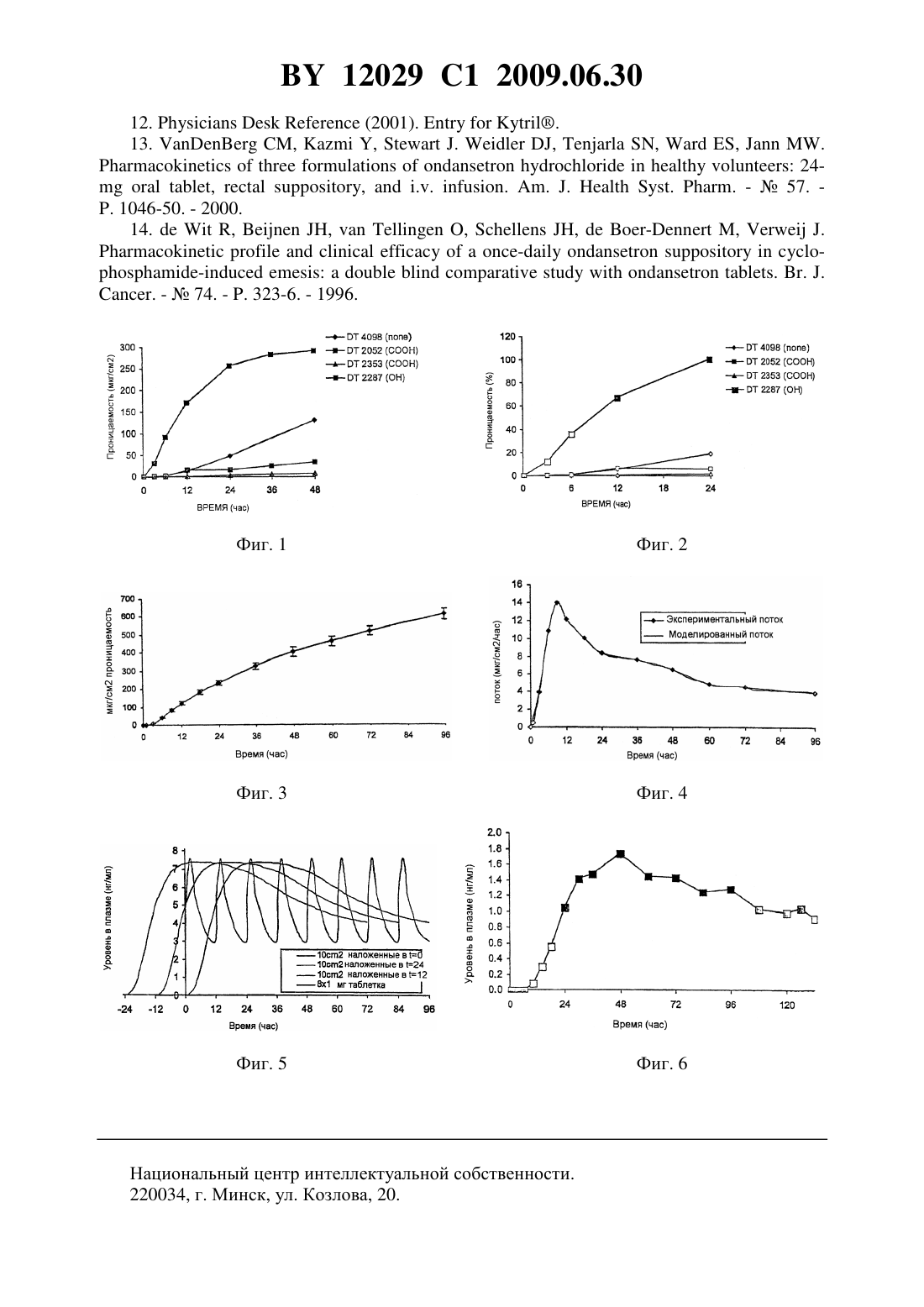
(51) МПК (2006) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ АДГЕЗИВНЫЙ ПЛАСТЫРЬ ДЛЯ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ ГРАНИЗЕТРОНА(71) Заявитель Стрэкэн Интэрнешнл Лимитед(73) Патентообладатель Стрэкэн Интэрнешнл Лимитед(57) 1. Адгезивный пластырь для трансдермального введения гранизетрона, в адгезив которого помещено физиологически эффективное количество гранизетрона, отличающийся тем, что адгезив представляет собой акриловый адгезив, содержащий некислотные гидроксильные группы. 2. Пластырь по п. 1, отличающийся тем, что включает адгезив, в котором некислотные гидроксильные группы обеспечиваются соответствующим образом выбранными сомономерами. 3. Пластырь по п. 2, отличающийся тем, что сомономеры выбраны из группы, включающей замещенные акрилаты и замещенные метакрилаты. 4. Пластырь по п. 3, отличающийся тем, что акрилат выбран из группы, включающей гидроксиэтил-, гидроксиметил- и гидроксипропилакрилат. 5. Пластырь по п. 3, отличающийся тем, что метакрилат выбран из группы, включающей гидроксиэтил- и гидроксиметилметакрилат. 6. Пластырь по п. 1, отличающийся тем, что чувствителен к давлению. 7. Пластырь по п. 1, отличающийся тем, что содержит адгезив, полученный в основном из первичного акрилатного мономера. 8. Пластырь по п. 7, отличающийся тем, что первичный акрилатный мономер выбран из группы, включающей 2-этилгексилакрилат и бутилакрилат. 9. Пластырь по п. 1, отличающийся тем, что обеспечивает введение фармакологически эффективного количества гранизетрона приблизительно через 2 часа после наложения. 10. Пластырь по п. 1, отличающийся тем, что содержит до 10 мас.гранизетрона. 11. Пластырь по п. 10, отличающийся тем, что содержит от 6 до 7,7 мас.гранизетрона. 12. Пластырь по п. 1, отличающийся тем, что содержит менее 8 мас.гранизетрона. 12029 1 2009.06.30 13. Пластырь по п. 1, отличающийся тем, что содержит более 4 мас.гранизетрона. 14. Пластырь по п. 1, отличающийся тем, что не наблюдается кристаллизации после одного месяца хранения при комнатной температуре. 15. Пластырь по одному из пп. 1-14, отличающийся тем, что предназначен для лечения и профилактики химически вызванной рвоты. 16. Пластырь по п. 15, отличающийся тем, что рвота является острой. 17. Пластырь по п. 15, отличающийся тем, что рвота является отсроченной. 18. Пластырь по п. 1, отличающийся тем, что предназначен для лечения и профилактики рвоты, связанной с дробной химиотерапией. 19. Пластырь по п. 1, отличающийся тем, что предназначен для лечения и профилактики послеоперационной тошноты и рвоты. 20. Пластырь по п. 1, отличающийся тем, что предназначен для лечения и профилактики тошноты и рвоты, связанной с химиотерапией. 21. Пластырь по п. 1, отличающийся тем, что предназначен для лечения и профилактики послеоперационной тошноты и рвоты, связанной с лучевой терапией. 22. Пластырь по п. 1, отличающийся тем, что предназначен для лечения и профилактики тошноты и рвоты, связанной с дробной терапией рака. 23. Пластырь по п. 1, отличающийся тем, что предназначен для лечения и профилактики состояний, выбранных из группы, включающей зуд, фибромиалгию и связанную с ней боль, мигрень, тревожность, когнитивные и психотические расстройства, депрессию,шизофрению, психоз при послеродовой депрессии, синдром раздраженного толстого кишечника, алкоголизм, обструктивное дыхание во сне, болезнь движения, потерю когнитивной функции, в частности болезнь Альцгеймера, недержание мочи, дискинезию,системную красную волчанку, зуд, вызванный приемом лекарственных препаратов, преждевременное семяизвержение, расстройство процесса приема пищи, расстройство, связанное с навязчивым неврозом, расстройство двигательной функции желудка, синдром хронической усталости, диспепсию и кокаиновую зависимость. 24. Пластырь по п. 1, отличающийся тем, что содержит в адгезиве от 3 до 12 мас.гранизетрона. 25. Пластырь по п. 24, отличающийся тем, что содержит в адгезиве от 4 до 10 мас.гранизетрона. 26. Пластырь по п. 24, отличающийся тем, что содержит в адгезиве от 5 до 8 мас.гранизетрона. 27. Пластырь по п. 1, отличающийся тем, что не содержит пластификаторов или усилителей проницаемости. 28. Пластырь по п. 1, отличающийся тем, что содержит в адгезиве 6 мас.гранизетрона, а адгезив имеет поверхность от 10 до 100 см 2. 29. Пластырь по п. 28, отличающийся тем, что адгезив имеет поверхность от 15 до 50 см 2. 30. Применение гранизетрона для изготовления адгезивного пластыря по одному из пп. 1-22 и 24-29, наносимого на кожу пациента и предназначенного для лечения или профилактики рвоты, связанной с активностью 5-3 рецепторов. 31. Применение гранизетрона для изготовления адгезивного пластыря по одному из пп. 1-22 и 24-29, наносимого на кожу пациента и предназначенного для лечения или профилактики рвоты, вызванной химиотерапией. 32. Применение гранизетрона для изготовления адгезивного пластыря по одному из пп. 1-22 и 24-29, наносимого на кожу пациента и предназначенного для лечения или профилактики состояний, выбранных из группы, включающей зуд, фибромиалгию и связанную с ней боль, мигрень, тревожность, когнитивные и психотические расстройства,депрессию, шизофрению, психоз при послеродовой депрессии, синдром раздраженного толстого кишечника, алкоголизм, обструктивное дыхание во сне, болезнь движения, поте 2 12029 1 2009.06.30 рю когнитивной функции, в частности болезнь Альцгеймера, недержание мочи, дискинезию, системную красную волчанку, зуд, вызванный приемом лекарственных препаратов,преждевременное семяизвержение, расстройство процесса приема пищи, расстройство,связанное с навязчивым неврозом, расстройство двигательной функции желудка, синдром хронической усталости, диспепсию и кокаиновую зависимость. 33. Способ лечения или профилактики рвоты, связанной с активностью 5-3 рецепторов, у нуждающегося в этом пациента, включающий наложение на кожу пациента адгезивного пластыря по одному из пп. 1-22 или 24-29. 34. Способ лечения или профилактики рвоты, связанной с химиотерапией, у нуждающегося в этом пациента, включающий наложение на кожу пациента адгезивного пластыря по одному из пп. 1-22 или 24-29. 35. Способ лечения или профилактики состояний, выбранных из группы, включающей зуд, фибромиалгию и связанную с ней боль, мигрень, тревожность, когнитивные и психотические расстройства, депрессию, шизофрению, психоз при послеродовой депрессии,синдром раздраженного толстого кишечника, алкоголизм, обструктивное дыхание во сне,болезнь движения, потерю когнитивной функции, в частности болезнь Альцгеймера, недержание мочи, дискинезию, системную красную волчанку, зуд, вызванный приемом лекарственных препаратов, преждевременное семяизвержение, расстройство процесса приема пищи, расстройство, связанное с навязчивым неврозом, расстройство двигательной функции желудка, синдром хронической усталости, диспепсию и кокаиновую зависимость, у нуждающегося в этом пациента, включающий наложение на кожу пациента адгезивного пластыря по одному из пп. 1-22 или 24-29. Настоящее изобретение относится к трансдермальным пластырям, содержащим гранизетрон, их применению и методам их изготовления. Тошнота и рвота зачастую являются наиболее изнуряющими и отвращающими от лечения симптомами препаратов, вводимых пациентам, больным раком. Побочные эффекты в виде рвоты не только неприятны, так как при определенных условиях могут вести к серьезному обезвоживанию и истощению. Пациенты, принимающие противораковые препараты, имеющие в качестве побочного эффекта выраженную способность вызывать рвоту (такие как цисплатин, стрептозотоцин,кармустин, прокарбазин, мехлоретамин и дактиномицин), особенно страдают и с этой целью пользуются интенсивным сопутствующим приемом противорвотных препаратов,чтобы сдерживать неукротимую тошноту и рвоту. Другими группами пациентов, пользующихся такими схемами лечения, являются страдающие от послеоперационной тошноты и рвоты. Цитотоксическая химиотерапия, как представляется, высвобождает серотонин из некоторых клеток тонкого кишечника. Высвобожденный серотонин может стимулировать афферентный блуждающий нерв через 5-НТ 3(5-гидрокситриптамин 3) рецепторы, таким образом стимулируя рвотный рефлекс. Соответственно, предполагается, что препаратыантагонисты 5-НТ 3 рецепторов, такие как ондансетрон, гранизетрон и трописетрон, проявляют свое действие блокированием серотонина как периферически, на окончаниях блуждающего нерва, так и центрально, на хеморецепторах триггерной зоны. Противорвотные антагонисты 5-НТ 3 рецепторов обычно вводятся внутривенно, орально или ректально. Внутривенное введение может производиться только под наблюдением врача и вызывает значительный дискомфорт у пациента, такой как покраснение и жжение в месте инъекции. Трудности в педиатрической практике вызваны нелюбовью детей к иглам, и они всегда возникают при виде игольных шприцов. Оральное введение имеет недостатки, связанные с частотой приема (до 4 раз в день), а также затруднительностью такого способа приема у пациентов, страдающих от тяжелой тошноты и рвоты, у пациен 3 12029 1 2009.06.30 тов, страдающих раком головы и шеи и не могущих хорошо глотать. Прерывистость орального приема может также вызывать проблемы, связанные с отклонениями от терапевтического интервала (часто ответственными за побочные эффекты). Ректальное введение только в некоторой степени обходит прерывистость орального введения и является не самым удобным, не широко приемлемым подходом к приему лекарств. Следовательно, существует потребность в неоральных системах доставки лекарственных средств, способствующих поддерживать постоянные уровни противорвотных лекарственных средств в плазме в течение длительных периодов времени. Действительно, в настоящее время имеются другие показания для антагонистов 5-НТ 3 рецепторов, которые не могут быть полностью использованы, и это может привести к преимуществам более регулируемой доставки по сравнению с доступной в настоящее время. 5-НТ 3 рецепторы расположены в основном в периферических и центральных нейронах, и представляется, что они принимают участие в деполяризации периферических нейронов, боли и рвотном рефлексе. Таким образом, другие показания, включая зуд (.), мигрень, тревожность, когнитивные и психотические расстройства и, более специфично, лечение или предупреждение депрессии, шизофрении, послеродового психоза,фибромиалгических болей, синдрома раздраженной толстой кишки, алкоголизма, затрудненного дыхания во сне, болезни движения, снижения когнитивной функции, недержания мочи, дискинезии, системной красной волчанки, зуда, вызванного приемом лекарственных препаратов, синдрома хронической усталости (-,., 2003), преждевременного семяизвержения и расстройств процесса приема пищи, таких как булимия. Трансдермальное введение лекарств является признанным методом для поддержания относительно постоянного уровня терапевтического агента в плазме, одновременно исключающим боль, дискомфорт и неудобство внутривенного, орального или ректального способов введения лекарственных препаратов. Следовательно, после химиотерапии или в послеоперационном периоде трансдермальная противорвотная терапия имеет возможность облегчить страдания пациентов, которые не только испытывают тошноту и рвоту,вызванную начальной терапией, но и страдают от значительного дискомфорта, вызванного собственно состоянием здоровья. Различные попытки были предприняты для создания успешного способа трансдермального введения антагонистов 5-НТ 3 рецепторов. Тем не менее большая часть патентных публикаций на эту тему просто включает возможность трансдермального введения как один из способов среди многих, как возможный путь введения. Похожим образом различные патентные публикации, относящиеся к специфическим трансдермальным и ионофорезным приспособлениям, называют ондансетрон, среди других, для возможного включения в эти приспособления. 5372819 называет, среди широчайшего списка других компонентов различных классов, метоклопрамид и ондансетрон как противорвотные для включения в трансдермальный пластырь. Тем не менее это не является ни конкретным примером для любого из перечисленных лекарственных препаратов, демонстрирующим терапевтический потенциал приспособления, ни представляет результатов, касающихся трансдермального введения данных веществ. Подобно вышеуказанному в 94/07468 (.), указаны гранизетрон и ондансетрон в качестве типичных противорвотных средств в более коротком перечне соединений для включения в другое трансдермальное устройство. В выкладке японской патентной заявки 8-34731 описаны перкутанные препараты гранизетрона, использующие такие формы, как кремы, линименты, лосьоны, гели, липкие ленты и пластыри. Эти препаративные формы содержат носители и вещества, улучшающие проницаемость, которые могут быть выбраны из спиртов, жирных кислот, их эфиров и других. В примерах этой публикации использовалась кожа безволосых мышей, чтобы обеспечить проницаемость, сходную с имеющейся у человека. Несмотря на то, что кожа этих животных имеет в 10 раз более высокую проницаемость, чем человеческая, была не 4 12029 1 2009.06.30 обходимость использовать 100 см 2 пластыря. Цель настоящего изобретения - уменьшить размер пластыря, необходимого для достижения противорвотного уровня препарата в плазме. Ондансетрон является широко применяемым антагонистом 5-НТ 3. Благодаря системной природе противорвотного действия, для достижения эффекта необходим относительно высокий уровень ондансетрона в плазме. Следовательно, успешное чрескожное введение терапевтически эффективного количества ондансетрона требует, чтобы трансдермальное устройство обеспечивало относительно высокий поток лекарственного вещества через кожу. Такой высокий поток может поддерживаться в течение клинически значимого периода времени, только если лекарственного вещества содержится в пластыре достаточно много, чтобы истощение запаса лекарственного вещества не уменьшало со временем поступление вещества, то есть высокий поток поддерживался. Высокое содержание лекарственного вещества в трансдермальном пластыре обычно достигается применением так называемого резервуарного пластыря. Резервуарный пластырь содержит раствор лекарственного вещества, который позволяет создать более высокое его содержание, чем обычно может быть достигнуто в альтернативной технологии матричного пластыря. Это высокое содержание лекарственных веществ достигается применением относительно больших объемов растворителей, таких как этанол или пропиленгликоль, которые зачастую раздражают кожу. Благодаря объему своего содержимого резервуарные пластыри зачастую физически и визуально пухлые и, однажды использованные, не приклеиваются к поверхности кожи. Такие качества делают их косметически неприемлемыми для многих пациентов. Более того, приклеивание резервуарных пластырей к коже может быть субоптимальным, если клейкий слой расположен только по краю пластыря, что предназначено для того, чтобы позволить лекарственному веществу проникать из центрального резервуара через контролирующую его поступление мембрану, соприкасающуюся с кожей. По контрасту, обычные пластыри имеют способность приклеиваться к коже гораздо более эффективно благодаря тому факту, что площадь адгезива, контактирующая с кожей,равна общей эффективной площади пластыря, вследствие этого обеспечивается максимально надежное сопряжение между кожей и пластырем. Это обеспечивает эффективное использование кожи в качестве пути доставки лекарств, так же как и простоту наблюдения за тем, чтобы пластырь оставался на месте. Однако сама природа матричных пластырей устанавливает ограничение на количество активного материала, поскольку резервуар для лекарственного вещества обеспечивается адгезивной матрицей. Матричные пластыри просто не подходят для лекарств, которые должны вводиться в больших количествах, таких как ондансетрон, так как они не могут нести достаточно лекарственного вещества. Например,00/47208 и ЕР-А-1064939 описывают резервуарные пластыри с трансдермальным ондансетроном, в то же время 00/47208 специально исключает матричные пластыри на том основании, что получаемое содержание лекарственного вещества неэффективно.01/74338 описывает фармацевтический препарат лерисетрона в виде трансдермальной терапевтической системы (ТТС), содержащей подложку, соединенный с ней по меньшей мере однослойный чувствительный к давлению адгезив, резервуар активной субстанции лерисетрона на основе силиконового адгезива, чувствительного к давлению, и удаляемый защитный слой.98/53815, 3 М описывает композиции, содержащие трописетрон или гранизетрон в акриловых адгезивах, подходящих для их трансдермального введения. Тем не менее адгезивы, содержащие нуклеофильные группы, такие как гидроксил, считаются неподходящими, так как показано, что трописетрон нестабилен в их присутствии. Авторы предполагают, что эта нестабильность может быть вызвана повышенным количеством по 5 12029 1 2009.06.30 перечных связей внутри адгезива, которые могут вызвать связывание лекарственного средства с полимером, и основная природа лекарственных средств может катализировать этот процесс. Такая реакция может вызвать образование нежелательных продуктов распада лекарственного средства, а также можно ожидать снижения поступления вещества от любой связи лекарственное средство - полимер. Тем не менее было обнаружено, что в то время как адгезивы, содержащие электроотрицательные группы, такие как , не могут быть использованы в изготовлении эффективных трансдермальных пластырей, адгезивы, содержащие гидроксильные группы,значительно лучше работают, чем ненуклеофильные, электронейтральные адгезивы, и такие адгезивы существенно улучшают приток, например, гранизетрона. Таким образом, в первом аспекте, данное изобретение представляет пластырь, подходящий для трансдермального введения гранизетрона, содержащий акриловый адгезив с некислотными гидроксильными группами. Пластыри в данном изобретении предпочтительно содержат гранизетрон (-эндо-9 метил-9-азабицикло 3.3.1 нон-3-ил-1-метилиндазол-3-карбоксамид гидрохлорид), или рамосетрон -5-(1-метил-3-индолил)карбонил-4,5,6,7-тетрагидро-1 Н-бензимидазол гидрохлорид), или их смесь в качестве активного ингредиента, причем смесь менее предпочтительна. Надо отметить, что все ссылки, относящиеся к гранизетрону, включают и рамосетрон и их смеси, если не указано иначе или не очевидно. Предпочтительно, чтобы некислотные гидроксильные группы, илигруппы, обеспечивались простым приемом включения подходящих мономеров во время изготовления адгезивного полимера. Подходящие мономеры могут включать акрилаты и метакрилаты,замещенные любым желаемым способом. В частности, предпочтительными акрилатами являются гидроксиметил, гидроксиэтил и гидроксипропилакрилаты, особенно гидроксиэтилакрилат (ГЭА). Из метакрилатов предпочтительны гидроксиметил и гидроксиэтил метакрилаты. Гидроксильные группы адгезивов данного изобретения предпочтительно не связаны с другими полярными группами или частями любых других групп. В частности, желательно, чтобы ОН группа не была бы частью ,или подобных групп. Несмотря на то, что минимальный уровень таких групп может быть допустимым, предпочтительно,чтобы адгезивы данного изобретения по существу не имели определяемого уровня таких групп. Адгезивы данного изобретения предпочтительно чувствительны к давлению. Чувствительные к давлению акриловые адгезивы обычно изготавливаются из значительного количества первичного мономера акрилата, который, в большинстве коммерческих акриловых адгезивов, ограничен или 2-этилгексилакрилатом, или бутилакрилатом. Другие мономеры могут подойти, если они имеют достаточно низкую температуру стеклования (Т). Модифицированные мономеры также обычно используются и могут быть выбраны из любого винилового мономера. Модифицированные сомономеры могут быть выбраны из имеющих модифицированный эффект липкости, такие как винилацетат и стирол в полиакрилатах, или винилпирролидон и акрилонитрил в полиметакрилатах, и сомономеры, содержащие функциональные группы, которые могут включать вышеуказанные, куда желательно включитьгруппу. Типичный уровень первичных мономеров находится между 50 и 90 весовыми, но не более 98 , а модифицированные мономеры, такие как винилацетат, стирол или метакрилонитрил, обычно присутствуют в количестве от 10 до 40 весовых. Сомономеры с функциональными или гидроксильными группами предпочтительно присутствуют в количестве от 0,5 до 20 весовых, предпочтительно от 3 до 10 весовых от всех мономеров. Если содержание мономера с функциональной группой повышено, то соответственно должен быть понижен уровень других составляющих. Дополнительно адгезив может со 6 12029 1 2009.06.30 держать мономеры, имеющие поперечные связи, такие как глицидилметакрилат в количестве от 0,05 до 1 весовой, вместо эквивалентного количества первичного мономера. Адгезивный пластырь данного изобретения эффективен без дополнительного введения пластификаторов или усилителей проницаемости, таких как изопропила миристат(ИПМ). Это является преимуществом, так как сокращает количество составляющих и исключает возможный источник раздражения, а также исключает субстанцию, которая уменьшает клеящую способность адгезива. Усилители проницаемости обычно требуются в трансдермальных пластырях. Тем не менее в пластыре настоящего изобретения присутствие полярных заместителей производит удивительный эффект на чрескожное прохождение, увеличивая проницаемость до уровня, на котором все содержимое может быть израсходовано в течение 24 ч, если необходимо. Действительно, в норме ожидается, что любая форма химического взаимодействия с адгезивом будет только препятствовать проницаемости и чрескожному проникновению посредством замедления высвобождения. В сопровождающих примерах показано, что присутствие гидроксильных групп в адгезиве на самом деле облегчает высвобождение, в сравнении с высвобождением в прямо сравниваемых адгезивах, не имеющих полярных групп. Особенно удивительно то, что начальные уровни высвобождения на несколько порядков выше, чем у ненуклеофильных адгезивов, и позволяют изготавливать трансдермальные пластыри с адгезивом данного изобретения для использования в обстоятельствах, когда требуется поддержание эффективного уровня гранизетрона на протяжении часов. Пластыри настоящего изобретения также имеют способность высвобождать гранизетрон фактически неравномерно, но идеально для лечения рвоты, вызванной химическими агентами. Такая рвота может подразделяться на острую и отсроченную, где острая рвота вызвана непосредственно химиотерапией и высоким уровнем антинеопластических лекарств, а отсроченная форма является более поздним ответом. Острая реакция требует более высокого уровня противорвотных в течение периода около 12 ч со времени приема препарата, тогда как отсроченная форма требует более низкого уровня в течение последующих дней. Пластыри настоящего исследования могут употребляться для обеспечения такого режима и при самостоятельном применении будут склонны обеспечивать такой режим. Надо отметить, что термин пластырь включает любую адгезивную конструкцию,подходящую для приклеивания и подачи гранизетрона на кожу, и в общем виде состоит из подложки с адгезивом с одной стороны и физиологически эффективным количеством гранизетрона, помещенного или способного быть помещенным в адгезив. Такая конструкция может изготавливаться в виде гибкой полоски, которая, например, может быть нарезана на порции. При однократной химиотерапии антагонисты 5-НТ 3 обычно применяются для предупреждения острой тошноты и рвоты, связанной с приемом вызывающего рвоту химиотерапевтического препарата. В то время как эффективность этих агентов в острых случаях ясна, наиболее подходящая доза и зависимость между эффективностью и уровнем в плазме не выяснены. Опубликованные исследования также ясно показывают эффективность антагонистов 5-НТ 3 (вводимых с дексаметазоном) при отсроченной рвоте (.,1998., 2000), но снова нет данных о зависимости от дозы. Несмотря на недостаток информации, касающейся терапевтической релевантности,плазматический профиль является все же полезным маркером для демонстрации биоэквивалентности при прерывистых формах дозирования. Большинство форм дозирования(инъекции, таблетки и сиропы для приема внутрь) антагонистов 5-НТ 3 проявляют типичный для лекарств прерывистого приема плазматический профиль, то есть короткоеи относительно высокуюс последующим снижением его уровня в плазме, соответствующим периоду полувыведения. 7 12029 1 2009.06.30 Наиболее общим режимом приема гранизетрона в сочетании с химиотерапией является начальная доза 1-2 мг перед лечением для предупреждения острой рвоты и последующей 2 мг дневной дозой в течение 3-5 дней в комбинации с дексаметазоном для предотвращения отсроченной рвоты. Последующий двухразовый ежедневный прием 1 мг у пациентов, больных раком (Справочник практического врача, 2001), обеспечивает пиковые значения уровня в плазме около 6 нг/мл и значения клиренса 0,52 л/ч/кг. Для пациента весом 60 кг эти данные означают, что приток около 190 мкг/ч из трансдермального пластыря будет достаточен для поддержания уровня в плазме 6 нг/мл. Тем не менее для достижения эффекта при отсроченной рвоте поддержанияв плазме на данном уровне не требуется (., 1993), а минимальный необходимый уровень в плазме неизвестен. Минимальный терапевтический уровень в плазме, требуемый для эффективного применения лекарственного средства, в идеале устанавливается титрованием, пролонгированной инфузиейвместе с анализом клинической реакции пациента. Непрерывная инфузия гранизетрона со скоростью только 40 мкг/ч обеспечила (., 1998) облегчение отсроченной рвоты у раковых пациентов, предполагается, что в данном случае больше подходит поддержание более низкого плазматического уровня (около 1,5 нг/мл). Основным ограничением применения пластыря является задержка в достижении необходимого эффективного уровня в плазме. В то время как значение Ттах при оральном введении гранизетрона составляет около 2 ч, при трансдермальном введении оно значительно больше. Уровни, обеспечиваемые пластырем настоящего изобретения, начинают проявлять эффективность примерно через 2 ч, таким образом пластыри данного изобретения могут быть полезны для лечения острой рвоты. В общем, пластыри, согласно настоящему изобретению, предпочтительно накладываются пациентам от 2 до 48 ч перед лечением, причем период от 6 до 24 ч предпочтительнее. Хорошие результаты получены, когда пластырь, например, накладывался от 12 до 16 часов до начала терапии. В контексте тошноты и рвоты надо отметить, что пластыри данного изобретения годятся для лечения любых форм тошноты и рвоты, вызванных активацией 5-НТ 3 рецепторов. Такие условия в общем характерны для лечения рака, включая лучевую терапию,многодневную терапию, дробную терапию и терминальную терапию рака, каждая из которых рассматривается отдельно настоящим изобретением. Другие формы лечения рака могут также рассматриваться в изобретении, включая приведенные в описании. Когда желательно обеспечить постоянный высокий уровень гранизетрона, пластырь может накладываться, например, два раза в день или так часто, как это предписывается опытным врачом. Уровень гранизетрона в адгезиве 387-2287, производимом,может достигать около 10 весовых, 8 весовых - это выше, чем желательный уровень,так как может произойти кристаллизация. Таким образом, в предпочтительных адгезивах изобретения уровень гранизетрона ниже, чем 8 весовых. Желательно обеспечить уровень гранизетрона выше, чем 4 весовых, 5 более предпочтительно. В частности,предпочтительно обеспечить уровень от 6 до 7,7 весовых. Для предпочтительных адгезивов, в пластырях, содержащих до 7,7 , не было замечено кристаллизации через 1 месяц. Концентрация гранизетрона в пластыре находится в пределах от 6 до 8 , но,принимая во внимание возраст и вес пациентов, так же как их физическое состояние и другие сопутствующие терапии, подходящий уровень гранизетрона определяется опытным врачом. В настоящее время предпочтительный уровень составляет 6 весовых. В целом, желательно избегать кристаллизации гранизетрона в пластырях данного изобретения из соображений стоимости. Тем не менее кристаллизация просто представляет резервуар лекарственного вещества, которое может растворяться в пластыре, и откуда оно может доставляться пациенту, когда в пластыре истощится, хотя бы частично, начальный 8 12029 1 2009.06.30 уровень гранизетрона. Если пластырь предназначен для немедленной быстрой доставки,например, то кристаллизация не представляет преимущества в дополнение к стоимости продукции. Следует также отметить, что пластырь может быть любого подходящего размера. В целом, пластыри размером до 100 см 2 или более подходят для введения эффективных доз гранизетрона пациенту. Если желателен такой размер, то это может достигаться применением одного пластыря, который может иметь любую желаемую форму, такую как круглая или квадратная, и который может быть, например, перфорированным, или же могут применяться два и более пластыря. Надо также отметить, что лечение можно начинать с одного или более пластырей полной желательной площади, а достигнутый уровень гранизетрона может поддерживаться, например, регулярным наложением меньших пластырей через интервалы, определенные опытным врачом. В общем, при содержании гранизетрона около 6 весовых было найдено, что подходящий размер пластыря находится между 10 и 100 см 2, предпочтительнее между 15 и 50 см 2, где пластырь размером около 40 см 2 в целом обеспечивает уровень в плазме, эквивалентный приему таблетки, содержащей 1 мг гранизетрона. Пластыри могут поставляться различных размеров или могут отрезаться нужного размера, и, таким образом, размер пластыря и содержание лекарства может просто подбираться опытным врачом, с широким варьированием его уровня в плазме. Также преимуществом данного изобретения является то, что поток из пластыря настолько велик, что маленькие пластыри могут легко употребляться для получения достаточного эффекта, а большие пластыри, такие как описаны в 98/53815, обычно не являются необходимыми, если только, например, не требуется массивного поступления лекарства. Полярные группы полимерных цепей адгезива дают дополнительное преимущество,увеличивая адгезию к коже. Включение таких групп также увеличивает возможности лекарственной формы, поскольку позволяет достигнуть поперечного связывания адгезива, таким образом улучшая когезию адгезивной матрицы в условиях трехмерной стабильности. Следует отметить, что пластыри настоящего изобретения могут содержать компоненты, отличные от адгезива и гранизетрона. Подходящие подложки, например, описаны ниже. Они могут иметь любую подходящую форму, могут быть, например, в виде пленок и тканей. Пленки могут быть выбраны за то, что пропускают воздух, или за окклюзионные качества. Можно применять металлизированные пленки, но в общем предпочтительно использовать пластмассы, такие как полиэтилена терефталат (ПЭТ). Материалы могут быть выбраны тканые и нетканые, при том что нетканые обычно обеспечивают большую гибкость. Такие материалы обычно сильно пористые, и желательно пропитывать их веществом, отталкивающим лекарственное вещество, и дополнительно водооталкивающим веществом, как это обычно делается. Адгезив обычно наносится слоем непосредственно на подложку, которая в свою очередь может быть многослойной. Адгезив подходит для прямого склеивания с большинством подложек, но может возникнуть необходимость или желание, в некоторых обстоятельствах, обеспечить более крепкое соединение адгезива с подложкой, такое как с помощью поперечно-связующего слоя. В то время как обычно нежелательно и не необходимо вводить другие ингредиенты в адгезив настоящего изобретения, надо отметить, что дополнительные компоненты могут при желании быть добавлены, и такие лекарственной формы или условия с другими ингредиентами могут иметь преимущества. Например, добавление растительного масла может использоваться для дальнейшего улучшения раннего высвобождения, подходящие примеры включают кокосовое масло и арахисовое масло. Такие ингредиенты, как мягчители и липкие агенты, тоже могут включаться, но в общем желательно минимизировать такие ингредиенты. 9 12029 1 2009.06.30 Пластыри настоящего изобретения также полезны при лечении рвоты, вызванной дробной химиотерапией. Режим дробной химиотерапии включает введение препаратов химиотерапии в следующие друг за другом дни в сниженных дозах, что предназначено для уменьшения побочных эффектов и увеличения эффективности. К сожалению, побочные эффекты, связанные с дробной химиотерапией, также включают значительную тошноту и рвоту, и в связи с этим антагонисты 5-НТ 3, включая гранизетрон, также применяются в этом режиме лечения. Дробная химиотерапия обычно назначается на период свыше 5 дней (хотя это может варьировать), и связанные с ней симптомы тошноты и рвоты предупреждаются дневными дозами противорвотных - в случае гранизетрона это 2 мг в день. Отсюда, схема приема подобна той, что применяется для предупреждения острой и отсроченной рвоты, связанной с однократной дозой химиотерапии. Пластыри, предохраняющие от тошноты и рвоты, связанной с дробной химиотерапией, могут быть сконструированы таким образом, чтобы доставлять более высокие дозы лекарственного вещества, чем для однократной дозы химиотерапии, и это легко достигается манипуляциями с площадью пластыря и содержащейся в нем дозой. Пластыри данного изобретения также могут использоваться для лечения и профилактики послеоперационной тошноты и рвоты (ПОТР). Отметим, что применяемое, как здесь указано, лечение включает профилактику. ПОТР остается частым и неприятным симптомом для пациентов, перенесших оперативное вмешательство. Примерно 20-30 хирургических больных страдают симптомами ПОТР, в зависимости от индивидуальных факторов, вида и продолжительности анестезии и вида хирургического вмешательства. ПОТР может вызывать дегидратацию, нарушение баланса электролитов, увеличение продолжительности нахождения в послеоперационном блоке, увеличение времени пребывания в стационаре и потерю трудоспособности. Как в случае с тошнотой и рвотой,вызванной химиотерапией, добавление дексаметазона к назначениям повышает эффективность лечения. Обычный режим приема для предотвращения послеоперационной тошноты и рвоты это однократный прием антагонистов 5-НТ 3 немедленно перед или после операции. Такие дозы могут быть заменены трансдермальным пластырем, наложенным перед операцией, в свете последних исследований возможно снижение дозы гранизетрона, необходимой для предупреждения послеоперационной тошноты и рвоты. На основании клинических данных одного из исследований возможно предположить, что гранизетрон был эффективен для предупреждения послеоперационной тошноты и рвоты в таких низких дозах, как 0,1 мг, которые легко могут быть введены пластырями данного изобретения. Другими показаниями, как указано выше, могут быть зуд, лечение и профилактика фибромиалгии и связанных с ней болей, мигрень, тревожность, когнитивные и психотические расстройства, депрессия, шизофрения, послеродовой психоз, синдром раздраженного толстого кишечника, алкоголизм, обструктивное дыхания во сне, болезнь движения, потеря когнитивной функции, такая как болезнь Альцгеймера, недержание мочи, дискинезия,системная красная волчанка, зуд, вызванный приемом лекарственных препаратов, преждевременное семяизвержение, расстройства процесса приема пищи, обсессивнокомпульсивные расстройства, расстройства моторики желудка (диарея), синдром хронической усталости, диспепсия и кокаиновая зависимость. Настоящее изобретение далее иллюстрировано следующими, не ограничивающими его, примерами, сопровождаемыми фигурами, где фиг. 1 показывает проникновение (мкг/см 2) гранизетрона из препаративных форм, содержащих 3 гранизетрона в разных адгезивах через кожу мышейфиг. 2 показывает проникновение гранизетрона из препаратов гранизетрона в адгезивных полимерах через кожу мышейфиг. 3 показывает относительное проникновение гранизетрона из выбранного адгезива через кожу человекав процентах 10 12029 1 2009.06.30 фиг. 4 показывает экспериментальное и смоделированноепроникновение гранизетрона из выбранного адгезива через кожу человека фиг. 5 показывает смоделированные плазматические профили гранизетрона от наложения 10 см 2 пластыря в сравнении с профилями в плазме, полученными экспериментально фиг. 6 показывает основной уровень гранизетрона в плазме после наложения одного 15 см 2 пластыря добровольцам. Пример 1. Для изучения возможности введения гранизетрона в адгезив, содержащий нуклеофильные мономеры, лекарственное вещество было помещено в четыре различных адгезива, производимых. Как перечислено в табл. 1, один адгезив содержал полимер без функциональных групп, два содержали полимер с кислотной функциональной группой и четвертый содержал гидроксильную функциональную группу. Таблица 1 Функциональнаямономера с функАдгезив Химическое вещество группа циональной группой 4098 акрилат-винилакрилат Нет 02052 акрилат-винилакрилат-мономера с функциональной группой обозначает примерный уровень (вес.) СООН или ОН содержащего мономера, использованного для изготовления адгезива, с 10 допуском. Сопроводительная фиг. 1 представляет проникновение (мкг/см 2) из 3 препаратов гранизетрона через кожу мышейв адгезивах, перечисленных в табл. 1. Каждый из этих образцов обладал покрывающим слоем весом 85 г/м 2, чтобы обеспечить содержание лекарственного вещества приблизительно 260 мкг/см 2. Кристаллизация не наблюдалась ни в одном из изготовленных образцов. Табл. 2 показывает уровни проникновения из различных образцов за разные интервалы времени и показывает, что уровень притока из 2287 в 30 раз больше, чем полученные у ненуклеофильного электронейтрального 4098. Причина такого высокого уровня расхождения в высвобождении лекарственного вещества из адгезива 2287. Таблица 2 Функциональная Проницаемость (мкг/см 2) Адгезив группа 3 6 12 24 36 484098 нет 1 2,9 13,4 48,5/ 129,82052 СООН 0,8 2,3 16,1 15,9 24,8 33,32353 СООН 0,3 0,8 1,7 3,7 5,4 7,22287 ОН 31,7 92,0 170,8 256,6 282,4 290,4 Проницаемость из адгезивов, содержащих кислотные группы, была гораздо ниже, чем из адгезивов без функциональных групп. В табл. 3 представлены те же самые данные, что и в табл. 2, но интерпретированные таким образом, чтобы показывать примерный поток. Таблица 3 2 Функциональная Примерный поток (мкг/см /ч) Адгезив группа 3 6 12 24 36 484098 нет 0,33 0,48 1,1 2,0 2,72052 12029 1 2009.06.30 В табл. 4 представлены те же данные, пересчитанные так, чтобы отражать абсолютный поток, который взят как градиент в избранной временной точке через начальные шесть часов, и демонстрировать дальнейшее превосходство пластырей данного изобретения. Ожидается, что пластыри со значительно большим количеством лекарственного средства будут доставлять более высокие дозы за более длительное время. Таблица 4 2 Функциональная Абсолютный поток (мкг/см /ч) Адгезив группа 3 6 12 24 36 484098 нет 0,33 0,63 1,8 2,9 3,32052 СООН 0,27 0,5 2,3 0,74 0,712353 СООН 0,10 0,17 0,15 0,17 0,15 0,152287 ОН 10,6 20,1 13,1 7,2 2,2 0,67 Наблюдалась удивительно высокая степень проницаемости гранизетрона из адгезива,содержащего гидроксильную группу (фиг. 1). Поток из этой препаративной формы был существенно выше, так что гранизетрон истощался в устройстве всего через 24 ч (что отражается в уплощении кривой проницаемости для состава с 2287 на фиг. 1). Это полное истощение означает, что, похоже, нет никакого остаточного взаимодействия между лекарственным веществом и данным адгезивом. Относительное истощение в составах,выраженное в , наблюдавшееся после 24-часового периода, представлено на фиг. 2, которая представляет проницаемость ( от дозы) гранизетрона через кожу мышейиз составов, содержащих адгезивные полимеры с различными функциональными группами,и ясно демонстрирует удивительную эффективность состава 2287. Пример 2. Исследована стабильность лекарственного препарата в самом лучшем составе из примера 1. Данные стабильности для пластырей, имеющих в составе 2287 и хранившихся при трех температурных режимах, как показано в табл. 5. Не наблюдалось снижения содержания гранизетрона в пластырях, даже при условиях 40 С лекарственное вещество оставалось стабильным в данном устройстве. Таблица 5 Стабильность гранизетрона в пластырях Температура хранения Время хранениягранизетрона 40 С 6 недель 99,3 25 С 6 недель 99,4 5 С 6 недель 99,4 Стандарт 99,5 Фиг. 3 показывает проницаемость гранизетрона через кожу человекаиз 387-2287 адгезива (4) и представляет применение покрывающего состава, содержащего 8 гранизетрона, с весом на единицу площади 110 г/м 2. Это соответствует содержанию гранизетрона около 880 мкг/см 2. Через 96 ч общая проницаемость составила около 600 мкг/см 2, что равно около 70 содержимого пластыря. Хотя проницаемость после 96 часов вышла на плато, можно допустить, что пластырь продолжал бы доставлять лекарственное вещество еще в течение 24 ч. Фиг. 4 - это кривая градиента фиг. 1 с течением времени, то есть изображение потока во времени. Фиг. 4 показывает экспериментальную и смоделированнуюпроницаемость гранизетрона через кожу человека из 2287 адгезива (мкг/см 2/ч). Профиль этого потока был смоделирован и использован как исходные данные для простой фармакокиентической модели (основанной на РК данных, полученных от пациентов) для предсказания действияпластыря 10 см 2, как показано на фиг. 5. 12 12029 1 2009.06.30 Фиг. 5 моделирует профили гранизетрона в плазме при использовании 10 см 2 пластыря в сравнении с экспериментальными профилями, при стабильных условиях после повторяющегося приема пациентами 1 мг гранизетрона орально. Данные на фиг. 3 показывают, что лекарственная форма будет доставлять лекарственное вещество через кожу в течение нескольких дней и подходит для пятидневного периода,так как гранизетрон часто назначается. Фиг. 3 также показывает предсказанный эффект от применения трансдермального пластыря в разное время, то есть до химиотерапии, и демонстрирует, как такое устройство может применяться на практике для защиты против острой и отсроченной рвоты, так же как от рвоты, связанной с дробной химиотерапией. Пример 3. Замедленное введение гранизетронау мужчин. Приготовление пластырей. Пластыри с гранизетроном были выработаны из покрывающего раствора, приготовленного следующим образом 1. Определили содержание твердого 2287 и адгезив растворили в этилацетате с нижней границей 49 по спецификации. Раствор затем перемешивался в мешалке в течение 15 минут. 2. Гранизетрон растворяли в диметилацетамиде (ДМА), пока не был получен прозрачный раствор (примерно 67 мг/мл). 3. Адгезивный раствор со стадии 1 смешали с раствором гранизетрона, полученным на стадии 2. Целью процесса было получить ламинат с показателем массы на площадь 110 г/см 2,низким уровнем растворителей и ограничить разложение лекарственного вещества при сушке ламината. Покрывающий раствор был нанесен на прокладочный материал (2000 100 мкм),чтобы получить массу на площадь 110 г/см 2. Затем он был заламинирован пленкой подложки 15 . Изготовление и стабильность покрывающего раствора не представили проблем. Активный и плацебо растворы легко наносились с требуемым показателем массы на площадь 110 г/см 2. Хорошие результаты были получены при нанесении при 90 С со скоростью нанесения 0,1 м/мин. Пластыри (15 см 2) были извлечены из ламината и упакованы в алюминиевые мешочки. Каждый 15 см 2 мешочек содержит 6 весовых гранизетрона в адгезиве (общее содержание около 10 мг на мешочек, или 660 мкг/см 2). 1 стадия исследования на добровольцах проводилась, чтобы установить системную биодоступность гранизетрона из пластыря вместе с местной и системной переносимостью устройства. Пластыри накладывали на живот добровольцев на 5 дней (120 ч) и забирали образцы крови в течение периода наложения. Результаты представлены в табл. 6 и на фиг. 6, показывающие значения уровня гранизетрона в плазме после наложения одного 15 см 2 пластыря добровольцам (11). Таблица 6 Предмет 117 1,379 72 Геометрическое значение 114 1,5 Геометрическое значение 88 72 площадь под кривой, от времени ноль до 132 чмаксимальная концентрациястандартное отклонениепроцентный коэффициент вариабельности. Данные на фиг. 6 являются уровнями гранизетрона в образцах, полученных от добровольцев. 13 12029 1 2009.06.30 Исследование показало замедленную биодоступность гранизетрона 15 см 2 трансдермальный пластырь. Пластырь демонстрирует низкую способность раздражения кожи и приемлемую адгезивность. Гранизетроновый пластырь был безопасным и хорошо переносимым у всех добровольцев, как местно, так и системно. Принимая во внимание данные, полученные в результате исследованияна добровольцах о применении пластыря 15 см 2, и фармакокинетический анализ и сравнение с известным(3,6 нг/мл) у добровольцев, принимавших однократно 1 мг таблетку гранизетрона (,), позволяют сделать заключение, что незначительно больший пластырь, примерно 40 см 2, обеспечил бы соответствующие уровни гранизетрона, оптимальные по эффективности. Пластырь такой площади легко приемлем. Понятно, что размер пластыря может определяться в зависимости от потребности пациента и опыта врача, и могут применяться пластыри желательного размера, и больше и меньше чем 40 см 2. Источники информации 1.,,,,,.. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 15
МПК / Метки
МПК: A61K 9/70
Метки: трансдермального, пластырь, адгезивный, гранизетрона, введения
Код ссылки
<a href="https://by.patents.su/15-12029-adgezivnyjj-plastyr-dlya-transdermalnogo-vvedeniya-granizetrona.html" rel="bookmark" title="База патентов Беларуси">Адгезивный пластырь для трансдермального введения гранизетрона</a>