Пролекарство для терапии опухолей и воспалительных заболеваний
Номер патента: 5789
Опубликовано: 30.12.2003
Авторы: Клод МОННЕРЕ, Райнер ШТРАУБ, Клаус БОСЛЕТ, Жан-Клод ФЛОРЭН, Ерг ЧЕХ, Фредерик ШМИДТ, Манфред ГЕРКЕН
Текст
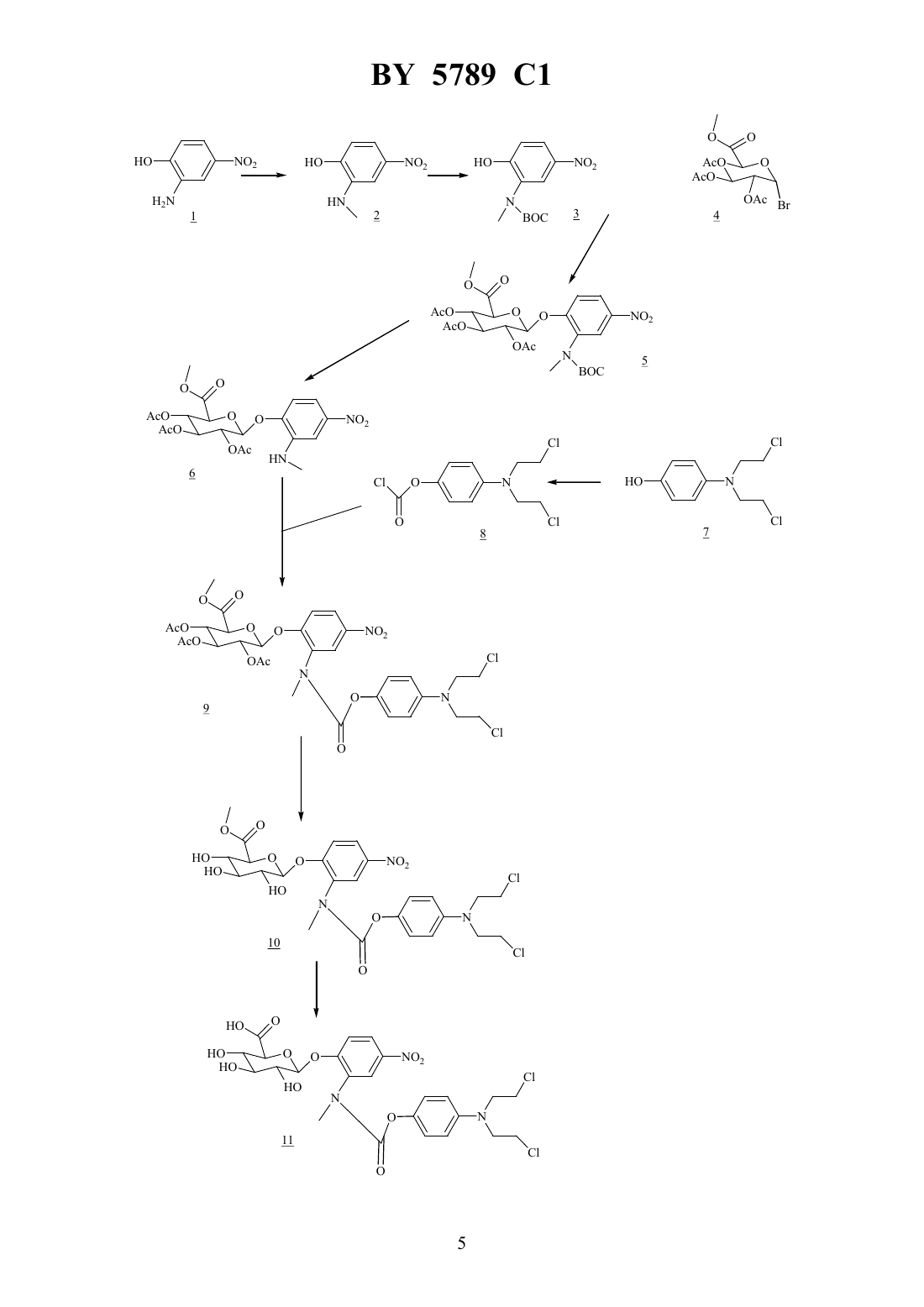
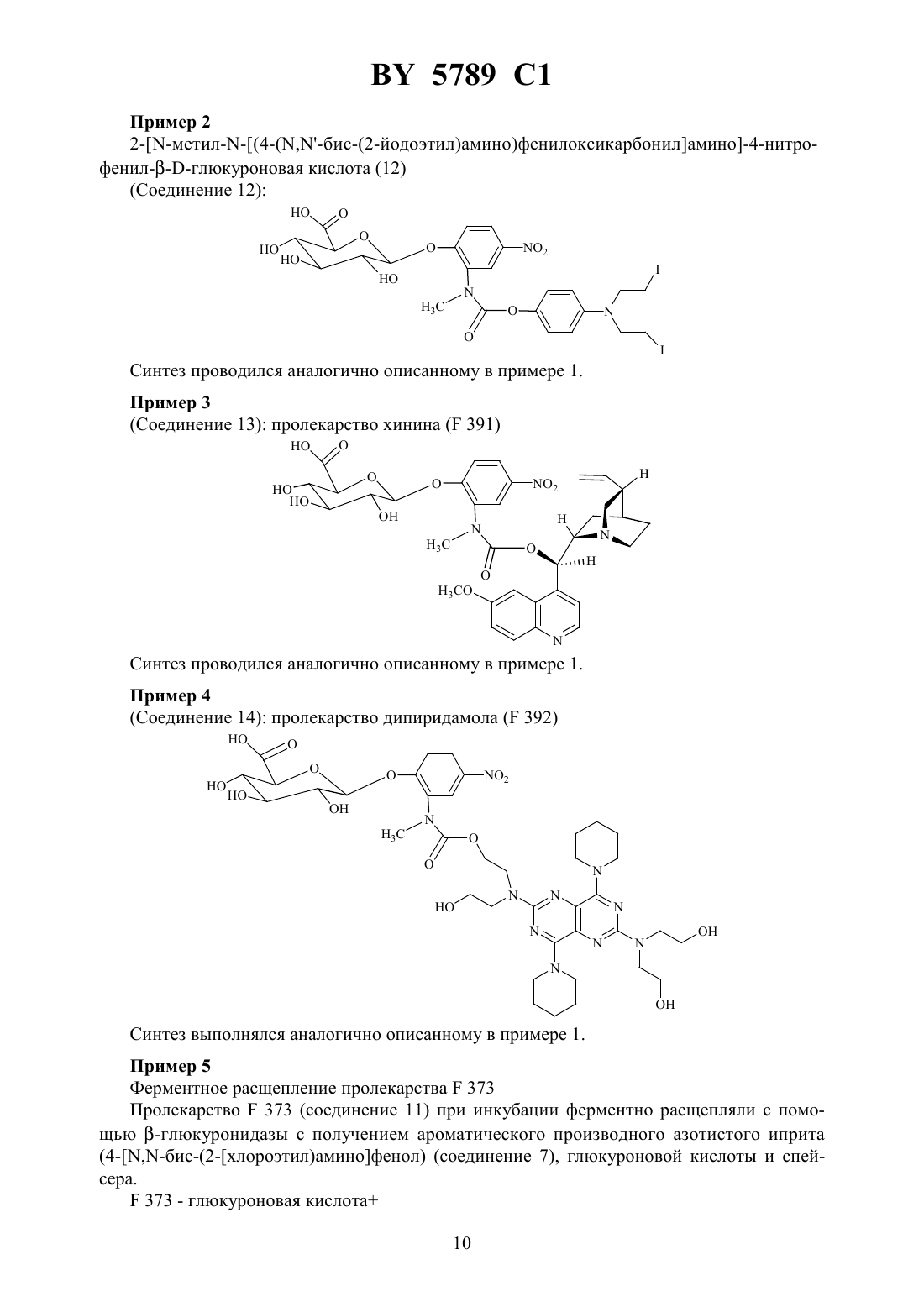
61 35/00 НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ПРОЛЕКАРСТВО ДЛЯ ТЕРАПИИ ОПУХОЛЕЙ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ(71) Заявитель Авентис Фарма Дойчланд ГмбХ(72) Авторы Клаус БОСЛЕТЕрг ЧЕХМанфред ГЕРКЕНРайнер ШТРАУБКлод МОННЕРЕЖан-Клод ФЛОРЭНФредерик ШМИДТ(73) Патентообладатель Авентис Фарма Дойчланд ГмбХ(57) 1. Пролекарство для терапии опухолей и воспалительных заболеваний общей формулыгликозил-активное начало или физиологически переносимые соли соединения формулы ,где гликозил - ферментно отщепляемый моносахарид, предпочтительно ферментно отщепляемая глюкуроновая кислота- фенил- водород, цианогруппа, нитрогруппа, фтор, хлор или бром- целое число 0, 1 или 2- кислород- группы -(3)-, -(3)2, -(3), -(3)2-(1-4-алкил)- или-(3)-(1-4-алкил)активное начало - биологически активное соединение, связанное через атом кислорода, первичный или вторичный аминорадикал или иминорадикал. 2. Пролекарство по п. 1, отличающееся тем, что соединение формулыпредставляет собой 2 метил(4-(,-бис(2-хлорэтил)амино)фенилоксикарбониламино-4-нитрофенилглюкуроновую кислоту,2 метил(4-(,-бис(2-йодэтил)амино)фенилоксикарбониламино-4-нитрофенилглюкуроновую кислоту,(56)0511917 1, 1992.0410366 2, 1991.0595133 2, 1994.0696456 2, 1996. Машковский М.Д. Лекарственные средства. - М. Медицина, 1993. Ч. 2. - С. 534-535. Действие лекарств очень часто проявляется в том, что ими подавляется деятельность ферментов, цитокинов или других генов, стимулирующих заболевание и патологически избыточно выделяющихся при определенных заболеваниях. Разумеется, подавляющий эффект лекарств распространяется не только на фармакологически целевые структуры(ферменты, цитокины, гены) пораженной ткани, ими также тормозятся процессы, протекающие в здоровых тканях. Поэтому при использовании многих лекарств наблюдаются нежелательные побочные действия. Для снижения побочных эффектов лекарств были разработаны экспериментальные системы, позволяющие выборочное выделение лекарств в пораженной ткани. Ниже приводится краткое описание таких систем. Система направленной на антитело терапии ферментным пролекарством (далее АТФП) (, , 1987 г., в журнале . . ., 56, стр. 531-532) представляет собой двухстадийную систему, при которой на первой стадии внутривенно впрыскивают конъюгат антитела и фермента (КАФ). Благодаря своей опухолевой избирательности КАФ остается в опухоли, а из здоровых тканей выводится через 2-7 суток. На второй стадии внутривенно введенное пролекарство (нетоксичная лекарственная предстадия) превращается внутри опухоли в результате ферментной активности КАФ в токсичное лекарство. Как следствие активации такого специфичного противоопухолевого пролекарства наблюдается повышение концентрации лекарства внутри опухоли (в 5-50 раз) и снижение его концентрации в здоровой ткани по сравнению со стандартной терапией. В результате на моделях ксенотрансплантата опухоли человека(, и др., 1991 г., в журнале,9, стр. 225-231) отмечены более легкая переносимость и превосходящие терапевтические эффекты. Аналогично системе АТФП работает и программа активации пролекарства через слияние белка (далее - АПСБ) , при которой вместо чужеродного и, следовательно, иммуногенного КАФ используется неиммуногенный слившийся белок человека для активизации избирательного действия на опухоль пролекарства ( и др., 1994 г., в журнале. 54, стр. 2151-2159). И в системе терапии зависимым от переносчика ферментным пролекарством (далее ТЗПФП) (,и др., в журнале.,2 5789 155, стр. 4808-4812), являющейся двухстадийным генно-терапевтическим приемом, пролекарства активируются избирательно в отношении опухоли после инъекции переносчика и экспрессии структурного гена, кодирующего фермент. Эндогенная активация пролекарств (глюкуронил-спейсер-антрациклин), (-,и др., 1991 г., Международная заявка 92/19639) в некротических опухолях и при воспалительных процессах в сочетании с выраженными противоопухолевыми и противовоспалительными фармакологическими эффектами были впервые описаныи др., 1994 г., в журнале.,54, стр. 2151-2159 и 1995 г., в журнале, 1, стр. 45-50, как монотерапия пролекарствами (МТП) (). Во время фармакологического употребления системы МТП было установлено, что решающее значение для эффективностиимеют как химия самоэлиминирующегося спейсера, так и гидрофильность и молярная цитотоксичность лекарственного компонента пролекарства. Дополнительное повышение эффективности МТП наблюдалось в комбинации с веществами, индуцирующими некрозы (Европейский патент ЕР 0696456 А 2). Прежде всего, применение конъюгатов антител, обладающих специфичностью в отношении рецепторного комплекса / и ковалентно связанных с коагулирующими белками, как, например, укороченный фактор ткани, оказалось особенно эффективным в фармакологических моделяхв сочетании с приемлемыми пролекарствами. Задачей изобретения является разработка пролекарства, обладающего повышенной эффективностью, а также повышенной устойчивостью, причем одновременно обеспечена его хорошая ферментная расщепляемость, а также получение лекарственного средства и фармацевтической композиции, содержащих такое пролекарство. Неожиданным образом удалось синтезировать пролекарства, которые после соответствующей эндогенной ферментной активации оказалисьеще более эффективными,чем пролекарства, описанные в Европейских патентах ЕР 0511917 А 1 и ЕР 0595133 А 2. Такое превосходное действие обусловлено, с одной стороны, специфической и благоприятной химией спейсера и, с другой стороны, большой молярной цитотоксичностью использованного лекарственного компонента. Новая благоприятная химия спейсера характеризуется тем, что особенно при наличии активных начал, связанных через гидроксильную группу со спейсером, активное начало выделяется после ферментного расщепления гликозильного остатка путем циклизации и отщепления спейсера. В результате повышается устойчивость пролекарства при одновременной хорошей ферментной расщепляемости. Пролекарства согласно изобретению, кроме того, более устойчивы в физиологических условиях, чем известные пролекарства, поскольку они не так быстро выделяют активное начало. Изобретение касается пролекарства формулыгликозил-ктивн начало и/или физиологически переносимых солей соединения формулы , где гликозил - это ферментно отщепляемый моносахарид, предпочтительно ферментно отщепляемая глюкуроновая кислота- фенил- водород, цианогруппа, нитрогруппа, фтор, хлор, или бром- целое число 0, 1 или 2- кислород- группы -3 -, -(3 )2 , -(3 )-, -(3 )2 -( 1 - 4 -алкил)- или-СН(СН 3)-(С 1-С 4-алкил)активное начало - биологически активное соединение, связанное через атом кислорода,первичный или вторичный аминорадикал или иминорадикал. В качестве активного начала приемлемы такие соединения, как, например, антрациклин, преимущественно доксорубицин, 4-эпи-доксорубицин, 4- или 4-дезоксидоксорубицин или соединение, предпочтительно выбранное из группы этопосид, 3 5789 1 бис(2-хлорэтил)-4-гидроксианилин, 4-гидроксициклофосфамид, виндезин, винбластин,винкристин, терфенадин, тербуталин, фенотерол, сальбутамол, мускарин, оксифенбутазон, салициловая кислота, парааминосалициловая кислота, 5-фтороурацил, 5 фтороцитидин, 5-фтороуридин, метотрексат, диклофенак, флуфоаминовая кислота, 4 метиламинофеназон, теофиллин, нифедипин, митомицин С, митоксантрон, камптотецин,мета-АМСА, таксол, нокодазол, колчицин, циклофосфамид, рашелмицин, цисплатин,мелфалан, беломицин, азот-горчичный газ, фосфорамид-горчичный газ, кверцетин, геништейн, эрбстатин, тирфостин, роитукин-производное -)-цис-5,7-дигидрокси-2-(2-хлорфенил)-8-4-(3-гидрокси-1-метил)-пиперидинил-4 Н-1-бензопиран-4-он см. Европейский патент ЕР 0 366 061), ретинолевая кислота, масляная кислота, форбольный эфир, диметилсульфоксид,аклациномицин, прогестерон, бузерелин, тамоксифен, мифепристон, онапристон, (4-аминобутил)-5-хлоро-2-нафтален-сульфонамид, пиридинил-оксазол-2-он, хинолилоксазолон-2-он, изохинолилоксазолон-2-он, стауроспорин, этаноламин,верапамил, форсколин, 1,9-дидеоксифорсколин, хинин, хинидин,резерпин, 18-О-(3,5-диметокси-4-гидроксибензоил)-резерпат, лонидамин, бутионинсульфоксимин, диэтилдитиокарбамат, циклоспорин А, азатиоприн, хлорамбуцил, амид (4-трифторметил)-фенил-2-циано-3-гидроксикротоновой кислоты (см. Международную заявку 91 17748), 15-деоксиспергуалин,506, ибупрофен, индометацин, аспирин,сульфазалазин, пенициллинамин, хлорохин, дексаметазон, преднизолон, лидокаин, пропафенон, прокаин, мефонаминовая кислота, парацетамол, 4-аминофеназон, мускозин, орципреналин, изопреналин, амилорид, пара-нитрофенилгуанидинбензоат или их производные, дополнительно замещенные одной или несколькими гидрокси-, амино- или иминогруппами. Кроме того, активное начало может иметь значения, дополнительно приведенные в Европейской заявке 595 133 на стр. 4 и 5, а гликозил может также означать указанные там моносахариды. Предпочтительно активное начало представляет собой указанное в примерах соединение азотистого иприта, хинин или дипиридамол. В нижеследующем приведены особенно предпочтительные пролекарства согласно изобретению Пример 1 Производное азотистого иприта в качестве пролекарства (373 соединение 11) синтезировали следующим образом В качестве исходного вещества брали 2-амино-4-нитрофенол (соединение 1). Сначала соединение 1 монометилировали с помощью йодистого метила (соединение 2), а аминогруппу защитили как БОК-производное (БОК-трет.бутилоксикарбонил) (соединение 3). Защищенную глюкуроновую кислоту вводили посредством соединения 3 и бромида (соединение 4), связанных окисью серебра, с получением соединения 5. После отщепления БОК-защитной группы действием соляной кислоты получали амин (соединение 6). Соединение 7 превращали в хлороформат (соединение 8) и конденсировали с хлороформатом (соединение 8) с получением соединения 9. После расщепления сложных эфиров глюкуроновокислой части соединения 3, в две стадии (метилат натрия/метиловый спирт,затем водная гидроокись натрия) через соединение 10 получили пролекарство (соединение 11). 4 5789 1 Соединение 2 2-(-метиламино)-4-нитрофенол (2). В раствор 2-амино-4-нитрофенола (1) (1,54 г, 10 ммолей) и йодистого метила (1 мл,16 ммолей) в метаноле (10 мл) добавляли триэтиламин (2 мл, 14,4 ммоля). Через час при 40 С дополнительно добавляли йодистый метил (1 мл) и триэтиламин (1 мл) и перемешивали при 40 С в течение 2 часов. В вакууме реакционную смесь сгущали до сухого остатка, добавляли в водный 2 Н раствор ацетата натрия и экстрагировали уксусным эфиром. Органическую фазу сушили над сульфатом натрия и хроматографировали на силикагеле(носитель дихлорметан/метанол, 955). Выход целевого продукта 880 мг (52 ). 7823 Расчет С 50,02 Н 4,76 16,73 Найдено С 50,00 Н 4,80 16,66 Температура плавления 148 С (толуол) 1 Н ЯМР (250 МГц, диметилсульфоксид)7,44(дд, орто 9,0 Гц, мета 3,0 Гц, 1 Н),7,13 (д,3,0 Гц, 1),6,77 (д,9,0 Гц, 1),2,76 (с, 3 Н). ИКС (бромид калия) (см-1) 3363, 1538, 1338 (2). МС (диссоц.-хим. ионизация, аммиак) м/ МН 169 Соединение 3 2-(-БОК,-метиламино)-4-нитрофенол (3) В раствор 2 метиламино-4-нитрофенола (2) (4,18 г, 24,9 ммоля) в тетрагидрофуране(50 мл) добавляли ди-трет.-бутилдикарбонат (14 г, 64,15 ммолей), карбонат калия (17 г,123 ммоля) и воду (50 мл) и в течение ночи перемешивали при комнатной температуре. Реакционную смесь подкисляли насыщенным водным раствором хлорида аммония, экстрагировали уксусным эфиром, сушили сульфатом натрия и сгущали в вакууме. Сырой продукт в течение 2 часов перемешивали в метаноле (100 мл) с карбонатом калия (17 г,123 ммоля), подкисляли насыщенным водным раствором хлорида аммония, экстрагировали уксусным эфиром, сушили над сульфатом натрия и сгущали в вакууме. Продукт хроматографировали на силикагеле (носитель дихлорметан/метанол, 97,52,5). Выход целевого продукта составил 6,2 г (93 ). 121625 Расчет С 53,72 Н 6,01 10,44 Найдено С 53,64 Н 6,20 10,36 Температура плавления 197 С (толуол/петролейный эфир) 1 Н ЯМР (250 МГц, диметилсульфоксид)8,10-8,00 (2 Н),7,03(д,8,5 Гц, 1 Н). 3,04 (с, 3 Н),1,40-1,30 (9 Н). ИКС (бромид калия) (см-1) 3129 (ОН), 1672 (СО), 1529, 1339 (О 2) МС (диссоц.-хим. ионизация, аммиак) м/е МН 269,МН-С 4 Н 8213,-48169. Соединение 5 Сложный метиловый эфир 2-(-БОК,-метиламино)-4-нитрофенил-2,3,4-три-О-ацетилглюкуроновой кислоты (5) В раствор бромида сложного метилового эфира 2,3,4-три-О-ацетилглюкуроновой кислоты (4) (126 мг, 0,317 ммоля) в ацетонитриле (5 мл) добавили окись серебра (0,23 г,6 5789 1 0,992 ммоля) и 2-(-БОК,-метиламино-4-нитрофенол (3). Реакционную смесь перемешивали в течение часа при комнатной температуре, фильтровали через целит и сгущали в вакууме. Продукт хроматографировали на силикагеле (растворитель дихлорметан/метанол, 97,52,5). Выход целевого продукта составил 165 мг (89 ). 2532214 Расчет С 51,37 Н 5,52 4,79 Найдено С 51,79 Н 5,724,66 Температура плавления 80 С (толуол/петролейный эфир) 20-39 (с 1,02 в хлороформе). 1 ЯМР (250 МГц, дейтерир. хлороформ)8,14 (дд, орто 9,0 Гц, мета 2,5 Гц, 1),8,15-8,05 (1),7,30-7,20 (1),5,45-5,30 (4 Н),4,25 (д,9,0 Гц, 1),3,73 (с, 3 Н),3,13 (с, 3 Н),2,15-2,05 (9 Н),1,65-1,40 (9 Н). ИКС (дейтерир. хлороформ) (см-1) 1760 (СО, эфир), 1699 (СО, карбамат), 1529,1349(2). МС (диссоц.-хим. ионизация, аммиак) м/е МН 602. Соединение 6 Сложный метиловый эфир 2-(-метиламино)-4-нитрофенил-2,3,4-три-О-ацетилглюкуроновой кислоты (6) Раствор сложного метилового эфира 2-(-БОК,-метиламино)-4-нитрофенил-2,3,4-триО-ацетилглюкуроновой кислоты (5) (3 г, 5,13 ммоля) в 2,12 М соляной кислоте и уксусном эфире (60 ммолей) перемешивали в течение одного часа при комнатной температуре. Раствор добавляли в избыточный, водный, насыщенный раствор бикарбоната натрия и экстрагировали уксусным эфиром. Органическая фаза просушивалась сульфатом натрия и сгущалась. Продукт хроматографировали на силикагеле (носительдихлорметан/метанол 97,52,5). Выход целевого продукта 2,14 г (86 ), твердое вещество желтого цвета. 2024212 Расчет С 49,59 Н 4,99 5,78 Найдено С 49,81 Н 5,12 4,80 Температура плавления 126 С (толуол) 20-58 (с 1,04 в СНС 3). 1 5789 1 ИКС (дейтерир. хлороформ) (см-1) 3443 , 1758 (СО), 1553, 1346 (2). МС (диссоц.-хим. ионизация, аммиак) м/е МН 485. Соединение 8 4-,-бис-(2-хлороэтил)аминофенил-хлороформат (8) Фосген в толуоле (1,93 М) (8 мл, 15,4 ммоля) добавляли в суспензию гидрохлорида 4,-бис-(2-хлороэтил)аминофенола (7) (1,85 ммоля) в тетрагидрофуране (30 мл) и перемешивали в течение 30 мин. при 0 С. После добавки триэтиламина (1 мл, 7,17 ммоля) продолжали перемешивать в течение одного часа при 0 С. Затем суспензию фильтровали и сгущали в условиях вакуума при комнатной температуре. Путем флэш-хроматографии на силикагеле с использованием дихлорметана в качестве носителя был получен продукт в виде бесцветной жидкости, которую тут же использовали в последующей реакции. Выход продукта составил 70 . 1 Н ЯМР (250 МГц, дейтерир. хлороформ)7,10 (д,9 Гц, 2 Н),6,66 (д,9 Гц, 2 Н),3,73 (т,6,5 Гц, 4 Н),3,63 (т,6,5 Гц, 4 Н). ИКС (дейтерир. хлороформ) (см-1) 1779 (СО), 1514 (ароматика). МС (диссоц.-хим. ионизация, аммиак), м/е МН 296,М 2 Н 298. Соединение 9 Сложный метиловый эфир 2 метил 4-(,-бис-(2-хлороэтил)-амино)фенилоксикарбониламино-4-нитрофенил-2,3,4-три-О-ацетилглюкуроновой кислоты (9) В раствор хлороформата 4-,-бис-(2-хлороэтил)амино)фенила (8) (0,31 г, 1,04 ммоля) в тетрагидрофуране (15 мл) и диизопропилэтиламине (0,25 мл, 1,44 ммоля) добавляли метиловый эфир 2-(-метиламино)-4-нитрофенил-2,3,4-триацетилглюкуроновой кислоты (6) (0,50 г, 1,03 ммоля) и выдерживали при кипении в течение двух часов с обратным холодильником. После охлаждения до комнатной температуры реакционную массу сгущали. Продукт хроматографировали на силикагеле (носитель дихлорметан/метанол,97,52,5). Выход продукта составил 487 мг (64 ). С 31351412 Расчет С 50,00 Н 4,74 5,64 С 9,52 Найдено С 49,90 Н 4,82 5,62 С 9,78 Температура плавления 101 С (метанол) 20-47 (с 1,10 в хлороформе). 1(2). МС (диссоц.-хим. ионизация, аммиак) м/е МН 744 М 2 Н 746,766,2768. Соединение 10 Сложный метиловый эфир 2 метил(4-(,-бис-(2-хлороэтил)-амино)-фенилоксикарбонил-амино-4-нитрофенилглюкуроновой кислоты (10) В суспензию сложного метилового эфира 2 метил(4-(,-бис-(2-хлороэтил)амино)фенилоксикарбониламино-4-нитрофенил-2,3,4-три-О-ацетилглюкуроновой кислоты (9) (68 мг, 0,0915 ммоля) в метаноле (5 мл), добавляли метилат натрия (2 мг,0,037 ммоля) при -15 С и перемешивали в течение 6 часов при -15 С. После нейтрализации ионитом (Амберлит -50 ) и фильтрации раствор сгущали и хроматографировали на силикагеле с уксусным эфиром в качестве носителя. Выход продукта составил 50 мг (89 ). С 25 Н 293 О 11 С 2 1 Н ЯМР (300 МГц, дейтерир. хлороформ)8,22 (с, 1 Н),8,16 (д,8,5 Гц, 1),7,25 (д, 1 Н),7,15-6,90 (2 Н),6,80-6,45 (2 Н),5,06 (1),4,09 (1),4,20-3,15 (17 Н). ИКС (дейтерир. хлороформ) (см-1) 3601, 3448 (ОН), 1714 (СО), 1528, 1349 (2). МС (ионизация электронным ударом) м/е 640,2642. Соединение 11 2 метил(4-(,-бис-(2-хлороэтил)амино)фенилоксикарбониламино-4-нитрофенилглюкуроновая кислота (11) В раствор соединения 10 (50 мг, 0,0809 ммоля) в ацетоне (4 мл) добавляли при -15 С 0,3 мл водного 1 Н раствора гидроокиси натрия. Смесь перемешивали в течение 2 часов при -15 С, нейтрализовали водной 1 Н соляной кислотой и сгущали в вакууме (температура ниже 40 С). Продукт хроматографировали на силикагеле с применением смеси ацетонитрила/воды (9/1). Выход продукта составил 45 мг (89 ). С 24273 О 11 С 2 1 Н ЯМР (250 МГц, дейтерир. хлороформ)8,30 (с, 1),8,24 (дд, орто 9,0 Гц, мета 2,5 Гц, 1 Н),7,52 (д,9,0 Гц, 1),6,99(д,9,0 Гц, 2 Н),6,69 (д,9,0 Гц, 2 Н),5,23 (1),3,89 (д,9,0 Гц, 1),3,80-3,33 (1). ИКС (бромид калия) (см-1) 3418 (ОН), 1705(СО), 1516, 1349 (2). МС (ионизация электронным ударом) м/е М-Н 603 М 2-Н 605. 9 Синтез проводился аналогично описанному в примере 1. Пример 3 Синтез проводился аналогично описанному в примере 1. Пример 4 Синтез выполнялся аналогично описанному в примере 1. Пример 5 Ферментное расщепление пролекарства 373 Пролекарство 373 (соединение 11) при инкубации ферментно расщепляли с помощью -глюкуронидазы с получением ароматического производного азотистого иприта Пролекарство 373 при хранении в растворе безводного диметилсульфоксида сохраняет стабильность. Для исследования расщепляемости раствор 373 10 мкл (5 мг/мл в диметилсульфоксиде) разводили 180 мкл 0,02 М фосфатного буферного раствора с величиной рН 7,2 и 10 мкл . -глюкуронидаза(330 мкг/мл) и инкубировали при 37 С. 25 мкл исходной смеси разбавляли 225 мкл 0,1 М фосфатного буферного раствора с величиной рН 3,0 (85 ) и ацетонитрилом (15 ) и сразу же проводили анализ с применением системы высокоэффективной жидкостной хроматографии. Система высокоэффективной жидкостной хроматографии Применявшаяся система высокоэффективной жидкостной хроматографии включала в себя градиентный насос (, модель 480), автоматический пробоотборник (,модель 231/401), ультрафиолетовый детектор (, модель 166, длина волны детектирования 212 нм) и анализаторный блок (, система ). Разделения производились на колонке( - 18, 5 микрон, 1254,6 мм). Подвижную фазу образовывали из двух компонентов по следующей схеме А - ацетонитрил В - 0,02 М фосфатный буферный раствор, рН 3,0 0 мин. 15 А, 85 В 15 мин. 75 А, 25 В 25 мин. 75 А, 25 В 27 мин. 15 А, 85 В 35 мин. 15 А, 85 В. Были найдены следующие величины площадей пиков Время, 373, соединение 7 Спейсер, соединение 15 мин. КТ 12,6 КТ 10,7 КТ 14,1 0 1 5 7 10 15 25 60 Пример 6 Цитотоксичность 373, 391, 392 по отношению к опухолевым клеткам в присутствии и при отсутствии -глюкуронидазы На пластину для микротитрования с 96 ячейками в среду из 100 мкл минимальной поддерживающей среды 10 сыворотки плода коровы высеивали -клетки в расчете 2103 на 1 ячейку. Через сутки тестируемые вещества помещали в 100 мкл среды с необходимой концентрацией и при необходимости добавляли дополнительно -глюкуронидазу (50 мкг/мл конечной концентрации 7896). Каждая группа состояла из 4 ячеек, контроль осуществлялся только инкубацией в среде. Через 65 часов добавляли 11 5789 1 50 мкл 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2 Н-тетразолий-бромида (2,5 мг/мл в физиологическом растворе с фосфатным буфером), а через 3 часа удаляли надосадочную жидкость. Краситель, образованный живыми клетками, растворяли добавкой 100 мкл диметилсульфоксида на ячейку. Для каждой ячейки экстинкцию измеряли на универсальном сканирующем фотометре 340 СС (фирмы ) при 492 нм. Показатели 4 ячеек каждой группы усредняли и использовали при расчете кривой эффективности дозы и ИК 50 с использованием программного обеспечения 3.0. Вещество без содержания глюкуронидазы ИК 50 в мкмолях с содержанием глюкуронидазы ИК 50 в мкмолях Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: A61P 35/00, A61K 31/7012, A61K 47/48
Метки: пролекарство, опухолей, терапии, воспалительных, заболеваний
Код ссылки
<a href="https://by.patents.su/12-5789-prolekarstvo-dlya-terapii-opuholejj-i-vospalitelnyh-zabolevanijj.html" rel="bookmark" title="База патентов Беларуси">Пролекарство для терапии опухолей и воспалительных заболеваний</a>
Предыдущий патент: Способ восстановления кишечной непрерывности после операции Гартмана
Следующий патент: 14,17-С2–мостиковые стероиды, фармацевтический препарат
Случайный патент: Помещение для содержания телок