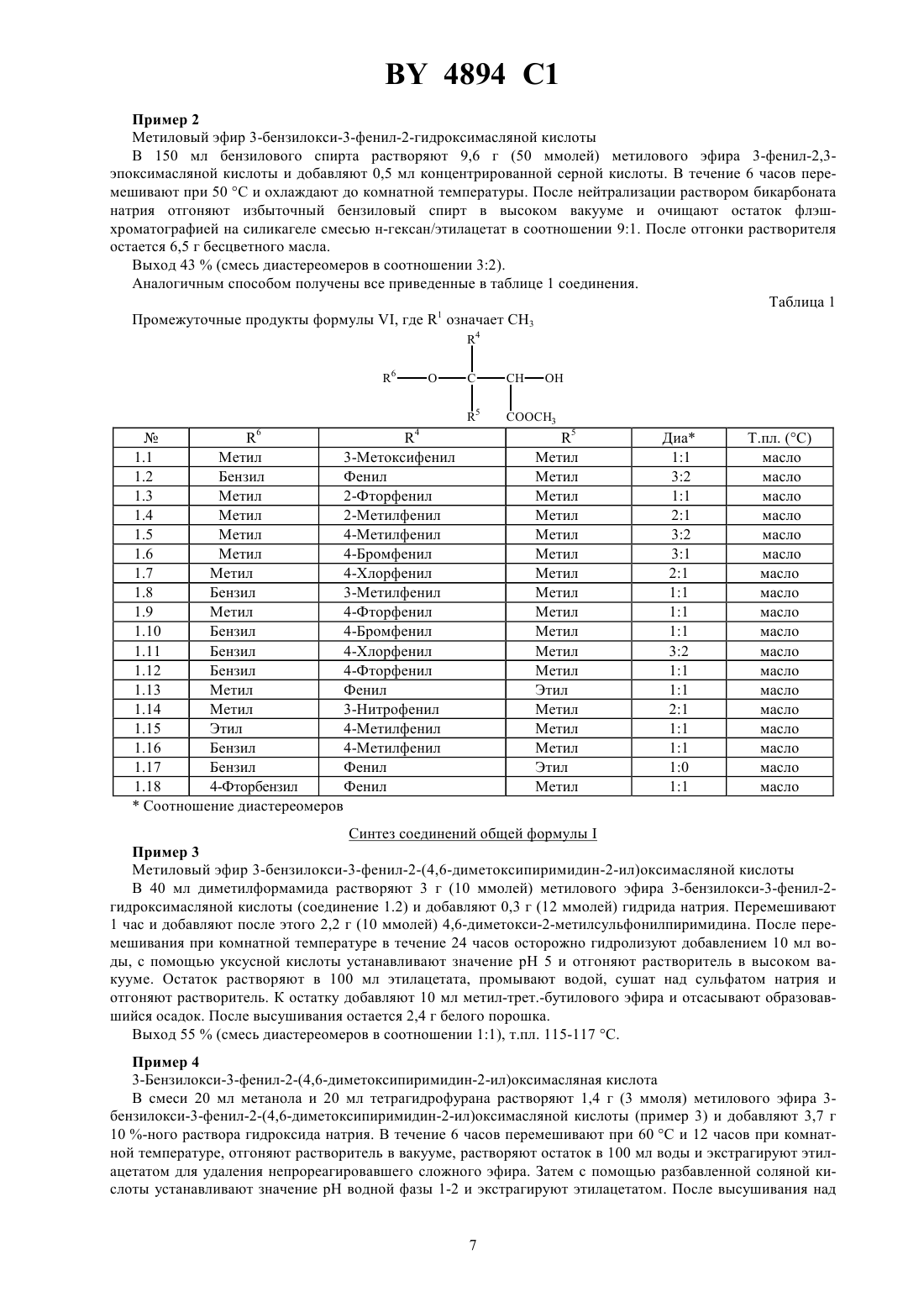
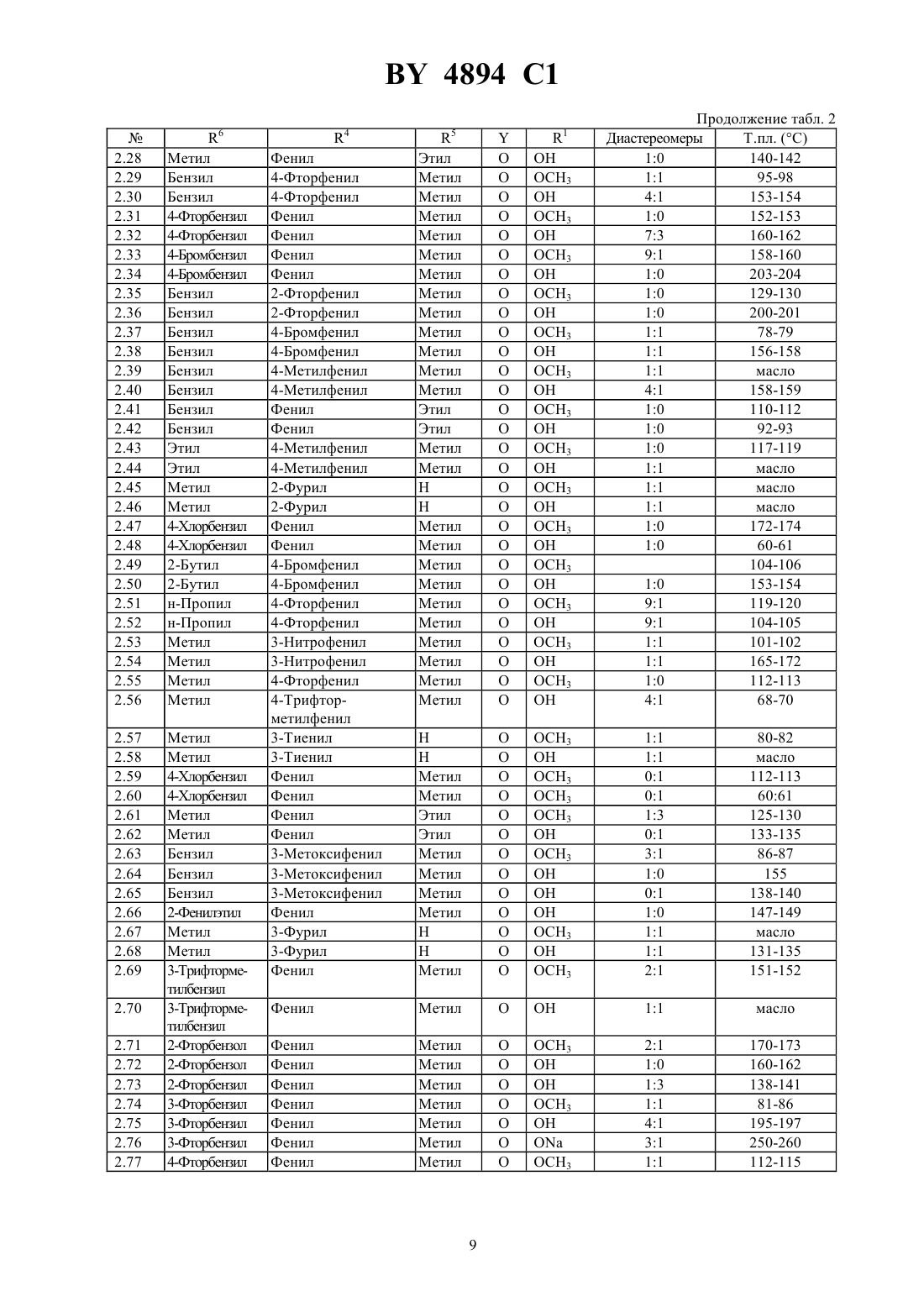
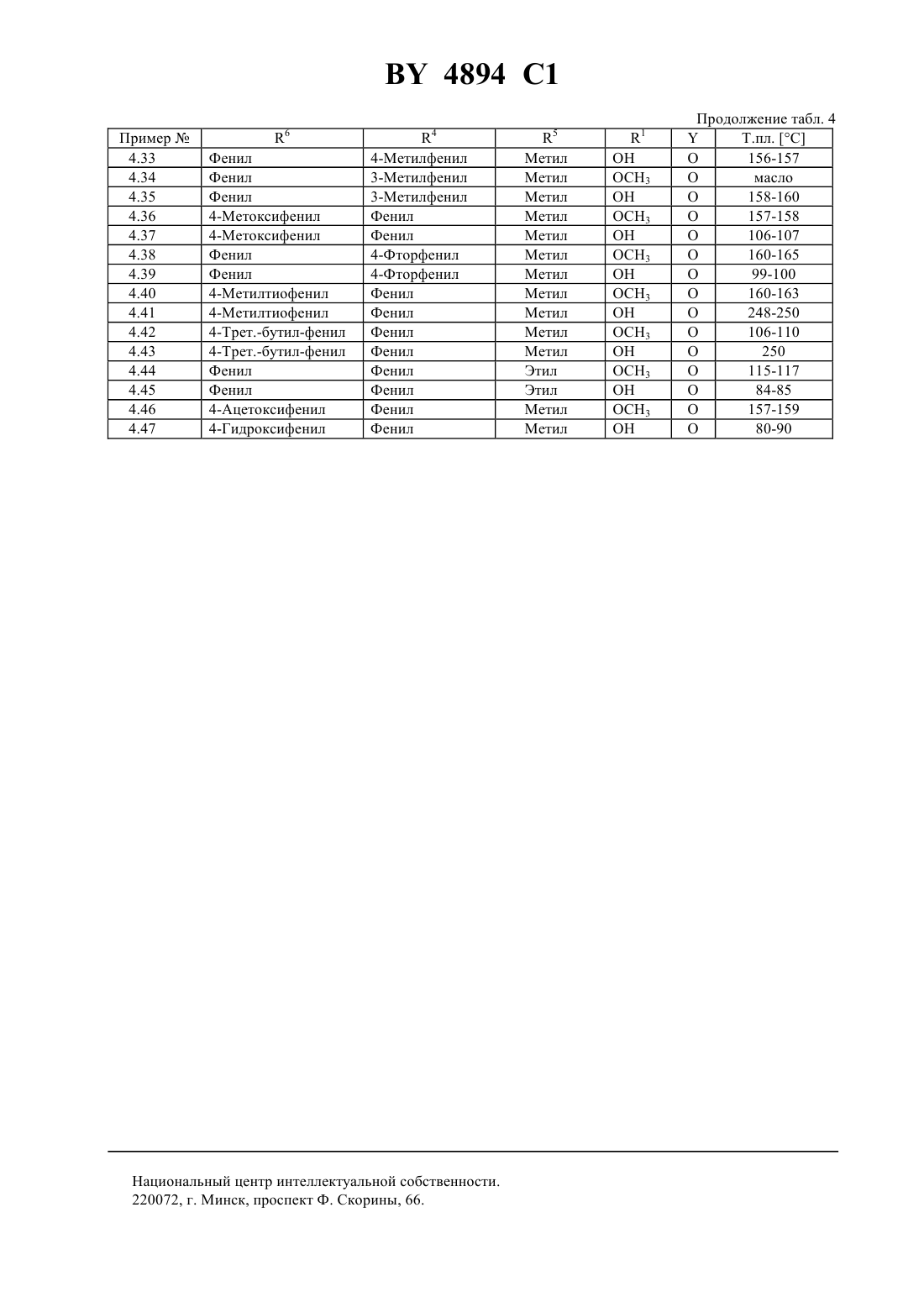
Лекарственное средство, обладающее свойствами ингибитора рецепторов эндотелина
Номер патента: 4894
Опубликовано: 30.12.2002
Авторы: Йоахим РАЙНХАЙМЕР, Дагмар КЛИНГЕ, Уве, Йозеф ФОГЕЛЬБАХЕР, Вольфганг ВЕРНЕТ, Клаус БОЛЛЬШВАЙЛЕР, Хартмут РИХЕРС, Манфред РАШАК, Зигфрид БИАЛОЯН, Лилиане УНГЕР, Эрнст БАУМАНН, Буркард КРЁГЕР
Текст
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ СВОЙСТВАМИ ИНГИБИТОРА РЕЦЕПТОРОВ ЭНДОТЕЛИНА(72) Авторы Эрнст БАУМАНН Уве, Йозеф ФОГЕЛЬБАХЕР Йоахим РАЙНХАЙМЕР Дагмар КЛИНГЕ Хартмут РИХЕРС Буркард КРГЕР Зигфрид БИАЛОЯН Клаус БОЛЛЬШВАЙЛЕР Вольфганг ВЕРНЕТ Лилиане УНГЕР Манфред РАШАК(57) Лекарственное средство, обладающее свойствами ингибитора рецепторов эндотелина, включающее активное вещество и целевые добавки, отличающееся тем, что в качестве активного вещества оно включает производное карбоновой кислоты общей формулы 2 4 6 где- карбоксильная группа или легко гидролизующийся до карбоксильной группы остаток 2 и 3 - С 1-С 4-алкоксил 4 - фенил, незамещенный или замещенный атомом галогена, нитрогруппой, С 1-С 4-алкилом, С 1-С 4 алкоксилом или С 1-С 4-галогеналкилом, пиридил, фурил или тиенил 5 - водород или С 1-С 4-алкил 6 - С 1-С 4-алкил, незамещенный или замещенный фенилом, незамещенным или замещенным атомом галогена или С 1-С 4-алкилом, или фенил, незамещенный или замещенный атомом галогена, гидроксилом, С 1 С 4-алкилом,С 1-С 4-галогеналкилом,С 1-С 4-алкилтиогруппой,С 1-С 4-алкоксилом или С 1-С 4 алкоксикарбонилом- сера или кислород в количестве 0,1-90,0 мас(56)0498723 1, 1992.0517215 1, 1992. Настоящее изобретение относится к лекарственным средствам на основе производных карбоновой кислоты, обладающим свойствами ингибитора рецептора эндотелина. 4894 1 Эндотелин представляет собой построенный из 21 аминокислоты пептид, который образуется в эндотелии кровеносных сосудов и секретируется им. Эндотелин существует в трех изоформах ЕТ-1, ЕТ-2 и ЕТ-3. Далее термин эндотелин или ЕТ будет означать одну или все изоформы эндотелина. Эндотелин представляет собой мощный вазоконстриктор, оказывающий сильный эффект на тонус сосудов. Известно, что связанное с ним сужение сосудов обусловлено взаимодействием эндотелина с его рецептором (, 332,411-415. 1988, 231, 440-444, 1988 и . . . ., 154, 868-875, 1988). Повышенное или отклоняющееся от нормы выделение эндотелина вызывает длительное сужение периферических и почечных сосудов, а также кровеносных сосудов центральной нервной системы, что приводит к болезненным состояниям. Как сообщается в литературе, повышенный уровень эндотелина обнаруживается в плазме крови у пациентов с гипертонией, острым инфарктом миокарда, легочной гипертонией, синдромом Рейно, атеросклерозом, а также в дыхательных путях астматиков ( . , 12, 79 (1989), ..2, 207 (1990), . . .264, 2868 (1990. В соответствии с этим вещества, которые избирательно ингибируют связывание эндотелина с рецептором, должны противодействовать названным выше различным физиологическим эффектам эндотелина и поэтому представляют собой ценные фармакологические препараты. Известно лекарственное средство, обладающее свойствами ингибитора рецепторов эндотелина, включающее производные (1,4-хинолинокси)метилбифенилкарбоновой кислоты в качестве активного вещества и целевые добавки (см. заявку ЕР 0 498 723 А 1, кл.07 215/12, А 61 К 31/395, 12.08.1992 г.). Задачей изобретения является разработка нового лекарственного средства, обладающего свойствами ингибитора рецепторов эндотелина, включающего активное вещество на основе производных карбоновой кислоты. Поставленная задача решается предлагаемым лекарственным средством, обладающим свойствами ингибитора рецепторов эндотелина, которое помимо целевых добавок в качестве активного вещества включает производное карбоновой кислоты общей формулы 2 4 6 в которойозначает карбоксильную группу или легко гидролизующийся до карбоксильной группы остаток 2 и 3 означают алкоксил с числом атомов углерода от одного до четырех 4 означает фенил, незамещенный или замещенный атомом галогена, нитрогруппой, алкилом с числом атомов углерода от 1 до 4, алкоксилом с числом атомов углерода от 1 до 4, галогеналкилом с числом атомов углерода от 1 до 4, пиридил, фурил, тиенил 5 означает атом водорода или алкил с числом атомов углерода от 1 до 4 6 означает алкил с числом атомов углерода от 1 до 4, незамещенный или замещенный фенилом, незамещенным или замещенным атомом галогена или алкилом с числом атомов углерода от 1 до 4, или фенил,незамещенный или замещенный атомом галогена, гидроксилом, алкилом с числом атомов углерода от 1 до 4, алкилтиогруппой с числом атомов углерода от 1 до 4, галогеналкилом с числом атомов углерода от 1 до 4,алкоксилом с числом атомов углерода от 1 до 4 или алкоксикарбонилом с числом атомов углерода от 1 до 4 означает атом серы или кислорода,в количестве 0,1-90 мас. . Получение соответствующих изобретению соединений исходит из эпоксидов , которые получают общеизвестными способами, например, как это описано в . ,, 2 изд., 1983, с. 862 и с. 750, из альдегидов или кетоновили же из олефинов 4 4894 1 Производные карбоновых кислот общей формулымогут быть получены по реакции эпоксидов общей формулы(в которой, например,означает 10) со спиртами или тиолами общей формулы , в которых 6 имеет приведенные выше значения 4 6 Для этого соединения общей формулынагревают с соединениями формулы , которые берут в избытке, например от 1,2 до 7, предпочтительно от 2 до 5 мольных эквивалентов, при температуре 50-200 С,предпочтительно при 80-150 С. Реакция может протекать и в присутствии разбавителя. Для этой цели могут применяться различные инертные к используемым реагентам растворители. Примерами таких растворителей или, соответственно,разбавителей служат вода, алифатические, алициклические и ароматические углеводороды, которые могут быть и хлорированными, как, например, гексан, циклогексан, петролейный эфир, лигроин, бензол, толуол,ксилол, метиленхлорид, хлороформ, четыреххлористый углерод, этиленхлорид и трихлорэтилен, простые эфиры, как, например, диизопропиловый эфир, дибутиловый эфир, пропиленоксид, диоксан и тетрагидрофуран, кетоны, как, например, ацетон, метилэтилкетон, метилизопропилкетон и метилизобутилкетон, нитрилы,как, например, ацетонитрил и пропионитрил, спирты, как, например, метанол, этанол, изопропанол, бутанол и этиленгликоль, сложные эфиры, как, например, этилацетат и амилацетат, амиды кислот, как, например,диметилформамид и диметилацетамид, сульфоксиды и сульфоны, как, например, диметилсульфоксид и сульфолан, и основания, как, например, пиридин. Реакция при этом проводится предпочтительно в температуом интервале между 0 С и температурой кипения растворителя или смеси растворителей. Определенные преимущества могут быть получены в присутствии катализатора реакции. В роли катализаторов при этом могут выступать сильные органические и неорганические кислоты, а также кислоты Льюиса. Примерами этому могут служить среди прочих серная кислота, соляная кислота, трифторуксусная кислота, эфират трифторида бора и алкоголяты титана . Соответствующие изобретению соединения, в которыхозначает атом кислорода и остальные заместители имеют приведенное для общей формулызначение, могут быть получены, например, таким образом,что производные карбоновых кислот общей формулы , в которой заместители имеют приведенное выше значение, вводят в реакцию с соединениями общей формулы 2 в которойозначает галоген или-2-, причемможет означать алкил с числом атомов углерода от одного до четырех, галогеналкил с числом атомов углерода от одного до четырех или фенил. Реакция предпочтительно протекает в одном из названных выше инертных разбавителей с добавлением подходящего основания, то есть основания, которое вызывает депротонирование промежуточного продукта , в интервале температур от комнатной до температуры кипения растворителя. В качестве основания может служить гидрид щелочного или щелочноземельного металла, например,гидрид натрия, гидрид калия или гидрид кальция, такая соль угольной кислоты, как карбонат щелочного металла, например, карбонат натрия или калия, гидроксид щелочного или щелочноземельного металла, например, гидроксид натрия или калия, металлорганическое соединение, например, бутиллитий, или же амид щелочного металла, такой как диизопропиламид лития. Соответствующие изобретению соединения, в которыхозначает атом серы и остальные заместители имеют указанное для общей формулызначение, могут быть получены, например, в результате взаимодействия производных карбоновых кислот общей формулы , которые образуются по известным способам из соединений общей формулыи в которых заместители имеют приведенное выше значение, с соединениями общей формулы , в которой 2 и 3 имеют указанное для общей формулызначение. Реакция предпочтительно протекает в одном из названных выше инертных разбавителей с добавлением подходящего основания, то есть основания, которое вызывает депротонирование промежуточного продукта, в интервале температур от комнатной до температуры кипения растворителя. В роли основания наряду с названными выше могут также служить такие органические основания, как третичные амины, например, триэтиламин, пиридин, имидазол или диазабициклоундецен. Соединения формулымогут быть также получены исходя из соответствующих карбоновых кислот, то есть таких соединений формулы , в которых 1 означает гидроксил, переводя их сначала обычными методами в активированную форму, например в галогенид, ангидрид или имидазолид, и уже затем вводя их в реакцию с соответствующим гидроксильным соединением 10. Это взаимодействие может быть проведено в обычных растворителях и оно часто нуждается в добавлении основания, в роли которого могут выступать названные выше вещества. Обе эти стадии могут быть также упрощены тем, что карбоновой кислотой действуют на гидроксильное соединение в присутствии водоотнимающего средства, например, карбодиимида. Кроме того, соединения формулымогут быть также получены исходя из солей соответствующих карбоновых кислот, то есть из соединений формулы , в которыхозначает группу 1 и 1 означает ОМ, где М может быть катионом щелочного металла или одним эквивалентом катиона щелочноземельного металла. Эти соли могут вступать в реакцию со многими соединениями формулы 10-, где А означает обычную нуклеофильную уходящую группу, например, такие атомы галогена, как хлор, бром, иод, или же арил- или алкилсульфогруппу, которая может иметь замещение атомом галогена, алкилом или галогеналкилом, например, толуолсульфогруппа или метансульфогруппа или же другую эквивалентную уходящую группу. Соединения формулы 10- с реакционноспособным заместителем А известны или могут быть легко получены по общим известным в этой области способам. Это взаимодействие может проводиться в обычных растворителях и, предпочтительно, с добавлением основания, в роли которого выступают вышеупомянутые вещества. Лекарственное средство согласно изобретению предлагает новые терапевтические возможности для лечения гипертонии, высокого легочного давления, инфаркта миокарда, стенокардии, острой и хронической почечной недостаточности, спазма церебральных сосудов, церебральной ишемии, субарахноидальных кровоизлияний, мигрени, астмы, атеросклероза, эндотоксического шока, индуцированного эндотоксинами отказа органов, внутрисосудистой коагуляции, повтоного стеноза сосудов после ангиопластики и индуцированной циклоспоринами почечной недостаточности, а также при гипертонии. Активность лекарственного средства согласно изобретению иллюстрируется результатами следующих опытов. Изучение связывания с рецепторами Для изучения связывания применялись клонированные человеческие клетки линии СНО с выраженными ЕТА-рецепторами и мембраны мозжечка морских свинок с содержанием ЕТВ-рецепторов более 60 по отношению к ЕТА-рецепторам. Подготовка мембран Клетки линии СНО с выраженными ЕТА-рецепторами выращивают в среде 12 с 10 фетальной телячьей сыворотки, 1 глютамина, 100 Е/мл пенициллина и 0,2 стрептомицина (фирма Джибко БРЛ, Гэйтерсберг,Мериленд, США). Через 48 часов клетки промывают солевым раствором с фосфатным буфером и в течение 5 минут инкубируют с фосфатным буфером, содержащим 0,05 трипсина. После этого нейтрализуют добавлением среды 12 и отделяют клетки центрифугированием при 300 . Для лизиса клеток осадок после центрифугирования непродолжительно промывают буфером для лизиса (5 ммоль/л гидрохлорида ТРИС(трис-гидроксиметиламинометан) с 7,4 с 10 глицерина) и после этого инкубируют при температуре 4 С в течение 30 минут при концентрации 107 клеток на 1 мл лизирующего буфера. Мембраны отделяют центрифугированием при 20000 в течение 10 минут и хранят осадок в жидком азоте. Мозжечки морских свинок гомогенизируют в гомогенизаторе Поттера-Элвейхема и отделяют экспериментальный материал дифференцированным центрифугированием в течение 10 минут при 1000 и повтоным центрифугированием супенатанта при 20000 в течение 10 минут. 4894 1 Опыты по изучению связывания Для опытов по связыванию с ЕТА- и ЕТ-рецепторами мембраны суспендируют в буфере для инкубирования (50 ммоль/л гидрохлорида ТРИС,7,4, с 5 ммоль/л хлорида марганца, 40 мкг/мл бацитрацина и 0,2 альбумина бычьей сыворотки) при концентрации 50 мкг протеина на один опыт и инкубируют с исследуемым веществом или без него при 25 С с 25 пкмолей 125-1 (в опыте на ЕТА-рецепторы) или с 25 пкмолей 125-3 (в опыте на ЕТВ-рецепторы). Неспецифическое связывание определяют с 10-7 моль/л 1. Через 30 минут свободный и связанный радиолиганд отделяют фильтрованием через фильтр из стекловолокна марки / (Ватман, Англия) на сборнике клеток Скатрон (фирмы Скатрон, Лиер, Норвегия) и промывают фильтр ледяным трис-буфером,7,4, с 0,2 альбумина бычьей сыворотки. Собранную на фильтрах радиоактивность количественно определяют на жидкостном сцинтиляционном счетчике Паккард 2200 СА. Определение значения константы ингибирования (Ки) проводят методом нелинейного регрессионного анализа по программе Лиганд . В таблице А под номером опытов приводится определенная в виде Ки моль/л активность соединений формулы . Таблица А Ки моль/л Соединение ЕТА ЕТВ 4.25 2,510-7 3,010-6 4.41 1,610-7 4,710-6 Соединения примеров 5, 10 и 2.1, 2.3, 2.6, 2.7, 2.56, 2.57, 2.67, 4.10, 4.30, 4.36, 4.46 и 4.47 проявляют аналогичную активность (1,5-8,910-6 моль/л). Функциональная система испытаниядля поиска антагонистов эндотелиновых рецепторов подтипа А Эта система испытаний представляет собой основанный на клетках функциональный тест на эндотелиновые рецепторы. Определенные клетки показывают при стимуляции эндотелином 1 (ЕТ 1) повышение внутриклеточной концентрации ионов кальция. Это повышение может быть измерено на неповрежденных клетках,заряженных чувствительными к кальцию красителями. Изолированные из крыс 1-фибробласты, у которых было доказано присутствие эндогенного эндотелинового рецептора подтипа А, заряжают флуоресцентным красителем фура 2-ан следующим образом после обработки трипсином клетки снова суспендируют в буфере А (120 ммоль/л хлорида натрия, 5 ммоль/л хлорида калия, 1,5 ммоль/л хлорида магния, 1 ммоль/л хлорида кальция, 25 ммоль/л -2-гидроксиэтилпиперазин 2-этансульфокислоты, 10 ммоль/л глюкозы,7,4) до плотности 2106/мл и инкубируют в течение 30 минут при температуре 37 С в темноте в растворе, содержащем фура 2-ан (2 мкмоль/л), плюроникс 127 (0,04 ) и диметилсульфоксид (0,2 ), затем клетки дважды промывают буфером А и снова суспендируют до плотности 2106/мл. В ходе опыта непрерывно регистрируют флуоресцентный сигнал от клеток плотностью 2105 клеток на 1 мл при температуре 30 С и при значении длин волн возбуждения-излучения 380/510. К клеткам добавляют исследуемые вещества и после инкубирования в течение 3 минут с ЕТ 1 определяют максимальное изменение флуоресценции. Отклик клеток на ЕТ 1 без предварительного добавления исследуемого вещества служит контролем и приравнивается к 100 . В таблице Б под номером опытов приведены определенные таким образом значения активности соединений формулыв виде концентрации ингибирования КИ 50 моль/л. Таблица Б Соединение КИ 50 моль/л 4.25 7,410-7 4.41 1,010-6 Испытание ЕТ-антагонистовСамцов крыс линиивесом 250-300 г наркотизируют амобарбиталом, при искусственной вентиляции легких ваготомируют и деспинализируют. В кровеносные сосудыивводят катетеры. У контрольных животных внутривенное введение 1 мкг/кг ЕТ 1 приводит к выраженному повышению давления крови, которое сохраняется в течение длительного времени. Подопытным животным за 5 минут до введения ЕТ 1 вводят внутривенно исследуемое соединение (1 мл/кг). Для определения свойств эндотелиновых антагонистов сравнивают увеличение давления крови у подопытных и у контрольных животных. 4894 1 Индуцированная эндотелином-1 скоротечная смерть мышей Принцип опыта заключается в предотвращении вызванной эндотелином скоротечной гибели мышей от остановки сердца, которая, вероятно, обусловлена сужением коронаных сосудов сердца, благодаря предварительному введению антагонистов рецепторов эндотелина. После внутривенной инъекции 10 нмоль/кг эндотелина в объеме 5 мл на 1 кг веса тела животные погибают в течение нескольких минут. Летальную дозу эндотелина-1 во всех случаях проверяют на небольшой группе животных. При внутривенном введении исследуемого вещества обычно уже через 5 минут следует инъекция летальной дозы эндотелина-1. При других способах введения время до инъекции эндотелина может быть более продолжительным, достигая при необходимости нескольких часов. Долю выживших животных протоколируют и эти данные используют для определения эффективной дозы, которая защищает 50 животных в течение 24 часов и более от остановки сердца (ЭД 50). Функциональный тест на сосудах для антагонистов рецепторов эндотелина В сегментах аорт кроликов после предварительного напряжения нагрузкой в 2 г и релаксации в течение 1 часа в растворе Кребса-Гензелейта при температуре 37 С и значениимежду 7,3 и 7,4 сначала вызывают обусловленную ионами К контрактуру. После отмывки строят зависимость физиологического отклика от дозы эндотелина до достижения максимального эффекта. Потенциальные антагонисты эндотелина наносят на другие препараты этих же сосудов за 15 минут до начала проявления действия эндотелина на кривой доза-активность. Эффект эндотелина определяют в процентах от контрактуры, вызываемой ионами калия. У эффективных антагонистов эндотелина кривая зависимости отклика от дозы эндотелина сдвигается вправо. Лекарственное средство согласно изобретению может вводиться обычными способами перорально или парэнтерально (подкожно, внутривенно, внутримышечно, внутрибрюшинно). Возможно также их применение в парах или в аэрозолях через носоглотку. Дозировка зависит от возраста, состояния и веса пациента, а также от способа применения. Как правило,суточная доза действующего начала составляет примерно от 0,5 до 50 мг на кг веса тела при пероральном введении и примерно между 0,1 и 10 мг на кг веса тела при парэнтеральном введении. Лекарственное средство согласно изобретению может иметься в виде стандартных твердых или жидких лекарственных форм, например, в виде таблеток, облаток, капсул, порошков, гранул, драже, свечей, растворов, мазей, кремов или аэрозолей. Эти формы получают обычными способами. При этом активное вещество может перерабатываться вместе с целевыми добавками, то есть обычными лекарственными вспомогательными средствами, такими как связующие для таблеток, наполнители, консерванты, разрыхлители, средства для регуляции текучести жидких форм, смягчители, смачиватели, диспергаторы, эмульгаторы, растворители,средства для пролонгирования эффекта, антиоксиданты и/или пропелленты (см. Н. и др., изд. Тиме, Штуттгарт, 1991). Полученные таким образом лекарственные формы содержат обычно активное вещество в количестве от 0,1 до 90 мас. . Содержащиеся в качестве активного вещества в лекарственном средстве согласно изобретению соединения относятся к категории малотоксичных веществ. Ниже представляются примеры возможных примеров препаратов согласно изобретению. Препарат А 1 мг (0,7 мас. ) соединения 4.25 интенсивно смешивают с 35 мг микрокристаллической целлюлозы, 4 мг кроскарамеллозы натрия, 1 мг стеарата магния, 99 мг моногидрата лактозы. Полученную таким образом смесь прессуют в таблетки. Препарат Б 100 мг (25 мас. ) соединения 4.41 интенсивно смешивают с 120 мг микрокристаллической целлюлозы, 25 мг кроскарамеллозы натрия, 4 мг стеарата магния и 151 мг моногидрата лактозы. Полученную смесь прессуют в таблетки. Препарат В 90 мас.соединения примера 5 смешивают с 9,8 мас.декстрозы и 0,2 мас.агара и полученную смесь растирают в порошок, к которому добавляют дистиллированную воду. Получают препарат для оральной аппликации. Синтез соединений общей формулыПример 1 Метиловый эфир 3-метокси-3-(3-метоксифенил)-2-гидроксимасляной кислоты В 200 мл абсолютного метанола растворяют 19,5 г (88 ммолей) метилового эфира 3-(3-метоксифенил)2,3-эпоксимасляной кислоты и добавляют 0,1 мл эфирата трифторида бора. Перемешивают при комнатной температуре 12 часов и отгоняют растворитель, остаток растворяют в этилацетате, промывают раствором бикарбоната натрия и водой и сушат над сульфатом натрия. После отгонки растворителя остается 21,1 г слегка желтоватого масла. Выход 94(смесь диастереомеров в соотношении 11). 6 4894 1 Пример 2 Метиловый эфир 3-бензилокси-3-фенил-2-гидроксимасляной кислоты В 150 мл бензилового спирта растворяют 9,6 г (50 ммолей) метилового эфира 3-фенил-2,3 эпоксимасляной кислоты и добавляют 0,5 мл концентрированной серной кислоты. В течение 6 часов перемешивают при 50 С и охлаждают до комнатной температуры. После нейтрализации раствором бикарбоната натрия отгоняют избыточный бензиловый спирт в высоком вакууме и очищают остаток флэшхроматографией на силикагеле смесью н-гексан/этилацетат в соотношении 91. После отгонки растворителя остается 6,5 г бесцветного масла. Выход 43(смесь диастереомеров в соотношении 32). Аналогичным способом получены все приведенные в таблице 1 соединения. Таблица 1 Промежуточные продукты формулы , где 1 означает СН 3 4 5 Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Этил Метил Метил Метил Этил Метил Т.пл. (С) масло масло масло масло масло масло масло масло масло масло масло масло масло масло масло масло масло масло Синтез соединений общей формулыПример 3 Метиловый эфир 3-бензилокси-3-фенил-2-(4,6-диметоксипиримидин-2-ил)оксимасляной кислоты В 40 мл диметилформамида растворяют 3 г (10 ммолей) метилового эфира 3-бензилокси-3-фенил-2 гидроксимасляной кислоты (соединение 1.2) и добавляют 0,3 г (12 ммолей) гидрида натрия. Перемешивают 1 час и добавляют после этого 2,2 г (10 ммолей) 4,6-диметокси-2-метилсульфонилпиримидина. После перемешивания при комнатной температуре в течение 24 часов осторожно гидролизуют добавлением 10 мл воды, с помощью уксусной кислоты устанавливают значение 5 и отгоняют растворитель в высоком вакууме. Остаток растворяют в 100 мл этилацетата, промывают водой, сушат над сульфатом натрия и отгоняют растворитель. К остатку добавляют 10 мл метил-трет.-бутилового эфира и отсасывают образовавшийся осадок. После высушивания остается 2,4 г белого порошка. Выход 55(смесь диастереомеров в соотношении 11), т.пл. 115-117 С. Пример 4 3-Бензилокси-3-фенил-2-(4,6-диметоксипиримидин-2-ил)оксимасляная кислота В смеси 20 мл метанола и 20 мл тетрагидрофурана растворяют 1,4 г (3 ммоля) метилового эфира 3 бензилокси-3-фенил-2-(4,6-диметоксипиримидин-2-ил)оксимасляной кислоты (пример 3) и добавляют 3,7 г 10 -ного раствора гидроксида натрия. В течение 6 часов перемешивают при 60 С и 12 часов при комнатной температуре, отгоняют растворитель в вакууме, растворяют остаток в 100 мл воды и экстрагируют этилацетатом для удаления непрореагировавшего сложного эфира. Затем с помощью разбавленной соляной кислоты устанавливают значениеводной фазы 1-2 и экстрагируют этилацетатом. После высушивания над 4894 1 сульфатом магния и отгонки растворителя добавляют к остатку немного ацетона и отсасывают образовавшийся осадок. После высушивания остается 1,2 г белого порошка. Выход 88(смесь диастереомеров в соотношении 32), т.пл. 165 С (с разложением). Пример 5 Метиловый эфир 3-бензилокси-3-фенил-2-(4,6-диметоксипиримидин-2-ил)тио-масляной кислоты В 50 мл метиленхлорида растворяют 11 г (25 ммолей) метилового эфира 3-бензилокси-3-фенил-2 гидроксимасляной кислоты (соединение 1.2), добавляют 3 г (30 ммолей) триэтиламина и при перемешивании прибавляют по каплям 3,2 г (28 ммолей) хлорангидрида метансульфокислоты. В течение 2 часов перемешивают при комнатной температуре, промывают водой, сушат над сульфатом магния и упаривают в вакууме. Остаток растворяют в диметилформамиде и при температуре 0 С прибавляют к суспензии 12,9 г (75 ммолей) 4,6-диметоксипиримидин-2-тиола и 8,4 г (100 ммолей) бикарбоната натрия в 100 мл диметилформамида. После перемешивания в течение 2 часов при комнатной температуре и еще в течение 2 часов при 60 С выливают в 1 л воды со льдом и отсасывают образующийся осадок. После высушивания остается 3,2 г белого порошка. Выход 29(смесь диастереомеров в соотношении 11). Аналогично вышеприведенным примерам получают указанные в таблице 2 соединения. Таблица 2 3 4 6 6 Бензил Бензил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Бензил Изопропил Изопропил Метил Метил Бензил Бензил Метил Метил Метил 5 Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Этил 6 Метил Бензил Бензил 4-Фторбензил 4-Фторбензил 4-Бромбензил 4-Бромбензил Бензил Бензил Бензил Бензил Бензил Бензил Бензил Бензил Этил Этил Метил Метил 4-Хлорбензил 4-Хлорбензил 2-Бутил 2-Бутил н-Пропил н-Пропил Метил Метил Метил Метил Метил Метил 4-Хлорбензил 4-Хлорбензил Метил Метил Бензил Бензил Бензил 2-Фенилэтил Метил Метил 3-Трифторметилбензил 3-Трифторметилбензил 2-Фторбензол 2-Фторбензол 2-Фторбензил 3-Фторбензил 3-Фторбензил 3-Фторбензил 4-Фторбензил 5 Этил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Этил Этил Метил Метил Н Н Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Н Н Метил Метил Этил Этил Метил Метил Метил Метил Н Н Метил ОСН 3 ОН ОСН 3 ОСН 3 ОСН 3 ОН ОСН 3 ОН ОН ОН ОСН 3 ОН ОСН 3 Фенил Фенил Фенил Фенил Фенил Фенил Фенил Метил Метил Метил Метил Метил Метил Метил ОСН 3 ОН ОН ОСН 3 ОН Фенил 4-Фторфенил 4-Фторфенил Фенил Фенил Фенил Фенил 2-Фторфенил 2-Фторфенил 4-Бромфенил 4-Бромфенил 4-Метилфенил 4-Метилфенил Фенил Фенил 4-Метилфенил 4-Метилфенил 2-Фурил 2-Фурил Фенил Фенил 4-Бромфенил 4-Бромфенил 4-Фторфенил 4-Фторфенил 3-Нитрофенил 3-Нитрофенил 4-Фторфенил 4-Трифторметилфенил 3-Тиенил 3-Тиенил Фенил Фенил Фенил Фенил 3-Метоксифенил 3-Метоксифенил 3-Метоксифенил Фенил 3-Фурил 3-Фурил Фенил 4894 1 Синтез соединений общей формулыПример 6 Метиловый эфир 3-фенокси-3-фенил-2-гидроксимасляной кислоты Смесь 28,2 г (0,3 моля) фенола и 19,2 г (0,1 моля) метилового эфира 3-фенил-2,3-эпоксимасляной кислоты нагревают в течение 6 часов при 100 С. После отгонки избыточного фенола в высоком вакууме и хроматографической очистки остатка на силикагеле смесями гексана и этилацетата получают 17,9 г слегка желтоватого масла. Выход 62,5 . Пример 7 Метиловый эфир 3-(4-бромфенил)окси-3-фенил-2-гидроксимасляной кислоты Смесь 51,9 г (0,3 моля) 4-бромфенола и 19,2 г (0,1 моля) метилового эфира 3-фенил-2,3-эпоксимасляной кислоты 8 часов перемешивают при температуре 100 С и 12 часов при комнатной температуре. После отгонки избыточного фенола остаток очищают с помощью флэш-хроматографии (силикагель, нгексан/этилацетат 91). Получают 7,2 г белого твердого вещества. Выход 20 , т.пл. 133-135 С. Аналогично получают приведенные в таблице 3 соединения. Таблица 3 Промежуточные продукты формулы , где 1 означает СН 3 4 4 Фенил Фенил Фенил Фенил Фенил 2-Тиенил Фенил Фенил Фенил 4-Хлорфенил 5 Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Т.пл. (С) масло 130-133 масло масло масло масло масло масло масло масло Синтез соединений общей формулыПример 8. Метиловый эфир 3-фенокси-3-фенил-2-(4,6-диметоксипиримидин-2-ил)оксимасляной кислоты В 40 мл диметилформамида растворяют 4,4 г (15,4 ммоля) метилового эфира 3-фенокси-3-фенил-2 гидроксимасляной кислоты (соединение 1.1) и прибавляют 0,46 г (18,4 ммолей) гидрида натрия. Перемешивают 1 час и добавляют 3,4 г (15,4 ммоля) 4,6-диметокси-2-метилсульфонилпиримидина. После перемешивания в течение 24 часов при комнатной температуре осторожно гидролизуют добавлением 10 мл воды, с помощью ледяной уксусной кислоты устанавливают значение 5 и отгоняют растворитель в высоком вакууме. Остаток растворяют в 100 мл этилацетата, промывают водой, сушат над сульфатом натрия и отгоняют растворитель. К остатку добавляют 10 мл метил-трет.-бутилового эфира и отсасывают образовавшийся осадок. После высушивания остается 1,6 г белого порошка. Выход 24,5 , т.пл. 143-145 С. Пример 9 3-Фенокси-3-фенил-2-(4,6-диметоксипиримидин-2-ил)оксимасляная кислота В 20 мл метилового спирта и 40 мл тетрагидрофурана растворяют 1,3 г метилового эфира 3-фенокси-3 фенил-2-(4,6-диметоксипиримидин-2-ил)оксимасляной кислоты (пример 8) и добавляют 3,7 г 10 -ного раствора гидроксида натрия. Перемешивают в течение 6 часов при 60 С и 12 часов при комнатной температуре, отгоняют растворитель в вакууме и растворяют остаток в 100 мл воды. Непрореагировавший сложный эфир экстрагируют этилацетатом. В заключение в водной фазе с помощью разбавленной соляной кислоты устанавливают 1-2 и экстрагируют этилацетатом. После высушивания над сульфатом магния и отгонки растворителя остается 1,0 г белого порошка. Выход 79,7 , т.пл. 50-55 С. 10 4894 1 Пример 10 Метиловый эфир 3-фенокси-3-фенил-2-(4,6-диметоксипиримидин-2-ил)тио-масляной кислоты В 50 мл метиленхлорида растворяют 7,2 г (25 ммолей) метилового эфира 3-фенокси-3-фенил-2 гидроксимасляной кислоты, добавляют 3 г (30 ммолей) триэтиламина и при перемешивании прибавляют по каплям 3,2 г (28 ммолей) хлорангидрида метансульфокислоты. При комнатной температуре перемешивают 2 часа, промывают водой, сушат над сульфатом магния и упаривают в вакууме. Остаток растворяют в 100 мл диметилформамида и прибавляют полученный раствор при температуре 0 С при перемешивании к суспензии 12,9 г (75 ммолей) 4,6-диметоксипиримидин-2-тиола и 8,4 г (100 ммолей) бикарбоната натрия в 100 мл диметилформамида. После перемешивания в течение 2 часов при комнатной температуре и еще в течение 2 часов при 60 С выливают в 1 литр воды со льдом и отсасывают образовавшийся осадок. После высушивания остается 4,2 г белого порошка. Выход 38 . Аналогично вышеприведенным примерам получают приведенные в таблице 4 соединения. 6 Фенил Фенил Фенил 4-Бромфенил 4-Бромфенил 2-Фторфенил 2-Фторфенил 3-Фторфенил 3-Фторфенил 4-Фторфенил 4-Фторфенил 4-Хлорфенил 4-Хлорфенил 4-Метилфенил 4-Метилфенил Фенил Фенил Фенил Фенил Фенил Фенил 3-Метилфенил 3-Метилфенил 4-Изопропилфенил 4-Изопропилфенил Фенил Фенил Фенил Фенил 2-Метилфенил 2-Метилфенил Фенил 4 Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил 2-Фторфенил 2-Фторфенил 3-Метоксифенил 3-Метоксифенил 4-Бромфенил 4-Бромфенил Фенил Фенил Фенил Фенил 4-Хлорфенил 4-Хлорфенил 2-Метилфенил 2-Метилфенил Фенил Фенил 4-Метилфенил 11 5 Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил 1 ОСН 3 ОН ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 ОН ОСН 3 6 Фенил Фенил Фенил 4-Метоксифенил 4-Метоксифенил Фенил Фенил 4-Метилтиофенил 4-Метилтиофенил 4-Трет.-бутил-фенил 4-Трет.-бутил-фенил Фенил Фенил 4-Ацетоксифенил 4-Гидроксифенил 4 4-Метилфенил 3-Метилфенил 3-Метилфенил Фенил Фенил 4-Фторфенил 4-Фторфенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Национальный центр интеллектуальной собственности. 220072, г. Минск, проспект Ф. Скорины, 66. 12 5 Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Метил Этил Этил Метил Метил
МПК / Метки
МПК: A61P 9/12, A61P 25/06, A61P 9/10, A61K 31/506, A61K 31/505, A61P 11/06
Метки: эндотелина, ингибитора, свойствами, лекарственное, обладающее, рецепторов, средство
Код ссылки
<a href="https://by.patents.su/12-4894-lekarstvennoe-sredstvo-obladayushhee-svojjstvami-ingibitora-receptorov-endotelina.html" rel="bookmark" title="База патентов Беларуси">Лекарственное средство, обладающее свойствами ингибитора рецепторов эндотелина</a>
Предыдущий патент: Способ непрерывной варки сусла, способ получения пива и пиво
Следующий патент: Лекарственные формы азитромицина с контролируемым высвобождением
Случайный патент: Массообменный аппарат Шлыкова-Годнева