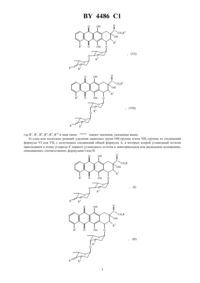
Антрациклиновые дисахариды, способ их получения и содержащая их фармацевтическая композиция
Номер патента: 4486
Опубликовано: 30.06.2002
Авторы: ЧИПОЛЛОНЕ, Амалия, АНИМАТИ, Фабио, ЛОМБАРДИ, Паоло, АРКАМОНЕ, Федерико
Текст
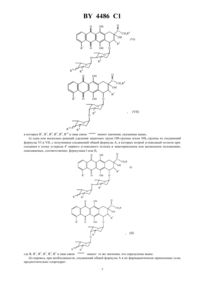
61 31/70, 61 35/00 НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ АНТРАЦИКЛИНОВЫЕ ДИСАХАРИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ(71) Заявитель А. МЕНАРИНИ ИНДУСТРИЕ ФАРМАСЕУТИКЕ РИЮНИТИ С.Р.Л.,БРИСТОЛЬ-МЕЙЕРЗ СКВИББ С.П.А.(73) Патентообладатель А.МЕНАРИНИ ИНДУСТРИЕ ФАРМАСЕУТИКЕ РИЮНИТЕ С.Р.Л., БРИСТОЛЬ-МЕЙЕРЗ СКВИББ С.П.А.(57) 1. Антрациклиновые дисахариды общей формулы где-или , 1 -или 3, 2 - , 3 - , 4 -или 2, 5 -или 2, знак связи указывает, что второй (конечный) углеводный остаток может быть присоединен к атому углерода 4 первого углеводного остатка в аксиальном либо в экваториальном положении и заместители 3, 4 и 5 могут находиться в аксиальном либо в экваториальном положении,или их фармацевтически приемлемые соли. 2. Соединения общей формулы А по п. 1, выбранные из группы, включающей 72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозил)ликсогексопиранозилдаунорубицинона хлоргидрат,72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозил)арабиногексопиранозилдаунорубицинона хлоргидрат,72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозиларабиногексопиранозил-4-деметоксидаунорубицинона хлоргидрат,72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозил)ликсогексопиранозил-4 деметоксидаунорубицинона хлоргидрат,72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозил)ликсогексопиранозил-4 деметоксидоксорубицинона хлоргидрат. 4486 1 72,6-дидеокси-4(2,3,4,6-тетрадеокси-4-аминоэритрогексопиранозил)ликсогексопиранозил-4-деметоксидоксорубицинона хлоргидрат. 3. Способ получения антрациклиновых дисахаридов общей формулы где-или , 1 -или 3, 2 - , 3 - , 4 -или 2, 5 -или 2, знак связи указывает, что второй (конечный) углеводный остаток может быть присоединен к атому углерода 4 первого углеводного остатка в аксиальном либо в экваториальном положении и заместители 3, 4 и 5 могут находиться в аксиальном либо в экваториальном положении,или их фармацевтически приемлемых солей, включающий следующие стадии) одна или несколько реакций удаления защитных групп -группы и/или 2-группы из соединений формулыили , с получением соединений общей формулы А, в которых второй углеводный остаток присоединен к атому углерода 4 первого углеводного остатка в экваториальном или аксиальном положениях,описываемых, соответственно, формуламиили 4486 1 где , 1, 2, 3, 4, 5 и знак связи имеют значения, указанные выше,) перевод, при необходимости, соединений общей формулыв их фармацевтически приемлемые соли. 4. Способ по п. 3, отличающийся тем, что на стадии ) в соединении формулыили 8 представляет собой О-группу, защищенную п-нитробензоилгруппой, 9 представляет собой Н или 2-группу, защищенную трифторацетил- или аллилоксикарбонилгруппой, 10 представляет собой ОН-группу, защищенную п-нитробензоилгруппой, или 2-группу, защищенную трифторацетил- или аллилоксикарбонилгруппой. 5. Способ по п. 3, отличающийся тем, что стадию ) проводят в присутствии конденсирующего агента,выбранного из группы, включающей трифлат серебра, перхлорат серебра, смесь окиси ртути и бромистой ртути, триметилсилилтрифлат, п-толуолсульфокислоту, трифторуксусную кислоту, галиды бора, четыреххлористое олово, четыреххлористый титан и ионообменные смолы типа Амберлит. 6. Способ по пп. 3 или 5, отличающийся тем, что соединение формулырастворяют в инертном органическом растворителе и конденсацию проводят в присутствии молекулярных сит в качестве обезвоживающих веществ. 7. Способ по пп. 5 или 6, отличающийся тем, что на стадии ) в реакционную смесь дополнительно вводят органическое основание, выбранное из пиридина, коллидина, ,-диметиламинопиридина, триэтиламина и 1,8-бисдиметиламинонафталина. 8. Способ по п. 3, отличающийся тем, что на стадии ) в соединении формулыилигалоген представляет собой хлор или бром. 9. Способ по п. 3, отличающийся тем, что на стадии ) трифторацетилгруппу, которая защищает 2 группу, и/или п-нитробензоил- и/или ацетилгруппу, которые защищают ОН-группу, удаляют в присутствии неорганического основания, выбранного из группы, включающей гидроксид или карбонат натрия, калия, лития и бария. 10. Способ по п. 3, отличающийся тем, что на стадии ) аллилоксикарбонильную группу, которая защищает 2-группу, удаляют в присутствии органических комплексов никеля или палладия. 11. Способ по п. 3, отличающийся тем, что на стадии ) метоксифенилдифенилметиловую группу, которая защищает ОН-группу, удаляют в присутствии органической кислоты. 12. Способ по п. 11, отличающийся тем, что указанной органической кислотой является уксусная кислота. 13. Способ по п. 3, отличающийся тем, что на стадии ) диметилтрет-бутилсилиловую группу, которая защищает ОН-группу, удаляют в присутствии фторида тетрабутиламмония. 14. Способ по п. 3, отличающийся тем, что на стадии ) соединения общей формулыпереводят в фармацевтически приемлемые хлоргидраты. 15. Соединения по пп. 1 или 2 или их фармацевтически приемлемые соли, обладающие противораковой активностью. 16. Фармацевтическая композиция, обладающая противораковой активностью, включающая активный ингредиент в смеси с фармацевтически приемлемым носителем или разбавителем, отличающаяся тем, что в качестве активного ингредиента она содержит терапевтически эффективную дозу соединения общей формулыпо пп. 1 или 2 или его фармацевтически приемлемой соли. Настоящее изобретение относится к соединениям общей формулы , в которой-или , где 1 -указывает, что второй (коили 3, 2 - , 3 - , 4 -или 2, 5 -или 2, знак связи нечный) углеводный остаток может быть присоединен к атому углерода 4 первого углеводного остатка в аксиальном либо в экваториальном положении и заместители 3, 4 и 5 могут находиться в аксиальном либо в экваториальном положении и к их фармацевтически приемлемым солям. Настоящее изобретение также относится к способу получения указанных соединений, их фармацевтически приемлемых солей и содержащим их фармацевтическим композициям. Даунорубицин и доксорубицин представляют собой хорошо известные антибиотики, которые используются в настоящее время в клинической практике при лечении ряда твердых опухолей и лейкоза (.в.. 1981). Соединения, имеющие структуру, схожую со структурой соединений, описанных в настоящей заявке, но представляющие только одну гликозидную группу, описаны в -457215,80/00305 и 90/07519. Соединения, имеющие две или несколько частей сахара, в которых сахар, непосредственно связанный с частью агликона, является амино-замещенным, описываются, например, в, стр. 1720-1730, . 93,37, 24, 4219-4228,2751395,, 228, 171-91/1992/ и 3641833. Соединения, имеющие три гликозидных фрагмента, по которым не представлены данные об активности,описаны в 92/07862. Однако, как известно, острые побочные действия, вызываемые противораковыми агентами, используемыми в настоящее время, ограничивают их применение значительным количеством больных, которые, если бы не эти явления, могли бы успешно вылечиваться. Кроме того, важно добиться существенного прогресса в лечении некоторых важных твердых опухолей, например легочных и яичниковых, которые плохо поддаются существующим видам лечения. Из этого следует, что существует острая необходимость в поступлении на рынок лекарств, которые высоко селективны в своем действии торможения пролиферации больных клеток в сравнении со здоровыми. Цель настоящего изобретения заключается в получении новых противораковых соединений, в частности аналогов антрациклина, в которых часть углевода состоит из остатка дисахарида. Неожиданно было выявлено, что заявленные антрациклиновые дисахариды, в которых сахар, непосредственно связанный с агликоном, никогда не содержит амино групп, проявляют более высокую противораковую активность и селективность, чем известный антрациклин. Следует отметить, что в известных антрациклинах, содержащих два остатка углевода, сахар, связанный с агликоном, всегда содержит свободную или замещенную амино группу. Соединения по настоящему изобретению представляют собой соединения общей формулы А и их фармацевтически приемлемые соли, в которых , 1, 2, 3, 4 и 5 имеют те же значения, что указаны выше. Настоящее изобретение также относится к фармацевтическим композициям, содержащим упомянутые соединения или их соли с фармацевтически приемлемыми кислотами, предпочтительно хлористоводородной кислотой. Наиболее предпочтительны следующие соединения) 72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозил)ликсогексопиранозил-4-деметокси-8-фтородоксорубицинона хлоргидрат. Соединения общей формулы А можно получить способом, состоящим из следующих стадий) конденсации соединения формулы в которойиимеют те же значения, что определены выше, и 6 -или 7 группа, где 7 является защитной группой, предпочтительно выбранной из ацетила, диметилтрет-бутилсилила или п-метоксифенилдефинилметила, с соединением формулыили 10 9 8 в которых- защищенная -группа,предпочтительно п-нитробензоат, 9 - Н или защищенная 2-группа, 10 - защищенная -группа,предпочтительно п-нитробензоат или защищенная 2-группа, предпочтительно трифтороацетамид или аллилкарбоксиамид и- группа, способная образовывать в условиях конденсации устойчивый карбо-катион,который может связываться с гидроксильной группой в положении -7 соединения формулы , при этом группуобычно выбирают из групп, используемых в реакциях гликозидирования, например, галогена, такого, как хлор или бром, предпочтительно хлор, или п-нитробензоилокси группа. Таким образом получают соединения формулыили . в которых,,,,,и знак связи имеют значения, указанные выше,) одна или несколько реакций удаления защитных групп -группы и/или 2-группы из соединений формулыи , с получением соединений общей формулы А, в которых второй углеводный остаток присоединен к атому углерода 4 первого углеводного остатка в экваториальном или аксиальном положениях,описываемых, соответственно, формуламиили ,где ,,,,,и знак связи имеют те же значения, что определены выше.) перевод, при необходимости, соединений общей формулыв их фармацевтически приемлемые соли,предпочтительно хлоргидрат. 7 4486 1 Условия реакции для гликозидирования соединения формулыс соединением формулыилис получением соединения формулыилимогут быть различными в зависимости от типа заместителей,присутствующих в соединениях формулыили . Гликозидирование проводят в инертном органическом растворителе в присутствии конденсирующего агента. Применяемые конденсирующие агенты представляют собой, например, фтороформ сульфонат серебра,хлорнокислое серебро, смеси окиси ртути и бромида ртути, галиды бора, четыреххлористое олово или титан или ионообменные смолы, такие, как , трифлат серебра, триметилсилилтрифлат, птолуолсульфокислота, трифторуксусная кислота. Предпочтительно гликозидирование проводят с молярным соотношением от 11 к 13 в инертном органическом растворителе, таком, как, например, бензол, толуол, этиловый эфир, тетрагидрофуран, диоксан, хлороформ, метиленхлорид или дихлорэтан и их смеси. Температура реакции может иметь диапазон от -40 до 40 , предпочтительно от -20 до 20 , и время реакции от 15 минут до 3 часов. Реакционная смесь может включать обезвоживающее вещество, такое, как активированное молекулярное сито. В ходе или в конце реакции реакционную смесь можно добавлять с органическим основанием, таким,как пиридин, коллидин, ,-диметиламинопиридин, триэтиламин или 1,8-бис-/диметиламино/-нафталин. В соответствии с настоящим изобретением удаление защитных групп дляи/или 2 функций из соединений формулыидля получения соединений формулыможно провести в различных условиях в зависимости от типа используемой защитной группы. Если 9 и/или 10 одинаковые или разные и каждый представляет защищенную 2 группу, такую, как трифторацетамид или защищеннуюгруппу, такую,как п-нитробензоат, и/или 8 - защищеннаягруппа, такая, как п-нитробензоат, и/или 6 - защищеннаягруппа, такая, как ацетат, реакции снятия защиты проводят в полярном растворителе, таком, как вода, метанол, этанол, пиридин, диметилформамид или их смеси и в присутствии неорганического основания в стехиометрическом количестве или в его избытке, такого, как гидроксид или карбонат натрия, калия, лития или бария. Температура реакции может колебаться от 0 до 50 и время реакции от 3 часов до 48 часов. Если 9 и/или 10 каждый представляет собой защищенную 2 группу, такую, как аллилкарбоксиамид,снятие защиты проводят в инертном растворителе и в присутствии комплекса металла, такого, как тетракис/трифенилфосфин/палладий, как раскрывают, например, в, 30, 3773 (1989), или тетракарбонил никель, как раскрывают, например, в . . . 38, 3233 (1973). Если 6 - защищеннаягруппа,такая, как диметилтретбутилсилилэфир, снятие защиты проводят в инертном растворителе и в присутствии фторида тетрабутиламмония, как раскрывают, например, в .. 37, 853 (1984). Если 6 - защищеннаягруппа, такая, как п-метоксифенилдифенилметилэфир, снятие защиты проводят в кислотной среде, например, в водной уксусной кислоте, как раскрыто, например, в . . . 42,3653 (1977). Соединения формулыили известны или их можно получить методами и способами, известными в органической химии, как раскрыто, например, в 33. . . 114, 517 (1984), в . . , . 59, 423(1986) и в вышеупомянутой патентной заявке Италии данного заявителя, раскрытие которой включается сюда ссылкой. Соединения формулыилиили известны или их можно получить методами и способами синтеза дисахаридов, известными в органической химии /. . . 10, 833 (1991), , ,74, 199 (1979), . ., 208, 111 (1980), , 46, 103, (1990). В другом случае при желании антрациклиновые гликозиды формулы А, в которой 1, 2, 3, 4, 5 - те же, что указаны выше и-группа, можно получить из гликозидов формулыиили их фармацевтиче- те же, что определены выше иски приемлемых солей, в которых 1, 2, 3, 4, 5 и знак связи, бромированием углерода в положении 14 бромом в хлороформе с последующим гидролизом, при комнатной температуре в течение 48 часов форматом натрия полученных 14-бромопроизводных. При желании гликозиды формулы А можно преобразовать в их фармацевтически приемлемые соли, например хлоргидраты, обработкой хлористоводородной кислотой в метиловом спирте. Настоящее изобретение также относится к фармацевтическим композициям, содержащим в качестве активного ингредиента соединение формулы А или его фармацевтически приемлемую соль, соединенную с фармацевтически приемлемым разбавителем или носителем. В соответствии с настоящим изобретением терапевтически эффективная доза соединения формулы А соединяется с инертным носителем. Композиции можно формировать традиционным способом с использованием обычных носителей. Заявленные соединения полезны для лечения людей и других млекопитающих. В частности, данные соединения являются хорошими противораковыми агентами при назначении в терапевтически эффективных дозах. Следующие примеры более подробно иллюстрируют настоящее изобретение. 4486 1 Пример 1. 72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозил)ликсогексопиранозил-4-деметоксидаунорубицинона хлоргидрат (соединение формулы ,12, 35,42). Смесь 4-деметоксидаунорубицинона (соединение формулы , 126) (300 мг, 0,81 мМ) и 2,6 дидеокси-4(2,3,6-тридеокси-4 п-нитробензоил-3-трифторацетамидоликсогексопиранозил)-3 пнитробензоилликсогексопиранозил-п-нитробензоата (соединение формулы , 35 п-нитробензоилокси-, 4 трифторацетамидо-,п-нитробензоилокси-) (600 мг, 0,72 мМ) в метилхлориде (72 мл) и этиловом эфире (24 мл) в присутствии молекулярных сит (4) при -20 обрабатывали триметилсилилтрифлатом (266 л, 1,44 мМ). Реакционную смесь перемешивали 1 час, затем ее разбавляли метиленхлоридом, промывали насыщенным раствором бикарбоната натрия и выпаривали до сухости. Остаток разделяли хроматографией на силикагеле (элюент 22 ), 99/1/ с выходом 360 мг 72,6-дидеокси-4(2,3,6 тридеокси-4 п-нитробензоил-3-трифторацетамидоликсогексопиранозил)-3 п-нитробензоилликсогексопиранозил-4-деметоксидаунорубицинона,1-26,8 10 9 п-нитробензоилокси-,-трифторацетамидо-). Замещенную суспензию дигликозида (соединения формулы , 126, 810 пнитробензоилокси, - 9 трифторацетамидо-) (120 мг, 0,117 мМ) в 17,6 мл 0,1 М раствора 2 в 2/, 1/1 выдерживали с помешиванием при комнатной температуре в течение 3 часов. Реакционную смесь нейтрализовали 0,2 М раствором бисульфата калия и экстрагировали хлороформом, органические экстракты собирали вместе, высушивали над безводным сульфатом натрия, выпаривали до сухости и подвергали поглощению 0,002 М раствором . Кислотный водный раствор промывали хлороформом и высушивали замораживанием с получением 62 мг нужного продукта (соединение формулы ,12,35, 42). Выход 39 . Полученные данные ЯМР представлены ниже 1-ЯМР (ДМСО-6),1,05 (д, 3), 1,15 (д, 3), 1,5-1,95 (м, 4), 2,1 (м, 2), 2,25 (с, 3), 2,95 (дд, 2),3,55 (с, 2), 3,8 (м, 1), 3,95 (м, 1), 4,15 (кв, 1), 4,35 (кв, 1), 4,6 (д, 1), 4,9 (шир.с, 2), 5,25 (шир. с,1), 5,35 (д. 1), 5,55 (с, 1), 7,95 (шир.с., 2), 8,25 (шир.с., 2). В соответствии с аналогичным способом были также получены следующие соединения формулыи 72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозил)ликсогексопиранозилдаунорубицинона хлоргидрат (соединение формулы ,2, 13,35, 42). 1(д, 1), 5,4 (шир.с., 2), 5,7 (с, 1), 7,95 (м, 2), 8,25 (м, 2). Данные ЯМР-спектров, относящиеся к полученным соединениями (1). Следующие соединения были получены по методике, аналогичной описанной в примерахв описании.(1) Соединениеформулы 72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозил)ликсогексопиранозил-4-деметоксидоксорубицинона хлоргидрат (,, 12,35, 42). Следующие полосы (, ) были соотнесены следующим образом 1,05 (, 3, 3) 1,15 (, 3, 3) 1,5-1,9 (, 4, -2 и -2) 2,1 (, 2, -8 и -8 ) 3,0 (, 2, -10 и -10 ) 3,45 (, 1, -3) 3,5 (, 1, -4) 3,6 (, 1, -4) 3,8 (, 1, -3) 4,1 (, 1, -5) 4,35 (, 1, -5) 4,55 (, 2, -14) 4,6 (, 1, -3) 4,85 (, 1, -14) 4,9 (, 2, -7 и -1) 5,2 (, 1, -1) 5,3 (, 1, -4) 5,53 (,1, -9) 8,0 и 8,3 (два , 4, ароматика). 4486 1 Следующие полосы (, ) были соотнесены следующим образом 1,1 (, 3, 3) 1,2 (, 3, 3) 1,5-2,3 (, 6, -2, -2 и -3) 2,1 (, 2, -8 и -8 ) 3,0 (, 2, -10 и -10 ) 3,35 (, 1, 4) 3,5 (, 1, -4) 3,65 (, 1, -5) 3,8 (, 1, -3) 4,1 (, 1, -5) 4,5 (, 2, -14) 4,6 (, 1, 3) 4,85 (, 1, -14) 4,9 (, 1, -7) 4,95 (, 1, -1) 5,2 (, 1, -1) 5,53 (, 1, -9) 8,0 и 8,3 (два, 4, ароматика). Цитотоксическая активность (50 мг/мл) представлена в опыте 1 (см. в конце описания). Опыт 2. Биологическая активность соединений 72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозил)ликсогексопиранозил-4-деметоксидаунорубицинона хлоргидрат (,, 1, 35, 42)(Соединение ) 2 во всех указанных соединениях, - проверялась в сравнении с доксорубицином в отношении множества видов рака человека различных гистотипов, включая рак яичника, рак легкого, рак молочной железы,рак шейки матки, рак толстой кишки. АктивностьВыживаемость клеток после воздействия на них испытуемого соединения оценивалась по увеличению ингибирования, за исключением клеточных линий мелкоклеточного рака легкого . Клеточную биомассу в логарифмической фазе роста собирали и размещали в 6 ячейках. Спустя 24 часа после засева клетки подвергали воздействию испытуемых соединений в течение различных периодов времени. После замены среды на среду, не содержащую лекарства, клеточную массу собирали и подсчитывали клетки спустя 72 часа после воздействия соединения. Для-7 ииспользовали метод -анализа и проводили колориметрическую оценку выживаемости в конце инкубационного периода (24 или 96 часов). Результаты,полученные в экспериментах по исследованию цитотоксичности, выражали в виде величины 50 (т.е. концентрации, требующейся для 50 -ного ингибирования роста клеток). Испытуемые соединения растворяли в дистиллированной воде и ею разбавляли культуральную среду. Результаты показаны в табл. 1. Заявленные соединения - демонстрируют удивительные цитотоксические воздействия, сила которых сопоставима или превышает эффект . ИсследованияДля исследованиябестимусным мышам подкожно с обеих сторон спины вводили фрагменты опухолей. Рост опухоли сопровождался измерением дважды в неделю ее длины и ширины с помощью кронциркуля. Вес опухоли вычисляли с помощью формулы мгобъем в мм 3 ширина 2 длина/2 (относительная плотность 1). Испытуемые соединения вводились в оптимальных дозах и по графику внутривенно мышам с опухолями, начиная с различных периодов времени в зависимости от использования различных видов рака (см. детально эксперименты). Эффекты, достигнутые лечением, выражали в виде величины ингибирования массы опухоли,( ) у мышей, подвергнутых лечению, по сравнению с контрольными, определяемой спустя 7-10 дней после последнего введения лекарства. Результаты показаны в таблицах 2 и 3. По отношению к раку яичника 2780 соединениепоказывает, по меньшей мере, такую же эффективность, что и доксорубицин, тогда как соединениедостигает уровня противоопухолевой активности, значительно более высокого, чем у исходного соединения, снижая рост опухоли на 99 . В отношенииопухоли , плохо поддающейся лечениюдоксорубицином, соединение ,как и соединение , показывает очень высокую противоопухолевую активность. Фармацевтическая композиция Примеры и методики получения Пример 1. Сравнительные количества различных компонентов, применяемых в композиции, были такими, как показано ниже (количества даны в расчете на флакон) Соединение- 10,00 мг Лактоза - 50,00 мг Точное количество (как определено методом ВЭЖХ) соединения , как активного начала, и лактозы(по фармакопее США) последовательно растворяют в воде для инъекций при перемешивании и при комнатной температуре. Раствор деаэрируют барботированием азота и затем добавляют деаэрированную воду для инъекций до получения конечной концентрации активного начала 5 мг/мл. Полученный в результате раствор фильтруют через фильтр 0,22 мм в стерильных условиях. 10 4486 1 Профильтрованный раствор разливают в стерильные стеклянные флаконы (объем 2 мл). Общая продолжительность лиофилизации составляет 45 часов. Спустя это время обычно давление восстанавливают введением азота, флаконы закрывают стерильными пробками и запечатывают алюминиевыми стерильными колпачками. Пример 2. Таким же образом получают лиофилизированную композицию на основе соединения , содержащую 50 кг активного начала Соединение- 50,00 мг Лактоза - 250,00 мг Сушка вымораживанием выполнялась в стерильных стеклянных флаконах емкостью 50 мл. Терапевтическое лечение (протокол) Противоопухолевая активность соединения 72,6-дидеокси-4(2,3,6-тридеокси-3-аминоликсогексопиранозил)ликсогексопиранозил-4-деметокси доксорубицинона хлоргидрата (, -,12, 35, 42) изучалась по отношению к -1 опухоли человека (рак молочной железы), привитой бесшерстным мышам. Изучение действительности для оценки реакции опухоли на соединениеего активностьопределяли при 6 мг/кг по графику 3/45 для того, чтобы оптимизировать противоопухолевую активность,учитывая зависимость времени выдержки от его цитотоксического действия в экспериментахкультурами клеток. Доксорубициниспользовался как лекарственное средство для сравнения при дозе 7 мг/кг и графике (73), который был установлен как оптимальный. Сравнительные подтверждения исследования для того, чтобы провести всестороннее сравнение двух лекарственных средств, более широкий спектр доз исследовали на опухоли МХ-1 один раз или дважды в неделю. В эту группу экспериментов входило также сравнение соединенияипри их максимальных толерантных дозах, для последнего она была определена путем наблюдения над обработанными животными в течение по меньшей мере трех месяцев с момента начала обработки. Во время исследованийлинии опухолевых клеток человека поддерживались серией подкожныхпассажей опухолевых фрагментов по обеим сторонам спины взрослым бестимусным бесшерстным мышам. Обычно опухолевые фрагменты гистологически проверялись на предмет человеческого происхождения после окрашивания гематоксилином и эозином и путем электрофореза изоэнзимов дегидрогеназы молочной кислоты. Бесшерстным мышам ( , , ) инъецировали опухолевые фрагменты в обе стороны спины (изучение действенности) или в один бок (сравнительные подтверждающие исследования). Рост опухоли сопровождался измерением ее длины и ширины с помощью кронциркуля в предопределенные ранее моменты времени (раз в неделю или два раза в неделю). Вес опухоливычисляли по формуле мгобъем в мм 3 ширина 2 х длина/2 (относительная плотность 1). 7/8 дней после последнего введения лекарства. Время удвоения опухоли (ДТ) вычисляли для каждой опухолевой линии по полулогарифмической наиболее соответствующей кривой для каждой контрольной опухоли, вычерченной в сравнении с некоторым уровнем (экспоненциальная фаза роста). Значения величин ДТ были использованы в исследованиях. Лекарства вводили внутривенно мышам с опухолями в разное время в зависимости от опухоли. Дни первой и последней инъекций были одни и те же для двух лекарств во всех экспериментах. По недельному графику соединениевводили дважды в один и тот же день с промежутком между инъекциями приблизительно 1 час. В каждой экспериментальной группе было по крайней мере восемь видов рака. Оценивали следующие эффекты, достигнутые при введении лекарств ингибирование массы опухоли( ) у мышей, подвергнутых обработке, по сравнению с контрольными, определяемое 7-10 дней спустя после последнего введения лекарства логарифм показателя уничтожения клетоку обработанных мышей в соответствии с формулой /ДТ 3,32, гдеи- время в сутках, необходимое для достижения среднего веса опухоли у обработанных и контрольныхмышей, указанного в каждом эксперименте токсическая смерть количество погибших мышей, у которых отсутствует опухоль измеримой массы, или мышей, погибших до первой смерти в контрольной группе долговременное выживаниеживые мыши с опухолью или без нее в конце эксперимента (сравнительные подтверждающие исследования). Результаты Модель МХ-1 рака молочной железы, полученная от пациентки, не получавшей лечения, была проверена на резистентность к(доксорубицину). По отношению к этой опухоли соединениебыло очень активно при различном уровне доз в двух отдельных экспериментах. Достигнутыеибыли значительно выше, чем те, которые получали от лечения(Табл. 1.1). Второй эксперимент (Табл. 2.1) показал, что 4486 1 противоопухолевая активность соединения по графику (3/4)5 была выше в определениях периода регрессии и продолжительности эффекта. Таблица 1.1 противоопухолевая активность соединенияи доксорубицинав отношении рака молочной железы человека МХ-1. Вес опухоли в начале обработки лекарством составлял 50 мг в обоих экспериментах. Таблица 2.1 противоопухолевая активность соединенияи доксорубицинав отношении рака молочной железы человека МХ-1. Вес опухоли в начале обработки лекарством составил 50 мг в обоих экспериментах. В сравнительных подтверждающих исследованиях соединениесравнивали св соответствии с еженедельным (таблица 3) или 2-недельным (таблица 3) графиком. Таблица 3 еженедельно (дни 7, 14, 21 вес опухоли на 7 сутки составил 50 мг). Таблица 3 дважды в неделю (дни 7, 10, 14, 17, 21 вес опухоли на 7 сутки составил 50 мг). Результаты этих сравнительных подтверждающих исследований свидетельствуют об эффективности соединенияпри ингибировании роста этой опухоли, выбранной из-за ее невыразительной реакции на . Опыт 1 Цитотоксическая активность (С 50 мг/мл) Лекарственное Продолжительность соединение воздействия, (ч) Доксо 24 а Таблица 1 Цитотоксическая активность ( ) Воздействие лекарства Линия клеток Таблица 2 Воздействие на рак яичника человека А 2780 ( ) оптимальная ингибирование опудни обработки гибель от токсичности доза, мг/кг холи,7 11, 18, 25 68 0/5 8,5 11, 18, 25 75 0/5 5 11, 15, 18, 21, 25 99 0/5 Таблица 3 Воздействие на мелкоклеточный рак легкого человека( ) оптимальная ингибирование опудни обработки гибель от токсичности доза, мг/кг холи,7 10, 17, 24 44 0/5 8,5 10, 17, 24 80 0/5 5 10, 14, 17, 21, 24 91 0/5 Таблица 1.1. Противоопухолевая активность соединенияи доксорубицинав отношении рака молочной железы человека -1. Вес опухоли в начале обработки лекарством составлял 50 мг в обоих экспериментах. Таблица 2.1. Противоопухолевая активность соединенияи доксорубицинав отношении рака молочной железы человека -1. Вес опухоли в начале обработки лекарством составил 50 мг в обоих экспериментах. Таблица 3 А еженедельно (дни 7, 14, 21 вес опухоли на 7 сутки составил 50 мг). Соединение Таблица 3 В дважды в неделю (дни 7, 10,14, 17, 21 вес опухоли на 7 сутки составил 50 мг). Соединение Национальный центр интеллектуальной собственности. 220072, г. Минск, проспект Ф. Скорины, 66.
МПК / Метки
МПК: A61K 31/70, C07H 15/252, A61P 35/00
Метки: композиция, дисахариды, содержащая, способ, фармацевтическая, антрациклиновые, получения
Код ссылки
<a href="https://by.patents.su/13-4486-antraciklinovye-disaharidy-sposob-ih-polucheniya-i-soderzhashhaya-ih-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Беларуси">Антрациклиновые дисахариды, способ их получения и содержащая их фармацевтическая композиция</a>
Предыдущий патент: Способ получения циклических лактамов
Следующий патент: Соединение, фармацевтическая композиция и способ ингибирования ВИЧ-протеазы
Случайный патент: Управляемый ведущий мост с автоматической блокировкой дифференциала