Восстановление тонической секреции эстрогена из яичников для продолжительных схем лечения
Текст
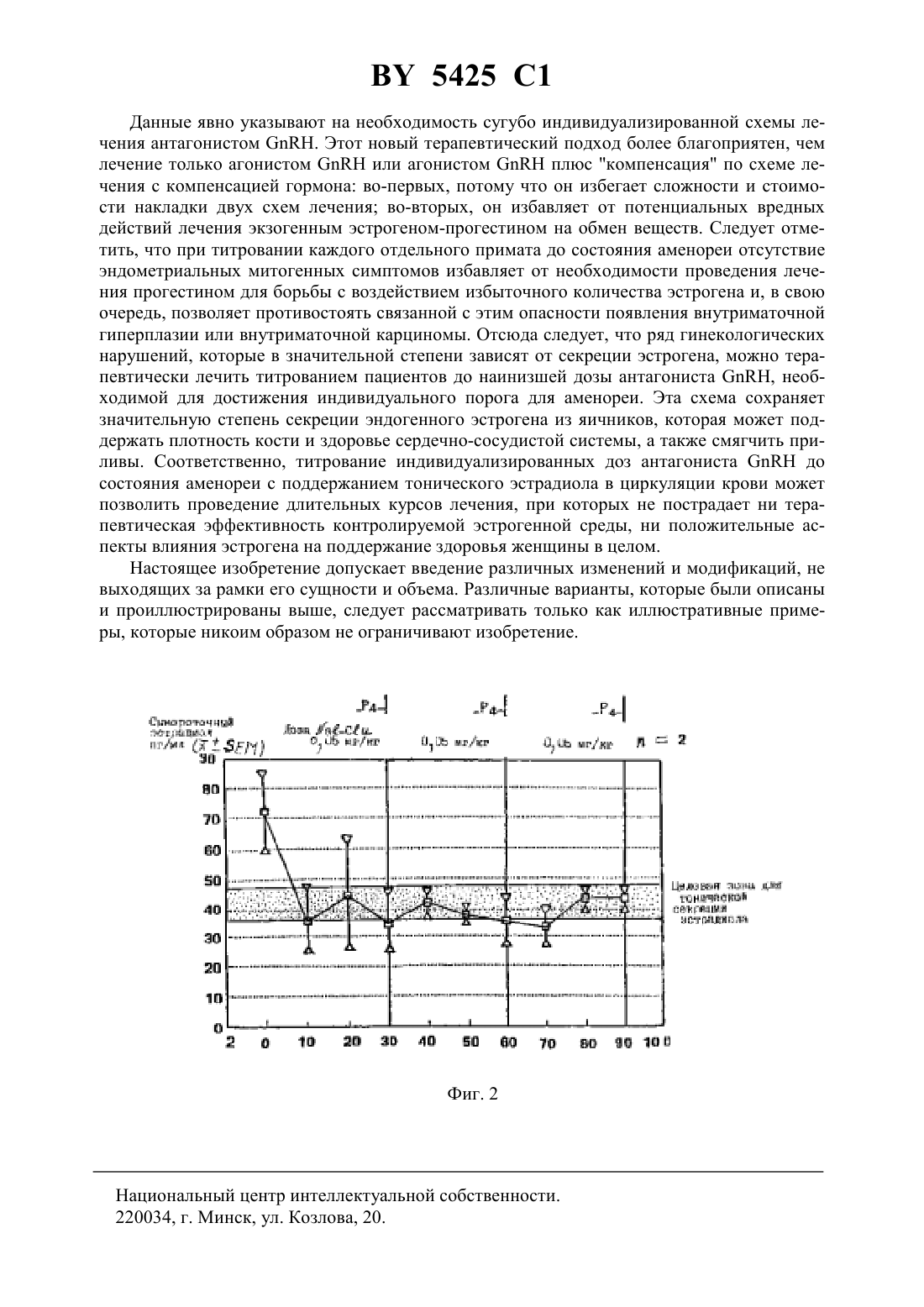
07 5/00, 61 5/24 НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ВОССТАНОВЛЕНИЕ ТОНИЧЕСКОЙ СЕКРЕЦИИ ЭСТРОГЕНА ИЗ ЯИЧНИКОВ ДЛЯ ПРОДОЛЖИТЕЛЬНЫХ СХЕМ ЛЕЧЕНИЯ(71) Заявители ДЗЕ МЕДИКАЛ КОЛЛЕДЖ ОФ ХЭМПТОН РОУДС ОРТО ФАРМАСЬЮТИКАЛ КОРПОРЕЙШН(73) Патентообладатели ДЗЕ МЕДИКАЛ КОЛЛЕДЖ ОФ ХЭМПТОН РОУДС ОРТО ФАРМАСЬЮТИКАЛ КОРПОРЕЙШН(57) 1. Способ терапевтического лечения зависимого от гонадо-стероидов состояния у млекопитающего путем снижения секреции эстрогена посредством введения антагониста гормона, высвобождающего гонадотропин , в количестве, эффективном для торможения пролиферации эндометрия, но недостаточном для снижения эндогенного эстрогена до кастрационного уровня. 2. Способ по п. 1, отличающийся тем, что млекопитающим является менструирующая женщина. 5425 1 3. Способ по п. 1, отличающийся тем, что антагониствводят в количестве, эффективном для обеспечения среднего уровня эстрадиола в сыворотке крови 30-50 пг/мл в течение 24 ч. 4. Способ по п. 3, отличающийся тем, что антагониствводят в количестве, эффективном для обеспечения среднего уровня эстрадиола в сыворотке крови 30-45 пг/мл в течение 24 ч. 5. Способ по п. 1, отличающийся тем, что антагониствводят многократно в кумулятивном количестве, эффективном для торможения пролиферации эндометрия, но недостаточном для ускорения разрежения костной ткани, связанного с продолжительным недостатком эстрогена. 6. Способ по п. 1, отличающийся тем, что антагониствводят многократно в кумулятивном количестве, эффективном для торможения пролиферации эндометрия, но недостаточном для усиления факторов риска сердечно-сосудистых заболеваний, связанных с продолжительным недостатком эстрогена. 7. Способ по п. 1, отличающийся тем, что антагониствводят многократно в кумулятивном количестве, эффективном для торможения пролиферации эндометрия, но недостаточном для проявления вазомоторных симптомов, таких как приливы, связанных с продолжительным недостатком эстрогена. 8. Способ снижения пролиферации эндометрия у менструирующей женщины, не вызывающий снижения эндогенного эстрогена до кастрационного уровня, включающий введение антагонистав количестве, эффективном для торможения пролиферации эндометрия и обеспечения среднего уровня эстрадиола в сыворотке крови 30-50 пг/мл в течение 24 ч. 9. Способ по п. 8, отличающийся тем, что антагониствводят в количестве, эффективном для обеспечения среднего уровня эстрадиола в сыворотке крови 30-45 пг/мл в течение 24 ч. 10. Способ снижения пролиферации эндометрия у менструирующей женщины, не вызывающий снижения эндогенного эстрогена до кастрационного уровня, включающий многократное введение антагонистав кумулятивном количестве, эффективном для торможения пролиферации эндометрия и обеспечения среднего уровня эстрадиола в сыворотке крови 30-50 пг/мл в течение 24 ч. 11. Способ по п. 10, отличающийся тем, что антагониствводят в количестве,эффективном для обеспечения среднего уровня эстрадиола в сыворотке крови 30-45 пг/мл в течение 24 ч. 12. Способ ослабления симптомов зависимого от гонадо-стероидов состояния у менструирующей женщины, не вызывающий снижения эндогенного эстрогена до кастрационного уровня, включающий введение антагонистав количестве, эффективном для торможения пролиферации эндометрия и обеспечения среднего уровня эстрадиола в сыворотке крови 30-50 пг/мл в течение 24 ч. 13. Способ по п. 12, отличающийся тем, что антагониствводят в количестве,эффективном для обеспечения среднего уровня эстрадиола в сыворотке крови 30-45 пг/мл в течение 24 ч. 14. Способ ослабления симптомов зависимого от гонадо-стероидов состояния у менструирующей женщины, не вызывающий снижения эндогенного эстрогена до кастрационного уровня, включающий многократное введение антагонистав кумулятивном количестве, эффективном для торможения пролиферации эндометрия и обеспечения среднего уровня эстрадиола в сыворотке крови 30-50 пг/мл в течение 24 ч. 15. Способ по п. 14, отличающийся тем, что антагониствводят в количестве,эффективном для обеспечения среднего уровня эстрадиола в сыворотке крови 30-45 пг/мл в течение 24 ч 16. Способ определения дозы антагонистадостаточной для снижения секреции эстрогена до уровня, эффективного для торможения пролиферации эндометрия, но недоста 2 5425 1 точного для снижения эндогенного эстрогена до кастрационного уровня, путем многократного введения антагонистамлекопитающему, включающий титрование доз антагониста. 17. Способ по п. 16, отличающийся тем, что титрование включает проведение теста на введение прогестерона указанному млекопитающему, при котором наличие аменореи указывает на адекватное подавление секреции эндогенного эстрогена. 18. Способ по п. 17, отличающийся тем, что проводят дополнительный тест на введение прогестерона. 19. Способ по п. 18, отличающийся тем, что титрование проводят с увеличением концентрации. 20. Способ по п. 18, отличающийся тем, что титрование проводят суменьшением концентрации. 21. Способ по п. 18, отличающийся тем, что введение доз антагониста и проведение дополнительного теста на введение прогестерона проводят более одного раза. 22. Способ по п. 16, отличающийся тем, что зависимым от гонадо-стероидов состоянием является эндометриоз. 23. Способ по п. 16, отличающийся тем, что зависимым от гонадо-стероидов состоянием является лейомиома.(56).. . . . . 1975. - .121. -5. - Р. 695-703. Это частичное продолжение заявки под серийным номером 08/279593, поданной 22 июля 1994 г. Эндометриоз представляет собой эктопическое наличие желез и стромы эндометриального типа на участках вне матки. Это эктопическое проявление эндометриальной ткани часто образует кисты, содержащие измененную кровь. Это состояние приводит к изнуряющей боли у миллионов женщин во всем мире и, в частности, имеет место вместе с месячной пролиферацией внутриматочной ткани. Часто такое состояние бывает на протяжении всей жизни и иногда с ним связывают бесплодие. Эндометриоз можно лечить разнообразными лекарственными средствами, но ни одно из этих средств не является достаточно безопасным и эффективным в течение длительного срока лечения свыше шести месяцев или больше. Возможно самым традиционным лечением с видимым результатом является введение прогестина инъекцией, перорально или в комбинации с оральными контрацептивами. Однако, длительное назначение прогестинов связано с рядом нежелательных побочных действий, сомнительной эффективностью и не получило одобрения соответствующих органов в США. Синтетический стероид, полученный из этистерона, а именно 17 прегна-2,4-диен 20-ино 2,3 изоксазол-17-ол, известный так же, как даназол, и зарегистрированный под товарным знаком(Данокрин), оказался эффективным средством в лечении эндометриоза, обеспечивающим гипоэстрогенную среду. К сожалению, это лекарственное средство также обладает многими андрогенными побочными действиями. Кроме вазомоторных приливов из-за эстрогенной недостаточности, он является причиной излишнего веса, мышечных спазмов, атрофии молочных желез, приливов, перепадов настроения, избыточной жировой секреции кожи, депрессии, отеков, угрей, утомления, гирсутизма, изменений в либидо, головных болей, сыпи и огрубления голоса. Одним из наиболее эффективных видов лечения эндометриоза является назначение агониста гормона, высвобождающего гонадотропин , для подавления гипофизарной секреции гонадотропина и тем самым стимулирования состояния обратимой псевдоменопаузы, т.е. назначение дозы, постепенно снижающей секрецию. Хотя индивидуальная ответная реакция различна, эндометриотические поражения, связанные с эндометриозом,3 5425 1 обычно быстро претерпевают обратное развитие и уменьшаются в размере уже в течение трех месяцев после начала лечения. По прекращении лечения боль часто возвращается и эндометриоз появляется вновь в течение нескольких месяцев после возврата нормальных менструальных циклов. Лекарственное средство можно также применять для лечения фиброзных опухолей (лейомиом). Основным недостатком этой длительной терапии является ряд побочных действий, вызванных продолжительным и значительным пониженным содержанием эстрогена или состоянием псевдоменопаузы, индуцированным большим недостатком эстрогена, а именно приливы, остеопороз и потеря защиты сердечно-сосудистой системы эстрогеном. Опять же у разных пациентов это происходит по-разному, но остеопороз в основном начинает проявлять себя после 3 месяцев лечения и иногда у наиболее уязвимых пациентов его симптомы становятся очень значительными после приблизительно 6 месяцев лечения. Этот побочный эффект остеопороза абсолютно неприемлем с точки зрения риска-преимуществ - предполагаемая продолжительность жизни после того, как женщина в постклимактерическом возрасте переносит перелом шейки бедра из-за остеопороза, составляет только около 3,2 лет. Из-за этого побочного действия Управление по питанию и лекарственным средствам США(УПЛ) не предписывает назначение никаких аналогов гормона, высвобождающего гонадотропин, после шести месяцев общего лечения. Другими словами, по настоятельному требованию УПЛ лекарство нельзя назначить повторно после перерыва. Таким образом, основное опасение в лечении агонистомзаключается в том, что длительное гипоэстрогенное состояние у женщин репродуктивного возраста может привести к кумулятивным побочным действиям истощения эстрогена, особенно ускоренному разрежению костной ткани, что повышает риск возникновения остеопороза и перелома костей. Пациенты, получающие дозу агониста , регулирующую снижение, имеют очень заниженные уровни эстрогена для борьбы с постклимактерическим состоянием. Эта обеспокоенность послужила мотивом для клинических исследований схем компенсации,основанных на гипотезе пороговой величины эстрогена, по которым пациентов с клинически значительными фиброзами матки лечили агонистомв сочетании с малой компенсационной дозой гормона эстрогена-прогестина, последний давали по схеме лечения, приближающейся к знакомой схеме лечения в постклимактерическом периоде. Целью было достижение достаточного снижения эндогенной секреции эстрогена яичниками посредством агониста вместе с экзогенным пополнением эстрогена-прогестина в небольшой дозе с тем, чтобы не потерять клинические преимущества из-за схемы лечения с компенсацией гормона. В научной литературе также описано потенциальное применение антагонистов гормона высвобождения гонадотропина, которое также эффективно в клиническом лечении эндометриоза и лейомиом матки. Например,. в,-, . , . ., 731262 (1991), исследовали действие антагонистаантида, и авторы сделали вывод, что антагонист при введении одной достаточной дозы может вызвать мгновенное и устойчивое торможение системы гипофизяичники. Полученная гипоэстрогенная среда была достаточной, чтобы ожидать, что лечение пациентов обеспечит контроль различных состояний гонадо-стероидной зависимости,таких, как эндометриоз и лейомиома матки, без задержки и потенциальных последствий знакомых приливов и снижений в ответ на лечение агонистом . Однако авторы также указали, что было бы очень желательно получить препарат, который обеспечит больший контроль биодоступности и меньшую индивидуальную реакцию на лечение. Основанием для антагонистического подхода настоящего изобретения является тот факт, что в отличие от агонистических продуктов, которые полностью тормозят подавление регуляции системы рецептора , антагонист монополизирует рецепторыконкуретной занятостью, достигая таким образом других степеней торможения, которые зависят от дозы. 4 5425 1 Поэтому при соответствующей дозе антагонистапредставляется возможным поддерживать тонус секреции эстрадиола яичниками на умеренном уровне, который достаточно снижен, чтобы контролировать гинекологические проблемы, вызванные эстрогеном, такие, как эндометриоз, но все же достаточно высок, чтобы избежать длительных осложнений из-за явного недостатка эстрогена. Существует необходимость обеспечить дозу и/или схему лечения антагонистом ,которые обеспечат оптимальный уровень концентрации эстрогена в сыворотке. Как указывалось в статье. выше, ответная реакция на конкретный антагонистразлична у разных пациентов. Поэтому дозировку антагонистаследует определять у каждого больного, чтобы достичь нужной степени секреции эстрогена. Следовательно,необходимо также найти удобный способ определения установления соответствующего уровня содержания эстрогена. Надо сказать, что имеется много схем лечения, в которых желательно поддерживать тоническую секрецию эстрогена яичниками. Такими примерами являются лечение эндометриоза и лейомиом. Существует уровень агента, который подходит для безопасного(т.е. не возникает побочных действий в менопаузе, таких, как разрежение кости) и эффективного (т.е. лечится состояние заболевания) долгосрочного терапевтического лечения состояний, зависимых от гонадо-стероидов. Настоящее изобретение обеспечивает такой уровень и способ его установления. На фиг. 1 показано, что остаточная секреция эстрогена яичниками зависит от доз антагонистаи что степень торможения стабилизируется в течение 7-10 дней после начала лечения. На фиг. 2 показано, что популяции менструирующих приматов можно титровать до нужного уровня частичного торможения секреции эстрогена в яичниках. Изобретение относится к лечению широкого спектра состояний, зависящих от гонадостероидов, таких, как эндометриоз, лейомиомы матки, предменструальный синдром и дисфункциональное маточное кровотечение. Более конкретно, изобретение относится к эффективному и безопасному лечению этих состояний, зависящих от гонадо-стероидов,путем назначения схемы лечения антагонистом , который эффективен в значительном торможении пролиферации внутриматочной ткани у менструирующей женщины, но неэффективен в прекращении выработки эстрогена, то есть неэффективен, чтобы значительно индуцировать кастрационный уровень эндогенного эстрогена. Другие предпочтительные варианты изобретения направлены на дозы антагониста , которые обеспечивают эффективные количества для торможения пролиферации внутриматочной ткани у менструирующей женщины, но которые неэффективны, чтобы значительно задержать выработку эндогенного эстрогена. В наиболее предпочтительных вариантах изобретения предлагаемая схема лечения и дозы обеспечивают достаточную выработку эндогенного эстрогена, чтобы вырабатывать и поддерживать концентрацию эстрадиола в сыворотке в пределах от около 30 до 50, а лучше от около 35 до 45 пг/мл. Это изобретение также предлагает способ определения того, является ли гипоэстрогенная среда у отдельного млекопитающего таковой, в которой концентрация эстрадиола была снижена до оптимального уровня, соответствующего терапевтическому лечению состояния, вызванного гонадо-стероидами у этого лица, путем введения антагонистаэтому лицу в данной дозе, установленной титрованием, например проведением теста на введение прогестерона этому лицу. В соответствии с настоящим изобретением предлагается схема лечения или доза антагониста , которая эффективна в торможении пролиферации внутриматочной ткани у менструирующей женщины, но неэффективна в значительной задержке выработки эндогенного эстрогена. Хотя количество антагониста , предусмотренное в схеме, и доза могут меняться в зависимости от конкретных субъектов, как правило, схему лечения и дозу регулируют таким образом, чтобы достичь на протяжении 24 ч содержания эстрадиола в сыворотке порядка от около 30 до 50, а лучше от около 35 до 45 пг/мл. 5 5425 1 Было высказано предположение, что снижение уровня эстрадиола в сыворотке дает нужный эффект торможения пролиферации внутриматочной ткани у менструирующей женщины. Однако существует и параллельная проблема, когда эстрогена недостаточно,чтобы смягчить, избежать или защитить от менопаузо-подобных симптомов, связанных с кастрационным уровнем эстрогена. Например, когда уровень эндогенного эстрогена падает ниже приблизительно 15 пг/мл, возникают побочные действия истощения эстрогена. Чтобы избежать этих побочных действий, после истощения эндогенного эстрогена до сих пор эстроген вводили вновь, проводили так называемую компенсирующую терапию. Только в настоящем изобретении предлагается лечение состояний зависимости от гонадо-стероидов с поддержанием уровней эндогенного эстрадиола в сыворотке по меньшей мере в пределах около 30 пг/мл, не полагаясь на компенсацию или дополнительное введение эстрогена. Клиническое лечение некоторых гинекологических заболеваний, которые зависят от эстрогена, таких, как эндометриоз, более сложно, чем лечение простого недостатка эстрогена у пациента. В действительности, причиняющий боль очень сниженный уровень эстрогена в течение продолжительного периода не только заставляет пациентов переносить неудобство симптомов недостатка эстрогена, но и создает риск ускорения разрежения кости, а также возрастание факторов риска для сердечно-сосудистой системы, что также связано с продолжительным недостатком эстрогена. Оптимальные условия лечения могут позволить долгосрочный клинический контроль этих нарушений, ограничить секрецию эстрогена из яичников до уровня, который дает ощутимый результат при лечении (т.е. боль внизу живота от эктопических эндометриальных поражений значительно снижается или прекращается), при одновременном поддержании остаточной (базальной) секреции эстрогена из яичников выше самого низкого кастрационного (менопаузо-подобного) уровня, обеспечивая таким образом благоприятное воздействие. Этот подход превосходит компенсационное лечение эстрогеном-прогестином, поскольку схему лечения антагонистомтитруют до индивидуальных потребностей,которые выявляют как по остаточным уровням эстрогена в крови, так и по факту, является ли внутриматочная пролиферация достаточной, чтобы снять кровотечение после краткого курса терапии прогестероном. В общем, эта технология дает практический способ, при котором уровни эстрогена достаточно низки, чтобы достичь положительных результатов в лечении от сниженного снабжения эстрогеном, но достаточно высоки, чтобы свести к минимуму или избежать последствий длительного недостатка эстрогена. В определении соответствующей дозировки важно знать, что простое измерение уровня секреции эстрадиола может не дать достаточной информации. Сейчас уже известно, что у разных людей в ответ на данную дозу антагонистаразличен не только уровень секреции эстрадиола, но и дозировка антагониста, которого достаточно, чтобы вызвать аменорею у субъекта, также различна для разных людей. Поэтому было выявлено,что определение дозировки должно сопровождаться титрованием дозы антагониста ,например, посредством применения теста на введение прогестерона. Соответственно, согласно изобретению, контроль состояния зависимости от гонадостероидов достигают введением антагонистасубъекту и затем титрованием антагониста до выбранной дозы и/или схемы лечения, с тем, чтобы можно было достичь оптимальной гипоэстрогенной среды. Гормон, высвобождающий гонадотропин, представляет собой небольшой полипептид,вырабатываемый в гипоталамусе, и иногда его называют гонадотропным высвобождающим гормоном, гормоном, высвобождающим лютеинизирующий гормон,или. В настоящем изобретении используют те аналоги или пептомиметики этого полипептида, которые являются антагонистами. Примеры антагониста гормона высвобождения гонадотропина можно найти в патентах США 4 409 208, 4 547 370, 4 565 804, 4 569 927 и 4 619 914, 5 198 533 и 89/01944,раскрытия которых включены сюда ссылкой. Примеры таких антагонистов включают 6 5425 1 Азалин В, Антид (декапептид, представленный формулой 2-1-233-4-56-7-8-910), -41, 42, 3,6, 10 , -42, 33, 5, 26, 10 , -2-1,42, 3, 6, 10 , -21, 42, 3, 6 , 21, 42, 3, (2)6, 10 ,-1, 42, 3,4, 5, 6, 7, 8, 9, 10 . Антагонисты гормона, высвобождающего гонадотропин, применяемые в настоящем изобретении, можно назначать в форме фармацевтически приемлемых нетоксических солей или комплексов. Соли включают соли кислотного присоединения, такие, как, например, гидрохлорид, гидробромид, сульфат, фосфат, нитрат, оксалат, фумарат, глюконат,таннат, малеат, ацетат, бензоат, сукцинат, алгинат, малат, аскорбат, тартрат и прочие. Комплексы могут быть с металлами, такими, как, например, цинк, барий, кальций, магний, алюминий и другие. Можно применять любой известный антагонист . Режим назначения, используемый до сих пор для подобных терапевтических средств, т.е. агонистов , можно также применять в практике настоящего изобретения, заменяя антагонистом ранее применяемый агент. Таким образом, способ назначения может быть любым традиционным способом, в котором аналог активен, например, перорально, внутривенно, подкожно, внутримышечно, подъязычно, чрезкожно, ректально, внутриназально или внутривагинально. Таким же образом форма назначения может быть таблеткой, драже, капсулой, пастилкой,ингаляционной средой, аэрозолем и прочим. На практике количество введенного первоначального антагониста гормона, высвобождающего гонадотропин, должно быть достаточным, чтобы отрегулировать циркулирующий эстроген до величины в намеченном диапазоне порядка 25-50 пг/мл. В зависимости от применяемого конкретного антагониста первоначальная доза обычно составляет около 0,0010,5 мг/кг в день при внутримышечном введении, но она может широко варьироваться в зависимости от режима назначения и конкретного соединения. Введение может быть периодическим, например раз в неделю или в месяц, либо непрерывным, например ежедневно. Ежедневное введение более предпочтительно, так как пациентам легче следовать режиму лечения и они не забывают и не пропускают дни приема лекарств. Удобным и приемлемым для пациента может быть введение лекарственного средства в виде депо. Является ли количество введенного антагониста достаточным, чтобы контролировать состояние зависимости от гонадо-стероида, можно легко определить простым наблюдением внешних проявлений состояния. Например, отсутствие боли указывает на то, что дозировка антагонистабыла достаточной, чтобы справиться с эндометриозом. Чтобы определить, является ли дозировка подходящей для того, чтобы оптимизировать тоническую концентрацию эстрадиола, проводят тест на введение прогестерона. Сам тест и процедура его проведения хорошо известны. Смотри, например,.,, , 2551600 (1986).,-, . . . ., 121695 (1975). В общем, в течение короткого периода времени вводят дозу прогестерона или синтетического прогестина, например, 7-14 дней, и когда прогестин снимают, отмечают наличие или отсутствие кровотечения после прекращения введения. Наличие такого кровотечения является показателем того, что концентрация эстрадиола остается достаточной, чтобы стимулировать эндометрий, и поэтому была снижена недостаточно. В этом случае дозировку антагонистаследует увеличить. И наоборот, отсутствие кровотечения после прекращения введения прогестерона означает, что было достигнуто состояние аменореи, и что уровень эстрадиола либо достаточный, либо слишком низом. В последнем случае снижают количество антагонистаи повторяют тест на введение. Цикл введения антагониста и проведения теста можно повторять до тех пор, пока не будет определена соответствующая концентрация вводимого антагониста. 7 5425 1 Прогестерон можно вводить в любой удобной фармацевтической форме. Например,такие формы могут содержать прогестин и подходящий носитель, такой, как твердые формы дозировки, которые включают таблетки, капсулы, облатки, пилюли, порошки или гранулы наружные формы, которые включают растворы, порошки, жидкие эмульсии,жидкие суспензии, полутвердые средства, мази, пасты, кремы, гели или желе и пены и парентеральные дозированные формы, которые включают растворы, суспензии, эмульсии или сухой порошок, содержащие эффективное количество прогестерона. В данной области известно, что активный ингредиент, прогестин, может содержаться в таких препаратах вместе с фармацевтически приемлемыми разбавителями, наполнителями, дезинтеграторами, связующими, смазывающими веществами, сурфактантами, гидрофобными носителями,водорастворимыми носителями, эмульгаторами, буферами, увлажнителями, растворителями, консервантами и другими средствами, усиливающими действие лекарств. Средства и способы введения известны и специалист может получить информацию в соответствующей литературе по фармакологии. Например, можно проконсультироваться в,,, . 1979, 6 ,.,1980. Аналогичным образом в тесте на аменорею можно использовать прогестины (аналоги), которые имитируют биологическую активность самого прогестерона. Применение компонентов, композиций и способов этого изобретения для лечебного и/или фармацевтического использования, которые описаны в этом тексте, можно реализовать любыми клиническими, медицинскими или фармацевтическими методами или способами, которые в настоящее время или перспективно известны специалистам данной области. Впервые настоящее изобретение осуществляет лечение состояний зависимости от гонадо-стероидов с одновременным поддержанием выработки достаточного количества эндогенного эстрогена, чтобы смягчить побочные действия истощения эстрогена. Настоящее изобретение предлагает некастрационную дозу антагониста , которую титруют с тем, чтобы обеспечить достаточное снижение эндогенного эстрогена для торможения пролиферации внутриматочной ткани у менструирующей женщины, но которое неэффективно, чтобы значительно задержать выработку эндогенного эстрогена. Эта доза может быть эффективной, чтобы обеспечить содержание эстрогена в сыворотке в пределах от около 30 до 50, а предпочтительно около 35-45 пг/мл, которое смягчает симптомы менопаузы, такие, как остеопороз, приливы и т.п. Это титрование дозы антагониставпервые проводили способом, описанным выше, с помощью теста на кровотечение после снятия прогестина. Отсутствие кровотечения после снятия прогестина указывает врачу на то, что антагонистбыл введен в достаточном количестве, чтобы замедлить выработку эндогенного эстрогена до уровня, достаточно низкого для торможения пролиферации внутриматочной ткани. Как уровни циркулирующего в крови эстрогена, так и ответная реакция пациента на остаточную (базальную) выработку эстрогена яичниками укажут на удовлетворительное поступление эндогенного эстрогена. Чтобы далее проиллюстрировать настоящее изобретение, было проведено исследование, как описано ниже. Однако следует принимать во внимание, что это исследование является только иллюстративным, и его не следует рассматривать как ограничивающее объем изобретения. Исследование проводили на одиннадцати взрослых самках обезьянс регулярными и предположительно овуляторными менструальными циклами. Взвешивание проводили ежемесячно. Менструальное кровотечение и кровяные выделения регистрировали ежедневно визуальным осмотром наружных половых органов и введением вагинальных тампонов, смоченных в физрастворе, с помощью апликатора с хлопковой тканью на конце. Пробы крови брали из бедренных сосудов и сыворотку оставляли для последующего радиоиммунанализа (РИА) эстрадиола и прогестерона. Коэффициенты вариации для 8 5425 1 этих проб были 7,4 и 11,1 и 7,0 и 10,9 , соответственно, в пробах и в промежутках между взятием проб. Применяемым антагонистомбыл - -2,42, 33, 5, 6, 10-. В Частиисследования была поставлена цель провести краткое исследование по определению дозы, которое указало бы остаточные уровни эстрадиола в сыворотке у здоровых приматов, ранее имевших регулярные менструальные циклы. Конкретно, пытались определить приблизительную минимальную ежедневную дозу -, достаточную, чтобы снизить уровни циркулирующего в крови эстрадиола до намеченного диапазона менее 45 пг/мл, но больше, чем 35 пг/мл. Начиная со 2-го дня менструального цикла, -,суспендированный в кунжутном масле, вводили с 9 до 10 часов утра в дозах 0,1 (5) и 0,3 мг/кг (6) на протяжении 14 дней. Кровь из бедренной вены брали ежедневно под анастезией кетамином. РИА эстрадиола сыворотки показал, что, если доза 0,1 мг/кг часто давала концентрации циркулирующего в крови эстрадиола, близкие к намеченному диапазону (35-45 пг/мл), доза в 0,3 мг/кг была слишком высокой, т.е. сывороточные уровни эстрадиола устойчиво держались ниже 30 пг/мл. Соответственно, диапазон дозы антагонистаснизили в Частиисследования. После 60-дневного интервала и по выведению лекарства приступили к Частиэксперимента, которая ставила две задачи 1) попытаться титровать дозу антагонистаиндивидуально для обезьян, так, чтобы остаточная секреция эстрогена яичниками часто была в пределах намеченного диапазона (35-45 мг/мл эстрадиола) как можно в большем количестве проб крови и 2) провести периодические тесты на введение прогестерона, в которых кровотечение после снятия прогестерона указывает на значительную эндометриальную пролиферацию, вызванную эстрогеном (т.е. избыточное эстрогенное влияние) в отличие от аменореи (отсутствие кровотечения после снятия прогестерона), как индикатора того, что доза антагонистаи, в свою очередь, тоническая выработка эстрогена яичниками указывают на контролируемую эстрогенную среду. По схеме эксперимента все одиннадцать обезьян, начиная со второго дня менструального цикла, вначале получали - антагонистежедневно с дозировкой 0,05 мг/кг до тех пор, пока результаты теста на введение прогестерона и уровни эстрадиола в циркуляции крови не показали необходимость поднять дозу. Одновременно с введением антагониста с 20 и 30 дня курса вживляли пару силастиковых имплантатов с прогестероном подкожно, а затем их удаляли. Если на следующей неделе после снятия прогестерона менструация имела место, индивидуальную дозу - поднимали до 0,1 мг/кг ежедневно. На 50 день введения антагонистадля всех обезьян повторили 10-дневный тест на прогестерон. Те приматы, которые проявляли аменорею, оставались на этой дозе других с проявлением кровотечений перевели на более высокую дозу антагониста 0,2 мг/кг ежедневно по 90-ый день эксперимента, и последний тест на прогестерон провели на всех обезьянах с 80 по 90 дни. И вновь регистрировали аменорею или кровотечение после снятия лекарства. Для определения, кровотечение после снятия засчитывалось, если на внешних половых органах кровь была в течение двух или более последующих дней на следующей неделе после снятия прогестерона. Кровяные выделения засчитывались, если кровь была видна только на тампоне после его введения во влагалище. Пробы крови из бедренной вены брали каждые 10 дней на РИА эстрадиола и прогестерона. Данные, показанные на фиг. 1, отображают действие двух доз - антагонистана уровни циркулирующего в крови эстрадиола у обезьян в течение 14-дневного периода проведения эксперимента, начиная со 2-го дня менструального цикла. Следует отметить, что дозировка в 0,1 мг/кг ежедневно давала почти все средние величины в намеченной зоне 35-45 пг/мл тонического эстрадиола. Хотя эта доза - представляется почти оптимальной, средние величины скрывают важные индивидуальные величины, в которых некоторые данные указывают, что антагонистс дозой 0,1 мг/кг внутримышечно (в/м) очень сильно действует на некоторых приматов, у которых сывороточные 9 5425 1 уровни эстрадиола доминировали с величиной 25 пг/мл. А в других случаях обезьянам требовалась более высокая доза антагониста , чтобы достичь устойчивых уровней эстрадиола ниже 45 пг/мл. Кроме того, исследование по установлению этой дозы ясно показывает, что ежедневная доза - антагонистав 0,3 мг/кг слишком высока. Действительно, сывороточные уровни эстрадиола сразу же снижались ниже намеченной зоны (даже 20 пг/мл) и продолжали снижаться еще в течение 14 дней курса лечения. На основании этих предварительных результатов были составлены индивидуальные перспективные схемы лечения антагонистом , чтобы титровать каждую обезьяну до оптимальной ежедневной дозы -. Начиная с дозы 0,05 мг/кг внутримышечно, только два примата показали аменорею после снятия после первого теста на введение прогестерона (таблица). На фиг. 2 показано, что их средние сывороточные уровни эстрадиола находятся в намеченной зоне или приближаются к ней. У других девяти обезьян после снятия кровотечение было значительным. Эти результаты подтверждают приемлемость обработки прогестероном посредством вживленных подкожно силастических имплантатов, в течение 10 дней. В последний день трех курсов обработки количество сывороточного прогестерона составило 6,40,6 нг/мл. На 31 день дозы - для других девяти обезьян были подняты до 0,1 мг/кг внутримышечно ежедневно. В результате проведения второго теста на введение прогестерона у 8 из девяти обезьян после снятия была достигнута аменорея одна показала явное менструальное кровотечение. Две, которые оставались на дозе антагониста 0,05 мг/кг, после снятия прогестерона были в состоянии аменореи. На фиг. 2 показано, что повышение дозы - для этих 8 обезьян снизило их средние сывороточные концентрации эстрадиола приблизительно до 40 пг/мл. Дозу для единственной устойчивой к эксперименту обезьяны довели до 0,2 мг/кгежедневно (фиг. 2). Результатом было сильное подавление эстрадиола, в конечном итоге до величин ниже 20 пг/мл. После третьего теста на прогестерон все одиннадцать обезьян достигли или поддерживали состояние аменореи при средних циркулирующих уровнях эстрадиола в намеченной зоне или близко к ней, при этом одна получала 0,2 мг/кг в/м ежедневно. Неделя снятия прогестерона (дни) 31-37 61-67 91-97 Кол-во обезьян на дозу (мг/кг в/м Достижение соСледы кровяных ежедневно) стояния аменовыделений (дни) реи (обезьяны) 0,05 0,1 0,2 11 2/11 13 2 8 10/11 12 2 8 1 11/11 0 Результаты, полученные из этого исследования приматов, демонстрируют полезность титрования для определения индивидуальных доз антагонистадля достижения аменореи с одновременным поддержанием тонической секреции эстрадиола из яичников в среде, приемлемой для длительных схем лечения. Например, эстрогенную зависимость эндометриоза можно контролировать поддержанием сывороточного эстрадиола на уровнях, которые не стимулируют пролиферацию клеток эндометрия (митогенез) ни в матке,ни эктопически. В то же время, снижение уровня эстрадиола в циркуляции крови не очень резкое и его можно титровать до около 40 пг/мл или несколько ниже путем индивидуального регулирования дозы антагониста , в зависимости от того, дает ли тест на введение прогестерона состояние аменореи после снятия прогестерона. Эту схему проводят до достижения состояния аменореи с наименьшей эффективной дозой антагониста ,с обеспечением невысоких уровней эндогенного эстрогена, и избегая явной недостаточности эстрогена. Соответственно, здесь оправданы длительные периоды лечения действительно, только титрование дозы антагонистатребует несколько лет лечения вместо 6-месячного срока ограничения из-за резкого недостатка эстрогена, как это происходит с применением агонистаи почти со всеми другими ингибиторами. 10 5425 1 Данные явно указывают на необходимость сугубо индивидуализированной схемы лечения антагонистом . Этот новый терапевтический подход более благоприятен, чем лечение только агонистомили агонистомплюс компенсация по схеме лечения с компенсацией гормона во-первых, потому что он избегает сложности и стоимости накладки двух схем лечения во-вторых, он избавляет от потенциальных вредных действий лечения экзогенным эстрогеном-прогестином на обмен веществ. Следует отметить, что при титровании каждого отдельного примата до состояния аменореи отсутствие эндометриальных митогенных симптомов избавляет от необходимости проведения лечения прогестином для борьбы с воздействием избыточного количества эстрогена и, в свою очередь, позволяет противостоять связанной с этим опасности появления внутриматочной гиперплазии или внутриматочной карциномы. Отсюда следует, что ряд гинекологических нарушений, которые в значительной степени зависят от секреции эстрогена, можно терапевтически лечить титрованием пациентов до наинизшей дозы антагониста , необходимой для достижения индивидуального порога для аменореи. Эта схема сохраняет значительную степень секреции эндогенного эстрогена из яичников, которая может поддержать плотность кости и здоровье сердечно-сосудистой системы, а также смягчить приливы. Соответственно, титрование индивидуализированных доз антагонистадо состояния аменореи с поддержанием тонического эстрадиола в циркуляции крови может позволить проведение длительных курсов лечения, при которых не пострадает ни терапевтическая эффективность контролируемой эстрогенной среды, ни положительные аспекты влияния эстрогена на поддержание здоровья женщины в целом. Настоящее изобретение допускает введение различных изменений и модификаций, не выходящих за рамки его сущности и объема. Различные варианты, которые были описаны и проиллюстрированы выше, следует рассматривать только как иллюстративные примеры, которые никоим образом не ограничивают изобретение. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: A61K 38/00, A61P 5/24, C07K 5/00
Метки: восстановление, яичников, лечения, продолжительных, тонической, схем, эстрогена, секреции
Код ссылки
<a href="https://by.patents.su/11-5425-vosstanovlenie-tonicheskojj-sekrecii-estrogena-iz-yaichnikov-dlya-prodolzhitelnyh-shem-lecheniya.html" rel="bookmark" title="База патентов Беларуси">Восстановление тонической секреции эстрогена из яичников для продолжительных схем лечения</a>
Предыдущий патент: Способ и устройство для изготовления строительных конструкций, преимущественно плит
Следующий патент: Способ приготовления пива, пиво, стабилизатор пены пива и способ экстрагирования пектинов
Случайный патент: Устройство для вычисления фундаментальных аддитивно симметрических булевых функций